Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оценка здоровья митохондрий в связанных с раком фибробластах, выделенных из 3D-многоклеточных сфероидов опухоли легкого
* Эти авторы внесли равный вклад
В этой статье
Резюме
Многоклеточные 3D-сфероиды опухолей были получены с клетками аденокарциномы легких, фибробластами и моноцитами с последующим выделением связанных с раком фибробластов (CAF) из этих сфероидов. Изолированные CAF сравнивали с нормальными фибробластами для оценки здоровья митохондрий путем изучения митохондриального трансмембранного потенциала, активных форм кислорода и ферментативной активности.
Аннотация
Связанные с раком фибробласты (ЦАФ) являются одними из наиболее распространенных стромальных клеток, присутствующих в микроокружении опухоли, способствуя росту и прогрессированию опухоли. Сложность в микроокружении опухоли, включая секретом опухоли, низкосортное воспаление, гипоксию и окислительно-восстановительный дисбаланс, способствует гетеротипическому взаимодействию и позволяет трансформировать неактивные резидентные фибробласты, чтобы стать активными ЦАФ. CAF метаболически отличаются от нормальных фибробластов (NF), поскольку они более гликолитически активны, производят более высокие уровни активных форм реактивного кислорода (АФК) и чрезмерно экспрессируют экспортер лактата MCT-4, что приводит к открытию митохондриальной проницаемости переходной поры (MPTP). Здесь был описан метод анализа митохондриального здоровья активированных ЦАФ, выделенных из многоклеточных 3D-сфероидов опухоли, состоящих из клеток аденокарциномы легкого человека (A549), моноцитов человека (THP-1) и клеток фибробластов легких человека (MRC5). Сфероиды опухолей распадались через разные промежутки времени и посредством магнитно-активированной сортировки клеток выделяли ЦАФ. Митохондриальный мембранный потенциал ЦАФ оценивали с использованием красителя JC-1, продукции АФК путем окрашивания 2',7'-дихлордигидрофлуоресцеина диацетата (DCFDA) и активности ферментов в изолированных ЦАФ. Анализ митохондриального здоровья изолированных ЦАФ обеспечивает лучшее понимание обратного эффекта Варбурга, а также может быть применен для изучения последствий митохондриальных изменений CAF, таких как метаболические потоки и соответствующие регуляторные механизмы на гетерогенность рака легких. Таким образом, настоящее исследование выступает за понимание взаимодействия опухоли и стромы на здоровье митохондрий. Это обеспечит платформу для проверки кандидатов на митохондриальные препараты на их эффективность против ЦАФ в качестве потенциальных терапевтических средств в микроокружении опухоли, тем самым предотвращая участие CAF в прогрессировании рака легких.
Введение
Солидные опухоли состоят из гетерогенных клеточных популяций, которые руководствуются микроокружением опухоли (TME), однако происхождение большинства клеток еще предстоит открыть. В основном стромальные и иммунные клетки (фибробласты, эндотелиальные клетки, моноциты, макрофаги, дендритные клетки, В-клетки, Т-клетки и их подмножества) отражают гетерогенность опухоли при раке легких, молочной железы, почек и других солидныхраковых заболеваниях 1,2,3. Понимание происхождения каждого подтипа и их трансдифференцировочного потенциала крайне необходимо для разработки передовых методов лечения этих видов рака. Анализ этой разнообразной клеточной популяции в биопсии человека представляет собой несколько проблем из-за типа опухоли, места, стадии, ограничения количества образца и специфических для пациента вариаций4. Таким образом, необходима экспериментальная модель, которая не только надежна, но и может имитировать состояние опухоли in vivo, зарекомендовав себя как идеальная для изучения перекрестных помех опухоль-строма и ее участия в патофизиологии заболевания.
Трехмерные (3D) многоклеточные опухолевые сфероидные (MCTS) культуры являются предпочтительной модельной системой опухолей in vitro из-за их сходства с природными аналогами. MCTS может лучше воспроизводить аспекты солидных опухолей, чем модели 2D-клеточных культур, включая их пространственную архитектуру, физиологические реакции, высвобождение растворимых медиаторов, паттерны экспрессии генов и механизмы лекарственной устойчивости. Более того, одним из основных преимуществ MCTS является то, что его можно использовать для изучения гетерогенности опухоли и микроокружения опухоли (TME). Метод подвешивания является наиболее часто используемым инструментом для разработки и анализа MCTS5. В этом методе различные клетки со средой суспендируются в виде капель, что позволяет их расти в согласованном 3D-агрегате и легко доступно для исследования. Техника проста; он не требует много клеток и устраняет потребность в специализированном субстрате, таком как агароза, для развития сфероидов6. Дополнительное преимущество данного метода заключается в воспроизводимости его методики. Кроме того, этот метод также использовался для совместной культивирования смешанных клеточных популяций, таких как эндотелиальные клетки и опухолевые клетки, для моделирования раннегоопухолевого ангиогенеза 7.
В этом исследовании многоклеточные 3D-сфероиды опухолей легких были получены с клетками аденокарциномы легких, фибробластами и моноцитами с использованием метода висячей капли, который имитирует микроокружение опухоли легких. Затем популяция связанных с раком фибробластов (CAF) была выделена для изучения здоровья митохондрий. Основная идея разработки этих сфероидов заключается в том, чтобы изолировать ЦАФ, поскольку перекрестные помехи между клетками в сфероидах могут преобразовать фибробласты в мио-фибробласт-подобное активированное состояние CAF. Во-вторых, это исследование может также показать, как аберрантная выработка АФК и митохондриальная дисфункция приводят нормальные фибробласты к более агрессивному фенотипу CAF. Было обнаружено, что фибробласты, собранные внутри сфероидов опухоли, приобрели миофибробластные характеристики с повышенной активностью АФК и индукцией экспрессии метаболических генов. Этот протокол подчеркивает важность микроокружения опухоли в активации CAF и может быть отличной моделью для генерации in vitro и изучения фенотипических характеристик CAF.
протокол
1. Клеточная культура
- Культивирование клеточной линии аденокарциномы легких человека A549 и моноцитарной клеточной линии человека THP-1 в среде RPMI1640 с добавлением 10% FBS и 1% пенициллин-стрептомицина при 37 °C в увлажненной камере с 5% CO2.
- Культивирование клеток фибробластов легкого человека MRC-5 в среде DMEM дополняют 10% FBS и 1% раствором пенициллина-стрептомицина при 37 °C в увлажненной камере с 5% CO2.
2. Получение многоклеточных сфероидов опухоли с использованием клеточной линии аденокарциномы легких A549, фибробластов MRC5 и моноцитов THP-1
ПРИМЕЧАНИЕ: Многоклеточные опухолевые и неопухолевые 3D-сфероиды были приготовлены с использованием метода висячей капли в чашке для культивирования клеток толщиной 90 мм. Подробное описание развития этих сфероидов приведено ниже. Все реагенты клеточной культуры, такие как полная среда, PBS и 0,25% раствор трипсина-ЭДТА, должны быть предварительно нагреты при 37 °C перед использованием, если не указано иное.
- Приготовление клеточной суспензии
- Выращивайте адгезивные клетки A549 и MRC5 (5 x 106 клеток каждая) в полной питательной среде DMEM (модифицированная орлиная среда Dulbecco [DMEM] + 10% фетальная бычья сыворотка [FBS] + 1% пенициллин-стрептомицин) в колбах T25 при 37 °C в увлажненной камере с 5% CO2.
- Для клеток THP-1 выращивают клеточную суспензию (5 х 106 клеток) в полной питательной среде (RPMI1640 + 10% FBS + 1% пенициллин-стрептомицин) в колбах T25. Для лучшего роста поместите колбы T25 при 37 °C в увлажненную камеру с 5% CO2 в стоячем положении.
- Через 3 дня, при 80%-85% слиянии, промыть клетки A549 и MRC5 безальциевым и магниевым PBS (фосфатным буферным физиологическим раствором), добавив 1 мл PBS (25-30 °C) в каждую колбу в течение 1 мин и аспирируя ее.
- Собирают клетки A549 и MRC5 из колбы, инкубируя их с 500 мкл 0,25% раствора трипсина-ЭДТА в течение 5 мин при 37 °C в увлажненном инкубаторе с 5% CO2. Сразу после этого добавляют 4 мл полной питательной среды для инактивации трипсина.
- Соберите клеточную суспензию из колбы T25 в трубку объемом 15 мл и гранулируйте ее при 125 х г в течение 5 минут. Удалить надосадочный материал и повторно суспендировать клетки в 5 мл полной питательной среды.
- Установление многоклеточных сфероидов опухолей
ПРИМЕЧАНИЕ: Все этапы образования сфероидов опухоли должны выполняться внутри кабинета биобезопасности для поддержания стерильных условий. Максимальный объем клеточной суспензии был стандартизирован как капля в 25 мкл, чтобы подготовить каплю таким образом, чтобы она не падала вниз при инвертировании крышек.- Подсчитайте номера ячеек A549, MRC5 и THP-1 с помощью счетчика ячеек. Для каждой сфероидной капли (25 мкл) поддерживают следующие номера клеток: 5000 клеток A549, 4000 клеток MRC5 и 1000 клеток THP-1, следуя протоколу, описанному Arora et al.7. Рассчитайте номера ячеек соответствующим образом для объема 1 мл.
ПРИМЕЧАНИЕ: Сфероиды были первоначально приготовлены с тремя различными подсчетами клеток на сфероид (т.е. 5000, 8000 и 10 000). Кроме того, были проверены различные клеточные соотношения опухолевых клеток / фибробластов / моноцитов (1: 1: 1, 2: 2: 1, 4: 2: 1, 5: 2: 1 и 5: 4: 1). Наконец, успешное 3D-образование многоклеточных сфероидов было замечено с соотношением 5: 4: 1 и было использовано для исследования. Концентрацию фибробластов увеличивали исходя из его доли в микроокружении опухоли, что еще больше усиливало жесткость сфероидов опухоли. Подробная процедура была изложена в недавней публикации Arora et al.7. - Готовят клеточную суспензию в соотношении 5 (A549, 2 x 105 клеток/мл) к 4 (MRC5, 1,6 x 105 клеток/мл) к 1 (THP-1, 5 x 104 ячейки/мл) и составляют объем до 1 мл с полным DMEM.
- Поместите каплю 25 мкл клеточной суспензионной смеси на крышку 90-миллиметровой чашки для культивирования (примерно 50 капель/90 мм тарелки). Наполните дно 90-миллиметровой чашки стерильной водой объемом 10 мл.
- Осторожно переверните крышку над заполненной водой гидратационной камерой и поместите блюдо в инкубатор клеточной культуры на 3 дня.
- Контролируйте сфероиды под микроскопом при 10-кратном увеличении на 4-й день. Для получения изображений включите выключатель питания, аккуратно поместите 60-миллиметровую тарелку на сцену и выберите увеличение (10x). Отрегулируйте линзы и исследуйте клетки, чтобы проанализировать агрегацию и пролиферацию клеток. Нажмите кнопки «Заморозить» и «Сохранить», установленные на микроскопе, чтобы захватить изображение.
- Измените питательную среду на 4-й день, тщательно аспирируя 20 мкл среды из каждой капли и заменяя ее свежей полной питательной средой.
- Подсчитайте номера ячеек A549, MRC5 и THP-1 с помощью счетчика ячеек. Для каждой сфероидной капли (25 мкл) поддерживают следующие номера клеток: 5000 клеток A549, 4000 клеток MRC5 и 1000 клеток THP-1, следуя протоколу, описанному Arora et al.7. Рассчитайте номера ячеек соответствующим образом для объема 1 мл.
3. Живо-мертвый анализ сфероидов опухолей
- На 7 и 10 день осторожно переверните 90-миллиметровую тарелку в шкафу биобезопасности и используйте пипетку объемом 200 мкл для сбора сфероидов из каждой капли. Соберите по пять сфероидов каждый в трубку объемом 1,5 мл.
- Добавьте 500 мкл 1x PBS в 1,5 мл трубку, содержащую сфероиды и центрифугу при 125 х г в течение 5 мин. Осторожно отбросьте супернатант и повторно суспендируйте сфероиды в 200 мкл 1x PBS. Не пипетку строго, чтобы избежать распада сфероидов.
- Выделите сфероиды с помощью пипетки объемом 200 мкл на 60-миллиметровой тарелке для окрашивания кальциеном-АМ и йодистым пропидием.
- Насадите на сфероиды 5 мкл раствора кальциина-АМ 1 мкМ и 5 мкл раствора пропидидия йодида 2 мг/мл. Инкубировать в течение 10 мин. После завершения инкубационного периода промыть сфероиды аккуратно 1x PBS дважды.
- Поместите 60-миллиметровую тарелку, содержащую сфероиды, под флуоресцентный инвертированный микроскоп, наблюдайте и захватывайте изображения с 10-кратным увеличением, выбрав опцию флуоресценции в программном обеспечении микроскопа и выбрав FITC (зеленый флуоресцентный канал; возбуждение 490 нм, излучение 515 нм) для кальцеина и техасского красного канала (TXR; возбуждение 535 нм, излучение 617 нм).
- Для получения изображения включите Ctr Adv, который является переключателем 1, с последующим включением процессора. Дождитесь загрузки программной системы. После загрузки аккуратно поместите 60-миллиметровую тарелку на сцену и выберите увеличительный (10x) и флуоресцентный каналы (FITC, TXR). Отрегулируйте объективы и выполните сканирование изображения.
- Чтобы просмотреть изображение в системе, выберите опцию Live и просмотрите изображение. Отрегулируйте интенсивность флуоресценции для соответствующей оптимизации. Сохраните изображение, нажав кнопку Сохранить .
ПРИМЕЧАНИЕ: На этом этапе сфероиды будут видны невооруженным глазом. Под световым микроскопом сфероиды будут выглядеть как круглые, жесткие сферы при 10-кратном увеличении. Несколько сфероидов могут быть собраны одновременно с помощью пипетки 200 мкл.
4. Распад и клеточная суспензия опухолевых сфероидов
- Соберите 200 сфероидов опухоли каждый на 7 и 10 день, используя пипетку 1 мл в трубке 15 мл.
ПРИМЕЧАНИЕ: Перед сбором тщательно проверьте форму и форму одного сфероида после переноса его на микроскопический слайд или на 30-миллиметровую тарелку и наблюдайте под микроскопом. - Гранулируют сфероиды центрифугированием при 125 х г в течение 5 мин. Аспирируйте супернатант осторожно, не нарушая сфероиды опухоли.
- Тщательно промыть сфероиды 200 мкл PBS, центрифугу при 125 х г в течение 5 мин и осторожно выбросить надосадочный материал.
- Для распада сфероидов добавляют 400 мкл 0,25% раствора трипсина-ЭДТА и держат при 37 °C в течение 10 мин. Выполняют энергичное пипетирование для полного распада сфероидов.
- Нейтрализуют трипсин, добавляя 1 мл полной питательной среды DMEM. Центрифугу при 125 х г в течение 5 мин и осторожно выбросьте супернатант.
- Повторно суспендируют гранулу в 1 мл полной среды DMEM и подсчитают общее количество клеток.
5. Выделение связанных с раком фибробластов (CAF) через микрошарики
- Для выделения ЦАФ из сфероидов опухоли повторно суспендируют 1 х 107 клеток в 80 мкл буфера холодной магнитно-активированной сортировки клеток (MACS) (PBS при рН 7,2, содержащего 0,5% бычьего сывороточного альбумина [BSA] и 2 мМ этилендиамина тетрауксусной кислоты [ЭДТА]).
- Инкубируют клеточную суспензию (содержащую 1 х 107 клеток) с 20 мкл антифибробластных микрошариков. Хорошо перемешать, аккуратно постукивая по тюбику, и инкубировать в течение 30 мин при комнатной температуре.
- Промыть клетки 1 мл холодного буфера MACS, центрифугу при 125 х г в течение 5 мин и аспирировать супернатант. Повторное суспендирование клеток в 500 мкл буфера MACS.
- Для разделения клеток на магнитной основе шариков подготовьте колонну MACS, промыв ее 3 мл буфера MACS.
- Поместите клеточную суспензию в столбец, а затем в проточную коллекцию, содержащую немаркированную клеточную популяцию.
- Трижды промойте колонку 3 мл буфера MACS. Снимите колонну с сепаратора и поместите ее на трубку для сбора.
- Соберите клетки, меченые микрогранулами антифибробластов, добавив 5 мл буфера MACS и прочно протолкнув плунжер в колонну.
- Центрифугируйте меченые ячейки при 125 х г в течение 5 мин. Продолжайте использовать изолированные фибробласты для последующих применений.
6. Анализ экспрессии ACTA2 на основе проточной цитометрии в изолированных КАФ
- Подсчитайте количество изолированных CAF и используйте приблизительно 6 x 104 ячейки. Вымойте ячейки один раз с PBS, центрифугируйте при 125 х г в течение 5 мин и аспирируйте супернатант.
- Добавьте 100 мкл буфера пермеабилизации клеток (PBS + 0,5% BSA + 0,3% v/v Triton X-100) и инкубируйте клетки при 4 °C в течение 30 мин.
- Периодически вращайте клетки, чтобы поддерживать одноклеточную суспензию. Центрифуга и повторное суспендирование клеток в 100 мкл буфера пермеабилизации клеток.
- Добавьте 2 мкл конъюгированного античеловеческого антитела к α-СМА и инкубируйте при 4 °C в течение 45 мин. После инкубации добавляют 1 мл пермеабилизационного буфера и центрифугу при 125 х г в течение 5 мин для удаления избытка антител.
- Повторное суспендирование гранулы в 400 мкл буфера пермеабилизации для проточного цитометрического анализа. Соберите в общей сложности 10 000 событий каждого образца в проточном цитометре. Выберите положительные клетки ACTA2 после различения популяций клеток на основе их прямого и бокового рассеяния, выбрав популяцию синглета с последующим выбором положительных клеток ACTA2 , которые отображаются как один пик на гистограмме с одним параметром.
7. Окрашивание JC-1 для определения мембранного потенциала митохондрий
- Подсчитайте количество выделенных КЭФ и используйте приблизительно 6 х 104 клеток для окрашивания 5,5,6,6'-тетрахлор-1,1',3,3' тетраэтилбензими-дазоилкарбоцианин йодида (JC-1) с помощью проточной цитометрии.
- Тщательно промыть клетки PBS, центрифугировать при 125 х г в течение 5 мин, аспирировать супернатант и добавить 100 мкл буфера окрашивания клеток.
- Добавляют краситель JC-1 в рабочей концентрации 2 мкМ и инкубируют при комнатной температуре в течение 30 мин. По окончании инкубации промыть клетки ПБС, центрифугировать при 125 х г в течение 5 мин и повторно суспендировать в конечном объеме 400 мкл.
- Получите в общей сложности 20 000 событий каждого образца в проточном цитометре. Количественное определение потенциала митохондриальной мембраны путем измерения агрегатов JC-1 с красным смещением на канале FL-2 и мономеров с зеленым смещением на канале FL-1.
8. Окрашивание DCFDA для оценки уровней клеточных активных форм кислорода (АФК)
- Используйте целые сфероиды (50 чисел), а также изолированные CAF (6 x 104 клетки) из сфероидов для окрашивания диацетатом 2',7'-дихлордигидрофлуоресцеина (DCFDA).
- Тщательно промыть клетки PBS, центрифугировать при 125 х г в течение 5 мин, аспирировать супернатант и добавить 100 мкл буфера окрашивания клеток.
- Добавляют краситель DCFDA в рабочей концентрации 1 мкМ и инкубируют при комнатной температуре в течение 30 мин. Дважды промыть клетки PBS, центрифугу при 125 х г в течение 5 мин, а затем повторно суспендировать в конечном объеме 400 мкл.
- Получите в общей сложности 20 000 событий каждого образца в проточном цитометре. Оцените уровни АФК, измерив флуоресценцию на 7-й и 10-й день для сфероидов, а также изолированных КАФ.
9. RT-qPCR анализ маркеров CAF и гликолитических генов
- Извлеките РНК из отсортированных CAF с помощью одноклеточного лизисного набора в соответствии с протоколом производителя. Подготовьте кДНК из 100 нг РНК с помощью набора для синтеза кДНК в соответствии с рекомендациями производителя.
- Выполняют RT-qPCR для анализа относительной экспрессии маркеров CAF (ACTA28 и COL1A29) и гликолитического гена (GLUT110 и MCT411). Выполните анализ кривой расплава после окончательного расширения, чтобы убедиться в специфичности продуктов. Нормализуйте данные, используя экспрессию GAPDH в качестве эталонного гена. Последовательности праймеров, используемые для RT-qPCR, перечислены в дополнительной таблице 1.
10. Экстракция и количественная оценка клеточного белка из ЦАФ
ПРИМЕЧАНИЕ: Выполните все этапы экстракции белка на льду, чтобы избежать деградации белка.
- Повторно суспендировать приблизительно 4 х 106 клеток CAF в 100 мкл ледяного буфера лизиса RIPA (содержащего 30 мМ HEPES, 150 мМ NaCl, 1% NP-40, 0,1% SDS и 0,5% дезоксихолата натрия с 5 мМ коктейля протеазы Halt и ингибитора фосфатазы и 5 мМ ЭДТА при рН 7,4).
- Строгий вихрь для правильного лизиса клеток. Обработайте ультразвуком суспензию ячейки на частоте 20 Гц, амплитуде 20% в течение 15 с и 3x импульсе.
- После обработки ультразвуком центрифугируют белковый экстракт при 13 000 х г в течение 15 мин при 4 °C. Переложите супернатант в предварительно охлажденную трубку объемом 1,5 мл. Выполните анализ белка BCA для количественной оценки белка.
11. Спектрофотометрический анализ ферментативной активности в ЦАФ
ПРИМЕЧАНИЕ: В ЦАФах, полученных из сфероидов опухолей, анализируются следующие ферментные активности.
- Измерение активности сукцинатдегидрогеназы
- Для оценки активности сукцинатдегидрогеназы (SDH) в КАФ получают SHE-буфер с 250 мМ сахарозы, 10 мМ 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновой кислотой (HEPES) и 1 мМ этиленгликол-бис(β-аминоэтиловый эфир)-N,N,N',N'-тетрауксусную кислоту (ЭГТА) и регулируют рН до 7,3. Добавить 0,4 мМ феназина метосульфата (ПМС), 0,2 мМ 2,6-дихлориндофенола (DCPIP), 50 мМ MgCl2, 0,02% тритона X-100 и 1 мМ цианида в буфер SHE и сохранить при 37 °C.
- Извлеките клеточный белок из CAF, как описано на этапе 10 (2 x 106 клеток). В каждой лунке из 96-луночной пластины инкубируют 100 мкл 0,1 мг клеточного белка со 100 мкл реакционной смеси SHE при 37 °C в течение 15 мин.
- Чтобы начать ферментативную активность, добавляют 10 мМ сукцината12. Рассчитать активность фермента в нМ/мин/мл путем измерения изменений абсорбции при 600 нм.
- Коэффициент пересчета для DCIP составляет 0,0215 A/nM на основе коэффициента молярного вымирания12. Рассчитайте относительную активность SDH, используя указанную формулу:
Относительная активность (нМ/мин/мл/фермент) =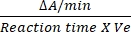 X
X  X V
X V
Где ΔA/min = скорость ферментативной реакции (Aначальная - Aконечная)/(время конечная - A/minначальная), Ve = объем образца, а V = объем реакции.
- Оценка активности цитохром-с-оксидазы
- Чтобы оценить активность цитохром-с-оксидазы (ЦОГ) в КЭФ, добавляют 0,2 мг/мл клеточного белка в реакционный буферный раствор КМЭ, содержащий буфер KME (125 мМ KCl, 20 мМ 3-(N-морфолино)пропановую сульфоновую кислоту [MOPS] и 1 мМ EGTA, рН 7,4), 0,02 % тритона X-100 и 5 мМ аскорбата натрия.
- В отдельной пробирке смешать 50 мкМ цитохрома с цинохромом сердца лошади с 5 мМ аскорбата натрия и инкубировать при 37 °C в течение 5 мин13. После инкубации добавляют 20 мкл восстановленного цитохрома c к 500 мкл реакционного буферного раствора KME, содержащего клеточный белок.
- Рассчитать активность фермента в единицах/мкл путем измерения изменений абсорбции при 550 нм. Абсорбция цитохрома c при 550 нм изменяется со степенью его окисления. Разница в коэффициентах вымирания (мМ) между восстановленным и окисленным цитохромом c составляет 21,84 при 550 нм14. Рассчитайте величину активности фермента в клеточном лизате как:
Единицы измерения/мкл =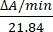
Где ΔA/min = A/minпроба - A/minпустой и 21,84 = ΔԑmM между окисленным цитохромом c и восстановленным цитохромом c при 550 нм
- Оценка активности лактатдегидрогеназы
- Выполните анализ лактатдегидрогеназы (ЛДГ) с использованием набора для анализа клеток лактатдегидрогеназы в соответствии с инструкциями производителя.
- Добавьте тестовый реагент LDH (10 мкл) к 0,5 мг/мл клеточных белков и инкубируйте в течение 5 мин при 37 °C. По окончании инкубации измеряют абсорбцию при 45 нм каждые 1 мин в течение 8 мин.
- Подготовьте стандарты NADH для колориметрического обнаружения с использованием 0 (пустой), 2,5, 5, 7,5, 10 и 12,5 нМ/лунка NADH с последующим добавлением тестового реагента LDH к конечному объему 50 мкл.
- Постройте различия в поглощении междуT начальным иT-конечным на стандартной кривой NADH для определения величины генерации NADH. Оцените активность ЛДГ, используя указанную формулу:
Активность ЛДГ =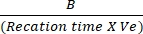 X коэффициент разбавления пробы
X коэффициент разбавления пробы
Где B = количество (nmole) NADH, генерируемое между Tначальным иT-конечным, время реакции = Tfinal - Tначальное (min), а Ve = объем образца (mL), добавленный к скважине.
Результаты
На рисунке 1 показано развитие многоклеточных сфероидов опухоли с использованием трех различных клеточных популяций - A549 (аденокарцинома легких), MRC-5 (фибробласты) и THP-1 (моноциты) - методом висячей капли, как это наблюдалось на 7-й и 10-й день под микроскопом. На 7-й день сфер?...
Обсуждение
Настоящее исследование вводит развитие многоклеточных сфероидов опухоли, включающих опухолевые клетки, популяцию стромальных клеток (т.е. фибробласты) и популяцию иммунных клеток (т.е. моноциты) с использованием модифицированного метода висячих капель. Фибробласты и моноциты / макроф?...
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Эта работа была поддержана проектом SERB-Women Excellence Award Project, Индия (SB/WEA-02/2017) и проектом SERB-Early Career Research Award Project, Индия (ECR/2017/000892) для DP. Авторы, LA и SR, признают IIT Ropar и MHRD за их исследовательские стипендии. МК благодарит ICMR за ее исследовательскую стипендию.
Материалы
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| APC anti-human α-SMA | R&D systems | Cat# IC1420A | |
| Anti-fibroblast microbeads | Miltenyi Biotec | Cat# 130-050-601 | |
| Cell lines | |||
| A549 lung adenocarcinoma cells | NCCS Pune | - | |
| MRC-5 fetal lung fibroblasts | ATCC | CCL-171 | |
| THP-1 Human monocytes | NCCS Pune | - | |
| Chemicals | |||
| BSA | Himedia | Cat# 9048-46-8 | |
| 2,6-dichloroindophenol (DCPIP) | SRL | Cat# 55287 | |
| Calcein-AM | Thermo Fisher Scientific | Cat# C3099 | |
| DAPI | Thermo Fisher Scientific | Cat# D1306 | |
| DCFDA | Sigma | Cat# D6883 | |
| DMEM | Gibco | Cat# 11995073 | |
| DPBS | Gibco | Cat# 14190-144 | |
| EDTA | Thermo fisher scientific | Cat# 17892 | |
| EGTA | SRL | Cat# 62858 | |
| EZcoun Lactate Dehydrogenase Cell Assay Kit | HiMedia | Cat# CCK036 | |
| FBS | Gibco | Cat# 10082147 | |
| Halt Protease and Phosphatase Inhibitor Cocktail (100X) | Thermo Fisher Scientific | Cat# 87786 | |
| HEPES | Thermo Fisher Scientific | Cat# 15630080 | |
| Horse heart Cytochrome c | SRL | Cat# 81551 | |
| Image-iT Red hypoxia reagent | Thermo Fisher Scientific | Cat# H10498 | |
| JC-1 Dye | Thermo Fisher Scientific | Cat# T3168 | |
| KCl | Merck | Cat# P9541 | |
| MgCl2 | Merck | Cat# M8266 | |
| MOPS | Thermo Fisher Scientific | Cat# 69824 | |
| Nacl | Sigma-Aldrich | Cat# S9888 | |
| NADH MB Grade | SRL | Cat# 54941 | |
| NP-40 | Thermo Fisher Scientific | Cat# 85124 | |
| Penicillin/Streptomycin | Gibco | Cat# 15140122 | |
| Phenazine methosulfate (PMS) | SRL | Cat# 55782 | |
| Propidium iodide | Thermo fisher scientific | Cat# P1304MP | |
| RPMI 1640 | Gibco | Cat# 11875093 | |
| Single Cell Lysis Kit | Thermo Fisher Scientific | Cat# 4458235 | |
| Sodium ascorbate | Merck | Cat# A7631 | |
| Sodium cyanide | Sigma | Cat# 205222 | |
| Sodium Deoxycholate | Thermo Fisher Scientific | Cat# 89904 | |
| Sodium dodecyl sulphate | Sigma-Aldrich | Cat# L3771 | |
| Sodium succinate hexahydrate | SRL | Cat# 36313 | |
| Sucrose | Sigma | Cat# S0389 | |
| SuperScript VILO cDNA synthesis kit | Thermo Fisher Scientific | Cat# 11754-050 | |
| Triton X-100 | Sigma | Cat# T8787 | |
| Trypsin 0.25% EDTA | Gibco | Cat# 25200072 | |
| Universal SYBR Green Supermix | BIO-RAD | Cat# 172-5124 | |
| Plasticware | |||
| MACS LS Columns | Miltenyi Biotec | Cat# 130-042-401 | |
| Equipment | |||
| Countess II FL Automated Cell Counter | Thermo Fisher Scientific | Cat# AMQAF1000 | |
| EVOS XL core imaging system | Thermo Fisher Scientific | Serial Number F0518-1727-0191 | |
| LAS X software | Leica Microsystems | ||
| Leica fluorescent inverted microscope | s | DMi8 automated S/N 424150) | |
| Midi MACS separator | Miltenyi Biotec | Cat# 130-042-302 |
Ссылки
- Kim, N., et al. Single-cell RNA sequencing demonstrates the molecular and cellular reprogramming of metastatic lung adenocarcinoma. Nature Communications. 11 (1), 1-5 (2020).
- Davidson, S., et al. Single-cell RNA sequencing reveals a dynamic stromal niche that supports tumor growth. Cell Reports. 31 (7), 107628 (2020).
- Zhang, Y., et al. Single-cell analyses of renal cell cancers reveal insights into tumor microenvironment, cell of origin, and therapy response. Proceedings of the National Academy of Sciences. 118 (24), (2021).
- Bray, L. J., Hutmacher, D. W., Bock, N. Addressing patient specificity in the engineering of tumor models. Frontiers in Bioengineering and Biotechnology. 7, 217 (2019).
- Timmins, N. E., Nielsen, L. K. Generation of multicellular tumor spheroids by the hanging-drop method. Tissue Engineering. , 141-151 (2007).
- Dituri, F., et al. Complex tumor spheroid formation and one-step cancer-associated fibroblasts purification from hepatocellular carcinoma tissue promoted by inorganic surface topography. Nanomaterials. 11 (12), 3233 (2021).
- Arora, L., et al. Development of a multicellular 3D tumor model to study cellular heterogeneity and plasticity in NSCLC tumor microenvironment. Frontiers in Oncology. 12, 881207 (2022).
- Nurmik, M., Ullmann, P., Rodriguez, F., Haan, S., Letellier, E. In search of definitions: Cancer-associated fibroblasts and their markers. International Journal of Cancer. 146 (4), 895-905 (2020).
- Zhang, Y., et al. HIF-1α is necessary for activation and tumour-promotion effect of cancer-associated fibroblasts in lung cancer. Journal of Cellular and Molecular Medicine. 25 (12), 5457-5469 (2021).
- Bu, L., et al. Biological heterogeneity and versatility of cancer-associated fibroblasts in the tumor microenvironment. Oncogene. 38 (25), 4887-4901 (2019).
- Whitaker-Menezes, D., et al. Evidence for a stromal-epithelial "lactate shuttle" in human tumors: MCT4 is a marker of oxidative stress in cancer-associated fibroblasts. Cell cycle. 10 (11), 1772-1783 (2011).
- Mandujano-Tinoco, E. A., Gallardo-Pérez, J. C., Marín-Hernández, A., Moreno-Sánchez, R., Rodríguez-Enríquez, S. Anti-mitochondrial therapy in human breast cancer multi-cellular spheroids. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research. 1833 (3), 541-551 (2013).
- Bregman, A. A. . Laboratory Investigations in Cell and Molecular Biology. , (2002).
- Berry, E. A., Trumpower, B. L. Simultaneous determination of hemes a, b, and c from pyridine hemochrome spectra. Analytical Biochemistry. 161 (1), 1-15 (1987).
- Avagliano, A., et al. Metabolic reprogramming of cancer associated fibroblasts: the slavery of stromal fibroblasts. BioMed Research International. , (2018).
- Lorusso, G., Rüegg, C. The tumor microenvironment and its contribution to tumor evolution toward metastasis. Histochemistry and Cell Biology. 130 (6), 1091-1103 (2008).
- Liu, T., Zhou, L., Li, D., Andl, T., Zhang, Y. Cancer-associated fibroblasts build and secure the tumor microenvironment. Frontiers in Cell and Developmental Biology. 7, 60 (2019).
- Sebastian, A., et al. Single-cell transcriptomic analysis of tumor-derived fibroblasts and normal tissue-resident fibroblasts reveals fibroblast heterogeneity in breast cancer. Cancers. 12 (5), 1307 (2020).
- Elyada, E., et al. Cross-species single-cell analysis of pancreatic ductal adenocarcinoma reveals antigen-presenting cancer-associated fibroblasts. Cancer Discovery. 9 (8), 1102-1123 (2019).
- Ganguly, D., et al. Cancer-associated fibroblasts: Versatile players in the tumor microenvironment. Cancers. 12 (9), 2652 (2020).
- Harryvan, T. J., Verdegaal, E. M., Hardwick, J. C., Hawinkels, L. J., vander Burg, S. H. Targeting of the cancer-associated fibroblast-T-cell axis in solid malignancies. Journal of Clinical Medicine. 8 (11), 1989 (2019).
- Santi, A., Kugeratski, F. G., Zanivan, S. Cancer associated fibroblasts: the architects of stroma remodeling. Proteomics. 18 (5-6), 1700167 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены