Method Article
使用封闭式半自动化工作流程进行临床应用的人间充质干细胞处理
摘要
在这里,我们提出了一种使用逆流离心系统以封闭的半自动方式从多层烧瓶中收获贴壁细胞的方案。该协议可用于从其他细胞扩增平台收获贴壁和悬浮细胞,只需对现有步骤进行少量修改。
摘要
人类间充质干细胞(hMSCs)目前正在被探索为一种有前途的基于细胞的治疗各种疾病的治疗方式,预计未来几年将有更多的市场批准用于临床应用。为了促进这一转变,解决规模、批次间重现性、成本、法规遵从性和质量控制的瓶颈至关重要。这些挑战可以通过关闭流程和采用自动化制造平台来解决。在这项研究中,我们开发了一种封闭的半自动工艺,用于使用逆流离心从多层烧瓶中传代和收获沃顿氏果冻(WJ)衍生的hMSC(WJ-hMSCs)。WJ-hMSCs使用符合法规的无血清无异种(SFM XF)培养基扩增,并且显示出与经典含血清培养基中扩增的WJ-hMSC相当的细胞增殖(群体倍增)和形态。我们的封闭式半自动收获方案显示出高细胞回收率(~98%)和活力(~99%)。使用逆流离心洗涤和浓缩的细胞保持WJ-hMSC表面标志物表达,集落形成单位(CFU-F),三系分化潜力和细胞因子分泌谱。研究中开发的半自动细胞收获方案可以通过直接连接到不同的细胞扩增平台以低输出体积进行体积减少、洗涤和收获,轻松应用于各种贴壁和悬浮细胞的中小规模处理。
引言
人间充质干细胞(hMSCs)是临床应用的绝佳候选者,无论是在组织工程还是细胞治疗中,因为它们具有治疗潜力和高自我更新潜力,可以在体外生长,这对于产生临床相关剂量的细胞至关重要1,2,3。据 ClinicalTrials.gov 称,目前正在研究针对各种疾病状况的1,000多项临床试验4。鉴于对使用hMSCs的兴趣日益浓厚,在不久的将来,更多的临床试验和市场批准即将到来5,6。然而,hMSCs的制造在批次间差异性、高风险原材料的使用、许多开放和手动过程引起的污染问题方面存在许多固有的挑战,因为制造涉及多个单元操作,更高的劳动力成本,横向扩展或扩大的成本以及监管障碍6,7,8,9,10, 11,12.这些问题仍然是当前和未来市场准入的重大障碍。
开发封闭、模块化、自动化的生产解决方案和使用低风险的辅助试剂将应对这些挑战。这还将确保一致的产品质量,减少由于人为错误而导致批次失败的可能性,降低劳动力成本,并提高流程标准化和法规遵从性,例如在数字批次记录保存方面8,12,13,14。为了能够获得临床相关的细胞剂量,无论是自体还是同种异体,以封闭、自动化的方式涉及上游细胞扩增和下游处理的简化制造至关重要。
对于上游hMSC扩增,目前采用的两种最常见的制造方法是横向扩展(2D单层)和纵向扩展(基于3D微载体的悬浮系统)15,16,17,18。最传统和最广泛采用的hMSC扩增方法是基于2D单层的培养,因为它生产成本低且易于设置19。
由堆叠在培养容器内的平坦表面托盘组成的多层烧瓶通常用于扩大hMSC生产。这些系统通常采用1层至40层培养容器20 ,并在生物安全柜内手动处理。细胞传代和收获过程中的处理步骤包括通过移液或物理倾斜整个容器来手动分配和倾析膨胀培养基、解离试剂和洗涤缓冲液。此外,由于多个单元的尺寸和重量庞大,处理多个单元具有挑战性且耗时。
随后,从多层烧瓶中收获后、离心以进行培养基交换、细胞洗涤和体积减小是整个细胞制造工作流程中必不可少的步骤21。传统的台式离心大多是开放式和手动过程,涉及多个步骤,例如将细胞悬液转移到生物安全柜内的带盖管或瓶中,旋转细胞,手动吸出上清液,用缓冲液重悬细胞,以及重复细胞洗涤。这大大增加了由于盖子的打开和关闭而导致的污染风险以及在手动抽吸/移液过程中丢失细胞沉淀的机会22。在处理贴壁细胞(如hMSCs)的多层培养系统时,操作员需要经历一个费力的过程,在离心机和生物安全柜之间反复穿梭,同时处理一个重型单元。这些手动步骤费力,在人为错误和污染方面存在风险,并且必须在B级洁净室环境中进行,这是昂贵的23。此外,传统的手动离心过程不可扩展,可能导致细胞剪切和应力;因此,最大限度地提高细胞回收率、活力和残留杂质的洗脱效率是其他主要挑战22。细胞疗法的商业cGMP规模生产需要封闭的模块化自动化解决方案,以降低污染风险,确保一致的产品质量,降低劳动力和生产成本,并提高过程可靠性24,25。多层烧瓶可以作为一个封闭系统进行处理,方法是在其中一个端口中放置一个0.2μm无菌过滤器,以促进无菌气体交换,第二个端口通过连接器无菌连接或直接焊接到自动细胞处理仪器上进行细胞收获。我们通过评估用于生产细胞、基因或组织产品的创新型封闭式逆流离心机,致力于关闭和自动化 WJ-hMSC 传代和收获的大多数步骤。该逆流离心机还具有执行各种细胞处理应用的灵活性,例如基于大小的细胞分离、培养基/缓冲液交换、浓度和收获,适用于各种细胞类型8,26,27,28。该仪器使用封闭的一次性套件,可以使用管焊接或无菌连接器进行无菌连接以转移袋子,也可以直接连接到任何选择的扩展平台。
在这项研究中,我们设计了一个定制的管路组件,以允许一次性逆流离心试剂盒和多层烧瓶之间的封闭无菌连接。我们优化了一个方案,在单次运行中以完全封闭和半自动的方式从多层烧瓶中酶促分离、洗涤和收获WJ-MSC。对收获的WJ-hMSCs进行纯度(表面标志物分析)和效力(CFU-F、三系分化和细胞因子分泌谱)表征,以确保最终产品符合批次放行的关键质量属性(CQA)。
研究方案
1. 培养基的制备和培养容器的涂层
- 培养基制备
- 经典含血清培养基的组成:通过混合 αMEM(445 mL)、胎牛血清 (FBS)(50 mL) 和 100x 青霉素-链霉素 (5 mL) 来制备经典含血清培养基。
- 准备完整的SFM XF培养基。
- 将 5 mL SFM XF 补充剂 (100x) 和 5 mL 100x L-丙氨酰-L-谷氨酰胺(参见 材料表)无菌添加到 SFM XF 基础培养基 (500 mL) 中,制成 500 mL 瓶子。
- 通过将 50 mL 注射器连接到袋子的相应端口,将 20 mL 定制 MSC SFM XF 补充剂 (100x) 和 20 mL 100x L-丙氨酰-L-谷氨酰胺(见 材料表)无菌添加到 SFM XF 基础培养基袋 (2 L) 中,制作 2 L 培养基袋。
注意:在培养中使用之前,将生长因子或细胞因子(未随培养基一起提供)添加到完整的SF XF培养基中:PDGF-BB(20 ng / mL),FGF碱性(4 ng / mL)和TGFβ(0.5 ng / mL)。
- 用玻连蛋白涂覆细胞培养皿,与无血清培养基一起使用
- 在4°C下解冻玻连蛋白(VTN-N;0.9mg / mL)储备。
- 使用不含钙和镁的无菌Dulbecco缓冲盐水(DPBS)将解冻的VTN-N稀释至5μg/ mL的工作浓度。
注意:使用前立即稀释VTN-N,不要储存稀释的玻连蛋白溶液。 - 将 1 mL/10 cm2 稀释的 VTN-N 溶液加入相应的培养容器中;终浓度为0.5μg/cm2。例如,将 7.5 mL 稀释的 VTN-N 溶液加入 T-75 烧瓶 (75 cm2);将 17.5 mL 稀释的 VTN-N 溶液加入 T-175 烧瓶 (175 cm2);将 250 mL 稀释的 VTN-N 溶液加入标准四层多层烧瓶 (2,528 cm2) 中;并将 630 mL 稀释的 VTN-N 溶液加入 10 层多层烧瓶 (6,320 cm2) 中。
- 在无菌条件下,将容器在室温(RT)下孵育1小时。
注意:包衣培养容器可在4°C下储存长达1周。用实验室薄膜包裹培养容器以防止其变干。使用前,将培养皿预热至室温至少1小时。 - 吸出VTN-N溶液,丢弃,并立即加入足够体积的培养基,以防止涂层容器表面干燥。
注意:移除VTN-N后,无需冲洗培养容器。
2. WJ-hMSC扩增
- 通过将冷冻管置于37°C水浴中快速解冻WJ-hMSCs(p2);慢慢旋转小瓶,直到内容物开始解冻。
- 解冻后,将WJ-hMSCs以5,000个细胞/ cm 2接种在T-175烧瓶(无VTN-N涂层)中,并在37°C的经典含血清培养基中在5%CO2的潮湿气氛中孵育以进行细胞扩增。两次传代(p4)后,将扩增的细胞存放在所需的冷冻保存培养基中,作为工作细胞库(WCB)。
- 按照活力和细胞计数方法使用自动细胞计数器进行细胞计数,以确定总细胞计数、细胞活力和细胞大小29。
- 从p4开始,在T-75培养瓶中以5,000个细胞/ cm2 在经典含血清培养基或SFM XF培养基中培养WJ-hMSC(使用带有SFM XF培养基的VTN-N包被烧瓶)。
- 将两种培养基中的细胞维持总共三次传代(12天),并通过将每次传代培养结束时计数的活细胞数量除以培养开始时的活细胞数量来测量每次传代的细胞扩增(倍数增加)(细胞接种日)。
3. 种子培养种横向扩展
- 在 T-175 烧瓶中扩增 WJ-hMSC
- 通过将冷冻管置于37°C水浴中,在p4处快速解冻WJ-hMSCs;慢慢旋转小瓶,直到溶液开始解冻。
- 将 5,000 个细胞/cm2 接种到 VTN-N 包被的 T-175 烧瓶中。让细胞在37°C的培养箱中生长,5%CO2。
- 每2-3天用新鲜制备的预热完全SFM XF培养基更换用过的培养基,以获得最佳性能和细胞生长。
- 处理多层烧瓶(图1A,B)
- 所有无菌连接都需要在无菌环境中进行。
- 在生物安全柜内打开多层烧瓶的包装。
- 将预灭菌的空气过滤器 (0.2 μm) 连接到一个端口,以便在使用逆流离心机进行流体传输期间释放压力。
- 将定制管组中的多层烧瓶连接器安装到另一个端口中(图1B)。
- 将定制管路的 PVC 线焊接到包含完整 SFM XF 介质的 2 升 PVC 转移袋上。
注意:在通过重力流将其添加到多层系统中之前,请完全混合中型袋。确保PVC转移袋悬挂在高于多层烧瓶的位置。 - 将多层烧瓶放在其长边,空气过滤器位于顶部(图1B)。
- 打开PVC管上的夹子,开始填充多层烧瓶。确保灌装过程中介质在托盘之间水平。
- 一旦培养基在所有托盘中完全平整,将多层烧瓶放在其短边上,端口直立。
- 关闭 PVC 管线上的夹子,然后用 MPC 蓝色闭盖更换管路连接来卸下转移袋。
注意:请勿拆下空气过滤器,因为这会在电池膨胀期间进行气体交换。 - 将多层烧瓶转入孵育位置。
注意: 过滤器和管道连接应朝上。 - 通过将多层烧瓶连接到吸气瓶来清空多层烧瓶;将其放在吸气瓶上方,液体就会流出。
注意:将多层烧瓶侧倾,通过重力完全排出用过的介质。或者,可以使用定制的管道组件将用过的介质倒入废瓶中。 - 重复步骤3.2.5-3.2.11以补充新鲜培养基。
- WJ-hMSCs在多层烧瓶中的传代培养(T-175>4层>10层)
- 使用前在37°C培养箱内预热细胞解离试剂(TrypLE)和完整的SFM XF培养基。
- 从T-175烧瓶中吸出用过的培养基并丢弃。
- 用预热的DPBS洗涤细胞单层,吸出并丢弃。
- 向每个烧瓶中加入TrypLE,确保细胞单层的完全覆盖,并在37°C下孵育5-10分钟。
- 将悬浮液转移到无菌 50 mL 锥形管中。
- 在室温下以100-200× g 离心管5分钟。 吸出并丢弃DPBS,并注意不要干扰细胞沉淀。
- 将细胞沉淀重悬于最小体积 (10 mL) 预热完全 SFM XF 培养基中以进行细胞计数。
- 如上文第 2 节所述,用约 800 mL 的完整 SFM XF 培养基填充 VTN-N 涂层的四层培养皿。加入5,000个细胞/cm2 (即,1.26 x 107 个活细胞/烧瓶)。轻轻旋转细胞悬液以确保均匀分布。
- 在加湿气氛中在含有5%CO2 的37°C培养箱中孵育。
- 每2-3天用新鲜的预热完全SFM XF培养基替换用过的培养基,以获得最佳细胞生长,直到细胞达到60%-80%汇合度或准备传代培养到10层多层烧瓶中。
- 如第 2 节所述,用约 2 L 完全 SFM XF 培养基填充 VTN-N 涂层的 10 层多层烧瓶。加入5,000个细胞/cm2 (即3.1 x 107 个细胞/烧瓶)。轻轻旋转细胞悬液以确保均匀分布。
- 在加湿气氛中在含有5%CO2 的37°C培养箱中孵育。
- 每2-3天用新鲜的预热完全SFM XF培养基替换用过的培养基,以获得最佳细胞生长,直到细胞达到60%-80%汇合度或准备收获。
4. 使用封闭式逆流离心法进行封闭式半自动 WJ-hMSC 解离和收获
- 一次性逆流离心套件组件
- 通过管焊将一次性套件与一次性PVC转移袋连接,类似于图1A所示的配置。
注意:一次性试剂盒的默认流速为 30-165 mL/min。 - 将含有汇合WJ-hMSC的10层多层烧瓶连接到生物安全柜内的定制管组件上。
- 将带有定制管组件的附加 10 层培养容器转移到工作台上,并焊接到一次性试剂盒的 E 线(ID PVC 中的 3/32),如图 1B 所示。
- 确保将 无菌样品端口焊接到 高流量一次性试剂盒的 G 管路。
- 接下来,将收获线 H 连接到装有 50 mL 注射器的无菌鲁尔。
注意:在上述所有步骤中,请确保手动夹具已关闭,以固定每个套件袋中的流体。
- 通过管焊将一次性套件与一次性PVC转移袋连接,类似于图1A所示的配置。
- 设置仪器运行
- 通过打开仪器背面的拨动开关为仪器 "ON" 供电。
- 使用提供的 USB-C 电缆将笔记本电脑连接到仪器上的 USB-C 端口(图 1B)。
- 从桌面或开始菜单运行逆流离心机图形用户界面 (GUI) 软件。
- 登录后,通过单击主欢迎页面上的 "选择协议" 按钮加载协议。
注意:逆流离心收获方案(表1)是使用协议生成器软件创建的,并存储在本地。 - 按下仪器上的蓝色解锁按钮,然后打开玻璃门。
- 将组装好的一次性试剂盒装载到逆流离心系统上。
- 首先将悬挂在衣架挂钩上的袋子按顺序与气泡传感器条上的管口最好地对齐,将 10 层多层烧瓶以一定角度放置,如图 1B 所示。
- 将 套件与两个套件位置按钮对齐,拉伸蠕动泵周围的 泵管 ,然后将 白色灯泡形连接器压 入到位。
注意: 确保压力传感器上的卡套管正确放置在管路中。 - 通过提起逆流离心室托架的银色杠杆并通过将杠杆返回到直立位置来固定离心室来连接离心室。
- 将管子从套件上的每个端口按入 气泡传感器条的轨道中。
注意:确保袋子没有缠结,以便可以轻松遵循协议过程。 - 按下门闩关闭门。
注意:泵夹臂将关闭,离心机室将旋转,阀门将关闭。如果不关闭门,系统将无法启动和运行协议。 - 打 启动 GUI 上的按钮。将出现一个清单;前四项是仪器检查,后两项是用户检查(确保袋子和连接与试剂盒图像匹配,并确保手动夹具打开)。
注意:对于仪器检查,如果出现问题,将显示红色 X 而不是蓝色复选标记。 - 按 确认 以显示协议输入屏幕。
- 将数据输入(收获体积)对话框值设置为 45 mL,然后按 确认。
注意:如果在用户创建的协议中设置了任何可变数据输入,将提示协议输入屏幕。收获体积在此协议中设置为变量,用户可以根据最终细胞密度要求选择测试不同的体积。系统允许的最小收获体积为 5 mL。系统最多只允许为每个协议设置四个数据变量。
- 运行协议
- 单击 GUI 上的启动,然后按仪器上的绿色 启动 按钮开始协议运行(请参阅 表 1)。
注意:系统将根据协议启动步骤,从启动顺序开始,用缓冲器替换系统中的空气。 - 启动完成后(表1,步骤8),确保将用过的介质完全泵出到废液袋中。
注意:一旦 10 层多层烧瓶为空,系统将在 GUI 中提示用户确认容器是否为空。如果容器是空的,请按仪器上的"跳过"按钮;如果没有,请按绿色的"播放/暂停"按钮继续排出容器中的任何残留液体。 - 在暂停步骤15,19和22(表1)中,确保提起多层烧瓶并摇动以使缓冲液均匀地分布到所有托盘上。完成后,将 10 层多层烧瓶放回其原始抽取位置以进行后续步骤。
注意:仅对于 表1 中的步骤19,摇动后,确保将多层烧瓶平放,并在室温下孵育10-15分钟以解离细胞。 - 在步骤20和步骤23(表1)中,确保将胰蛋白酶化的细胞完全转移到中间袋中。
- 在步骤25中手动混合中间袋(表1)。
- 在步骤26(表1)中,使用2 mL鲁尔注射器通过采样口取样。
注意:建议至少采样三次以获得准确的细胞计数。 - 在步骤29和步骤30(表1)中,检查流化池床的稳定形成;它应该类似于流化池床,如图 1C所示。
注意:如果稳定的流化池床的形成与 图1C所示相似,则优化g力与流速(G / F)的比值对于在电池加载和洗涤步骤期间在腔室中实现稳定的流化池床(高细胞回收率)至关重要。G / F比率取决于细胞的大小和培养基的密度。高密度样品/洗涤缓冲液需要高G/F比,而低密度样品/洗涤缓冲液可以使用低G/F比。 - 运行在 斜坡到停止 步骤( 表1中的步骤35)完成,逆流离心系统上的所有夹紧值将自动关闭。
注意: 最后,在打开门之前,请确保手动夹具已关闭以固定每个套件袋中的液体。 - 协议运行完成后,按下仪器上的蓝色解锁按钮,然后打开玻璃门。将装有收获的浓缩物的一次性试剂盒从仪器中取出。
- 使用手提管封口机无菌密封收获线。小心地将装满浓缩细胞收获的密封注射器转移到生物安全柜中进行细胞计数和冷冻保存。
- 使用杠杆再次拆下腔室,将灯泡连接器从配件中拉出,小心地将套件提起,然后放入生物危害袋中。
- 使用乙醇湿巾清洁仪器,并确保关闭门。
- 在关闭仪器背面的开关之前,请先关闭 GUI 应用程序。
注意:细胞收获方案在生物一式三份(n = 3)中进行测试。
- 单击 GUI 上的启动,然后按仪器上的绿色 启动 按钮开始协议运行(请参阅 表 1)。
5. 关键质量属性 (CQA) 评估
- 细胞身份表面标志物(CD73、CD90 和 CD105)和非基质标志物(CD34 和 CD45)
- 通过加入适当体积的流式细胞术缓冲液(DPBS,含 1% BSA 或 2% FBS),将收获的 WJ-hMSC 细胞悬液稀释至 1 x 106 活细胞/mL 的浓度。
- 向每个微量离心管或 96 孔板中加入 100 μL 细胞悬液。确保每 100 μL 细胞悬液至少存在 0.1 x 106 个细胞。
- 按照抗体供应商的建议,以适当的稀释度将荧光团偶联抗体添加到样品中。
- 在黑暗中孵育20分钟。
- 孵育后,加入 100 μL 流式细胞术缓冲液,以 380 x g 离心 3 分钟洗涤样品。
- 弃去上清液,留下沉淀。
- 将细胞沉淀重悬于200μL流式细胞术缓冲液中,并进行流式细胞术分析30。
- 菌落形成单位成纤维细胞测定 (CFU-F)
- 将细胞悬液稀释至1,000个活细胞/ mL完全培养基的浓度。
- 在完整培养基中的6孔组织培养板中每孔板~500个细胞。
- 在37°C下在5%加湿的CO2中孵育10-14天,用PBS洗涤,并在室温下用0.5%结晶紫在甲醇中染色30分钟。
- 枚举每个孔中的菌落。
- 计算CFU-F效率:将原始播种数形成的菌落数除以得到菌落形成的百分比效率,并用百分比表示。
- 三系分化潜力
- 按照制造商的方案,将5 x 103 细胞/cm 2 接种到12孔板中的成骨和脂肪生成分化培养基中。对于软骨形成,根据制造商的方案,制备 1.6 x 107 活细胞/mL,并通过在 96 孔板孔的中心接种 5 μL 液滴来生成微量质谱培养物。
- 在分化过程中,每 3-4 天进行一次完整的培养基更换。
- 14 天(脂肪生成)或 21 天(成骨和软骨形成)后,根据制造商的方案使用谱系特异性生物染色剂监测培养物的分化情况。对于脂肪分化,用0.5%油红O溶液染色培养物。对于成骨,使用2%茜素红S溶液进行染色。对于软骨分化,用1%阿尔新蓝染色微质量颗粒。
- 细胞因子分泌谱
- 解冻手动或使用逆流离心系统收获的冷冻保存细胞,并在带有SFM XF培养基的T-175烧瓶中接种5,000个细胞/ cm2 。
- 4天后,收集用过的培养基,并将其储存在-80°C直至分析。
- 在多重阅读器上使用细胞因子表达谱 19 重面板试剂盒定量细胞因子的表达。
- 按照制造商的建议进行多重免疫测定。
结果
在经典含血清培养基中将WJ-hMSC主细胞库(MCB)解冻后保持三次连续传代(p1-p4),以产生足够的工作细胞库(WCB)用于实验。将p4 WCB在含血清培养基和SFM XF培养基中解冻并扩增,在T-175烧瓶中再传代三次(p4-p7)。WJ-MSCs在SFM XF培养基中扩增时适应良好,并且能够保持与含血清培养基相似的稳定增殖(图2A)。然而,在SFM XF培养基中扩增的细胞表现出稍长的成纤维细胞样纺锤形形态,导致细胞尺寸略大(图2B),平均为~17μm,而含血清培养基中的~15μm。在三个传代的两种培养基条件下,WJ-hMSCs始终达到其最大细胞密度~2.3 x 104 个细胞/ cm2 和~34小时的群体倍增时间(图2C,D)。
为了在封闭系统中进行大规模的WJ-hMSC扩增,我们首先在4层烧瓶中进行WJ-hMSCs的种子培养扩增,然后在10层多层烧瓶中进行。培养4天后,在约80%-90%的汇合度下,我们分别收获了9.6 x 10 7±0.9 x 107和2.3 x 10 8±0.2 x 108细胞用于4层和10层堆栈。与 T-175 烧瓶相比,电池密度更高,为 3.6 x 10 4-3.8 x 104 个细胞/cm2,这意味着电池组允许更好的细胞扩增多达 7 倍。
此外,使用逆流离心直接收获在10层培养容器中扩增的WJ-hMSC。使用仪器的蠕动泵,很容易建立与一次性试剂盒的无菌连接,以最大流速 165 mL/min 直接输送流体。半自动细胞收获过程是通过首先使用酶解离收获细胞,将细胞加载到逆流室中进行体积减小和浓缩,然后用洗涤缓冲液洗涤来实现的,洗涤缓冲液约为逆流离心室体积的 3 倍。此外,然后将洗涤的细胞浓缩并收获至协议中预设的所需收获体积。用于半自动细胞处理的处理步骤旨在模拟手动收获工作流程。我们实现了 10 倍的体积减少,从而产生了高达 530 万个细胞/mL 的细胞浓度。对于所有三个独立运行,该方案能够在~98%时实现高细胞回收率和~99%的高细胞活力(图3A-C)。
我们进行了广泛的细胞表征分析,以确定与手动离心相比,使用逆流离心收获的细胞的关键质量属性。为了测试WJ-hMSCs的身份,通过流式细胞术分析细胞表面标志物。 如图4A所示,使用两种方法收获的WJ-hMSCs显示出符合ISCT规定的特征表面标志物谱,CD73,CD90和CD105的阳性表达以及CD34和CD45的阴性表达。接下来,为了评估WJ-hMSCs的克隆发生潜力,进行了CFU-F测定。 如图4B所示,与手动离心收获的细胞相比,从逆流离心收获的细胞显示出相似的CFU-F电位(分别为21%±1%和20%±1%)。此外,如图 4C所示,逆流离心收获的细胞保留了分化为脂肪细胞、成骨细胞和软骨细胞的能力,类似于手动离心方法中的细胞。最后,我们使用多重免疫测定法研究了细胞的18种不同的细胞因子分泌谱。 如图4D所示,使用后逆流离心洗涤和浓缩的细胞保持细胞因子分泌谱,并且图谱与洗涤/浓缩细胞(预逆流离心)之前采集的样品相当。
总体而言,我们已经在SFM XF培养系统中证明了有效的hMSC扩增,并且使用封闭的自动逆流离心系统洗涤和浓缩的细胞在洗涤后产生了高细胞回收率和活力,并且可以保持其表型和功能。本研究中开发的封闭式半自动化工艺可以在最终WJ-MSC回收方面提供产品质量一致性,这从三次独立运行中得到证明。

图 1:用于收获、洗涤和浓缩 hMSC 的高流量一次性试剂盒配置和组装。 (A) 袋子与相应管道连接后的试剂盒图。(B)与定制管路组件一起连接到高流量一次性套件的10层多层烧瓶。(C) 通过逆流离心软件图形用户界面中启用的摄像头功能,可视化逆流室中形成的稳定流化池床。请点击此处查看此图的大图。

图2:含血清培养基和SFM XF培养基中hMSCs的细胞形态和扩增比较。 (A)经典血清培养基和SFM XF培养基中hMSCs的代表性细胞形态。SFM XF扩增的细胞显示出更长的纺锤形特征性成纤维细胞样形态,而在含血清培养基中生长的细胞显示出更扁平的形态。(B)含血清培养基和SFM XF培养基之间的平均MSC大小,由自动细胞计数器(n = 3)测量。很明显,在不同传代中,SFM XF扩增的细胞通常比血清扩增的细胞大。不同传代的总细胞产量(n = 3)(C)以每培养表面积的细胞数和(D)群体加倍水平表示。在不同传代中,SFM XF培养基和含血清培养基之间的细胞产量水平相似。数据表示为平均值±标准差。 请点击此处查看此图的大图。
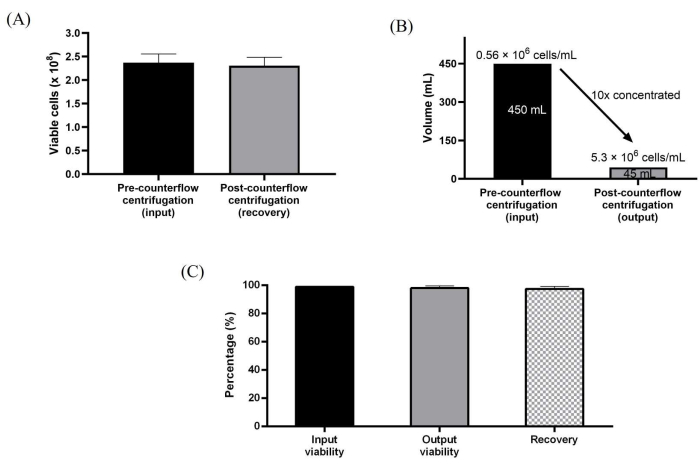
图 3:使用逆流离心系统处理的细胞的表征 。 (A)洗涤和浓缩前后的总活细胞。(B) 逆流离心处理后体积减少 10 倍。(C)细胞的总回收率和活力。数据在洗涤和浓缩运行的三个生物学重复(n = 3)中取平均值。数据表示为平均值±标准偏差。 请点击此处查看此图的大图。

图 4:关键质量属性分析 。 (A)流式细胞术的代表性数据。(B)显示总CFU的代表性图像。(C)三系分化的代表性显微图像。(D)在逆流离心系统上处理细胞前后的细胞因子表达分析结果(n = 3)。数据表示为平均值±标准偏差。 请点击此处查看此图的大图。
表1:在逆流离心系统上通过胰蛋白酶消化,洗涤和浓缩方案收获hMSC的顺序,包括初始启动步骤。请按此下载此表格。
讨论
在这项工作中,我们已经展示了使用逆流离心仪器在工作台上关闭和半自动hMSC解离以及洗涤和收获的能力。整个工作流程中的关键步骤之一是确保管道按照逆流离心系统方案构建器中定义的预设方案进行连接。设置和操作简单,从试剂盒组装到细胞收获,从 10 层烧瓶处理约 2 L 培养物所需的时间约为 60 分钟。该工作流程中的限制步骤之一是将流体从多层烧瓶转移到连接到逆流离心仪器的转移袋。高流量一次性试剂盒只能以 165 mL/min 的最大流速运行,这对于处理(例如 40 层烧瓶)可能具有挑战性。为了加快流体转移过程,可以使用外部高流量泵首先将胰蛋白酶化的内容物转移到转移袋中,然后使用逆流离心系统洗涤/浓缩并从转移袋中收获细胞。此外,该协议还可用于传代4层至10层多层烧瓶的细胞。在上游,逆流离心系统也可以优化,以洗涤解冻的hMSCs,并将收获和培养基配方直接收获到多层烧瓶中以启动种子培养。应该注意的是,在逆流离心室中形成流化床所需的最小细胞数约为3000万个细胞,每批的最大推荐处理体积为20 L。
目前,在cGMP设置中,不希望将定制管组件连接到生物安全柜中的多层烧瓶上以及组件部件的高压灭菌。作为替代方案,可以将定制的伽马灭菌管组件外包给供应商。提供多层烧瓶的供应商还提供使用所需的管道组件(包括0.2 μm过滤器)预装烧瓶的选项,并对整个设备进行伽马灭菌。这将确保多层烧瓶和连接的管道真正封闭,这意味着该过程可以在C级洁净室环境中的工作台上完成。
利用逆流离心系统的该过程不仅限于多层容器中基于贴壁的培养细胞,并且可以适用于动态(搅拌罐或波浪生物反应器)和静态(透气)悬浮液的细胞扩增平台。具体来说,对于在3D微载体培养物中扩增的hMSC,可以在逆流离心系统上优化方案,以收获,洗涤和配制从微载体中解离的hMSC。
总体而言,人们对开发具有改进工艺稳健性和可靠性的转化细胞疗法的兴趣日益浓厚,这导致了封闭式自动化细胞处理平台的开发。这些系统势在必行,因为它们减少了处理步骤的数量,防止无菌连接的潜在污染,并通过减少劳动力和提高洁净室空间的有效利用来降低制造成本21。与此一致,许多正在寻求监管部门批准以转化其疗法的细胞治疗产品开发人员都意识到早在工艺开发阶段就关闭流程并实施完全自动化或半自动化的重要性14,31,32。
通过使用监管友好的SFM XF培养基,以及符合21 CFR GMP Part 11和国际质量指南的辅助试剂,这种半自动化工艺将很容易适用于临床生产。我们已经展示了封闭过程的可重复性和WJ-MSC的质量保持。 提高在多层烧瓶中培养贴壁细胞的效率和安全性不仅有利于hMSC治疗领域,而且有利于细胞系库和贴壁病毒生产的公司。
披露声明
P.J.、A.B.、R.L. 和 J.N. 是赛默飞世尔科技的员工。A.L.和S.O.没有利益冲突。
致谢
作者要感谢来自新加坡A * STAR的行业调整基金预定位(IAF-PP)资金(H18 / 01 / a0 / 021和H18 / AH / a0 / 001)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 2L PVC transfer bag | TerumoBCT | BB*B200TM | |
| Alcian blue solution, pH 2.5 | Merck | 101647 | |
| Alizarin-Red Staining Solution | Merck | TMS-008-C | |
| APC anti-human CD73 Antibody | Biolegend | 344015 | |
| APC Mouse IgG1, κ Isotype Ctrl (FC) Antibody | Biolegend | 400121 | |
| Bio-Plex MAGPIX Multiplex Reader | Bio-Rad | ||
| Counterflow Centrifugation System | Thermo Fisher Scientific | A47679 | Gibco CTS Rotea Counterflow Centrifugation System |
| Crystal Violet | Sigma-aldrich | C0775 | |
| CTS (L-alanyl-L-glutamine) GlutaMAX supplement | Thermo Fisher Scientific | A1286001 | |
| CTS Dulbecco's phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | A1285601 | no calcium, no magnesium |
| CTS Recombinant Human Vitronectin (VTN-N) | Thermo Fisher Scientific | A27940 | |
| CTS TrypLE Select Enzyme | Thermo Fisher Scientific | A1285901 | |
| Custom tubing assembly | Saint-Gobain and Colder Product Company (CPC) | N/A | Gamma-sterilized 3/32” ID PVC line fitted with a sterile male MPC (1/8” barb) and sealed on the other end. Autoclave a short C-Flex line fitted with a sterile Cell Factory port connector on one end and a female MPC (3/8” barb) on the other. Connect the PVC and C-Flex lines in a biosafety cabinet |
| Emflon II capsule (0.2um filter) | Pall | KM5V002P2G100 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | 12662029 | Mesenchymal stem cell-qualified, USDA-approved regions |
| FGF-basic | Thermo Fisher Scientific | PHG0024 | |
| FITC anti-human CD105 Antibody | Biolegend | 323203 | |
| FITC anti-human CD45 Antibody | Biolegend | 304005 | |
| FITC anti-human CD90 (Thy1) Antibody | Biolegend | 328107 | |
| FITC Mouse IgG1, κ Isotype Ctrl (FC) Antibody | Biolegend | 400109 | |
| Hi-Flow Single Use Kit | Thermo Fisher Scientific | A46575 | Gibco CTS Rotea Hi-flow single-use kit, flow rate of 30 – 165 mL/min |
| Multi-layered systems | Thermo Fisher Scientific | 140360 (4-layers); 140410 (10-layers) | Nunc Standard Cell Factory Systems |
| NucleoCounter NC-3000 | Chemometec | NC-3000 | |
| Oil red O staining solution | Merck | 102419 | |
| PDGF-BB | Thermo Fisher Scientific | PHG0045 | |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | |
| PerCP anti-human CD34 Antibody | Biolegend | 343519 | |
| PerCP Mouse IgG1, κ Isotype Ctrl Antibody | Biolegend | 400147 | |
| ProcartaPlex Multiplex Immunoassays | Thermo Fisher Scientific | Custom 19-Plex panel: FGF-2, HGF, IDO, IL-10, IL-1RA, IL-6, IL-8, IP-10, MCP-1, MCP-2 , MIP-1α, MIP-1β, MIP-3α, PDGF-BB, RANTES, SDF-1α, TGFα, TNF-alpha, VEGF-A | |
| Sample port | Thermo Fisher Scientific | A50111 | Gamma-sterilized leur sample port with 2 PVC lines attached |
| StemPro Adipogenesis Differentiation Kit | Thermo Fisher Scientific | A10070-01 | |
| StemPro Chondrocyte Differentiation | Thermo Fisher Scientific | A10071-01 | |
| StemPro Custom MSC SF XF Medium Kit (SFM XF medium) | Thermo Fisher Scientific | ME20236L1 | Contains StemPro MSC SFM Basal Medium and Custom MSC SF XF Supplement (100x) |
| StemPro Osteogenesis Differentiation Kit | Thermo Fisher Scientific | A10072-01 | |
| T175 Nunc EasYFlask | Thermo Fisher Scientific | 159910 | |
| T75 Nunc EasYFlask | Thermo Fisher Scientific | 156472 | |
| TGFβ1 | Thermo Fisher Scientific | PHG9204 | |
| WJ MSCs | PromoCell | (#C12971; Germany) | Human mesenchymal stem cells |
| αMEM media | Thermo Fisher Scientific | 12571063 | With nucleosides |
参考文献
- Zhou, T., et al. Challenges and advances in clinical applications of mesenchymal stromal cells. Journal of Hematology & Oncology. 14 (1), 24 (2021).
- García-Bernal, D., et al. The current status of mesenchymal stromal cells: Controversies, unresolved issues and some promising solutions to improve their therapeutic efficacy. Frontiers in Cell and Developmental Biology. 9, 650664 (2021).
- Mastrolia, I., et al. Challenges in clinical development of mesenchymal stromal/stem cells: Concise review. Stem Cells Translational Medicine. 8 (11), 1135-1148 (2019).
- Jovic, D., et al. A brief overview of global trends in MSC-based cell therapy. Stem Cell Reviews and Reports. 18 (5), 1525-1545 (2022).
- Lechanteur, C., Briquet, A., Bettonville, V., Baudoux, E., Beguin, Y. MSC manufacturing for academic clinical trials: From a clinical-grade to a full GMP-compliant process. Cells. 10, 1320 (2021).
- Fernández-Santos, M. E., et al. Optimization of mesenchymal stromal cell (MSC) manufacturing processes for a better therapeutic outcome. Frontiers in Immunology. 13, 918565 (2022).
- Jossen, V., vanden Bos, C., Eibl, R., Eibl, D. Manufacturing human mesenchymal stem cells at clinical scale: Process and regulatory challenges. Applied Microbiology and Biotechnology. 102 (9), 3981-3994 (2018).
- Jayaraman, P., Lim, R., Ng, J., Vemuri, M. C. Acceleration of translational mesenchymal stromal cell therapy through consistent quality GMP manufacturing. Frontiers in Cell and Developmental Biology. 9, 648472 (2021).
- Levy, O., et al. Shattering barriers toward clinically meaningful MSC therapies. Science Advances. 6 (30), (2020).
- Fričová, D., Korchak, J. A., Zubair, A. C. Challenges and translational considerations of mesenchymal stem/stromal cell therapy for Parkinson's disease. npj Regenerative Medicine. 5 (1), 20 (2020).
- Childs, P. G., Reid, S., Salmeron-Sanchez, M., Dalby, M. J. Hurdles to uptake of mesenchymal stem cells and their progenitors in therapeutic products. Biochemical Journal. 477 (17), 3349-3366 (2020).
- James, D. How short-term gain can lead to long-term pain. Cell & Gene Therapy Insights. 3 (4), 271-284 (2017).
- Ochs, J., Barry, F., Schmitt, R., Murphy, M. Advances in automation for the production of clinical-grade mesenchymal stromal cells: The AUTOSTEM robotic platform. Cell & Gene Therapy Insights. 3 (8), 739-748 (2017).
- Doulgkeroglou, M. N., et al. Automation, monitoring, and standardization of cell product manufacturing. Frontiers in Bioengineering and Biotechnology. 8, 811 (2020).
- Chen, A. K. -. L., Reuveny, S., Oh, S. K. W. Application of human mesenchymal and pluripotent stem cell microcarrier cultures in cellular therapy: Achievements and future direction. Biotechnology Advances. 31 (7), 1032-1046 (2013).
- Couto, P. S., Bersenev, A., Rafiq, Q. A., Fernandes, T. G., Diogo, M. M., Cabral, J. M. S. . Engineering Strategies for Regenerative Medicine. , 33-71 (2020).
- Tsai, A. -. C., Pacak, C. A. Bioprocessing of human mesenchymal stem cells: From planar culture to microcarrier-based bioreactors. Bioengineering. 8 (7), 96 (2021).
- Cherian, D. S., Bhuvan, T., Meagher, L., Heng, T. S. P. Biological considerations in scaling up therapeutic cell manufacturing. Frontiers in Pharmacology. 11, 654 (2020).
- Mizukami, A., Swiech, K. Mesenchymal stromal cells: From discovery to manufacturing and commercialization. Stem Cells International. 2018, 4083921 (2018).
- Hassan, M., et al. Large-scale expansion of human mesenchymal stem cells. Stem Cells International. 2020, 9529465 (2020).
- Li, A., et al. Advances in automated cell washing and concentration. Cytotherapy. 23 (9), 774-786 (2021).
- Mehta, S. Single-use centrifugation solution for volume reduction and cell washing process in cell therapy manufacturing. Cytotherapy. 16, 101 (2014).
- Giancola, R., Bonfini, T., Iacone, A. Cell therapy: cGMP facilities and manufacturing. Muscles Ligaments and Tendons Journal. 2 (3), 243-247 (2012).
- Moutsatsou, P., Ochs, J., Schmitt, R. H., Hewitt, C. J., Hanga, M. P. Automation in cell and gene therapy manufacturing: From past to future. Biotechnology Letters. 41 (11), 1245-1253 (2019).
- Iancu, E. M., Kandalaft, L. E. Challenges and advantages of cell therapy manufacturing under Good Manufacturing Practices within the hospital setting. Current Opinion in Biotechnology. 65, 233-241 (2020).
- Li, A., James, D., Lim, R. The Gibco™ CTS™ Rotea™ system story-A case study of industry-academia collaboration. Gene Therapy. , (2021).
- Li, A., et al. Improving cell viability using counterflow centrifugal elutriation. Cytotherapy. 24 (6), 650-658 (2022).
- Li, A., et al. Automated counterflow centrifugal system for small-scale cell processing. Journal of Visualized Experiments. (154), e60423 (2019).
- Shah, D., Naciri, M., Clee, P., Al-Rubeai, M. NucleoCounter-An efficient technique for the determination of cell number and viability in animal cell culture processes. Cytotechnology. 51 (1), 39-44 (2006).
- Chan, A. K. C., Heathman, T. R. J., Coopman, K., Hewitt, C. J. Multiparameter flow cytometry for the characterisation of extracellular markers on human mesenchymal stem cells. Biotechnology Letters. 36 (4), 731-741 (2014).
- Smith, D., et al. Towards automated manufacturing for cell therapies. Current Hematologic Malignancy Reports. 14 (4), 278-285 (2019).
- Stroncek, D. F., Somerville, R. P. T., Highfill, S. L. Point-of-care cell therapy manufacturing; it's not for everyone. Journal of Translational Medicine. 20 (1), 34 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。