Method Article
Procesamiento de células madre mesenquimales humanas para aplicaciones clínicas utilizando un flujo de trabajo semiautomatizado cerrado
En este artículo
Resumen
Aquí, presentamos un protocolo para cosechar células adherentes de matraces multicapa de manera semiautomatizada cerrada utilizando un sistema de centrifugación de contraflujo. Este protocolo se puede aplicar para recolectar células adherentes y de suspensión de otras plataformas de expansión celular con pocas modificaciones a los pasos existentes.
Resumen
Las células madre mesenquimales humanas (hMSC) se están explorando actualmente como una modalidad terapéutica prometedora basada en células para diversas enfermedades, y se esperan más aprobaciones de mercado para uso clínico en los próximos años. Para facilitar esta transición, es fundamental abordar los cuellos de botella de la escala, la reproducibilidad de lote a lote, el costo, el cumplimiento normativo y el control de calidad. Estos desafíos se pueden abordar cerrando el proceso y adoptando plataformas de fabricación automatizadas. En este estudio, desarrollamos un proceso cerrado y semiautomatizado para el paso y la recolección de hMSC derivadas de la jalea de Wharton (WJ) (WJ-hMSC) de matraces de varias capas mediante centrifugación de contraflujo. Las WJ-hMSC se expandieron utilizando un medio libre de xeno-sin suero (SFM XF) que cumple con las regulaciones, y mostraron una proliferación celular (duplicación de la población) y morfología comparables a las WJ-hMSC expandidas en medios clásicos que contienen suero. Nuestro protocolo cerrado de recolección semiautomatizada demostró una alta recuperación celular (~ 98%) y viabilidad (~ 99%). Las células lavadas y concentradas mediante centrifugación de contraflujo mantuvieron la expresión del marcador de superficie WJ-hMSC, las unidades formadoras de colonias (UFC-F), el potencial de diferenciación de trilinaje y los perfiles de secreción de citoquinas. El protocolo de recolección celular semiautomatizado desarrollado en el estudio se puede aplicar fácilmente para el procesamiento a pequeña y mediana escala de varias células adherentes y de suspensión conectándose directamente a diferentes plataformas de expansión celular para realizar la reducción de volumen, lavado y recolección con un bajo volumen de salida.
Introducción
Las células madre mesenquimales humanas (hMSCs) son un gran candidato para aplicaciones clínicas, tanto en ingeniería tisular como en terapias celulares, dado su potencial terapéutico y su alto potencial de autorrenovación para crecer in vitro, que son críticos para generar dosis clínicamente relevantes de células 1,2,3. Según ClinicalTrials.gov, hay más de 1.000 ensayos clínicos actualmente bajo investigación para diversas enfermedades4. Dado el telón de fondo del creciente interés en el uso de hMSCs, más ensayos clínicos y aprobaciones de mercado son inminentes en un futuro próximo 5,6. Sin embargo, la fabricación de hMSC tiene muchos desafíos inherentes en términos de variabilidad de lote a lote, el uso de materias primas de alto riesgo, preocupaciones con respecto a la contaminación debido a muchos procesos abiertos y manuales, ya que la fabricación implica múltiples operaciones unitarias, mayores costos de mano de obra, el costo de escalar o ampliar y obstáculos regulatorios 6,7,8,9,10, 11,12. Estas cuestiones siguen siendo un obstáculo importante para el acceso actual y futuro a los mercados.
El desarrollo de soluciones de fabricación cerradas, modulares y automatizadas y el uso de reactivos auxiliares de bajo riesgo abordarían estos desafíos. Esto también garantizaría una calidad constante del producto, disminuiría la probabilidad de fallas de lotes debido a errores humanos, reduciría los costos de mano de obra y mejoraría la estandarización del proceso y el cumplimiento normativo, como en términos de mantenimiento de registros digitales de lotes 8,12,13,14. Para poder obtener una dosis clínicamente relevante de células, ya sea autóloga o alogénica, es crucial una fabricación simplificada que implique la expansión celular ascendente y el procesamiento posterior de manera cerrada y automatizada.
Para la expansión hMSC aguas arriba, los dos métodos de fabricación más comunes empleados actualmente son el escalamiento horizontal (monocapa 2D) y el escalado vertical (sistema de suspensión basado en microportadores 3D)15,16,17,18. El método más tradicional y ampliamente adoptado para la expansión de hMSC es el cultivo monocapa 2D debido al bajo costo de producción y la facilidad de configuración19.
Los matraces multicapa compuestos de bandejas de superficie plana apiladas dentro de un recipiente de cultivo se utilizan comúnmente para escalar la producción de hMSC. Estos sistemas generalmente vienen en recipientes de cultivo de 1 capa a 40 capas20 y se manejan manualmente dentro de los gabinetes de bioseguridad. Los pasos de procesamiento durante el paso y la recolección de células implican la dispensación y decantación manual de los medios de expansión, el reactivo de disociación y el tampón de lavado mediante pipeteo o inclinación física de todo el recipiente. Además, manejar múltiples unidades es desafiante y requiere mucho tiempo debido a su gran tamaño y peso.
Posteriormente, la poscosecha de matraces multicapa, la centrifugación para el intercambio de medios, el lavado celular y la reducción de volumen son pasos esenciales en todo el flujo de trabajo de fabricación de células21. La centrifugación convencional de sobremesa es un proceso mayormente abierto y manual que implica una multitud de pasos, como transferir la suspensión celular a tubos o botellas tapados dentro de un gabinete de bioseguridad, girar las células, aspirar manualmente el sobrenadante, resuspensión celular con el tampón y lavados celulares repetidos. Esto aumenta dramáticamente tanto el riesgo de contaminación debido a la apertura y cierre de las tapas como las posibilidades de perder el pellet de la celda durante el proceso manual de aspiración/pipeteo22. En el contexto del manejo de sistemas de cultivo multicapa para células basadas en adherentes, como las hMSC, el operador tendría que pasar por un laborioso proceso de transporte entre la centrífuga y el gabinete de bioseguridad repetidamente y manejar una unidad pesada al mismo tiempo. Estos pasos manuales son laboriosos, plantean riesgos en términos de errores humanos y contaminación, y deben llevarse a cabo en un entorno de sala limpia de Clase B, que es costoso23. Además, el proceso de centrifugación manual convencional no es escalable y podría causar cizallamiento celular y estrés; Por lo tanto, maximizar la recuperación celular, la viabilidad y la eficiencia de lavado de las impurezas residuales son otros desafíos importantes22. La fabricación comercial a escala cGMP de terapias celulares requiere soluciones de automatización cerradas y modulares para reducir el riesgo de contaminación, garantizar una calidad constante del producto, reducir los costos de mano de obra y producción, y aumentar la confiabilidad del proceso24,25. Los matraces multicapa se pueden manejar como un sistema cerrado al tener un filtro estéril de 0,2 μm en uno de los puertos para facilitar el intercambio de gases estériles y un segundo puerto conectado asépticamente a través de conectores o soldado por tubo directamente a un instrumento automatizado de procesamiento celular para la recolección de células. Trabajamos para cerrar y automatizar la mayoría de los pasos de paso y cosecha de WJ-hMSC mediante la evaluación de una innovadora centrífuga de contraflujo cerrado destinada a la fabricación de productos basados en células, genes o tejidos. Esta centrífuga de contraflujo también tiene la flexibilidad de realizar una variedad de aplicaciones de procesamiento celular, como la separación celular basada en el tamaño, el intercambio medio/tampón, la concentración y la recolección para una variedad de tipos de células 8,26,27,28. El instrumento utiliza un kit cerrado de un solo uso que se puede conectar estéril mediante soldadura de tubos o conectores asépticos para transferir bolsas o se puede conectar directamente a cualquier plataforma de expansión de su elección.
En este estudio, diseñamos un conjunto de tubos personalizado para permitir conexiones estériles cerradas entre el kit de centrifugación de contraflujo de un solo uso y el matraz multicapa. Optimizamos un protocolo para separar, lavar y cosechar enzimáticamente WJ-MSC del matraz multicapa de una manera completamente cerrada y semiautomatizada en una sola ejecución. Las WJ-hMSC cosechadas se caracterizaron por su pureza (análisis de marcadores de superficie) y potencia (UFC-F, diferenciación trilinaje y perfiles de secreción de citoquinas) para garantizar que el producto final cumpliera con los atributos críticos de calidad (CQA) para la liberación del lote.
Protocolo
1. Preparación de los medios de cultivo y recubrimiento de los recipientes de cultivo
- Preparación de los medios
- Composición del medio que contiene suero clásico: Prepare el medio clásico que contiene suero mezclando αMEM (445 ml), suero fetal bovino (FBS) (50 ml) y 100x penicilina-estreptomicina (5 ml).
- Prepare el medio SFM XF completo.
- Haga un frasco de 500 ml agregando asépticamente 5 ml de suplemento SFM XF (100x) y 5 ml de L-alanil-L-glutamina 100x (consulte Tablas de materiales) al medio basal SFM XF (500 ml).
- Haga una bolsa de medios de 2 L agregando asépticamente 20 ml de suplemento personalizado MSC SFM XF (100x) y 20 ml de 100x L-alanil-L-glutamina (consulte Tablas de materiales) a la bolsa mediana basal SFM XF (2 L) conectando una jeringa de 50 ml al puerto apropiado de la bolsa.
NOTA: Antes de usarlos en cultivo, agregue factores de crecimiento o citocinas (no suministrados con el medio) al medio SF XF completo: PDGF-BB (20 ng/ml), FGF básico (4 ng/ml) y TGFβ (0,5 ng/ml).
- Recubrimiento de los vasos de cultivo celular con vitronectina para su uso con medios sin suero
- Descongelar una reserva de vitronectina (VTN-N; 0,9 mg/ml) a 4 °C.
- Utilice solución salina tamponada estéril de Dulbecco sin calcio y magnesio (DPBS) para diluir el VTN-N descongelado a una concentración de trabajo de 5 μg/ml.
NOTA: Diluya el VTN-N inmediatamente antes de usarlo y no guarde la solución diluida de vitronectina. - Añadir 1 ml/10cm2 de la solución diluida de VTN-N al recipiente de cultivo correspondiente; La concentración final es de 0,5 μg/cm2. Por ejemplo, añadir 7,5 ml de solución diluida de VTN-N a un matraz T-75 (75 cm2); añadir 17,5 ml de solución diluida de VTN-N a un matraz T-175 (175 cm2); añadir 250 ml de solución de VTN-N diluida a un matraz patrón de cuatro capas de varias capas (2,528 cm2); y añadir 630 ml de solución diluida de VTN-N a un matraz multicapa de 10 capas (6,320 cm2).
- En condiciones estériles, incubar los recipientes durante 1 h a temperatura ambiente (RT).
NOTA: El recipiente de cultivo recubierto puede conservarse a 4 °C durante un máximo de 1 semana. Envuelva el recipiente de cultivo con una película de laboratorio para evitar que se seque. Antes de su uso, precaliente el recipiente de cultivo a temperatura ambiente durante al menos 1 h. - Aspire la solución de VTN-N, deseche e inmediatamente agregue un volumen suficiente de medio de cultivo para evitar que la superficie del recipiente recubierto se seque.
NOTA: No es necesario enjuagar el recipiente de cultivo después de la extracción del VTN-N.
2. Expansión WJ-hMSC
- Descongele rápidamente las WJ-hMSCs (p2) colocando el criovial en un baño de agua a 37 °C; Agite lentamente el vial hasta que el contenido comience a descongelarse.
- Tras la descongelación, sembrar las WJ-hMSCs a 5.000 células/cm2 en un matraz T-175 (sin recubrimiento VTN-N) e incubar en el medio clásico que contiene suero a 37 °C en una atmósfera humidificada de 5% deCO2 para la expansión celular. Después de dos pasajes (p4), deposite las células expandidas en el medio de criopreservación deseado como un banco de células de trabajo (WCB).
- Llevar a cabo el recuento de células utilizando un contador de células automatizado siguiendo el método de viabilidad y recuento de células para determinar el recuento total de células, la viabilidad celular y el tamaño de las células29.
- A partir de p4, cultivar las WJ-hMSCs a 5.000 células/cm2 en matraces T-75 en medio clásico que contiene suero o en medio SFM XF (utilice matraces recubiertos con VTN-N con medio SFM XF).
- Mantener las células en ambos medios de cultivo durante un total de tres pasajes (12 días), y medir la expansión celular (aumento del pliegue) en cada pasaje dividiendo el número de células viables contadas al final del cultivo de cada pasaje por el número de células viables al comienzo del cultivo (día de siembra celular).
3. Expansión de escalabilidad horizontal del tren de semillas
- Expansión WJ-hMSC en matraz T-175
- Descongele rápidamente las WJ-hMSC a p4 colocando el criovial en un baño maría a 37 °C; Agite lentamente el vial hasta que la solución comience a descongelarse.
- Sembrar 5.000 células/cm2 en un matraz T-175 recubierto con VTN-N. Permitir que las células crezcan en una incubadora a 37 °C con un 5% deCO2.
- Reemplace el medio de cultivo gastado cada 2-3 días con medio SFM XF completo precalentado recién preparado para un rendimiento y crecimiento celular óptimos.
- Manipulación de los matraces multicapa (Figura 1A, B)
- Todas las conexiones asépticas deben realizarse en un ambiente estéril.
- Desembale el matraz de varias capas dentro de un armario de seguridad biológica.
- Conecte el filtro de aire preesterilizado (0,2 μm) a un puerto para permitir que se libere presión durante la transferencia de fluido utilizando la centrífuga de contraflujo.
- Coloque el conector del matraz multicapa del conjunto de tubos personalizado en el otro puerto (Figura 1B).
- Suelde la línea de PVC del conjunto de tubos personalizado a la bolsa de transferencia de PVC de 2 L que contiene el medio SFM XF completo.
NOTA: Mezcle completamente la bolsa mediana antes de agregarla al sistema multicapa por flujo por gravedad. Asegúrese de que la bolsa de transferencia de PVC cuelgue más alta que el matraz multicapa. - Colocar el matraz multicapa en su lado largo, con el filtro de aire en la parte superior (figura 1B).
- Abra la abrazadera del tubo de PVC para empezar a llenar el matraz multicapa. Asegúrese de que el medio esté nivelado entre las bandejas durante el llenado.
- Una vez que el medio se haya nivelado completamente en todas las bandejas, gire el matraz de varias capas sobre su lado corto con los puertos en posición vertical.
- Cierre la abrazadera de la línea de PVC y retire la bolsa de transferencia reemplazando la conexión del tubo con la tapa de cierre azul MPC.
NOTA: No retire el filtro de aire, ya que esto permite el intercambio de gases durante la expansión de la celda. - Gire el matraz multicapa a la posición de incubación.
NOTA: El filtro y la conexión del tubo deben estar mirando hacia arriba. - Vacíe el matraz multicapa conectándolo a un frasco aspirador; Colóquelo sobre la botella del aspirador y el líquido fluirá.
NOTA: Incline el matraz multicapa de lado para drenar completamente el medio gastado por gravedad. Alternativamente, el medio gastado se puede verter en una botella de residuos utilizando un conjunto de tubos personalizado. - Repita los pasos 3.2.5-3.2.11 para reponer el medio fresco.
- Subcultivo de WJ-hMSCs en matraz multicapa (T-175 > 4 capas > 10 capas)
- Reactivo de disociación celular precaliente (TrypLE) y medio SFM XF completo dentro de una incubadora a 37 °C antes de su uso.
- Aspirar el medio gastado del matraz T-175 y desechar.
- Lave la monocapa celular con DPBS precalentados, aspire y deseche.
- Añadir TrypLE a cada matraz, asegurar una cobertura completa de la monocapa celular e incubar durante 5-10 min a 37 °C.
- Transfiera la suspensión a un tubo cónico estéril de 50 ml.
- Centrifugar el tubo a 100-200 x g durante 5 min en RT. Aspirar y desechar el DPBS, y tener cuidado de no perturbar el pellet celular.
- Resuspender el pellet celular en un volumen mínimo (10 ml) de medio SFM XF completo precalentado para el recuento celular.
- Llene un recipiente de cultivo de cuatro capas recubierto con VTN-N con aproximadamente 800 ml de medio SFM XF completo, como se mencionó en la sección 2 anterior. Añadir 5.000 células/cm2 (es decir, 1,26 x 107 células/matraz viable). Agite suavemente la suspensión de la celda para garantizar una distribución uniforme.
- Incubar en una incubadora a 37 °C con un 5% deCO2 en atmósfera humidificada.
- Reemplace el medio de cultivo gastado cada 2-3 días con medio SFM XF completo fresco y precalentado para un crecimiento celular óptimo hasta que las células alcancen una confluencia del 60% -80% o estén listas para ser subcultivadas en el matraz multicapa de 10 capas.
- Llenar un matraz multicapa de 10 capas recubierto con VTN-N con aproximadamente 2 L de medio SFM XF completo, como se menciona en la sección 2. Añadir 5.000 células/cm2 (es decir, 3,1 x 107 células/matraz). Agite suavemente la suspensión de la celda para garantizar una distribución uniforme.
- Incubar en una incubadora a 37 °C con un 5% deCO2 en atmósfera humidificada.
- Reemplace el medio de cultivo gastado cada 2-3 días con medio SFM XF completo fresco y precalentado para un crecimiento celular óptimo hasta que las células alcancen una confluencia del 60% -80% o estén listas para ser cosechadas.
4. Disociación y cosecha WJ-hMSC semiautomatizada cerrada mediante centrifugación cerrada por contraflujo
- Conjunto del kit de centrifugación de contraflujo de un solo uso
- Conecte el kit de un solo uso con las bolsas de transferencia de PVC de un solo uso mediante soldadura de tubos, similar a la configuración que se muestra en la Figura 1A.
NOTA: El caudal predeterminado del kit de un solo uso es de 30-165 ml/min. - Acople un matraz multicapa de 10 capas que contenga WJ-hMSC confluentes al conjunto de tubos personalizado dentro de un armario de bioseguridad.
- Transfiera el recipiente de cultivo de 10 capas adjunto con el conjunto de tubería personalizado a un banco y suelde a la Línea E (3/32 en PVC identificado) del kit de un solo uso, como se muestra en la Figura 1B.
- Asegúrese de soldar un puerto de muestra estéril a la Línea G del kit de un solo uso de alto flujo.
- A continuación, conecte la línea de cosecha H a un Luer estéril equipado con una jeringa de 50 ml.
NOTA: En todos los pasos anteriores, asegúrese de que las abrazaderas manuales estén cerradas para asegurar el líquido en cada bolsa del kit.
- Conecte el kit de un solo uso con las bolsas de transferencia de PVC de un solo uso mediante soldadura de tubos, similar a la configuración que se muestra en la Figura 1A.
- Configuración de la ejecución del instrumento
- Encienda el instrumento encendiendo el interruptor de palanca en la parte posterior del instrumento.
- Conecte el portátil al puerto USB-C del instrumento mediante el cable USB-C suministrado (Figura 1B).
- Ejecute el software de interfaz gráfica de usuario (GUI) de centrífuga de contraflujo desde el escritorio o el menú de inicio.
- Después de iniciar sesión, cargue el protocolo haciendo clic en el botón Seleccionar un protocolo en la página de bienvenida principal.
NOTA: El protocolo de recolección por centrifugación de contraflujo (Tabla 1) se creó utilizando el software Protocol Builder y se almacenó localmente. - Presione el botón azul de desbloqueo en el instrumento y abra la puerta de vidrio.
- Cargue el kit de un solo uso montado en el sistema de centrifugación de contraflujo.
- Comience colgando las bolsas suspendidas en ganchos de percha en el orden que mejor las alinee con los puertos del tubo en las tiras del sensor de burbujas, con el matraz multicapa de 10 capas colocado en ángulo, como se muestra en la Figura 1B.
- Alinee el kit con los dos botones de ubicación del kit, estire el tubo de la bomba alrededor de la bomba peristáltica y presione el conector blanco en forma de bombilla en su lugar.
NOTA: Asegúrese de que el tubo sobre el sensor de presión esté colocado correctamente en la pista de tubos. - Acople la cámara de centrífuga levantando la palanca de plata del portador de la cámara de centrífuga de contraflujo y asegurándola devolviendo la palanca a su posición vertical.
- Presione el tubo de cada puerto del kit en las pistas a lo largo de las tiras del sensor de burbujas.
NOTA: Asegúrese de que las bolsas no estén enredadas para que el proceso de protocolo se pueda seguir fácilmente. - Cierre la puerta presionando el pestillo de la puerta.
NOTA: El brazo de la abrazadera de la bomba se cerrará, la cámara de la centrífuga girará y las válvulas se cerrarán. Sin cerrar la puerta, el sistema no podrá iniciar y ejecutar el protocolo. - Presione el botón Iniciar en la GUI. Aparecerá una lista de verificación; Los primeros cuatro elementos son verificaciones de instrumentos, y los dos últimos elementos son verificaciones de usuario (asegúrese de que las bolsas y las conexiones coincidan con la imagen del kit y asegúrese de que las abrazaderas manuales estén abiertas).
NOTA: Para las comprobaciones de instrumentos, se muestran las X rojas en lugar de las marcas de verificación azules si algo no está bien. - Pulse Confirmar para mostrar la pantalla de entradas de protocolo.
- Establezca el valor del cuadro de diálogo Entrada de datos (Volumen de cosecha) en 45 ml y pulse Confirmar.
NOTA: Se mostrará la pantalla de entrada del protocolo si se establecen entradas de datos variables en el protocolo creado por el usuario. El volumen de cosecha se establece como una variable en este protocolo, y el usuario puede elegir probar diferentes volúmenes dependiendo de los requisitos finales de densidad celular. El volumen mínimo de cosecha que permite el sistema es de 5 mL. El sistema permite establecer un máximo de solo cuatro variables de datos para cada protocolo.
- Ejecución del protocolo
- Haga clic en Iniciar en la GUI y presione el botón verde Inicio en el instrumento para iniciar la ejecución del protocolo (consulte la Tabla 1).
NOTA: El sistema iniciará los pasos de acuerdo con el protocolo comenzando con la secuencia de cebado reemplazando el aire en el sistema con un búfer. - Una vez que se complete el cebado (Tabla 1, paso 8), asegúrese de que el medio gastado se bombee completamente a la bolsa de residuos.
NOTA: Una vez que el matraz multicapa de 10 capas esté vacío, el sistema solicitará al usuario en la GUI que confirme si el recipiente está vacío. Presione el botón "Skip" en el instrumento si el recipiente está vacío; si no es así, presione el botón verde "Reproducir/Pausa" para continuar drenando cualquier líquido residual del recipiente. - En los pasos de pausa 15, 19 y 22 (Tabla 1), asegúrese de levantar el matraz de varias capas y agitarlo para distribuir el tampón por igual a todas las bandejas. Una vez completado, vuelva a colocar el matraz multicapa de 10 capas en su posición de dibujo original para los siguientes pasos.
NOTA: Para el paso 19 de la Tabla 1 solamente, después de agitar, asegúrese de colocar el matraz multicapa plano e incubar durante 10-15 minutos en RT para disociar las células. - En los pasos 20 y 23 (Tabla 1), asegúrese de que las células tripsinizadas se transfieran completamente a la bolsa intermedia.
- Mezcle bien la bolsa intermedia manualmente en el paso 25 (Tabla 1).
- En el paso 26 (Tabla 1), utilice una jeringa Luer de 2 ml para tomar muestras a través del puerto de muestreo.
NOTA: Se recomienda tomar muestras al menos tres veces para obtener recuentos celulares precisos. - En los pasos 29 y 30 (Tabla 1), verifique la formación estable del lecho celular fluidizado; debe ser similar al lecho celular fluidizado como se muestra en la Figura 1C.
NOTA: Si el lecho celular fluidizado estable no está formado de manera similar a la que se muestra en la Figura 1C, la optimización de la relación entre la fuerza g y el caudal (G / F) es fundamental para lograr un lecho celular fluidizado estable (alta recuperación celular) en la cámara durante los pasos de carga y lavado de la celda. La relación G/F depende del tamaño de las células y de la densidad del medio. Se necesita una relación G/F alta para un tampón muestra/lavado de alta densidad, mientras que se puede utilizar una relación G/F baja para un tampón muestra/lavado de baja densidad. - La ejecución se completa en el paso Rampa a parada (paso 35 en la Tabla 1), y todos los valores de pellizco en el sistema de centrifugación de contraflujo se cerrarán automáticamente.
NOTA: Por último, asegúrese de que las abrazaderas manuales estén cerradas para asegurar el líquido en cada bolsa del kit antes de abrir la puerta. - Una vez completado el protocolo, presione el botón azul de desbloqueo en el instrumento y abra la puerta de vidrio. Saque el kit de un solo uso con el concentrado cosechado del instrumento.
- Selle asépticamente la línea de cosecha con un sellador de tubos de transporte manual. Transfiera cuidadosamente la jeringa sellada llena con la cosecha de células concentradas al gabinete de seguridad biológica para el recuento de células y la criopreservación.
- Vuelva a separar la cámara con la palanca, saque el conector de la bombilla de su accesorio, levante con cuidado el kit y deséchelo en una bolsa de riesgo biológico.
- Limpie el instrumento con toallitas de etanol y asegúrese de cerrar la puerta.
- Cierre primero la aplicación GUI antes de apagar el interruptor en la parte posterior del instrumento.
NOTA: El protocolo de recolección celular se probó en triplicados biológicos (n = 3).
- Haga clic en Iniciar en la GUI y presione el botón verde Inicio en el instrumento para iniciar la ejecución del protocolo (consulte la Tabla 1).
5. Evaluación de atributos críticos de calidad (CQA)
- Marcadores de superficie de identidad celular (CD73, CD90 y CD105) y marcadores no estromales (CD34 y CD45)
- Diluir la suspensión celular WJ-hMSC cosechada a una concentración de 1 x 106 células viables/ml agregando un volumen apropiado de tampón de citometría de flujo (DPBS con 1% BSA o 2% FBS).
- Agregue 100 μL de la suspensión celular a cada tubo de microcentrífuga o placa de 96 pocillos. Asegúrese de que haya un mínimo de 0,1 x 106 células por cada 100 μL de suspensión celular.
- Agregue el anticuerpo conjugado fluoróforo a la muestra en una dilución adecuada, según lo recomendado por el proveedor de anticuerpos.
- Incubar durante 20 minutos en la oscuridad.
- Después de la incubación, añadir 100 μL de tampón de citometría de flujo para lavar las muestras por centrifugación a 380 x g durante 3 min.
- Deseche el sobrenadante, dejando atrás el pellet.
- Resuspender el pellet celular en 200 μL de tampón de citometría de flujo y someterlo a análisis de citometría de flujo30.
- Ensayo fibroblástico de unidades formadoras de colonias (UFC-F)
- Diluir la suspensión celular a una concentración de 1.000 células viables/ml de medio de cultivo completo.
- Placa ~500 células por pocillo en una placa de cultivo de tejido de 6 pocillos en medio de cultivo completo.
- Incubar durante 10-14 días a 37 °C enCO2 humidificado al 5%, lavar con PBS y teñir con violeta cristal al 0,5% en metanol durante 30 min en RT.
- Enumere las colonias en cada pozo.
- Calcular la eficiencia CFU-F: Divida el número de colonias formadas por el número de siembra original para obtener el porcentaje de eficiencia de formación de colonias, y expréselo como un porcentaje.
- Potencial de diferenciación del trilinaje
- Semilla 5 x 103 células/cm2 en medio de diferenciación de osteogénesis y adipogénesis en placas de12 pocillos según el protocolo del fabricante. Para la condrogénesis, prepare 1.6 x 107 células viables / ml y genere cultivos de micromasa sembrando gotas de 5 μL de la solución celular en los centros de los pocillos de las placas de 96 pocillos, según el protocolo del fabricante.
- Durante la diferenciación, haga cambios medios completos cada 3-4 días.
- Después de 14 días (para adipogénesis) o 21 días (para osteogénesis y condrogénesis), monitoree los cultivos para la diferenciación mediante el uso de tinciones biológicas específicas del linaje según el protocolo del fabricante. Para la diferenciación adipogénica, teñir los cultivos con solución Oil Red O al 0,5%. Para la osteogénesis, realice la tinción utilizando una solución de Alizarin Red S al 2%. Para la diferenciación condrogénica, tiñe los pellets de micromasa con 1% de azul alciano.
- Perfiles de secreción de citoquinas
- Descongelar las células criopreservadas recolectadas manualmente o utilizando el sistema de centrifugación de contraflujo, y sembrar 5.000 células/cm2 en un matraz T-175 con medios SFM XF.
- Después de 4 días, recoger el medio de cultivo gastado y almacenarlo a -80 °C hasta el análisis.
- Cuantificar la expresión de citoquinas utilizando un kit de panel de 19-plex de perfiles de expresión de citoquinas en un lector múltiplex.
- Realice los inmunoensayos multiplex según las recomendaciones del fabricante.
Resultados
El banco de células maestras (MCB) WJ-hMSC después de la descongelación se mantuvo durante tres pasajes sucesivos (p1-p4) en un medio clásico que contiene suero para producir suficientes bancos de células de trabajo (WCB) para los experimentos. Los WCB p4 se descongelaron y expandieron tanto en medio que contenía suero como en medio SFM XF durante tres pasajes más (p4-p7) en matraces T-175. Las WJ-MSC se adaptaron bien cuando se expandieron en medio SFM XF y fueron capaces de mantener una proliferación estable similar a la del medio que contiene suero (Figura 2A). Sin embargo, las células expandidas en medio SFM XF exhibieron una morfología en forma de huso similar a fibroblastos ligeramente más larga, lo que resultó en un tamaño celular ligeramente mayor (Figura 2B) de un promedio de ~ 17 μm en comparación con ~ 15 μm en medio que contiene suero. En ambas condiciones medias a través de los tres pasajes, las WJ-hMSCs alcanzaron consistentemente su densidad celular máxima de ~2.3 x 104 células/cm2 y un tiempo de duplicación de la población de ~34 h (Figura 2C, D).
Para la expansión a gran escala de WJ-hMSC en un sistema cerrado, llevamos a cabo una expansión del tren de semillas de WJ-hMSC primero en un matraz de 4 capas y, posteriormente, en un matraz multicapa de 10 capas. Con una confluencia de alrededor del 80% -90% después de 4 días de cultivo, cosechamos 9.6 x 10 7 ± 0.9 x 107 y 2.3 x 10 8± 0.2 x 108 celdas para las pilas de 4 y 10 capas, respectivamente. Se alcanzó una densidad celular más alta de 3.6 x 10 4-3.8 x 104 celdas / cm2 en comparación con los matraces T-175, lo que significa que las pilas permitieron una mejor expansión celular hasta siete veces.
Además, los WJ-hMSCs expandidos en recipientes de cultivo de 10 capas se cosecharon directamente mediante centrifugación de contraflujo. La conexión estéril al kit de un solo uso fue fácil de establecer para la transferencia directa de fluido a un caudal máximo de 165 ml / min utilizando la bomba peristáltica del instrumento. El proceso semiautomático de recolección celular se logró recolectando primero las células utilizando disociación enzimática, cargando las células en la cámara de contraflujo para reducir el volumen y concentrarlas, y luego lavándolas con tampón de lavado, que era aproximadamente 3 veces el volumen de la cámara de centrifugación de contraflujo. Además, las células lavadas se concentraron y cosecharon al volumen de cosecha deseado preestablecido en el protocolo. Los pasos de procesamiento utilizados para el procesamiento celular semiautomatizado se diseñaron para emular el flujo de trabajo de recolección manual. Logramos una reducción de volumen de 10 veces, lo que resultó en la generación de concentraciones celulares tan altas como 5.3 millones de células / ml. El protocolo fue capaz de lograr una alta recuperación celular a ~98% y una alta viabilidad celular a ~99% consistentemente para las tres ejecuciones independientes (Figura 3A-C).
Llevamos a cabo extensos ensayos de caracterización celular para determinar los atributos críticos de calidad de la recolección celular utilizando centrifugación de contraflujo en comparación con la centrifugación manual. Para probar la identidad de las WJ-hMSCs, los marcadores de superficie celular se analizaron mediante citometría de flujo. Como se muestra en la Figura 4A, las WJ-hMSCs recolectadas utilizando ambos métodos mostraron perfiles característicos de marcadores de superficie de acuerdo con las regulaciones ISCT, expresión positiva de CD73, CD90 y CD105, así como expresión negativa de CD34 y CD45. A continuación, para evaluar el potencial clonogénico de las WJ-hMSCs, se realizaron ensayos CFU-F. Como se muestra en la Figura 4B, las células recolectadas de la centrifugación por contraflujo mostraron un potencial de UFC-F similar en comparación con las células recolectadas por centrifugación manual (21% ± 1% vs. 20% ± 1%, respectivamente). Además, como se muestra en la Figura 4C, las células recolectadas por centrifugación posterior al contraflujo conservaron la capacidad de diferenciarse en adipocitos, osteoblastos y condrocitos similares a las células en el método de centrifugación manual. Por último, investigamos 18 perfiles diferentes de secreción de citoquinas de las células utilizando inmunoensayos multiplex. Como se muestra en la Figura 4D, las células lavadas y concentradas utilizando la centrifugación post-contraflujo mantuvieron perfiles de secreción de citoquinas, y los perfiles fueron comparables a los de la muestra tomada antes de lavar/concentrar las células (centrifugación pre-contraflujo).
En general, hemos demostrado una expansión eficiente de hMSC en un sistema de cultivo SFM XF, y las células lavadas y concentradas utilizando el sistema de centrifugación de contraflujo cerrado y automatizado produjeron una alta recuperación celular y viabilidad después del lavado y pudieron mantener su fenotipo y funcionalidad. El proceso semiautomatizado cerrado desarrollado en este estudio puede ofrecer consistencia en la calidad del producto en términos de recuperación final de WJ-MSC, como se evidencia en tres ejecuciones independientes.

Figura 1: Configuración y montaje del kit de un solo uso de alto flujo para la cosecha, lavado y concentración de hMSC . (A) Diagrama del kit después de que las bolsas se hayan conectado en línea con el tubo respectivo. (B) El matraz multicapa de 10 capas conectado al kit de un solo uso de alto flujo con el conjunto de tubos personalizado. (C) Visualización del lecho celular fluidizado estable formado en la cámara de contraflujo a través de la función de cámara habilitada en la interfaz gráfica de usuario del software de centrifugación de contraflujo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Comparación de la morfología celular y expansión de hMSCs en medio que contiene suero y medio SFM XF. (A) La morfología celular representativa de hMSCs en medio sérico clásico y medio SFM XF. Las células expandidas SFM XF mostraron una morfología más larga, en forma de huso, característica similar a un fibroblasto, mientras que las células cultivadas en medio que contenía suero mostraron una morfología más aplanada. (B) El tamaño medio de la MSC entre el medio que contiene suero y el medio SFM XF, medido por un contador celular automatizado (n = 3). Está claro que las células expandidas XF de SFM eran generalmente más grandes que las células expandidas en suero en diferentes pasajes. El rendimiento celular total en diferentes pasajes (n = 3) (C) en términos de células por área de superficie de cultivo y (D) niveles de duplicación de la población. Se obtuvieron niveles similares de rendimiento celular entre el medio SFM XF y el medio que contenía suero en diferentes pasajes. Los datos se expresan como la media ± la desviación estándar. Haga clic aquí para ver una versión más grande de esta figura.
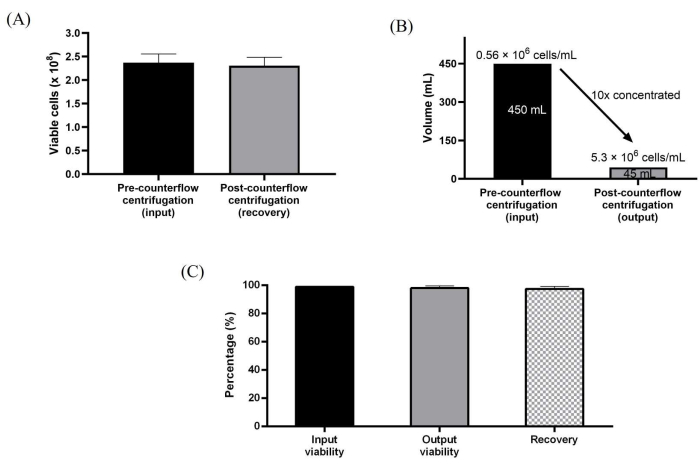
Figura 3: Caracterización de células procesadas mediante el sistema de centrifugación por contraflujo . (A) Total de células viables antes y después del lavado y concentración. (B) Se logró una reducción de volumen de 10 veces después del procesamiento de centrifugación de contraflujo. (C) Recuperación total y viabilidad de las células. Los datos se promedian en tres réplicas biológicas (n = 3) de series de lavado y concentración. Los datos se expresan como media ± desviación estándar. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Análisis de atributos críticos de calidad . (A) Datos representativos de la citometría de flujo. (B) Imágenes representativas que muestren el total de UFC. (C) Imágenes microscópicas representativas de la diferenciación del trilinaje. (D) Resultados del análisis de expresión de citoquinas antes y después de procesar las células en el sistema de centrifugación de contraflujo (n = 3). Los datos se expresan como media ± desviación estándar. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Secuencia de la cosecha de hMSC por tripsinización, lavado y protocolo de concentración en el sistema de centrifugación de contraflujo, incluyendo los pasos iniciales de cebado. Haga clic aquí para descargar esta tabla.
Discusión
En este trabajo, hemos demostrado la capacidad de cerrar y semiautomatizar la disociación de hMSC y lavar y cosechar en el banco utilizando un instrumento de centrifugación de contraflujo. Uno de los pasos críticos en todo el flujo de trabajo es asegurarse de que los tubos estén conectados de acuerdo con el protocolo preestablecido definido en el generador de protocolos del sistema de centrifugación de contraflujo. La configuración y el funcionamiento son sencillos, y el tiempo necesario para procesar alrededor de 2 L de cultivo desde un matraz de 10 capas desde el montaje del kit hasta la cosecha de células fue de unos 60 minutos. Uno de los pasos limitantes en este flujo de trabajo es la transferencia de fluido desde el matraz multicapa a las bolsas de transferencia conectadas al instrumento de centrifugación de contraflujo. El kit de un solo uso de alto caudal solo puede funcionar a un caudal máximo de 165 ml/min, y esto podría ser un reto para el procesamiento, por ejemplo, de un matraz de 40 capas. Para acelerar el proceso de transferencia de fluidos, se pueden usar bombas externas de alto caudal para transferir primero el contenido tripsinizado a una bolsa de transferencia, seguido de lavar / concentrar y recolectar las células de la bolsa de transferencia utilizando el sistema de centrifugación de contraflujo. Además, este protocolo también se puede aplicar para pasar celdas de matraces multicapa de 4 capas a 10 capas. Más arriba, el sistema de centrifugación de contraflujo también podría optimizarse para el lavado de hMSC descongelados y la cosecha directa y la formulación media en matraces de varias capas para iniciar el tren de semillas. Cabe señalar que el número mínimo de células necesarias para formar el lecho fluidizado en la cámara de centrifugación de contraflujo es de aproximadamente 30 millones de células, y el volumen máximo recomendado para procesar por lote es de 20 L.
Actualmente, la fijación del conjunto de tubos personalizado al matraz multicapa en el gabinete de bioseguridad y el esterilizado en autoclave de las partes de los componentes no son deseables en un entorno cGMP. Como alternativa, un conjunto de tubos esterilizado gamma personalizado podría subcontratarse a proveedores. Los proveedores que proporcionan matraces multicapa también ofrecen la opción de preajustar los matraces con los conjuntos de tubos deseados, incluido un filtro de 0,2 μm, y la esterilización gamma de todo el equipo. Esto aseguraría que los matraces de varias capas y los tubos conectados estén realmente cerrados, lo que significa que el proceso podría completarse en el banco en un entorno de sala limpia de Clase C.
Este proceso que utiliza el sistema de centrifugación de contraflujo no se limita a células cultivadas basadas en adherentes en un recipiente de múltiples capas y podría adaptarse a plataformas de expansión de celdas dinámicas (biorreactores de tanque agitado o de onda) y estáticas (permeables al gas). Específicamente, para hMSC expandidos en cultivos de microportadores 3D, los protocolos se pueden optimizar en el sistema de centrifugación de contraflujo para cosechar, lavar y formular los hMSC disociados de los microportadores.
En general, el creciente interés en el desarrollo de terapias celulares traslacionales con una mayor robustez y fiabilidad del proceso ha llevado al desarrollo de plataformas de procesamiento celular cerradas y automatizadas. Estos sistemas son imprescindibles, ya que reducen el número de pasos de manipulación, evitan la contaminación potencial por conexiones estériles y reducen los costos de fabricación al reducir la mano de obra y mejorar el uso efectivo del espacio de la sala limpia21. En línea con esto, muchos de los desarrolladores de productos de terapia celular que buscan la aprobación regulatoria para traducir sus terapias son conscientes de la importancia de cerrar el proceso e implementar la automatización completa o semiautomatización ya en la etapa de desarrollo del proceso 14,31,32.
Con el uso de un medio SFM XF respetuoso con la regulación, y junto con reactivos auxiliares que cumplen con 21 CFR GMP Parte 11 y las pautas internacionales de calidad, este proceso semiautomatizado sería fácilmente adecuado para la fabricación clínica. Hemos demostrado la reproducibilidad del proceso cerrado y el mantenimiento de la calidad de los WJ-MSC. Mejorar la eficiencia y la seguridad del cultivo de células basadas en adherentes en matraces multicapa beneficiaría no solo al campo de la terapia hMSC, sino también a las empresas en bancos de líneas celulares y producción de virus adherentes.
Divulgaciones
P.J., A.B., R.L. y J.N. son empleados de Thermo Fisher Scientific. A.L. y S.O. no tienen conflictos de intereses.
Agradecimientos
Los autores desean agradecer el apoyo de la financiación del Fondo de Alineación de la Industria (IAF-PP) (H18/01/a0/021 y H18/AH/a0/001) de A*STAR, Singapur.
Materiales
| Name | Company | Catalog Number | Comments |
| 2L PVC transfer bag | TerumoBCT | BB*B200TM | |
| Alcian blue solution, pH 2.5 | Merck | 101647 | |
| Alizarin-Red Staining Solution | Merck | TMS-008-C | |
| APC anti-human CD73 Antibody | Biolegend | 344015 | |
| APC Mouse IgG1, κ Isotype Ctrl (FC) Antibody | Biolegend | 400121 | |
| Bio-Plex MAGPIX Multiplex Reader | Bio-Rad | ||
| Counterflow Centrifugation System | Thermo Fisher Scientific | A47679 | Gibco CTS Rotea Counterflow Centrifugation System |
| Crystal Violet | Sigma-aldrich | C0775 | |
| CTS (L-alanyl-L-glutamine) GlutaMAX supplement | Thermo Fisher Scientific | A1286001 | |
| CTS Dulbecco's phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | A1285601 | no calcium, no magnesium |
| CTS Recombinant Human Vitronectin (VTN-N) | Thermo Fisher Scientific | A27940 | |
| CTS TrypLE Select Enzyme | Thermo Fisher Scientific | A1285901 | |
| Custom tubing assembly | Saint-Gobain and Colder Product Company (CPC) | N/A | Gamma-sterilized 3/32” ID PVC line fitted with a sterile male MPC (1/8” barb) and sealed on the other end. Autoclave a short C-Flex line fitted with a sterile Cell Factory port connector on one end and a female MPC (3/8” barb) on the other. Connect the PVC and C-Flex lines in a biosafety cabinet |
| Emflon II capsule (0.2um filter) | Pall | KM5V002P2G100 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | 12662029 | Mesenchymal stem cell-qualified, USDA-approved regions |
| FGF-basic | Thermo Fisher Scientific | PHG0024 | |
| FITC anti-human CD105 Antibody | Biolegend | 323203 | |
| FITC anti-human CD45 Antibody | Biolegend | 304005 | |
| FITC anti-human CD90 (Thy1) Antibody | Biolegend | 328107 | |
| FITC Mouse IgG1, κ Isotype Ctrl (FC) Antibody | Biolegend | 400109 | |
| Hi-Flow Single Use Kit | Thermo Fisher Scientific | A46575 | Gibco CTS Rotea Hi-flow single-use kit, flow rate of 30 – 165 mL/min |
| Multi-layered systems | Thermo Fisher Scientific | 140360 (4-layers); 140410 (10-layers) | Nunc Standard Cell Factory Systems |
| NucleoCounter NC-3000 | Chemometec | NC-3000 | |
| Oil red O staining solution | Merck | 102419 | |
| PDGF-BB | Thermo Fisher Scientific | PHG0045 | |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | |
| PerCP anti-human CD34 Antibody | Biolegend | 343519 | |
| PerCP Mouse IgG1, κ Isotype Ctrl Antibody | Biolegend | 400147 | |
| ProcartaPlex Multiplex Immunoassays | Thermo Fisher Scientific | Custom 19-Plex panel: FGF-2, HGF, IDO, IL-10, IL-1RA, IL-6, IL-8, IP-10, MCP-1, MCP-2 , MIP-1α, MIP-1β, MIP-3α, PDGF-BB, RANTES, SDF-1α, TGFα, TNF-alpha, VEGF-A | |
| Sample port | Thermo Fisher Scientific | A50111 | Gamma-sterilized leur sample port with 2 PVC lines attached |
| StemPro Adipogenesis Differentiation Kit | Thermo Fisher Scientific | A10070-01 | |
| StemPro Chondrocyte Differentiation | Thermo Fisher Scientific | A10071-01 | |
| StemPro Custom MSC SF XF Medium Kit (SFM XF medium) | Thermo Fisher Scientific | ME20236L1 | Contains StemPro MSC SFM Basal Medium and Custom MSC SF XF Supplement (100x) |
| StemPro Osteogenesis Differentiation Kit | Thermo Fisher Scientific | A10072-01 | |
| T175 Nunc EasYFlask | Thermo Fisher Scientific | 159910 | |
| T75 Nunc EasYFlask | Thermo Fisher Scientific | 156472 | |
| TGFβ1 | Thermo Fisher Scientific | PHG9204 | |
| WJ MSCs | PromoCell | (#C12971; Germany) | Human mesenchymal stem cells |
| αMEM media | Thermo Fisher Scientific | 12571063 | With nucleosides |
Referencias
- Zhou, T., et al. Challenges and advances in clinical applications of mesenchymal stromal cells. Journal of Hematology & Oncology. 14 (1), 24 (2021).
- García-Bernal, D., et al. The current status of mesenchymal stromal cells: Controversies, unresolved issues and some promising solutions to improve their therapeutic efficacy. Frontiers in Cell and Developmental Biology. 9, 650664 (2021).
- Mastrolia, I., et al. Challenges in clinical development of mesenchymal stromal/stem cells: Concise review. Stem Cells Translational Medicine. 8 (11), 1135-1148 (2019).
- Jovic, D., et al. A brief overview of global trends in MSC-based cell therapy. Stem Cell Reviews and Reports. 18 (5), 1525-1545 (2022).
- Lechanteur, C., Briquet, A., Bettonville, V., Baudoux, E., Beguin, Y. MSC manufacturing for academic clinical trials: From a clinical-grade to a full GMP-compliant process. Cells. 10, 1320 (2021).
- Fernández-Santos, M. E., et al. Optimization of mesenchymal stromal cell (MSC) manufacturing processes for a better therapeutic outcome. Frontiers in Immunology. 13, 918565 (2022).
- Jossen, V., vanden Bos, C., Eibl, R., Eibl, D. Manufacturing human mesenchymal stem cells at clinical scale: Process and regulatory challenges. Applied Microbiology and Biotechnology. 102 (9), 3981-3994 (2018).
- Jayaraman, P., Lim, R., Ng, J., Vemuri, M. C. Acceleration of translational mesenchymal stromal cell therapy through consistent quality GMP manufacturing. Frontiers in Cell and Developmental Biology. 9, 648472 (2021).
- Levy, O., et al. Shattering barriers toward clinically meaningful MSC therapies. Science Advances. 6 (30), (2020).
- Fričová, D., Korchak, J. A., Zubair, A. C. Challenges and translational considerations of mesenchymal stem/stromal cell therapy for Parkinson's disease. npj Regenerative Medicine. 5 (1), 20 (2020).
- Childs, P. G., Reid, S., Salmeron-Sanchez, M., Dalby, M. J. Hurdles to uptake of mesenchymal stem cells and their progenitors in therapeutic products. Biochemical Journal. 477 (17), 3349-3366 (2020).
- James, D. How short-term gain can lead to long-term pain. Cell & Gene Therapy Insights. 3 (4), 271-284 (2017).
- Ochs, J., Barry, F., Schmitt, R., Murphy, M. Advances in automation for the production of clinical-grade mesenchymal stromal cells: The AUTOSTEM robotic platform. Cell & Gene Therapy Insights. 3 (8), 739-748 (2017).
- Doulgkeroglou, M. N., et al. Automation, monitoring, and standardization of cell product manufacturing. Frontiers in Bioengineering and Biotechnology. 8, 811 (2020).
- Chen, A. K. -. L., Reuveny, S., Oh, S. K. W. Application of human mesenchymal and pluripotent stem cell microcarrier cultures in cellular therapy: Achievements and future direction. Biotechnology Advances. 31 (7), 1032-1046 (2013).
- Couto, P. S., Bersenev, A., Rafiq, Q. A., Fernandes, T. G., Diogo, M. M., Cabral, J. M. S. . Engineering Strategies for Regenerative Medicine. , 33-71 (2020).
- Tsai, A. -. C., Pacak, C. A. Bioprocessing of human mesenchymal stem cells: From planar culture to microcarrier-based bioreactors. Bioengineering. 8 (7), 96 (2021).
- Cherian, D. S., Bhuvan, T., Meagher, L., Heng, T. S. P. Biological considerations in scaling up therapeutic cell manufacturing. Frontiers in Pharmacology. 11, 654 (2020).
- Mizukami, A., Swiech, K. Mesenchymal stromal cells: From discovery to manufacturing and commercialization. Stem Cells International. 2018, 4083921 (2018).
- Hassan, M., et al. Large-scale expansion of human mesenchymal stem cells. Stem Cells International. 2020, 9529465 (2020).
- Li, A., et al. Advances in automated cell washing and concentration. Cytotherapy. 23 (9), 774-786 (2021).
- Mehta, S. Single-use centrifugation solution for volume reduction and cell washing process in cell therapy manufacturing. Cytotherapy. 16, 101 (2014).
- Giancola, R., Bonfini, T., Iacone, A. Cell therapy: cGMP facilities and manufacturing. Muscles Ligaments and Tendons Journal. 2 (3), 243-247 (2012).
- Moutsatsou, P., Ochs, J., Schmitt, R. H., Hewitt, C. J., Hanga, M. P. Automation in cell and gene therapy manufacturing: From past to future. Biotechnology Letters. 41 (11), 1245-1253 (2019).
- Iancu, E. M., Kandalaft, L. E. Challenges and advantages of cell therapy manufacturing under Good Manufacturing Practices within the hospital setting. Current Opinion in Biotechnology. 65, 233-241 (2020).
- Li, A., James, D., Lim, R. The Gibco™ CTS™ Rotea™ system story-A case study of industry-academia collaboration. Gene Therapy. , (2021).
- Li, A., et al. Improving cell viability using counterflow centrifugal elutriation. Cytotherapy. 24 (6), 650-658 (2022).
- Li, A., et al. Automated counterflow centrifugal system for small-scale cell processing. Journal of Visualized Experiments. (154), e60423 (2019).
- Shah, D., Naciri, M., Clee, P., Al-Rubeai, M. NucleoCounter-An efficient technique for the determination of cell number and viability in animal cell culture processes. Cytotechnology. 51 (1), 39-44 (2006).
- Chan, A. K. C., Heathman, T. R. J., Coopman, K., Hewitt, C. J. Multiparameter flow cytometry for the characterisation of extracellular markers on human mesenchymal stem cells. Biotechnology Letters. 36 (4), 731-741 (2014).
- Smith, D., et al. Towards automated manufacturing for cell therapies. Current Hematologic Malignancy Reports. 14 (4), 278-285 (2019).
- Stroncek, D. F., Somerville, R. P. T., Highfill, S. L. Point-of-care cell therapy manufacturing; it's not for everyone. Journal of Translational Medicine. 20 (1), 34 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados