Method Article
Humane mesenchymale Stammzellprozessierung für klinische Anwendungen in einem geschlossenen, halbautomatischen Workflow
In diesem Artikel
Zusammenfassung
In dieser Arbeit stellen wir ein Protokoll vor, mit dem adhärente Zellen aus mehrschichtigen Kolben in einer geschlossenen, halbautomatischen Weise unter Verwendung eines Gegenstromzentrifugationssystems gewonnen werden können. Dieses Protokoll kann sowohl für die Ernte von adhärenten als auch von Suspensionszellen von anderen Zellexpansionsplattformen mit wenigen Änderungen an den bestehenden Schritten angewendet werden.
Zusammenfassung
Humane mesenchymale Stammzellen (hMSCs) werden derzeit als vielversprechende zellbasierte Therapiemodalität für verschiedene Krankheiten erforscht, wobei in den nächsten Jahren weitere Marktzulassungen für den klinischen Einsatz erwartet werden. Um diesen Übergang zu erleichtern, ist es von entscheidender Bedeutung, die Engpässe in Bezug auf Skalierung, Reproduzierbarkeit von Charge zu Charge, Kosten, Einhaltung gesetzlicher Vorschriften und Qualitätskontrolle zu beheben. Diese Herausforderungen können durch den Abschluss des Prozesses und die Einführung automatisierter Fertigungsplattformen angegangen werden. In dieser Studie haben wir einen geschlossenen und halbautomatischen Prozess für die Weitergabe und Ernte von Wharton's Jelly (WJ)-abgeleiteten hMSCs (WJ-hMSCs) aus mehrschichtigen Kolben mittels Gegenstromzentrifugation entwickelt. Die WJ-hMSCs wurden mit regulatorisch konformem serumfreiem xenofreiem (SFM XF) Medium gezüchtet und zeigten eine vergleichbare Zellproliferation (Populationsverdopplung) und Morphologie wie WJ-hMSCs, die in klassischen serumhaltigen Medien expandierten. Unser geschlossenes halbautomatisches Ernteprotokoll zeigte eine hohe Zellrückgewinnung (~98%) und Viabilität (~99%). Die Zellen, die mittels Gegenstromzentrifugation gewaschen und konzentriert wurden, behielten die WJ-hMSC-Oberflächenmarkerexpression, die koloniebildenden Einheiten (CFU-F), das Differenzierungspotenzial der Trilinien und die Profile der Zytokinsekretion bei. Das in der Studie entwickelte halbautomatische Zellernteprotokoll kann leicht für die Verarbeitung verschiedener Adhärent- und Suspensionszellen im kleinen bis mittleren Maßstab angewendet werden, indem es direkt mit verschiedenen Zellexpansionsplattformen verbunden wird, um Volumenreduzierung, Waschen und Ernten mit einem geringen Ausgangsvolumen durchzuführen.
Einleitung
Humane mesenchymale Stammzellen (hMSCs) sind aufgrund ihres therapeutischen Potenzials und ihres hohen Selbsterneuerungspotenzials für das Wachstum in vitro ein hervorragender Kandidat für klinische Anwendungen, sowohl im Tissue Engineering als auch in Zelltherapien, die für die Erzeugung klinisch relevanter Zelldosen von entscheidender Bedeutung sind 1,2,3. Laut ClinicalTrials.gov werden derzeit über 1.000 klinische Studien für verschiedene Krankheitszustände untersucht4. Vor dem Hintergrund des zunehmenden Interesses an der Verwendung von hMSCs stehen innaher Zukunft weitere klinische Studien und Marktzulassungen bevor 5,6. Die Herstellung von hMSCs birgt jedoch viele inhärente Herausforderungen in Bezug auf die Variabilität von Charge zu Charge, die Verwendung von Rohstoffen mit hohem Risiko, Bedenken hinsichtlich der Kontamination aufgrund vieler offener und manueller Prozesse, da die Herstellung mehrere Einheiten umfasst, höhere Arbeitskosten, die Kosten für die Skalierung oder Skalierung und regulatorische Hürden 6,7,8,9,10, 11,12. Diese Probleme stellen nach wie vor ein erhebliches Hindernis für den derzeitigen und künftigen Marktzugang dar.
Die Entwicklung geschlossener, modularer, automatisierter Fertigungslösungen und die Verwendung risikoarmer Hilfsreagenzien würden diese Herausforderungen angehen. Dies würde auch eine gleichbleibende Produktqualität sicherstellen, die Wahrscheinlichkeit von Chargenausfällen aufgrund menschlicher Fehler verringern, die Arbeitskosten senken und die Prozessstandardisierung und die Einhaltung gesetzlicher Vorschriften verbessern, z. B. in Bezug auf die digitale Chargenaufzeichnung 8,12,13,14. Um eine klinisch relevante Dosierung von Zellen zu erhalten, sei es autologe oder allogene, ist eine optimierte Herstellung entscheidend, die die vorgeschaltete Zellexpansion und die nachgelagerte Verarbeitung in einer geschlossenen, automatisierten Weise umfasst.
Für die vorgelagerte hMSC-Expansion sind die beiden derzeit am häufigsten verwendeten Herstellungsmethoden Scale-out (2D-Monolayer) und Scale-up (3D-Microcarrier-basiertes Aufhängungssystem)15,16,17,18. Die traditionellste und am weitesten verbreitete Methode zur hMSC-Expansion ist die 2D-Monolayer-basierte Kultur aufgrund der niedrigen Produktionskosten und der einfachen Einrichtung19.
Mehrschichtige Kolben, die aus flachen Schalen bestehen, die in einem Kulturgefäß gestapelt sind, werden häufig verwendet, um die hMSC-Produktion zu skalieren. Diese Systeme werden in der Regel in 1- bis 40-lagigen Kulturgefäßen20 geliefert und manuell in Biosicherheitswerkbänken gehandhabt. Die Verarbeitungsschritte während der Zelldurchlässigkeit und -ernte beinhalten die manuelle Abgabe und Dekantierung des Expansionsmediums, des Dissoziationsreagenzes und des Waschpuffers durch Pipettieren oder physisches Kippen des gesamten Gefäßes. Außerdem ist die Handhabung mehrerer Einheiten aufgrund ihrer schieren Größe und ihres Gewichts schwierig und zeitaufwändig.
Anschließend sind die Nachernte aus mehrschichtigen Kolben, die Zentrifugation für den Medienaustausch, die Zellwäsche und die Volumenreduzierung wesentliche Schritte im gesamten Arbeitsablauf bei der Zellherstellung21. Die konventionelle Tischzentrifugation ist ein meist offener und manueller Prozess, der eine Vielzahl von Schritten umfasst, wie z. B. das Umfüllen der Zellsuspension in verschlossene Röhrchen oder Flaschen in einer Biosicherheitswerkbank, das Abdrehen der Zellen, das manuelle Ansaugen des Überstands, die Resuspension der Zellen mit dem Puffer und wiederholte Zellwäschen. Dies erhöht sowohl das Risiko einer Kontamination aufgrund des Öffnens und Schließens der Kappen als auch die Wahrscheinlichkeit, dass das Zellpellet während des manuellen Aspirations-/Pipettiervorgangsverloren geht 22, dramatisch. Im Zusammenhang mit der Handhabung von mehrschichtigen Kultursystemen für adhärente Zellen wie hMSCs müsste der Bediener einen mühsamen Prozess durchlaufen, bei dem er wiederholt zwischen Zentrifuge und Biosicherheitswerkbank pendelt und gleichzeitig eine schwere Einheit handhabt. Diese manuellen Schritte sind mühsam, bergen Risiken in Bezug auf menschliche Fehler und Verunreinigungen und müssen in einer Reinraumumgebung der Klasse B durchgeführt werden, was kostspielig ist23. Darüber hinaus ist der herkömmliche manuelle Zentrifugationsprozess nicht skalierbar und kann zu zellulärer Scherung und Stress führen. Daher sind die Maximierung der Zellrückgewinnung, der Lebensfähigkeit und der Auswascheffizienz von Restverunreinigungen weitere große Herausforderungen22. Die kommerzielle Herstellung von Zelltherapien im cGMP-Maßstab erfordert geschlossene, modulare Automatisierungslösungen, um das Kontaminationsrisiko zu verringern, eine gleichbleibende Produktqualität zu gewährleisten, die Arbeits- und Produktionskosten zu senken und die Prozesssicherheit zu erhöhen24,25. Mehrschichtige Kolben können als geschlossenes System gehandhabt werden, indem ein steriler 0,2-μm-Filter in einem der Anschlüsse vorhanden ist, um den sterilen Gasaustausch zu erleichtern, und ein zweiter Anschluss, der aseptisch über Anschlüsse verbunden oder direkt mit einem automatisierten Zellverarbeitungsgerät für die Zellernte verschweißt ist. Wir arbeiteten daran, die meisten Schritte der WJ-hMSC-Passage und -Ernte abzuschließen und zu automatisieren, indem wir eine innovative geschlossene Gegenstromzentrifuge evaluierten, die für die Herstellung von zell-, gen- oder gewebebasierten Produkten vorgesehen ist. Diese Gegenstromzentrifuge bietet auch die Flexibilität, eine Vielzahl von Zellverarbeitungsanwendungen durchzuführen, wie z. B. die Zelltrennung basierend auf Größe, Medium/Pufferaustausch, Konzentration und Ernte für eine Vielzahl von Zelltypen 8,26,27,28. Das Gerät verwendet ein geschlossenes Einweg-Kit, das steril mit Rohrschweißen oder aseptischen Konnektoren zum Übertragen von Beuteln verbunden oder direkt an eine beliebige Erweiterungsplattform Ihrer Wahl angeschlossen werden kann.
In dieser Studie haben wir eine kundenspezifische Schlauchbaugruppe entwickelt, um geschlossene sterile Verbindungen zwischen dem Einweg-Gegenstrom-Zentrifugationskit und dem mehrschichtigen Kolben zu ermöglichen. Wir haben ein Protokoll optimiert, um WJ-MSCs innerhalb eines einzigen Durchlaufs enzymatisch vollständig geschlossen und halbautomatisch aus dem mehrschichtigen Kolben zu lösen, zu waschen und zu ernten. Die geernteten WJ-hMSCs wurden hinsichtlich Reinheit (Oberflächenmarkeranalyse) und Potenz (KBE-F, Trilineage-Differenzierung und Zytokin-Sekretionsprofile) charakterisiert, um sicherzustellen, dass das Endprodukt die kritischen Qualitätsattribute (CQAs) für die Chargenfreigabe erfüllt.
Protokoll
1. Aufbereitung der Nährmedien und Beschichtung der Nährgefäße
- Medienvorbereitung
- Zusammensetzung des klassischen serumhaltigen Mediums: Bereiten Sie das klassische serumhaltige Medium vor, indem Sie αMEM (445 ml), fötales Kälberserum (FBS) (50 ml) und 100x Penicillin-Streptomycin (5 ml) mischen.
- Bereiten Sie das komplette SFM XF-Medium vor.
- Stellen Sie eine 500-ml-Flasche her, indem Sie aseptisch 5 ml SFM XF-Supplement (100x) und 5 ml 100x L-Alanyl-L-glutamin (siehe Materialtabellen) in das SFM XF-Basalmedium (500 ml) geben.
- Stellen Sie einen 2-Liter-Medienbeutel her, indem Sie aseptisch 20 ml benutzerdefiniertes MSC SFM XF-Supplement (100x) und 20 ml 100x L-Alanyl-L-Glutamin (siehe Materialtabellen) in den SFM XF-Basalmittelbeutel (2 l) geben, indem Sie eine 50-ml-Spritze an den entsprechenden Anschluss des Beutels anschließen.
Anmerkungen: Vor der Verwendung in Kultur werden Wachstumsfaktoren oder Zytokine (nicht im Lieferumfang des Mediums enthalten) zum gesamten SF XF-Medium gegeben: PDGF-BB (20 ng/ml), FGF basic (4 ng/ml) und TGFβ (0,5 ng/ml).
- Beschichtung der Zellkulturgefäße mit Vitronektin zur Verwendung mit serumfreien Medien
- Auftauen eines Vorrats an Vitronektin (VTN-N; 0,9 mg/ml) bei 4 °C.
- Verwenden Sie sterile gepufferte Kochsalzlösung von Dulbecco ohne Calcium und Magnesium (DPBS), um das aufgetaute VTN-N auf eine Arbeitskonzentration von 5 μg/ml zu verdünnen.
Anmerkungen: Verdünnen Sie das VTN-N unmittelbar vor Gebrauch und bewahren Sie die verdünnte Vitronektinlösung nicht auf. - 1 ml/10cm2 der verdünnten VTN-N-Lösung in das entsprechende Kulturgefäß geben; Die Endkonzentration beträgt 0,5 μg/cm2. Geben Sie beispielsweise 7,5 ml verdünnte VTN-N-Lösung in einen T-75-Kolben (75 cm2); 17,5 ml verdünnte VTN-N-Lösung in einen T-175-Kolben (175cm2) geben; 250 ml verdünnte VTN-N-Lösung in einen vierschichtigen Standard-Mehrschichtkolben (2.528cm2) geben; und 630 ml verdünnte VTN-N-Lösung in einen 10-lagigen Mehrschichtkolben (6.320cm2) geben.
- Unter sterilen Bedingungen werden die Gefäße 1 h bei Raumtemperatur (RT) inkubiert.
HINWEIS: Das beschichtete Kulturgefäß kann bis zu 1 Woche bei 4 °C gelagert werden. Wickeln Sie das Kulturgefäß mit Laborfolie ein, um ein Austrocknen zu verhindern. Das Kulturgefäß vor Gebrauch mindestens 1 h auf Raumtemperatur vorwärmen. - Saugen Sie die VTN-N-Lösung an, entsorgen Sie sie und fügen Sie sofort eine ausreichende Menge Nährmedium hinzu, um ein Austrocknen der beschichteten Gefäßoberfläche zu verhindern.
HINWEIS: Es ist nicht notwendig, das Kulturgefäß nach der Entnahme des VTN-N abzuspülen.
2. Erweiterung des WJ-hMSC
- WJ-hMSCs (p2) werden schnell aufgetaut, indem das Kryoöl in ein 37 °C warmes Wasserbad gelegt wird. Schwenken Sie die Durchstechflasche langsam, bis der Inhalt aufzutauen beginnt.
- Nach dem Auftauen werden die WJ-hMSCs mit 5.000 Zellen/cm2 in einen T-175-Kolben (ohne VTN-N-Beschichtung) ausgesät und im klassischen serumhaltigen Medium bei 37 °C in einer befeuchteten Atmosphäre von 5 % CO2 zur Zellexpansion inkubiert. Nach zwei Durchgängen (p4) werden die expandierten Zellen im gewünschten Kryokonservierungsmedium als Arbeitszellbank (WCB) abgelagert.
- Führen Sie die Zellzählung mit einem automatisierten Zellzähler nach der Viabilitäts- und Zellzählmethode durch, um die Gesamtzellzahl, die Zellviabilität und die Zellgröße29 zu bestimmen.
- Ab p4 werden die WJ-hMSCs bei 5.000 Zellen/cm2 in T-75-Kolben entweder in klassischem serumhaltigem Medium oder SFM XF-Medium kultiviert (verwenden Sie VTN-N-beschichtete Kolben mit SFM XF-Medium).
- Bewahren Sie die Zellen in beiden Nährmedien für insgesamt drei Passagen (12 Tage) auf und messen Sie die Zellexpansion (Faltungszunahme) bei jeder Passage, indem Sie die Anzahl der lebensfähigen Zellen, die am Ende der Kultur jeder Passage gezählt werden, durch die Anzahl der lebensfähigen Zellen zu Beginn der Kultur (Tag der Zellaussaat) teilen.
3. Scale-out-Erweiterung des Seed-Zuges
- WJ-hMSC-Expansion in einem T-175-Kolben
- Tauen Sie die WJ-hMSCs bei p4 schnell auf, indem Sie das Kryoial in ein 37 °C warmes Wasserbad legen. Schwenken Sie die Durchstechflasche langsam, bis die Lösung aufzutauen beginnt.
- Samen Sie 5.000 Zellen/cm2 in einen VTN-N-beschichteten T-175-Kolben. Lassen Sie die Zellen in einem Inkubator bei 37 °C mit 5% CO2 wachsen.
- Ersetzen Sie das verbrauchte Nährmedium alle 2-3 Tage durch frisch zubereitetes, vorgewärmtes komplettes SFM XF-Medium, um eine optimale Leistung und ein optimales Zellwachstum zu erzielen.
- Handhabung der mehrschichtigen Kolben (Abbildung 1A, B)
- Alle aseptischen Anschlüsse müssen in einer sterilen Umgebung erfolgen.
- Packen Sie den mehrschichtigen Kolben in einer biologischen Sicherheitswerkbank aus.
- Schließen Sie den vorsterilisierten Luftfilter (0,2 μm) an einen Anschluss an, damit der Druck während des Flüssigkeitstransfers mit der Gegenstromzentrifuge abgelassen werden kann.
- Setzen Sie den mehrschichtigen Kolbenanschluss aus dem kundenspezifischen Schlauchsatz in den anderen Anschluss ein (Abbildung 1B).
- Schweißen Sie die PVC-Leitung des kundenspezifischen Schlauchsatzes an den 2-Liter-PVC-Transferbeutel, der das komplette SFM XF-Medium enthält.
Anmerkungen: Mischen Sie den mittelgroßen Beutel vollständig, bevor Sie ihn durch Schwerkraftströmung in das mehrschichtige System geben. Stellen Sie sicher, dass der PVC-Transferbeutel höher hängt als die mehrlagige Flasche. - Stellen Sie den mehrschichtigen Kolben mit dem Luftfilter nach oben auf die lange Seite (Abbildung 1B).
- Öffnen Sie die Klemme am PVC-Schlauch, um mit dem Befüllen des mehrschichtigen Kolbens zu beginnen. Achten Sie darauf, dass sich das Medium während des Befüllens waagerecht zwischen den Schalen befindet.
- Sobald sich das Medium in allen Schalen vollständig eingenivelliert hat, drehen Sie den mehrlagigen Kolben mit den Anschlüssen nach oben auf die kurze Seite.
- Schließen Sie die Klemme an der PVC-Leitung und entfernen Sie den Transferbeutel, indem Sie die Schlauchverbindung durch die blaue MPC-Verschlusskappe ersetzen.
Anmerkungen: Entfernen Sie nicht den Luftfilter, da dies den Gasaustausch während der Zellenexpansion ermöglicht. - Drehen Sie den mehrschichtigen Kolben in die Inkubationsposition.
Anmerkungen: Der Filter und der Schlauchanschluss sollten nach oben zeigen. - Entleeren Sie den mehrschichtigen Kolben, indem Sie ihn an eine Absaugflasche anschließen. Platzieren Sie es über der Absaugflasche und die Flüssigkeit fließt heraus.
Anmerkungen: Kippen Sie den mehrschichtigen Kolben auf die Seite, um das verbrauchte Medium durch die Schwerkraft vollständig abzulassen. Alternativ kann das verbrauchte Medium mit einer kundenspezifischen Schlauchbaugruppe in eine Abfallflasche gefüllt werden. - Wiederholen Sie die Schritte 3.2.5-3.2.11, um das frische Medium wieder aufzufüllen.
- Subkultur von WJ-hMSCs im Mehrschichtkolben (T-175 > 4-lagig > 10-lagig)
- Vor Gebrauch das Zelldissoziationsreagenz (TrypLE) und das komplette SFM XF-Medium in einem 37 °C-Inkubator vorwärmen.
- Saugen Sie das verbrauchte Medium aus dem T-175-Kolben ab und entsorgen Sie es.
- Waschen Sie die Zellmonoschicht mit vorgewärmtem DPBS, saugen Sie sie an und entsorgen Sie sie.
- Geben Sie TrypLE in jeden Kolben, stellen Sie sicher, dass die Zellmonoschicht vollständig bedeckt ist, und inkubieren Sie es 5-10 Minuten lang bei 37 °C.
- Übertragen Sie die Suspension in ein steriles konisches 50-ml-Röhrchen.
- Zentrifugieren Sie das Röhrchen bei 100-200 x g für 5 min bei RT. Saugen Sie das DPBS an und entsorgen Sie es und achten Sie darauf, das Zellpellet nicht zu stören.
- Resuspendieren Sie das Zellpellet in einem minimalen Volumen (10 ml) des vorwarmen kompletten SFM XF-Mediums für die Zellzählung.
- Füllen Sie ein VTN-N-beschichtetes vierschichtiges Kulturgefäß mit etwa 800 ml vollständigem SFM XF-Medium, wie in Abschnitt 2 oben erwähnt. Fügen Sie 5.000 Zellen/cm2 hinzu (d. h. 1,26 x 107 lebensfähige Zellen/Kolben). Schwenken Sie die Zellsuspension vorsichtig, um eine gleichmäßige Verteilung zu gewährleisten.
- Inkubation in einem 37 °C Inkubator mit 5% CO2 in befeuchteter Atmosphäre.
- Ersetzen Sie das verbrauchte Nährmedium alle 2-3 Tage durch frisches, vorgewärmtes komplettes SFM XF-Medium, um ein optimales Zellwachstum zu erzielen, bis die Zellen eine Konfluenz von 60%-80% erreichen oder bereit sind, in den 10-lagigen Mehrschichtkolben subkultiviert zu werden.
- Füllen Sie einen VTN-N-beschichteten 10-lagigen Mehrschichtkolben mit etwa 2 l vollständigem SFM XF-Medium, wie in Abschnitt 2 erwähnt. Fügen Sie 5.000 Zellen/cm2 hinzu (d. h. 3,1 x 107 Zellen/Kolben). Schwenken Sie die Zellsuspension vorsichtig, um eine gleichmäßige Verteilung zu gewährleisten.
- Inkubation in einem 37 °C Inkubator mit 5% CO2 in befeuchteter Atmosphäre.
- Ersetzen Sie das verbrauchte Nährmedium alle 2-3 Tage durch frisches, vorgewärmtes komplettes SFM XF-Medium für ein optimales Zellwachstum, bis die Zellen eine Konfluenz von 60%-80% erreichen oder erntereif sind.
4. Geschlossene halbautomatische WJ-hMSC-Dissoziation und -Ernte mittels geschlossener Gegenstromzentrifugation
- Baugruppe des Einweg-Gegenstromzentrifugationskits
- Verbinden Sie das Einweg-Kit mit den Einweg-PVC-Transferbeuteln durch Rohrschweißen, ähnlich der in Abbildung 1A gezeigten Konfiguration.
Anmerkungen: Die Standard-Durchflussrate des Einweg-Kits beträgt 30-165 ml/min. - Befestigen Sie einen 10-lagigen, mehrschichtigen Kolben mit konfluenten WJ-hMSCs an der kundenspezifischen Schlauchbaugruppe in einer Biosicherheitswerkbank.
- Übertragen Sie das beigefügte 10-lagige Kulturgefäß mit der kundenspezifischen Schlauchbaugruppe auf eine Werkbank und schweißen Sie es an die Linie E (3/32 in ID PVC) des Einweg-Kits, wie in Abbildung 1B gezeigt.
- Stellen Sie sicher, dass Sie einen sterilen Probenanschluss an die Linie G des High-Flow-Einwegkits schweißen.
- Verbinden Sie als Nächstes die Ernteleitung H mit einem sterilen Luer, der mit einer 50-ml-Spritze ausgestattet ist.
Anmerkungen: Stellen Sie bei allen oben genannten Schritten sicher, dass die manuellen Klemmen geschlossen sind, um die Flüssigkeit in jedem Kit-Beutel zu sichern.
- Verbinden Sie das Einweg-Kit mit den Einweg-PVC-Transferbeuteln durch Rohrschweißen, ähnlich der in Abbildung 1A gezeigten Konfiguration.
- Einrichten des Gerätelaufs
- Schalten Sie das Gerät ein, indem Sie den Kippschalter auf der Rückseite des Geräts einschalten.
- Schließen Sie den Laptop mit dem mitgelieferten USB-C-Kabel an den USB-C-Anschluss des Geräts an (Abbildung 1B).
- Führen Sie die Software für die grafische Benutzeroberfläche (GUI) der Gegenstromzentrifuge über den Desktop oder das Startmenü aus.
- Laden Sie nach der Anmeldung das Protokoll, indem Sie auf der Hauptbegrüßungsseite auf die Schaltfläche Protokoll auswählen klicken.
HINWEIS: Das Ernteprotokoll für die Gegenstromzentrifugation (Tabelle 1) wurde mit der Protocol Builder-Software erstellt und lokal gespeichert. - Drücken Sie die blaue Entriegelungstaste am Instrument und öffnen Sie die Glasklappe.
- Laden Sie das zusammengebaute Einweg-Kit in das Gegenstrom-Zentrifugationssystem.
- Beginnen Sie damit, die Beutel an Aufhängehaken in einer Reihenfolge aufzuhängen, die sie am besten mit den Rohranschlüssen an den Blasensensorstreifen ausrichtet, wobei der 10-lagige mehrschichtige Kolben schräg platziert ist, wie in Abbildung 1B gezeigt.
- Richten Sie das Kit mit den beiden Tasten zum Positionieren des Kits aus, spannen Sie den Pumpenschlauch um die Peristaltikpumpe und drücken Sie den weißen kugelförmigen Stecker fest.
Anmerkungen: Stellen Sie sicher, dass der Schlauch über dem Drucksensor richtig in der Schlauchschiene platziert ist. - Befestigen Sie die Zentrifugenkammer , indem Sie den silbernen Hebel des Gegenstrom-Zentrifugenkammerträgers anheben und sichern, indem Sie den Hebel wieder in seine aufrechte Position bringen.
- Drücken Sie den Schlauch von jedem Anschluss des Kits in die Schienen entlang der Blasensensorstreifen.
Anmerkungen: Stellen Sie sicher, dass sich die Beutel nicht verheddern, damit der Protokollprozess leicht befolgt werden kann. - Schließen Sie die Tür, indem Sie die Türverriegelung nach unten drücken.
Anmerkungen: Der Pumpenklemmarm schließt sich, die Zentrifugenkammer dreht sich und die Ventile schließen. Ohne das Schließen der Tür kann das System das Protokoll nicht initiieren und ausführen. - Klicken Sie auf die Schaltfläche Initiieren in der GUI. Eine Checkliste wird angezeigt. Bei den ersten vier Punkten handelt es sich um Instrumentenkontrollen und bei den letzten beiden Punkten um Benutzerkontrollen (stellen Sie sicher, dass die Taschen und Anschlüsse mit dem Kit-Bild übereinstimmen und stellen Sie sicher, dass die manuellen Klemmen geöffnet sind).
HINWEIS: Bei Instrumentenprüfungen werden rote X anstelle von blauen Häkchen angezeigt, wenn etwas nicht stimmt. - Drücken Sie auf Bestätigen , um den Bildschirm mit den Protokolleingaben anzuzeigen.
- Legen Sie den Wert für die Dateneingabe (Erntevolumen) auf 45 ml fest, und drücken Sie auf Bestätigen.
HINWEIS: Der Protokolleingabebildschirm wird aufgefordert, wenn im vom Benutzer erstellten Protokoll variable Dateneingaben festgelegt sind. Das Erntevolumen wird in diesem Protokoll als Variable festgelegt, und der Benutzer kann wählen, ob er je nach den Anforderungen an die endgültige Zelldichte unterschiedliche Volumina testen möchte. Das minimale Erntevolumen, das das System zulässt, beträgt 5 ml. Das System erlaubt es, für jedes Protokoll maximal vier Datenvariablen einzustellen.
- Ausführen des Protokolls
- Klicken Sie in der GUI auf Initiieren und drücken Sie die grüne Starttaste am Gerät, um den Protokolllauf zu starten (siehe Tabelle 1).
Anmerkungen: Das System leitet die Schritte gemäß dem Protokoll ein, beginnend mit der Ansaugsequenz, indem es die Luft im System durch einen Puffer ersetzt. - Stellen Sie nach Abschluss der Grundierung (Tabelle 1, Schritt 8) sicher, dass das verbrauchte Medium vollständig in den Abfallsack abgepumpt wird.
Anmerkungen: Sobald der 10-lagige mehrschichtige Kolben leer ist, fordert das System den Benutzer in der GUI auf, zu bestätigen, ob das Gefäß leer ist. Drücken Sie die Taste "Überspringen" am Gerät, wenn das Gefäß leer ist. Wenn nicht, drücken Sie die grüne "Play/Pause"-Taste, um alle Restflüssigkeiten aus dem Behälter abzulassen. - Achten Sie bei den Pausenschritten 15, 19 und 22 (Tabelle 1) darauf, den mehrschichtigen Kolben anzuheben und zu schütteln, um den Puffer gleichmäßig auf alle Schalen zu verteilen. Wenn Sie fertig sind, stellen Sie den 10-lagigen mehrschichtigen Kolben für die nächsten Schritte wieder in seine ursprüngliche Ziehposition.
Anmerkungen: Nur für Schritt 19 in Tabelle 1 ist nach dem Schütteln darauf zu achten, den mehrschichtigen Kolben flach zu platzieren und 10-15 Minuten bei RT zu inkubieren, um die Zellen zu dissoziieren. - Stellen Sie in Schritt 20 und Schritt 23 (Tabelle 1) sicher, dass die trypsinisierten Zellen vollständig in den Zwischenbeutel übertragen werden.
- Mischen Sie den Zwischenbeutel in Schritt 25 manuell gut (Tabelle 1).
- Verwenden Sie in Schritt 26 (Tabelle 1) eine 2-ml-Luer-Spritze, um die Probe durch den Probenahmeanschluss zu entnehmen.
HINWEIS: Es wird empfohlen, mindestens dreimal Proben zu nehmen, um eine genaue Zellzahl zu erhalten. - In Schritt 29 und Schritt 30 (Tabelle 1) wird die stabile Ausbildung des Wirbelschichtbetts überprüft; Es sollte ähnlich wie das Wirbelschichtbett sein, wie in Abbildung 1C gezeigt.
HINWEIS: Wenn das stabile Wirbelzellenbett nicht ähnlich wie in Abbildung 1C dargestellt ausgebildet ist, ist die Optimierung des Verhältnisses der g-Kraft zur Durchflussrate (G/F) entscheidend, um ein stabiles Wirbelschichtbett (hohe Zellrückgewinnung) in der Kammer während der Zelllade- und Waschschritte zu erreichen. Das G/F-Verhältnis hängt von der Größe der Zellen und der Dichte des Mediums ab. Ein hohes G/F-Verhältnis ist für einen Proben-/Waschpuffer mit hoher Dichte erforderlich, während ein niedriges G/F-Verhältnis für einen Proben-/Waschpuffer mit geringer Dichte verwendet werden kann. - Der Lauf ist im Schritt "Rampe zum Stopp " (Schritt 35 in Tabelle 1) abgeschlossen, und alle Quetschwerte auf dem Gegenstromzentrifugationssystem schließen sich automatisch.
Anmerkungen: Stellen Sie abschließend sicher, dass die manuellen Klemmen geschlossen sind, um die Flüssigkeit in jedem Kit-Beutel zu sichern, bevor Sie die Tür öffnen. - Drücken Sie nach Abschluss des Protokolllaufs die blaue Entriegelungstaste am Gerät und öffnen Sie die Glasklappe. Nehmen Sie das Einwegset mit dem geernteten Konzentrat aus dem Instrument.
- Versiegeln Sie die Erntelinie aseptisch mit einem Handversiegelungsgerät. Die versiegelte Spritze, die mit der konzentrierten Zellernte gefüllt ist, wird zur Zellzählung und Kryokonservierung vorsichtig in die biologische Sicherheitswerkbank überführt.
- Nehmen Sie die Kammer mit dem Hebel wieder ab, ziehen Sie den Lampenstecker aus seiner Fassung, heben Sie das Kit vorsichtig ab und entsorgen Sie es in einem Biohazard-Beutel.
- Reinigen Sie das Gerät mit Ethanoltüchern und stellen Sie sicher, dass die Tür geschlossen ist.
- Schließen Sie zuerst die GUI-Anwendung, bevor Sie den Schalter auf der Rückseite des Geräts ausschalten.
HINWEIS: Das Zellernteprotokoll wurde in biologischen Triplikaten (n = 3) getestet.
- Klicken Sie in der GUI auf Initiieren und drücken Sie die grüne Starttaste am Gerät, um den Protokolllauf zu starten (siehe Tabelle 1).
5. Bewertung kritischer Qualitätsattribute (CQA)
- Oberflächenmarker für Zellidentität (CD73, CD90 und CD105) und nicht-stromale Marker (CD34 und CD45)
- Die gewonnene WJ-hMSC-Zellsuspension wird auf eine Konzentration von 1 x 106 lebensfähigen Zellen/ml verdünnt, indem ein geeignetes Volumen an Durchflusszytometriepuffer (DPBS mit 1 % BSA oder 2 % FBS) hinzugefügt wird.
- Geben Sie 100 μl der Zellsuspension in jedes Mikrozentrifugenröhrchen oder jede 96-Well-Platte. Stellen Sie sicher, dass mindestens 0,1 x 106 Zellen pro 100 μl Zellsuspension vorhanden sind.
- Fügen Sie der Probe Fluorophor-konjugierte Antikörper in einer geeigneten Verdünnung hinzu, wie vom Antikörperhersteller empfohlen.
- 20 min im Dunkeln inkubieren.
- Nach der Inkubation werden 100 μl Durchflusszytometrie-Puffer hinzugefügt, um die Proben durch Zentrifugation bei 380 x g für 3 min zu waschen.
- Entsorgen Sie den Überstand und lassen Sie das Pellet zurück.
- Das Zellpellet wird in 200 μl Durchflusszytometriepuffer resuspendiert und einer durchflusszytometrischen Analyseunterzogen 30.
- Fibroblastischer Assay für koloniebildende Einheiten (KBE-F)
- Verdünnen Sie die Zellsuspension auf eine Konzentration von 1.000 lebensfähigen Zellen/ml des vollständigen Nährmediums.
- Platte ~500 Zellen pro Well in einer 6-Well-Gewebekulturplatte in komplettem Nährmedium.
- 10-14 Tage bei 37 °C in 5 % befeuchtetem CO2 inkubieren, mit PBS waschen und mit 0,5 % Kristallviolett in Methanol 30 min bei RT färben.
- Zählen Sie die Kolonien in jedem Brunnen auf.
- Berechnen Sie die CFU-F-Effizienz: Teilen Sie die Anzahl der gebildeten Kolonien durch die ursprüngliche Saatzahl, um die prozentuale Effizienz der Koloniebildung zu erhalten, und drücken Sie sie als Prozentsatz aus.
- Differenzierungspotenzial der Trilinien
- 5 x 103 Zellen/cm2 in Osteogenese- und Adipogenese-Differenzierungsmedium in12-Well-Platten gemäß dem Protokoll des Herstellers aussampen. Bereiten Sie für die Chondrogenese 1,6 x 107 lebensfähige Zellen/ml vor und erzeugen Sie Mikromassenkulturen, indem Sie 5 μl Tröpfchen der Zelllösung in die Zentren der Vertiefungen von 96-Well-Platten aussäen, wie es das Protokoll des Herstellers vorsieht.
- Nehmen Sie während der Differenzierung alle 3-4 Tage einen vollständigen Medienwechsel vor.
- Überwachen Sie die Kulturen nach 14 Tagen (für Adipogenese) oder 21 Tagen (für Osteogenese und Chondrogenese) auf Differenzierung, indem Sie linienspezifische biologische Färbungen gemäß dem Protokoll des Herstellers verwenden. Zur adipogenen Differenzierung werden die Kulturen mit 0,5%iger Ölrot-O-Lösung eingefärbt. Für die Osteogenese führen Sie eine Färbung mit einer 2%igen Alizarin-Rot-S-Lösung durch. Zur chondrogenen Differenzierung werden die Mikromassepellets mit 1% Alcianblau eingefärbt.
- Profile der Zytokinsekretion
- Tauen Sie die kryokonservierten Zellen, die manuell oder mit dem Gegenstromzentrifugationssystem geerntet wurden, auf und säen Sie 5.000 Zellen/cm2 in einen T-175-Kolben mit SFM XF-Medien.
- Sammeln Sie nach 4 Tagen das verbrauchte Nährmedium und lagern Sie es bis zur Analyse bei −80 °C.
- Quantifizieren Sie die Expression von Zytokinen mit einem 19-Plex-Panel-Kit für die Zytokinexpression auf einem Multiplex-Lesegerät.
- Führen Sie die Multiplex-Immunoassays gemäß den Empfehlungen des Herstellers durch.
Ergebnisse
Die WJ-hMSC-Masterzellbank (MCB) nach dem Auftauen wurde für drei aufeinanderfolgende Passagen (p1-p4) in klassischem serumhaltigem Medium beibehalten, um genügend funktionierende Zellbanken (WCBs) für die Experimente zu produzieren. Die p4-WCBs wurden sowohl in serumhaltigem Medium als auch in SFM XF-Medium für drei weitere Passagen (p4-p7) in T-175-Kolben aufgetaut und expandiert. Die WJ-MSCs passten sich gut an, wenn sie in SFM XF-Medium expandiert wurden, und waren in der Lage, eine stabile Proliferation ähnlich der in serumhaltigem Medium aufrechtzuerhalten (Abbildung 2A). Die in SFM XF-Medium expandierten Zellen wiesen jedoch eine etwas längere fibroblastenartige spindelförmige Morphologie auf, was zu einer etwas größeren Zellgröße (Abbildung 2B) von durchschnittlich ~17 μm im Vergleich zu ~15 μm in serumhaltigem Medium führte. Unter beiden Mediumbedingungen erreichten die WJ-hMSCs über die drei Passagen hinweg durchweg ihre maximale Zelldichte von ~2,3 x 104 Zellen/cm2 und eine Populationsverdopplungszeit von ~34 h (Abbildung 2C,D).
Für die großflächige WJ-hMSC-Expansion in einem geschlossenen System führten wir eine Seed-Train-Expansion von WJ-hMSCs zunächst in einem 4-Schicht-Kolben und anschließend in einem 10-Schicht-Mehrschichtkolben durch. Bei einer Konfluenz von etwa 80%-90% nach 4 Tagen Kultur ernteten wir 9,6 x 10 7 ± 0,9 x 107 und 2,3 x 10 8 ± 0,2 x 108 Zellen für die 4-Schicht- bzw. 10-Schicht-Stapel. Im Vergleich zu den T-175-Kolben wurde eine höhere Zelldichte von 3,6 x 10 4-3,8 x 104 Zellen/cm2 erreicht, was bedeutet, dass die Stacks eine bis zu siebenfache bessere Zellexpansion ermöglichten.
Des Weiteren wurden die in 10-Schicht-Kulturgefäßen expandierten WJ-hMSCs direkt mittels Gegenstromzentrifugation geerntet. Die sterile Verbindung zum Einweg-Kit war einfach herzustellen, um mit der Peristaltikpumpe des Instruments einen direkten Flüssigkeitstransfer bei einer maximalen Durchflussrate von 165 ml/min zu ermöglichen. Der halbautomatische Zellernteprozess wurde erreicht, indem die Zellen zunächst durch enzymatische Dissoziation geerntet, die Zellen zur Volumenreduktion und -konzentration in die Gegenstromkammer geladen und anschließend mit Waschpuffer gewaschen wurden, der etwa das 3-fache des Volumens der Gegenstromzentrifugationskammer betrug. Darüber hinaus wurden die gewaschenen Zellen dann konzentriert und auf das gewünschte Erntevolumen geerntet, das im Protokoll voreingestellt war. Die Verarbeitungsschritte, die für die halbautomatische Zellverarbeitung verwendet werden, wurden so konzipiert, dass sie den manuellen Harvesting-Workflow nachahmen. Wir erreichten eine 10-fache Volumenreduktion, was zur Erzeugung von Zellkonzentrationen von bis zu 5,3 Millionen Zellen/ml führte. Das Protokoll war in der Lage, eine hohe Zellrückgewinnung von ~98 % und eine hohe Zellviabilität von ~99 % konsistent für alle drei unabhängigen Durchläufe zu erzielen (Abbildung 3A-C).
Wir führten umfangreiche Zellcharakterisierungsassays durch, um die kritischen Qualitätsmerkmale der Zellernte mittels Gegenstromzentrifugation im Vergleich zur manuellen Zentrifugation zu bestimmen. Um die Identität der WJ-hMSCs zu testen, wurden Zelloberflächenmarker mittels Durchflusszytometrie analysiert. Wie in Abbildung 4A dargestellt, zeigten die WJ-hMSCs, die mit beiden Methoden geerntet wurden, charakteristische Oberflächenmarkerprofile gemäß den ISCT-Vorschriften, eine positive Expression von CD73, CD90 und CD105 sowie eine negative Expression von CD34 und CD45. Um das klonogene Potential der WJ-hMSCs zu evaluieren, wurden anschließend CFU-F-Assays durchgeführt. Wie in Abbildung 4B dargestellt, zeigten Zellen, die aus Gegenstromzentrifugation gewonnen wurden, ein ähnliches KBE-F-Potenzial im Vergleich zu Zellen, die durch manuelle Zentrifugation gewonnen wurden (21 % ± 1 % bzw. 20 % ± 1 %). Darüber hinaus behielten die nach der Gegenstromzentrifugation gewonnenen Zellen, wie in Abbildung 4C gezeigt, die Fähigkeit, sich ähnlich wie die Zellen in der manuellen Zentrifugationsmethode in Adipozyten, Osteoblasten und Chondrozyten zu differenzieren. Schließlich untersuchten wir 18 verschiedene Zytokinsekretionsprofile der Zellen mit Hilfe von Multiplex-Immunoassays. Wie in Abbildung 4D gezeigt, behielten die Zellen, die mit der Post-Gegenstrom-Zentrifugation gewaschen und konzentriert wurden, die Zytokinsekretionsprofile bei, und die Profile waren vergleichbar mit denen der Probe, die vor dem Waschen/Konzentrieren der Zellen entnommen wurde (Prä-Gegenstrom-Zentrifugation).
Insgesamt haben wir eine effiziente hMSC-Expansion in einem SFM XF-Kultursystem nachgewiesen, und die Zellen, die mit dem geschlossenen, automatisierten Gegenstrom-Zentrifugationssystem gewaschen und konzentriert wurden, ergaben eine hohe Zellausbeute und Viabilität nach der Wäsche und konnten ihren Phänotyp und ihre Funktionalität beibehalten. Der geschlossene halbautomatische Prozess, der in dieser Studie entwickelt wurde, kann eine konsistente Produktqualität in Bezug auf die endgültige WJ-MSC-Rückgewinnung liefern, wie aus drei unabhängigen Durchläufen hervorgeht.

Abbildung 1: Konfiguration und Montage von High-Flow-Einweg-Kits für die Ernte, das Waschen und die Konzentrierung von hMSCs. (A) Kit-Diagramm nach dem Anschließen der Beutel in einer Linie mit dem jeweiligen Schlauch. (B) Der 10-lagige mehrschichtige Kolben, der mit dem High-Flow-Einweg-Kit mit der kundenspezifischen Schlauchbaugruppe verbunden ist. (C) Visualisierung des stabilen Wirbelzellenbettes, das in der Gegenstromkammer gebildet wird, über die Kamerafunktion, die in der grafischen Benutzeroberfläche der Gegenstromzentrifugationssoftware aktiviert ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Vergleich der Zellmorphologie und Expansion von hMSCs in serumhaltigem Medium und SFM XF-Medium. (A) Die repräsentative Zellmorphologie von hMSCs im klassischen Serummedium und SFM XF-Medium. Die SFM XF-expandierten Zellen zeigten eine längere, spindelförmige, charakteristische fibroblastenartige Morphologie, während die Zellen, die in serumhaltigem Medium gezüchtet wurden, eine abgeflachtere Morphologie aufwiesen. (B) Die durchschnittliche MSC-Größe zwischen dem serumhaltigen Medium und dem SFM XF-Medium, gemessen mit einem automatisierten Zellzähler (n = 3). Es ist deutlich zu erkennen, dass die SFM XF-expandierten Zellen in verschiedenen Passagen im Allgemeinen größer waren als die serumexpandierten Zellen. Die Gesamtzellausbeute in verschiedenen Passagen (n= 3) (C) in Zellen pro Kulturfläche und (D) Populationsverdopplungsniveaus. Ähnliche Niveaus der Zellausbeute wurden zwischen dem SFM XF-Medium und dem serumhaltigen Medium über verschiedene Passagen hinweg erzielt. Die Daten werden als Mittelwert ± Standardabweichung ausgedrückt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
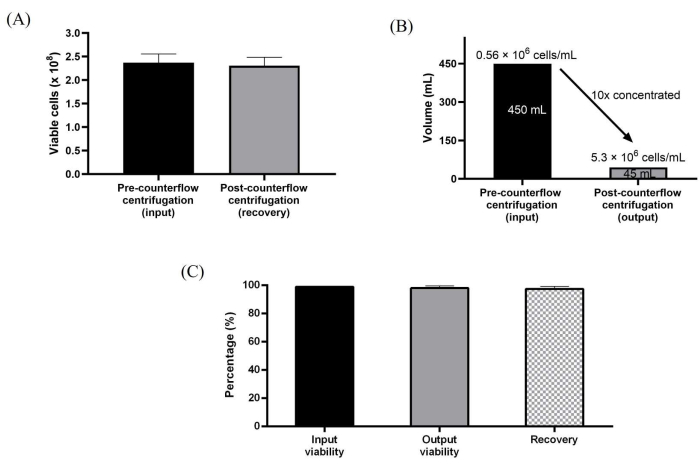
Abbildung 3: Charakterisierung von Zellen, die mit dem Gegenstromzentrifugationssystem verarbeitet wurden . (A) Gesamtzahl der lebensfähigen Zellen vor und nach dem Waschen und Konzentrieren. (B) Eine 10-fache Volumenreduktion wurde nach der Zentrifugationsverarbeitung im Gegenstrom erreicht. (C) Vollständige Erholung und Lebensfähigkeit der Zellen. Die Daten werden über drei biologische Replikate (n = 3) von Wasch- und Konzentrationsläufen gemittelt. Die Daten werden als Mittelwert ± Standardabweichung ausgedrückt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4: Analyse kritischer Qualitätsmerkmale . (A) Repräsentative Daten aus der Durchflusszytometrie. (B) Repräsentative Bilder, die die gesamte KBE zeigen. (C) Repräsentative mikroskopische Aufnahmen der Triliniendifferenzierung. (D) Ergebnisse der Zytokinexpressionsanalyse vor und nach der Prozessierung der Zellen auf dem Gegenstromzentrifugationssystem (n = 3). Die Daten werden als Mittelwert ± Standardabweichung ausgedrückt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Tabelle 1: Ablauf der hMSC-Ernte durch Trypsinisierung, Waschen und Konzentrationsprotokoll auf dem Gegenstromzentrifugationssystem, einschließlich der ersten Priming-Schritte. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
In dieser Arbeit haben wir gezeigt, dass wir in der Lage sind, die hMSC-Dissoziation zu schließen und halb zu automatisieren und auf dem Labor mit einem Gegenstrom-Zentrifugationsgerät zu waschen und zu ernten. Einer der entscheidenden Schritte im gesamten Arbeitsablauf besteht darin, sicherzustellen, dass die Schläuche gemäß dem voreingestellten Protokoll angeschlossen werden, das im Protokollgenerator des Gegenstromzentrifugationssystems definiert ist. Die Einrichtung und der Betrieb sind einfach, und die Zeit, die benötigt wurde, um etwa 2 l Kultur aus einem 10-Schicht-Kolben von der Kit-Montage bis zur Zellernte zu verarbeiten, betrug etwa 60 Minuten. Einer der einschränkenden Schritte in diesem Arbeitsablauf ist der Flüssigkeitstransfer vom mehrschichtigen Kolben zu den Transferbeuteln, die mit dem Gegenstromzentrifugationsgerät verbunden sind. Das High-Flow-Single-Use-Kit kann nur mit einer maximalen Durchflussrate von 165 ml/min betrieben werden, was beispielsweise für die Verarbeitung eines 40-Schicht-Kolbens eine Herausforderung darstellen kann. Um den Prozess des Flüssigkeitstransfers zu beschleunigen, können externe Pumpen mit hoher Durchflussrate verwendet werden, um den trypsinisierten Inhalt zuerst in einen Transferbeutel zu füllen, gefolgt vom Waschen/Konzentrieren und Ernten der Zellen aus dem Transferbeutel mit dem Gegenstrom-Zentrifugationssystem. Darüber hinaus kann dieses Protokoll auch für die Durchleitung von Zellen von 4-lagigen auf 10-lagige mehrschichtige Kolben angewendet werden. Weiter stromaufwärts könnte das Gegenstrom-Zentrifugationssystem auch für das Waschen von aufgetauten hMSCs und die direkte Ernte- und Mediumformulierung in mehrschichtige Kolben optimiert werden, um den Saatzug zu starten. Es ist zu beachten, dass die Mindestanzahl von Zellen, die zur Bildung der Wirbelschicht in der Gegenstrom-Zentrifugationskammer erforderlich sind, etwa 30 Millionen Zellen beträgt und das maximal empfohlene Verarbeitungsvolumen pro Charge 20 l beträgt.
Derzeit ist die Befestigung der kundenspezifischen Schlauchbaugruppe am mehrschichtigen Kolben in der Biosicherheitswerkbank und das Autoklavieren der Teile der Komponenten in einer cGMP-Umgebung nicht wünschenswert. Als Alternative könnte eine kundenspezifische gammasterilisierte Schlauchbaugruppe an Lieferanten ausgelagert werden. Anbieter, die mehrschichtige Kolben anbieten, bieten auch die Möglichkeit, die Kolben mit den gewünschten Schlauchbaugruppen einschließlich eines 0,2-μm-Filters und der Gamma-Sterilisation des gesamten Outfits vorzurüsten. Dies würde sicherstellen, dass die mehrschichtigen Kolben und die daran befestigten Schläuche wirklich geschlossen sind, was bedeutet, dass der Prozess auf dem Prüfstand in einer Reinraumumgebung der Klasse C abgeschlossen werden kann.
Dieses Verfahren unter Verwendung des Gegenstromzentrifugationssystems ist nicht auf adhärente kultivierte Zellen in einem mehrschichtigen Gefäß beschränkt und könnte an dynamische (Rührkessel- oder Wellenbioreaktoren) und statische (gasdurchlässige) Zellexpansionsplattformen auf Suspensionsbasis angepasst werden. Insbesondere für hMSCs, die in 3D-Mikroträgerkulturen expandiert wurden, können Protokolle auf dem Gegenstromzentrifugationssystem optimiert werden, um die von den Mikroträgern dissoziierten hMSCs zu ernten, zu waschen und zu formulieren.
Insgesamt hat das zunehmende Interesse an der Entwicklung translationaler zellulärer Therapien mit verbesserter Prozessrobustheit und -zuverlässigkeit zur Entwicklung geschlossener, automatisierter Zellverarbeitungsplattformen geführt. Diese Systeme sind zwingend erforderlich, da sie die Anzahl der Handhabungsschritte reduzieren, eine mögliche Kontamination durch sterile Verbindungen verhindern und die Herstellungskosten senken, indem sie den Arbeitsaufwand reduzieren und die effektive Nutzung des Reinraumraums21 verbessern. Dementsprechend sind sich viele der Entwickler von Zelltherapieprodukten, die eine behördliche Genehmigung für die Umsetzung ihrer Therapien beantragen, bewusst, wie wichtig es ist, den Prozess abzuschließen und bereits in der Phase der Prozessentwicklung eine vollständige Automatisierung oder Halbautomatisierung zu implementieren 14,31,32.
Mit der Verwendung von regulatorisch freundlichem SFM XF-Medium und zusammen mit zusätzlichen Reagenzien, die mit 21 CFR GMP Part 11 und internationalen Qualitätsrichtlinien konform sind, wäre dieser halbautomatische Prozess problemlos für die klinische Herstellung geeignet. Wir haben die Reproduzierbarkeit des geschlossenen Prozesses und die Aufrechterhaltung der Qualität der WJ-MSCs gezeigt. Die Verbesserung der Effizienz und Sicherheit der Kultivierung adhärenter Zellen in mehrschichtigen Kolben würde nicht nur dem hMSC-Therapiefeld, sondern auch Unternehmen in der Zelllinienbankierung und der Produktion adhärenter Viren zugute kommen.
Offenlegungen
P.J., A.B., R.L. und J.N. sind Mitarbeiter von Thermo Fisher Scientific. A.L. und S.O. haben keine Interessenkonflikte.
Danksagungen
Die Autoren bedanken sich für die Unterstützung durch die Finanzierung des Industry Alignment Fund Pre-Positioning (IAF-PP) (H18/01/a0/021 und H18/AH/a0/001) von A*STAR, Singapur.
Materialien
| Name | Company | Catalog Number | Comments |
| 2L PVC transfer bag | TerumoBCT | BB*B200TM | |
| Alcian blue solution, pH 2.5 | Merck | 101647 | |
| Alizarin-Red Staining Solution | Merck | TMS-008-C | |
| APC anti-human CD73 Antibody | Biolegend | 344015 | |
| APC Mouse IgG1, κ Isotype Ctrl (FC) Antibody | Biolegend | 400121 | |
| Bio-Plex MAGPIX Multiplex Reader | Bio-Rad | ||
| Counterflow Centrifugation System | Thermo Fisher Scientific | A47679 | Gibco CTS Rotea Counterflow Centrifugation System |
| Crystal Violet | Sigma-aldrich | C0775 | |
| CTS (L-alanyl-L-glutamine) GlutaMAX supplement | Thermo Fisher Scientific | A1286001 | |
| CTS Dulbecco's phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | A1285601 | no calcium, no magnesium |
| CTS Recombinant Human Vitronectin (VTN-N) | Thermo Fisher Scientific | A27940 | |
| CTS TrypLE Select Enzyme | Thermo Fisher Scientific | A1285901 | |
| Custom tubing assembly | Saint-Gobain and Colder Product Company (CPC) | N/A | Gamma-sterilized 3/32” ID PVC line fitted with a sterile male MPC (1/8” barb) and sealed on the other end. Autoclave a short C-Flex line fitted with a sterile Cell Factory port connector on one end and a female MPC (3/8” barb) on the other. Connect the PVC and C-Flex lines in a biosafety cabinet |
| Emflon II capsule (0.2um filter) | Pall | KM5V002P2G100 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | 12662029 | Mesenchymal stem cell-qualified, USDA-approved regions |
| FGF-basic | Thermo Fisher Scientific | PHG0024 | |
| FITC anti-human CD105 Antibody | Biolegend | 323203 | |
| FITC anti-human CD45 Antibody | Biolegend | 304005 | |
| FITC anti-human CD90 (Thy1) Antibody | Biolegend | 328107 | |
| FITC Mouse IgG1, κ Isotype Ctrl (FC) Antibody | Biolegend | 400109 | |
| Hi-Flow Single Use Kit | Thermo Fisher Scientific | A46575 | Gibco CTS Rotea Hi-flow single-use kit, flow rate of 30 – 165 mL/min |
| Multi-layered systems | Thermo Fisher Scientific | 140360 (4-layers); 140410 (10-layers) | Nunc Standard Cell Factory Systems |
| NucleoCounter NC-3000 | Chemometec | NC-3000 | |
| Oil red O staining solution | Merck | 102419 | |
| PDGF-BB | Thermo Fisher Scientific | PHG0045 | |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | |
| PerCP anti-human CD34 Antibody | Biolegend | 343519 | |
| PerCP Mouse IgG1, κ Isotype Ctrl Antibody | Biolegend | 400147 | |
| ProcartaPlex Multiplex Immunoassays | Thermo Fisher Scientific | Custom 19-Plex panel: FGF-2, HGF, IDO, IL-10, IL-1RA, IL-6, IL-8, IP-10, MCP-1, MCP-2 , MIP-1α, MIP-1β, MIP-3α, PDGF-BB, RANTES, SDF-1α, TGFα, TNF-alpha, VEGF-A | |
| Sample port | Thermo Fisher Scientific | A50111 | Gamma-sterilized leur sample port with 2 PVC lines attached |
| StemPro Adipogenesis Differentiation Kit | Thermo Fisher Scientific | A10070-01 | |
| StemPro Chondrocyte Differentiation | Thermo Fisher Scientific | A10071-01 | |
| StemPro Custom MSC SF XF Medium Kit (SFM XF medium) | Thermo Fisher Scientific | ME20236L1 | Contains StemPro MSC SFM Basal Medium and Custom MSC SF XF Supplement (100x) |
| StemPro Osteogenesis Differentiation Kit | Thermo Fisher Scientific | A10072-01 | |
| T175 Nunc EasYFlask | Thermo Fisher Scientific | 159910 | |
| T75 Nunc EasYFlask | Thermo Fisher Scientific | 156472 | |
| TGFβ1 | Thermo Fisher Scientific | PHG9204 | |
| WJ MSCs | PromoCell | (#C12971; Germany) | Human mesenchymal stem cells |
| αMEM media | Thermo Fisher Scientific | 12571063 | With nucleosides |
Referenzen
- Zhou, T., et al. Challenges and advances in clinical applications of mesenchymal stromal cells. Journal of Hematology & Oncology. 14 (1), 24(2021).
- García-Bernal, D., et al. The current status of mesenchymal stromal cells: Controversies, unresolved issues and some promising solutions to improve their therapeutic efficacy. Frontiers in Cell and Developmental Biology. 9, 650664(2021).
- Mastrolia, I., et al. Challenges in clinical development of mesenchymal stromal/stem cells: Concise review. Stem Cells Translational Medicine. 8 (11), 1135-1148 (2019).
- Jovic, D., et al. A brief overview of global trends in MSC-based cell therapy. Stem Cell Reviews and Reports. 18 (5), 1525-1545 (2022).
- Lechanteur, C., Briquet, A., Bettonville, V., Baudoux, E., Beguin, Y. MSC manufacturing for academic clinical trials: From a clinical-grade to a full GMP-compliant process. Cells. 10, 1320(2021).
- Fernández-Santos, M. E., et al. Optimization of mesenchymal stromal cell (MSC) manufacturing processes for a better therapeutic outcome. Frontiers in Immunology. 13, 918565(2022).
- Jossen, V., vanden Bos, C., Eibl, R., Eibl, D. Manufacturing human mesenchymal stem cells at clinical scale: Process and regulatory challenges. Applied Microbiology and Biotechnology. 102 (9), 3981-3994 (2018).
- Jayaraman, P., Lim, R., Ng, J., Vemuri, M. C. Acceleration of translational mesenchymal stromal cell therapy through consistent quality GMP manufacturing. Frontiers in Cell and Developmental Biology. 9, 648472(2021).
- Levy, O., et al. Shattering barriers toward clinically meaningful MSC therapies. Science Advances. 6 (30), (2020).
- Fričová, D., Korchak, J. A., Zubair, A. C. Challenges and translational considerations of mesenchymal stem/stromal cell therapy for Parkinson's disease. npj Regenerative Medicine. 5 (1), 20(2020).
- Childs, P. G., Reid, S., Salmeron-Sanchez, M., Dalby, M. J. Hurdles to uptake of mesenchymal stem cells and their progenitors in therapeutic products. Biochemical Journal. 477 (17), 3349-3366 (2020).
- James, D. How short-term gain can lead to long-term pain. Cell & Gene Therapy Insights. 3 (4), 271-284 (2017).
- Ochs, J., Barry, F., Schmitt, R., Murphy, M. Advances in automation for the production of clinical-grade mesenchymal stromal cells: The AUTOSTEM robotic platform. Cell & Gene Therapy Insights. 3 (8), 739-748 (2017).
- Doulgkeroglou, M. N., et al. Automation, monitoring, and standardization of cell product manufacturing. Frontiers in Bioengineering and Biotechnology. 8, 811(2020).
- Chen, A. K. -L., Reuveny, S., Oh, S. K. W. Application of human mesenchymal and pluripotent stem cell microcarrier cultures in cellular therapy: Achievements and future direction. Biotechnology Advances. 31 (7), 1032-1046 (2013).
- Couto, P. S., Bersenev, A., Rafiq, Q. A. Engineering Strategies for Regenerative Medicine. Fernandes, T. G., Diogo, M. M., Cabral, J. M. S. , Academic Press. Cambridge, MA. 33-71 (2020).
- Tsai, A. -C., Pacak, C. A. Bioprocessing of human mesenchymal stem cells: From planar culture to microcarrier-based bioreactors. Bioengineering. 8 (7), 96(2021).
- Cherian, D. S., Bhuvan, T., Meagher, L., Heng, T. S. P. Biological considerations in scaling up therapeutic cell manufacturing. Frontiers in Pharmacology. 11, 654(2020).
- Mizukami, A., Swiech, K. Mesenchymal stromal cells: From discovery to manufacturing and commercialization. Stem Cells International. 2018, 4083921(2018).
- Hassan, M., et al. Large-scale expansion of human mesenchymal stem cells. Stem Cells International. 2020, 9529465(2020).
- Li, A., et al. Advances in automated cell washing and concentration. Cytotherapy. 23 (9), 774-786 (2021).
- Mehta, S. Single-use centrifugation solution for volume reduction and cell washing process in cell therapy manufacturing. Cytotherapy. 16, Supplement 101(2014).
- Giancola, R., Bonfini, T., Iacone, A. Cell therapy: cGMP facilities and manufacturing. Muscles Ligaments and Tendons Journal. 2 (3), 243-247 (2012).
- Moutsatsou, P., Ochs, J., Schmitt, R. H., Hewitt, C. J., Hanga, M. P. Automation in cell and gene therapy manufacturing: From past to future. Biotechnology Letters. 41 (11), 1245-1253 (2019).
- Iancu, E. M., Kandalaft, L. E. Challenges and advantages of cell therapy manufacturing under Good Manufacturing Practices within the hospital setting. Current Opinion in Biotechnology. 65, 233-241 (2020).
- Li, A., James, D., Lim, R. The Gibco™ CTS™ Rotea™ system story-A case study of industry-academia collaboration. Gene Therapy. , (2021).
- Li, A., et al. Improving cell viability using counterflow centrifugal elutriation. Cytotherapy. 24 (6), 650-658 (2022).
- Li, A., et al. Automated counterflow centrifugal system for small-scale cell processing. Journal of Visualized Experiments. (154), e60423(2019).
- Shah, D., Naciri, M., Clee, P., Al-Rubeai, M. NucleoCounter-An efficient technique for the determination of cell number and viability in animal cell culture processes. Cytotechnology. 51 (1), 39-44 (2006).
- Chan, A. K. C., Heathman, T. R. J., Coopman, K., Hewitt, C. J. Multiparameter flow cytometry for the characterisation of extracellular markers on human mesenchymal stem cells. Biotechnology Letters. 36 (4), 731-741 (2014).
- Smith, D., et al. Towards automated manufacturing for cell therapies. Current Hematologic Malignancy Reports. 14 (4), 278-285 (2019).
- Stroncek, D. F., Somerville, R. P. T., Highfill, S. L. Point-of-care cell therapy manufacturing; it's not for everyone. Journal of Translational Medicine. 20 (1), 34(2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten