Method Article
クローズド半自動ワークフローを用いた臨床応用のためのヒト間葉系幹細胞処理
要約
ここでは、向流遠心分離システムを使用して、多層フラスコから接着細胞を密閉半自動方式で回収するためのプロトコルを紹介します。このプロトコルは、既存のステップにほとんど変更を加えることなく、他の細胞増殖プラットフォームから接着細胞と浮遊細胞の両方を回収するために適用できます。
要約
ヒト間葉系幹細胞(hMSC)は現在、さまざまな疾患の有望な細胞ベースの治療法として探求されており、今後数年間で臨床使用のためのより多くの市場承認が見込まれています。この移行を促進するには、規模、ロット間の再現性、コスト、規制コンプライアンス、品質管理のボトルネックに対処することが重要です。これらの課題は、プロセスを終了し、自動化された製造プラットフォームを採用することで対処できます。本研究では、ウォートンゼリー(WJ)由来のhMSC(WJ-hMSC)を向流遠心分離を用いて多層フラスコから継代および回収するための閉鎖および半自動プロセスを開発しました。WJ-hMSCは、規制に準拠した無血清ゼノフリー(SFM XF)培地を使用して拡張され、従来の血清含有培地で拡張されたWJ-hMSCと同等の細胞増殖(集団倍増)および形態を示しました。当社のクローズド半自動ハーベスティングプロトコルは、高い細胞回収率(~98%)と生存率(~99%)を示しました。細胞を洗浄し、WJ-hMSC表面マーカー発現、コロニー形成単位(CFU-F)、三系統分化能、およびサイトカイン分泌プロファイルを維持したカウンターフロー遠心分離を用いて濃縮した。本研究で開発された半自動細胞採取プロトコルは、異なる細胞増殖プラットフォームに直接接続して、低出力量で減容、洗浄、および収穫を行うことにより、さまざまな接着細胞および浮遊細胞の小規模から中規模の処理に簡単に適用できます。
概要
ヒト間葉系幹細胞(hMSC)は、臨床的に関連する細胞の投与量を生成するために重要な、治療の可能性とin vitroで増殖する高い自己複製の可能性を考えると、組織工学と細胞治療の両方における臨床応用の優れた候補です1,2,3。ClinicalTrials.gov によると、現在、さまざまな病状について1,000を超える臨床試験が調査中です4。hMSCの使用への関心の高まりを背景に、近い将来、より多くの臨床試験と市場承認が差し迫っています5,6。ただし、hMSCの製造には、バッチ間のばらつき、リスクの高い原材料の使用、製造には複数のユニット操作、人件費の上昇、スケールアウトまたはスケールアップのコスト、および規制上のハードルが含まれるため、多くのオープンおよび手動プロセスによる汚染に関する懸念に関して、多くの固有の課題があります6,7,8,9,10、11,12。これらの問題は、現在および将来の市場アクセスに対する重大な障壁であり続けています。
クローズドでモジュール式の自動化された製造ソリューションを開発し、リスクの低い補助試薬を使用することで、これらの課題に対処できます。これにより、一貫した製品品質が確保され、人為的ミスによるバッチ障害の可能性が減少し、人件費が削減され、デジタルバッチ記録管理などの観点から、プロセスの標準化と規制コンプライアンスが向上します8、12、13、14。臨床的に関連する細胞の投与量を取得できるようにするには、自家または同種異系のいずれであっても、上流の細胞増殖と下流の処理を閉じた自動化された方法で含む合理化された製造が不可欠です。
上流のhMSC拡張では、現在採用されている2つの最も一般的な製造方法は、スケールアウト(2D単層)とスケールアップ(3Dマイクロキャリアベースのサスペンションシステム)です15,16,17,18。hMSC拡張のための最も伝統的で広く採用されている方法は、低い生産コストとセットアップの容易さのために、2D単層ベースの培養です19。
培養容器内に積み重ねられた平らな表面トレイで構成される多層フラスコは、hMSC生産のスケールアウトに一般的に利用されます。これらのシステムは、典型的には、1層〜40層の培養容器20 で提供され、バイオセーフティキャビネット内で手動で取り扱われる。細胞の継代および回収中の処理ステップでは、容器全体をピペッティングまたは物理的に傾けて、増殖培地、解離試薬、および洗浄バッファーを手動で分注およびデカントします。さらに、複数のユニットを扱うことは、そのサイズと重量のために困難で時間がかかります。
続いて、多層フラスコからのポストハーベスト、培地交換のための遠心分離、細胞洗浄、および体積減少は、細胞製造ワークフロー21全体にわたって不可欠なステップである。従来のベンチトップ遠心分離は、バイオセーフティキャビネット内のキャップ付きチューブまたはボトルへの細胞懸濁液の移し替え、細胞のスピンダウン、上清の手動吸引、バッファーによる細胞の再懸濁、細胞洗浄の繰り返しなど、多数のステップを含む、ほとんどオープンで手動のプロセスです。これにより、キャップの開閉による汚染のリスクと、手動吸引/ピペッティングプロセス中にセルペレットを失う可能性の両方が劇的に増加します22。hMSCなどの接着性細胞用の多層培養システムを扱う場合、オペレーターは遠心分離機とバイオセーフティキャビネットの間を繰り返し行き来し、同時に重いユニットを扱うという骨の折れるプロセスを経る必要があります。これらの手動ステップは面倒であり、人為的ミスや汚染の面でリスクをもたらし、コストがかかるクラスBのクリーンルーム環境で実施する必要があります23。さらに、従来の手動遠心分離プロセスはスケーラブルではなく、細胞のせん断やストレスを引き起こす可能性があります。したがって、細胞回収率、生存率、および残留不純物のウォッシュアウト効率を最大化することは、他の主要な課題22である。細胞治療の商用cGMPスケール製造には、汚染のリスクを低減し、一貫した製品品質を確保し、人件費と生産コストを削減し、プロセスの信頼性を高めるために、閉じたモジュール式の自動化ソリューションが必要です24,25。多層フラスコは、滅菌ガス交換を容易にするためにポートの1つに滅菌0.2μmフィルターを備え、2番目のポートをコネクタを介して無菌的に接続するか、細胞収穫用の自動細胞処理装置に直接チューブ溶接することで、クローズドシステムとして取り扱うことができます。私たちは、細胞、遺伝子、または組織ベースの製品の製造を目的とした革新的なクローズドカウンターフロー遠心分離機を評価することにより、WJ-hMSC継代および回収のほとんどのステップの閉鎖と自動化に取り組みました。この向流遠心分離機は、サイズに基づく細胞分離、培地/バッファー交換、濃縮、さまざまな細胞タイプの回収など、さまざまな細胞処理アプリケーションを実行する柔軟性も備えています8、26、27、28。この装置は、チューブ溶接または無菌コネクタを使用して滅菌接続してバッグを移送したり、選択した拡張プラットフォームに直接接続したりできるクローズドシングルユースキットを使用しています。
この研究では、シングルユース向流遠心分離キットと多層フラスコの間の閉じた滅菌接続を可能にするカスタムチューブアセンブリを設計しました。私たちは、WJ-MSCを多層フラスコから酵素的に分離、洗浄、回収するためのプロトコルを最適化しました。採取したWJ-hMSCは、純度(表面マーカー分析)と効力(CFU-F、三系統分化、サイトカイン分泌プロファイル)について特徴付け、最終製品がロット放出の重要な品質属性(CQA)を満たしていることを確認しました。
プロトコル
1. 培地の調製と培養容器のコーティング
- メディアの準備
- 古典的血清含有培地の組成:αMEM(445mL)、ウシ胎児血清(FBS)(50mL)、および100xペニシリン-ストレプトマイシン(5mL)を混合することにより、古典的血清含有培地を調製する。
- 完全な SFM XF メディアを準備します。
- SFM XF基礎培地(500 mL)に5 mLのSFM XFサプリメント(100x)と5 mLの100x L-アラニル-L-グルタミン( 材料の表を参照)を無菌的に添加して、500 mLのボトルを作ります。
- 50 mLシリンジをバッグの適切なポートに接続して、20 mLのカスタムMSC SFM XFサプリメント(100x)と20 mLの100x L-アラニル-L-グルタミン( 材料の表を参照)をSFM XF基礎培地バッグ(2 L)に無菌的に添加することにより、50 Lの培地バッグを作成します。
注:培養に使用する前に、成長因子またはサイトカイン(培地に付属していません)を完全なSF XF培地(PDGF-BB(20 ng / mL)、FGF塩基性(4 ng / mL)、およびTGFβ(0.5 ng / mL)に追加します。
- 無血清培地で使用するためのビトロネクチンによる細胞培養容器のコーティング
- ストックのビトロネクチン(VTN-N;0.9 mg/mL)を4°Cで解凍します。
- カルシウムとマグネシウムを含まない滅菌ダルベッコ緩衝生理食塩水(DPBS)を使用して、解凍したVTN-Nを使用濃度5 μg / mLに希釈します。
注意: 使用直前にVTN-Nを希釈し、希釈したビトロネクチン溶液を保管しないでください。 - 1 mL/10 cm2 の希釈VTN-N溶液を対応する培養容器に加えます。最終濃度は0.5μg/cm2である。例えば、7.5mLの希釈VTN-N溶液をT-75フラスコ(75cm2)に加える。17.5mLの希釈VTN-N溶液をT-175フラスコ(175cm2)に加える。250mLの希釈VTN-N溶液を標準的な4層多層フラスコ(2,528cm2)に加える。630 mLの希釈VTN-N溶液を10層多層フラスコ(6,320 cm2)に加えます。
- 無菌条件下で、容器を室温(RT)で1時間インキュベートする。
注:コーティングされた培養容器は、4°Cで最大1週間保存できます。乾燥を防ぐために、培養容器を実験用フィルムで包みます。使用前に、培養容器を室温まで少なくとも1時間予熱してください。 - VTN-N溶液を吸引し、廃棄し、コーティングされた容器表面が乾燥しないように十分な量の培養液を直ちに添加します。
注:VTN-Nを取り外した後、培養容器を洗い流す必要はありません。
2. WJ-hMSCの拡張
- WJ-hMSC(p2)を37°Cの水浴に入れて急速に解凍します。内容物が解凍し始めるまでバイアルをゆっくりと回転させます。
- 解凍したら、WJ-hMSCをT-175フラスコ(VTN-Nコーティングなし)に5,000細胞/cm2で播種し、細胞増殖のために5%CO2の加湿雰囲気下で37°Cの古典的な血清含有培地でインキュベートします。2回の継代(p4)の後、展開した細胞を所望の凍結保存培地でバンクダウンし、作業細胞バンク(WCB)とした。
- 生存率および細胞数法に従って自動細胞カウンターを使用して細胞計数を実行し、総細胞数、細胞生存率、および細胞サイズを決定する29。
- p4から、従来の血清含有培地またはSFM XF培地のいずれかのT-75フラスコで5,000細胞/cm2 でWJ-hMSCを培養します(VTN-NコーティングフラスコとSFM XF培地を使用)。
- 両培地中の細胞を合計3継代(12日間)維持し、各継代の培養終了時にカウントした生細胞数を培養開始時(細胞播種日)の生細胞数で割ることにより、各継代における細胞増殖(倍増)を測定する。
3. シードトレインのスケールアウト拡大
- T-175フラスコ内でのWJ-hMSC拡張
- クライオバイアルを37°Cの水浴に入れて、p4でWJ-hMSCを迅速に解凍します。溶液が解凍し始めるまでバイアルをゆっくりと回転させます。
- 5,000細胞/cm2 をVTN-NコーティングT-175フラスコに播種します。細胞を5%CO2を含む37°Cのインキュベーター内で増殖させます。
- 使用済みの培地を2〜3日ごとに、最適な性能と細胞増殖のために、新たに調製した温めた完全なSFM XF培地と交換してください。
- 多層フラスコの取り扱い(図1A、B)
- すべての無菌接続は、無菌環境で行う必要があります。
- 多層フラスコを生物学的安全キャビネット内で開梱します。
- 滅菌済みのエアフィルター(0.2 μm)を1つのポートに接続し、向流遠心分離機を使用して流体移送中に圧力を解放できるようにします。
- カスタムチューブセットの多層フラスココネクタをもう一方のポートに取り付けます(図1B)。
- カスタムチューブセットのPVCラインを、完全なSFM XF培地を含む2 L PVCトランスファーバッグに溶接します。
注意: 重力流によって多層システムに追加する前に、ミディアムバッグを完全に混合してください。PVCトランスファーバッグが多層フラスコよりも高くぶら下がっていることを確認してください。 - 多層フラスコを長辺に置き、エアフィルターを上部に置きます(図1B)。
- PVCチューブのクランプを開いて、多層フラスコの充填を開始します。充填中は、用紙がトレイ間で水平になっていることを確認してください。
- 培地がすべてのトレイで完全に水平になったら、ポートを直立させた状態で多層フラスコを短辺に回します。
- clを閉じますamp PVCライン、チューブ接続をMPCブルークロージャーキャップに交換してトランスファーバッグを取り外します。
注意: エアフィルターはセル拡張中にガス交換が可能になるため、取り外さないでください。 - 多層フラスコをインキュベーション位置に回します。
注意: フィルターとチューブ接続は上を向いている必要があります。 - 多層フラスコをアスピレーターボトルに接続して空にします。アスピレーターボトルの上に置くと、液体が流出します。
注意: 多層フラスコを横に傾けて、使用済みの培地を重力で完全に排出します。あるいは、使用済み培地は、カスタムチューブアセンブリを使用して廃棄物ボトルに注ぐことができます。 - 手順3.2.5〜3.2.11を繰り返して、新しい培地を補充します。
- 多層フラスコ内でのWJ-hMSCの継代培養(T-175 > 4層>10層)
- 使用前に、細胞解離試薬(TrypLE)と完全なSFM XF培地を37°Cのインキュベーター内で事前に温めてください。
- 使用済みの培地をT-175フラスコから吸引し、廃棄します。
- 細胞単層を予熱したDPBSで洗浄し、吸引して廃棄する。
- 各フラスコにTrypLEを加え、細胞単層を完全にカバーし、37°Cで5〜10分間インキュベートします。
- 懸濁液を滅菌済みの50 mLコニカルチューブに移します。
- チューブを100-200 x g でRTで5分間遠心分離します。 DPBSを吸引して廃棄し、細胞ペレットを乱さないように注意してください。
- 細胞ペレットを、細胞計数のために予熱した完全SFM XF培地の最小容量(10 mL)に再懸濁します。
- 上記のセクション2で述べたように、VTN-Nコーティングされた4層培養容器に約800 mLの完全なSFM XF培地を充填します。5,000細胞/cm2 (すなわち、1.26 x 107 生細胞/フラスコ)を追加します。細胞懸濁液を静かに回転させて、均一な分布を確保します。
- 加湿雰囲気下で5%CO2 を含む37°Cのインキュベーターでインキュベートします。
- 細胞が60%〜80%のコンフルエンシーに達するまで、または10層多層フラスコに継代培養する準備ができるまで、最適な細胞増殖のために、2〜3日ごとに使用済みの培養培地を新鮮で事前に温めた完全なSFM XF培地と交換します。
- セクション2で述べたように、VTN-Nコーティングされた10層多層フラスコに約2 Lの完全なSFM XF培地を充填します。5,000細胞/cm2 (すなわち、3.1 x 107 細胞/フラスコ)を追加します。細胞懸濁液を静かに回転させて、均一な分布を確保します。
- 加湿雰囲気下で5%CO2 を含む37°Cのインキュベーターでインキュベートします。
- 細胞が60%〜80%のコンフルエンシーに達するか、または回収の準備が整うまで、最適な細胞増殖のために、2〜3日ごとに使用済みの培養培地を新鮮で温めた完全なSFM XF培地に交換します。
4. クローズド向流遠心分離を用いたWJ-hMSCの閉鎖半自動解離と回収
- シングルユース向流遠心分離キットアセンブリ
- 図1Aに示す構成と同様に、チューブ溶接を介してシングルユースキットをシングルユースPVCトランスファーバッグに接続します。
注:シングルユースキットのデフォルトの流量は30〜165mL / minです。 - コンフルエントなWJ-hMSCを含む10層多層フラスコを、バイオセーフティキャビネット内のカスタムチューブアセンブリに取り付けます。
- 図1Bに示すように、カスタムチューブアセンブリを備えた付属の10層培養容器をベンチに移し、シングルユースキットのラインE(ID PVCで3/32)に溶接します。
- 無菌サンプルポートを高流量シングルユースキットのラインGに溶接してください。
- 次に、収穫ラインHを50mLシリンジを取り付けた滅菌ルアーに接続します。
注意: 上記のすべての手順で、手動clを確認してくださいamp 各キットバッグ内の液体を固定するために閉じています。
- 図1Aに示す構成と同様に、チューブ溶接を介してシングルユースキットをシングルユースPVCトランスファーバッグに接続します。
- インストゥルメントランのセットアップ
- 機器の背面にあるトグルスイッチをオンにして、機器に 「オン」 の電源を供給します。
- 付属のUSB-Cケーブルを使用して、ラップトップを機器のUSB-Cポートに接続します(図1B)。
- カウンターフロー遠心分離機のグラフィカルユーザーインターフェイス(GUI)ソフトウェアをデスクトップまたはスタートメニューから実行します。
- サインイン後、メインのウェルカムページの[プロトコルの選択]ボタンをクリックして プロトコル をロードします。
注:向流遠心分離ハーベスティングプロトコル(表1)は、プロトコルビルダーソフトウェアを使用して作成され、ローカルに保存されました。 - 機器の青いロック解除ボタンを押して、ガラスのドアを開きます。
- 組み立てたシングルユースキットを向流遠心分離システムにロードします。
- 図1Bに示すように、10層の多層フラスコを斜めに配置して、ハンガーフックに吊るされたバッグをバブルセンサーストリップのチューブポートと最もよく並べるように吊るすことから始めます。
- キットを2つのキット位置ボタンに合わせ、ポンプチューブを蠕動ポンプの周りに伸ばし、白い電球型のコネクタを所定の位置に押し込みます。
注意: 圧力センサーの上のチューブがチューブトラックに正しく配置されていることを確認してください。 - 向流遠心室キャリアの銀色のレバーを持ち上げて遠心分離室を取り付け、レバーを直立位置に戻して固定します。
- キットの各ポートからのチューブ をバブルセンサーストリップに沿ってトラックに押し込みます。
注意: プロトコルプロセスに簡単に従うことができるように、バッグが絡まっていないことを確認してください。 - ドアラッチを押してドアを閉じます。
注意: ポンプクランプアームが閉じ、遠心分離機チャンバーが回転し、バルブが閉じます。ドアを閉めないと、システムはプロトコルを開始して実行できません。 - GUIの [開始 ]ボタンを押します。チェックリストが表示されます。最初の4つの項目は機器チェックで、最後の2つの項目はユーザーチェックです(バッグと接続がキットの画像と一致し、手動クランプが開いていることを確認してください)。
注意: 機器のチェックでは、何かが正しくない場合は、青いチェックマークの代わりに赤いXが表示されます。 - 確認を押して、プロトコル入力画面を表示します。
- データ入力(収穫量)ダイアログボックスの値を45mLに設定し、 確認を押します。
注:ユーザーが作成したプロトコルで変数データ入力が設定されている場合、プロトコル入力画面が表示されます。このプロトコルでは、収穫量は変数として設定されており、ユーザーは最終的な細胞密度要件に応じて異なる量をテストすることを選択できます。システムが許容する最小収穫量は5mLです。システムでは、プロトコルごとに最大 4 つのデータ変数のみを設定できます。
- プロトコルの実行
- GUI で[開始]をクリックし、機器の緑色の [開始 ]ボタンを押してプロトコルの実行を開始します( 表1を参照)。
注意: システムは、システム内の空気をバッファーに置き換えることにより、プライミングシーケンスから始めて、プロトコルに従って手順を開始します。 - プライミングが完了したら(表1、ステップ8)、使用済み培地が完全に廃棄物バッグにポンプで排出されていることを確認します。
注意: 10層多層フラスコが空になると、システムはGUIでユーザーに容器が空かどうかを確認するように求めます。容器が空の場合は、機器の「スキップ」ボタンを押します。そうでない場合は、緑色の「再生/一時停止」ボタンを押して、容器から残留液を排出し続けます。 - 一時停止手順15、19、および22(表1)では、必ず多層フラスコを持ち上げて振って、バッファーをすべてのトレイに均等に分配します。完了したら、次のステップのために10層多層フラスコを元の描画位置に戻します。
注意: 表1 のステップ19の場合のみ、振とうした後、必ず多層フラスコを平らに置き、RTで10〜15分間インキュベートして細胞を解離してください。 - ステップ20およびステップ23(表1)において、トリプシン処理された細胞が中間バッグに完全に移されることを確認する。
- ステップ25(表1)で中間バッグを手動でよく混合します。
- ステップ26(表1)では、2 mLルアーシリンジを使用してサンプリングポートからサンプリングします。
注:正確な細胞数を得るには、少なくとも3回サンプリングすることをお勧めします。 - ステップ29およびステップ30(表1)において、流動細胞床の安定な形成を確認する;図 1Cに示すように、流動化された細胞床に類似している必要があります。
注: 図1Cに示すような安定した流動細胞床が形成されない場合、流量に対するg力の比率(G/F)を最適化することは、細胞の負荷および洗浄ステップ中にチャンバー内で安定した流動化細胞床(高い細胞回収率)を達成するために重要です。G/F比は、細胞のサイズと培地の密度によって異なります。高密度のサンプル/洗浄バッファーには高いG/F比が必要ですが、低密度のサンプル/洗浄バッファーには低いG/F比を使用できます。 - ランプ から停止 までのステップ( 表1のステップ35)で実行が完了し、向流遠心分離システムのすべてのピンチ値が自動的に閉じます。
注意: 最後に、手動clを確認してくださいamp ドアを開ける前に、各キットバッグ内の液体を固定するために閉じています。 - プロトコルの実行が完了したら、機器の青いロック解除ボタンを押して、ガラスのドアを開きます。回収した濃縮液の入ったシングルユースキットを装置から取り出します。
- ハンドキャリーチューブシーラーを使用して収穫ラインを無菌的に密封します。濃縮細胞回収物で満たされた密封されたシリンジを、細胞計数と凍結保存のために生物学的安全キャビネットに慎重に移します。
- レバーを使用してチャンバーを再度取り外し、バルブコネクタをフィッティングから引き出し、キットを慎重に持ち上げて、バイオハザードバッグに入れます。
- エタノールワイプを使用して機器を清掃し、必ずドアを閉めてください。
- 機器の背面にあるスイッチをオフにする前に、まずGUIアプリケーションを閉じてください。
注:細胞採取プロトコルは、生物学的トリプリケート(n = 3)でテストされました。
- GUI で[開始]をクリックし、機器の緑色の [開始 ]ボタンを押してプロトコルの実行を開始します( 表1を参照)。
5. 重要品質属性(CQA)評価
- 細胞同一性表面マーカー(CD73、CD90、およびCD105)および非間質マーカー(CD34およびCD45)
- 採取したWJ-hMSC細胞懸濁液を、適切な量のフローサイトメトリーバッファー(1%BSAまたは2%FBSを含むDPBS)を加えて、1 x 106 生細胞/mLの濃度に希釈します。
- 100 μLの細胞懸濁液を各マイクロ遠心チューブまたは96ウェルプレートに加えます。細胞懸濁液100 μLあたり最低0.1 x 106 細胞が存在することを確認してください。
- 蛍光色素標識抗体を、抗体ベンダーが推奨する適切な希釈率でサンプルに追加します。
- 暗闇の中で20分間インキュベートします。
- インキュベーション後、100 μLのフローサイトメトリーバッファーを添加し、380 x g で3分間遠心分離してサンプルを洗浄します。
- ペレットを残して上清を捨てる。
- 細胞ペレットを200 μLのフローサイトメトリーバッファーに再懸濁し、フローサイトメトリー分析30に供した。
- コロニー形成単位線維芽細胞アッセイ(CFU-F)
- 細胞懸濁液を1,000生細胞/mLの完全培養培地の濃度に希釈します。
- プレートは、完全培養培地中の6ウェル組織培養プレートにウェルあたり~500細胞。
- 5%加湿したCO2中で37°Cで10〜14日間インキュベートし、PBSで洗浄し、メタノール中の0.5%クリスタルバイオレットでRTで30分間染色します。
- 各ウェルのコロニーを列挙します。
- CFU-F効率の計算:形成されたコロニーの数を元の播種数で割って、コロニー形成のパーセンテージ効率を求め、パーセンテージで表します。
- 三系統分化の可能性
- メーカーのプロトコルに従って、5 x 103 細胞/cm2 を12ウェルプレートの骨形成および脂肪形成分化培地に播種します。軟骨形成のために、1.6 x 107 生細胞/mLを調製し、メーカーのプロトコルに従って、96ウェルプレートのウェルの中央に5 μLの細胞溶液滴を播種することにより、マイクロマス培養を生成します。
- 分化中は、3〜4日ごとに培地を完全に交換します。
- 14日後(脂肪形成の場合)または21日後(骨形成および軟骨形成の場合)、製造元のプロトコルに従って、系統特異的な生物学的染色を使用して培養物の分化を監視します。脂肪分化のために、培養物を0.5%オイルレッドO溶液で染色する。骨形成のために、2%アリザリンレッドS溶液を用いて染色を行う。軟骨形成分化のために、マイクロマスペレットを1%アルシアンブルーで染色する。
- サイトカイン分泌プロファイル
- 手作業または向流遠心分離システムを使用して回収した凍結保存細胞を解凍し、SFM XF培地を含むT-175フラスコに5,000細胞/cm2 を播種します。
- 4日後、使用済みの培地を回収し、分析するまで-80°Cで保存します。
- マルチプレックスリーダー上のサイトカイン発現プロファイル19-plexパネルキットを用いてサイトカインの発現を定量化する。
- メーカーの推奨に従ってマルチプレックスイムノアッセイを実行します。
結果
融解後のWJ-hMSCマスターセルバンク(MCB)は、実験に十分な作業細胞バンク(WCB)を生成するために、古典的な血清含有培地で3回連続した継代(p1-p4)にわたって維持されました。p4 WCBを、血清含有培地およびSFM XF培地の両方で解凍し、T-175フラスコ内でさらに3回継代(p4-p7)増殖させた。WJ-MSCは、SFM XF培地で増殖した場合に良好に適応し、血清含有培地と同様の安定した増殖を維持することができました(図2A)。しかし、SFM XF培地で増殖した細胞は、わずかに長い線維芽細胞様の紡錘形の形態を示し、血清含有培地では~15 μmと比較して、平均~17 μmのわずかに大きな細胞サイズ(図2B)をもたらしました。3つの継代にわたる両方の培地条件において、WJ-hMSCは一貫して最大細胞密度~2.3 x 104 細胞/cm2 に達し、集団倍加時間は~34時間でした(図2C、D)。
閉鎖系での大規模なWJ-hMSC拡張のために、WJ-hMSCのシードトレイン拡張を最初に4層フラスコで行い、その後、10層多層フラスコで展開しました。培養4日後の約80%〜90%のコンフルエントで、4層スタックおよび10層スタックについて、それぞれ9.6 x 10 7 ± 0.9 x 107および2.3 x 10 8 ± 0.2 x 108細胞を採取した。T-175フラスコと比較して、3.6 x 10 4-3.8 x 104細胞/cm2のより高い細胞密度に達し、スタックにより最大7倍の細胞増殖が可能になりました。
また、10層培養容器に展開したWJ-hMSCsを、向流遠心分離を用いて直接回収した。シングルユースキットへの滅菌接続は、装置の蠕動ポンプを使用して最大流量165 mL/minで直接流体移送するために簡単に確立できました。半自動細胞採取プロセスは、最初に酵素解離を使用して細胞を回収し、細胞を向流チャンバーにロードして体積を減らして濃縮し、次に向流遠心分離チャンバーの約3倍の体積の洗浄バッファーで洗浄することによって達成されました。さらに、洗浄した細胞を濃縮し、プロトコルに予め設定された所望の収穫量まで回収した。半自動細胞処理に使用される処理ステップは、手動収穫ワークフローをエミュレートするように設計されました。体積を10倍に低減し、530万細胞/mLもの細胞濃度を実現しました。このプロトコルは、3回の独立した実行すべてで一貫して~98%の高い細胞回収率と~99%の高い細胞生存率を達成することができました(図3A-C)。
手動遠心分離と比較した向流遠心分離を使用して、細胞採取の重要な品質属性を決定するために、広範な細胞特性評価アッセイを実施しました。WJ-hMSCの同一性を試験するために、細胞表面マーカーをフローサイトメトリーにより分析した。 図4Aに示すように、両法を用いて採取したWJ-hMSCは、ISCT規則に従って特徴的な表面マーカープロファイル、CD73、CD90、およびCD105の陽性発現、ならびにCD34およびCD45の陰性発現を示した。次に、WJ-hMSCsのクローン形成能を評価するために、CFU-Fアッセイを実施した。 図4Bに示すように、向流遠心分離から採取された細胞は、手動遠心分離によって回収された細胞と比較して同様のCFU-F電位を示した(それぞれ21%±1%対20%±1%)。さらに、 図4Cに示すように、向流遠心後に回収した細胞は、手動遠心分離法の細胞と同様の脂肪細胞、骨芽細胞、軟骨細胞への分化能を保持していた。最後に、マルチプレックスイムノアッセイを用いて、細胞の18種類のサイトカイン分泌プロファイルを調査しました。 図4Dに示すように、逆流遠心分離後の細胞洗浄・濃縮はサイトカイン分泌プロファイルを維持し、細胞洗浄/濃縮前(向流前遠心分離)のサンプルと同程度であった。
全体として、SFM XF培養システムで効率的なhMSC増殖が実証されており、閉じた自動向流遠心分離システムを使用して細胞を洗浄および濃縮すると、洗浄後の高い細胞回収率と生存率が得られ、表現型と機能を維持することができました。この研究で開発されたクローズド半自動プロセスは、3回の独立した実行から証明されるように、最終的なWJ-MSC回収に関して製品品質の一貫性を提供できます。

図1:hMSCの収穫、洗浄、濃縮のための高流量シングルユースキットの構成と組み立て 。 (A)バッグをそれぞれのチューブに沿って接続した後のキット図。(B)カスタムチューブアセンブリを備えた高流量シングルユースキットに接続された10層多層フラスコ。(C)向流遠心分離ソフトウェアのグラフィカルユーザーインターフェイスで有効になるカメラ機能 を介して 、向流チャンバー内に形成された安定した流動細胞床の視覚化。 この図の拡大版を表示するには、ここをクリックしてください。

図2:血清含有培地とSFM XF培地におけるhMSCの細胞形態と増殖の比較。 (A)古典血清培地およびSFM XF培地におけるhMSCsの代表的な細胞形態。SFM XF増殖細胞は、より長い紡錘形の特徴的な線維芽細胞様形態を示したが、血清含有培地で増殖した細胞はより平坦な形態を示した。(b)血清含有培地とSFM XF培地との間の平均MSCサイズを、自動セルカウンター(n=3)により測定する。SFM XF増殖細胞は、異なる継代にわたって血清増殖細胞よりも一般的に大きかったことは明らかである。異なる継代における総細胞収量(n=3)(C)培養表面積当たりの細胞換算および(D)集団倍加レベル。SFM XF培地と血清含有培地との間で、異なる継代にわたって同様のレベルの細胞収量が得られた。データは、標準偏差±平均値として表されます。 この図の拡大版を表示するには、ここをクリックしてください。
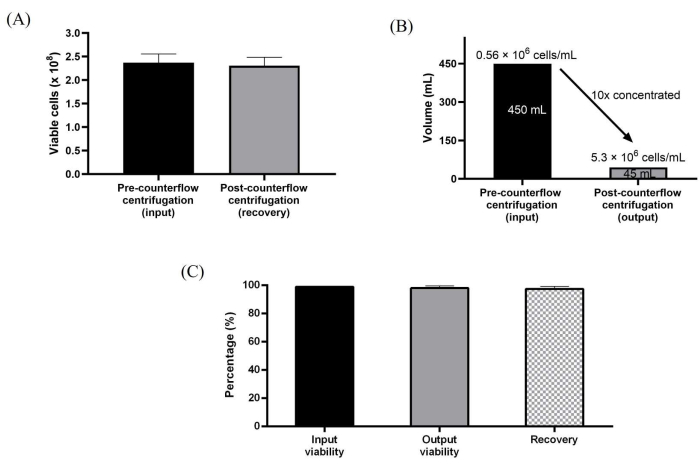
図3:向流遠心分離システムを使用して処理された細胞の特性評価 。 (a)洗浄および濃縮前後の全生細胞。(B)向流遠心分離処理後により10倍の体積減少を達成した。(C)細胞の全回収率および生存率。データは、洗浄および濃縮実行の3つの生物学的反復(n = 3)にわたって平均化されます。データは、平均値±標準偏差で表されます。 この図の拡大版を表示するには、ここをクリックしてください。

図4:重要な品質属性分析 。 (A)フローサイトメトリーからの代表的なデータ。(B)CFUの合計を示す代表的な画像。(C)三系統分化の代表的な顕微鏡像。(d)細胞をカウンターフロー遠心分離システムで処理する前後のサイトカイン発現解析結果(n=3)。データは、平均値±標準偏差で表されます。 この図の拡大版を表示するには、ここをクリックしてください。
表1:初期プライミングステップを含む、向流遠心分離システムでのトリプシン処理、洗浄、および濃縮プロトコルによるhMSC回収の順序。この表をダウンロードするには、ここをクリックしてください。
ディスカッション
この研究では、向流遠心分離装置を使用して、hMSC解離を閉じ、半自動化し、ベンチで洗浄および回収する能力を示しました。ワークフロー全体の重要なステップの1つは、カウンターフロー遠心分離システムのプロトコルビルダーで定義されたプリセットプロトコルに従ってチューブが接続されていることを確認することです。セットアップと操作は簡単で、キットの組み立てから細胞回収までの10層フラスコからの約2Lの培養を処理するのにかかった時間は約60分でした。このワークフローの制限ステップの1つは、多層フラスコから向流遠心分離装置に接続されたトランスファーバッグへの流体移送です。高流量シングルユースキットは、最大流量165 mL/minでしか実行できず、40層フラスコなどの処理には困難な場合があります。流体移送のプロセスを迅速化するために、外部の高流量ポンプを使用して、最初にトリプシン処理された内容物をトランスファーバッグに移し、次に向流遠心分離システムを使用してトランスファーバッグから細胞を洗浄/濃縮および回収することができます。さらに、このプロトコルは、4層から10層多層フラスコへの継代細胞にも適用できます。さらに上流では、向流遠心分離システムは、解凍したhMSCの洗浄、およびシードトレインを開始するための多層フラスコへの直接収穫および培地製剤の最適化にも最適化できます。気流遠心分離チャンバ内の流動床を形成するのに必要な最小細胞数は約3000万細胞であり、バッチ当たりの処理に推奨される最大容量は20Lであることに留意すべきである。
現在、カスタムチューブアセンブリをバイオセーフティキャビネット内の多層フラスコに取り付け、コンポーネントのパーツをオートクレーブすることは、cGMP設定では望ましくありません。別の方法として、カスタムガンマ滅菌チューブアセンブリをサプライヤーにアウトソーシングすることもできます。多層フラスコを提供するサプライヤーは、0.2 μmフィルターを含む目的のチューブアセンブリをフラスコに事前取り付けし、衣装全体のガンマ滅菌を行うオプションも提供しています。これにより、多層フラスコと付属チューブが真に閉じられ、クラスCのクリーンルーム設定のベンチでプロセスを完了できるようになります。
向流遠心分離システムを利用するこのプロセスは、多層容器内の接着ベースの培養細胞に限定されず、動的(攪拌タンクまたはウェーブバイオリアクター)および静的(ガス透過性)懸濁液ベースの細胞増殖プラットフォームに適応できます。具体的には、3Dマイクロキャリア培養で増殖したhMSCの場合、マイクロキャリアから解離したhMSCを回収、洗浄、および製剤化するためのプロトコルをカウンターフロー遠心分離システムで最適化できます。
全体として、プロセスの堅牢性と信頼性が向上したトランスレーショナル細胞療法の開発への関心の高まりにより、閉鎖型の自動化された細胞処理プラットフォームが開発されました。これらのシステムは、取り扱い工程の数を減らし、滅菌接続による潜在的な汚染を防ぎ、労力を削減し、クリーンルームスペースの有効利用を高めることによって製造コストを削減するため、不可欠です21。これに沿って、治療法を翻訳するための規制当局の承認を求めている細胞治療製品開発者の多くは、プロセス開発段階の早い段階でプロセスを閉じ、完全自動化または半自動化を実装することの重要性を認識しています14,31,32。
規制に配慮したSFM XF培地を使用し、21 CFR GMP Part 11および国際的な品質ガイドラインに準拠した補助試薬とともに、この半自動化されたプロセスは臨床製造に容易に適しています。我々は、クローズドプロセスの再現性とWJ-MSCの品質の維持を示しました。 多層フラスコで接着性細胞を培養する効率と安全性を向上させることは、hMSC治療分野だけでなく、細胞株バンキングや接着性ウイルス生産の企業にも利益をもたらすでしょう。
開示事項
P.J.、A.B.、R.L.、およびJ.N.はサーモフィッシャーサイエンティフィックの従業員です。A.L.とS.O.には利益相反はありません。
謝辞
著者らは、シンガポールのA*STARからのインダストリー・アライメント・ファンド・プレポジショニング(IAF-PP)資金(H18/01/a0/021およびH18/AH/a0/001)からの支援に感謝の意を表したい。
資料
| Name | Company | Catalog Number | Comments |
| 2L PVC transfer bag | TerumoBCT | BB*B200TM | |
| Alcian blue solution, pH 2.5 | Merck | 101647 | |
| Alizarin-Red Staining Solution | Merck | TMS-008-C | |
| APC anti-human CD73 Antibody | Biolegend | 344015 | |
| APC Mouse IgG1, κ Isotype Ctrl (FC) Antibody | Biolegend | 400121 | |
| Bio-Plex MAGPIX Multiplex Reader | Bio-Rad | ||
| Counterflow Centrifugation System | Thermo Fisher Scientific | A47679 | Gibco CTS Rotea Counterflow Centrifugation System |
| Crystal Violet | Sigma-aldrich | C0775 | |
| CTS (L-alanyl-L-glutamine) GlutaMAX supplement | Thermo Fisher Scientific | A1286001 | |
| CTS Dulbecco's phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | A1285601 | no calcium, no magnesium |
| CTS Recombinant Human Vitronectin (VTN-N) | Thermo Fisher Scientific | A27940 | |
| CTS TrypLE Select Enzyme | Thermo Fisher Scientific | A1285901 | |
| Custom tubing assembly | Saint-Gobain and Colder Product Company (CPC) | N/A | Gamma-sterilized 3/32” ID PVC line fitted with a sterile male MPC (1/8” barb) and sealed on the other end. Autoclave a short C-Flex line fitted with a sterile Cell Factory port connector on one end and a female MPC (3/8” barb) on the other. Connect the PVC and C-Flex lines in a biosafety cabinet |
| Emflon II capsule (0.2um filter) | Pall | KM5V002P2G100 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | 12662029 | Mesenchymal stem cell-qualified, USDA-approved regions |
| FGF-basic | Thermo Fisher Scientific | PHG0024 | |
| FITC anti-human CD105 Antibody | Biolegend | 323203 | |
| FITC anti-human CD45 Antibody | Biolegend | 304005 | |
| FITC anti-human CD90 (Thy1) Antibody | Biolegend | 328107 | |
| FITC Mouse IgG1, κ Isotype Ctrl (FC) Antibody | Biolegend | 400109 | |
| Hi-Flow Single Use Kit | Thermo Fisher Scientific | A46575 | Gibco CTS Rotea Hi-flow single-use kit, flow rate of 30 – 165 mL/min |
| Multi-layered systems | Thermo Fisher Scientific | 140360 (4-layers); 140410 (10-layers) | Nunc Standard Cell Factory Systems |
| NucleoCounter NC-3000 | Chemometec | NC-3000 | |
| Oil red O staining solution | Merck | 102419 | |
| PDGF-BB | Thermo Fisher Scientific | PHG0045 | |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | |
| PerCP anti-human CD34 Antibody | Biolegend | 343519 | |
| PerCP Mouse IgG1, κ Isotype Ctrl Antibody | Biolegend | 400147 | |
| ProcartaPlex Multiplex Immunoassays | Thermo Fisher Scientific | Custom 19-Plex panel: FGF-2, HGF, IDO, IL-10, IL-1RA, IL-6, IL-8, IP-10, MCP-1, MCP-2 , MIP-1α, MIP-1β, MIP-3α, PDGF-BB, RANTES, SDF-1α, TGFα, TNF-alpha, VEGF-A | |
| Sample port | Thermo Fisher Scientific | A50111 | Gamma-sterilized leur sample port with 2 PVC lines attached |
| StemPro Adipogenesis Differentiation Kit | Thermo Fisher Scientific | A10070-01 | |
| StemPro Chondrocyte Differentiation | Thermo Fisher Scientific | A10071-01 | |
| StemPro Custom MSC SF XF Medium Kit (SFM XF medium) | Thermo Fisher Scientific | ME20236L1 | Contains StemPro MSC SFM Basal Medium and Custom MSC SF XF Supplement (100x) |
| StemPro Osteogenesis Differentiation Kit | Thermo Fisher Scientific | A10072-01 | |
| T175 Nunc EasYFlask | Thermo Fisher Scientific | 159910 | |
| T75 Nunc EasYFlask | Thermo Fisher Scientific | 156472 | |
| TGFβ1 | Thermo Fisher Scientific | PHG9204 | |
| WJ MSCs | PromoCell | (#C12971; Germany) | Human mesenchymal stem cells |
| αMEM media | Thermo Fisher Scientific | 12571063 | With nucleosides |
参考文献
- Zhou, T., et al. Challenges and advances in clinical applications of mesenchymal stromal cells. Journal of Hematology & Oncology. 14 (1), 24(2021).
- García-Bernal, D., et al. The current status of mesenchymal stromal cells: Controversies, unresolved issues and some promising solutions to improve their therapeutic efficacy. Frontiers in Cell and Developmental Biology. 9, 650664(2021).
- Mastrolia, I., et al. Challenges in clinical development of mesenchymal stromal/stem cells: Concise review. Stem Cells Translational Medicine. 8 (11), 1135-1148 (2019).
- Jovic, D., et al. A brief overview of global trends in MSC-based cell therapy. Stem Cell Reviews and Reports. 18 (5), 1525-1545 (2022).
- Lechanteur, C., Briquet, A., Bettonville, V., Baudoux, E., Beguin, Y. MSC manufacturing for academic clinical trials: From a clinical-grade to a full GMP-compliant process. Cells. 10, 1320(2021).
- Fernández-Santos, M. E., et al. Optimization of mesenchymal stromal cell (MSC) manufacturing processes for a better therapeutic outcome. Frontiers in Immunology. 13, 918565(2022).
- Jossen, V., vanden Bos, C., Eibl, R., Eibl, D. Manufacturing human mesenchymal stem cells at clinical scale: Process and regulatory challenges. Applied Microbiology and Biotechnology. 102 (9), 3981-3994 (2018).
- Jayaraman, P., Lim, R., Ng, J., Vemuri, M. C. Acceleration of translational mesenchymal stromal cell therapy through consistent quality GMP manufacturing. Frontiers in Cell and Developmental Biology. 9, 648472(2021).
- Levy, O., et al. Shattering barriers toward clinically meaningful MSC therapies. Science Advances. 6 (30), (2020).
- Fričová, D., Korchak, J. A., Zubair, A. C. Challenges and translational considerations of mesenchymal stem/stromal cell therapy for Parkinson's disease. npj Regenerative Medicine. 5 (1), 20(2020).
- Childs, P. G., Reid, S., Salmeron-Sanchez, M., Dalby, M. J. Hurdles to uptake of mesenchymal stem cells and their progenitors in therapeutic products. Biochemical Journal. 477 (17), 3349-3366 (2020).
- James, D. How short-term gain can lead to long-term pain. Cell & Gene Therapy Insights. 3 (4), 271-284 (2017).
- Ochs, J., Barry, F., Schmitt, R., Murphy, M. Advances in automation for the production of clinical-grade mesenchymal stromal cells: The AUTOSTEM robotic platform. Cell & Gene Therapy Insights. 3 (8), 739-748 (2017).
- Doulgkeroglou, M. N., et al. Automation, monitoring, and standardization of cell product manufacturing. Frontiers in Bioengineering and Biotechnology. 8, 811(2020).
- Chen, A. K. -L., Reuveny, S., Oh, S. K. W. Application of human mesenchymal and pluripotent stem cell microcarrier cultures in cellular therapy: Achievements and future direction. Biotechnology Advances. 31 (7), 1032-1046 (2013).
- Couto, P. S., Bersenev, A., Rafiq, Q. A. Engineering Strategies for Regenerative Medicine. Fernandes, T. G., Diogo, M. M., Cabral, J. M. S. , Academic Press. Cambridge, MA. 33-71 (2020).
- Tsai, A. -C., Pacak, C. A. Bioprocessing of human mesenchymal stem cells: From planar culture to microcarrier-based bioreactors. Bioengineering. 8 (7), 96(2021).
- Cherian, D. S., Bhuvan, T., Meagher, L., Heng, T. S. P. Biological considerations in scaling up therapeutic cell manufacturing. Frontiers in Pharmacology. 11, 654(2020).
- Mizukami, A., Swiech, K. Mesenchymal stromal cells: From discovery to manufacturing and commercialization. Stem Cells International. 2018, 4083921(2018).
- Hassan, M., et al. Large-scale expansion of human mesenchymal stem cells. Stem Cells International. 2020, 9529465(2020).
- Li, A., et al. Advances in automated cell washing and concentration. Cytotherapy. 23 (9), 774-786 (2021).
- Mehta, S. Single-use centrifugation solution for volume reduction and cell washing process in cell therapy manufacturing. Cytotherapy. 16, Supplement 101(2014).
- Giancola, R., Bonfini, T., Iacone, A. Cell therapy: cGMP facilities and manufacturing. Muscles Ligaments and Tendons Journal. 2 (3), 243-247 (2012).
- Moutsatsou, P., Ochs, J., Schmitt, R. H., Hewitt, C. J., Hanga, M. P. Automation in cell and gene therapy manufacturing: From past to future. Biotechnology Letters. 41 (11), 1245-1253 (2019).
- Iancu, E. M., Kandalaft, L. E. Challenges and advantages of cell therapy manufacturing under Good Manufacturing Practices within the hospital setting. Current Opinion in Biotechnology. 65, 233-241 (2020).
- Li, A., James, D., Lim, R. The Gibco™ CTS™ Rotea™ system story-A case study of industry-academia collaboration. Gene Therapy. , (2021).
- Li, A., et al. Improving cell viability using counterflow centrifugal elutriation. Cytotherapy. 24 (6), 650-658 (2022).
- Li, A., et al. Automated counterflow centrifugal system for small-scale cell processing. Journal of Visualized Experiments. (154), e60423(2019).
- Shah, D., Naciri, M., Clee, P., Al-Rubeai, M. NucleoCounter-An efficient technique for the determination of cell number and viability in animal cell culture processes. Cytotechnology. 51 (1), 39-44 (2006).
- Chan, A. K. C., Heathman, T. R. J., Coopman, K., Hewitt, C. J. Multiparameter flow cytometry for the characterisation of extracellular markers on human mesenchymal stem cells. Biotechnology Letters. 36 (4), 731-741 (2014).
- Smith, D., et al. Towards automated manufacturing for cell therapies. Current Hematologic Malignancy Reports. 14 (4), 278-285 (2019).
- Stroncek, D. F., Somerville, R. P. T., Highfill, S. L. Point-of-care cell therapy manufacturing; it's not for everyone. Journal of Translational Medicine. 20 (1), 34(2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved