Method Article
폐쇄형 반자동 워크플로우를 사용한 임상 적용을 위한 인간 중간엽 줄기 세포 처리
요약
여기에서는 역류 원심분리 시스템을 사용하여 폐쇄형 반자동 방식으로 다층 플라스크에서 부착 세포를 수확하는 프로토콜을 제시합니다. 이 프로토콜은 기존 단계를 거의 수정하지 않고 다른 세포 확장 플랫폼에서 부착 세포와 현탁 세포를 모두 수확하는 데 적용할 수 있습니다.
초록
인간 중간엽 줄기 세포(hMSC)는 현재 다양한 질병에 대한 유망한 세포 기반 치료 방식으로 연구되고 있으며 향후 몇 년 동안 임상 사용에 대한 더 많은 시장 승인이 예상됩니다. 이러한 전환을 촉진하려면 규모, 로트 간 재현성, 비용, 규정 준수 및 품질 관리의 병목 현상을 해결하는 것이 중요합니다. 이러한 문제는 프로세스를 종료하고 자동화된 제조 플랫폼을 채택하여 해결할 수 있습니다. 이 연구에서 우리는 역류 원심분리를 사용하여 다층 플라스크에서 Wharton's jelly(WJ) 유래 hMSC(WJ-hMSC)를 통과 및 수확하기 위한 폐쇄형 및 반자동 공정을 개발했습니다. WJ-hMSC는 규정을 준수하는 SFM XF(serum-free xeno-free) 배지를 사용하여 확장되었으며, 고전적인 혈청 함유 배지에서 확장된 WJ-hMSC와 유사한 세포 증식(집단 배가) 및 형태를 보여주었습니다. 당사의 폐쇄형 반자동 수확 프로토콜은 높은 세포 회수율(~98%)과 생존력(~99%)을 입증했습니다. 역류 원심분리를 사용하여 세포를 세척하고 농축하여 WJ-hMSC 표면 마커 발현, 집락-형성 단위 (CFU-F), 삼계통 분화 전위 및 사이토카인 분비 프로파일을 유지하였다. 연구에서 개발된 반자동 세포 수확 프로토콜은 서로 다른 세포 확장 플랫폼에 직접 연결하여 부피 감소, 세척 및 낮은 출력 부피로 수확을 수행함으로써 다양한 부착 및 현탁 세포의 중소 규모 처리에 쉽게 적용할 수 있습니다.
서문
인간 중간엽 줄기세포(hMSCs)는 임상적으로 관련된 세포 투여량을 생성하는데 중요한 치료 잠재력과 시험관 내에서 성장할 수 있는 높은 자가 재생 가능성을 감안할 때 조직 공학 및 세포 치료 모두에서 임상 적용을 위한 훌륭한 후보입니다 1,2,3. ClinicalTrials.gov 에 따르면, 현재 다양한 질병 상태에 대해 1,000건 이상의 임상 시험이 진행 중이다4. hMSC 사용에 대한 관심이 높아지고 있는 상황에서 가까운 장래에 더 많은 임상 시험과 시장 승인이 임박했습니다 5,6. 그러나 hMSC의 제조는 배치 간 변동성, 고위험 원료 사용, 제조에 여러 단위 작업이 포함되기 때문에 많은 개방형 및 수동 공정으로 인한 오염에 대한 우려, 높은 인건비, 확장 또는 확장 비용 및 규제 장애물 6,7,8,9,10, 11,12. 이러한 문제는 현재와 미래의 시장 접근에 중요한 장벽으로 남아 있습니다.
폐쇄형, 모듈식, 자동화된 제조 솔루션의 개발과 저위험 보조 시약을 사용하면 이러한 문제를 해결할 수 있습니다. 이는 또한 일관된 제품 품질을 보장하고, 인적 오류로 인한 배치 실패 가능성을 줄이고, 인건비를 줄이고, 디지털 배치 기록 보관 8,12,13,14와 같은 프로세스 표준화 및 규정 준수를 개선합니다. 자가 또는 동종 세포에 임상적으로 적합한 용량을 얻을 수 있으려면 폐쇄적이고 자동화된 방식으로 업스트림 세포 확장 및 다운스트림 처리를 포함하는 간소화된 제조가 중요합니다.
업스트림 hMSC 확장의 경우, 현재 사용되는 가장 일반적인 두 가지 제조 방법은 스케일 아웃 (2D 단층) 및 스케일 업 (3D 마이크로 캐리어 기반 서스펜션 시스템)입니다 15,16,17,18. hMSC 확장을 위해 가장 전통적이고 널리 채택된 방법은 낮은 생산 비용과 설정의 용이성으로 인한 2D 단층 기반 배양이다19.
배양 용기 내에 쌓인 평평한 표면 트레이로 구성된 다층 플라스크는 일반적으로 hMSC 생산을 확장하는 데 사용됩니다. 이들 시스템은 전형적으로 1층 내지 40층 배양 용기(20 )로 제공되며, 생물안전 캐비넷 내부에서 수동으로 처리된다. 세포 계대 및 수확 중 처리 단계에는 전체 용기를 피펫팅하거나 물리적으로 기울여 팽창 배지, 해리 시약 및 세척 완충액을 수동으로 분배하고 디캔팅하는 작업이 포함됩니다. 게다가, 여러 장치를 다루는 것은 크기와 무게로 인해 어렵고 시간이 많이 걸립니다.
그 후, 다층 플라스크로부터의 수확 후, 배지 교환을 위한 원심분리, 세포 세척 및 부피 감소는 전체 세포 제조 워크플로우에 걸쳐 필수적인 단계이다21. 기존의 탁상형 원심분리는 세포 현탁액을 생물 안전 캐비닛 내부의 캡이 있는 튜브 또는 병으로 옮기고, 세포를 회전시키고, 상층액을 수동으로 흡인하고, 완충액을 사용한 세포 재현탁 및 반복적인 세포 세척과 같은 여러 단계를 포함하는 대부분 개방적이고 수동적인 공정입니다. 이는 캡의 개폐로 인한 오염 위험과 수동 흡인/피펫팅 공정22 동안 세포 펠릿을 잃어버릴 가능성을 극적으로 증가시킨다. hMSC와 같은 부착 기반 세포에 대한 다층 배양 시스템을 처리하는 맥락에서 작업자는 원심분리기와 생물안전 캐비닛 사이를 반복적으로 왕복하고 동시에 무거운 장치를 취급하는 힘든 과정을 거쳐야 합니다. 이러한 수동 단계는 힘들고 인적 오류 및 오염 측면에서 위험을 내포하며 비용이 많이 드는 클래스 B 클린룸 환경에서 수행해야 합니다23. 또한 기존의 수동 원심분리 공정은 확장 가능하지 않으며 세포 전단 및 응력을 유발할 수 있습니다. 따라서, 세포 회수율, 생존율 및 잔류 불순물의 세척 효율을 극대화하는 것은 다른 주요 과제이다22. 세포 치료제의 상업적 cGMP 규모 제조에는 오염 위험을 줄이고, 일관된 제품 품질을 보장하고, 인건비 및 생산 비용을 절감하고, 공정 신뢰성을 높이기 위해 폐쇄형 모듈식 자동화 솔루션이 필요합니다24,25. 다층 플라스크는 멸균 가스 교환을 용이하게 하기 위해 포트 중 하나에 멸균 0.2μm 필터를 두고 커넥터를 통해 무균적으로 연결되거나 세포 수확을 위한 자동화된 셀 처리 기기에 직접 튜브로 용접된 두 번째 포트를 통해 폐쇄형 시스템으로 처리할 수 있습니다. 우리는 세포, 유전자 또는 조직 기반 제품의 제조를 위한 혁신적인 폐쇄형 역류 원심분리기를 평가하여 WJ-hMSC 계대배양 및 수확의 대부분의 단계를 닫고 자동화하기 위해 노력했습니다. 이 역류 원심분리 기는 또한 다양한 세포 유형 8,26,27,28에 대한 크기, 배지/완충액 교환, 농축 및 수확에 기반한 세포 분리와 같은 다양한 세포 처리 응용 분야를 수행할 수 있는 유연성을 가지고 있습니다. 이 기기는 튜브 용접 또는 무균 커넥터를 사용하여 백을 이송하여 멸균 연결하거나 선택한 확장 플랫폼에 직접 연결할 수 있는 폐쇄형 일회용 키트를 사용합니다.
이 연구에서는 일회용 역류 원심분리 키트와 다층 플라스크 사이에 폐쇄된 멸균 연결이 가능하도록 맞춤형 튜브 어셈블리를 설계했습니다. 우리는 단일 실행 내에서 완전히 폐쇄되고 반자동화된 방식으로 다층 플라스크에서 WJ-MSC를 효소적으로 분리, 세척 및 수확하도록 프로토콜을 최적화했습니다. 수확된 WJ-hMSC는 순도(표면 마커 분석) 및 효능(CFU-F, 삼계선 분화 및 사이토카인 분비 프로필)을 특성화하여 최종 제품이 로트 방출에 대한 중요 품질 특성(CQA)을 충족하는지 확인했습니다.
프로토콜
1. 배양액의 준비 및 배양용기 코팅
- 배지 준비
- 고전적 혈청 함유 배지의 조성: αMEM(445 mL), 소태아혈청(FBS)(50 mL), 및 100x 페니실린-스트렙토마이신(5 mL)을 혼합하여 고전적 혈청 함유 배지를 준비한다.
- 완전한 SFM XF 매체를 준비합니다.
- SFM XF 보충제 5mL(100x)와 100x L-알라닐-L-글루타민 5mL( 재료 표 참조)를 SFM XF 기본 배지(500mL)에 무균적으로 첨가하여 500mL 병을 만듭니다.
- 50mL 주사기를 백의 해당 포트에 연결하여 맞춤형 MSC SFM XF 보충제(100x) 20mL와 100x L-알라닐-L-글루타민(재료 표 참조) 20mL를 SFM XF 기본 배지 백(2L)에 무균적으로 추가하여 2L 미디어 백을 만듭니다.
참고: 배양에 사용하기 전에 완전한 SF XF 배지에 성장 인자 또는 사이토카인(배지와 함께 제공되지 않음)을 추가합니다: PDGF-BB(20ng/mL), FGF 염기성(4ng/mL) 및 TGFβ(0.5ng/mL).
- 무혈청 배지와 함께 사용하기 위해 세포 배양 용기에 비트로넥틴 코팅
- 비트로넥틴(VTN-N; 0.9mg/mL) 스톡을 4°C에서 해동합니다.
- 칼슘과 마그네슘이 없는 멸균 Dulbecco의 완충 식염수(DPBS)를 사용하여 해동된 VTN-N을 5μg/mL의 작업 농도로 희석합니다.
알림: VTN-N은 사용 직전에 희석하고 희석된 비트로넥틴 용액을 보관하지 마십시오. - 희석된 VTN-N 용액 1mL/10cm2를 해당 배양 용기에 추가합니다. 최종 농도는 0.5μg/cm2입니다. 예를 들어, 희석된 VTN-N 용액 7.5mL를 T-75 플라스크(75cm2)에 첨가하고; 희석된 VTN-N 용액 17.5mL를 T-175 플라스크(175cm2)에 첨가합니다. 희석 된 VTN-N 용액 250mL를 표준 4 층 다층 플라스크 (2,528 cm2)에 첨가한다. 희석된 VTN-N 용액 630mL를 10층 다층 플라스크(6,320cm2)에 첨가합니다.
- 무균 조건 하에서, 실온 (RT)에서 1 시간 동안 용기를 배양한다.
참고: 코팅된 배양 용기는 최대 1주일 동안 4°C에서 보관할 수 있습니다. 배양 용기가 건조되지 않도록 실험실 필름으로 포장하십시오. 사용하기 전에 배양 용기를 실온으로 최소 1시간 동안 예열하십시오. - VTN-N 용액을 흡인하고, 버리고, 코팅된 용기 표면이 건조되는 것을 방지하기 위해 충분한 양의 배양 배지를 즉시 첨가한다.
알림: VTN-N을 제거한 후 배양 용기를 헹굴 필요는 없습니다.
2. WJ-hMSC 확장
- WJ-hMSCs(p2)를 37°C 수조에 극저온 수조에 두어 빠르게 해동하고; 내용물이 해동되기 시작할 때까지 바이알을 천천히 휘젓습니다.
- 해동 시, WJ-hMSC를 T-175 플라스크(VTN-N 코팅 없음)에서 5,000 cells/cm2로 시딩하고, 세포 확장을 위해 5%CO2의 가습 분위기에서 37°C의 고전적인 혈청 함유 배지에서 배양합니다. 두 계대 후(p4) 원하는 동결 보존 배지에서 확장된 세포를 작업 세포 은행(WCB)으로 뱅크다운합니다.
- 총 세포 수, 세포 생존율 및 세포 크기를 결정하기 위해 생존율 및 세포 계수 방법에 따라 자동 세포 계수기를 사용하여 세포 계수를 수행합니다29.
- p4에서 WJ-hMSC를 클래식 혈청 함유 배지 또는 SFM XF 배지(SFM XF 배지와 함께 VTN-N 코팅 플라스크 사용)의 T-75 플라스크에서 5,000 cells/cm2 로 배양합니다.
- 세포를 총 3계대(12일) 동안 두 계대배양액에 유지하고, 각 계대배양 종료 시 계수된 생세포 수를 배양 초기(세포 파종일)의 생세포 수로 나누어 각 계대에서 세포 확장(fold increase)을 측정한다.
3. 종자 열차 규모 확장 확대
- T-175 플라스크에서 WJ-hMSC 확장
- 극저온 난조를 37°C 수조에 위치시킴으로써 p4에서 WJ-hMSCs를 빠르게 해동시키고; 용액이 해동되기 시작할 때까지 바이알을 천천히 돌립니다.
- 5,000 cells/cm2 를 VTN-N 코팅된 T-175 플라스크에 시드합니다. 세포가 5%CO2와 함께 37°C의 인큐베이터에서 성장하도록 한다.
- 최적의 성능과 세포 성장을 위해 2-3일마다 사용한 배양 배지를 새로 준비된 예열 된 완전한 SFM XF 배지로 교체하십시오.
- 다층 플라스크 취급(그림 1A, B)
- 모든 무균 연결은 멸균 환경에서 이루어져야 합니다.
- 생물 안전 캐비닛 내부의 다층 플라스크의 포장을 풉니다.
- 사전 멸균된 공기 필터(0.2μm)를 하나의 포트에 연결하여 역류 원심분리기를 사용하여 유체를 이송하는 동안 압력이 해제되도록 합니다.
- 맞춤형 튜브 세트의 다층 플라스크 커넥터를 다른 포트에 맞춥니다(그림 1B).
- 맞춤형 튜브 세트의 PVC 라인을 완전한 SFM XF 매체가 들어 있는 2L PVC 전사 백에 용접합니다.
알림: 중력 흐름에 의해 다층 시스템에 추가하기 전에 중간 백을 완전히 혼합하십시오. PVC 전사 백이 다층 플라스크보다 높게 매달려 있는지 확인하십시오. - 다층 플라스크를 긴 면에 놓고 공기 필터를 맨 위에 놓습니다(그림 1B).
- PVC 튜브의 클램프를 열어 다층 플라스크를 채우기 시작합니다. 채우는 동안 매체가 트레이 사이의 수평인지 확인하십시오.
- 매체가 모든 트레이에서 완전히 수평이 되면 포트를 똑바로 세우고 다층 플라스크를 짧은 면으로 돌립니다.
- PVC 라인의 클램프를 닫고 튜브 연결부를 MPC 파란색 클로저 캡으로 교체하여 전사 백을 제거합니다.
알림: 셀 확장 중에 가스를 교환할 수 있으므로 공기 필터를 제거하지 마십시오. - 다층 플라스크를 배양 위치로 돌립니다.
알림: 필터와 튜브 연결부는 위쪽을 향해야 합니다. - 다층 플라스크를 흡인기 병에 연결하여 비우십시오. 흡인기 병 위에 놓으면 액체가 흘러나옵니다.
알림: 다층 플라스크를 옆으로 기울여 중력에 의해 사용한 매체를 완전히 배출합니다. 또는 사용한 매체를 맞춤형 튜브 어셈블리를 사용하여 폐기물 병에 부을 수 있습니다. - 3.2.5-3.2.11 단계를 반복하여 새 매체를 보충하십시오.
- 다층 플라스크에서 WJ-hMSCs의 계대 배양(T-175 > 4층 > 10층)
- 예열 세포 해리 시약(TrypLE)과 완전한 SFM XF 배지를 사용하기 전에 37°C 인큐베이터 내부에 보관합니다.
- T-175 플라스크에서 사용한 배지를 흡인하고 폐기합니다.
- 예열된 DPBS로 세포 단층을 세척하고 흡인하고 버립니다.
- 각 플라스크에 TrypLE를 첨가하고, 세포 단층의 완전한 커버리지를 보장하고, 37°C에서 5-10분 동안 배양합니다.
- 현탁액을 멸균된 50mL 원뿔형 튜브로 옮깁니다.
- RT에서 100-200 x g 에서 5분 동안 튜브를 원심분리합니다. DPBS를 흡인 및 폐기하고 세포 펠릿을 방해하지 않도록 주의하십시오.
- 세포 계수를 위해 최소 부피(10mL)의 예열 완전 SFM XF 배지에 세포 펠릿을 재현탁합니다.
- 위의 섹션 2에서 언급한 대로 VTN-N 코팅된 4층 배양 용기에 약 800mL의 완전한 SFM XF 배지를 채웁니다. 5,000 cells/cm2 (즉, 1.26 x 107 생존 세포/플라스크)를 추가합니다. 균일한 분포를 보장하기 위해 세포 현탁액을 부드럽게 소용돌이칩니다.
- 가습 분위기에서 5%CO2 와 함께 37°C 인큐베이터에서 인큐베이션한다.
- 세포가 60%-80% 밀도에 도달하거나 10층 다층 플라스크에 계대 배양할 준비가 될 때까지 최적의 세포 성장을 위해 2-3일마다 사용한 배양 배지를 신선하고 예열된 완전한 SFM XF 배지로 교체합니다.
- 섹션 2에서 언급한 대로 VTN-N 코팅된 10층 다층 플라스크에 약 2L의 완전한 SFM XF 배지를 채웁니다. 5,000 cells/cm2 (즉, 3.1 x 107 cells/플라스크)를 추가합니다. 균일한 분포를 보장하기 위해 세포 현탁액을 부드럽게 소용돌이칩니다.
- 가습 분위기에서 5%CO2 와 함께 37°C 인큐베이터에서 인큐베이션한다.
- 세포가 60%-80% 밀도에 도달하거나 수확할 준비가 될 때까지 최적의 세포 성장을 위해 2-3일마다 사용한 배양 배지를 신선하고 예열된 완전한 SFM XF 배지로 교체하십시오.
4. 폐쇄형 역류 원심분리를 이용한 폐쇄형 반자동 WJ-hMSC 해리 및 수확
- 일회용 역류 원심분리 키트 어셈블리
- 그림 1A에 표시된 구성과 유사하게 튜브 용접을 통해 일회용 키트를 일회용 PVC 전사 백과 연결합니다.
알림: 일회용 키트의 기본 유속은 30-165mL/분입니다. - 융합성 WJ-hMSC가 포함된 10층 다층 플라스크를 생물 안전 캐비닛 내부의 맞춤형 튜브 어셈블리에 부착합니다.
- 맞춤형 튜빙 어셈블리와 함께 부착된 10층 배양 용기를 벤치로 옮기고 그림 1B와 같이 일회용 키트의 라인 E(ID PVC의 3/32)에 용접합니다.
- 멸균 샘플 포트를 고유량 일회용 키트의 라인 G에 용접해야 합니다.
- 다음으로, 수확 라인 H를 50mL 주사기가 장착된 멸균 루어에 연결합니다.
알림: 위의 모든 단계에서 수동 cl이 있는지 확인하십시오.amps는 각 키트 백에 유체를 고정하기 위해 닫혀 있습니다.
- 그림 1A에 표시된 구성과 유사하게 튜브 용접을 통해 일회용 키트를 일회용 PVC 전사 백과 연결합니다.
- 기기 실행 설정
- 기기 후면에 있는 토글 스위치를 켜서 기기의 전원을 "ON" 으로 설정합니다.
- 제공된 USB-C 케이블을 사용하여 노트북을 기기의 USB-C 포트에 연결합니다(그림 1B).
- 바탕 화면이나 시작 메뉴에서 역류 원심분리기 그래픽 사용자 인터페이스(GUI) 소프트웨어를 실행합니다.
- 로그인한 후 기본 시작 페이지에서 Select a Protocol(프로토콜 선택 ) 버튼을 클릭하여 프로토콜을 로드합니다.
참고: 역류 원심분리 수확 프로토콜(표 1)은 Protocol Builder 소프트웨어를 사용하여 생성되어 로컬에 저장되었습니다. - 악기의 파란색 잠금 해제 버튼을 누르고 유리문을 엽니다.
- 조립된 일회용 키트를 역류 원심분리 시스템에 로드합니다.
- 그림 10B와 같이 1층 다층 플라스크를 비스듬히 배치하여 기포 센서 스트립의 튜브 포트와 가장 잘 정렬되는 순서로 행거 후크에 매달린 가방을 걸어 시작합니다.
- 키트를 두 개의 키트 위치 버튼에 맞추고 연동 펌프 주위 의 펌프 튜브를 늘 린 다음 흰색 전구 모양의 커넥터를 제자리에 누릅니다 .
알림: 압력 센서 위의 튜브가 튜브 트랙에 올바르게 배치되었는지 확인하십시오. - 역류 원심분리기 챔버 캐리어의 은색 레버를 들어 올려 원심분리기 챔버를 부착하고 레버를 수직 위치로 되돌려 고정합니다.
- 키트의 각 포트에서 버블 센서 스트립을 따라 트랙으로 튜브를 누릅니다.
알림: 프로토콜 프로세스를 쉽게 따를 수 있도록 가방이 엉키지 않았는지 확인하십시오. - 도어 걸쇠를 눌러 도어를 닫습니다.
알림: 펌프 clamp 암이 닫히고 원심분리기 챔버가 회전하며 밸브가 닫힙니다. 도어를 닫지 않으면 시스템이 프로토콜을 시작하고 실행할 수 없습니다. - GUI에서 시작 버튼을 누르십시오. 체크리스트가 나타납니다. 처음 네 항목은 기기 검사이고 마지막 두 항목은 사용자 검사입니다(가방과 연결이 키트 이미지와 일치하는지 확인하고 수동 cl이 있는지 확인amps가 열려 있습니다).
알림: 기기 점검의 경우 문제가 있는 경우 파란색 확인 표시 대신 빨간색 X가 표시됩니다. - 확인을 눌러 프로토콜 입력 화면을 표시합니다.
- 데이터 입력(Harvest Volume) 대화 상자 값을 45mL로 설정하고 확인을 누릅니다.
알림: 사용자가 만든 프로토콜에 가변 데이터 입력이 설정되어 있는 경우 프로토콜 입력 화면이 표시됩니다. 수확량은 이 프로토콜에서 변수로 설정되며 사용자는 최종 세포 밀도 요구 사항에 따라 다른 부피를 테스트하도록 선택할 수 있습니다. 시스템이 허용하는 최소 수확량은 5mL입니다. 시스템에서는 각 프로토콜에 대해 최대 4개의 데이터 변수만 설정할 수 있습니다.
- 프로토콜 실행
- GUI에서 Initiate 를 클릭하고 계측기의 녹색 Start 버튼을 눌러 프로토콜 실행을 시작합니다( 표 1 참조).
알림: 시스템은 시스템의 공기를 버퍼로 교체하여 프라이밍 시퀀스로 시작하는 프로토콜에 따라 단계를 시작합니다. - 프라이밍이 완료되면(표 1, 8단계) 폐 매체가 폐기물 봉투로 완전히 펌핑되었는지 확인합니다.
알림: 10층 다층 플라스크가 비어 있으면 시스템은 GUI의 사용자에게 용기가 비어 있는지 확인하라는 메시지를 표시합니다. 용기가 비어 있는 경우 기기의 "Skip" 버튼을 누르십시오. 그렇지 않은 경우 녹색 "재생/일시 중지" 버튼을 눌러 용기에서 잔류 유체를 계속 배출하십시오. - 일시 중지 단계 15, 19 및 22(표 1)에서 다층 플라스크를 들어 올리고 흔들어 버퍼를 모든 트레이에 균등하게 분배합니다. 완료되면 다음 단계를 위해 10층 다층 플라스크를 원래 그리기 위치에 다시 놓습니다.
참고: 표 19의 1단계에서만 진탕 후 다층 플라스크를 평평하게 놓고 RT에서 10-15 분 동안 배양하여 세포를 해리합니다. - 단계 20 및 단계 23(표 1)에서, 트립신화된 세포가 중간 백으로 완전히 옮겨졌는지 확인한다.
- 단계 25에서 중간 백을 수동으로 잘 혼합합니다(표 1).
- 단계 26(표 1)에서 2mL Luer 주사기를 사용하여 샘플링 포트를 통해 샘플링합니다.
참고: 정확한 세포 수를 위해 최소 세 번 샘플링하는 것이 좋습니다. - 단계 29 및 단계 30(표 1)에서, 유동화된 세포층의 안정된 형성을 확인하고; 그림 1C와 같이 유동화된 세포층과 유사해야 합니다.
참고: 안정적인 유동화 셀 베드가 그림 1C에 표시된 것과 유사하게 형성되지 않은 경우, 유량(G/F)에 대한 g-force의 비율을 최적화하는 것은 셀 로딩 및 세척 단계 동안 챔버에서 안정적인 유동 셀 베드(높은 셀 회수율)를 달성하는 데 중요합니다. G/F 비율은 세포의 크기와 배지의 밀도에 따라 다릅니다. 고밀도 시료/세척 완충액에는 높은 G/F 비율이 필요하며, 저밀도 시료/세척 완충액에는 낮은 G/F 비율이 필요할 수 있습니다. - R에서 Ramp to Stop 단계(표 35의 1단계)에서 실행이 완료되고 역류 원심분리 시스템의 모든 핀치 값이 자동으로 닫힙니다.
알림: 마지막으로 수동 cl인지 확인하십시오.amps는 문을 열기 전에 각 키트 백에 유체를 고정하기 위해 닫혀 있습니다. - 프로토콜 실행이 완료되면 기기의 파란색 잠금 해제 버튼을 누르고 유리문을 엽니다. 수확한 농축액이 포함된 일회용 키트를 기기에서 꺼냅니다.
- 핸드 캐리 튜브 실러를 사용하여 수확 라인을 무균 밀봉합니다. 농축된 세포 수확물로 채워진 밀봉된 주사기를 세포 계수 및 냉동 보존을 위해 생물학적 안전 캐비닛으로 조심스럽게 옮깁니다.
- 레버를 사용하여 챔버를 다시 분리하고 전구 커넥터를 피팅에서 당겨 빼낸 다음 키트를 조심스럽게 들어 올려 생물학적 위험 백에 폐기합니다.
- 에탄올 물티슈를 사용하여 기기를 청소하고 문을 닫아야 합니다.
- 기기 후면의 스위치를 끄기 전에 먼저 GUI 응용 프로그램을 닫으십시오.
참고: 세포 수확 프로토콜은 생물학적 삼중체(n = 3)로 테스트되었습니다.
- GUI에서 Initiate 를 클릭하고 계측기의 녹색 Start 버튼을 눌러 프로토콜 실행을 시작합니다( 표 1 참조).
5. 중요 품질 속성(CQA) 평가
- 세포 동일성 표면 마커(CD73, CD90 및 CD105) 및 비기질 마커(CD34 및 CD45)
- 적절한 부피의 유세포 분석 완충액(DPBS with 1% BSA 또는 2% FBS)을 추가하여 수확된 WJ-hMSC 세포 현탁액을 1 x 106 viable cells/mL의 농도로 희석합니다.
- 100μL의 세포 현탁액을 각 미세원심분리기 튜브 또는 96웰 플레이트에 추가합니다. 세포 현탁액 100μL당 최소 0.1 x 106 개의 세포가 존재하는지 확인합니다.
- 형광단 접합 항체를 적절한 희석액으로 샘플에 추가하고, 항체 공급업체가 권장하는 대로.
- 어둠 속에서 20 분 동안 배양하십시오.
- 배양 후 100μL의 유세포 분석 완충액을 추가하여 380 x g 에서 3분 동안 원심분리하여 샘플을 세척합니다.
- 펠릿을 남겨두고 상청액을 버립니다.
- 세포 펠렛을 200 μL의 유세포 분석 완충액에 재현탁하고, 유세포 분석대상(30)을 적용한다.
- 집락 형성 단위 섬유아세포 분석(CFU-F)
- 세포 현탁액을 완전한 배양 배지의 1,000 생존 세포/mL 농도로 희석합니다.
- 완전한 배양 배지에서 6-웰 조직 배양 플레이트에서 웰당 ~500개의 세포를 플레이트합니다.
- 37°C에서 5% 가습된CO2 중에서 10-14일 동안 인큐베이션하고, PBS로 세척하고, RT에서 30분 동안 메탄올 중의 0.5% 크리스탈 바이올렛으로 염색한다.
- 각 우물에 있는 식민지를 열거합니다.
- CFU-F 효율 계산: 형성된 콜로니 수를 원래 파종 번호로 나누어 콜로니 형성 효율 백분율을 구하고 백분율로 표현합니다.
- 삼계종 차별화 잠재력
- 제조업체의 프로토콜에 따라 5 x 103 cells/cm2를 12 웰 플레이트의 골형성 및 지방 생성 분화 배지에 시드합니다. 연골 형성의 경우 1.6 x 107 생존 세포/mL를 준비하고 제조업체의 프로토콜에 따라 96웰 플레이트의 웰 중앙에 세포 용액 5μL 방울을 뿌려 미세 대량 배양을 생성합니다.
- 분화하는 동안 3-4 일마다 배지를 완전히 변경하십시오.
- 14일(지방 생성의 경우) 또는 21일(골형성 및 연골 형성의 경우) 후 제조업체의 프로토콜에 따라 계통 특이적 생물학적 염색을 사용하여 배양물의 분화를 모니터링합니다. 지방 분화를 위해 0.5% Oil Red O 용액으로 배양물을 염색합니다. 골 형성의 경우 2 % Alizarin Red S 용액을 사용하여 염색을 수행하십시오. 연골 형성 분화를 위해 마이크로 매스 펠릿을 1% Alcian Blue로 염색합니다.
- 사이토카인 분비 프로파일
- 수동으로 또는 역류 원심분리 시스템을 사용하여 수확한 냉동보존된 세포를 해동하고 SFM XF 배지가 있는 T-175 플라스크에서 5,000 cells/cm2 를 시딩합니다.
- 4일 후, 사용된 배양 배지를 수집하고, 분석될 때까지 -80°C에서 저장한다.
- 사이토카인 발현 프로파일 19-플렉스 패널 키트를 사용하여 멀티플렉스 판독기에서 사이토카인의 발현을 정량화한다.
- 제조업체의 권장 사항에 따라 다중 면역 분석을 수행합니다.
결과
WJ-hMSC 마스터 세포 뱅크 (MCB) 해동 후는 실험을 위한 충분한 작업 세포 뱅크 (WCB)를 생산하기 위해 고전적인 혈청 함유 배지에서 3개의 연속 계대 (p1-p4) 동안 유지되었다. p4 WCB는 T-175 플라스크에서 3개의 추가 계대(p4-p7)를 위해 혈청 함유 배지 및 SFM XF 배지 모두에서 해동 및 확장되었습니다. WJ-MSC는 SFM XF 배지에서 확장되었을 때 잘 적응했으며 혈청 함유 배지에서와 유사한 안정적인 증식을 유지할 수 있었습니다(그림 2A). 그러나 SFM XF 배지에서 확장된 세포는 섬유아세포와 같은 방추형 형태가 약간 더 길었고, 그 결과 혈청 함유 배지의 ~15μm에 비해 평균 ~17μm의 약간 더 큰 세포 크기(그림 2B)를 나타냈습니다. 세 계대에 걸친 두 배지 조건에서 WJ-hMSC는 ~2.3 x 104 cells/cm2의 최대 세포 밀도와 ~34h의 집단 배가 시간에 일관되게 도달했습니다(그림 2C,D).
폐쇄형 시스템에서 대규모 WJ-hMSC 확장을 위해 먼저 4층 플라스크에서 WJ-hMSC의 시드 트레인 확장을 수행한 후 10층 다층 플라스크에서 수행했습니다. 배양 4일 후 약 80%-90% 밀도에서 4층 및 10층 스택에 대해 각각 9.6 x 10 7 ± 0.9 x 107 및 2.3 x 10 8 ± 0.2 x 108 세포를 수확했습니다. T-175 플라스크에 비해 3.6 x 10 4-3.8 x 104 cells/cm2의 더 높은 세포 밀도에 도달했으며, 이는 스택이 최대 7배까지 더 나은 세포 확장을 허용했음을 의미합니다.
또한, 10층 배양 용기에서 확장된 WJ-hMSC를 역류 원심분리를 사용하여 직접 수확했습니다. 일회용 키트에 대한 멸균 연결은 기기의 연동 펌프를 사용하여 최대 165mL/분의 유속으로 유체를 직접 전달하기 위해 쉽게 설정할 수 있었습니다. 반자동 세포 수확 공정은 먼저 효소 해리를 사용하여 세포를 수확하고, 부피 감소 및 농축을 위해 세포를 역류 챔버에 로딩한 다음, 역류 원심분리 챔버 부피의 약 3배인 세척 완충액으로 세척함으로써 달성되었습니다. 또한, 세척된 세포를 농축하고, 프로토콜에 미리 설정된 원하는 수확량으로 수확하였다. 반자동 세포 처리에 사용되는 처리 단계는 수동 수확 워크플로를 에뮬레이션하도록 설계되었습니다. 부피를 10배 감소시켜 530만 cells/mL에 달하는 세포 농도를 생성했습니다. 이 프로토콜은 세 가지 독립적인 실행 모두에 대해 일관되게 ~98%에서 높은 세포 회수율과 ~99%에서 높은 세포 생존율을 달성할 수 있었습니다(그림 3A-C).
우리는 수동 원심분리와 비교하여 역류 원심분리를 사용하여 세포 수확의 중요한 품질 특성을 결정하기 위해 광범위한 세포 특성화 분석을 수행했습니다. WJ-hMSCs의 정체를 시험하기 위해, 세포 표면 마커를 유세포 분석에 의해 분석하였다. 도 4A에 나타낸 바와 같이, 두 가지 방법을 사용하여 수확된 WJ-hMSC는 ISCT 규정에 따라 특징적인 표면 마커 프로파일, CD73, CD90 및 CD105의 양성 발현 및 CD34 및 CD45의 음성 발현을 나타냈다. 다음으로, WJ-hMSCs의 클론 생성 가능성을 평가하기 위해, CFU-F 분석을 수행하였다. 도 4B에 나타낸 바와 같이, 역류 원심분리로부터 수확된 세포는 수동 원심분리에 의해 수확된 세포와 비교하여 유사한 CFU-F 전위를 나타내었다 (각각 21% ± 1% 대 20% ± 1%). 또한, 도 4C에 나타난 바와 같이, 역류 후 원심분리-수확된 세포는 수동 원심분리 방법에서의 세포와 유사한 지방세포, 조골세포 및 연골세포로 분화하는 능력을 유지하였다. 마지막으로, 우리는 다중 면역 분석법을 사용하여 세포의 18 가지 사이토 카인 분비 프로파일을 조사했습니다. 도 4D에 나타낸 바와 같이, 역류 후 원심분리를 사용하여 세포를 세척하고 농축한 후 사이토카인 분비 프로파일을 유지했으며, 프로파일은 세포 세척/농축 전에 채취한 샘플의 프로파일과 비슷했습니다(역류 전 원심분리).
전반적으로, 당사는 SFM XF 배양 시스템에서 효율적인 hMSC 확장을 입증했으며, 폐쇄형 자동 역류 원심분리 시스템을 사용하여 세척 및 농축된 세포는 세척 후 높은 세포 회수율과 생존력을 산출했으며 표현형과 기능을 유지할 수 있었습니다. 이 연구에서 개발된 폐쇄형 반자동 공정은 세 번의 독립적인 실행에서 입증된 바와 같이 최종 WJ-MSC 회수 측면에서 제품 품질 일관성을 제공할 수 있습니다.

그림 1: hMSC의 수확, 세척 및 농축을 위한 고유량 일회용 키트 구성 및 조립 . (A) 백이 각 튜브와 일직선으로 연결된 후의 키트 다이어그램. (B) 맞춤형 튜빙 어셈블리와 함께 고유량 일회용 키트에 연결된 10층 다층 플라스크. (C) 역류 원심분리 소프트웨어의 그래픽 사용자 인터페이스에서 활성화된 카메라 기능을 통해 역류 챔버에 형성된 안정적인 유동 세포 베드의 시각화. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 혈청 함유 배지와 SFM XF 배지에서 hMSC의 세포 형태 및 확장 비교. (A) 고전적 혈청 배지 및 SFM XF 배지에서 hMSC의 대표적인 세포 형태. SFM XF 확장 세포는 더 긴 방추형 특징적인 섬유아세포와 유사한 형태를 보인 반면, 혈청 함유 배지에서 성장한 세포는 더 평평한 형태를 나타냈습니다. (B) 자동 세포 계수기(n=3)에 의해 측정된 혈청 함유 배지와 SFM XF 배지 사이의 평균 MSC 크기. SFM XF 확장 세포가 일반적으로 다른 계대에서 혈청 확장 세포보다 더 컸다는 것을 분명히 알 수 있습니다. 상이한 계대(n=3)에서의 총 세포 수율 (C) 배양 표면적당 세포 및 (D) 개체군 배가 수준. 서로 다른 계대에 걸쳐 SFM XF 배지와 혈청 함유 배지 간에 유사한 수준의 세포 수율이 얻어졌습니다. 데이터는 평균± 표준편차로 표현됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
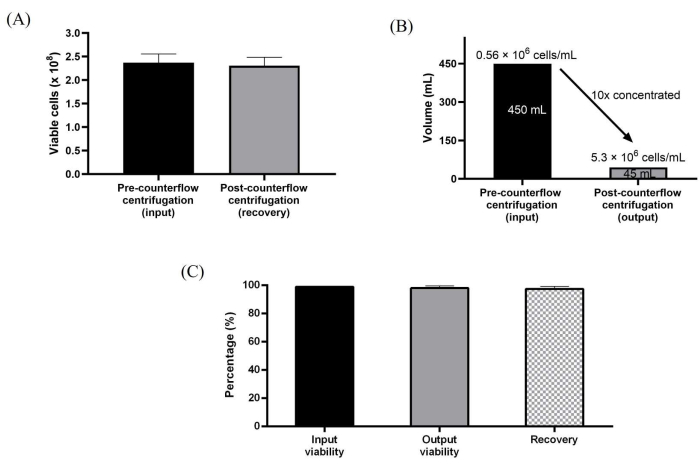
그림 3: 역류 원심분리 시스템을 사용하여 처리된 세포의 특성 분석 . (a) 세척 전후의 총 생존 세포 및 농축. (B) 10배 부피 감소는 역류 원심분리 처리 후 달성되었습니다. (C) 세포의 총 회수율 및 생존력. 데이터는 세척 및 농축 실행의 3번의 생물학적 복제(n = 3)에 대해 평균화됩니다. 데이터는 평균 ± 표준 편차로 표현됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 중요한 품질 속성 분석. (A) 유세포 분석의 대표 데이터. (B) 총 CFU를 보여주는 대표 이미지. (C) 삼계통 분화의 대표적인 현미경 이미지. (d) 역류 원심분리 시스템 상에서 세포를 처리하기 전과 후의 사이토카인 발현 분석 결과(n=3). 데이터는 평균 ± 표준 편차로 표현됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 초기 프라이밍 단계를 포함하는 역류 원심분리 시스템 상의 트립신 처리, 세척 및 농축 프로토콜에 의한 hMSC 수확의 순서. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
이 작업에서 우리는 역류 원심분리 기기를 사용하여 hMSC 해리를 닫고 반자동화하고 벤치에서 세척 및 수확하는 능력을 보여주었습니다. 전체 워크플로에서 중요한 단계 중 하나는 역류 원심분리 시스템 프로토콜 빌더에 정의된 사전 설정 프로토콜에 따라 튜빙이 연결되었는지 확인하는 것입니다. 설정 및 작동이 간단하며 키트 조립에서 세포 수확까지 10층 플라스크에서 약 2L의 배양을 처리하는 데 걸린 시간은 약 60분이었습니다. 이 워크플로우의 제한 단계 중 하나는 다층 플라스크에서 역류 원심분리 기기에 연결된 이송 백으로 유체를 이송하는 것입니다. 고유량 일회용 키트는 최대 165mL/분의 유속에서만 작동할 수 있으며, 예를 들어 40층 플라스크를 처리하는 데 어려움이 있을 수 있습니다. 유체 이송 과정을 가속화하기 위해 외부 고유량 펌프를 사용하여 트립신 처리된 내용물을 먼저 이송 백으로 이송한 다음 역류 원심분리 시스템을 사용하여 이송 백에서 세포를 세척/농축 및 수확할 수 있습니다. 또한, 이 프로토콜은 4층에서 10층 다층 플라스크로 세포를 계대배양하는 데에도 적용할 수 있습니다. 더 상류에서, 역류 원심분리 시스템은 또한 해동된 hMSC의 세척과 종자 트레인을 시작하기 위해 다층 플라스크에 직접 수확 및 배지 제형을 최적화할 수 있습니다. 역류 원심분리 챔버에서 유동층을 형성하는 데 필요한 최소 셀 수는 약 3천만 개의 셀이며, 배치당 처리할 최대 권장 부피는 20L입니다.
현재, 생물 안전 캐비닛의 다층 플라스크에 맞춤형 튜브 어셈블리를 부착하고 구성 요소 부품의 오토클레이빙은 cGMP 설정에서 바람직하지 않습니다. 대안으로, 맞춤형 감마선 멸균 튜빙 어셈블리를 공급업체에 아웃소싱할 수 있습니다. 다층 플라스크를 제공하는 공급업체는 또한 0.2μm 필터를 포함하여 원하는 튜브 어셈블리로 플라스크를 사전 장착하고 전체 복장의 감마선 멸균을 할 수 있는 옵션을 제공합니다. 이렇게 하면 다층 플라스크와 부착된 튜브가 실제로 닫히게 되며, 이는 클래스 C 클린룸 설정의 벤치에서 프로세스를 완료할 수 있음을 의미합니다.
역류 원심분리 시스템을 활용한 이 공정은 다층 용기의 부착 기반 배양 세포에 국한되지 않으며 동적(교반 탱크 또는 파동 생물반응기) 및 정적(가스 투과성) 현탁액 기반 세포 확장 플랫폼에 적용할 수 있습니다. 특히, 3D 마이크로캐리어 배양에서 확장된 hMSC의 경우, 역류 원심분리 시스템에서 프로토콜을 최적화하여 마이크로캐리어에서 해리된 hMSC를 수확, 세척 및 공식화할 수 있습니다.
전반적으로, 공정 견고성과 신뢰성이 향상된 번역 세포 치료법 개발에 대한 관심이 높아짐에 따라 폐쇄형 자동 세포 처리 플랫폼이 개발되었습니다. 이러한 시스템은 취급 단계의 수를 줄이고, 멸균 연결부에 의한 잠재적 오염을 방지하며, 노동력을 줄이고 클린룸 공간(21)의 효과적인 사용을 향상시킴으로써 제조 비용을 절감하기 때문에 필수적이다. 이에 따라, 치료법을 번역하기 위해 규제 승인을 받고자 하는 많은 세포치료제 개발자들은 공정 개발 단계(14,31,32)부터 공정을 종료하고 완전 자동화 또는 반자동화를 구현하는 것의 중요성을 인식하고 있다.
규제 친화적인 SFM XF 배지를 사용하고 21 CFR GMP Part 11 및 국제 품질 지침을 준수하는 보조 시약과 함께 이 반자동 공정은 임상 제조에 매우 적합합니다. 우리는 폐쇄 공정의 재현성과 WJ-MSC의 품질 유지를 보여주었습니다. 다층 플라스크에서 부착 기반 세포를 배양하는 효율성과 안전성을 개선하면 hMSC 치료 분야뿐만 아니라 세포주 은행 및 부착 바이러스 생산 회사에도 도움이 될 것입니다.
공개
P.J., A.B., R.L. 및 J.N.은 Thermo Fisher Scientific의 직원입니다. A.L.과 S.O.는 이해 상충이 없습니다.
감사의 말
저자는 싱가포르 A*STAR의 IAF-PP(Industry Alignment Fund Pre-Positioning) 자금(H18/01/a0/021 및 H18/AH/a0/001)의 지원에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 2L PVC transfer bag | TerumoBCT | BB*B200TM | |
| Alcian blue solution, pH 2.5 | Merck | 101647 | |
| Alizarin-Red Staining Solution | Merck | TMS-008-C | |
| APC anti-human CD73 Antibody | Biolegend | 344015 | |
| APC Mouse IgG1, κ Isotype Ctrl (FC) Antibody | Biolegend | 400121 | |
| Bio-Plex MAGPIX Multiplex Reader | Bio-Rad | ||
| Counterflow Centrifugation System | Thermo Fisher Scientific | A47679 | Gibco CTS Rotea Counterflow Centrifugation System |
| Crystal Violet | Sigma-aldrich | C0775 | |
| CTS (L-alanyl-L-glutamine) GlutaMAX supplement | Thermo Fisher Scientific | A1286001 | |
| CTS Dulbecco's phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | A1285601 | no calcium, no magnesium |
| CTS Recombinant Human Vitronectin (VTN-N) | Thermo Fisher Scientific | A27940 | |
| CTS TrypLE Select Enzyme | Thermo Fisher Scientific | A1285901 | |
| Custom tubing assembly | Saint-Gobain and Colder Product Company (CPC) | N/A | Gamma-sterilized 3/32” ID PVC line fitted with a sterile male MPC (1/8” barb) and sealed on the other end. Autoclave a short C-Flex line fitted with a sterile Cell Factory port connector on one end and a female MPC (3/8” barb) on the other. Connect the PVC and C-Flex lines in a biosafety cabinet |
| Emflon II capsule (0.2um filter) | Pall | KM5V002P2G100 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | 12662029 | Mesenchymal stem cell-qualified, USDA-approved regions |
| FGF-basic | Thermo Fisher Scientific | PHG0024 | |
| FITC anti-human CD105 Antibody | Biolegend | 323203 | |
| FITC anti-human CD45 Antibody | Biolegend | 304005 | |
| FITC anti-human CD90 (Thy1) Antibody | Biolegend | 328107 | |
| FITC Mouse IgG1, κ Isotype Ctrl (FC) Antibody | Biolegend | 400109 | |
| Hi-Flow Single Use Kit | Thermo Fisher Scientific | A46575 | Gibco CTS Rotea Hi-flow single-use kit, flow rate of 30 – 165 mL/min |
| Multi-layered systems | Thermo Fisher Scientific | 140360 (4-layers); 140410 (10-layers) | Nunc Standard Cell Factory Systems |
| NucleoCounter NC-3000 | Chemometec | NC-3000 | |
| Oil red O staining solution | Merck | 102419 | |
| PDGF-BB | Thermo Fisher Scientific | PHG0045 | |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | |
| PerCP anti-human CD34 Antibody | Biolegend | 343519 | |
| PerCP Mouse IgG1, κ Isotype Ctrl Antibody | Biolegend | 400147 | |
| ProcartaPlex Multiplex Immunoassays | Thermo Fisher Scientific | Custom 19-Plex panel: FGF-2, HGF, IDO, IL-10, IL-1RA, IL-6, IL-8, IP-10, MCP-1, MCP-2 , MIP-1α, MIP-1β, MIP-3α, PDGF-BB, RANTES, SDF-1α, TGFα, TNF-alpha, VEGF-A | |
| Sample port | Thermo Fisher Scientific | A50111 | Gamma-sterilized leur sample port with 2 PVC lines attached |
| StemPro Adipogenesis Differentiation Kit | Thermo Fisher Scientific | A10070-01 | |
| StemPro Chondrocyte Differentiation | Thermo Fisher Scientific | A10071-01 | |
| StemPro Custom MSC SF XF Medium Kit (SFM XF medium) | Thermo Fisher Scientific | ME20236L1 | Contains StemPro MSC SFM Basal Medium and Custom MSC SF XF Supplement (100x) |
| StemPro Osteogenesis Differentiation Kit | Thermo Fisher Scientific | A10072-01 | |
| T175 Nunc EasYFlask | Thermo Fisher Scientific | 159910 | |
| T75 Nunc EasYFlask | Thermo Fisher Scientific | 156472 | |
| TGFβ1 | Thermo Fisher Scientific | PHG9204 | |
| WJ MSCs | PromoCell | (#C12971; Germany) | Human mesenchymal stem cells |
| αMEM media | Thermo Fisher Scientific | 12571063 | With nucleosides |
참고문헌
- Zhou, T., et al. Challenges and advances in clinical applications of mesenchymal stromal cells. Journal of Hematology & Oncology. 14 (1), 24(2021).
- García-Bernal, D., et al. The current status of mesenchymal stromal cells: Controversies, unresolved issues and some promising solutions to improve their therapeutic efficacy. Frontiers in Cell and Developmental Biology. 9, 650664(2021).
- Mastrolia, I., et al. Challenges in clinical development of mesenchymal stromal/stem cells: Concise review. Stem Cells Translational Medicine. 8 (11), 1135-1148 (2019).
- Jovic, D., et al. A brief overview of global trends in MSC-based cell therapy. Stem Cell Reviews and Reports. 18 (5), 1525-1545 (2022).
- Lechanteur, C., Briquet, A., Bettonville, V., Baudoux, E., Beguin, Y. MSC manufacturing for academic clinical trials: From a clinical-grade to a full GMP-compliant process. Cells. 10, 1320(2021).
- Fernández-Santos, M. E., et al. Optimization of mesenchymal stromal cell (MSC) manufacturing processes for a better therapeutic outcome. Frontiers in Immunology. 13, 918565(2022).
- Jossen, V., vanden Bos, C., Eibl, R., Eibl, D. Manufacturing human mesenchymal stem cells at clinical scale: Process and regulatory challenges. Applied Microbiology and Biotechnology. 102 (9), 3981-3994 (2018).
- Jayaraman, P., Lim, R., Ng, J., Vemuri, M. C. Acceleration of translational mesenchymal stromal cell therapy through consistent quality GMP manufacturing. Frontiers in Cell and Developmental Biology. 9, 648472(2021).
- Levy, O., et al. Shattering barriers toward clinically meaningful MSC therapies. Science Advances. 6 (30), (2020).
- Fričová, D., Korchak, J. A., Zubair, A. C. Challenges and translational considerations of mesenchymal stem/stromal cell therapy for Parkinson's disease. npj Regenerative Medicine. 5 (1), 20(2020).
- Childs, P. G., Reid, S., Salmeron-Sanchez, M., Dalby, M. J. Hurdles to uptake of mesenchymal stem cells and their progenitors in therapeutic products. Biochemical Journal. 477 (17), 3349-3366 (2020).
- James, D. How short-term gain can lead to long-term pain. Cell & Gene Therapy Insights. 3 (4), 271-284 (2017).
- Ochs, J., Barry, F., Schmitt, R., Murphy, M. Advances in automation for the production of clinical-grade mesenchymal stromal cells: The AUTOSTEM robotic platform. Cell & Gene Therapy Insights. 3 (8), 739-748 (2017).
- Doulgkeroglou, M. N., et al. Automation, monitoring, and standardization of cell product manufacturing. Frontiers in Bioengineering and Biotechnology. 8, 811(2020).
- Chen, A. K. -L., Reuveny, S., Oh, S. K. W. Application of human mesenchymal and pluripotent stem cell microcarrier cultures in cellular therapy: Achievements and future direction. Biotechnology Advances. 31 (7), 1032-1046 (2013).
- Couto, P. S., Bersenev, A., Rafiq, Q. A. Engineering Strategies for Regenerative Medicine. Fernandes, T. G., Diogo, M. M., Cabral, J. M. S. , Academic Press. Cambridge, MA. 33-71 (2020).
- Tsai, A. -C., Pacak, C. A. Bioprocessing of human mesenchymal stem cells: From planar culture to microcarrier-based bioreactors. Bioengineering. 8 (7), 96(2021).
- Cherian, D. S., Bhuvan, T., Meagher, L., Heng, T. S. P. Biological considerations in scaling up therapeutic cell manufacturing. Frontiers in Pharmacology. 11, 654(2020).
- Mizukami, A., Swiech, K. Mesenchymal stromal cells: From discovery to manufacturing and commercialization. Stem Cells International. 2018, 4083921(2018).
- Hassan, M., et al. Large-scale expansion of human mesenchymal stem cells. Stem Cells International. 2020, 9529465(2020).
- Li, A., et al. Advances in automated cell washing and concentration. Cytotherapy. 23 (9), 774-786 (2021).
- Mehta, S. Single-use centrifugation solution for volume reduction and cell washing process in cell therapy manufacturing. Cytotherapy. 16, Supplement 101(2014).
- Giancola, R., Bonfini, T., Iacone, A. Cell therapy: cGMP facilities and manufacturing. Muscles Ligaments and Tendons Journal. 2 (3), 243-247 (2012).
- Moutsatsou, P., Ochs, J., Schmitt, R. H., Hewitt, C. J., Hanga, M. P. Automation in cell and gene therapy manufacturing: From past to future. Biotechnology Letters. 41 (11), 1245-1253 (2019).
- Iancu, E. M., Kandalaft, L. E. Challenges and advantages of cell therapy manufacturing under Good Manufacturing Practices within the hospital setting. Current Opinion in Biotechnology. 65, 233-241 (2020).
- Li, A., James, D., Lim, R. The Gibco™ CTS™ Rotea™ system story-A case study of industry-academia collaboration. Gene Therapy. , (2021).
- Li, A., et al. Improving cell viability using counterflow centrifugal elutriation. Cytotherapy. 24 (6), 650-658 (2022).
- Li, A., et al. Automated counterflow centrifugal system for small-scale cell processing. Journal of Visualized Experiments. (154), e60423(2019).
- Shah, D., Naciri, M., Clee, P., Al-Rubeai, M. NucleoCounter-An efficient technique for the determination of cell number and viability in animal cell culture processes. Cytotechnology. 51 (1), 39-44 (2006).
- Chan, A. K. C., Heathman, T. R. J., Coopman, K., Hewitt, C. J. Multiparameter flow cytometry for the characterisation of extracellular markers on human mesenchymal stem cells. Biotechnology Letters. 36 (4), 731-741 (2014).
- Smith, D., et al. Towards automated manufacturing for cell therapies. Current Hematologic Malignancy Reports. 14 (4), 278-285 (2019).
- Stroncek, D. F., Somerville, R. P. T., Highfill, S. L. Point-of-care cell therapy manufacturing; it's not for everyone. Journal of Translational Medicine. 20 (1), 34(2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유