Method Article
Обработка мезенхимальных стволовых клеток человека для клинического применения с использованием закрытого полуавтоматизированного рабочего процесса
В этой статье
Резюме
Здесь мы представляем протокол сбора адгезивных клеток из многослойных колб закрытым полуавтоматическим способом с использованием системы противоточного центрифугирования. Этот протокол может быть применен для сбора как адгезивных, так и суспензионных ячеек с других платформ расширения ячеек с небольшими изменениями существующих этапов.
Аннотация
Мезенхимальные стволовые клетки человека (МСК) в настоящее время изучаются в качестве перспективного клеточного терапевтического метода лечения различных заболеваний, и в течение следующих нескольких лет ожидается больше одобрений рынка для клинического использования. Чтобы облегчить этот переход, решающее значение имеет устранение узких мест, связанных с масштабом, воспроизводимостью от партии к партии, стоимостью, соблюдением нормативных требований и контролем качества. Эти проблемы можно решить, закрыв процесс и внедрив автоматизированные производственные платформы. В этом исследовании мы разработали закрытый и полуавтоматизированный процесс пассажирования и сбора хМСК, полученных из желе Уортона (WJ) (WJ-hMSCs), из многослойных колб с использованием противоточного центрифугирования. WJ-hMSCs были расширены с использованием совместимой с нормативными требованиями безсывороточной среды без ксено (SFM XF), и они показали сопоставимую пролиферацию клеток (удвоение популяции) и морфологию с WJ-hMSCs, расширенными в классических средах, содержащих сыворотку. Наш закрытый полуавтоматический протокол сбора показал высокое извлечение клеток (~98%) и жизнеспособность (~99%). Клетки, промытые и сконцентрированные с помощью противоточного центрифугирования, поддерживали экспрессию поверхностных маркеров WJ-hMSC, колониеобразующие единицы (КОЕ-F), потенциал дифференцировки трилинейных и профили секреции цитокинов. Полуавтоматический протокол сбора клеток, разработанный в исследовании, может быть легко применен для мелкой и среднемасштабной обработки различных адгезивных и суспензионных ячеек путем прямого подключения к различным платформам расширения клеток для уменьшения объема, промывки и сбора урожая с низким выходным объемом.
Введение
Мезенхимальные стволовые клетки человека (МСК) являются отличным кандидатом для клинического применения, как в тканевой инженерии, так и в клеточной терапии, учитывая их терапевтический потенциал и высокий потенциал самообновления для роста in vitro, которые имеют решающее значение для получения клинически значимых доз клеток 1,2,3. По данным ClinicalTrials.gov, в настоящее время проводится более 1,000 клинических испытаний различных заболеваний4. На фоне растущего интереса к использованию hMSCs в ближайшем будущем неизбежны новые клинические испытания и одобрения рынка 5,6. Тем не менее, производство hMSC имеет много неотъемлемых проблем с точки зрения вариабельности от партии к партии, использования сырья с высоким риском, опасений по поводу загрязнения из-за многих открытых и ручных процессов, поскольку производство включает в себя несколько единичных операций, более высокие затраты на рабочую силу, стоимость масштабирования или масштабирования, а также нормативные препятствия 6,7,8,9,10, 11,12. Эти вопросы по-прежнему являются серьезным препятствием для доступа к нынешним и будущим рынкам.
Разработка закрытых, модульных, автоматизированных производственных решений и использование вспомогательных реагентов с низким уровнем риска позволят решить эти проблемы. Это также обеспечит стабильное качество продукции, снизит вероятность сбоев партии из-за человеческой ошибки, снизит затраты на рабочую силу и улучшит стандартизацию процессов и соответствие нормативным требованиям, например, с точки зрения цифрового учета партий 8,12,13,14. Чтобы иметь возможность получить клинически значимую дозировку клеток, будь то аутологичная или аллогенная доза, решающее значение имеет оптимизированное производство, которое включает в себя расширение клеток вверх по течению и последующую обработку в закрытом, автоматизированном режиме.
Для расширения hMSC в настоящее время используются два наиболее распространенных метода производства: горизонтальное масштабирование (2D-монослой) и масштабирование (система суспензии на основе 3D-микронесущих)15,16,17,18. Наиболее традиционным и широко распространенным методом расширения hMSC является 2D-монослойная культура из-за низкой стоимости производства и простоты настройки19.
Многослойные колбы, состоящие из лотков с плоской поверхностью, уложенных в культуральный сосуд, обычно используются для масштабирования производства hMSC. Эти системы обычно поставляются в емкостях для культивирования от 1 до 40 слоев20 и обрабатываются вручную внутри шкафов биобезопасности. Этапы обработки во время прохождения и сбора клеток включают ручное дозирование и декантацию расширительной среды, диссоциативного реагента и буфера для промывки путем пипетирования или физического наклона всего сосуда. Кроме того, работа с несколькими устройствами является сложной задачей и отнимает много времени из-за их огромных размеров и веса.
Впоследствии, послеуборочная обработка из многослойных колб, центрифугирование для замены среды, промывка ячеек и уменьшение объема являются важными этапами всего рабочего процесса21 производства ячеек. Обычное настольное центрифугирование представляет собой в основном открытый и ручной процесс, который включает в себя множество этапов, таких как перенос клеточной суспензии в закрытые пробирки или бутылки внутри шкафа биобезопасности, вращение клеток, ручная аспирация надосадочной жидкости, ресуспендирование клеток с буфером и повторная промывка клеток. Это значительно увеличивает как риск загрязнения из-за открытия и закрытия крышек, так и вероятность потери клеточного гранулирования во время процесса ручной аспирации/пипетирования22. В контексте работы с многослойными системами культивирования адгезивных клеток, таких как hMSCs, оператору необходимо будет пройти трудоемкий процесс многократного перемещения между центрифугой и шкафом биобезопасности и одновременного обращения с тяжелой установкой. Эти ручные действия трудоемки, представляют риск с точки зрения человеческих ошибок и загрязнения и должны выполняться в чистых помещениях класса B, что является дорогостоящим23. Кроме того, обычный процесс ручного центрифугирования не является масштабируемым и может вызвать клеточный сдвиг и напряжение; Таким образом, максимизация извлечения клеток, жизнеспособности и эффективности вымывания остаточных примесей являются другими серьезными проблемами22. Коммерческое производство клеточной терапии в масштабе cGMP требует закрытых модульных решений автоматизации для снижения риска загрязнения, обеспечения стабильного качества продукции, снижения затрат на рабочую силу и производства, а также повышения надежности процесса24,25. Многослойные колбы могут обрабатываться как закрытая система, имея стерильный фильтр 0,2 мкм в одном из портов для облегчения стерильного газообмена и второй порт, асептически соединенный через разъемы или приваренный трубкой непосредственно к автоматизированному инструменту обработки клеток для сбора клеток. Мы работали над закрытием и автоматизацией большинства этапов прохождения и сбора WJ-hMSC, оценивая инновационную закрытую противоточную центрифугу, предназначенную для производства продуктов на клеточной, генной или тканевой основе. Эта противоточная центрифуга также обладает гибкостью для выполнения различных задач обработки клеток, таких как разделение клеток на основе размера, обмена средой / буфером, концентрации и сбора для различных типов клеток 8,26,27,28. В приборе используется закрытый одноразовый комплект, который может быть стерильно соединен с помощью сварки труб или асептических соединителей для переноса мешков или может быть подключен непосредственно к любой платформе расширения по выбору.
В этом исследовании мы разработали специальный узел трубки, чтобы обеспечить закрытые стерильные соединения между одноразовым комплектом противоточного центрифугирования и многослойной колбой. Мы оптимизировали протокол для ферментативного отсоединения, промывки и сбора WJ-MSC из многослойной колбы полностью закрытым и полуавтоматическим способом за один прогон. Собранные WJ-hMSCs характеризовали по чистоте (анализ поверхностных маркеров) и активности (КОЕ-F, трехлинейная дифференцировка и профили секреции цитокинов), чтобы гарантировать, что конечный продукт соответствует критическим атрибутам качества (CQA) для высвобождения партии.
протокол
1. Подготовка питательных сред и покрытие культуральных сосудов
- Подготовка СМИ
- Состав классической среды, содержащей сыворотку: Приготовьте классическую среду, содержащую сыворотку, смешав αMEM (445 мл), эмбриональную бычью сыворотку (FBS) (50 мл) и 100x пенициллин-стрептомицин (5 мл).
- Подготовьте готовую среду SFM XF.
- Сделайте флакон объемом 500 мл, асептически добавив 5 мл добавки SFM XF (100x) и 5 мл 100x L-аланил-L-глютамина (см. Таблицы материалов) в базальную среду SFM XF (500 мл).
- Сделайте мешок для носителя объемом 2 л, асептически добавив 20 мл специальной добавки MSC SFM XF (100x) и 20 мл 100x L-аланил-L-глютамина (см. Таблицы материалов) в базальный средний мешок SFM XF (2 л), подключив шприц объемом 50 мл к соответствующему порту пакета.
ПРИМЕЧАНИЕ: Перед использованием в культуре добавьте факторы роста или цитокины (не поставляемые со средой) в полную среду SF XF: PDGF-BB (20 нг / мл), FGF basic (4 нг / мл) и TGFβ (0,5 нг / мл).
- Покрытие сосудов клеточных культур витронектином для использования с безсывороточными средами
- Разморозить запас витронектина (VTN-N; 0,9 мг/мл) при 4 °C.
- Используйте стерильный буферный физиологический раствор Dulbecco без кальция и магния (DPBS) для разбавления размороженного VTN-N до рабочей концентрации 5 мкг / мл.
ПРИМЕЧАНИЕ: Разбавляйте VTN-N непосредственно перед использованием и не храните разбавленный раствор витронектина. - Добавить 1 мл/10см2 разбавленного раствора ВТН-Н в соответствующий культуральный сосуд; Конечная концентрация составляет 0,5 мкг/см2. Например, добавить 7,5 мл разбавленного раствора ВТН-Н в колбу Т-75 (75 см2 ); добавить 17,5 мл разбавленного раствора ВТН-Н в колбу Т-175 (175см2); добавить 250 мл разбавленного раствора ВТН-Н в стандартную четырехслойную многослойную колбу (2,528см2); и добавить 630 мл разбавленного раствора VTN-N в 10-слойную многослойную колбу (6,320см2).
- В стерильных условиях сосуды инкубируют в течение 1 ч при комнатной температуре (ВТ).
ПРИМЕЧАНИЕ: Сосуд для культуры с покрытием можно хранить при температуре 4 °C до 1 недели. Оберните сосуд для культуры лабораторной пленкой, чтобы предотвратить его высыхание. Перед употреблением предварительно прогрейте сосуд с культурой до комнатной температуры не менее 1 ч. - Аспирируйте раствор ВТН-Н, выбросьте и сразу же добавьте достаточный объем питательной среды, чтобы предотвратить высыхание поверхности сосуда с покрытием.
ПРИМЕЧАНИЕ: Промывать сосуд культуры после удаления ВТН-Н не нужно.
2. Расширение WJ-hMSC
- Быстро разморозьте WJ-hMSCs (p2), поместив криовиал на водяную баню с температурой 37 °C; Медленно взбалтывайте флакон, пока содержимое не начнет размораживаться.
- После размораживания посев WJ-hMSCs в количестве 5 000 клеток/см2 в колбу T-175 (без покрытия VTN-N) и инкубацию в классической среде, содержащей сыворотку, при 37 ° C в увлажненной атмосфере 5% CO2 для расширения клеток. После двух проходов (p4) поместите расширенные клетки в желаемую среду для криоконсервации в качестве рабочего банка клеток (WCB).
- Проведите подсчет клеток с помощью автоматического счетчика клеток, следуя методу жизнеспособности и подсчета клеток, чтобы определить общее количество клеток, жизнеспособность клеток и размер клеток29.
- Из p4 культивируйте WJ-hMSCs в концентрации 5,000 клеток/см2 в колбах T-75 либо в классической среде, содержащей сыворотку, либо в среде SFM XF (используйте колбы с покрытием VTN-N со средой SFM XF).
- Поддерживайте клетки в обеих питательных средах в общей сложности три прохода (12 дней) и измеряйте расширение клеток (увеличение в разы) при каждом проходе, деля количество жизнеспособных клеток, подсчитанных в конце культивирования каждого пассажа, на количество жизнеспособных клеток в начале культуры (день посева клеток).
3. Расширение горизонтального масштабирования начального поезда
- Расширение WJ-hMSC в колбе Т-175
- Быстро разморозьте WJ-hMSCs при p4, поместив криовиал на водяную баню с температурой 37 °C; Медленно взбалтывайте флакон, пока раствор не начнет размораживаться.
- Засейте 5 000 ячеек/см2 в колбу T-175 с покрытием VTN-N. Дайте клеткам расти в инкубаторе при 37 ° C с 5% CO2.
- Заменяйте отработанную питательную среду каждые 2-3 дня свежеприготовленной предварительно подогретой полной средой SFM XF для оптимальной производительности и роста клеток.
- Обращение с многослойными колбами (рис. 1А, Б)
- Все асептические соединения должны выполняться в стерильной среде.
- Распакуйте многослойную колбу в шкаф биологической безопасности.
- Подсоедините предварительно стерилизованный воздушный фильтр (0,2 мкм) к одному отверстию, чтобы обеспечить сброс давления во время перекачки жидкости с помощью противоточной центрифуги.
- Вставьте многослойный соединитель колбы из специального набора трубок в другой порт (рис. 1B).
- Приварите линию ПВХ специального набора труб к пакету для переноса ПВХ объемом 2 л, содержащему полную среду SFM XF.
ПРИМЕЧАНИЕ: Полностью перемешайте средний мешок, прежде чем добавлять его в многослойную систему под действием силы тяжести. Убедитесь, что мешок для переноса ПВХ висит выше, чем многослойная колба. - Поместите многослойную колбу на длинную сторону, с воздушным фильтром вверху (рис. 1B).
- Откройте зажим на трубке из ПВХ, чтобы начать заполнение многослойной колбы. Убедитесь, что среда находится на одном уровне между лотками во время наполнения.
- Как только среда полностью выровняется во всех лотках, переверните многослойную колбу на короткую сторону вертикальными портами.
- Закройте зажим на линии ПВХ и снимите передаточный мешок, заменив соединение трубки синей крышкой MPC.
ПРИМЕЧАНИЕ: Не снимайте воздушный фильтр, так как это обеспечивает газообмен во время расширения ячейки. - Переверните многослойную колбу в положение инкубации.
ПРИМЕЧАНИЕ: Фильтр и трубка должны быть обращены вверх. - Опорожните многослойную колбу, подключив ее к бутылке аспиратора; Поместите его над бутылкой аспиратора, и жидкость вытечет.
ПРИМЕЧАНИЕ: Наклоните многослойную колбу на бок, чтобы полностью слить отработанную среду под действием силы тяжести. В качестве альтернативы, отработанная среда может быть вылита в контейнер для отходов с помощью специального узла трубки. - Повторите шаги 3.2.5-3.2.11, чтобы пополнить свежую среду.
- Субкультура WJ-hMSCs в многослойной колбе (Т-175 > 4-слойная > 10-слойная)
- Предварительно подогретый реагент для диссоциации клеток (TrypLE) и полная среда SFM XF в инкубаторе с температурой 37 °C перед использованием.
- Отработавшую среду отдохните из колбы Т-175 и выбросьте.
- Промойте монослой ячейки предварительно подогретым DPBS, аспирируйте и выбросьте.
- Добавьте TrypLE в каждую колбу, обеспечьте полное покрытие монослоя клетки и инкубируйте в течение 5-10 минут при 37 ° C.
- Перенесите суспензию в стерильную коническую пробирку объемом 50 мл.
- Центрифугируйте пробирку при 100-200 x g в течение 5 мин при RT. Аспирируйте и выбросьте DPBS, будьте осторожны, чтобы не повредить гранулы клетки.
- Ресуспендируйте гранулы клеток в минимальном объеме (10 мл) предварительно разогретой полной среды SFM XF для подсчета клеток.
- Наполните четырехслойный культуральный сосуд с покрытием VTN-N примерно 800 мл полной среды SFM XF, как указано в разделе 2 выше. Добавьте 5 000 клеток/см2 (т.е. 1,26 x 107 жизнеспособных клеток/колбу). Аккуратно перемешайте суспензию ячейки, чтобы обеспечить равномерное распределение.
- Инкубировать в инкубаторе с температурой 37 °C с содержаниемСО2 5% в увлажненной атмосфере.
- Заменяйте отработанную питательную среду каждые 2-3 дня свежей, предварительно подогретой полной средой SFM XF для оптимального роста клеток до тех пор, пока клетки не достигнут слияния 60-80% или не будут готовы к субкультивированию в 10-слойную многослойную колбу.
- Наполните 10-слойную многослойную колбу с покрытием VTN-N примерно 2 л полной среды SFM XF, как указано в разделе 2. Добавьте 5 000 ячеек/см2 (т.е. 3,1 х 107 ячеек/колбу). Аккуратно перемешайте суспензию ячейки, чтобы обеспечить равномерное распределение.
- Инкубировать в инкубаторе с температурой 37 °C с содержаниемСО2 5% в увлажненной атмосфере.
- Заменяйте отработанную питательную среду каждые 2-3 дня свежей, предварительно подогретой полной средой SFM XF для оптимального роста клеток, пока клетки не достигнут слияния 60-80% или не будут готовы к сбору.
4. Закрытая полуавтоматическая диссоциация и сбор WJ-hMSC с использованием закрытого противоточного центрифугирования
- Одноразовый комплект противоточного центрифугирования в сборе
- Соедините одноразовый комплект с одноразовыми пакетами для переноса ПВХ с помощью сварки труб, аналогично конфигурации, показанной на рисунке 1A.
ПРИМЕЧАНИЕ: Расход одноразового комплекта по умолчанию составляет 30-165 мл / мин. - Прикрепите 10-слойную многослойную колбу , содержащую сливающиеся WJ-hMSCs, к нестандартному узлу трубки внутри шкафа биобезопасности.
- Перенесите прикрепленный 10-слойный сосуд для культивирования с изготовленным на заказ узлом трубки на стенд и приварите к линии E (3/32 в ПВХ ID) одноразового комплекта, как показано на рисунке 1B.
- Обязательно приварите стерильный порт для образца к линии G одноразового комплекта с высоким расходом.
- Затем подключите линию сбора урожая H к стерильному Luer, оснащенному шприцем объемом 50 мл.
ПРИМЕЧАНИЕ: На всех вышеперечисленных этапах убедитесь, что ручные зажимы закрыты, чтобы закрепить жидкость в каждом пакете комплекта.
- Соедините одноразовый комплект с одноразовыми пакетами для переноса ПВХ с помощью сварки труб, аналогично конфигурации, показанной на рисунке 1A.
- Настройка запуска прибора
- Включите прибор, включив тумблер на задней панели прибора.
- Подключите ноутбук к порту USB-C на приборе с помощью прилагаемого кабеля USB-C (рис. 1B).
- Запустите программное обеспечение графического пользовательского интерфейса (GUI) противоточной центрифуги с рабочего стола или из меню «Пуск».
- После входа в систему загрузите протокол, нажав кнопку « Выбрать протокол» на главной странице приветствия.
ПРИМЕЧАНИЕ: Протокол сбора противоточного центрифугирования (таблица 1) был создан с помощью программного обеспечения Protocol Builder и хранится локально. - Нажмите синюю кнопку разблокировки на приборе и откройте стеклянную дверцу.
- Загрузите собранный одноразовый комплект в систему противоточного центрифугирования.
- Начните с того, что повесьте пакеты, подвешенные на крючках вешалки, в порядке, который лучше всего совпадает с отверстиями трубок на пузырьковых сенсорных полосках, при этом 10-слойная многослойная колба расположена под углом, как показано на рисунке 1B.
- Совместите комплект с помощью двух кнопок расположения комплекта, растяните трубку насоса вокруг перистальтического насоса и вдавите белый разъем в форме колбы на место.
ПРИМЕЧАНИЕ: Убедитесь, что трубка над датчиком давления правильно размещена в направляющей трубки. - Прикрепите камеру центрифуги , подняв серебристый рычаг держателя камеры противоточной центрифуги и закрепив его, вернув рычаг в вертикальное положение.
- Вдавите трубку из каждого порта комплекта в дорожки вдоль пузырьковых сенсорных планок.
ПРИМЕЧАНИЕ: Убедитесь, что мешки не запутаны, чтобы можно было легко следовать протокольному процессу. - Закройте дверь, нажав на дверную защелку.
ПРИМЕЧАНИЕ: Зажимной рычаг насоса закроется, камера центрифуги начнет вращаться, а клапаны закроются. Не закрыв дверь, система не сможет инициировать и запустить протокол. - Нажмите кнопку «Инициировать » в графическом интерфейсе. Появится контрольный список; Первые четыре элемента — это проверки приборов, а последние два — проверки пользователя (убедитесь, что мешки и соединения соответствуют изображению комплекта, и убедитесь, что ручные зажимы открыты).
ПРИМЕЧАНИЕ: При проверке приборов красные крестики вместо синих галочек отображаются, если что-то не так. - Нажмите «Подтвердить», чтобы отобразить экран ввода протокола.
- Установите значение в диалоговом окне ввода данных (Объем сбора урожая) равным 45 мл и нажмите «Подтвердить».
ПРИМЕЧАНИЕ: На экране ввода протокола будет предложено, установлены ли какие-либо переменные входные данные в протоколе, созданном пользователем. Объем урожая устанавливается в качестве переменной в этом протоколе, и пользователь может выбрать тестирование различных объемов в зависимости от конечных требований к плотности ячеек. Минимальный объем урожая, который позволяет система, составляет 5 мл. Система позволяет установить не более четырех переменных данных для каждого протокола.
- Запуск протокола
- Нажмите « Инициировать » в графическом интерфейсе и нажмите зеленую кнопку «Пуск » на приборе, чтобы начать запуск протокола (см. Таблицу 1).
ПРИМЕЧАНИЕ: Система инициирует шаги в соответствии с протоколом, начиная с последовательности заливки, заменяя воздух в системе буфером. - После завершения грунтовки (таблица 1, шаг 8) убедитесь, что отработанная среда полностью откачана в мешок для отходов.
ПРИМЕЧАНИЕ: Как только 10-слойная многослойная колба опустеет, система предложит пользователю в графическом интерфейсе подтвердить, пуст ли сосуд. Нажмите кнопку «Пропустить» на приборе, если сосуд пуст; если нет, нажмите зеленую кнопку «Воспроизведение/Пауза», чтобы продолжить слив остатков жидкости из сосуда. - На этапах паузы 15, 19 и 22 (таблица 1) обязательно поднимите многослойную колбу и встряхните, чтобы буфер равномерно распределился по всем лоткам. После завершения поместите 10-слойную многослойную колбу обратно в исходное положение для рисования для следующих шагов.
ПРИМЕЧАНИЕ: Только для шага 19 в таблице 1 после встряхивания обязательно поместите многослойную колбу на плоское место и инкубируйте в течение 10-15 минут при RT для диссоциации клеток. - На шагах 20 и 23 (таблица 1) убедитесь, что трипсинизированные клетки полностью перенесены в промежуточный мешок.
- Хорошо перемешайте промежуточный мешок вручную на шаге 25 (таблица 1).
- На этапе 26 (таблица 1) используйте шприц Люера объемом 2 мл для отбора проб через порт для отбора проб.
ПРИМЕЧАНИЕ: Рекомендуется отбирать не менее трех проб для точного подсчета клеток. - На шагах 29 и 30 (таблица 1) проверьте стабильное образование слоя псевдоожиженной ячейки; он должен быть похож на слой псевдоожиженной ячейки, как показано на рисунке 1C.
ПРИМЕЧАНИЕ: Если стабильный слой кипящей ячейки не сформирован, как показано на рисунке 1C, оптимизация отношения перегрузки к скорости потока (G / F) имеет решающее значение для достижения стабильного слоя кипящей ячейки (высокое извлечение ячейки) в камере во время этапов загрузки и промывки ячейки. Соотношение G/F зависит от размера ячеек и плотности среды. Высокое соотношение G/F необходимо для буфера для образца/промывки высокой плотности, в то время как низкое соотношение G/F можно использовать для буфера для образца/промывки низкой плотности. - Прогон завершается на этапе «От рампы до остановки » (шаг 35 в таблице 1), и все значения защемления в системе противоточного центрифугирования автоматически закрываются.
ПРИМЕЧАНИЕ: Наконец, перед открытием дверцы убедитесь, что ручные зажимы закрыты, чтобы зафиксировать жидкость в каждом пакете для комплекта. - После завершения выполнения протокола нажмите синюю кнопку разблокировки на приборе и откройте стеклянную дверцу. Извлеките из прибора одноразовый набор с собранным концентратом.
- Асептически запечатайте линию сбора урожая с помощью ручного трубчатого запайщика. Осторожно перенесите запечатанный шприц, наполненный концентрированным клеточным сбором, в шкаф биологической безопасности для подсчета клеток и криоконсервации.
- Снова отсоедините камеру с помощью рычага, вытащите разъем лампы из штуцера, осторожно извлеките комплект и выбросьте в пакет с биологической опасностью.
- Очистите прибор салфетками с этанолом и обязательно закройте дверцу.
- Сначала закройте приложение с графическим интерфейсом, прежде чем выключать переключатель на задней панели прибора.
ПРИМЕЧАНИЕ: Протокол забора клеток был протестирован в биологических тройках (n = 3).
- Нажмите « Инициировать » в графическом интерфейсе и нажмите зеленую кнопку «Пуск » на приборе, чтобы начать запуск протокола (см. Таблицу 1).
5. Оценка критических атрибутов качества (CQA)
- Маркеры поверхности идентификации клеток (CD73, CD90 и CD105) и нестромальные маркеры (CD34 и CD45)
- Разбавьте собранную клеточную суспензию WJ-hMSC до концентрации 1 x 106 жизнеспособных клеток/мл, добавив соответствующий объем буфера проточной цитометрии (DPBS с 1% BSA или 2% FBS).
- Добавьте 100 мкл клеточной суспензии в каждую микроцентрифужную пробирку или 96-луночную пластину. Убедитесь, что на 100 мкл клеточной суспензии присутствует не менее 0,1 x 106 клеток.
- Добавьте флуорофор-конъюгированное антитело в образец в соответствующем разведении в соответствии с рекомендациями поставщика антител.
- Инкубировать 20 мин в темноте.
- После инкубации добавляют 100 мкл буфера для проточной цитометрии для промывки образцов центрифугированием при 380 х г в течение 3 мин.
- Выбросьте надосадочную жидкость, оставив гранулы.
- Ресуспендируют клеточную гранулу в 200 мкл буфера проточной цитометрии и подвергают анализу проточной цитометрии30.
- Фибробластический анализ колониеобразующих единиц (КОЕ-Ф)
- Разбавьте клеточную суспензию до концентрации 1000 жизнеспособных клеток/мл полной питательной среды.
- Планшет ~ 500 клеток на лунку в 6-луночном планшете для культивирования тканей в полной питательной среде.
- Инкубировать в течение 10-14 дней при 37 ° C в 5% увлажненном CO2, промыть PBS и окрасить 0,5% Crystal violet в метаноле в течение 30 мин при RT.
- Перечислите колонии в каждой лунке.
- Рассчитайте эффективность КОЕ-Ф: разделите количество образованных колоний на исходное число посева, чтобы получить процентную эффективность образования колоний, и выразите ее в процентах.
- Потенциал дифференциации трилинейных линий
- Засейте 5 x 103 клеток/см2 в среду для дифференцировки остеогенеза и адипогенеза в 12-луночные планшеты в соответствии с протоколом производителя. Для хондрогенеза готовят 1,6 х 107 жизнеспособных клеток/мл и генерируют микромассовые культуры путем посева 5 мкл капель клеточного раствора в центры лунок 96-луночных планшетов в соответствии с протоколом производителя.
- Во время дифференцировки делайте полную смену среды каждые 3-4 дня.
- Через 14 дней (для адипогенеза) или 21 день (для остеогенеза и хондрогенеза) контролируйте культуры на предмет дифференцировки с помощью биологических красителей, специфичных для линии, в соответствии с протоколом производителя. Для адипогенной дифференцировки окрашивают культуры 0,5% масляным раствором красного О. Для остеогенеза проводят окрашивание с использованием 2% раствора Alizarin Red S. Для хондрогенной дифференцировки окрашивайте гранулы микромассы 1% Alcian Blue.
- Профили секреции цитокинов
- Разморозьте криоконсервированные клетки, собранные вручную или с помощью системы противоточного центрифугирования, и засейте 5 000 клеток/см2 в колбу T-175 с фильтрующим материалом SFM XF.
- Через 4 дня соберите отработанную питательную среду и храните ее при температуре −80 °C до анализа.
- Количественно определите экспрессию цитокинов с помощью 19-плексного панельного набора профилей экспрессии цитокинов на мультиплексном считывателе.
- Выполняйте мультиплексные иммуноанализы в соответствии с рекомендациями производителя.
Результаты
Мастер-банк клеток WJ-hMSC (MCB) после размораживания поддерживался в течение трех последовательных пассажей (p1-p4) в классической среде, содержащей сыворотку, для получения достаточного количества рабочих банков клеток (WCB) для экспериментов. Р4 WCB размораживали и расширяли как в сывороткосодержащей среде, так и в среде SFM XF для еще трех пассажей (p4-p7) в колбах T-175. WJ-MSC хорошо адаптировались при расширении в среде SFM XF и были способны поддерживать стабильную пролиферацию, аналогичную таковой в среде, содержащей сыворотку (рис. 2A). Однако клетки, разросшиеся в среде SFM XF, демонстрировали несколько более длинную фибробластоподобную веретенообразную морфологию, что приводило к несколько большему размеру клеток (рис. 2B) в среднем ~ 17 мкм по сравнению с ~ 15 мкм в среде, содержащей сыворотку. В обеих срединных условиях через три прохода WJ-hMSC последовательно достигали максимальной плотности клеток ~ 2,3 x 104 клеток / см2 и времени удвоения популяции ~ 34 ч (рис. 2C, D).
Для крупномасштабного расширения WJ-hMSC в закрытой системе мы провели расширение затравочного поезда WJ-hMSC сначала в 4-слойной колбе, а затем в 10-слойной многослойной колбе. При слиянии около 80%-90% после 4 дней культивирования мы собрали 9,6 x 10 7 ± 0,9 x 107 и 2,3 x 10 8 ± 0,2 x 108 клеток для 4-слойных и 10-слойных стеков соответственно. Была достигнута более высокая плотность ячеек 3,6 x 10 4-3,8 x 104 ячейки/см2 по сравнению с колбами Т-175, что означает, что стеки позволяли лучше расширять ячейки до семи раз.
Кроме того, WJ-hMSCs, расширенные в 10-слойных культивальных сосудах, собирали непосредственно с использованием противоточного центрифугирования. Стерильное соединение с одноразовым комплектом было легко установить для прямой перекачки жидкости с максимальной скоростью потока 165 мл / мин с помощью перистальтического насоса прибора. Полуавтоматический процесс сбора клеток был достигнут путем сначала сбора клеток с использованием ферментативной диссоциации, загрузки клеток в противоточную камеру для уменьшения объема и концентрации, а затем промывки буфером для промывки, который примерно в 3 раза превышал объем камеры противоточного центрифугирования. Затем промытые клетки концентрировали и собирали до желаемого объема урожая, заданного в протоколе. Этапы обработки, используемые для полуавтоматической обработки клеток, были разработаны для имитации ручного рабочего процесса сбора урожая. Мы достигли 10-кратного уменьшения объема, в результате чего концентрация клеток достигла 5,3 миллиона клеток / мл. Протокол смог достичь высокого восстановления клеток на уровне ~ 98% и высокой жизнеспособности клеток на уровне ~ 99% последовательно для всех трех независимых запусков (рис. 3A-C).
Мы провели обширные анализы характеристик клеток, чтобы определить критические атрибуты качества урожая клеток с использованием противоточного центрифугирования по сравнению с ручным центрифугированием. Чтобы проверить идентичность WJ-hMSCs, маркеры клеточной поверхности были проанализированы с помощью проточной цитометрии. Как показано на рисунке 4A, WJ-hMSCs, собранные с использованием обоих методов, показали характерные профили поверхностных маркеров в соответствии с правилами ISCT, положительную экспрессию CD73, CD90 и CD105, а также отрицательную экспрессию CD34 и CD45. Далее для оценки клоногенного потенциала WJ-hMSCs были проведены анализы КОЕ-F. Как показано на рисунке 4B, клетки, собранные в противоточном центрифугировании, показали аналогичный потенциал КОЕ-F по сравнению с клетками, собранными ручным центрифугированием (21% ± 1% против 20% ± 1% соответственно). Кроме того, как показано на рисунке 4C, клетки, собранные после противоточного центрифугирования, сохранили способность дифференцироваться в адипоциты, остеобласты и хондроциты, аналогичные клеткам в методе ручного центрифугирования. Наконец, мы исследовали 18 различных профилей секреции цитокинов клеток с использованием мультиплексных иммуноанализов. Как показано на рисунке 4D, клетки, промытые и концентрированные с помощью центрифугирования после противотока, поддерживали профили секреции цитокинов, и профили были сопоставимы с профилями образца, взятого до промывки/концентрирования клеток (центрифугирование перед противотоком).
В целом, мы продемонстрировали эффективное расширение hMSC в системе культивирования SFM XF, а клетки, промытые и концентрированные с помощью закрытой автоматизированной системы противоточного центрифугирования, обеспечили высокое извлечение клеток и жизнеспособность после промывки и смогли сохранить их фенотип и функциональность. Закрытый полуавтоматический процесс, разработанный в этом исследовании, может обеспечить постоянство качества продукта с точки зрения окончательного извлечения WJ-MSC, о чем свидетельствуют три независимых запуска.

Рисунок 1: Конфигурация и сборка одноразового комплекта с высоким расходом для сбора, промывки и концентрирования hMSC . (A) Схема комплекта после того, как мешки были соединены на одной линии с соответствующей трубкой. (B) 10-слойная многослойная колба, соединенная с одноразовым комплектом с высоким расходом с помощью специального узла трубки. (C) Визуализация стабильного слоя псевдоожиженной ячейки, сформированного в противоточной камере, с помощью функции камеры, включенной в графическом пользовательском интерфейсе программного обеспечения противоточного центрифугирования. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Сравнение морфологии клеток и экспансии МСК в сыворотке, содержащей среду, и среду SFM XF. (A) Репрезентативная клеточная морфология hMSCs в классической сывороточной среде и среде SFM XF. Клетки, расширенные SFM XF, демонстрировали более длинную, веретенообразную, характерную фибробластоподобную морфологию, тогда как клетки, выращенные в среде, содержащей сыворотку, демонстрировали более уплощенную морфологию. (B) Средний размер МСК между средой, содержащей сыворотку, и средой SFM XF, измеренный с помощью автоматического счетчика клеток (n = 3). Ясно видно, что клетки, расширенные SFM XF, обычно были больше, чем клетки, расширенные сывороткой, в разных проходах. Общий выход клеток в разных пассажах (n = 3) (C) с точки зрения клеток на площадь поверхности культуры и (D) уровни удвоения популяции. Аналогичные уровни выхода клеток были получены между средой SFM XF и средой, содержащей сыворотку, в разных проходах. Данные выражаются в виде среднего значения ± стандартного отклонения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
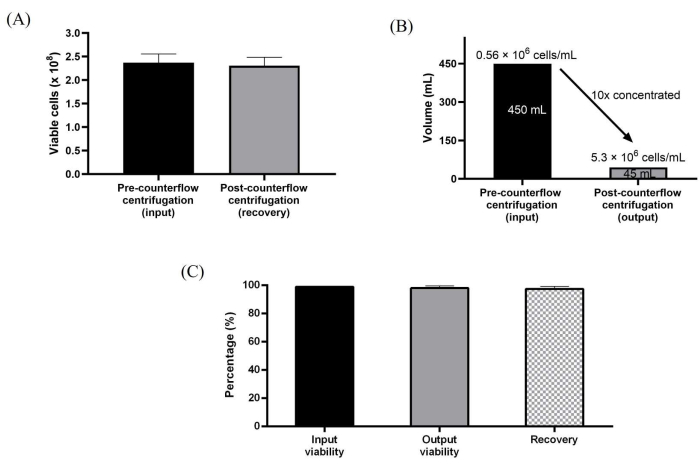
Рисунок 3: Характеристика клеток, обработанных с использованием системы противоточного центрифугирования . (A) Общее количество жизнеспособных клеток до и после промывки и концентрирования. (B) После обработки противоточным центрифугированием объем был достигнут в 10 раз. (C) Полное восстановление и жизнеспособность клеток. Данные усредняются по трем биологическим репликам (n = 3) промывки и концентрирования. Данные выражаются в виде среднего значения ± стандартного отклонения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Анализ критических атрибутов качества . (A) Репрезентативные данные проточной цитометрии. (B) Репрезентативные изображения, показывающие общее количество КОЕ. (C) Репрезентативные микроскопические изображения дифференциации трилинейных линий. (D) Результаты анализа экспрессии цитокинов до и после обработки клеток в системе противоточного центрифугирования (n = 3). Данные выражаются в виде среднего значения ± стандартного отклонения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Последовательность сбора hMSC путем трипсинизации, промывки и протокола концентрирования в системе противоточного центрифугирования, включая начальные этапы заливки. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
В этой работе мы показали возможность закрывать и полуавтоматизировать диссоциацию hMSC, а также промывку и сбор урожая на стенде с помощью прибора противоточного центрифугирования. Одним из важнейших шагов во всем рабочем процессе является обеспечение соединения трубок в соответствии с заданным протоколом, определенным в конструкторе протоколов противоточной центрифугирования. Настройка и эксплуатация просты, а время, необходимое для обработки около 2 л культуры из 10-слойной колбы от сборки комплекта до сбора клеток, составило около 60 минут. Одним из ограничивающих этапов этого рабочего процесса является перекачка жидкости из многослойной колбы в передаточные мешки, подключенные к прибору противоточного центрифугирования. Одноразовый комплект с высоким расходом может работать только при максимальной скорости потока 165 мл/мин, и это может быть сложно для обработки, например, 40-слойной колбы. Чтобы ускорить процесс перекачки жидкости, можно использовать внешние насосы с высокой скоростью потока для переноса трипсинизированного содержимого сначала в передаточный мешок, а затем для промывки/концентрирования и сбора клеток из передаточного мешка с использованием системы противоточного центрифугирования. Кроме того, этот протокол также может быть применен для прохода ячеек от 4-слойных до 10-слойных многослойных колб. Кроме того, система противоточного центрифугирования также может быть оптимизирована для промывки размороженных МСК и прямого сбора урожая и приготовления среды в многослойные колбы для запуска семенного конвейера. Следует отметить, что минимальное количество ячеек, необходимых для формирования кипящего слоя в камере противоточного центрифугирования, составляет примерно 30 миллионов ячеек, а максимальный рекомендуемый объем для обработки одной партии составляет 20 л.
В настоящее время крепление нестандартного узла трубки к многослойной колбе в шкафу биобезопасности и автоклавирование частей компонентов нежелательны в условиях cGMP. В качестве альтернативы сборка трубок с гамма-стерилизацией по индивидуальному заказу может быть передана на аутсорсинг поставщикам. Поставщики, поставляющие многослойные колбы, также предлагают возможность предварительной установки колб с желаемыми трубками в сборе, включая фильтр 0,2 мкм, и гамма-стерилизацию всего оборудования. Это гарантирует, что многослойные колбы и прикрепленные трубки будут действительно закрыты, а это означает, что процесс может быть завершен на стенде в чистом помещении класса C.
Этот процесс, использующий систему противоточного центрифугирования, не ограничивается культивируемыми клетками на основе адгезии в многослойном сосуде и может быть адаптирован к динамическим (биореакторы с перемешиваемым резервуаром или волновыми биореакторами) и статическим (газопроницаемым) платформам расширения клеток на основе суспензии. В частности, для hMSCs, расширенных в 3D-культурах микроносителей, протоколы могут быть оптимизированы в системе противоточного центрифугирования для сбора, промывки и составления hMSCs, диссоциированных из микроносителей.
В целом, растущий интерес к разработке трансляционной клеточной терапии с улучшенной устойчивостью и надежностью процесса привел к разработке закрытых автоматизированных платформ обработки клеток. Эти системы являются обязательными, поскольку они сокращают количество этапов обработки, предотвращают потенциальное загрязнение стерильными соединениями и снижают производственные затраты за счет сокращения трудозатрат и повышения эффективности использования пространства чистых помещений21. В соответствии с этим многие разработчики продуктов клеточной терапии, которые ищут одобрение регулирующих органов для перевода своих методов лечения, осознают важность закрытия процесса и внедрения полной автоматизации или полуавтоматизации уже на стадии разработки процесса 14,31,32.
С использованием дружественной к нормативным требованиям среды SFM XF и наряду со вспомогательными реагентами, соответствующими 21 CFR GMP Part 11 и международным рекомендациям по качеству, этот полуавтоматический процесс будет легко подходить для клинического производства. Показана воспроизводимость замкнутого процесса и поддержание качества МСК-МСК. Повышение эффективности и безопасности культивирования адгезивных клеток в многослойных колбах принесет пользу не только в области терапии МСК, но и в компаниях, занимающихся банковским обслуживанием клеточных линий и производством адгезивных вирусов.
Раскрытие информации
P.J., A.B., R.L. и J.N. являются сотрудниками компании Thermo Fisher Scientific. А.Л. и С.О. не имеют конфликта интересов.
Благодарности
Авторы выражают благодарность за поддержку со стороны Фонда предварительного позиционирования промышленности (IAF-PP) (H18/01/a0/021 и H18/AH/a0/001) от A*STAR, Сингапур.
Материалы
| Name | Company | Catalog Number | Comments |
| 2L PVC transfer bag | TerumoBCT | BB*B200TM | |
| Alcian blue solution, pH 2.5 | Merck | 101647 | |
| Alizarin-Red Staining Solution | Merck | TMS-008-C | |
| APC anti-human CD73 Antibody | Biolegend | 344015 | |
| APC Mouse IgG1, κ Isotype Ctrl (FC) Antibody | Biolegend | 400121 | |
| Bio-Plex MAGPIX Multiplex Reader | Bio-Rad | ||
| Counterflow Centrifugation System | Thermo Fisher Scientific | A47679 | Gibco CTS Rotea Counterflow Centrifugation System |
| Crystal Violet | Sigma-aldrich | C0775 | |
| CTS (L-alanyl-L-glutamine) GlutaMAX supplement | Thermo Fisher Scientific | A1286001 | |
| CTS Dulbecco's phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | A1285601 | no calcium, no magnesium |
| CTS Recombinant Human Vitronectin (VTN-N) | Thermo Fisher Scientific | A27940 | |
| CTS TrypLE Select Enzyme | Thermo Fisher Scientific | A1285901 | |
| Custom tubing assembly | Saint-Gobain and Colder Product Company (CPC) | N/A | Gamma-sterilized 3/32” ID PVC line fitted with a sterile male MPC (1/8” barb) and sealed on the other end. Autoclave a short C-Flex line fitted with a sterile Cell Factory port connector on one end and a female MPC (3/8” barb) on the other. Connect the PVC and C-Flex lines in a biosafety cabinet |
| Emflon II capsule (0.2um filter) | Pall | KM5V002P2G100 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | 12662029 | Mesenchymal stem cell-qualified, USDA-approved regions |
| FGF-basic | Thermo Fisher Scientific | PHG0024 | |
| FITC anti-human CD105 Antibody | Biolegend | 323203 | |
| FITC anti-human CD45 Antibody | Biolegend | 304005 | |
| FITC anti-human CD90 (Thy1) Antibody | Biolegend | 328107 | |
| FITC Mouse IgG1, κ Isotype Ctrl (FC) Antibody | Biolegend | 400109 | |
| Hi-Flow Single Use Kit | Thermo Fisher Scientific | A46575 | Gibco CTS Rotea Hi-flow single-use kit, flow rate of 30 – 165 mL/min |
| Multi-layered systems | Thermo Fisher Scientific | 140360 (4-layers); 140410 (10-layers) | Nunc Standard Cell Factory Systems |
| NucleoCounter NC-3000 | Chemometec | NC-3000 | |
| Oil red O staining solution | Merck | 102419 | |
| PDGF-BB | Thermo Fisher Scientific | PHG0045 | |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | |
| PerCP anti-human CD34 Antibody | Biolegend | 343519 | |
| PerCP Mouse IgG1, κ Isotype Ctrl Antibody | Biolegend | 400147 | |
| ProcartaPlex Multiplex Immunoassays | Thermo Fisher Scientific | Custom 19-Plex panel: FGF-2, HGF, IDO, IL-10, IL-1RA, IL-6, IL-8, IP-10, MCP-1, MCP-2 , MIP-1α, MIP-1β, MIP-3α, PDGF-BB, RANTES, SDF-1α, TGFα, TNF-alpha, VEGF-A | |
| Sample port | Thermo Fisher Scientific | A50111 | Gamma-sterilized leur sample port with 2 PVC lines attached |
| StemPro Adipogenesis Differentiation Kit | Thermo Fisher Scientific | A10070-01 | |
| StemPro Chondrocyte Differentiation | Thermo Fisher Scientific | A10071-01 | |
| StemPro Custom MSC SF XF Medium Kit (SFM XF medium) | Thermo Fisher Scientific | ME20236L1 | Contains StemPro MSC SFM Basal Medium and Custom MSC SF XF Supplement (100x) |
| StemPro Osteogenesis Differentiation Kit | Thermo Fisher Scientific | A10072-01 | |
| T175 Nunc EasYFlask | Thermo Fisher Scientific | 159910 | |
| T75 Nunc EasYFlask | Thermo Fisher Scientific | 156472 | |
| TGFβ1 | Thermo Fisher Scientific | PHG9204 | |
| WJ MSCs | PromoCell | (#C12971; Germany) | Human mesenchymal stem cells |
| αMEM media | Thermo Fisher Scientific | 12571063 | With nucleosides |
Ссылки
- Zhou, T., et al. Challenges and advances in clinical applications of mesenchymal stromal cells. Journal of Hematology & Oncology. 14 (1), 24 (2021).
- García-Bernal, D., et al. The current status of mesenchymal stromal cells: Controversies, unresolved issues and some promising solutions to improve their therapeutic efficacy. Frontiers in Cell and Developmental Biology. 9, 650664 (2021).
- Mastrolia, I., et al. Challenges in clinical development of mesenchymal stromal/stem cells: Concise review. Stem Cells Translational Medicine. 8 (11), 1135-1148 (2019).
- Jovic, D., et al. A brief overview of global trends in MSC-based cell therapy. Stem Cell Reviews and Reports. 18 (5), 1525-1545 (2022).
- Lechanteur, C., Briquet, A., Bettonville, V., Baudoux, E., Beguin, Y. MSC manufacturing for academic clinical trials: From a clinical-grade to a full GMP-compliant process. Cells. 10, 1320 (2021).
- Fernández-Santos, M. E., et al. Optimization of mesenchymal stromal cell (MSC) manufacturing processes for a better therapeutic outcome. Frontiers in Immunology. 13, 918565 (2022).
- Jossen, V., vanden Bos, C., Eibl, R., Eibl, D. Manufacturing human mesenchymal stem cells at clinical scale: Process and regulatory challenges. Applied Microbiology and Biotechnology. 102 (9), 3981-3994 (2018).
- Jayaraman, P., Lim, R., Ng, J., Vemuri, M. C. Acceleration of translational mesenchymal stromal cell therapy through consistent quality GMP manufacturing. Frontiers in Cell and Developmental Biology. 9, 648472 (2021).
- Levy, O., et al. Shattering barriers toward clinically meaningful MSC therapies. Science Advances. 6 (30), (2020).
- Fričová, D., Korchak, J. A., Zubair, A. C. Challenges and translational considerations of mesenchymal stem/stromal cell therapy for Parkinson's disease. npj Regenerative Medicine. 5 (1), 20 (2020).
- Childs, P. G., Reid, S., Salmeron-Sanchez, M., Dalby, M. J. Hurdles to uptake of mesenchymal stem cells and their progenitors in therapeutic products. Biochemical Journal. 477 (17), 3349-3366 (2020).
- James, D. How short-term gain can lead to long-term pain. Cell & Gene Therapy Insights. 3 (4), 271-284 (2017).
- Ochs, J., Barry, F., Schmitt, R., Murphy, M. Advances in automation for the production of clinical-grade mesenchymal stromal cells: The AUTOSTEM robotic platform. Cell & Gene Therapy Insights. 3 (8), 739-748 (2017).
- Doulgkeroglou, M. N., et al. Automation, monitoring, and standardization of cell product manufacturing. Frontiers in Bioengineering and Biotechnology. 8, 811 (2020).
- Chen, A. K. -. L., Reuveny, S., Oh, S. K. W. Application of human mesenchymal and pluripotent stem cell microcarrier cultures in cellular therapy: Achievements and future direction. Biotechnology Advances. 31 (7), 1032-1046 (2013).
- Couto, P. S., Bersenev, A., Rafiq, Q. A., Fernandes, T. G., Diogo, M. M., Cabral, J. M. S. . Engineering Strategies for Regenerative Medicine. , 33-71 (2020).
- Tsai, A. -. C., Pacak, C. A. Bioprocessing of human mesenchymal stem cells: From planar culture to microcarrier-based bioreactors. Bioengineering. 8 (7), 96 (2021).
- Cherian, D. S., Bhuvan, T., Meagher, L., Heng, T. S. P. Biological considerations in scaling up therapeutic cell manufacturing. Frontiers in Pharmacology. 11, 654 (2020).
- Mizukami, A., Swiech, K. Mesenchymal stromal cells: From discovery to manufacturing and commercialization. Stem Cells International. 2018, 4083921 (2018).
- Hassan, M., et al. Large-scale expansion of human mesenchymal stem cells. Stem Cells International. 2020, 9529465 (2020).
- Li, A., et al. Advances in automated cell washing and concentration. Cytotherapy. 23 (9), 774-786 (2021).
- Mehta, S. Single-use centrifugation solution for volume reduction and cell washing process in cell therapy manufacturing. Cytotherapy. 16, 101 (2014).
- Giancola, R., Bonfini, T., Iacone, A. Cell therapy: cGMP facilities and manufacturing. Muscles Ligaments and Tendons Journal. 2 (3), 243-247 (2012).
- Moutsatsou, P., Ochs, J., Schmitt, R. H., Hewitt, C. J., Hanga, M. P. Automation in cell and gene therapy manufacturing: From past to future. Biotechnology Letters. 41 (11), 1245-1253 (2019).
- Iancu, E. M., Kandalaft, L. E. Challenges and advantages of cell therapy manufacturing under Good Manufacturing Practices within the hospital setting. Current Opinion in Biotechnology. 65, 233-241 (2020).
- Li, A., James, D., Lim, R. The Gibco™ CTS™ Rotea™ system story-A case study of industry-academia collaboration. Gene Therapy. , (2021).
- Li, A., et al. Improving cell viability using counterflow centrifugal elutriation. Cytotherapy. 24 (6), 650-658 (2022).
- Li, A., et al. Automated counterflow centrifugal system for small-scale cell processing. Journal of Visualized Experiments. (154), e60423 (2019).
- Shah, D., Naciri, M., Clee, P., Al-Rubeai, M. NucleoCounter-An efficient technique for the determination of cell number and viability in animal cell culture processes. Cytotechnology. 51 (1), 39-44 (2006).
- Chan, A. K. C., Heathman, T. R. J., Coopman, K., Hewitt, C. J. Multiparameter flow cytometry for the characterisation of extracellular markers on human mesenchymal stem cells. Biotechnology Letters. 36 (4), 731-741 (2014).
- Smith, D., et al. Towards automated manufacturing for cell therapies. Current Hematologic Malignancy Reports. 14 (4), 278-285 (2019).
- Stroncek, D. F., Somerville, R. P. T., Highfill, S. L. Point-of-care cell therapy manufacturing; it's not for everyone. Journal of Translational Medicine. 20 (1), 34 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены