需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用于评估非酒精性脂肪肝进展的新型 体内 微计算机断层扫描成像技术
* 这些作者具有相同的贡献
摘要
使用饮食诱导的非酒精性脂肪性肝病(NAFLD)小鼠模型,我们 描述了使用新型 体内微型计算机断层扫描成像技术作为评估NAFLD进展阶段的非侵入性方法,主要关注肝血管网络,因为它显着参与NAFLD相关的肝失调。
摘要
非酒精性脂肪性肝病(NAFLD)是一个日益严重的全球健康问题,目前缺乏有效治疗方法加剧了NAFLD的影响。阻碍NAFLD的及时和准确诊断(包括分级)和监测以及潜在疗法开发的相当大的限制因素是目前在肝微环境结构表征和疾病分期评分方面的不足时空和非侵入性方式。使用饮食诱导的NAFLD小鼠模型,我们研究了 体内 显微计算机断层扫描(CT)成像技术作为评估NAFLD进展阶段的非侵入性方法的使用,主要集中在肝血管网络上,因为它显着参与NAFLD相关的肝脏失调。这种成像方法可以对肝脏脂肪变性和功能性组织摄取进行纵向分析,以及评估相对血容量、门静脉直径和血管网络密度。了解NAFLD进展过程中肝血管网络的适应性,并将其与使用所提出的方法表征疾病进展(脂肪变性,炎症,纤维化)的其他方法相关联,可以为建立新的,更有效的,可重复的方法铺平道路用于小鼠的NAFLD研究。该协议还有望提升临床前动物模型的价值,以研究针对疾病进展的新疗法的开发。
引言
非酒精性脂肪性肝病(NAFLD)是一种代谢性疾病,影响约25%的人口和>80%的病态肥胖人群1。据估计,这些人中有三分之一进展为非酒精性脂肪性肝炎(NASH),其特征是肝脂肪变性,炎症和纤维化2。NASH是一个疾病阶段,发生肝硬化和肝细胞癌(HCC)的风险明显更高3,4。因此,NASH是目前肝移植的第二大常见原因,也有望很快成为肝移植最重要的预测因子5,6,7。尽管其患病率和严重程度,但没有针对NAFLD的疾病特异性疗法,现有的治疗方法仅旨在解决与疾病相关的病理,例如胰岛素抵抗和高脂血症5,6。
近年来,内皮细胞以及一般代谢组织(如脂肪组织和肝脏)的血管网络的病理生理作用和适应在研究中变得越来越重要,特别是在肥胖和代谢失调期间7,8。内皮是细胞单层,在内部排列血管网络,充当功能和结构屏障。它还有助于各种生理和病理过程,例如血栓形成,代谢物运输,炎症和血管生成9,10。在肝脏的情况下,血管网络的特征之一是存在高度特化的细胞,定义为肝窦内皮细胞(LSEC)。这些细胞缺乏基底膜并且具有多个腱骨,允许底物更容易在血液和肝实质之间转移。由于其独特的解剖位置和特征,LSEC可能在肝脏的病理生理过程中起着至关重要的作用,包括在NAFLD / NASH期间肝脏炎症和纤维化的发展。事实上,LSEC在NAFLD过程中经历的病理,分子和细胞适应有助于疾病进展11。具体来说,在NAFLD期间发生的LSC依赖性肝血管生成与炎症的发展和疾病进展为NASH甚至HCC12显着相关。此外,肥胖相关的早期NAFLD的特征是LSC中胰岛素抵抗的发展,这发生在肝脏炎症或其他晚期NAFLD体征的发展之前13。
此外,LSEC最近已成为几种病因的肝病期间肝血流和血管网络适应的中枢调节剂14,15。事实上,慢性肝病的特征是明显的肝内血管收缩和对血流的阻力增加,这有助于门静脉高压的发展16。就NAFLD而言,一些与LSEC有关的机制助长了这一现象。例如,如上所述,LSEC 特异性胰岛素抵抗与肝血管系统的胰岛素依赖性血管舒张减少有关13。此外,在疾病过程中,肝脏脉管系统对血管收缩剂变得更加敏感,进一步导致肝血流受损并导致剪切应激的出现,这两者都会导致正弦微循环的破坏17。这些事实表明,脉管系统是肝病的关键靶标。然而,阻碍NAFLD / NASH的及时诊断和监测以及潜在疗法开发的限制因素是肝脏微环境和(微)血管结构的一致表征以及以时空和非侵入性方式对疾病分期进行评分的不足。
显微计算机断层扫描(CT)成像是目前用于准确描述生物体内解剖信息的金标准非侵入性成像方法。显微CT和MRI代表了两种互补的成像方法,可以覆盖广泛的病理,并在成像的结构和组织中提供出色的分辨率和细节。特别是显微CT是一种非常快速和准确的工具,通常用于研究骨骼疾病和相关骨表面变化等病理学18,评估肺纤维化随时间的进展19,诊断肺癌及其分期20,甚至检查牙齿病理21,而无需对成像样本进行任何特殊准备(或破坏)。
显微CT的成像技术是基于各种器官在X射线与物质相互作用方面的不同衰减特性。在CT图像中,呈现高X射线衰减差异的器官以高对比度描绘(即,肺部看起来很暗,骨骼看起来很亮)。具有非常相似的衰减特性的器官(不同的软组织)在CT图像上难以区分22。为了解决这一限制,基于碘、金和铋的专用造影剂已被广泛用于 体内 使用。这些药剂改变它们积聚的组织的衰减特性,从循环中缓慢清除,并使整个血管系统或所选组织均匀而稳定地混浊23。
在人类诊断中,CT成像和类似技术,例如MRI衍生的质子密度脂肪分数,已经用于测定肝脂肪含量24,25。在NAFLD的背景下,高软组织对比度对于准确区分病理病变或小血管至关重要。为此,使用造影剂来增强肝组织特征的对比度。这些工具和材料允许研究多种肝脏特征和可能的病理表达,例如血管网络的结构和密度,脂质沉积/脂肪变性以及肝脏中的功能性组织摄取/脂质(乳糜微粒)转移。此外,还可以评估肝脏相对血容量和门静脉直径。在非常短的扫描时间内,所有这些参数都提供了关于NAFLD评估和进展的不同和互补信息,可用于制定非侵入性和详细的诊断。
在本文中,我们提供了一种分步协议,用于使用新型 体内 显微CT成像技术作为评估NAFLD进展阶段的非侵入性方法。使用该协议,可以进行肝脂肪变性和功能性组织摄取的纵向分析,以及相对血容量,门静脉直径和血管网络密度的评估,并将其应用于肝病小鼠模型。
Access restricted. Please log in or start a trial to view this content.
研究方案
所有程序均由BIOEMTECH的人员根据欧洲和国家福利法规执行,并得到国家当局的批准(许可证号EL 25 BIOexp 45 / PN 49553 21/01/20)。所有实验的设计和报告均符合ARRIVE指南26。这些小鼠是从希腊雅典的希腊巴斯德研究所购买的。
注意:将动物分组饲养在20-22°C的房间中富含轨道和纸板管的单独通风笼子中,相对湿度为50%-60%,光照/黑暗循环为12小时(光照07:00 am-07:00 pm)。高脂肪饮食(HFD)和高果糖玉米糖浆(HFCS)的组合,一种广泛用于现代富脂肪饮食中的含果糖和葡萄糖的甜味剂,用于诱导NAFLD作为公认的可靠模型27,28,29,30。在7-8周龄时,雄性C57BL / 6小鼠随意获得正常饮食(n = 2),其中10%的千卡热量来自脂肪或含有60%千卡热量的HFD(n = 2)来自脂肪,补充有5%的HFCS在水中22周。每周使用数字天平获得体重,在实验期间,隔天使用评分表监测动物福利。在成像方案结束时,通过颈椎脱位对小鼠实施安乐死。
1. 动物制备
注: 图1总结了成像协议。
- 使用3%-4%异氟醚(在室内空气中)麻醉小鼠,并使用专用加热垫保持其体温。
注意:在开始扫描之前,必须使用没有踏板撤回反射来确认足够的麻醉深度。 - 在实验前将眼药膏涂抹在动物的眼睛上。
- 将动物放入CT扫描仪支架中,固定鼻锥,并切换到1.5%-3%异氟醚(在室内空气中)进行维护。
注意:必须使用没有踏板撤回反射来确认用于维持麻醉的异氟醚的适当百分比。 - 持续监控鼠标。
2. 扫描前准备
注意:成像分两个实验阶段进行,以使第一个造影剂从循环和组织中充分清除。eXIA(第一造影剂)在第一阶段给药,ExiTron(第二造影剂)在第二阶段给药,如下文"成像工作流程"部分(第 3 节)所述。
- 允许造影剂(eXIA或ExiTron,取决于实验阶段)达到室温3小时。
- 在CT扫描仪上设置以下扫描参数:50 kVp管电压和460μA电流下的高分辨率协议,非螺旋,720投影/旋转,四次旋转和4分钟采集时间。
3. 成像工作流程
- 实验阶段 1
- 计算并制备要以6μL / g体重的未稀释剂量施用的第一个造影剂的体积,以获得最大对比度。
- 通过用盐水填充尾静脉导管并将其连接到装有造影剂的注射器来准备尾静脉导管。
- 进行造影前全身 (WB) 和肝脏基线扫描。
- 确保注射器或导管中没有气泡或堵塞。
- 将预填充的导管插入尾静脉,并通过缓慢和手动进行的注射 给药 造影剂,持续时间为1-3分钟(不是推注注射)。当设置为适当的输注速率时,可以使用注射泵。
注意:动物的尾巴可以放在温水中以诱导血管舒张并帮助导管插入 - 在不同时间点进行WB和肝脏扫描,如 表1所示。
注意:如果无法获得所有点,则应将重点放在注射后45分钟(PI)上,这是最大肝脏摄取的点,以及48小时PI,这是达到清除率的时间。
- 实验阶段 2
- 再次按照第1节所述准备小鼠,以便在使用第一造影剂(48小时PI)进行最终读数后10天施用第二种造影剂。
- 执行步骤 2.1-2.2。
- 计算并制备要以8μL / g体重的未稀释剂量施用的第二种造影剂的体积,以获得最大对比度。
- 通过用盐水填充尾静脉导管并将其连接到装有造影剂的注射器来准备尾静脉导管。
- 进行造影前 WB 和肝脏基线扫描,以评估相对血容量和肝脂肪变性。
- 确保在扫描中无法检测到对比度,以指示第一种造影剂的完全清除。
- 将预填充的导管插入尾静脉,并通过缓慢和手动进行的静脉注射 给药 造影剂,持续时间为 1-3 分钟(不是推注)。当设置为适当的输注速率时,可以使用注射泵。
- 在不同时间点进行WB和肝脏扫描,如 表1所示。
注意:WB扫描在10分钟和4小时PI采集。它们之间的显着时间间隔允许评估体内示踪剂的生物分布及其相对清除率。
4. 数据提取和分析
注意:在此协议中,提供了基于特定成像处理软件(参见 材料表)的数据提取和分析步骤。使用不同的软件时,可能需要调整所描述的步骤。
- 肝脂沉积/脂肪变性的评估。
注意:对于肝脂肪变性的评估,不使用造影剂,并进行对照和病理学之间的比较。由于不同小鼠之间组织衰减特性的偏差相对较高,因此根据以下等式和如前所述25,肝脏对脾脏(无脂肪组织)和脂肪(绝对脂肪组织)的密度值进行归一化: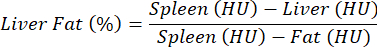
- 要执行分析,请加载对比前扫描的DICOM文件,并调整条形/对比度以清楚地看到肝脏,脾脏和白色脂肪组织(WAT)。
- 通过前面板上的工具下拉菜单访问建模操作员工具,然后选择 3D ROI 工具。
- 在 3D ROI 运算符下,选择添加 ROI 以生成多个 ROI (每个组织最多 8 个),以在肝脏(最好在左内侧叶、右内侧叶和左外侧叶区域)和脾脏看起来透明、没有明显血管和脂肪的区域执行采样。
注意:对于 WAT,ROI 选择在内脏脂肪组织库的中间。推荐区域如图 2 所示。使用肝/脾比且不包括WAT的标准化方法也可以如先前建立的31所示应用。 - 在 3D 绘画模式和侵蚀/扩张 功能下,选择 2D,然后使用显示的界面为每个 ROI 指定名称和颜色。
- 使用直径为 8 像素的 球体 绘画 ROI 工具手动绘制 2D ROI。
- 通过在横向平面上使用 十字准线 工具分割感兴趣区域的 2D ROI 来执行采样,如图 3A 所示。
- 单击矢状面和冠状面上的选定点,完成2D ROI的分割,如图 3B所示。
- 重复该过程以定义其余的 ROI。
注意:采样时,请避开器官边界区域,因为这会引入噪声并影响每个ROI的Hounsfield单位(HU)值的计算可靠性。 - 对细分的 ROI 满意后,转到 导航,然后选择 显示表 以显示包含每个 ROI 的计算 HU 值的量化 表 。
注意:感兴趣的值列在"平均值"列中,该列包含感兴趣器官的ROI中包含的体素(HU)的数字平均值。记下感兴趣的值,或通过选择"导出表"保存整个 表。 - 计算肝脏、脾脏和 WAT 的平均 HU,并将这些值代入上述公式以计算肝脏脂肪的百分比。
- 肝脏中的功能性组织摄取/脂质(乳糜微粒)转移
注意:基于先前发布的方法32,在第一次造影剂输注后45分钟和48小时从获得的扫描中分析功能组织摄取/脂质(乳糜微粒)转移。使用以下公式计算不同组织和时间点的对比度: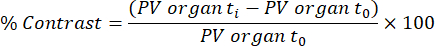
PV器官t i是时间t i(范围从0小时到48小时)器官中的平均像素值,PV器官t0是图像中器官中没有对比度的平均像素值。- 要执行此分析,请加载eXIA扫描DICOM文件,并调整条形/对比度以清楚地看到肝脏,脾脏和左心室。
- 通过前面板上的工具下拉菜单访问建模操作员,然后选择 3D ROI 工具。
- 在 3D ROI 运算符下,选择添加 ROI 以细分肝脏的多个 ROI 。
- 在 3D 绘画模式和侵蚀/膨胀 功能下,使用直径为 8 像素和 −1 侵蚀的 球体 绘画 ROI 工具。
注意:在切片上选择多个ROI,其中每个器官都清晰显示。避免边界区域,因为这会引入噪声并影响每个ROI的计算HU值的可靠性。这将导致多个 3D ROI 的采样,这些 ROI 对应于小器官体积。 - 使用显示的界面为每个 ROI 指定名称和颜色。
- 对设计的 ROI 满意后,转到 导航,然后选择显示 表 以显示包含每个 ROI 计算的 HU 值的量化表。
注意:感兴趣的值列在"平均值"列下,该列显示ROI中包含的体素(HU)的数字平均值。每个器官投资回报率的平均HU值对应于 PV器官ti。记下感兴趣的值,或通过选择"导出表"保存整个 表。 - 要获得 PV器官t0,请使用造影前DICOM文件重复上述所有步骤,以计算注射造影剂之前肝脏,脾脏和左心室的平均亮度。
- 将这些值插入到上述等式中,以提取对应于功能组织摄取/脂质(乳糜微粒)转移的百分比对比度。
- 肝血管网络的结构和密度
注意:肝血管网络的结构和密度分析基于先前发表的方法33 并对获得10分钟PI的第二造影剂的肝脏扫描进行。- 要执行此分析,请加载ExiTron扫描DICOM文件,并调整条形/对比度以清楚地看到肝脏血管网络。
- 通过前面板上的工具下拉菜单访问建模操作员,然后选择 3D ROI 工具。
- 在 "3D ROI 运算符"下,选择"添加 ROI"以生成肝脏的 3D ROI 。
- 在" 3D 绘画模式"和"侵蚀/扩张" 特征下,选择 3D。
注: 使用带有 −1 侵蚀的 球体 绘画 ROI 工具来定义整个日冕平面的分割层。ROI 绘制工具的直径必须根据每个图层进行调整(用于添加/删除任何需要/不需要的体素选择)。建议首先在冠状面上定义肝脏体积,然后可以使用横向和矢状面来校正ROI。这个过程需要精确。用户在分割每个ROI层时必须非常小心,不要包括其他组织,血管和骨骼,同时确保肝脏的所有区域都包含在定义的ROI中。因此,熟悉肝脏的解剖边界至关重要。 - 一旦对生成的肝脏ROI感到满意,请执行剪切,以便从图像数据中删除不属于初始分割肝脏ROI的所有体素。为此,请从 ROI 选择器中选择肝脏投资回报率,然后单击 执行切割 图标。此操作会去除背景并使肝脏投资回报率保持不变。
注意: 尽管撤消/重做功能适用于 在 3D ROI 工具下执行的所有操作,但剪切 ROI 的操作无法撤消。因此,在此操作之前,用户可以考虑以DICOM格式保存初始肝脏ROI。 - 由此产生的肝脏投资回报率包括血管网络和周围组织,必须将其切除。为此,通过单击重置 投资回报 率扫帚按钮来重置肝脏投资回报率。
- 使用出现的界面将肝脏ROI的所有像素传输到背景。
注意:此操作后肝脏ROI仍然存在,但将不再包含任何体素。 - 要重新分割肝脏 ROI 以使其仅包含血管相关像素,请转到魔杖图标表示的 分割算法 ,然后选择 连接阈值。
- 在应用阈值之前,从输入下拉菜单中将ROI定义为 输出 ,将背景定义为 输入 。
- 通过单击每个阈值字段左侧的最小和最大图标来设置阈值,以填写最大值和最小值并获取血管网络。
注意:只有所选范围内的像素才会包含在生成的 ROI 中。调整不同动物之间的阈值可确保在注射到每只动物的造影剂的确切量方面考虑相同的解剖区域。即使数值不相同,这在所选组织中也是恒定的。 - 使用 十字准线 工具单击血管网络看起来清晰的点,然后单击 应用 以执行分割。
- 激活最大强度投影 (MIP) 查看器。
- 根据血管网络在MIP视图中的清晰度来评估产生的肝脏ROI。
- 如果组织保留在肝脏ROI的某些部分,则通过调整 最小 阈值重复步骤4.3.5-4.3.11,直到分段的肝脏ROI清楚地代表血管网络。
- 一旦对所得肝脏ROI感到满意,生成包含计算的肝脏ROI体积(以立方毫米为单位)的定量表。
注意:感兴趣的值列在"mm3"列中,该列包含肝脏ROI中包含的体素(HU)的数字体积值。记下感兴趣的值,或通过选择"导出表"保存整个 表。
- 肝相对血容量
注意:为了测量与纤维化进展期间新形成的血管量显着相关的肝相对血容量(rBV),使用造影前扫描和第二次造影剂注射后4小时的扫描。分析如前所述34进行。- 要执行此分析,请加载 ExiTron 扫描 DICOM 文件,并调整条形/对比度。
注意:禁用 MIP 查看器:在首选项下,选中复选框以在加载时禁用 MIP 查看器。对于大型数据集,这可以提高加载速度。 - 通过前面板上的工具下拉菜单访问建模操作员,然后选择 3D ROI 工具。此工具提供了用于绘制、可视化、保存和量化 2D 和 3D 区域的高级选项。
- 在" 3D ROI 运算符"下,选择" 添加 ROI",然后细分两个 ROI:一个用于肝脏,一个用于大血管。
- 在" 3D 绘画模式"和"侵蚀/扩张" 特征下,选择" 2D"。
注意:建议使用 球体 绘制ROI工具,肝脏直径为8-10像素,血管直径为4-6像素。但是,可以根据要选择的区域有多小来调整油漆工具直径。 - 使用显示的界面为每个 ROI 指定名称和颜色。
注意:选择感兴趣组织的中心部分的两到五个切片,并定义分割层以为每个组织生成 2D ROI。选择每个切片上的区域时,请避开器官边界区域,如图 4所示,因为这会引入噪声并影响每个ROI的计算HU值的可靠性。 - 对设计的 ROI 满意后,转到 导航,然后选择显示 表 以显示包含每个 ROI 计算的 HU 值的量化表。
注意:感兴趣的值列在"平均值"列下,该列显示ROI中包含的体素(HU)的数字平均值。记下感兴趣的值,或通过选择"导出表"保存整个 表。 - 对造影前DICOM文件重复所有步骤,以获得注射造影剂之前肝脏的平均亮度。为此,仅对肝脏执行步骤4.4.2-4.4.5。
- 计算每个组织在等效时间点的平均HU值,并将获得的值插入到下面的等式中:
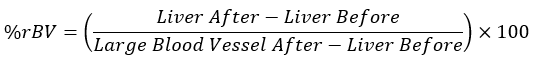
注意:注射造影剂后的大血管被认为是100%rBV,而在使用造影剂之前,肝脏被认为是0%rBV。
- 要执行此分析,请加载 ExiTron 扫描 DICOM 文件,并调整条形/对比度。
- 门静脉直径
注意:对于门静脉直径测量,如前所述分析用于肝脏rBV测量的相同扫描35。- 加载 ExiTron 扫描 DICOM 文件,并调整条形/对比度。
- 在肠系膜上静脉和脾静脉交界处上方找到三到四个切片的横向平面(图5)。
- 使用 标尺 工具测量两点之间的精确距离(即圆脉区域的直径)。
注意:距离是在图像上提取的,但也可以转到 导航 并选择显示 表格以显示 包含计算距离的量化表,或选择 导出表 以保存结果。
Access restricted. Please log in or start a trial to view this content.
结果
在这项代表性研究中,不含任何造影剂的显微CT成像表明,与对照组相比,NAFLD小鼠的肝脂肪百分比更高(表2),证实了病理学。使用ExiTron造影剂和上述肝血管网络结构和密度分析,发现与健康对照相比,NAFLD小鼠肝血管网络的总体积密度更高(图6,表2)。与对照组小鼠相比,患有NAFLD的小鼠也具有更大的门静脉直径(表2),这是与肝...
Access restricted. Please log in or start a trial to view this content.
讨论
目前推荐的人类NAFLD诊断和分期方法是肝活检,它存在出血复杂性的风险,以及采样不准确40。相反,在动物模型中,这种诊断是通过尸检的组织学进行的,尽管现在可以使用可存活肝活检的方案,并且在研究设计允许时推荐41。使用验尸组织学意味着需要大量的动物来研究这种疾病的进展。因此,在疾病进展时,不能在同一只动物身上进行研究;当比较在不同时...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
图 1 是使用 BioRender.com 创建的。这项工作得到了希腊研究与创新基金会(#3222 至 A.C.)的支持。Anna Hadjihambi由肝脏研究基金会罗杰威廉姆斯肝病学研究所资助。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| eXIA160 | Binitio Biomedical, Inc. | https://www.binitio.com/?Page=Products | |
| High fat diet with 60% of kilocalories from fat | Research Diets, New Brunswick, NJ, USA | D12492 | |
| High-fructose corn syrup | Best flavors, CA | hfcs-1gallon | |
| Lacrinorm ophthalmic ointment | Bausch & Lomb | ||
| Normal diet with 10% of kilocalories from fat | Research Diets, New Brunswick, NJ, USA | D12450 | |
| Viscover ExiTron nano 12000 | Milteny Biotec, Bergisch Gladbach, Germany | 130-095-698 | |
| VivoQuant | Invicro | ||
| X-CUBE | Molecubes, Belgium | https://www.molecubes.com/systems/ |
参考文献
- Lazarus, J. V., et al. Advancing the global public health agenda for NAFLD: A consensus statement. Nature Reviews. Gastroenterology & Hepatology. 19 (1), 60-78 (2022).
- Takahashi, Y., Fukusato, T. Histopathology of non-alcoholic fatty liver disease/non-alcoholic steatohepatitis. World Journal of Gastroenterology. 20 (42), 15539-15548 (2014).
- Huang, D. Q., El-Serag, H. B., Loomba, R. Global epidemiology of NAFLD-related HCC: Trends, predictions, risk factors and prevention. Nature Reviews Gastroenterology & Hepatology. 18 (4), 223-238 (2021).
- Niederseer, D., Wernly, B., Aigner, E., Stickel, F., Datz, C. NAFLD and cardiovascular diseases: Epidemiological, mechanistic and therapeutic considerations. Journal of Clinical Medicine. 10 (3), 467(2021).
- Lefere, S., et al. Differential effects of selective- and pan-PPAR agonists on experimental steatohepatitis and hepatic macrophages. Journal of Hepatology. 73 (4), 757-770 (2020).
- Chrysavgis, L., Papatheodoridi, A. M., Chatzigeorgiou, A., Cholongitas, E. The impact of sodium glucose co-transporter 2 inhibitors on non-alcoholic fatty liver disease.Journal of Gastroenterology and Hepatology. Journal of Gastroenterology and Hepatology. 36 (4), 893-909 (2021).
- Li, M., Qian, M., Xu, J. Vascular endothelial regulation of obesity-associated insulin resistance. Frontiers in Cardiovascular Medicine. 4, 51(2017).
- Pi, X., Xie, L., Patterson, C. Emerging roles of vascular endothelium in metabolic homeostasis. Circulation Research. 123 (4), 477-494 (2018).
- Chiu, J. J., Chien, S. Effects of disturbed flow on vascular endothelium: Pathophysiological basis and clinical perspectives. Physiological Reviews. 91 (1), 327-387 (2011).
- Koyama, Y., Brenner, D. A. Liver inflammation and fibrosis. The Journal of Clinical Investigation. 127 (1), 55-64 (2017).
- Nasiri-Ansari, N., et al. Endothelial cell dysfunction and non-alcoholic fatty liver disease (NAFLD): A concise review. Cells. 11 (16), 2511(2022).
- Lefere, S., et al. Angiopoietin-2 promotes pathological angiogenesis and is a therapeutic target in murine non-alcoholic fatty liver disease. Hepatology. 69 (3), 1087-1104 (2019).
- Pasarin, M., et al. Insulin resistance and liver microcirculation in a rat model of early NAFLD. Journal of Hepatology. 55 (5), 1095-1102 (2011).
- Hammoutene, A., Rautou, P. E. Role of liver sinusoidal endothelial cells in non-alcoholic fatty liver disease. Journal of Hepatology. 70 (6), 1278-1291 (2019).
- Sun, X., Harris, E. N. New aspects of hepatic endothelial cells in physiology and non-alcoholic fatty liver disease. American Journal of Physiology. Cell Physiology. 318 (6), C1200-C1213 (2020).
- Iwakiri, Y., Shah, V., Rockey, D. C. Vascular pathobiology in chronic liver disease and cirrhosis - current status and future directions. Journal of Hepatology. 61 (4), 912-924 (2014).
- Baffy, G. Origins of portal hypertension in non-alcoholic fatty liver disease. Digestive Diseases and Sciences. 63 (3), 563-576 (2018).
- Ruhli, F. J., Kuhn, G., Evison, R., Muller, R., Schultz, M. Diagnostic value of micro-CT in comparison with histology in the qualitative assessment of historical human skull bone pathologies. American Journal of Physical Anthropology. 133 (4), 1099-1111 (2007).
- Rodt, T., et al. Micro-computed tomography of pulmonary fibrosis in mice induced by adenoviral gene transfer of biologically active transforming growth factor-beta1. Respiratory Research. 11 (1), 181(2010).
- Deng, L., Xiao, S. M., Qiang, J. W., Li, Y. A., Zhang, Y. Early lung adenocarcinoma in mice: Micro-computed tomography manifestations and correlation with pathology. Translational Oncology. 10 (3), 311-317 (2017).
- Feng, J., et al. Abnormalities in the enamel in bmp2-deficient mice. Cells, Tissues, Organs. 194 (2-4), 216-221 (2011).
- Kagadis, G. C., Loudos, G., Katsanos, K., Langer, S. G., Nikiforidis, G. C. In vivo small animal imaging: current status and future prospects. Medical Physics. 37 (12), 6421-6442 (2010).
- Starosolski, Z., et al. Ultra high-resolution in vivo computed tomography imaging of mouse cerebrovasculature using a long circulating blood pool contrast agent. Scientific Reports. 5, 10178(2015).
- Caussy, C., Reeder, S. B., Sirlin, C. B., Noninvasive Loomba, R. quantitative assessment of liver fat by MRI-PDFF as an endpoint in NASH trials. Hepatology. 68 (2), 763-772 (2018).
- Lubura, M., et al. Non-invasive quantification of white and brown adipose tissues and liver fat content by computed tomography in mice. PLoS One. 7 (5), e37026(2012).
- Perciedu Sert, N., et al. The ARRIVE guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biology. 18 (7), e3000410(2020).
- Tetri, L. H., Basaranoglu, M., Brunt, E. M., Yerian, L. M., Neuschwander-Tetri, B. A. Severe NAFLD with hepatic necroinflammatory changes in mice fed trans fats and a high-fructose corn syrup equivalent. American Journal of Physiology. Gastrointestinal and Liver Physiology. 295 (5), G987-G995 (2008).
- Machado, M. V., et al. Mouse models of diet-induced non-alcoholic steatohepatitis reproduce the heterogeneity of the human disease. PLoS One. 10 (5), 0127991(2015).
- Jensen, T., et al. Fructose and sugar: A major mediator of non-alcoholic fatty liver disease. Journal of Hepatology. 68 (5), 1063-1075 (2018).
- Nevzorova, Y. A., Boyer-Diaz, Z., Cubero, F. J., Gracia-Sancho, J. Animal models for liver disease - A practical approach for translational research. Journal of Hepatology. 73 (2), 423-440 (2020).
- De Rudder, M., et al. Automated computerized image analysis for the user-independent evaluation of disease severity in preclinical models of NAFLD/NASH. Laboratory Investigation. 100 (1), 147-160 (2020).
- Willekens, I., et al. Time-course of contrast enhancement in spleen and liver with Exia 160, Fenestra LC, and VC. Molecular Imaging and Biology. 11 (2), 128-135 (2009).
- Das, N. M., et al. In vivo quantitative microcomputed tomographic analysis of vasculature and organs in a normal and diseased mouse model. PLoS One. 11 (2), e0150085(2016).
- Ehling, J., et al. CCL2-dependent infiltrating macrophages promote angiogenesis in progressive liver fibrosis. Gut. 63 (12), 1960-1971 (2014).
- Zhang, J., et al. Gamna-Gandy bodies of the spleen detected with susceptibility weighted imaging: maybe a new potential non-invasive marker of esophageal varices. PLoS One. 8 (1), e55626(2013).
- Chen, Y., Li, J., Zhou, Q., Lyu, G., Li, S. Detection of liver and spleen stiffness in rats with portal hypertension by two-dimensional shear wave elastography. BMC Medical Imaging. 22 (1), 68(2022).
- Lessa, A. S., et al. Ultrasound imaging in an experimental model of fatty liver disease and cirrhosis in rats. BMC Veterinary Research. 6, 6(2010).
- Abikhzer, G., Alabed, Y. Z., Azoulay, L., Assayag, J., Rush, C. Altered hepatic metabolic activity in patients with hepatic steatosis on FDG PET/CT. AJR. American Journal of Roentgenology. 196 (1), 176-180 (2011).
- Newman, E. M., Rowland, A. A physiologically based pharmacokinetic model to predict the impact of metabolic changes associated with metabolic associated fatty liver disease on drug exposure. International Journal of Molecular Sciences. 23 (19), 11751(2022).
- Tsai, E., Lee, T. P. Diagnosis and evaluation of non-alcoholic fatty liver disease/non-alcoholic steatohepatitis, including noninvasive biomarkers and transient elastography. Clinics in Liver Disease. 22 (1), 73-92 (2018).
- Oldham, S., Rivera, C., Boland, M. L., Trevaskis, J. L. Incorporation of a survivable liver biopsy procedure in mice to assess non-alcoholic steatohepatitis (NASH) resolution. Journal of Visualized Experiments. 146, e59130(2019).
- Boll, H., et al. Comparison of Fenestra LC, ExiTron nano 6000, and ExiTron nano 12000 for micro-CT imaging of liver and spleen in mice. Academic Radiology. 20 (9), 1137-1143 (2013).
- Ashton, J. R., West, J. L., Badea, C. T. In vivo small animal micro-CT using nanoparticle contrast agents. Frontiers in Pharmacology. 6, 256(2015).
- Rothe, J. H., et al. Time course of contrast enhancement by micro-CT with dedicated contrast agents in normal mice and mice with hepatocellular carcinoma: Comparison of one iodinated and two nanoparticle-based agents. Academic Radiology. 22 (2), 169-178 (2015).
- Toczek, J., et al. Computed tomography imaging of macrophage phagocytic activity in abdominal aortic aneurysm. Theranostics. 11 (12), 5876-5888 (2021).
- Mannheim, J. G., et al. Comparison of small animal CT contrast agents. Contrast Media & Molecular Imaging. 11 (4), 272-284 (2016).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。