A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
רומן in vivo טכניקות הדמיה טומוגרפיה מיקרו-ממוחשבת להערכת ההתקדמות של מחלת כבד שומני לא אלכוהולי
* These authors contributed equally
In This Article
Summary
באמצעות מודל עכבר של מחלת כבד שומני לא אלכוהולי (NAFLD) הנגרמת על ידי דיאטה, אנו מתארים את השימוש בטכניקות הדמיה מיקרו-ממוחשבות חדשניות in vivo כשיטה לא פולשנית להערכת שלבי ההתקדמות של NAFLD, תוך התמקדות בעיקר ברשת כלי הדם בכבד בשל מעורבותה המשמעותית בחוסר ויסות כבד הקשור ל- NAFLD.
Abstract
מחלת כבד שומני לא אלכוהולי (NAFLD) היא בעיה בריאותית עולמית הולכת וגדלה, וההשפעה של NAFLD מורכבת על ידי היעדר טיפולים יעילים כיום. גורמים מגבילים ניכרים המעכבים אבחון מדויק ועדכני (כולל דירוג) וניטור של NAFLD, כמו גם פיתוח טיפולים פוטנציאליים, הם הליקויים הנוכחיים באפיון מבנה המיקרו-סביבה בכבד ובניקוד שלב המחלה באופן מרחבי-זמני ולא פולשני. באמצעות מודל עכבר NAFLD המושרה על ידי דיאטה, חקרנו את השימוש בטכניקות הדמיה של טומוגרפיה מיקרו-ממוחשבת in vivo (CT) כשיטה לא פולשנית להערכת שלבי ההתקדמות של NAFLD, תוך התמקדות בעיקר ברשת כלי הדם בכבד בשל מעורבותה המשמעותית בחוסר ויסות בכבד הקשור ל- NAFLD. מתודולוגיית הדמיה זו מאפשרת ניתוח אורך של סטאטוזיס בכבד וספיגת רקמות תפקודיות, כמו גם הערכה של נפח הדם היחסי, קוטר הווריד הפורטלי וצפיפות רשת כלי הדם. הבנת ההתאמות של רשת כלי הדם בכבד במהלך התקדמות NAFLD וקורלציה זו עם דרכים אחרות לאפיון התקדמות המחלה (סטאטוזיס, דלקת, פיברוזיס) באמצעות השיטה המוצעת יכולה לסלול את הדרך לקראת הקמת גישות חדשות, יעילות יותר וניתנות לשחזור לחקר NAFLD בעכברים. פרוטוקול זה צפוי גם לשדרג את ערכם של מודלים פרה-קליניים בבעלי חיים לחקר פיתוח טיפולים חדשניים נגד התקדמות המחלה.
Introduction
מחלת כבד שומני לא אלכוהולי (NAFLD) היא מחלה מטבולית המשפיעה על כ -25% מהאוכלוסייה ו ->80% מהאנשים הסובלים מהשמנת יתר חולנית1. על פי הערכות, שליש מהאנשים הללו מתקדמים לסטאטוהפטיטיס לא אלכוהולית (NASH), המאופיינת בסטאטוזיס כבד, דלקת ופיברוזיס2. NASH הוא שלב מחלה עם סיכון גבוה משמעותית להתפתחות שחמת הכבד וקרצינומה הפטוצלולרית (HCC)3,4. מסיבה זו, NASH הוא כיום הגורם השני בשכיחותו להשתלת כבד, והוא גם צפוי להפוך בקרוב למנבא החשוב ביותר להשתלת כבד 5,6,7. למרות שכיחותו וחומרתו, אין טיפול ספציפי למחלה זמין עבור NAFLD, והטיפולים הקיימים נועדו רק להתמודד עם פתולוגיות הקשורות למחלה כגון עמידות לאינסולין והיפרליפידמיה 5,6.
בשנים האחרונות, התפקיד הפתופיזיולוגי וההתאמות של האנדותל, ובכלל, של רשת כלי הדם של רקמות מטבוליות, כגון רקמת השומן והכבד, צוברים חשיבות רבה יותר במחקר, במיוחד במהלך השמנת יתר וחוסר ויסות מטבולי 7,8. האנדותל הוא חד-שכבה תאית המרפדת את רשת כלי הדם באופן פנימי, ופועלת כמחסום תפקודי ומבני. הוא גם תורם לתהליכים פיזיולוגיים ופתולוגיים שונים, כגון פקקת, הובלת מטבוליטים, דלקת ואנגיוגנזה 9,10. במקרה של הכבד, רשת כלי הדם מאופיינת בין היתר בנוכחות של תאים מיוחדים מאוד, המוגדרים כתאי אנדותל סינוסואידים בכבד (LSECs). תאים אלה חסרים קרום מרתף ויש להם fenestrae מרובים, המאפשר העברה קלה יותר של מצעים בין הדם ואת parenchyma הכבד. בשל מיקומם האנטומי הייחודי ומאפייניהם, סביר להניח של-LSECs יש תפקיד מכריע בתהליכים הפתופיזיולוגיים של הכבד, כולל התפתחות דלקת כבד ופיברוזיס במהלך NAFLD/NASH. ואכן, ההתאמות הפתולוגיות, המולקולריות והתאיות שעוברות LSECs במהלך NAFLD תורמות להתקדמות המחלה11. באופן ספציפי, אנגיוגנזה בכבד תלוית LSEC המתרחשת במהלך NAFLD קשורה באופן משמעותי עם התפתחות דלקת והתקדמות המחלה ל- NASH או אפילו HCC12. חוץ מזה, NAFLD מוקדם הקשור להשמנת יתר מאופיין בהתפתחות עמידות לאינסולין ב- LSECs, אשר מקדימה את התפתחות דלקת הכבד או סימני NAFLD מתקדמים אחרים13.
בנוסף, LSECs התגלו לאחרונה כרגולטורים מרכזיים של זרימת הדם בכבד והתאמות רשת כלי הדם במהלך מחלת כבד של מספר אטיולוגיות14,15. ואכן, מחלת כבד כרונית מאופיינת בהתכווצות כלי דם תוך כבדית בולטת ובהתנגדות מוגברת לזרימת הדם, התורמות להתפתחות יתר לחץ דם פורטלי16. במקרה של NAFLD, מספר מנגנונים הקשורים ל-LSEC תורמים לתופעה זו. לדוגמה, תנגודת לאינסולין ספציפית ל-LSEC, כפי שהוזכר לעיל, קשורה להרחבת כלי דם מופחתת תלוית אינסולין של כלי הדם בכבד13. חוץ מזה, במהלך המחלה, כלי הדם בכבד הופך רגיש יותר vasoconstrictors, תורם עוד יותר לפגיעה בזרימת הדם בכבד ומוביל את הופעתה של מתח גזירה, אשר שניהם לגרום לשיבוש של microcirculation סינוסואידלי17. עובדות אלה מצביעות על כך שכלי הדם הם יעד מרכזי במחלות כבד. עם זאת, גורמים מגבילים המעכבים את האבחון והניטור בזמן של NAFLD/NASH, כמו גם את הפיתוח של טיפולים פוטנציאליים, הם הליקויים באפיון עקבי של מיקרו-סביבה בכבד ומבנה (מיקרו) כלי דם, כמו גם הניקוד של שלב המחלה באופן מרחבי-זמני ולא פולשני.
הדמיית טומוגרפיה מיקרו-ממוחשבת (CT) היא כיום שיטת ההדמיה הלא פולשנית הסטנדרטית לתיאור מדויק של מידע אנטומי בתוך אורגניזם חי. מיקרו-CT ו-MRI מייצגים שתי שיטות הדמיה משלימות שיכולות לכסות מגוון רחב של פתולוגיות ולספק רזולוציה ופירוט יוצאי דופן במבנים וברקמות המודמיים. מיקרו-CT, בפרט, הוא כלי מהיר ומדויק מאוד המשמש לעתים קרובות לחקר פתולוגיות כגון מחלות עצם ושינויים הקשורים לפני השטח של העצם18, הערכת התקדמות פיברוזיס ריאתי לאורך זמן19, אבחון סרטן ריאות והיערכות20, או אפילו בחינת פתולוגיות שיניים21, ללא כל הכנה מיוחדת (או הרס) של הדגימות להיות דמות.
טכנולוגיית ההדמיה של מיקרו-CT מבוססת על תכונות ההנחתה השונות של איברים שונים מבחינת האינטראקציה של קרני רנטגן עם חומר. איברים המציגים הבדלי הנחתה גבוהים בקרני רנטגן מתוארים בניגודיות גבוהה בתמונות CT (כלומר, הריאות נראות כהות והעצמות בהירות). איברים בעלי תכונות הנחתה דומות מאוד (רקמות רכות שונות), מאתגרים להבחנה בתמונות CT22. כדי להתמודד עם מגבלה זו, חומרי ניגוד מיוחדים המבוססים על יוד, זהב וביסמוט נחקרו בהרחבה לשימוש in vivo . חומרים אלה משנים את תכונות ההנחתה של הרקמות שבהן הם מצטברים, מנוקים לאט ממחזור הדם, ומאפשרים אופסיפיקציה אחידה ויציבה של מערכת כלי הדם כולה או רקמות נבחרות23.
באבחון אנושי, הדמיית CT וטכניקות דומות, כגון מקטע שומן צפיפות פרוטונים הנגזר מ- MRI, כבר נמצאות בשימוש לקביעת תכולת שומן בכבד24,25. בהקשר של NAFLD, ניגודיות גבוהה של רקמות רכות חיונית להבחנה מדויקת בין נגעים פתולוגיים או כלי דם קטנים. למטרה זו נעשה שימוש בחומרי ניגוד המספקים ניגודיות משופרת של מאפייני רקמת הכבד. כלים וחומרים כאלה מאפשרים לחקור מאפייני כבד מרובים וביטויים פתולוגיים אפשריים, כגון ארכיטקטורה וצפיפות של רשת כלי הדם, שקיעת שומנים/סטאטוזיס וספיגת רקמה תפקודית/העברת שומנים (כילומיקרון) בכבד. בנוסף, ניתן להעריך גם את נפח הדם היחסי בכבד ואת קוטר הווריד הפורטלי. בזמן סריקה קצר מאוד, כל הפרמטרים הללו מספקים מידע שונה ומשלים על הערכה והתקדמות של NAFLD, אשר יכול לשמש לפיתוח אבחנה לא פולשנית ומפורטת.
במאמר זה, אנו מספקים פרוטוקול שלב אחר שלב לשימוש בטכניקות הדמיה מיקרו-CT חדשניות in vivo כשיטה לא פולשנית להערכת שלבי ההתקדמות של NAFLD. באמצעות פרוטוקול זה, ניתוח אורך של סטאטוזיס בכבד וספיגת רקמות תפקודיות, כמו גם הערכה של נפח הדם היחסי, קוטר הווריד הפורטלי וצפיפות רשת כלי הדם, ניתן לבצע וליישם במודלים עכבריים של מחלת כבד.
Protocol
כל ההליכים בוצעו על ידי אנשי ביומטק בהתאם לתקנות הרווחה האירופיות והלאומיות ואושרו על ידי הרשויות הלאומיות (מספר רישיון: EL 25, BIOexp 45/PN 49553, 21/01/20). כל הניסויים תוכננו ודווחו בהתאם להנחיות ARRIVE26. העכברים נרכשו ממכון פסטר ההלני, אתונה, יוון.
הערה: בעלי החיים שוכנו בקבוצות בכלובים מאווררים בנפרד מועשרים במסילות ובצינורות קרטון בחדר בטמפרטורה של 20-22 מעלות צלזיוס, עם לחות יחסית של 50%-60% ומחזור אור/חושך של 12 שעות (אור 07:00-19:00). שילוב של תזונה עתירת שומן (HFD) וסירופ תירס עתיר פרוקטוז (HFCS), ממתיק המכיל פרוקטוז וגלוקוז הנמצא בשימוש נרחב בסוגים מודרניים של דיאטות מועשרות בשומן, שימש להשראת NAFLD כמודל אמין מוכר27,28,29,30. בגיל 7-8 שבועות, עכברי C57BL/6 זכרים קיבלו גישה לתזונה רגילה (n = 2) עם 10% קילוקלוריות משומן או HFD (n = 2) המכיל 60% קילוקלוריות משומן בתוספת 5% HFCS במים במשך 22 שבועות. משקל הגוף התקבל מדי שבוע באמצעות איזון דיגיטלי, ובמהלך תקופת הניסוי נוטר רווחת בעלי החיים לסירוגין בימים חלופיים באמצעות גיליון ציונים. בסוף פרוטוקול ההדמיה, העכברים הומתו באמצעות פריקת צוואר הרחם.
1. הכנת בעלי חיים
הערה: פרוטוקול ההדמיה מסוכם באיור 1.
- מרדימים את העכבר באמצעות איזופלורן 3%-4% (באוויר החדר), ושומרים על טמפרטורת גופו באמצעות כרית חימום ייעודית.
הערה: יש להשתמש בהיעדר רפלקס נסיגה מדוושה כדי לוודא עומק הרדמה מספיק לפני תחילת הסריקה. - יש למרוח משחה אופתלמית על עיני בעל החיים לפני הניסוי.
- הניחו את בעל החיים בעריסה של סורק ה-CT, הדקו את חרוט האף ועברו לאיזופלורן 1.5%-3% (באוויר החדר) לתחזוקה.
הערה: היעדר רפלקס נסיגה מדוושה חייב לשמש כדי לאשר את האחוז המתאים של isoflurane לשמירה על הרדמה. - נטר את העכבר ברציפות.
2. הכנה מראש לסריקה
הערה: ההדמיה מבוצעת בשני שלבים ניסיוניים כדי לאפשר לחומר הניגוד הראשון להתפנות כראוי ממחזור הדם ומהרקמות. eXIA (סוכן ניגודיות ראשון) מנוהל בשלב הראשון ו- ExiTron (סוכן ניגודיות שני) בשלב השני, כמתואר בסעיף "זרימת עבודה של הדמיה" (סעיף 3) להלן.
- אפשר לחומר הניגוד (eXIA או ExiTron, בהתאם לשלב הניסוי) להגיע לטמפרטורת החדר למשך 3 שעות.
- הגדר את פרמטרי הסריקה הבאים בסורק ה- CT: פרוטוקול ברזולוציה גבוהה מתחת למתח צינור של 50 kVp וזרם של 460 μA, לא ספירלי, 720 הקרנות/סיבוב, ארבעה סיבובים וזמן רכישה של 4 דקות.
3. זרימת עבודה של הדמיה
- שלב ניסויי 1
- חשב והכן את נפח חומר הניגוד הראשון שיינתן במינון לא מדולל של 6 מיקרוליטר/גרם של משקל גוף לקבלת ניגודיות מרבית.
- הכינו את צנתר ורידי הזנב על ידי מילויו במי מלח וחיבורו למזרק המלא בחומר הניגוד.
- קבל סריקת טרום ניגודיות של כל הגוף (WB) ושל קו הבסיס של הכבד.
- יש לוודא שאין בועות או סתימות במזרק או בצנתר.
- יש להחדיר את הצנתר הממולא מראש לווריד הזנב, ולתת את חומר הניגוד באמצעות זריקה המבוצעת לאט וידני, למשך 1-3 דקות (לא כהזרקת בולוס). משאבת מזרק ניתן להשתמש כאשר מוגדר לקצב העירוי המתאים.
הערה: זנב בעל החיים יכול להיות ממוקם במים פושרים כדי לגרום להרחבת כלי הדם ולעזור עם החדרת הצנתר - לרכוש סריקות WB וכבד בנקודות זמן שונות, כפי שמצוין בטבלה 1.
הערה: אם רכישת כל הנקודות אינה אפשרית, יש להתמקד ב- 45 דקות לאחר ההזרקה (PI), שהיא נקודת ספיגת הכבד המרבית, וב- PI של 48 שעות, שהיא נקודת הפינוי המרבית.
- שלב ניסויי 2
- הכן את העכבר שוב כמתואר בסעיף 1 לניהול סוכן הניגוד השני 10 ימים לאחר הקריאה הסופית עם סוכן הניגוד הראשון (48 שעות PI).
- בצע את שלבים 2.1-2.2.
- חשב והכן את נפח חומר הניגוד השני שיינתן במינון לא מדולל של 8 מיקרוליטר/גרם של משקל גוף לקבלת ניגודיות מרבית.
- הכינו את צנתר ורידי הזנב על ידי מילויו במי מלח וחיבורו למזרק המלא בחומר הניגוד.
- רכוש WB טרום ניגודיות וסריקת קו בסיס של הכבד כדי להעריך את נפח הדם היחסי ואת סטאטוזיס הכבד.
- ודא שלא ניתן לזהות ניגודיות בסריקה כאינדיקציה לסילוק מלא של חומר הניגוד הראשון.
- יש להחדיר את הצנתר הממולא מראש לווריד הזנב, ולתת את חומר הניגוד באמצעות הזרקה תוך ורידית המבוצעת לאט וידני, למשך 1-3 דקות (לא כהזרקת בולוס). משאבת מזרק ניתן להשתמש כאשר מוגדר לקצב העירוי המתאים.
- לרכוש סריקות WB וכבד בנקודות זמן שונות, כפי שמצוין בטבלה 1.
הערה: סריקות WB נרכשות ב-PI של 10 דקות ו-4 שעות. פרק הזמן המשמעותי ביניהם מאפשר להעריך את ההתפלגות הביולוגית הנותבת בגוף כמו גם את הפינוי היחסי שלה.
4. חילוץ וניתוח נתונים
הערה: בפרוטוקול זה, שלבי חילוץ הנתונים והניתוח המבוססים על תוכנת עיבוד הדמיה ספציפית (ראה טבלת חומרים) מסופקים. ייתכן שיהיה צורך להתאים את השלבים המתוארים בעת שימוש בתוכנות שונות.
- הערכה של תצהיר שומנים בכבד / סטאטוזיס.
הערה: להערכת סטאטוזיס בכבד, לא נעשה שימוש בסוכן ניגוד, ומבוצעת השוואה בין שליטה לפתולוגיה. בשל סטיות גבוהות יחסית בתכונות הנחתת רקמות בין עכברים שונים, ערכי הצפיפות מנורמלים עבור הכבד כנגד הטחול (רקמה נטולת שומן) והשומן (רקמות שומן מוחלטות) על פי המשוואה הבאה וכפי שתואר לעיל25: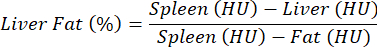
- כדי לבצע את הניתוח, טען את קובץ DICOM של סריקת קדם-הניגודיות, וכוונן את הבר/הניגוד כדי לראות בבירור את רקמת הכבד, הטחול והשומן הלבן (WAT).
- גש לכלי מפעיל המידול דרך התפריט הנפתח של הכלי בלוח הקדמי, ובחר 3D ROI Tool.
- תחת אופרטור החזר השקעה תלת-ממדי, בחר הוסף החזר השקעה כדי ליצור ROI מרובים (עד שמונה עבור כל רקמה) לביצוע דגימה באזורים שבהם הכבד (רצוי באזורים של האונה האמצעית השמאלית, האונה האמצעית הימנית והאונה הצידית השמאלית) והטחול נראים צלולים, ללא כלי דם ושומן נראים לעין.
הערה: עבור WAT, החזר השקעה נבחר באמצע מחסן רקמת השומן הקרביים. האזורים המומלצים מוצגים באיור 2. ניתן ליישם שיטות נורמליזציה באמצעות יחס כבד/טחול וללא הכללת WAT כפי שנקבע קודם לכן31. - תחת מצב צביעה תלת-ממדי והתכונה שחיקה/הרחבה , בחר דו-ממד והשתמש בממשק שמופיע כדי לציין שם וצבע עבור כל החזר השקעה.
- השתמש בכלי החזר ההשקעה על צביעת כדור בקוטר של 8 פיקסלים כדי לצייר באופן ידני את החזר ההשקעה הדו-ממדי.
- בצעו דגימה על-ידי פילוח ה-ROI הדו-ממדי על אזורי העניין באמצעות הכלי Cross Hair במישור הרוחבי, כפי שמוצג באיור 3A.
- לחצו על הנקודה שנבחרה במישור הקשת והעטרה כדי להשלים את הפילוח של החזר ההשקעה הדו-ממדי, כפי שמוצג באיור 3B.
- חזור על התהליך להגדרת שאר ה- ROIs.
הערה: בעת הדגימה, הימנע מאזורי גבול האיברים, מכיוון שהדבר עלול לגרום לרעש ולהשפיע על אמינות ערך יחידת Hounsfield המחושב (HU) של כל החזר השקעה. - לאחר שהיית מרוצה מההחזר על ההשקעה המקוטע, עבור אל ניווט ובחר הצג טבלה כדי להציג את טבלת הכימות המכילה את ערכי HU המחושבים עבור כל החזר השקעה.
הערה: ערכי העניין מפורטים בעמודה "ממוצע", המכילה את ערכי הממוצע המספרי של הווקסלים (HU) הכלולים בהחזר ההשקעה עבור איברי העניין. שים לב לערכי העניין, או שמור את הטבלה כולה על-ידי בחירה באפשרות יצא טבלה. - חשב את ממוצע HU עבור הכבד, הטחול וה- WAT, וחבר את הערכים למשוואה לעיל כדי לחשב את אחוז השומן בכבד.
- ספיגת רקמה תפקודית/העברת שומנים (כילומיקרון) בכבד
הערה: ספיגת רקמה תפקודית/העברת שומנים (כילומיקרון) מנותחת מהסריקות שנרכשו ב-45 דקות ו-48 שעות לאחר עירוי חומר הניגוד הראשון, בהתבסס על שיטה32 שפורסמה בעבר. הניגודיות מחושבת עבור הרקמות ונקודות הזמן השונות באמצעות המשוואה הבאה: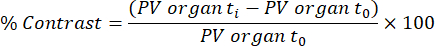
איבר PV t i הוא ערך הפיקסלים הממוצע באיבר בזמן t i (בין 0 שעות ל-48 שעות), ואיבר PV t0 הוא ערך הפיקסלים הממוצע באיבר בתמונה ללא ניגודיות.- כדי לבצע ניתוח זה, טען את קובץ DICOM של סריקת eXIA, והתאם את הבר/הניגוד כדי לראות בבירור את הכבד, הטחול והחדר השמאלי.
- גש למפעיל המידול דרך התפריט הנפתח של הכלי בלוח הקדמי, ובחר 3D ROI Tool.
- תחת אופרטור החזר השקעה תלת-ממדי, בחר הוסף החזר השקעה כדי לפלח ROI מרובים עבור הכבד.
- תחת מצב צביעה תלת-ממדי ותכונת שחיקה/הרחבה , השתמש בכלי החזר ההשקעה על צביעה כדורית בקוטר של 8 פיקסלים ושחיקה של -1.
הערה: בחר החזר השקעה מרובים על פרוסות שבהן כל איבר מופיע בבירור. הימנע מאזורי גבול, מכיוון שהדבר עלול לגרום לרעש ולהשפיע על אמינות ערך ה- HU המחושב של כל החזר השקעה. התוצאה תהיה דגימה של מספר ROI תלת-ממדי, המתאימים לנפחי איברים קטנים. - השתמש בממשק שמופיע כדי לציין שם וצבע עבור כל החזר השקעה.
- לאחר שתהיה מרוצה מההחזר על ההשקעה המתוכנן, עבור אל ניווט ובחר הצג טבלה כדי להציג את טבלת הכימות המכילה את ערכי HU המחושבים עבור כל החזר השקעה.
הערה: ערכי העניין מפורטים תחת העמודה "ממוצע", המציגה את ערכי הממוצע המספרי של הווקסלים (HU) הכלולים בהחזר ההשקעה. ערך HU הממוצע של החזר ההשקעה של כל איבר מתאים לאיבר PV ti. שים לב לערכי העניין, או שמור את הטבלה כולה על-ידי בחירה באפשרות יצא טבלה. - כדי לקבל איבר PV t0, חזור על כל השלבים לעיל באמצעות קובץ DICOM טרום ניגודיות כדי לחשב את הבהירות הממוצעת של הכבד, הטחול והחדר השמאלי לפני הזרקת חומר הניגוד.
- הכנס את הערכים למשוואה לעיל כדי לחלץ את אחוז הניגודיות המתאים לספיגת הרקמה הפונקציונלית/העברת שומנים (כילומיקרון).
- ארכיטקטורה וצפיפות של רשת כלי הדם בכבד
הערה: ניתוח הארכיטקטורה והצפיפות של רשת כלי הדם בכבד מבוסס על מתודולוגיה שפורסמה בעבר33 ומבוצעת על סריקות הכבד המתקבלות 10 דקות PI של סוכן הניגוד השני.- כדי לבצע ניתוח זה, טען את קובץ DICOM של סריקת ExiTron וכוונן את הבר/הניגוד כדי לראות בבירור את רשת כלי הדם בכבד.
- גש למפעיל המידול דרך התפריט הנפתח של הכלי בלוח הקדמי, ובחר 3D ROI Tool.
- תחת אופרטור החזר השקעה תלת-ממדי, בחר הוסף החזר השקעה כדי ליצור החזר השקעה תלת-ממדי עבור הכבד.
- תחת מצב צביעה תלת-ממדית והתכונה שחיקה/הרחבה , בחר תלת-ממד.
הערה: השתמש בכלי החזר השקעה על צביעה כדורית עם שחיקה -1 כדי להגדיר את שכבות הסגמנטציה על פני מישור העטרה. יש להתאים את קוטר כלי צביעת החזר ההשקעה בהתאם לכל שכבה (להוספה/מחיקה של בחירות ווקסל רצויות/לא רצויות). מומלץ להגדיר תחילה את נפח הכבד על פני מישור העטרה, ולאחר מכן ניתן להשתמש במישור הרוחבי והקשת כדי לתקן את החזר ההשקעה. תהליך זה דורש דיוק. על המשתמש להיזהר מאוד שלא לכלול רקמות, כלי דם ועצמות אחרים בעת פילוח כל שכבת ROI תוך הקפדה על כך שכל אזורי הכבד נכללים בהחזר ההשקעה המוגדר. מסיבה זו, היכרות עם הגבולות האנטומיים של הכבד היא קריטית. - לאחר שתהיו מרוצים מההחזר על ההשקעה בכבד שנוצר, בצעו חיתוך על מנת להסיר את כל הווקסלים מנתוני התמונה שאינם שייכים להחזר ההשקעה הראשוני על הכבד. לשם כך, בחר את החזר ההשקעה על הכבד מתוך בורר החזר ההשקעה, ולחץ על סמל ביצוע חיתוך . פעולה זו מסירה את הרקע ומשאירה את החזר ההשקעה על הכבד ללא שינוי.
הערה: למרות שפונקציות ביטול/ביצוע חוזר חלות על כל הפעולות המבוצעות במסגרת כלי החזר ההשקעה התלת-ממדי, לא ניתן לבטל את הפעולה של חיתוך החזר השקעה. לכן, לפני פעולה זו, המשתמש עשוי לשקול לשמור את החזר ההשקעה הראשוני על הכבד בפורמט DICOM. - החזר ההשקעה בכבד המתקבל כולל את רשת כלי הדם ואת הרקמה הסובבת אותה, אותה יש להסיר. לשם כך, אפסו את החזר ההשקעה בכבד על ידי לחיצה על כפתור איפוס מטאטא ROI .
- השתמש בממשק שמופיע כדי להעביר את כל הפיקסלים של החזר ההשקעה על הכבד לרקע.
הערה: החזר ההשקעה על הכבד עדיין יהיה קיים לאחר ניתוח זה, אך הוא לא יכיל עוד ווקסלים. - כדי לפלח מחדש את החזר ההשקעה על הכבד כך שיכיל רק פיקסלים הקשורים לכלי הדם, עבור אל אלגוריתמי סגמנטציה המסומנים בסמל מטה הקסמים, ובחר סף מחובר.
- הגדר את החזר ההשקעה כפלט ואת הרקע כקלט מהתפריט הנפתח של הקלט לפני החלת הסף.
- הגדר את ערכי הסף על-ידי לחיצה על הסמלים Min ו - Max משמאל לכל שדה סף כדי למלא ערכי מקסימום ומינימום ולקבל את רשת כלי הדם.
הערה: רק פיקסלים בטווח שנבחר ייכללו בהחזר ההשקעה שנוצר. התאמת ערכי הסף בין בעלי חיים שונים מבטיחה כי אותם אזורים אנטומיים נלקחים בחשבון ביחס לכמות המדויקת של חומר הניגוד המוזרק לכל חיה. זה קבוע בין הרקמות שנבחרו גם אם הערכים המספריים אינם זהים. - השתמש בכלי כוונת כדי ללחוץ על נקודה שבה רשת כלי הדם נראית ברורה, ולחץ על החל כדי לבצע את הפילוח.
- הפעל את מציג ההקרנה בעוצמה מרבית (MIP).
- הערך את החזר ההשקעה על הכבד המתקבל במונחים של עד כמה ברורה רשת כלי הדם מופיעה בתצוגת MIP.
- אם הרקמה נשארת בחלקים של החזר ההשקעה בכבד, חזור על שלבים 4.3.5-4.3.11 על ידי התאמת ערך הסף המינימלי עד להחזר ההשקעה המקוטע בכבד המייצג בבירור את רשת כלי הדם.
- לאחר שתהיו מרוצים מההחזר על ההשקעה בכבד שנוצר, צרו את טבלת הכימות המכילה את נפח החזר ההשקעה המחושב על הכבד במילימטרים מעוקבים.
הערה: הערכים המעניינים מפורטים בעמודה "mm3", המכילה את ערך הנפח המספרי של הווקסלים (HU) הכלולים בהחזר ההשקעה על הכבד. שים לב לערכי העניין, או שמור את הטבלה כולה על-ידי בחירה באפשרות יצא טבלה.
- נפח הדם היחסי בכבד
הערה: למדידת נפח הדם היחסי בכבד (rBV), אשר מתואם באופן משמעותי עם כמות כלי הדם החדשים שנוצרו במהלך התקדמות פיברוזיס, סריקות טרום ניגודיות וסריקות ב 4 שעות לאחר הזרקת סוכן הניגוד השני משמשים. הניתוח מבוצע כמתואר לעיל34.- לביצוע ניתוח זה, טען את קובץ DICOM של סריקת ExiTron והתאם את הבר/הניגודיות.
הערה: הפוך את מציג MIP ללא זמין: תחת העדפות, סמן את התיבה כדי להשבית את מציג MIP בעת הטעינה. עבור ערכות נתונים גדולות, הדבר יכול לשפר את מהירות הטעינה. - גש למפעיל המידול דרך התפריט הנפתח של הכלי בלוח הקדמי, ובחר 3D ROI Tool. כלי זה מספק אפשרויות מתקדמות לציור, הצגה חזותית, שמירה וכימות של אזורים דו-ממדיים ותלת-ממדיים.
- תחת אופרטור החזר השקעה תלת-ממדי, בחר הוסף החזר השקעה, וחלק שני ROIs: אחד עבור הכבד ואחד עבור כלי דם גדול.
- תחת מצב צביעה תלת-ממדית והתכונה שחיקה/הרחבה , בחר דו-ממד.
הערה: מומלץ להשתמש בכלי החזר ההשקעה על צבע כדור בקוטר של 8-10 פיקסלים לכבד ו-4-6 פיקסלים לכלי הדם. עם זאת, ניתן להתאים את קוטר כלי הצבע בהתאם לגודל השטח שנבחר. - השתמש בממשק שמופיע כדי לציין שם וצבע עבור כל החזר השקעה.
הערה: בחר שתיים עד חמש פרוסות של חלקים מרכזיים של הרקמות המעניינות, והגדר את שכבות הסגמנטציה כדי ליצור ROI דו-ממדי עבור כל רקמה. בעת בחירת האזורים בכל פרוסה, הימנעו מאזורי גבול האיברים, כפי שמוצג באיור 4, מכיוון שהדבר עלול לגרום לרעש ולהשפיע על אמינות ערך ה-HU המחושב של כל החזר השקעה. - לאחר שתהיה מרוצה מההחזר על ההשקעה המתוכנן, עבור אל ניווט ובחר הצג טבלה כדי להציג את טבלת הכימות המכילה את ערכי HU המחושבים עבור כל החזר השקעה.
הערה: ערכי העניין מפורטים תחת העמודה "ממוצע", המציגה את ערכי הממוצע המספרי של הווקסלים (HU) הכלולים בהחזר ההשקעה. שים לב לערכי העניין, או שמור את הטבלה כולה על-ידי בחירה באפשרות יצא טבלה. - חזור על כל השלבים עבור קובץ DICOM לפני הניגודיות כדי לקבל את הבהירות הממוצעת של הכבד לפני הזרקת חומר הניגוד. לשם כך, בצע שלבים 4.4.2-4.4.5 עבור הכבד בלבד.
- חשב את ערכי HU הממוצעים עבור כל רקמה בנקודות הזמן המקבילות, והכנס את הערכים המתקבלים למשוואה להלן:
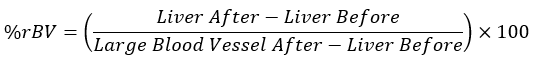
הערה: כלי דם גדול לאחר הזרקת חומר ניגוד נחשב 100% rBV, והכבד, לפני מתן חומר ניגוד, נחשב 0% rBV.
- לביצוע ניתוח זה, טען את קובץ DICOM של סריקת ExiTron והתאם את הבר/הניגודיות.
- קוטר וריד הפורטל
הערה: עבור מדידות קוטר ורידים פורטליים, אותן סריקות המשמשות למדידות rBV בכבד מנותחות כפי שתואר קודם לכן35.- טען את קובץ DICOM של סריקת ExiTron וכוונן את הפסול/הניגודיות.
- אתרו את המישורים הרוחביים של שלוש עד ארבע פרוסות מעל צומת הוורידים המזנטריים והספלניים העליונים (איור 5).
- השתמשו בכלי סרגל למדידת המרחק המדויק בין שתי נקודות (כלומר, קוטר אזור הווריד המעגלי).
הערה: המרחק מחולץ בתמונה, אך ניתן גם לעבור אל ניווט ולבחור הצג טבלה כדי להציג את טבלת הכימות המכילה את המרחק המחושב או לבחור יצא טבלה כדי לשמור את התוצאה.
תוצאות
במחקר מייצג זה, הדמיית מיקרו-CT ללא כל חומר ניגוד הצביעה על אחוז גבוה יותר של שומן בכבד בעכברים עם NAFLD בהשוואה לבקרות (טבלה 2), ואישרה את הפתולוגיה. באמצעות חומר הניגוד ExiTron וארכיטקטורת רשת כלי הדם בכבד וניתוח הצפיפות שתוארו לעיל, צפיפות הנפח הכוללת של רשת כלי הדם בכבד נמצאה גבוהה יות?...
Discussion
השיטה המומלצת כיום לאבחון והיערכות NAFLD בבני אדם היא ביופסיית כבד, הטומנת בחובה סיכון לדימום מורכב, כמו גם לאי דיוקי דגימה40. להיפך, במודלים של בעלי חיים, אבחון כזה מבוצע על ידי היסטולוגיה לאחר המוות, אם כי פרוטוקולים לביופסיה של כבד שרידות זמינים כיום ומומלצים כאשר תכנון המחקר מ...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
איור 1 נוצר באמצעות BioRender.com. עבודה זו נתמכה על ידי הקרן ההלנית למחקר וחדשנות (#3222 עד A.C). אנה חג'יהמבי ממומנת על ידי מכון רוג'ר ויליאמס להפטולוגיה, הקרן לחקר הכבד.
Materials
| Name | Company | Catalog Number | Comments |
| eXIA160 | Binitio Biomedical, Inc. | https://www.binitio.com/?Page=Products | |
| High fat diet with 60% of kilocalories from fat | Research Diets, New Brunswick, NJ, USA | D12492 | |
| High-fructose corn syrup | Best flavors, CA | hfcs-1gallon | |
| Lacrinorm ophthalmic ointment | Bausch & Lomb | ||
| Normal diet with 10% of kilocalories from fat | Research Diets, New Brunswick, NJ, USA | D12450 | |
| Viscover ExiTron nano 12000 | Milteny Biotec, Bergisch Gladbach, Germany | 130-095-698 | |
| VivoQuant | Invicro | ||
| X-CUBE | Molecubes, Belgium | https://www.molecubes.com/systems/ |
References
- Lazarus, J. V., et al. Advancing the global public health agenda for NAFLD: A consensus statement. Nature Reviews. Gastroenterology & Hepatology. 19 (1), 60-78 (2022).
- Takahashi, Y., Fukusato, T. Histopathology of non-alcoholic fatty liver disease/non-alcoholic steatohepatitis. World Journal of Gastroenterology. 20 (42), 15539-15548 (2014).
- Huang, D. Q., El-Serag, H. B., Loomba, R. Global epidemiology of NAFLD-related HCC: Trends, predictions, risk factors and prevention. Nature Reviews Gastroenterology & Hepatology. 18 (4), 223-238 (2021).
- Niederseer, D., Wernly, B., Aigner, E., Stickel, F., Datz, C. NAFLD and cardiovascular diseases: Epidemiological, mechanistic and therapeutic considerations. Journal of Clinical Medicine. 10 (3), 467 (2021).
- Lefere, S., et al. Differential effects of selective- and pan-PPAR agonists on experimental steatohepatitis and hepatic macrophages. Journal of Hepatology. 73 (4), 757-770 (2020).
- Chrysavgis, L., Papatheodoridi, A. M., Chatzigeorgiou, A., Cholongitas, E. The impact of sodium glucose co-transporter 2 inhibitors on non-alcoholic fatty liver disease.Journal of Gastroenterology and Hepatology. Journal of Gastroenterology and Hepatology. 36 (4), 893-909 (2021).
- Li, M., Qian, M., Xu, J. Vascular endothelial regulation of obesity-associated insulin resistance. Frontiers in Cardiovascular Medicine. 4, 51 (2017).
- Pi, X., Xie, L., Patterson, C. Emerging roles of vascular endothelium in metabolic homeostasis. Circulation Research. 123 (4), 477-494 (2018).
- Chiu, J. J., Chien, S. Effects of disturbed flow on vascular endothelium: Pathophysiological basis and clinical perspectives. Physiological Reviews. 91 (1), 327-387 (2011).
- Koyama, Y., Brenner, D. A. Liver inflammation and fibrosis. The Journal of Clinical Investigation. 127 (1), 55-64 (2017).
- Nasiri-Ansari, N., et al. Endothelial cell dysfunction and non-alcoholic fatty liver disease (NAFLD): A concise review. Cells. 11 (16), 2511 (2022).
- Lefere, S., et al. Angiopoietin-2 promotes pathological angiogenesis and is a therapeutic target in murine non-alcoholic fatty liver disease. Hepatology. 69 (3), 1087-1104 (2019).
- Pasarin, M., et al. Insulin resistance and liver microcirculation in a rat model of early NAFLD. Journal of Hepatology. 55 (5), 1095-1102 (2011).
- Hammoutene, A., Rautou, P. E. Role of liver sinusoidal endothelial cells in non-alcoholic fatty liver disease. Journal of Hepatology. 70 (6), 1278-1291 (2019).
- Sun, X., Harris, E. N. New aspects of hepatic endothelial cells in physiology and non-alcoholic fatty liver disease. American Journal of Physiology. Cell Physiology. 318 (6), C1200-C1213 (2020).
- Iwakiri, Y., Shah, V., Rockey, D. C. Vascular pathobiology in chronic liver disease and cirrhosis - current status and future directions. Journal of Hepatology. 61 (4), 912-924 (2014).
- Baffy, G. Origins of portal hypertension in non-alcoholic fatty liver disease. Digestive Diseases and Sciences. 63 (3), 563-576 (2018).
- Ruhli, F. J., Kuhn, G., Evison, R., Muller, R., Schultz, M. Diagnostic value of micro-CT in comparison with histology in the qualitative assessment of historical human skull bone pathologies. American Journal of Physical Anthropology. 133 (4), 1099-1111 (2007).
- Rodt, T., et al. Micro-computed tomography of pulmonary fibrosis in mice induced by adenoviral gene transfer of biologically active transforming growth factor-beta1. Respiratory Research. 11 (1), 181 (2010).
- Deng, L., Xiao, S. M., Qiang, J. W., Li, Y. A., Zhang, Y. Early lung adenocarcinoma in mice: Micro-computed tomography manifestations and correlation with pathology. Translational Oncology. 10 (3), 311-317 (2017).
- Feng, J., et al. Abnormalities in the enamel in bmp2-deficient mice. Cells, Tissues, Organs. 194 (2-4), 216-221 (2011).
- Kagadis, G. C., Loudos, G., Katsanos, K., Langer, S. G., Nikiforidis, G. C. In vivo small animal imaging: current status and future prospects. Medical Physics. 37 (12), 6421-6442 (2010).
- Starosolski, Z., et al. Ultra high-resolution in vivo computed tomography imaging of mouse cerebrovasculature using a long circulating blood pool contrast agent. Scientific Reports. 5, 10178 (2015).
- Caussy, C., Reeder, S. B., Sirlin, C. B., Noninvasive Loomba, R. quantitative assessment of liver fat by MRI-PDFF as an endpoint in NASH trials. Hepatology. 68 (2), 763-772 (2018).
- Lubura, M., et al. Non-invasive quantification of white and brown adipose tissues and liver fat content by computed tomography in mice. PLoS One. 7 (5), e37026 (2012).
- Perciedu Sert, N., et al. The ARRIVE guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biology. 18 (7), e3000410 (2020).
- Tetri, L. H., Basaranoglu, M., Brunt, E. M., Yerian, L. M., Neuschwander-Tetri, B. A. Severe NAFLD with hepatic necroinflammatory changes in mice fed trans fats and a high-fructose corn syrup equivalent. American Journal of Physiology. Gastrointestinal and Liver Physiology. 295 (5), G987-G995 (2008).
- Machado, M. V., et al. Mouse models of diet-induced non-alcoholic steatohepatitis reproduce the heterogeneity of the human disease. PLoS One. 10 (5), 0127991 (2015).
- Jensen, T., et al. Fructose and sugar: A major mediator of non-alcoholic fatty liver disease. Journal of Hepatology. 68 (5), 1063-1075 (2018).
- Nevzorova, Y. A., Boyer-Diaz, Z., Cubero, F. J., Gracia-Sancho, J. Animal models for liver disease - A practical approach for translational research. Journal of Hepatology. 73 (2), 423-440 (2020).
- De Rudder, M., et al. Automated computerized image analysis for the user-independent evaluation of disease severity in preclinical models of NAFLD/NASH. Laboratory Investigation. 100 (1), 147-160 (2020).
- Willekens, I., et al. Time-course of contrast enhancement in spleen and liver with Exia 160, Fenestra LC, and VC. Molecular Imaging and Biology. 11 (2), 128-135 (2009).
- Das, N. M., et al. In vivo quantitative microcomputed tomographic analysis of vasculature and organs in a normal and diseased mouse model. PLoS One. 11 (2), e0150085 (2016).
- Ehling, J., et al. CCL2-dependent infiltrating macrophages promote angiogenesis in progressive liver fibrosis. Gut. 63 (12), 1960-1971 (2014).
- Zhang, J., et al. Gamna-Gandy bodies of the spleen detected with susceptibility weighted imaging: maybe a new potential non-invasive marker of esophageal varices. PLoS One. 8 (1), e55626 (2013).
- Chen, Y., Li, J., Zhou, Q., Lyu, G., Li, S. Detection of liver and spleen stiffness in rats with portal hypertension by two-dimensional shear wave elastography. BMC Medical Imaging. 22 (1), 68 (2022).
- Lessa, A. S., et al. Ultrasound imaging in an experimental model of fatty liver disease and cirrhosis in rats. BMC Veterinary Research. 6, 6 (2010).
- Abikhzer, G., Alabed, Y. Z., Azoulay, L., Assayag, J., Rush, C. Altered hepatic metabolic activity in patients with hepatic steatosis on FDG PET/CT. AJR. American Journal of Roentgenology. 196 (1), 176-180 (2011).
- Newman, E. M., Rowland, A. A physiologically based pharmacokinetic model to predict the impact of metabolic changes associated with metabolic associated fatty liver disease on drug exposure. International Journal of Molecular Sciences. 23 (19), 11751 (2022).
- Tsai, E., Lee, T. P. Diagnosis and evaluation of non-alcoholic fatty liver disease/non-alcoholic steatohepatitis, including noninvasive biomarkers and transient elastography. Clinics in Liver Disease. 22 (1), 73-92 (2018).
- Oldham, S., Rivera, C., Boland, M. L., Trevaskis, J. L. Incorporation of a survivable liver biopsy procedure in mice to assess non-alcoholic steatohepatitis (NASH) resolution. Journal of Visualized Experiments. 146, e59130 (2019).
- Boll, H., et al. Comparison of Fenestra LC, ExiTron nano 6000, and ExiTron nano 12000 for micro-CT imaging of liver and spleen in mice. Academic Radiology. 20 (9), 1137-1143 (2013).
- Ashton, J. R., West, J. L., Badea, C. T. In vivo small animal micro-CT using nanoparticle contrast agents. Frontiers in Pharmacology. 6, 256 (2015).
- Rothe, J. H., et al. Time course of contrast enhancement by micro-CT with dedicated contrast agents in normal mice and mice with hepatocellular carcinoma: Comparison of one iodinated and two nanoparticle-based agents. Academic Radiology. 22 (2), 169-178 (2015).
- Toczek, J., et al. Computed tomography imaging of macrophage phagocytic activity in abdominal aortic aneurysm. Theranostics. 11 (12), 5876-5888 (2021).
- Mannheim, J. G., et al. Comparison of small animal CT contrast agents. Contrast Media & Molecular Imaging. 11 (4), 272-284 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved