È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Nuove tecniche di imaging con tomografia microcomputerizzata in vivo per valutare la progressione della steatosi epatica non alcolica
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Utilizzando un modello murino di steatosi epatica non alcolica (NAFLD) indotto dalla dieta, descriviamo l'uso di nuove tecniche di imaging di tomografia microcomputerizzata in vivo come metodo non invasivo per valutare le fasi di progressione della NAFLD, concentrandoci prevalentemente sulla rete vascolare epatica a causa del suo significativo coinvolgimento nella disregolazione epatica correlata alla NAFLD.
Abstract
La steatosi epatica non alcolica (NAFLD) è un problema di salute globale in crescita e l'impatto della NAFLD è aggravato dall'attuale mancanza di trattamenti efficaci. Considerevoli fattori limitanti che ostacolano la diagnosi tempestiva e accurata (incluso il grading) e il monitoraggio della NAFLD, nonché lo sviluppo di potenziali terapie, sono le attuali inadeguatezze nella caratterizzazione della struttura del microambiente epatico e nella valutazione dello stadio della malattia in modo spazio-temporale e non invasivo. Utilizzando un modello murino di NAFLD indotto dalla dieta, abbiamo studiato l'uso di tecniche di imaging con micro-tomografia computerizzata (TC) in vivo come metodo non invasivo per valutare le fasi di progressione della NAFLD, concentrandoci prevalentemente sulla rete vascolare epatica a causa del suo significativo coinvolgimento nella disregolazione epatica correlata alla NAFLD. Questa metodologia di imaging consente l'analisi longitudinale della steatosi epatica e dell'assorbimento funzionale del tessuto, nonché la valutazione del volume ematico relativo, del diametro della vena porta e della densità della rete vascolare. Comprendere gli adattamenti della rete vascolare epatica durante la progressione della NAFLD e correlarli con altri modi di caratterizzare la progressione della malattia (steatosi, infiammazione, fibrosi) utilizzando il metodo proposto può aprire la strada alla creazione di nuovi approcci più efficienti e riproducibili per la ricerca sulla NAFLD nei topi. Si prevede inoltre che questo protocollo migliorerà il valore dei modelli animali preclinici per lo studio dello sviluppo di nuove terapie contro la progressione della malattia.
Introduzione
La steatosi epatica non alcolica (NAFLD) è una malattia metabolica che colpisce circa il 25% della popolazione e il >80% delle persone patologicamente obese1. Si stima che un terzo di questi individui progredisca verso la steatoepatite non alcolica (NASH), che è caratterizzata da steatosi epatica, infiammazione e fibrosi2. La NASH è uno stadio della malattia con un rischio significativamente più elevato di sviluppo di cirrosi e carcinoma epatocellulare (HCC)3,4. Per questo motivo, la NASH è attualmente la seconda causa più comune di trapianto di fegato e si prevede che presto diventerà anche il più importante predittore di trapianto di fegato 5,6,7. Nonostante la sua prevalenza e gravità, non è disponibile alcuna terapia specifica per la NAFLD e i trattamenti esistenti mirano solo ad affrontare le patologie associate alla malattia come l'insulino-resistenza e l'iperlipidemia 5,6.
Negli ultimi anni, il ruolo fisiopatologico e gli adattamenti dell'endotelio e, in generale, della rete vascolare dei tessuti metabolici, come il tessuto adiposo e il fegato, stanno acquisendo maggiore importanza nella ricerca, soprattutto durante l'obesità e la disregolazione metabolica 7,8. L'endotelio è un monostrato cellulare che riveste internamente la rete vascolare, fungendo da barriera funzionale e strutturale. Contribuisce inoltre a vari processi fisiologici e patologici, come la trombosi, il trasporto di metaboliti, l'infiammazione e l'angiogenesi 9,10. Nel caso del fegato, la rete vascolare è, tra le altre caratteristiche, caratterizzata dalla presenza di cellule altamente specializzate, definite cellule endoteliali sinusoidali epatiche (LSEC). Queste cellule sono prive di una membrana basale e hanno più fenestrae, consentendo un più facile trasferimento di substrati tra il sangue e il parenchima epatico. A causa della loro posizione anatomica e delle loro caratteristiche distintive, gli LSEC hanno probabilmente un ruolo cruciale nei processi fisiopatologici del fegato, compreso lo sviluppo dell'infiammazione e della fibrosi epatica durante la NAFLD/NASH. Infatti, gli adattamenti patologici, molecolari e cellulari che le LSEC subiscono nel corso della NAFLD contribuiscono alla progressione della malattia11. In particolare, l'angiogenesi epatica LSEC-dipendente che avviene durante la NAFLD è significativamente associata allo sviluppo dell'infiammazione e alla progressione della malattia verso la NASH o addirittura l'HCC12. Inoltre, la NAFLD precoce correlata all'obesità è caratterizzata dallo sviluppo di insulino-resistenza nelle LSEC, che precede lo sviluppo di infiammazione epatica o altri segni avanzati di NAFLD13.
Inoltre, le LSEC sono recentemente emerse come regolatori centrali del flusso sanguigno epatico e degli adattamenti della rete vascolare durante le malattie epatiche di diverse eziologie14,15. Infatti, la malattia epatica cronica è caratterizzata da una prominente vasocostrizione intraepatica e da una maggiore resistenza al flusso sanguigno, che contribuiscono allo sviluppo dell'ipertensione portale16. Nel caso della NAFLD, diversi meccanismi correlati alla LSEC contribuiscono a questo fenomeno. Ad esempio, l'insulino-resistenza specifica per LSEC, come accennato in precedenza, è associata a una ridotta vasodilatazione insulino-dipendente della vascolarizzazione epatica13. Inoltre, nel corso della malattia, la vascolarizzazione del fegato diventa più sensibile ai vasocostrittori, contribuendo ulteriormente alla compromissione del flusso sanguigno epatico e portando all'insorgenza di stress da taglio, che si traducono entrambi in un'interruzione della microcircolazione sinusoidale17. Questi fatti suggeriscono che la vascolarizzazione è un bersaglio chiave nelle malattie del fegato. Tuttavia, i fattori limitanti che ostacolano la diagnosi e il monitoraggio tempestivi della NAFLD/NASH, nonché lo sviluppo di potenziali terapie, sono le inadeguatezze nella caratterizzazione coerente del microambiente epatico e della struttura (micro)vascolare, nonché il punteggio dello stadio della malattia in modo spazio-temporale e non invasivo.
L'imaging con tomografia microcomputerizzata (TC) è attualmente il metodo di imaging non invasivo gold standard per rappresentare accuratamente le informazioni anatomiche all'interno di un organismo vivente. La micro-TC e la risonanza magnetica rappresentano due metodi di imaging complementari in grado di coprire una vasta gamma di patologie e fornire una risoluzione e un dettaglio eccezionali nelle strutture e nei tessuti ripresi. La micro-TC, in particolare, è uno strumento molto veloce e preciso che viene spesso utilizzato per studiare patologie come le malattie ossee e le alterazioni della superficie ossea associate18, valutare la progressione della fibrosi polmonare nel tempo19, diagnosticare il cancro del polmone e la sua stadiazione20, o ancora esaminare le patologie dentali21, senza alcuna particolare preparazione (o distruzione) dei campioni sottoposti a imaging.
La tecnologia di imaging della micro-TC si basa sulle diverse proprietà di attenuazione dei vari organi in termini di interazione dei raggi X con la materia. Gli organi che presentano elevate differenze di attenuazione dei raggi X sono rappresentati con un contrasto elevato nelle immagini TC (ad esempio, i polmoni appaiono scuri e le ossa chiare). Gli organi che presentano proprietà di attenuazione molto simili (tessuti molli diversi) sono difficili da distinguere nelle immagini TC22. Per affrontare questa limitazione, agenti di contrasto specializzati a base di iodio, oro e bismuto sono stati ampiamente studiati per l'uso in vivo . Questi agenti alterano le proprietà di attenuazione dei tessuti in cui si accumulano, vengono eliminati lentamente dalla circolazione e consentono l'opacizzazione uniforme e stabile dell'intero sistema vascolare o dei tessuti scelti23.
Nella diagnostica umana, l'imaging TC e tecniche analoghe, come la frazione grassa a densità protonica derivata dalla risonanza magnetica, sono già in uso per la determinazione del contenuto di grasso epatico24,25. Nel contesto della NAFLD, un elevato contrasto dei tessuti molli è essenziale per distinguere con precisione le lesioni patologiche o i piccoli vasi. A tale scopo, vengono utilizzati agenti di contrasto che forniscono un maggiore contrasto delle caratteristiche del tessuto epatico. Tali strumenti e materiali consentono lo studio di molteplici caratteristiche epatiche e di possibili espressioni patologiche, come l'architettura e la densità della rete vascolare, la deposizione/steatosi lipidica e l'assorbimento funzionale del tessuto/trasferimento di lipidi (chilomicroni) nel fegato. Inoltre, è possibile valutare anche il volume ematico relativo epatico e il diametro della vena porta. In un tempo di scansione molto breve, tutti questi parametri forniscono informazioni diverse e complementari sulla valutazione e la progressione della NAFLD, che possono essere utilizzate per sviluppare una diagnosi non invasiva e dettagliata.
In questo articolo, forniamo un protocollo passo-passo per l'uso di nuove tecniche di imaging micro-CT in vivo come metodo non invasivo per valutare le fasi di progressione della NAFLD. Utilizzando questo protocollo, l'analisi longitudinale della steatosi epatica e dell'assorbimento funzionale del tessuto, nonché la valutazione del volume ematico relativo, del diametro della vena porta e della densità della rete vascolare, possono essere eseguite e applicate in modelli murini di malattia epatica.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutte le procedure sono state eseguite dal personale BIOEMTECH in conformità con le normative europee e nazionali in materia di benessere e sono state approvate dalle autorità nazionali (numero di licenza EL 25 BIOexp 45/PN 49553 21/01/20). Tutti gli esperimenti sono stati progettati e riportati in conformità alle linee guida ARRIVE26. I topi sono stati acquistati dall'Istituto Ellenico Pasteur di Atene, in Grecia.
NOTA: Gli animali sono stati alloggiati in gruppo in gabbie ventilate singolarmente arricchite con binari e tubi di cartone in una stanza a 20-22 °C, con un'umidità relativa del 50%-60% e un ciclo luce/buio di 12 ore (luce 07:00-19:00). Una combinazione di una dieta ricca di grassi (HFD) e sciroppo di mais ad alto contenuto di fruttosio (HFCS), un dolcificante contenente fruttosio e glucosio ampiamente utilizzato nei moderni tipi di diete arricchite di grassi, è stata utilizzata per indurre la NAFLD come modello affidabilericonosciuto 27,28,29,30. A 7-8 settimane di età, i topi maschi C57BL/6 hanno avuto accesso ad libitum a una dieta normale (n = 2) con il 10% di chilocalorie da grassi o a un HFD (n = 2) contenente il 60% di chilocalorie da grassi integrati con il 5% di HFCS in acqua per 22 settimane. Il peso corporeo è stato ottenuto settimanalmente utilizzando una bilancia digitale e, durante il periodo sperimentale, il benessere degli animali è stato monitorato a giorni alterni utilizzando un foglio di valutazione. Alla fine del protocollo di imaging, i topi sono stati soppressi tramite lussazione cervicale.
1. Preparazione dell'animale
NOTA: Il protocollo di imaging è riassunto nella Figura 1.
- Anestetizzare il topo utilizzando isoflurano al 3%-4% (nell'aria ambiente) e mantenere la temperatura corporea utilizzando un termoforo dedicato.
NOTA: L'assenza di un riflesso di astinenza del pedale deve essere utilizzata per confermare una profondità di anestesia sufficiente prima di iniziare la scansione. - Applicare un unguento oftalmico sugli occhi dell'animale prima della sperimentazione.
- Posizionare l'animale nella culla dello scanner CT, fissare l'ogiva nasale e passare all'isoflurano all'1,5%-3% (nell'aria ambiente) per la manutenzione.
NOTA: L'assenza di un riflesso di astinenza del pedale deve essere utilizzata per confermare la percentuale appropriata di isoflurano per il mantenimento dell'anestesia. - Monitorare continuamente il mouse.
2. Preparazione pre-scansione
NOTA: L'imaging viene eseguito in due fasi sperimentali per consentire al primo mezzo di contrasto di essere adeguatamente eliminato dalla circolazione e dai tessuti. eXIA (primo mezzo di contrasto) viene somministrato nella prima fase ed ExiTron (secondo mezzo di contrasto) nella seconda fase, come descritto nella sezione "Flusso di lavoro di imaging" (paragrafo 3) di seguito.
- Lasciare che il mezzo di contrasto (eXIA o ExiTron, a seconda della fase sperimentale) raggiunga la temperatura ambiente per 3 ore.
- Impostare i seguenti parametri di scansione sullo scanner CT: protocollo ad alta risoluzione con una tensione del tubo di 50 kVp e una corrente di 460 μA, non a spirale, 720 proiezioni/rotazione, quattro rotazioni e tempo di acquisizione di 4 minuti.
3. Flusso di lavoro di imaging
- Fase sperimentale 1
- Calcolare e preparare il volume del primo mezzo di contrasto da somministrare alla dose non diluita di 6 μL/g di peso corporeo per ottenere il massimo contrasto.
- Preparare il catetere della vena caudale riempiendolo di soluzione fisiologica e collegandolo alla siringa riempita con il mezzo di contrasto.
- Acquisire una scansione pre-contrasto dell'intero corpo (WB) e del fegato al basale.
- Assicurarsi che non vi siano bolle o ostruzioni nella siringa o nel catetere.
- Inserire il catetere preriempito nella vena caudale e somministrare il mezzo di contrasto tramite un'iniezione eseguita lentamente e manualmente, della durata di 1-3 minuti (non come iniezione in bolo). È possibile utilizzare una pompa a siringa quando è impostata sulla velocità di infusione appropriata.
NOTA: La coda dell'animale può essere posta in acqua tiepida per indurre la vasodilatazione e facilitare l'inserimento del catetere - Acquisire scansioni WB ed epatiche in momenti diversi, come indicato nella Tabella 1.
NOTA: Se l'acquisizione di tutti i punti non è possibile, l'attenzione deve essere posta su 45 minuti dopo l'iniezione (PI), che è il punto di massimo assorbimento epatico, e 48 h PI, che è quando viene raggiunta la clearance.
- Fase sperimentale 2
- Preparare nuovamente il topo come descritto nel paragrafo 1 per la somministrazione del secondo mezzo di contrasto 10 giorni dopo la lettura finale con il primo mezzo di contrasto (48 h PI).
- Eseguire i passaggi 2.1-2.2.
- Calcolare e preparare il volume del secondo mezzo di contrasto da somministrare alla dose non diluita di 8 μL/g di peso corporeo per ottenere il massimo contrasto.
- Preparare il catetere della vena caudale riempiendolo di soluzione fisiologica e collegandolo alla siringa riempita con il mezzo di contrasto.
- Acquisire una scansione del WB e del basale epatico pre-mezzo di contrasto per valutare il volume ematico relativo e la steatosi epatica.
- Assicurarsi che non sia rilevabile alcun contrasto nella scansione come indicazione della completa eliminazione del primo mezzo di contrasto.
- Inserire il catetere preriempito nella vena caudale e somministrare il mezzo di contrasto tramite un'iniezione endovenosa eseguita lentamente e manualmente, con una durata di 1-3 minuti (non come iniezione in bolo). È possibile utilizzare una pompa a siringa quando è impostata sulla velocità di infusione appropriata.
- Acquisire scansioni WB ed epatiche in momenti diversi, come indicato nella Tabella 1.
NOTA: Le scansioni WB vengono acquisite a 10 min e 4 h PI. Il significativo lasso di tempo tra di loro consente di valutare la biodistribuzione del tracciante nell'organismo e la sua relativa clearance.
4. Estrazione e analisi dei dati
NOTA: In questo protocollo vengono fornite le fasi di estrazione e analisi dei dati basate su uno specifico software di elaborazione delle immagini (vedi Tabella dei materiali). Potrebbe essere necessario adattare i passaggi descritti quando si utilizza un software diverso.
- Valutazione della deposizione/steatosi lipidica epatica.
NOTA: Per la valutazione della steatosi epatica non viene utilizzato alcun mezzo di contrasto e viene eseguito un confronto tra controllo e patologia. A causa delle deviazioni relativamente elevate nelle proprietà di attenuazione dei tessuti tra topi diversi, i valori di densità sono normalizzati per il fegato rispetto alla milza (tessuto privo di grasso) e al grasso (tessuti adiposi assoluti) secondo la seguente equazione e come descrittoin precedenza 25: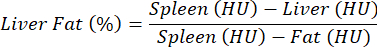
- Per eseguire l'analisi, caricare il file DICOM della scansione pre-contrasto e regolare la barra/contrasto per vedere chiaramente il fegato, la milza e il tessuto adiposo bianco (WAT).
- Accedere allo strumento Operatore di modellazione tramite il menu a discesa dello strumento sul pannello frontale e selezionare Strumento ROI 3D.
- In Operatore ROI 3D, selezionare Aggiungi ROI per generare più ROI (fino a otto per ogni tessuto) per eseguire il campionamento nelle aree in cui il fegato (preferibilmente nelle aree del lobo mediale sinistro, del lobo mediale destro e del lobo laterale sinistro) e la milza appaiono chiare, senza vasi sanguigni e grasso apparenti.
NOTA: Per il WAT, i ROI vengono selezionati al centro del deposito di tessuto adiposo viscerale. Le aree consigliate sono mostrate nella Figura 2. Possono essere applicati anche metodi di normalizzazione che utilizzano il rapporto fegato/milza e senza includere il WAT come stabilito in precedenza31. - In Modalità di disegno 3D e funzione Erode/Dilate , selezionare 2D e utilizzare l'interfaccia visualizzata per specificare un nome e un colore per ogni ROI.
- Utilizza lo strumento ROI di pittura sferica con un diametro di 8 pixel per disegnare manualmente le ROI 2D.
- Eseguire il campionamento segmentando le ROI 2D sulle aree di interesse utilizzando lo strumento Mirino sul piano trasversale, come mostrato nella Figura 3A.
- Fare clic sul punto selezionato sul piano sagittale e coronale per completare la segmentazione del ROI 2D, come mostrato nella Figura 3B.
- Ripeti il processo per definire il resto delle ROI.
NOTA: Durante il campionamento, evitare le regioni di confine dell'organo, in quanto ciò può introdurre rumore e influire sull'affidabilità del valore dell'unità di Hounsfield (HU) calcolato di ciascun ROI. - Una volta soddisfatti dei ROI segmentati, vai a Navigazione e seleziona Mostra tabella per visualizzare la tabella di quantificazione contenente i valori HU calcolati per ogni ROI.
NOTA: I valori di interesse sono elencati nella colonna "Media", che contiene i valori medi numerici dei voxel (HU) contenuti nelle ROI per gli organi di interesse. Prendere nota dei valori di interesse oppure salvare l'intera tabella selezionando Esporta tabella. - Calcola l'HU medio per il fegato, la milza e il WAT e inserisci i valori nell'equazione sopra per calcolare la percentuale di grasso epatico.
- Assorbimento funzionale del tessuto/trasferimento di lipidi (chilomicroni) nel fegato
NOTA: L'assorbimento funzionale del tessuto/trasferimento lipidico (chilomicrono) viene analizzato dalle scansioni acquisite a 45 minuti e 48 ore dopo la prima infusione di mezzo di contrasto, sulla base di un metodoprecedentemente pubblicato 32. Il contrasto viene calcolato per i diversi tessuti e punti temporali utilizzando l'equazione seguente: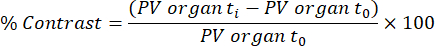
PV organo t i è il valore medio dei pixel nell'organo al tempo t i (compreso tra 0 h e 48 h) e PV organo t0 è il valore medio dei pixel nell'organo nell'immagine senza contrasto.- Per eseguire questa analisi, caricare il file DICOM di scansione eXIA e regolare la barra/contrasto per vedere chiaramente il fegato, la milza e il ventricolo sinistro.
- Accedere a Modelling Operator tramite il menu a discesa dello strumento sul pannello frontale e selezionare 3D ROI Tool.
- In Operatore ROI 3D, seleziona Aggiungi ROI per segmentare più ROI per il fegato.
- Sotto la funzione Modalità disegno 3D ed erode/dilatazione , utilizzare lo strumento ROI della pittura a sfera con un diametro di 8 pixel e un'erosione di −1.
NOTA: Selezionare più ROI su fette in cui ogni organo appare chiaramente. Evitare le regioni di confine, in quanto ciò può introdurre rumore e influire sull'affidabilità del valore HU calcolato di ciascun ROI. Ciò si tradurrà nel campionamento di più ROI 3D, che corrispondono a piccoli volumi di organi. - Utilizzare l'interfaccia visualizzata per specificare un nome e un colore per ogni ROI.
- Una volta soddisfatti dei ROI progettati, vai a Navigazione e seleziona Mostra tabella per visualizzare la tabella di quantificazione contenente i valori HU calcolati per ogni ROI.
NOTA: I valori di interesse sono elencati nella colonna "Media", che visualizza i valori medi numerici dei voxel (HU) inclusi nel ROI. Il valore medio HU del ROI di ciascun organo corrisponde al PV organo ti. Prendere nota dei valori di interesse oppure salvare l'intera tabella selezionando Esporta tabella. - Per ottenere l'organo PV t0, ripetere tutti i passaggi precedenti utilizzando il file DICOM di pre-contrasto per calcolare la luminosità media del fegato, della milza e del ventricolo sinistro prima dell'iniezione del mezzo di contrasto.
- Inserire i valori nell'equazione precedente per estrarre il contrasto percentuale corrispondente all'assorbimento funzionale del tessuto/trasferimento lipidico (chilomicrone).
- Architettura e densità del reticolo vascolare epatico
NOTA: L'analisi dell'architettura e della densità della rete vascolare epatica si basa su una metodologia precedentemente pubblicata33 e viene eseguito sulle scansioni epatiche ottenute 10 min PI del secondo mezzo di contrasto.- Per eseguire questa analisi, caricare il file DICOM di scansione ExiTron e regolare la barra/contrasto per vedere chiaramente la rete vascolare del fegato.
- Accedere a Modelling Operator tramite il menu a discesa dello strumento sul pannello frontale e selezionare 3D ROI Tool.
- In Operatore ROI 3D, seleziona Aggiungi ROI per generare un ROI 3D per il fegato.
- In Modalità disegno 3D e funzione Erode/Dilate , selezionare 3D.
NOTA: Utilizzare lo strumento Sphere paint ROI con erode −1 per definire gli strati di segmentazione lungo il piano coronale. Il diametro dello strumento di pittura ROI deve essere regolato in base a ciascun livello (per aggiungere/eliminare qualsiasi selezione voxel desiderata/indesiderata). Si raccomanda di definire inizialmente il volume del fegato attraverso il piano coronale, quindi i piani trasverso e sagittale possono essere utilizzati per correggere il ROI. Questo processo richiede precisione. L'utente deve fare molta attenzione a non includere altri tessuti, vasi e ossa quando segmenta ogni strato di ROI, assicurandosi che tutte le aree del fegato siano incluse nella ROI definita. Per questo motivo, è fondamentale familiarizzare con i confini anatomici del fegato. - Una volta soddisfatti del ROI epatico risultante, eseguire un taglio per rimuovere tutti i voxel dai dati dell'immagine che non appartengono al ROI del fegato inizialmente segmentato. Per questo, scegli il ROI del fegato dal selettore ROI e fai clic sull'icona Esegui taglio . Questa operazione rimuove lo sfondo e lascia inalterato il ROI del fegato.
NOTA: Sebbene le funzioni di annullamento/ripristino siano applicabili a tutte le operazioni eseguite con lo strumento ROI 3D, l'azione di taglio di una ROI non può essere annullata. Quindi, prima di questa azione, l'utente potrebbe prendere in considerazione la possibilità di salvare il ROI iniziale del fegato in formato DICOM. - Il ROI epatico risultante include la rete vascolare e il tessuto circostante, che deve essere rimosso. Per questo, ripristina il ROI del fegato facendo clic sul pulsante Ripristina ROI scopa.
- Usa l'interfaccia che appare per trasferire tutti i pixel del ROI del fegato sullo sfondo.
NOTA: Il ROI del fegato esisterà ancora dopo questa operazione, ma non conterrà più voxel. - Per risegmentare il ROI del fegato in modo che contenga solo pixel associati al vascolare, vai su Algoritmi di segmentazione indicati dall'icona della bacchetta magica e seleziona Soglia connessa.
- Definisci il ROI come Output e lo sfondo come Input dal menu a discesa dell'input prima di applicare la soglia.
- Impostare le soglie facendo clic sulle icone Min e Max a sinistra di ciascun campo di soglia per inserire i valori massimo e minimo e ottenere la rete vascolare.
NOTA: solo i pixel all'interno dell'intervallo scelto saranno inclusi nel ROI risultante. La regolazione dei valori soglia tra i diversi animali garantisce che le stesse regioni anatomiche siano prese in considerazione rispetto all'esatta quantità di mezzo di contrasto iniettato in ciascun animale. Questo è costante tra i tessuti selezionati anche se i valori numerici non sono identici. - Usa lo strumento Mirino per fare clic su un punto in cui la rete vascolare appare chiara e fai clic su Applica per eseguire la segmentazione.
- Attivare il visualizzatore di proiezione di massima intensità (MIP).
- Valutare il ROI epatico risultante in termini di chiarezza della rete vascolare nella vista MIP.
- Se il tessuto rimane in parti della ROI epatica, ripetere i passaggi 4.3.5-4.3.11 regolando il valore di soglia Min fino a quando la ROI epatica segmentata rappresenta chiaramente la rete vascolare.
- Una volta soddisfatti del ROI epatico risultante, generare la tabella di quantificazione contenente il volume di ROI epatico calcolato in millimetri cubi.
NOTA: I valori di interesse sono elencati nella colonna "mm3", che contiene il valore volumetrico numerico dei voxel (HU) contenuti nel ROI epatico. Prendere nota dei valori di interesse oppure salvare l'intera tabella selezionando Esporta tabella.
- Volume ematico relativo epatico
NOTA: Per la misurazione del volume ematico relativo epatico (rBV), che è correlato in modo significativo con la quantità di vasi sanguigni di nuova formazione durante la progressione della fibrosi, vengono utilizzate scansioni pre-contrasto e scansioni a 4 ore dopo la seconda iniezione di mezzo di contrasto. L'analisi viene eseguita come descritto in precedenza34.- Per eseguire questa analisi, caricare il file DICOM di scansione ExiTron e regolare la barra/contrasto.
NOTA: Disabilitare il visualizzatore MIP: in Preferenze, selezionare la casella per disabilitare il visualizzatore MIP al momento del caricamento. Per set di dati di grandi dimensioni, questo può migliorare la velocità di caricamento. - Accedere a Modelling Operator tramite il menu a discesa dello strumento sul pannello frontale e selezionare 3D ROI Tool. Questo strumento fornisce opzioni avanzate per disegnare, visualizzare, salvare e quantificare le regioni 2D e 3D.
- In Operatore ROI 3D, seleziona Aggiungi ROI e segmenta due ROI: una per il fegato e una per un vaso sanguigno di grandi dimensioni.
- In Modalità disegno 3D e funzione Erode/Dilatazione , selezionare 2D.
NOTA: Si consiglia di utilizzare lo strumento Sphere paint ROI con un diametro di 8-10 pixel per il fegato e 4-6 pixel per il vaso sanguigno. Tuttavia, il diametro dello strumento di disegno può essere regolato in base a quanto è piccola l'area da selezionare. - Utilizzare l'interfaccia visualizzata per specificare un nome e un colore per ogni ROI.
NOTA: Selezionare da due a cinque sezioni di parti centrali dei tessuti di interesse e definire gli strati di segmentazione per generare ROI 2D per ciascun tessuto. Quando si selezionano le aree su ciascuna sezione, evitare le regioni di confine dell'organo, come mostrato nella Figura 4, in quanto ciò può introdurre rumore e influire sull'affidabilità del valore HU calcolato di ciascun ROI. - Una volta soddisfatti dei ROI progettati, vai a Navigazione e seleziona Mostra tabella per visualizzare la tabella di quantificazione contenente i valori HU calcolati per ogni ROI.
NOTA: I valori di interesse sono elencati nella colonna "Media", che visualizza i valori medi numerici dei voxel (HU) inclusi nel ROI. Prendere nota dei valori di interesse oppure salvare l'intera tabella selezionando Esporta tabella. - Ripetere tutti i passaggi per il file DICOM di pre-contrasto per ottenere la luminosità media del fegato prima dell'iniezione del mezzo di contrasto. A tal fine, eseguire i passaggi 4.4.2-4.4.5 solo per il fegato.
- Calcola i valori medi di HU per ogni tessuto nei punti temporali equivalenti e inserisci i valori ottenuti nell'equazione seguente:
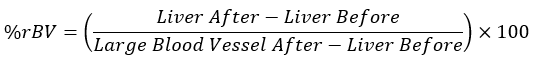
NOTA: Un vaso sanguigno di grandi dimensioni dopo l'iniezione di mezzo di contrasto è considerato rBV al 100% e il fegato, prima della somministrazione di mezzo di contrasto, è considerato rBV allo 0%.
- Per eseguire questa analisi, caricare il file DICOM di scansione ExiTron e regolare la barra/contrasto.
- Diametro della vena porta
NOTA: Per le misurazioni del diametro della vena porta, vengono analizzate le stesse scansioni utilizzate per le misurazioni della rBV epatica come descrittoin precedenza 35.- Caricare il file DICOM di scansione ExiTron e regolare la barra/contrasto.
- Individuare i piani trasversali di tre o quattro fette al di sopra della giunzione delle vene mesenterica e splenica superiore (Figura 5).
- Utilizzare lo strumento Righello per misurare la distanza esatta tra due punti (ad esempio, il diametro della regione della vena circolare).
NOTA: La distanza viene estratta sull'immagine, ma è anche possibile andare su Navigazione e selezionare Mostra tabella per visualizzare la tabella di quantificazione contenente la distanza calcolata o selezionare Esporta tabella per salvare il risultato.
Access restricted. Please log in or start a trial to view this content.
Risultati
In questo studio rappresentativo, l'imaging micro-CT senza alcun mezzo di contrasto ha indicato una percentuale maggiore di grasso epatico nei topi con NAFLD rispetto ai controlli (Tabella 2), confermando la patologia. Utilizzando l'agente di contrasto ExiTron e l'architettura della rete vascolare epatica e l'analisi della densità sopra descritte, la densità volumetrica totale della rete vascolare epatica è risultata più elevata nei topi con NAFLD rispetto ai controlli sani (Figu...
Access restricted. Please log in or start a trial to view this content.
Discussione
L'attuale metodo raccomandato per la diagnosi e la stadiazione della NAFLD nell'uomo è la biopsia epatica, che comporta il rischio di complessità emorragiche, nonché di imprecisioni di campionamento40. Al contrario, nei modelli animali, tale diagnosi viene eseguita mediante istologia post-mortem, anche se sono ora disponibili protocolli per la biopsia epatica sopravvissuta e sono raccomandati quando il disegno dellostudio lo consente. L'uso dell'istologia post-mortem sig...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
La Figura 1 è stata creata con BioRender.com. Questo lavoro è stato sostenuto dalla Fondazione Ellenica per la Ricerca e l'Innovazione (#3222 ad A.C.). Anna Hadjihambi è finanziata dal Roger Williams Institute of Hepatology, Foundation for Liver Research.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| eXIA160 | Binitio Biomedical, Inc. | https://www.binitio.com/?Page=Products | |
| High fat diet with 60% of kilocalories from fat | Research Diets, New Brunswick, NJ, USA | D12492 | |
| High-fructose corn syrup | Best flavors, CA | hfcs-1gallon | |
| Lacrinorm ophthalmic ointment | Bausch & Lomb | ||
| Normal diet with 10% of kilocalories from fat | Research Diets, New Brunswick, NJ, USA | D12450 | |
| Viscover ExiTron nano 12000 | Milteny Biotec, Bergisch Gladbach, Germany | 130-095-698 | |
| VivoQuant | Invicro | ||
| X-CUBE | Molecubes, Belgium | https://www.molecubes.com/systems/ |
Riferimenti
- Lazarus, J. V., et al. Advancing the global public health agenda for NAFLD: A consensus statement. Nature Reviews. Gastroenterology & Hepatology. 19 (1), 60-78 (2022).
- Takahashi, Y., Fukusato, T. Histopathology of non-alcoholic fatty liver disease/non-alcoholic steatohepatitis. World Journal of Gastroenterology. 20 (42), 15539-15548 (2014).
- Huang, D. Q., El-Serag, H. B., Loomba, R. Global epidemiology of NAFLD-related HCC: Trends, predictions, risk factors and prevention. Nature Reviews Gastroenterology & Hepatology. 18 (4), 223-238 (2021).
- Niederseer, D., Wernly, B., Aigner, E., Stickel, F., Datz, C. NAFLD and cardiovascular diseases: Epidemiological, mechanistic and therapeutic considerations. Journal of Clinical Medicine. 10 (3), 467(2021).
- Lefere, S., et al. Differential effects of selective- and pan-PPAR agonists on experimental steatohepatitis and hepatic macrophages. Journal of Hepatology. 73 (4), 757-770 (2020).
- Chrysavgis, L., Papatheodoridi, A. M., Chatzigeorgiou, A., Cholongitas, E. The impact of sodium glucose co-transporter 2 inhibitors on non-alcoholic fatty liver disease.Journal of Gastroenterology and Hepatology. Journal of Gastroenterology and Hepatology. 36 (4), 893-909 (2021).
- Li, M., Qian, M., Xu, J. Vascular endothelial regulation of obesity-associated insulin resistance. Frontiers in Cardiovascular Medicine. 4, 51(2017).
- Pi, X., Xie, L., Patterson, C. Emerging roles of vascular endothelium in metabolic homeostasis. Circulation Research. 123 (4), 477-494 (2018).
- Chiu, J. J., Chien, S. Effects of disturbed flow on vascular endothelium: Pathophysiological basis and clinical perspectives. Physiological Reviews. 91 (1), 327-387 (2011).
- Koyama, Y., Brenner, D. A. Liver inflammation and fibrosis. The Journal of Clinical Investigation. 127 (1), 55-64 (2017).
- Nasiri-Ansari, N., et al. Endothelial cell dysfunction and non-alcoholic fatty liver disease (NAFLD): A concise review. Cells. 11 (16), 2511(2022).
- Lefere, S., et al. Angiopoietin-2 promotes pathological angiogenesis and is a therapeutic target in murine non-alcoholic fatty liver disease. Hepatology. 69 (3), 1087-1104 (2019).
- Pasarin, M., et al. Insulin resistance and liver microcirculation in a rat model of early NAFLD. Journal of Hepatology. 55 (5), 1095-1102 (2011).
- Hammoutene, A., Rautou, P. E. Role of liver sinusoidal endothelial cells in non-alcoholic fatty liver disease. Journal of Hepatology. 70 (6), 1278-1291 (2019).
- Sun, X., Harris, E. N. New aspects of hepatic endothelial cells in physiology and non-alcoholic fatty liver disease. American Journal of Physiology. Cell Physiology. 318 (6), C1200-C1213 (2020).
- Iwakiri, Y., Shah, V., Rockey, D. C. Vascular pathobiology in chronic liver disease and cirrhosis - current status and future directions. Journal of Hepatology. 61 (4), 912-924 (2014).
- Baffy, G. Origins of portal hypertension in non-alcoholic fatty liver disease. Digestive Diseases and Sciences. 63 (3), 563-576 (2018).
- Ruhli, F. J., Kuhn, G., Evison, R., Muller, R., Schultz, M. Diagnostic value of micro-CT in comparison with histology in the qualitative assessment of historical human skull bone pathologies. American Journal of Physical Anthropology. 133 (4), 1099-1111 (2007).
- Rodt, T., et al. Micro-computed tomography of pulmonary fibrosis in mice induced by adenoviral gene transfer of biologically active transforming growth factor-beta1. Respiratory Research. 11 (1), 181(2010).
- Deng, L., Xiao, S. M., Qiang, J. W., Li, Y. A., Zhang, Y. Early lung adenocarcinoma in mice: Micro-computed tomography manifestations and correlation with pathology. Translational Oncology. 10 (3), 311-317 (2017).
- Feng, J., et al. Abnormalities in the enamel in bmp2-deficient mice. Cells, Tissues, Organs. 194 (2-4), 216-221 (2011).
- Kagadis, G. C., Loudos, G., Katsanos, K., Langer, S. G., Nikiforidis, G. C. In vivo small animal imaging: current status and future prospects. Medical Physics. 37 (12), 6421-6442 (2010).
- Starosolski, Z., et al. Ultra high-resolution in vivo computed tomography imaging of mouse cerebrovasculature using a long circulating blood pool contrast agent. Scientific Reports. 5, 10178(2015).
- Caussy, C., Reeder, S. B., Sirlin, C. B., Noninvasive Loomba, R. quantitative assessment of liver fat by MRI-PDFF as an endpoint in NASH trials. Hepatology. 68 (2), 763-772 (2018).
- Lubura, M., et al. Non-invasive quantification of white and brown adipose tissues and liver fat content by computed tomography in mice. PLoS One. 7 (5), e37026(2012).
- Perciedu Sert, N., et al. The ARRIVE guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biology. 18 (7), e3000410(2020).
- Tetri, L. H., Basaranoglu, M., Brunt, E. M., Yerian, L. M., Neuschwander-Tetri, B. A. Severe NAFLD with hepatic necroinflammatory changes in mice fed trans fats and a high-fructose corn syrup equivalent. American Journal of Physiology. Gastrointestinal and Liver Physiology. 295 (5), G987-G995 (2008).
- Machado, M. V., et al. Mouse models of diet-induced non-alcoholic steatohepatitis reproduce the heterogeneity of the human disease. PLoS One. 10 (5), 0127991(2015).
- Jensen, T., et al. Fructose and sugar: A major mediator of non-alcoholic fatty liver disease. Journal of Hepatology. 68 (5), 1063-1075 (2018).
- Nevzorova, Y. A., Boyer-Diaz, Z., Cubero, F. J., Gracia-Sancho, J. Animal models for liver disease - A practical approach for translational research. Journal of Hepatology. 73 (2), 423-440 (2020).
- De Rudder, M., et al. Automated computerized image analysis for the user-independent evaluation of disease severity in preclinical models of NAFLD/NASH. Laboratory Investigation. 100 (1), 147-160 (2020).
- Willekens, I., et al. Time-course of contrast enhancement in spleen and liver with Exia 160, Fenestra LC, and VC. Molecular Imaging and Biology. 11 (2), 128-135 (2009).
- Das, N. M., et al. In vivo quantitative microcomputed tomographic analysis of vasculature and organs in a normal and diseased mouse model. PLoS One. 11 (2), e0150085(2016).
- Ehling, J., et al. CCL2-dependent infiltrating macrophages promote angiogenesis in progressive liver fibrosis. Gut. 63 (12), 1960-1971 (2014).
- Zhang, J., et al. Gamna-Gandy bodies of the spleen detected with susceptibility weighted imaging: maybe a new potential non-invasive marker of esophageal varices. PLoS One. 8 (1), e55626(2013).
- Chen, Y., Li, J., Zhou, Q., Lyu, G., Li, S. Detection of liver and spleen stiffness in rats with portal hypertension by two-dimensional shear wave elastography. BMC Medical Imaging. 22 (1), 68(2022).
- Lessa, A. S., et al. Ultrasound imaging in an experimental model of fatty liver disease and cirrhosis in rats. BMC Veterinary Research. 6, 6(2010).
- Abikhzer, G., Alabed, Y. Z., Azoulay, L., Assayag, J., Rush, C. Altered hepatic metabolic activity in patients with hepatic steatosis on FDG PET/CT. AJR. American Journal of Roentgenology. 196 (1), 176-180 (2011).
- Newman, E. M., Rowland, A. A physiologically based pharmacokinetic model to predict the impact of metabolic changes associated with metabolic associated fatty liver disease on drug exposure. International Journal of Molecular Sciences. 23 (19), 11751(2022).
- Tsai, E., Lee, T. P. Diagnosis and evaluation of non-alcoholic fatty liver disease/non-alcoholic steatohepatitis, including noninvasive biomarkers and transient elastography. Clinics in Liver Disease. 22 (1), 73-92 (2018).
- Oldham, S., Rivera, C., Boland, M. L., Trevaskis, J. L. Incorporation of a survivable liver biopsy procedure in mice to assess non-alcoholic steatohepatitis (NASH) resolution. Journal of Visualized Experiments. 146, e59130(2019).
- Boll, H., et al. Comparison of Fenestra LC, ExiTron nano 6000, and ExiTron nano 12000 for micro-CT imaging of liver and spleen in mice. Academic Radiology. 20 (9), 1137-1143 (2013).
- Ashton, J. R., West, J. L., Badea, C. T. In vivo small animal micro-CT using nanoparticle contrast agents. Frontiers in Pharmacology. 6, 256(2015).
- Rothe, J. H., et al. Time course of contrast enhancement by micro-CT with dedicated contrast agents in normal mice and mice with hepatocellular carcinoma: Comparison of one iodinated and two nanoparticle-based agents. Academic Radiology. 22 (2), 169-178 (2015).
- Toczek, J., et al. Computed tomography imaging of macrophage phagocytic activity in abdominal aortic aneurysm. Theranostics. 11 (12), 5876-5888 (2021).
- Mannheim, J. G., et al. Comparison of small animal CT contrast agents. Contrast Media & Molecular Imaging. 11 (4), 272-284 (2016).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon