É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Novas Técnicas de Imagem por Microtomografia Computadorizada In Vivo para Avaliação da Progressão da Doença Hepática Gordurosa Não Alcoólica
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Usando um modelo de camundongo com doença hepática gordurosa não alcoólica (DHGNA) induzida por dieta, descrevemos o uso de novas técnicas de microtomografia computadorizada in vivo como um método não invasivo para avaliar os estágios de progressão da DHGNA, enfocando predominantemente a rede vascular hepática devido ao seu envolvimento significativo na desregulação hepática relacionada à DHGNA.
Resumo
A doença hepática gordurosa não alcoólica (DHGNA) é um crescente problema de saúde global, e o impacto da DHGNA é agravado pela atual falta de tratamentos eficazes. Consideráveis fatores limitantes que dificultam o diagnóstico oportuno e preciso (incluindo a graduação) e o monitoramento da DHGNA, bem como o desenvolvimento de potenciais terapias, são as atuais inadequações na caracterização da estrutura do microambiente hepático e na pontuação do estágio da doença de forma espaço-temporal e não invasiva. Usando um modelo de camundongo com DHGNA induzida por dieta, investigamos o uso de técnicas de imagem de microtomografia computadorizada (TC) in vivo como um método não invasivo para avaliar os estágios de progressão da DHGNA, enfocando predominantemente a rede vascular hepática devido ao seu envolvimento significativo na desregulação hepática relacionada à DHGNA. Essa metodologia de imagem permite a análise longitudinal da esteatose hepática e da captação tecidual funcional, bem como a avaliação do volume sanguíneo relativo, do diâmetro da veia porta e da densidade da rede vascular. Compreender as adaptações da rede vascular hepática durante a progressão da DHGNA e correlacioná-la com outras formas de caracterizar a progressão da doença (esteatose, inflamação, fibrose) usando o método proposto pode abrir caminho para o estabelecimento de novas abordagens, mais eficientes e reprodutíveis para a pesquisa da DHGNA em camundongos. Espera-se também que este protocolo atualize o valor dos modelos animais pré-clínicos para investigar o desenvolvimento de novas terapias contra a progressão da doença.
Introdução
A doença hepática gordurosa não alcoólica (DHGNA) é uma doença metabólica que afeta aproximadamente 25% da população e >80% das pessoas obesas mórbidas1. Estima-se que um terço desses indivíduos evolua para esteato-hepatite não alcoólica (EHNA), que se caracteriza por esteatose hepática, inflamação e fibrose2. A EHNA é um estágio da doença com risco significativamente maior para o desenvolvimento de cirrose e carcinoma hepatocelular (CHC)3,4. Por essa razão, a EHNA é atualmente a segunda causa mais comum de transplante hepático, e espera-se que em breve se torne o mais importante preditor de transplante hepático 5,6,7. Apesar de sua prevalência e gravidade, nenhuma terapia doença-específica está disponível para a DHGNA, e os tratamentos existentes visam apenas combater patologias associadas à doença, como resistência insulínica e hiperlipidemia 5,6.
Nos últimos anos, o papel fisiopatológico e as adaptações do endotélio e, em geral, da rede vascular de tecidos metabólicos, como o tecido adiposo e o fígado, vêm ganhando maior importância nas pesquisas, principalmente durante a obesidade e a desregulaçãometabólica7,8. O endotélio é uma monocamada celular que reveste internamente a rede vascular, atuando como barreira funcional e estrutural. Também contribui para vários processos fisiológicos e patológicos, como trombose, transporte de metabólitos, inflamação e angiogênese 9,10. No caso do fígado, a rede vascular caracteriza-se, entre outras características, pela presença de células altamente especializadas, definidas como células endoteliais sinusoidais hepáticas (LSECs). Essas células não possuem membrana basal e possuem múltiplas fenestras, permitindo a transferência mais fácil de substratos entre o parênquima sanguíneo e hepático. Devido à sua localização anatômica e características distintas, os LSECs provavelmente têm um papel crucial nos processos fisiopatológicos do fígado, incluindo o desenvolvimento de inflamação e fibrose hepática durante a DHGNA/EHNA. De fato, as adaptações patológicas, moleculares e celulares que os LSECs sofrem no curso da DHGNA contribuem para a progressão da doença11. Especificamente, a angiogênese hepática dependente de LSEC que ocorre durante a DHGNA está significativamente associada ao desenvolvimento de inflamação e à progressão da doença para EHNA ou mesmo CHC12. Além disso, a DHGNA precoce relacionada à obesidade é caracterizada pelo desenvolvimento de resistência insulínica nos LSECs, que precede o desenvolvimento de inflamação hepática ou outros sinais avançados de DHGNA13.
Além disso, os LSECs emergiram recentemente como reguladores centrais do fluxo sanguíneo hepático e adaptações da rede vascular durante doenças hepáticas de diversas etiologias14,15. De fato, a doença hepática crônica é caracterizada por proeminente vasoconstrição intra-hepática e aumento da resistência ao fluxo sanguíneo, que contribuem para o desenvolvimento da hipertensão portal16. No caso da DHGNA, vários mecanismos relacionados à LSEC contribuem para esse fenômeno. Por exemplo, a resistência insulínica específica para LSC, como mencionado acima, está associada à redução da vasodilatação insulino-dependente da vasculatura hepática13. Além disso, com o curso da doença, a vasculatura hepática torna-se mais sensível aos vasoconstritores, contribuindo ainda mais para o comprometimento do fluxo sanguíneo hepático e levando ao surgimento de estresse de cisalhamento, que resultam em ruptura da microcirculação sinusoidal17. Esses fatos sugerem que a vasculatura é um alvo chave na doença hepática. No entanto, fatores limitantes que dificultam o diagnóstico e o monitoramento oportunos da DHGNA/EHNA, bem como o desenvolvimento de potenciais terapias, são as inadequações na caracterização consistente do microambiente hepático e da estrutura (micro)vascular, bem como a pontuação do estágio da doença de forma espaço-temporal e não invasiva.
A microtomografia computadorizada (TC) é atualmente o método de imagem não invasivo padrão-ouro para retratar com precisão informações anatômicas dentro de um organismo vivo. A micro-TC e a RM representam dois métodos de imagem complementares que podem cobrir uma vasta gama de patologias e fornecer resolução e detalhes excepcionais nas estruturas e tecidos imageados. A micro-TC, em particular, é uma ferramenta muito rápida e precisa, sendo frequentemente utilizada para estudar patologias como doenças ósseas e alterações da superfície óssea associadas18, avaliar a progressão da fibrose pulmonar ao longo dotempo19, diagnosticar câncer de pulmão e seuestadiamento20, ou mesmo examinar patologiasdentárias21, sem qualquer preparo especial (ou destruição) das amostras que estão sendo analisadas.
A tecnologia de imagem da micro-TC baseia-se nas diferentes propriedades de atenuação de vários órgãos em termos de interação dos raios X com a matéria. Órgãos com altas diferenças de atenuação radiográfica são representados com alto contraste nas imagens de TC (ou seja, os pulmões parecem escuros e os ossos claros). Órgãos com propriedades atenuantes muito semelhantes (diferentes tecidos moles) são difíceis de distinguir nas imagens de TC22. Para resolver essa limitação, agentes de contraste especializados à base de iodo, ouro e bismuto têm sido extensivamente investigados para uso in vivo . Esses agentes alteram as propriedades atenuantes dos tecidos nos quais se acumulam, são eliminados lentamente da circulação e permitem a opacificação uniforme e estável de todo o sistema vascular ou tecidosescolhidos 23.
No diagnóstico humano, a TC e técnicas comparáveis, como a fração gorda de densidade de prótons derivada da RM, já são utilizadas para a determinação do conteúdo de gordura hepática24,25. No contexto da DHGNA, o alto contraste de partes moles é essencial para distinguir com precisão lesões patológicas ou pequenos vasos. Para isso, são utilizados agentes de contraste que proporcionam maior contraste nas características do tecido hepático. Tais ferramentas e materiais permitem o estudo de múltiplas características hepáticas e possíveis expressões patológicas, tais como a arquitetura e densidade da rede vascular, deposição/esteatose lipídica e captação tecidual funcional/transferência de lipídios (quilomícrons) no fígado. Além disso, o volume sanguíneo relativo hepático e o diâmetro da veia porta também podem ser avaliados. Em um tempo de exame muito curto, todos esses parâmetros fornecem informações diferentes e complementares sobre a avaliação e a progressão da DHGNA, que podem ser usadas para desenvolver um diagnóstico não invasivo e detalhado.
Neste artigo, apresentamos um protocolo passo a passo para o uso de novas técnicas de imagem por micro-TC in vivo como um método não invasivo para avaliar os estágios de progressão da DHGNA. Por meio desse protocolo, a análise longitudinal da esteatose hepática e da captação tecidual funcional, bem como a avaliação do volume sanguíneo relativo, diâmetro da veia porta e densidade da rede vascular, podem ser realizadas e aplicadas em modelos murinos de hepatopatia.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos os procedimentos foram realizados pelo pessoal da BIOEMTECH de acordo com os regulamentos de bem-estar europeus e nacionais e foram aprovados pelas autoridades nacionais (número de licença EL 25 BIOexp 45/PN 49553 21/01/20). Todos os experimentos foram delineados e relatados com aderência às diretrizes do ARRIVE26. Os ratos foram comprados do Instituto Helênico Pasteur, Atenas, Grécia.
OBS: Os animais foram alojados em gaiolas ventiladas individualmente enriquecidas com trilhos e tubos de papelão em uma sala a 20-22 °C, com umidade relativa de 50%-60% e ciclo claro/escuro de 12 h (luz 07:00-19:00). Uma combinação de uma dieta rica em gordura (HFD) e xarope de milho com alto teor de frutose (HFCS), um adoçante contendo frutose e glicose amplamente utilizado em tipos modernos de dietas enriquecidas com gordura, foi usada para induzir a DHGNA como um modelo confiável reconhecido27,28,29,30. Com 7-8 semanas de idade, camundongos machos C57BL/6 receberam acesso ad libitum a uma dieta normal (n = 2) com 10% de quilocalorias de gordura ou a um HFD (n = 2) contendo 60% de quilocalorias de gordura suplementada com 5% de HFCS em água por 22 semanas. O peso corporal foi obtido semanalmente por meio de balança digital e, durante o período experimental, o bem-estar dos animais foi monitorado em dias alternados por meio de uma folha de pontuação. Ao final do protocolo de imagem, os camundongos foram eutanasiados via deslocamento cervical.
1. Preparo dos animais
NOTA: O protocolo de imagem está resumido na Figura 1.
- Anestesiar o rato utilizando isoflurano a 3%-4% (em ar ambiente) e manter a temperatura corporal utilizando uma almofada de aquecimento dedicada.
NOTA: A ausência de um reflexo de retirada do pedal deve ser usada para confirmar a profundidade suficiente da anestesia antes de iniciar o exame. - Aplique pomada oftálmica nos olhos do animal antes da experimentação.
- Coloque o animal no berço do tomógrafo, prenda o cone nasal e mude para isoflurano a 1,5%-3% (em ar ambiente) para manutenção.
NOTA: A ausência de reflexo de retirada do pedal deve ser utilizada para confirmar a porcentagem adequada de isoflurano para a manutenção da anestesia. - Monitore o mouse continuamente.
2. Preparação pré-digitalização
NOTA: A aquisição de imagens é realizada em duas fases experimentais para permitir que o primeiro agente de contraste seja adequadamente eliminado da circulação e dos tecidos. O eXIA (primeiro agente de contraste) é administrado na primeira fase e o ExiTron (segundo agente de contraste) na segunda fase, conforme descrito na seção "Fluxo de trabalho de imagem" (seção 3) abaixo.
- Permitir que o agente de contraste (eXIA ou ExiTron, dependendo da fase experimental) atinja a temperatura ambiente por 3 h.
- Defina os seguintes parâmetros de varredura no tomógrafo: protocolo de alta resolução sob tensão de tubo de 50 kVp e corrente de 460 μA, não espiral, 720 projeções/rotação, quatro rotações e tempo de aquisição de 4 min.
3. Fluxo de trabalho de geração de imagens
- Fase experimental 1
- Calcular e preparar o volume do primeiro agente de contraste a ser administrado na dose não diluída de 6 μL/g de peso corporal para o contraste máximo.
- Prepare o cateter da veia caudal preenchendo-o com soro fisiológico e conectando-o à seringa preenchida com o agente de contraste.
- Adquira um exame de corpo inteiro (WB) pré-contraste e uma varredura basal do fígado.
- Certifique-se de que não existem bolhas ou bloqueios na seringa ou cateter.
- Insira o cateter pré-preenchido na veia caudal e administre o agente de contraste através de uma injeção realizada lenta e manualmente, com uma duração de 1-3 minutos (não como uma injeção em bolus). Uma bomba de seringa pode ser usada quando ajustada para a taxa de infusão apropriada.
OBS: A cauda do animal pode ser colocada em água morna para induzir vasodilatação e auxiliar na inserção do cateter - Adquirir WB e exames hepáticos em diferentes momentos, conforme indicado na Tabela 1.
OBS: Se a aquisição de todos os pontos não for possível, o foco deve ser colocado em 45 min pós-injeção (PI), que é o ponto de captação hepática máxima, e 48 h PI, que é quando a depuração é alcançada.
- Fase experimental 2
- Preparar novamente o rato, conforme descrito na secção 1, para a administração do segundo agente de contraste 10 dias após a leitura final com o primeiro agente de contraste (48 h PI).
- Execute as etapas 2.1-2.2.
- Calcular e preparar o volume do segundo agente de contraste a ser administrado na dose não diluída de 8 μL/g de peso corporal para o contraste máximo.
- Prepare o cateter da veia caudal preenchendo-o com soro fisiológico e conectando-o à seringa preenchida com o agente de contraste.
- Adquirir um WB pré-contraste e uma varredura basal do fígado para avaliar o volume sanguíneo relativo e a esteatose hepática.
- Certifique-se de que nenhum contraste seja detectável no exame como uma indicação da completa depuração do primeiro agente de contraste.
- Insira o cateter pré-preenchido na veia caudal e administre o agente de contraste através de uma injeção intravenosa realizada lenta e manualmente, com uma duração de 1-3 minutos (não como uma injeção em bolus). Uma bomba de seringa pode ser usada quando ajustada para a taxa de infusão apropriada.
- Adquirir WB e exames hepáticos em diferentes momentos, conforme indicado na Tabela 1.
NOTA: Os exames de WB são adquiridos em 10 min e 4 h PI. O significativo lapso de tempo entre eles permite a avaliação da biodistribuição do traçador no organismo, bem como sua depuração relativa.
4. Extração e análise dos dados
NOTA: Neste protocolo, as etapas de extração e análise de dados com base em um software de processamento de imagens específico (consulte Tabela de Materiais) são fornecidas. As etapas descritas podem precisar ser adaptadas ao usar diferentes softwares.
- Avaliação da deposição/esteatose lipídica hepática.
NOTA: Para a avaliação da esteatose hepática, nenhum agente de contraste é usado, e uma comparação entre controle e patologia é realizada. Devido a desvios relativamente altos nas propriedades de atenuação tecidual entre diferentes camundongos, os valores de densidade são normalizados para o fígado contra o baço (tecido livre de gordura) e a gordura (tecido adiposo absoluto) de acordo com a seguinte equação e conforme descrito anteriormente25: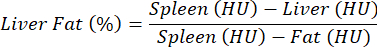
- Para realizar a análise, carregue o arquivo DICOM do exame pré-contraste e ajuste a barra/contraste para ver o fígado, o baço e o tecido adiposo branco (TAB) claramente.
- Acesse a ferramenta Operador de modelagem através do menu suspenso da ferramenta no painel frontal e selecione Ferramenta de ROI 3D.
- No Operador de ROI 3D, selecione Adicionar ROI para gerar várias ROIs (até oito para cada tecido) para realizar amostragem nas áreas onde o fígado (de preferência nas áreas do lobo medial esquerdo, o lobo medial direito e o lobo lateral esquerdo) e o baço parecem claros, sem vasos sanguíneos aparentes e gordura.
NOTA: Para TAB, as ROIs são selecionadas no meio do depósito de tecido adiposo visceral. As áreas recomendadas são mostradas na Figura 2. Métodos de normalização utilizando a relação fígado/baço e sem a inclusão do WAT também podem ser aplicados conforme previamente estabelecido31. - No modo de pintura 3D e no recurso Erode/Dilate , selecione 2D e use a interface que aparece para especificar um nome e uma cor para cada ROI.
- Use a ferramenta Sphere paint ROI com um diâmetro de 8 pixels para desenhar manualmente as ROIs 2D.
- Realize a amostragem segmentando as ROIs 2D nas áreas de interesse usando a ferramenta Cross Hair no plano transversal, como mostrado na Figura 3A.
- Clique no ponto selecionado no plano sagital e coronal para completar a segmentação da ROI 2D, como mostra a Figura 3B.
- Repita o processo para definir o restante das ROIs.
NOTA: Ao fazer amostragem, evite as regiões de borda do órgão, pois isso pode introduzir ruído e afetar a confiabilidade do valor calculado da unidade Hounsfield (UH) de cada ROI. - Quando estiver satisfeito com as ROIs segmentadas, vá para Navegação e selecione Mostrar Tabela para exibir a tabela de quantificação contendo os valores de UH calculados para cada ROI.
NOTA: Os valores de interesse estão listados na coluna "Média", que contém os valores médios numéricos dos voxels (UH) contidos nas ROIs para os órgãos de interesse. Observe os valores de interesse ou salve a tabela inteira selecionando Exportar Tabela. - Calcule a UH média para o fígado, baço e AT e conecte os valores à equação acima para calcular o percentual de gordura no fígado.
- Captação tecidual funcional/transferência de lipídios (quilomícrons) no fígado
OBS: A captação tecidual funcional/transferência lipídica (quilomícron) é analisada a partir dos exames adquiridos 45 min e 48 h após a primeira infusão do meio de contraste, com base em método previamente publicado32. O contraste é calculado para os diferentes tecidos e pontos de tempo usando a equação abaixo: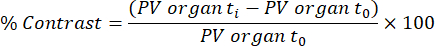
PV organ t i é o valor médio de pixel no órgão no tempo t i (variando de 0 h a 48 h), e PV organ t0 é o valor médio de pixel no órgão na imagem sem contraste.- Para realizar essa análise, carregue o arquivo DICOM de varredura eXIA e ajuste a barra/contraste para ver o fígado, o baço e o ventrículo esquerdo claramente.
- Acesse o Operador de Modelagem através do menu suspenso da ferramenta no painel frontal e selecione Ferramenta de ROI 3D.
- No Operador de ROI 3D, selecione Adicionar ROI para segmentar várias ROIs para o fígado.
- No modo de pintura 3D e no recurso Erode/Dilate , use a ferramenta Sphere paint ROI com um diâmetro de 8 pixels e −1 erode.
NOTA: Selecione várias ROIs em fatias onde cada órgão aparece claramente. Evite regiões de fronteira, pois isso pode introduzir ruído e afetar a confiabilidade do valor de UH calculado de cada ROI. Isso resultará na amostragem de múltiplas ROIs 3D, que correspondem a pequenos volumes de órgãos. - Use a interface que aparece para especificar um nome e uma cor para cada ROI.
- Quando estiver satisfeito com os ROIs projetados, vá para Navegação e selecione Mostrar Tabela para exibir a tabela de quantificação contendo os valores de UH calculados para cada ROI.
NOTA: Os valores de interesse estão listados na coluna "Média", que exibe os valores médios numéricos dos voxels (HU) incluídos na ROI. O valor médio de UH das ROIs de cada órgão corresponde ao VP ti do órgão. Observe os valores de interesse ou salve a tabela inteira selecionando Exportar Tabela. - Para obter o órgão PV t0, repita todas as etapas acima usando o arquivo DICOM pré-contraste para calcular o brilho médio do fígado, baço e ventrículo esquerdo antes da injeção do meio de contraste.
- Insira os valores na equação acima para extrair a porcentagem de contraste correspondente à captação tecidual funcional/transferência de lipídios (quilomícrons).
- Arquitetura e densidade da rede vascular hepática
NOTA: A análise da arquitetura e densidade da rede vascular hepática é baseada em uma metodologia previamente publicada33 e é realizada nos exames hepáticos obtidos 10 min IP do segundo meio de contraste.- Para realizar essa análise, carregue o arquivo DICOM de varredura ExiTron e ajuste a barra/contraste para ver a rede vascular hepática claramente.
- Acesse o Operador de Modelagem através do menu suspenso da ferramenta no painel frontal e selecione Ferramenta de ROI 3D.
- No Operador de ROI 3D, selecione Adicionar ROI para gerar um ROI 3D para o fígado.
- No modo de pintura 3D e no recurso Erode/Dilate , selecione 3D.
NOTA: Use a ferramenta Sphere paint ROI com −1 erode para definir as camadas de segmentação no plano coronal. O diâmetro da ferramenta de pintura ROI deve ser ajustado de acordo com cada camada (para adicionar/excluir quaisquer seleções de voxels desejadas/indesejadas). Recomenda-se que o volume hepático seja inicialmente definido através do plano coronal e, em seguida, os planos transverso e sagital possam ser usados para corrigir a ROI. Este processo requer precisão. O usuário deve ter muito cuidado para não incluir outros tecidos, vasos e ossos ao segmentar cada camada de ROI, garantindo que todas as áreas do fígado sejam incluídas na ROI definida. Por essa razão, a familiarização com os limites anatômicos do fígado é crucial. - Uma vez satisfeito com a ROI hepática resultante, realizar um corte para remover todos os voxels dos dados da imagem que não pertencem à ROI hepática inicialmente segmentada. Para isso, escolha o ROI do fígado no Seletor de ROI e clique no ícone Executar corte . Esta operação remove o fundo e deixa o ROI do fígado inalterado.
NOTA: Embora as funções de desfazer/refazer sejam aplicáveis a todas as operações executadas sob a ferramenta de ROI 3D, a ação de cortar um ROI não pode ser desfeita. Assim, antes dessa ação, o usuário pode considerar salvar o ROI inicial do fígado no formato DICOM. - A ROI hepática resultante inclui a rede vascular e o tecido circundante, que devem ser removidos. Para isso, redefina o ROI do fígado clicando no botão Redefinir vassoura ROI .
- Use a interface que parece transferir todos os pixels da ROI do fígado para o plano de fundo.
NOTA: O ROI do fígado ainda existirá após esta operação, mas não conterá mais voxels. - Para resegmentar o ROI do fígado para que ele contenha apenas pixels associados à vascular, vá para Algoritmos de segmentação indicados pelo ícone da varinha mágica e selecione Limiar conectado.
- Defina o ROI como Saída e o plano de fundo como Entrada no menu suspenso de entrada antes de aplicar o limite.
- Defina os Limites clicando nos ícones Min e Max à esquerda de cada campo de limiar para preencher os valores máximo e mínimo e obter a rede vascular.
NOTA: Somente pixels dentro do intervalo escolhido serão incluídos no ROI resultante. O ajuste dos valores limite entre diferentes animais garante que as mesmas regiões anatômicas sejam levadas em consideração em relação à quantidade exata de contraste injetado em cada animal. Isso é constante entre os tecidos selecionados, mesmo que os valores numéricos não sejam idênticos. - Use a ferramenta Cross Hair para clicar em um ponto onde a rede vascular aparece clara e clique em Aplicar para realizar a segmentação.
- Ative o visualizador de projeção de intensidade máxima (MIP).
- Avalie a ROI hepática resultante em termos de quão clara a rede vascular aparece na visualização MIP.
- Se o tecido permanecer em partes da ROI hepática, repita os passos 4.3.5-4.3.11 ajustando o valor do limiar mínimo até que a ROI hepática segmentada represente claramente a rede vascular.
- Uma vez satisfeito com a ROI hepática resultante, gere a tabela de quantificação contendo o volume de ROI hepática calculado em milímetros cúbicos.
NOTA: Os valores de interesse estão listados na coluna "mm3", que contém o valor numérico de volume dos voxels (HU) contidos na ROI hepática. Observe os valores de interesse ou salve a tabela inteira selecionando Exportar Tabela.
- Volume sanguíneo relativo hepático
NOTA: Para a medição do volume sanguíneo relativo hepático (rBV), que se correlaciona significativamente com a quantidade de vasos sanguíneos recém-formados durante a progressão da fibrose, são usados exames pré-contraste e varreduras em 4 h após a segunda injeção do meio de contraste. A análise é realizada conforme descrito anteriormente34.- Para executar essa análise, carregue o arquivo DICOM de varredura ExiTron e ajuste a barra/contraste.
Observação : desativar o visualizador MIP: em Preferências, marque a caixa para desativar o visualizador MIP ao carregar. Para grandes conjuntos de dados, isso pode melhorar a velocidade de carregamento. - Acesse o Operador de Modelagem através do menu suspenso da ferramenta no painel frontal e selecione Ferramenta de ROI 3D. Esta ferramenta fornece opções avançadas para desenhar, visualizar, salvar e quantificar regiões 2D e 3D.
- No Operador de ROI 3D, selecione Adicionar ROI e segmente duas ROIs: uma para o fígado e outra para um grande vaso sanguíneo.
- No modo de pintura 3D e no recurso Erode/Dilate , selecione 2D.
NOTA: Recomenda-se usar a ferramenta Sphere paint ROI com um diâmetro de 8-10 pixels para o fígado e 4-6 pixels para o vaso sanguíneo. No entanto, o diâmetro da ferramenta de pintura pode ser ajustado dependendo de quão pequena é a área a ser selecionada. - Use a interface que aparece para especificar um nome e uma cor para cada ROI.
NOTA: Selecione de dois a cinco cortes de partes centrais dos tecidos de interesse e defina as camadas de segmentação para gerar ROIs 2D para cada tecido. Ao selecionar as áreas em cada corte, evite as regiões de borda do órgão, como mostra a Figura 4, pois isso pode introduzir ruído e afetar a confiabilidade do valor de UH calculado de cada ROI. - Quando estiver satisfeito com os ROIs projetados, vá para Navegação e selecione Mostrar Tabela para exibir a tabela de quantificação contendo os valores de UH calculados para cada ROI.
NOTA: Os valores de interesse estão listados na coluna "Média", que exibe os valores médios numéricos dos voxels (HU) incluídos na ROI. Observe os valores de interesse ou salve a tabela inteira selecionando Exportar Tabela. - Repita todas as etapas do arquivo DICOM pré-contraste para obter o brilho médio do fígado antes da injeção do meio de contraste. Para isso, execute as etapas 4.4.2-4.4.5 apenas para o fígado.
- Calcule os valores médios de UH para cada tecido nos momentos equivalentes e insira os valores obtidos na equação abaixo:
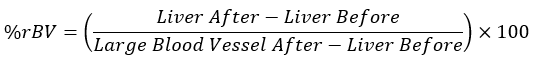
NOTA: Um grande vaso sanguíneo após a injeção do meio de contraste é considerado 100% rBV, e o fígado, antes da administração do meio de contraste, é considerado 0% rBV.
- Para executar essa análise, carregue o arquivo DICOM de varredura ExiTron e ajuste a barra/contraste.
- Diâmetro da veia porta
NOTA: Para as medidas do diâmetro da veia porta, os mesmos exames utilizados para as medidas hepáticas do rBV são analisados conforme descrito anteriormente35.- Carregue o arquivo DICOM de varredura ExiTron e ajuste a barra/contraste.
- Localizam-se os planos transversais de três a quatro cortes acima da junção das veias mesentérica superior e esplênica (Figura 5).
- Use a ferramenta Régua para medir a distância exata entre dois pontos (ou seja, o diâmetro da região da veia circular).
NOTA: A distância é extraída na imagem, mas também é possível ir para Navegação e selecionar Mostrar Tabela para exibir a tabela de quantificação que contém a distância calculada ou selecionar Exportar Tabela para salvar o resultado.
Access restricted. Please log in or start a trial to view this content.
Resultados
Neste estudo representativo, a micro-TC sem contraste indicou maior percentual de gordura hepática em camundongos com DHGNA em relação aos controles (Tabela 2), confirmando a patologia. Usando o contraste ExiTron e a análise da arquitetura e densidade da rede vascular hepática descrita acima, a densidade de volume total da rede vascular hepática foi maior em camundongos com DHGNA em comparação com controles saudáveis (Figura 6, Tabela 2). Camundongo...
Access restricted. Please log in or start a trial to view this content.
Discussão
O método atualmente recomendado para o diagnóstico e estadiamento da DHGNA em humanos é a biópsia hepática, que abriga o risco de complexidades hemorrágicas, bem como imprecisões deamostragem40. Ao contrário, em modelos animais, esse diagnóstico é realizado por histologia post-mortem, embora protocolos para biópsia hepática de sobrevivência já estejam disponíveis e sejam recomendados quando o desenho do estudopermitir41. O uso da histologia post-mortem signif...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
A Figura 1 foi criada com BioRender.com. Este trabalho foi apoiado pela Fundação Helênica para Pesquisa e Inovação (#3222 a A.C.). Anna Hadjihambi é financiada pelo Instituto Roger Williams de Hepatologia, Fundação para Pesquisa do Fígado.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| eXIA160 | Binitio Biomedical, Inc. | https://www.binitio.com/?Page=Products | |
| High fat diet with 60% of kilocalories from fat | Research Diets, New Brunswick, NJ, USA | D12492 | |
| High-fructose corn syrup | Best flavors, CA | hfcs-1gallon | |
| Lacrinorm ophthalmic ointment | Bausch & Lomb | ||
| Normal diet with 10% of kilocalories from fat | Research Diets, New Brunswick, NJ, USA | D12450 | |
| Viscover ExiTron nano 12000 | Milteny Biotec, Bergisch Gladbach, Germany | 130-095-698 | |
| VivoQuant | Invicro | ||
| X-CUBE | Molecubes, Belgium | https://www.molecubes.com/systems/ |
Referências
- Lazarus, J. V., et al. Advancing the global public health agenda for NAFLD: A consensus statement. Nature Reviews. Gastroenterology & Hepatology. 19 (1), 60-78 (2022).
- Takahashi, Y., Fukusato, T. Histopathology of non-alcoholic fatty liver disease/non-alcoholic steatohepatitis. World Journal of Gastroenterology. 20 (42), 15539-15548 (2014).
- Huang, D. Q., El-Serag, H. B., Loomba, R. Global epidemiology of NAFLD-related HCC: Trends, predictions, risk factors and prevention. Nature Reviews Gastroenterology & Hepatology. 18 (4), 223-238 (2021).
- Niederseer, D., Wernly, B., Aigner, E., Stickel, F., Datz, C. NAFLD and cardiovascular diseases: Epidemiological, mechanistic and therapeutic considerations. Journal of Clinical Medicine. 10 (3), 467(2021).
- Lefere, S., et al. Differential effects of selective- and pan-PPAR agonists on experimental steatohepatitis and hepatic macrophages. Journal of Hepatology. 73 (4), 757-770 (2020).
- Chrysavgis, L., Papatheodoridi, A. M., Chatzigeorgiou, A., Cholongitas, E. The impact of sodium glucose co-transporter 2 inhibitors on non-alcoholic fatty liver disease.Journal of Gastroenterology and Hepatology. Journal of Gastroenterology and Hepatology. 36 (4), 893-909 (2021).
- Li, M., Qian, M., Xu, J. Vascular endothelial regulation of obesity-associated insulin resistance. Frontiers in Cardiovascular Medicine. 4, 51(2017).
- Pi, X., Xie, L., Patterson, C. Emerging roles of vascular endothelium in metabolic homeostasis. Circulation Research. 123 (4), 477-494 (2018).
- Chiu, J. J., Chien, S. Effects of disturbed flow on vascular endothelium: Pathophysiological basis and clinical perspectives. Physiological Reviews. 91 (1), 327-387 (2011).
- Koyama, Y., Brenner, D. A. Liver inflammation and fibrosis. The Journal of Clinical Investigation. 127 (1), 55-64 (2017).
- Nasiri-Ansari, N., et al. Endothelial cell dysfunction and non-alcoholic fatty liver disease (NAFLD): A concise review. Cells. 11 (16), 2511(2022).
- Lefere, S., et al. Angiopoietin-2 promotes pathological angiogenesis and is a therapeutic target in murine non-alcoholic fatty liver disease. Hepatology. 69 (3), 1087-1104 (2019).
- Pasarin, M., et al. Insulin resistance and liver microcirculation in a rat model of early NAFLD. Journal of Hepatology. 55 (5), 1095-1102 (2011).
- Hammoutene, A., Rautou, P. E. Role of liver sinusoidal endothelial cells in non-alcoholic fatty liver disease. Journal of Hepatology. 70 (6), 1278-1291 (2019).
- Sun, X., Harris, E. N. New aspects of hepatic endothelial cells in physiology and non-alcoholic fatty liver disease. American Journal of Physiology. Cell Physiology. 318 (6), C1200-C1213 (2020).
- Iwakiri, Y., Shah, V., Rockey, D. C. Vascular pathobiology in chronic liver disease and cirrhosis - current status and future directions. Journal of Hepatology. 61 (4), 912-924 (2014).
- Baffy, G. Origins of portal hypertension in non-alcoholic fatty liver disease. Digestive Diseases and Sciences. 63 (3), 563-576 (2018).
- Ruhli, F. J., Kuhn, G., Evison, R., Muller, R., Schultz, M. Diagnostic value of micro-CT in comparison with histology in the qualitative assessment of historical human skull bone pathologies. American Journal of Physical Anthropology. 133 (4), 1099-1111 (2007).
- Rodt, T., et al. Micro-computed tomography of pulmonary fibrosis in mice induced by adenoviral gene transfer of biologically active transforming growth factor-beta1. Respiratory Research. 11 (1), 181(2010).
- Deng, L., Xiao, S. M., Qiang, J. W., Li, Y. A., Zhang, Y. Early lung adenocarcinoma in mice: Micro-computed tomography manifestations and correlation with pathology. Translational Oncology. 10 (3), 311-317 (2017).
- Feng, J., et al. Abnormalities in the enamel in bmp2-deficient mice. Cells, Tissues, Organs. 194 (2-4), 216-221 (2011).
- Kagadis, G. C., Loudos, G., Katsanos, K., Langer, S. G., Nikiforidis, G. C. In vivo small animal imaging: current status and future prospects. Medical Physics. 37 (12), 6421-6442 (2010).
- Starosolski, Z., et al. Ultra high-resolution in vivo computed tomography imaging of mouse cerebrovasculature using a long circulating blood pool contrast agent. Scientific Reports. 5, 10178(2015).
- Caussy, C., Reeder, S. B., Sirlin, C. B., Noninvasive Loomba, R. quantitative assessment of liver fat by MRI-PDFF as an endpoint in NASH trials. Hepatology. 68 (2), 763-772 (2018).
- Lubura, M., et al. Non-invasive quantification of white and brown adipose tissues and liver fat content by computed tomography in mice. PLoS One. 7 (5), e37026(2012).
- Perciedu Sert, N., et al. The ARRIVE guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biology. 18 (7), e3000410(2020).
- Tetri, L. H., Basaranoglu, M., Brunt, E. M., Yerian, L. M., Neuschwander-Tetri, B. A. Severe NAFLD with hepatic necroinflammatory changes in mice fed trans fats and a high-fructose corn syrup equivalent. American Journal of Physiology. Gastrointestinal and Liver Physiology. 295 (5), G987-G995 (2008).
- Machado, M. V., et al. Mouse models of diet-induced non-alcoholic steatohepatitis reproduce the heterogeneity of the human disease. PLoS One. 10 (5), 0127991(2015).
- Jensen, T., et al. Fructose and sugar: A major mediator of non-alcoholic fatty liver disease. Journal of Hepatology. 68 (5), 1063-1075 (2018).
- Nevzorova, Y. A., Boyer-Diaz, Z., Cubero, F. J., Gracia-Sancho, J. Animal models for liver disease - A practical approach for translational research. Journal of Hepatology. 73 (2), 423-440 (2020).
- De Rudder, M., et al. Automated computerized image analysis for the user-independent evaluation of disease severity in preclinical models of NAFLD/NASH. Laboratory Investigation. 100 (1), 147-160 (2020).
- Willekens, I., et al. Time-course of contrast enhancement in spleen and liver with Exia 160, Fenestra LC, and VC. Molecular Imaging and Biology. 11 (2), 128-135 (2009).
- Das, N. M., et al. In vivo quantitative microcomputed tomographic analysis of vasculature and organs in a normal and diseased mouse model. PLoS One. 11 (2), e0150085(2016).
- Ehling, J., et al. CCL2-dependent infiltrating macrophages promote angiogenesis in progressive liver fibrosis. Gut. 63 (12), 1960-1971 (2014).
- Zhang, J., et al. Gamna-Gandy bodies of the spleen detected with susceptibility weighted imaging: maybe a new potential non-invasive marker of esophageal varices. PLoS One. 8 (1), e55626(2013).
- Chen, Y., Li, J., Zhou, Q., Lyu, G., Li, S. Detection of liver and spleen stiffness in rats with portal hypertension by two-dimensional shear wave elastography. BMC Medical Imaging. 22 (1), 68(2022).
- Lessa, A. S., et al. Ultrasound imaging in an experimental model of fatty liver disease and cirrhosis in rats. BMC Veterinary Research. 6, 6(2010).
- Abikhzer, G., Alabed, Y. Z., Azoulay, L., Assayag, J., Rush, C. Altered hepatic metabolic activity in patients with hepatic steatosis on FDG PET/CT. AJR. American Journal of Roentgenology. 196 (1), 176-180 (2011).
- Newman, E. M., Rowland, A. A physiologically based pharmacokinetic model to predict the impact of metabolic changes associated with metabolic associated fatty liver disease on drug exposure. International Journal of Molecular Sciences. 23 (19), 11751(2022).
- Tsai, E., Lee, T. P. Diagnosis and evaluation of non-alcoholic fatty liver disease/non-alcoholic steatohepatitis, including noninvasive biomarkers and transient elastography. Clinics in Liver Disease. 22 (1), 73-92 (2018).
- Oldham, S., Rivera, C., Boland, M. L., Trevaskis, J. L. Incorporation of a survivable liver biopsy procedure in mice to assess non-alcoholic steatohepatitis (NASH) resolution. Journal of Visualized Experiments. 146, e59130(2019).
- Boll, H., et al. Comparison of Fenestra LC, ExiTron nano 6000, and ExiTron nano 12000 for micro-CT imaging of liver and spleen in mice. Academic Radiology. 20 (9), 1137-1143 (2013).
- Ashton, J. R., West, J. L., Badea, C. T. In vivo small animal micro-CT using nanoparticle contrast agents. Frontiers in Pharmacology. 6, 256(2015).
- Rothe, J. H., et al. Time course of contrast enhancement by micro-CT with dedicated contrast agents in normal mice and mice with hepatocellular carcinoma: Comparison of one iodinated and two nanoparticle-based agents. Academic Radiology. 22 (2), 169-178 (2015).
- Toczek, J., et al. Computed tomography imaging of macrophage phagocytic activity in abdominal aortic aneurysm. Theranostics. 11 (12), 5876-5888 (2021).
- Mannheim, J. G., et al. Comparison of small animal CT contrast agents. Contrast Media & Molecular Imaging. 11 (4), 272-284 (2016).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados