Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Nuevas técnicas de imagen de microtomografía computarizada in vivo para evaluar la progresión de la enfermedad del hígado graso no alcohólico
* Estos autores han contribuido por igual
En este artículo
Resumen
Utilizando un modelo de ratón de enfermedad del hígado graso no alcohólico (EHGNA) inducida por la dieta, describimos el uso de nuevas técnicas de imagen de microtomografía computarizada in vivo como método no invasivo para evaluar las etapas de progresión de la EHGNA, centrándonos predominantemente en la red vascular hepática debido a su participación significativa en la desregulación hepática relacionada con la EHGNA.
Resumen
La enfermedad del hígado graso no alcohólico (EHGNA) es un problema de salud mundial creciente, y el impacto de la EHGNA se ve agravado por la falta actual de tratamientos eficaces. Los factores limitantes considerables que dificultan el diagnóstico oportuno y preciso (incluida la clasificación) y el seguimiento de la EHGNA, así como el desarrollo de posibles terapias, son las insuficiencias actuales en la caracterización de la estructura del microambiente hepático y la puntuación del estadio de la enfermedad de manera espaciotemporal y no invasiva. Utilizando un modelo de ratón de EHGNA inducido por la dieta, investigamos el uso de técnicas de imagen de microtomografía computarizada (TC) in vivo como método no invasivo para evaluar las etapas de progresión de la EHGNA, centrándonos predominantemente en la red vascular hepática debido a su participación significativa en la desregulación hepática relacionada con la EHGNA. Esta metodología de imagen permite el análisis longitudinal de la esteatosis hepática y la captación de tejido funcional, así como la evaluación del volumen sanguíneo relativo, el diámetro de la vena porta y la densidad de la red vascular. Comprender las adaptaciones de la red vascular hepática durante la progresión de la EHGNA y correlacionarla con otras formas de caracterizar la progresión de la enfermedad (esteatosis, inflamación, fibrosis) utilizando el método propuesto puede allanar el camino hacia el establecimiento de enfoques nuevos, más eficientes y reproducibles para la investigación de la EHGNA en ratones. También se espera que este protocolo mejore el valor de los modelos animales preclínicos para investigar el desarrollo de nuevas terapias contra la progresión de la enfermedad.
Introducción
La enfermedad del hígado graso no alcohólico (EHGNA) es una enfermedad metabólica que afecta aproximadamente al 25% de la población y al >80% de las personas con obesidad mórbida1. Se estima que un tercio de estos individuos progresan a esteatohepatitis no alcohólica (EHNA), que se caracteriza por esteatosis hepática, inflamación y fibrosis2. La EHNA es un estadio de la enfermedad con un riesgo significativamente mayor de desarrollar cirrosis y carcinoma hepatocelular (CHC)3,4. Por esta razón, la EHNA es actualmente la segunda causa más común de trasplante hepático, y también se espera que pronto se convierta en el predictor más importante de trasplante hepático 5,6,7. A pesar de su prevalencia y gravedad, no se dispone de una terapia específica para la EHGNA, y los tratamientos existentes solo tienen como objetivo abordar patologías asociadas a la enfermedad, como la resistencia a la insulina y la hiperlipidemia 5,6.
En los últimos años, el papel fisiopatológico y las adaptaciones del endotelio y, en general, de la red vascular de tejidos metabólicos, como el tejido adiposo y el hígado, han ido ganando mayor importancia en la investigación, especialmente durante la obesidad y la desregulación metabólica 7,8. El endotelio es una monocapa celular que recubre internamente la red vascular, actuando como una barrera funcional y estructural. También contribuye a diversos procesos fisiológicos y patológicos, como la trombosis, el transporte de metabolitos, la inflamación y la angiogénesis 9,10. En el caso del hígado, la red vascular se caracteriza, entre otras características, por la presencia de células altamente especializadas, definidas como células endoteliales sinusoidales hepáticas (LSEC). Estas células carecen de membrana basal y tienen múltiples fenestras, lo que permite una transferencia más fácil de sustratos entre la sangre y el parénquima hepático. Debido a su ubicación anatómica y características distintivas, es probable que los LSEC tengan un papel crucial en los procesos fisiopatológicos del hígado, incluido el desarrollo de inflamación y fibrosis hepática durante la EHGNA/EHNA. De hecho, las adaptaciones patológicas, moleculares y celulares que experimentan las LSEC en el curso de la EHGNA contribuyen a la progresión de la enfermedad11. Específicamente, la angiogénesis hepática dependiente de LSEC que tiene lugar durante la EHGNA se asocia significativamente con el desarrollo de inflamación y la progresión de la enfermedad a EHNA o incluso CHC12. Además, la EHGNA temprana relacionada con la obesidad se caracteriza por el desarrollo de resistencia a la insulina en los LSEC, que precede al desarrollo de inflamación hepática u otros signos avanzados de EHGNA13.
Además, los LSEC han surgido recientemente como reguladores centrales del flujo sanguíneo hepático y de las adaptaciones de la red vascular durante la enfermedad hepática de diversas etiologías14,15. De hecho, la enfermedad hepática crónica se caracteriza por una vasoconstricción intrahepática prominente y un aumento de la resistencia al flujo sanguíneo, lo que contribuye al desarrollo de hipertensión portal16. En el caso de la EHGNA, varios mecanismos relacionados con la LSEC contribuyen a este fenómeno. Por ejemplo, la resistencia a la insulina específica de LSEC, como se mencionó anteriormente, se asocia con una vasodilatación insulinodependiente reducida de la vasculatura hepática13. Además, en el transcurso de la enfermedad, la vasculatura hepática se vuelve más sensible a los vasoconstrictores, lo que contribuye aún más al deterioro del flujo sanguíneo hepático y conduce a la aparición de esfuerzos de cizallamiento, que resultan en una interrupción de la microcirculación sinusoidal17. Estos hechos sugieren que la vasculatura es un objetivo clave en la enfermedad hepática. Sin embargo, los factores limitantes que dificultan el diagnóstico oportuno y el seguimiento de la EHGNA/EHNA, así como el desarrollo de posibles terapias, son las insuficiencias en la caracterización coherente del microambiente hepático y la estructura (micro)vascular, así como la puntuación del estadio de la enfermedad de forma espaciotemporal y no invasiva.
Las imágenes de microtomografía computarizada (TC) son actualmente el método de imagen no invasivo de referencia para representar con precisión la información anatómica dentro de un organismo vivo. La microtomografía computarizada y la resonancia magnética representan dos métodos de imagen complementarios que pueden cubrir una amplia gama de patologías y proporcionar una resolución y un detalle excepcionales en las estructuras y tejidos de los que se obtienen imágenes. La microtomografía computarizada, en particular, es una herramienta muy rápida y precisa que se utiliza a menudo para estudiar patologías como las enfermedades óseas y los cambios en la superficie ósea asociados18, evaluar la progresión de la fibrosis pulmonar a lo largo del tiempo19, diagnosticar el cáncer de pulmón y su estadificación20, o incluso examinar patologías dentales21, sin ninguna preparación especial (o destrucción) de las muestras que se están fotografiando.
La tecnología de imagen de la micro-TC se basa en las diferentes propiedades de atenuación de varios órganos en términos de la interacción de los rayos X con la materia. Los órganos que presentan altas diferencias en la atenuación de los rayos X se representan con alto contraste en las imágenes de TC (es decir, los pulmones aparecen oscuros y los huesos claros). Los órganos que presentan propiedades de atenuación muy similares (diferentes tejidos blandos), son difíciles de distinguir en las imágenes de TC22. Para abordar esta limitación, se han investigado ampliamente los agentes de contraste especializados basados en yodo, oro y bismuto para su uso in vivo . Estos agentes alteran las propiedades de atenuación de los tejidos en los que se acumulan, se eliminan lentamente de la circulación y permiten la opacificación uniforme y estable de todo el sistema vascular o de los tejidos seleccionados23.
En el diagnóstico humano, la TC y técnicas comparables, como la fracción de grasa de densidad de protones derivada de la RM, ya se utilizan para la determinación del contenido de grasa hepática24,25. En el contexto de la EHGNA, el alto contraste de los tejidos blandos es esencial para distinguir con precisión las lesiones patológicas o los vasos pequeños. Para ello, se utilizan agentes de contraste que proporcionan un mayor contraste de las características del tejido hepático. Estas herramientas y materiales permiten el estudio de múltiples características hepáticas y posibles expresiones patológicas, como la arquitectura y densidad de la red vascular, el depósito de lípidos/esteatosis y la captación de tejidos funcionales/transferencia de lípidos (quilomicrones) en el hígado. Además, también se puede evaluar el volumen sanguíneo relativo hepático y el diámetro de la vena porta. En un tiempo de exploración muy corto, todos estos parámetros proporcionan información diferente y complementaria sobre la evaluación y progresión de la EHGNA, que puede utilizarse para desarrollar un diagnóstico no invasivo y detallado.
En este artículo, proporcionamos un protocolo paso a paso para el uso de nuevas técnicas de imagen de micro-TC in vivo como un método no invasivo para evaluar las etapas de progresión de la EHGNA. Con este protocolo, el análisis longitudinal de la esteatosis hepática y la captación de tejido funcional, así como la evaluación del volumen sanguíneo relativo, el diámetro de la vena porta y la densidad de la red vascular, se pueden realizar y aplicar en modelos murinos de enfermedad hepática.
Protocolo
Todos los procedimientos fueron realizados por el personal de BIOEMTECH de acuerdo con las normas europeas y nacionales de bienestar y fueron aprobados por las autoridades nacionales (número de licencia EL 25 BIOexp 45/PN 49553 21/01/20). Todos los experimentos fueron diseñados y reportados con el cumplimiento de las directrices ARRIVE26. Los ratones fueron comprados en el Instituto Pasteur Helénico de Atenas, Grecia.
NOTA: Los animales fueron alojados en grupo en jaulas ventiladas individualmente enriquecidas con rieles y tubos de cartón en una habitación a 20-22 °C, con una humedad relativa del 50%-60% y un ciclo de luz/oscuridad de 12 h (luz 07:00 am-07:00 pm). Se utilizó una combinación de una dieta alta en grasas (HFD) y jarabe de maíz de alta fructosa (JMAF), un edulcorante que contiene fructosa y glucosa ampliamente utilizado en los tipos modernos de dietas enriquecidas en grasas, para inducir NAFLD como un modelo confiable reconocido27,28,29,30. A las 7-8 semanas de edad, los ratones machos C57BL/6 tuvieron acceso ad libitum a una dieta normal (n = 2) con un 10% de kilocalorías de grasa o a un HFD (n = 2) que contenía un 60% de kilocalorías de grasa suplementada con 5% de JMAF en agua durante 22 semanas. El peso corporal se obtuvo semanalmente mediante una balanza digital y, durante el período experimental, se monitoreó el bienestar animal en días alternos mediante una hoja de puntuación. Al final del protocolo de imagen, los ratones fueron sacrificados a través de la luxación cervical.
1. Preparación animal
NOTA: El protocolo de imágenes se resume en la Figura 1.
- Anestesiar al ratón con isoflurano al 3%-4% (en el aire de la habitación) y mantener su temperatura corporal con una almohadilla térmica dedicada.
NOTA: La ausencia de un reflejo de retirada del pedal debe utilizarse para confirmar una profundidad de anestesia suficiente antes de iniciar la exploración. - Aplique ungüento oftálmico en los ojos del animal antes de experimentar.
- Coloque al animal en la base del escáner de tomografía computarizada, asegure el cono de la nariz y cambie a isoflurano al 1,5 % -3 % (en el aire de la habitación) para su mantenimiento.
NOTA: La ausencia de un reflejo de retirada del pedal debe utilizarse para confirmar el porcentaje adecuado de isoflurano para el mantenimiento de la anestesia. - Supervise el ratón continuamente.
2. Preparación previa al escaneo
NOTA: Las imágenes se realizan en dos fases experimentales para permitir que el primer agente de contraste se elimine adecuadamente de la circulación y los tejidos. En la primera fase se administra eXIA (primer agente de contraste) y en la segunda fase ExiTron (segundo agente de contraste), tal y como se describe en la sección "Flujo de trabajo de obtención de imágenes" (sección 3) a continuación.
- Deje que el agente de contraste (ya sea eXIA o ExiTron, dependiendo de la fase experimental) alcance la temperatura ambiente durante 3 h.
- Configure los siguientes parámetros de escaneo en el escáner de TC: protocolo de alta resolución bajo una tensión de tubo de 50 kVp y una corriente de 460 μA, sin espiral, 720 proyecciones/rotación, cuatro rotaciones y tiempo de adquisición de 4 min.
3. Flujo de trabajo de imágenes
- Fase experimental 1
- Calcular y preparar el volumen del primer agente de contraste que se administrará a una dosis sin diluir de 6 μL/g de peso corporal para obtener el máximo contraste.
- Prepare el catéter de la vena de la cola llenándolo con solución salina y conectándolo a la jeringa llena con el agente de contraste.
- Hágase una exploración basal de cuerpo entero (WB) y hepática previa al contraste.
- Asegúrese de que no haya burbujas ni obstrucciones en la jeringa o el catéter.
- Inserte el catéter precargado en la vena de la cola y administre el agente de contraste mediante una inyección realizada lenta y manualmente, con una duración de 1-3 min (no como inyección en bolo). Se puede usar una bomba de jeringa cuando se ajusta a la velocidad de infusión adecuada.
NOTA: La cola del animal se puede colocar en agua tibia para inducir la vasodilatación y ayudar con la inserción del catéter - Adquirir WB y gammagrafías hepáticas en diferentes momentos, como se indica en la Tabla 1.
NOTA: Si no es posible la adquisición de todos los puntos, la atención debe centrarse en los 45 min posteriores a la inyección (IP), que es el punto de máxima absorción hepática, y en las 48 h de PI, que es cuando se logra el aclaramiento.
- Fase experimental 2
- Preparar de nuevo el ratón como se describe en la sección 1 para la administración del segundo agente de contraste 10 días después de la lectura final con el primer agente de contraste (48 h PI).
- Realice los pasos 2.1-2.2.
- Calcular y preparar el volumen del segundo agente de contraste que se administrará a una dosis sin diluir de 8 μL/g de peso corporal para obtener el máximo contraste.
- Prepare el catéter de la vena de la cola llenándolo con solución salina y conectándolo a la jeringa llena con el agente de contraste.
- Adquirir una gammagrafía basal hepática y pre-contraste para evaluar el volumen sanguíneo relativo y la esteatosis hepática.
- Asegúrese de que no se detecte contraste en la exploración como indicación de la eliminación completa del primer agente de contraste.
- Inserte el catéter prellenado en la vena de la cola y administre el agente de contraste mediante una inyección intravenosa realizada lenta y manualmente, con una duración de 1-3 min (no como inyección en bolo). Se puede usar una bomba de jeringa cuando se ajusta a la velocidad de infusión adecuada.
- Adquirir WB y gammagrafías hepáticas en diferentes momentos, como se indica en la Tabla 1.
NOTA: Las exploraciones WB se adquieren a los 10 min y 4 h PI. El importante lapso de tiempo entre ellos permite evaluar la biodistribución del trazador en el cuerpo, así como su aclaramiento relativo.
4. Extracción y análisis de datos
NOTA: En este protocolo, se proporcionan los pasos de extracción y análisis de datos basados en un software específico de procesamiento de imágenes (consulte la Tabla de materiales). Es posible que sea necesario adaptar los pasos descritos cuando se utiliza un software diferente.
- Evaluación del depósito lipídico/esteatosis hepática.
NOTA: Para la evaluación de la esteatosis hepática no se utiliza ningún agente de contraste y se realiza una comparación entre control y patología. Debido a las desviaciones relativamente altas en las propiedades de atenuación tisular entre diferentes ratones, los valores de densidad se normalizan para el hígado frente al bazo (tejido libre de grasa) y la grasa (tejidos grasos absolutos) de acuerdo con la siguiente ecuación y como se describió anteriormente25: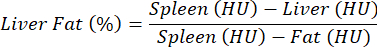
- Para realizar el análisis, cargue el archivo DICOM de la exploración previa al contraste y ajuste la barra/contraste para ver claramente el hígado, el bazo y el tejido adiposo blanco (WAT).
- Acceda a la herramienta Operador de modelado a través del menú desplegable de herramientas en el panel frontal y seleccione Herramienta de ROI 3D.
- En el Operador de ROI 3D, seleccione Agregar ROI para generar varios ROI (hasta ocho para cada tejido) para realizar el muestreo en las áreas donde el hígado (preferiblemente en las áreas del lóbulo medial izquierdo, el lóbulo medial derecho y el lóbulo lateral izquierdo) y el bazo parecen limpios, sin vasos sanguíneos ni grasa aparentes.
NOTA: Para WAT, los ROI se seleccionan en el medio del depósito de tejido adiposo visceral. Las áreas recomendadas se muestran en la Figura 2. También se pueden aplicar métodos de normalización utilizando la relación hígado/bazo y sin incluir WAT como se estableció anteriormente31. - En la función Modo de pintura 3D y Erosionar/Dilatar , seleccione 2D y utilice la interfaz que aparece para especificar un nombre y un color para cada ROI.
- Utilice la herramienta ROI de pintura Sphere con un diámetro de 8 píxeles para dibujar manualmente las ROI 2D.
- Realice el muestreo segmentando el ROI 2D en las áreas de interés utilizando la herramienta Retícula en el plano transversal, como se muestra en la Figura 3A.
- Haga clic en el punto seleccionado en el plano sagital y coronal para completar la segmentación del ROI 2D, como se muestra en la Figura 3B.
- Repita el proceso para definir el resto de los ROI.
NOTA: Al muestrear, evite las regiones del borde del órgano, ya que esto puede introducir ruido y afectar la confiabilidad del valor calculado de la unidad de Hounsfield (HU) de cada ROI. - Una vez que esté satisfecho con los ROI segmentados, vaya a Navegación y seleccione Mostrar tabla para mostrar la tabla de cuantificación que contiene los valores de HU calculados para cada ROI.
NOTA: Los valores de interés se enumeran en la columna "Media", que contiene los valores medios numéricos de los vóxeles (HU) contenidos en los ROI de los órganos de interés. Anote los valores de interés o guarde toda la tabla seleccionando Exportar tabla. - Calcule el HU promedio para el hígado, el bazo y el WAT, y reemplace los valores en la ecuación anterior para calcular el porcentaje de grasa hepática.
- Absorción de tejido funcional/transferencia de lípidos (quilomicrones) en el hígado
NOTA: La captación tisular funcional/transferencia de lípidos (quilomicrones) se analiza a partir de las exploraciones adquiridas a los 45 min y 48 h después de la primera infusión del agente de contraste, basándose en un método previamente publicado32. El contraste se calcula para los diferentes tejidos y puntos de tiempo utilizando la siguiente ecuación: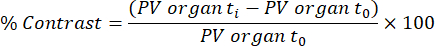
El órgano PV t i es el valor medio de píxel en el órgano en el tiempo t i (que oscila entre 0 h y 48 h), y el órgano PV t0 es el valor medio de píxel en el órgano de la imagen sin contraste.- Para realizar este análisis, cargue el archivo DICOM de escaneo eXIA y ajuste la barra/contraste para ver claramente el hígado, el bazo y el ventrículo izquierdo.
- Acceda al operador de modelado a través del menú desplegable de herramientas en el panel frontal y seleccione Herramienta de ROI 3D.
- En el operador de ROI 3D, seleccione Agregar ROI para segmentar varios ROI para el hígado.
- En la función Modo de pintura 3D y Erodar/Dilatar , utilice la herramienta ROI de pintura de esfera con un diámetro de 8 píxeles y -1 de erosión.
NOTA: Seleccione varios ROI en cortes donde cada órgano aparezca claramente. Evite las regiones fronterizas, ya que esto puede introducir ruido y afectar a la fiabilidad del valor de HU calculado de cada ROI. Esto dará como resultado el muestreo de múltiples ROI 3D, que corresponden a pequeños volúmenes de órganos. - Utilice la interfaz que aparece para especificar un nombre y un color para cada ROI.
- Una vez satisfecho con los ROI diseñados, vaya a Navegación y seleccione Mostrar tabla para mostrar la tabla de cuantificación que contiene los valores de HU calculados para cada ROI.
NOTA: Los valores de interés se enumeran en la columna "Media", que muestra los valores medios numéricos de los vóxeles (HU) incluidos en el ROI. El valor medio de HU de los ROI de cada órgano corresponde a la ti del órgano PV. Anote los valores de interés o guarde toda la tabla seleccionando Exportar tabla. - Para obtener el órgano PV t0, repita todos los pasos anteriores utilizando el archivo DICOM previo al contraste para calcular el brillo medio del hígado, el bazo y el ventrículo izquierdo antes de la inyección del agente de contraste.
- Inserte los valores en la ecuación anterior para extraer el contraste porcentual correspondiente a la absorción tisular funcional/transferencia de lípidos (quilomicrones).
- Arquitectura y densidad de la red vascular hepática
NOTA: El análisis de la arquitectura y densidad de la red vascular hepática se basa en una metodología previamente publicada33 y se realiza en las gammagrafías hepáticas obtenidas 10 min IP del segundo agente de contraste.- Para realizar este análisis, cargue el archivo DICOM de escaneo ExiTron y ajuste la barra/contraste para ver claramente la red vascular hepática.
- Acceda al operador de modelado a través del menú desplegable de herramientas en el panel frontal y seleccione Herramienta de ROI 3D.
- En el operador de ROI 3D, seleccione Agregar ROI para generar un ROI 3D para el hígado.
- En la función Modo de pintura 3D y Erodar/Dilatar , seleccione 3D.
NOTA: Utilice la herramienta ROI de pintura de esfera con erosión de −1 para definir las capas de segmentación en el plano coronal. El diámetro de la herramienta de pintura ROI debe ajustarse de acuerdo con cada capa (para agregar/eliminar cualquier selección de vóxeles deseada/no deseada). Se recomienda que el volumen hepático se defina inicialmente a través del plano coronal, y luego se pueden usar los planos transversal y sagital para corregir el ROI. Este proceso requiere precisión. El usuario debe tener mucho cuidado de no incluir otros tejidos, vasos y huesos al segmentar cada capa de ROI, asegurándose de que todas las áreas del hígado estén incluidas en el ROI definido. Por esta razón, la familiarización con los límites anatómicos del hígado es crucial. - Una vez satisfecho con el ROI hepático resultante, realice un corte para eliminar todos los vóxeles de los datos de imagen que no pertenezcan al ROI hepático inicialmente segmentado. Para ello, elija el ROI del hígado en el Selector de ROI y haga clic en el icono Realizar corte . Esta operación elimina el fondo y deja el ROI del hígado sin cambios.
NOTA: Aunque las funciones de deshacer/rehacer son aplicables a todas las operaciones realizadas en la herramienta ROI 3D, la acción de cortar un ROI no se puede deshacer. Por lo tanto, antes de esta acción, el usuario podría considerar guardar el ROI inicial del hígado en formato DICOM. - El ROI hepático resultante incluye la red vascular y el tejido circundante, que debe ser extirpado. Para ello, restablezca el ROI del hígado haciendo clic en el botón Restablecer escoba ROI .
- Utilice la interfaz que aparece para transferir todos los píxeles del ROI del hígado al fondo.
NOTA: El ROI del hígado seguirá existiendo después de esta operación, pero ya no contendrá vóxeles. - Para volver a segmentar el ROI del hígado de modo que solo contenga píxeles asociados a los vasos vasculares, vaya a Algoritmos de segmentación indicados por el icono de la varita mágica y seleccione Umbral conectado.
- Defina el ROI como Salida y el fondo como Entrada en el menú desplegable de entrada antes de aplicar el umbral.
- Establezca los umbrales haciendo clic en los iconos Mín . y Máx . a la izquierda de cada campo de umbral para rellenar los valores máximo y mínimo y obtener la red vascular.
NOTA: Solo los píxeles dentro del rango elegido se incluirán en el ROI resultante. El ajuste de los valores umbral entre diferentes animales garantiza que se tengan en cuenta las mismas regiones anatómicas con respecto a la cantidad exacta de agente de contraste inyectado en cada animal. Esto es constante entre los tejidos seleccionados, incluso si los valores numéricos no son idénticos. - Utilice la herramienta Punto de mira para hacer clic en un punto donde la red vascular aparezca clara y haga clic en Aplicar para realizar la segmentación.
- Active el visor de proyección de intensidad máxima (MIP).
- Evalúe el ROI hepático resultante en términos de qué tan clara aparece la red vascular en la vista MIP.
- Si el tejido permanece en partes del ROI del hígado, repita los pasos 4.3.5-4.3.11 ajustando el valor del umbral mínimo hasta que el ROI del hígado segmentado represente claramente la red vascular.
- Una vez satisfecho con el ROI hepático resultante, genere la tabla de cuantificación que contiene el volumen de ROI hepático calculado en milímetros cúbicos.
NOTA: Los valores de interés se enumeran en la columna "mm3", que contiene el valor numérico del volumen de los vóxeles (HU) contenidos en el ROI del hígado. Anote los valores de interés o guarde toda la tabla seleccionando Exportar tabla.
- Volumen sanguíneo relativo hepático
NOTA: Para la medición del volumen sanguíneo relativo hepático (rBV), que se correlaciona significativamente con la cantidad de vasos sanguíneos recién formados durante la progresión de la fibrosis, se utilizan exploraciones previas al contraste y exploraciones a las 4 h después de la segunda inyección del agente de contraste. El análisis se realiza como se ha descrito anteriormente34.- Para realizar este análisis, cargue el archivo DICOM de escaneo ExiTron y ajuste la barra/contraste.
NOTA: Deshabilite el visor MIP: en Preferencias, marque la casilla para deshabilitar el visor MIP al cargar. En el caso de grandes conjuntos de datos, esto puede mejorar la velocidad de carga. - Acceda al operador de modelado a través del menú desplegable de herramientas en el panel frontal y seleccione Herramienta de ROI 3D. Esta herramienta proporciona opciones avanzadas para dibujar, visualizar, guardar y cuantificar regiones 2D y 3D.
- En el Operador de ROI 3D, seleccione Agregar ROI y segmente dos ROI: uno para el hígado y otro para un vaso sanguíneo grande.
- En la función Modo de pintura 3D y Erosionar/Dilatar , seleccione 2D.
NOTA: Se recomienda utilizar la herramienta ROI de pintura Sphere con un diámetro de 8-10 píxeles para el hígado y 4-6 píxeles para el vaso sanguíneo. Sin embargo, el diámetro de la herramienta de pintura se puede ajustar en función de lo pequeña que sea el área a seleccionar. - Utilice la interfaz que aparece para especificar un nombre y un color para cada ROI.
NOTA: Seleccione de dos a cinco cortes de partes centrales de los tejidos de interés y defina las capas de segmentación para generar ROI 2D para cada tejido. Al seleccionar las áreas de cada corte, evite las regiones de borde de los órganos, como se muestra en la Figura 4, ya que esto puede introducir ruido y afectar la confiabilidad del valor de HU calculado de cada ROI. - Una vez satisfecho con los ROI diseñados, vaya a Navegación y seleccione Mostrar tabla para mostrar la tabla de cuantificación que contiene los valores de HU calculados para cada ROI.
NOTA: Los valores de interés se enumeran en la columna "Media", que muestra los valores medios numéricos de los vóxeles (HU) incluidos en el ROI. Anote los valores de interés o guarde toda la tabla seleccionando Exportar tabla. - Repita todos los pasos para el archivo DICOM previo al contraste para obtener el brillo medio del hígado antes de la inyección del agente de contraste. Para ello, lleve a cabo los pasos 4.4.2-4.4.5 solo para el hígado.
- Calcule los valores promedio de HU para cada tejido en los puntos de tiempo equivalentes e inserte los valores obtenidos en la siguiente ecuación:
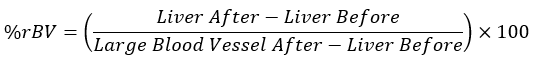
NOTA: Un vaso sanguíneo grande después de la inyección del agente de contraste se considera 100% rBV, y el hígado, antes de la administración del agente de contraste, se considera 0% rBV.
- Para realizar este análisis, cargue el archivo DICOM de escaneo ExiTron y ajuste la barra/contraste.
- Diámetro de la vena porta
NOTA: Para las mediciones del diámetro de la vena porta, se analizan las mismas exploraciones utilizadas para las mediciones del rBV hepático como se describió anteriormente35.- Cargue el archivo DICOM de escaneo ExiTron y ajuste la barra/contraste.
- Localice los planos transversales de tres a cuatro cortes por encima de la unión de las venas mesentéricas superiores y esplénicas (Figura 5).
- Utilice la herramienta Regla para medir la distancia exacta entre dos puntos (es decir, el diámetro de la región de la vena circular).
NOTA: La distancia se extrae en la imagen, pero también se puede ir a Navegación y seleccionar Mostrar tabla para mostrar la tabla de cuantificación que contiene la distancia calculada o seleccionar Exportar tabla para guardar el resultado.
Resultados
En este estudio representativo, la micro-TC sin ningún agente de contraste indicó un mayor porcentaje de grasa hepática en ratones con EHGNA en comparación con los controles (Tabla 2), confirmando la patología. Utilizando el agente de contraste ExiTron y la arquitectura de la red vascular hepática y el análisis de densidad descritos anteriormente, se encontró que la densidad de volumen total de la red vascular hepática era mayor en ratones con EHGNA en comparación con los controles sanos (
Discusión
El método recomendado actualmente para el diagnóstico y la estadificación de la EHGNA en humanos es la biopsia hepática, que conlleva el riesgo de complejidades hemorrágicas, así como de imprecisiones en el muestreo40. Por el contrario, en modelos animales, dicho diagnóstico se realiza por histología post-mortem, aunque ya se dispone de protocolos para la biopsia hepática con capacidad de supervivencia y se recomiendan cuando el diseño del estudio lo permite41. El...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
La figura 1 se creó con BioRender.com. Este trabajo fue apoyado por la Fundación Helénica para la Investigación y la Innovación (#3222 a A.C.). Anna Hadjihambi está financiada por el Instituto Roger Williams de Hepatología, Fundación para la Investigación del Hígado.
Materiales
| Name | Company | Catalog Number | Comments |
| eXIA160 | Binitio Biomedical, Inc. | https://www.binitio.com/?Page=Products | |
| High fat diet with 60% of kilocalories from fat | Research Diets, New Brunswick, NJ, USA | D12492 | |
| High-fructose corn syrup | Best flavors, CA | hfcs-1gallon | |
| Lacrinorm ophthalmic ointment | Bausch & Lomb | ||
| Normal diet with 10% of kilocalories from fat | Research Diets, New Brunswick, NJ, USA | D12450 | |
| Viscover ExiTron nano 12000 | Milteny Biotec, Bergisch Gladbach, Germany | 130-095-698 | |
| VivoQuant | Invicro | ||
| X-CUBE | Molecubes, Belgium | https://www.molecubes.com/systems/ |
Referencias
- Lazarus, J. V., et al. Advancing the global public health agenda for NAFLD: A consensus statement. Nature Reviews. Gastroenterology & Hepatology. 19 (1), 60-78 (2022).
- Takahashi, Y., Fukusato, T. Histopathology of non-alcoholic fatty liver disease/non-alcoholic steatohepatitis. World Journal of Gastroenterology. 20 (42), 15539-15548 (2014).
- Huang, D. Q., El-Serag, H. B., Loomba, R. Global epidemiology of NAFLD-related HCC: Trends, predictions, risk factors and prevention. Nature Reviews Gastroenterology & Hepatology. 18 (4), 223-238 (2021).
- Niederseer, D., Wernly, B., Aigner, E., Stickel, F., Datz, C. NAFLD and cardiovascular diseases: Epidemiological, mechanistic and therapeutic considerations. Journal of Clinical Medicine. 10 (3), 467 (2021).
- Lefere, S., et al. Differential effects of selective- and pan-PPAR agonists on experimental steatohepatitis and hepatic macrophages. Journal of Hepatology. 73 (4), 757-770 (2020).
- Chrysavgis, L., Papatheodoridi, A. M., Chatzigeorgiou, A., Cholongitas, E. The impact of sodium glucose co-transporter 2 inhibitors on non-alcoholic fatty liver disease.Journal of Gastroenterology and Hepatology. Journal of Gastroenterology and Hepatology. 36 (4), 893-909 (2021).
- Li, M., Qian, M., Xu, J. Vascular endothelial regulation of obesity-associated insulin resistance. Frontiers in Cardiovascular Medicine. 4, 51 (2017).
- Pi, X., Xie, L., Patterson, C. Emerging roles of vascular endothelium in metabolic homeostasis. Circulation Research. 123 (4), 477-494 (2018).
- Chiu, J. J., Chien, S. Effects of disturbed flow on vascular endothelium: Pathophysiological basis and clinical perspectives. Physiological Reviews. 91 (1), 327-387 (2011).
- Koyama, Y., Brenner, D. A. Liver inflammation and fibrosis. The Journal of Clinical Investigation. 127 (1), 55-64 (2017).
- Nasiri-Ansari, N., et al. Endothelial cell dysfunction and non-alcoholic fatty liver disease (NAFLD): A concise review. Cells. 11 (16), 2511 (2022).
- Lefere, S., et al. Angiopoietin-2 promotes pathological angiogenesis and is a therapeutic target in murine non-alcoholic fatty liver disease. Hepatology. 69 (3), 1087-1104 (2019).
- Pasarin, M., et al. Insulin resistance and liver microcirculation in a rat model of early NAFLD. Journal of Hepatology. 55 (5), 1095-1102 (2011).
- Hammoutene, A., Rautou, P. E. Role of liver sinusoidal endothelial cells in non-alcoholic fatty liver disease. Journal of Hepatology. 70 (6), 1278-1291 (2019).
- Sun, X., Harris, E. N. New aspects of hepatic endothelial cells in physiology and non-alcoholic fatty liver disease. American Journal of Physiology. Cell Physiology. 318 (6), C1200-C1213 (2020).
- Iwakiri, Y., Shah, V., Rockey, D. C. Vascular pathobiology in chronic liver disease and cirrhosis - current status and future directions. Journal of Hepatology. 61 (4), 912-924 (2014).
- Baffy, G. Origins of portal hypertension in non-alcoholic fatty liver disease. Digestive Diseases and Sciences. 63 (3), 563-576 (2018).
- Ruhli, F. J., Kuhn, G., Evison, R., Muller, R., Schultz, M. Diagnostic value of micro-CT in comparison with histology in the qualitative assessment of historical human skull bone pathologies. American Journal of Physical Anthropology. 133 (4), 1099-1111 (2007).
- Rodt, T., et al. Micro-computed tomography of pulmonary fibrosis in mice induced by adenoviral gene transfer of biologically active transforming growth factor-beta1. Respiratory Research. 11 (1), 181 (2010).
- Deng, L., Xiao, S. M., Qiang, J. W., Li, Y. A., Zhang, Y. Early lung adenocarcinoma in mice: Micro-computed tomography manifestations and correlation with pathology. Translational Oncology. 10 (3), 311-317 (2017).
- Feng, J., et al. Abnormalities in the enamel in bmp2-deficient mice. Cells, Tissues, Organs. 194 (2-4), 216-221 (2011).
- Kagadis, G. C., Loudos, G., Katsanos, K., Langer, S. G., Nikiforidis, G. C. In vivo small animal imaging: current status and future prospects. Medical Physics. 37 (12), 6421-6442 (2010).
- Starosolski, Z., et al. Ultra high-resolution in vivo computed tomography imaging of mouse cerebrovasculature using a long circulating blood pool contrast agent. Scientific Reports. 5, 10178 (2015).
- Caussy, C., Reeder, S. B., Sirlin, C. B., Noninvasive Loomba, R. quantitative assessment of liver fat by MRI-PDFF as an endpoint in NASH trials. Hepatology. 68 (2), 763-772 (2018).
- Lubura, M., et al. Non-invasive quantification of white and brown adipose tissues and liver fat content by computed tomography in mice. PLoS One. 7 (5), e37026 (2012).
- Perciedu Sert, N., et al. The ARRIVE guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biology. 18 (7), e3000410 (2020).
- Tetri, L. H., Basaranoglu, M., Brunt, E. M., Yerian, L. M., Neuschwander-Tetri, B. A. Severe NAFLD with hepatic necroinflammatory changes in mice fed trans fats and a high-fructose corn syrup equivalent. American Journal of Physiology. Gastrointestinal and Liver Physiology. 295 (5), G987-G995 (2008).
- Machado, M. V., et al. Mouse models of diet-induced non-alcoholic steatohepatitis reproduce the heterogeneity of the human disease. PLoS One. 10 (5), 0127991 (2015).
- Jensen, T., et al. Fructose and sugar: A major mediator of non-alcoholic fatty liver disease. Journal of Hepatology. 68 (5), 1063-1075 (2018).
- Nevzorova, Y. A., Boyer-Diaz, Z., Cubero, F. J., Gracia-Sancho, J. Animal models for liver disease - A practical approach for translational research. Journal of Hepatology. 73 (2), 423-440 (2020).
- De Rudder, M., et al. Automated computerized image analysis for the user-independent evaluation of disease severity in preclinical models of NAFLD/NASH. Laboratory Investigation. 100 (1), 147-160 (2020).
- Willekens, I., et al. Time-course of contrast enhancement in spleen and liver with Exia 160, Fenestra LC, and VC. Molecular Imaging and Biology. 11 (2), 128-135 (2009).
- Das, N. M., et al. In vivo quantitative microcomputed tomographic analysis of vasculature and organs in a normal and diseased mouse model. PLoS One. 11 (2), e0150085 (2016).
- Ehling, J., et al. CCL2-dependent infiltrating macrophages promote angiogenesis in progressive liver fibrosis. Gut. 63 (12), 1960-1971 (2014).
- Zhang, J., et al. Gamna-Gandy bodies of the spleen detected with susceptibility weighted imaging: maybe a new potential non-invasive marker of esophageal varices. PLoS One. 8 (1), e55626 (2013).
- Chen, Y., Li, J., Zhou, Q., Lyu, G., Li, S. Detection of liver and spleen stiffness in rats with portal hypertension by two-dimensional shear wave elastography. BMC Medical Imaging. 22 (1), 68 (2022).
- Lessa, A. S., et al. Ultrasound imaging in an experimental model of fatty liver disease and cirrhosis in rats. BMC Veterinary Research. 6, 6 (2010).
- Abikhzer, G., Alabed, Y. Z., Azoulay, L., Assayag, J., Rush, C. Altered hepatic metabolic activity in patients with hepatic steatosis on FDG PET/CT. AJR. American Journal of Roentgenology. 196 (1), 176-180 (2011).
- Newman, E. M., Rowland, A. A physiologically based pharmacokinetic model to predict the impact of metabolic changes associated with metabolic associated fatty liver disease on drug exposure. International Journal of Molecular Sciences. 23 (19), 11751 (2022).
- Tsai, E., Lee, T. P. Diagnosis and evaluation of non-alcoholic fatty liver disease/non-alcoholic steatohepatitis, including noninvasive biomarkers and transient elastography. Clinics in Liver Disease. 22 (1), 73-92 (2018).
- Oldham, S., Rivera, C., Boland, M. L., Trevaskis, J. L. Incorporation of a survivable liver biopsy procedure in mice to assess non-alcoholic steatohepatitis (NASH) resolution. Journal of Visualized Experiments. 146, e59130 (2019).
- Boll, H., et al. Comparison of Fenestra LC, ExiTron nano 6000, and ExiTron nano 12000 for micro-CT imaging of liver and spleen in mice. Academic Radiology. 20 (9), 1137-1143 (2013).
- Ashton, J. R., West, J. L., Badea, C. T. In vivo small animal micro-CT using nanoparticle contrast agents. Frontiers in Pharmacology. 6, 256 (2015).
- Rothe, J. H., et al. Time course of contrast enhancement by micro-CT with dedicated contrast agents in normal mice and mice with hepatocellular carcinoma: Comparison of one iodinated and two nanoparticle-based agents. Academic Radiology. 22 (2), 169-178 (2015).
- Toczek, J., et al. Computed tomography imaging of macrophage phagocytic activity in abdominal aortic aneurysm. Theranostics. 11 (12), 5876-5888 (2021).
- Mannheim, J. G., et al. Comparison of small animal CT contrast agents. Contrast Media & Molecular Imaging. 11 (4), 272-284 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados