Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Nouvelles techniques d’imagerie par micro-tomodensitométrie in vivo pour évaluer la progression de la stéatose hépatique non alcoolique
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
À l’aide d’un modèle murin de stéatose hépatique non alcoolique induite par l’alimentation, nous décrivons l’utilisation de nouvelles techniques d’imagerie par micro-tomodensitométrie in vivo comme méthode non invasive pour évaluer les stades de progression de la NAFLD, en nous concentrant principalement sur le réseau vasculaire hépatique hépatique en raison de son implication significative dans la dérégulation hépatique liée à la NAFLD.
Résumé
La stéatose hépatique non alcoolique (NAFLD) est un problème de santé mondial croissant, et l’impact de la NAFLD est aggravé par le manque actuel de traitements efficaces. Les insuffisances actuelles dans la caractérisation de la structure du microenvironnement hépatique et dans l’évaluation du stade de la maladie de manière spatio-temporelle et non invasive sont des facteurs limitatifs considérables qui entravent le diagnostic rapide et précis (y compris le classement) et la surveillance de la stéatose hépatique, ainsi que la mise au point de thérapies potentielles. À l’aide d’un modèle murin de NAFLD induit par l’alimentation, nous avons étudié l’utilisation de techniques d’imagerie par micro-tomodensitométrie (TDM) in vivo comme méthode non invasive pour évaluer les stades de progression de la NAFLD, en nous concentrant principalement sur le réseau vasculaire hépatique en raison de son implication significative dans la dérégulation hépatique liée à la NAFLD. Cette méthodologie d’imagerie permet l’analyse longitudinale de la stéatose hépatique et de l’absorption des tissus fonctionnels, ainsi que l’évaluation du volume sanguin relatif, du diamètre de la veine porte et de la densité du réseau vasculaire. Comprendre les adaptations du réseau vasculaire hépatique au cours de la progression de la stéatose hépatique non alcoolique et les corréler avec d’autres moyens de caractériser la progression de la maladie (stéatose, inflammation, fibrose) à l’aide de la méthode proposée peut ouvrir la voie à la mise en place de nouvelles approches plus efficaces et reproductibles pour la recherche sur la stéatose hépatique non alcoolique chez la souris. Ce protocole devrait également améliorer la valeur des modèles animaux précliniques pour étudier le développement de nouvelles thérapies contre la progression de la maladie.
Introduction
La stéatose hépatique non alcoolique (NAFLD) est une maladie métabolique qui touche environ 25 % de la population et >80 % des personnes souffrant d’obésité morbide1. On estime qu’un tiers de ces personnes évoluent vers une stéatohépatite non alcoolique (NASH), qui se caractérise par une stéatose hépatique, une inflammation et une fibrose2. La NASH est un stade de la maladie qui présente un risque significativement plus élevé de développement de la cirrhose et du carcinome hépatocellulaire (CHC)3,4. Pour cette raison, la NASH est actuellement la deuxième cause la plus fréquente de transplantation hépatique, et on s’attend également à ce qu’elle devienne bientôt le prédicteur le plus important de la transplantation hépatique 5,6,7. Malgré sa prévalence et sa gravité, il n’existe pas de traitement spécifique de la NAFLD, et les traitements existants ne visent qu’à s’attaquer aux pathologies associées à la maladie telles que la résistance à l’insuline et l’hyperlipidémie 5,6.
Ces dernières années, le rôle physiopathologique et les adaptations de l’endothélium et, en général, du réseau vasculaire des tissus métaboliques, tels que le tissu adipeux et le foie, ont pris de plus en plus d’importance dans la recherche, en particulier au cours de l’obésité et de la dérégulation métabolique 7,8. L’endothélium est une monocouche cellulaire qui tapisse le réseau vasculaire à l’intérieur, agissant comme une barrière fonctionnelle et structurelle. Il contribue également à divers processus physiologiques et pathologiques, tels que la thrombose, le transport des métabolites, l’inflammation et l’angiogenèse 9,10. Dans le cas du foie, le réseau vasculaire est, entre autres, caractérisé par la présence de cellules hautement spécialisées, définies comme des cellules endothéliales sinusoïdales hépatiques (LSEC). Ces cellules n’ont pas de membrane basale et ont de multiples fenêtres, ce qui facilite le transfert des substrats entre le sang et le parenchyme hépatique. En raison de leur emplacement anatomique et de leurs caractéristiques distinctives, les LSEC jouent probablement un rôle crucial dans les processus physiopathologiques du foie, y compris le développement de l’inflammation et de la fibrose hépatiques au cours de la NAFLD/NASH. En effet, les adaptations pathologiques, moléculaires et cellulaires que subissent les LSEC au cours de la NAFLD contribuent à la progression de la maladie11. Plus précisément, l’angiogenèse hépatique dépendante de la LSEC qui a lieu au cours de la NAFLD est significativement associée au développement de l’inflammation et à la progression de la maladie vers la NASH ou même le CHC12. En outre, la NAFLD précoce liée à l’obésité est caractérisée par le développement d’une résistance à l’insuline dans les LSEC, qui précède le développement d’une inflammation hépatique ou d’autres signes avancés de NAFLD13.
De plus, les LSEC sont récemment apparus comme des régulateurs centraux du flux sanguin hépatique et des adaptations du réseau vasculaire au cours d’une maladie hépatique de plusieurs étiologies14,15. En effet, la maladie hépatique chronique se caractérise par une vasoconstriction intra-hépatique importante et une résistance accrue au flux sanguin, qui contribuent au développement de l’hypertension portale16. Dans le cas de la stéatose hépatique non alcoolique, plusieurs mécanismes liés à la LSEC contribuent à ce phénomène. Par exemple, la résistance à l’insuline spécifique au LSEC, comme mentionné ci-dessus, est associée à une réduction de la vasodilatation insulino-dépendante du système vasculaire hépatique13. En outre, au cours de la maladie, le système vasculaire du foie devient plus sensible aux vasoconstricteurs, ce qui contribue davantage à l’altération du flux sanguin hépatique et à l’apparition d’une contrainte de cisaillement, qui entraînent toutes deux une perturbation de la microcirculation sinusoïdale17. Ces faits suggèrent que le système vasculaire est une cible clé dans les maladies du foie. Néanmoins, les facteurs limitatifs qui entravent le diagnostic et le suivi en temps opportun de la NAFLD/NASH, ainsi que le développement de thérapies potentielles, sont les insuffisances dans la caractérisation cohérente du microenvironnement hépatique et de la structure (micro)vasculaire, ainsi que dans la notation du stade de la maladie de manière spatio-temporelle et non invasive.
La microtomodensitométrie (TDM) est actuellement la méthode d’imagerie non invasive de référence pour représenter avec précision les informations anatomiques d’un organisme vivant. La micro-tomodensitométrie et l’IRM représentent deux méthodes d’imagerie complémentaires qui peuvent couvrir un large éventail de pathologies et fournir une résolution et un niveau de détail exceptionnels dans les structures et les tissus imagés. La micro-tomodensitométrie, en particulier, est un outil très rapide et précis qui est souvent utilisé pour étudier des pathologies telles que les maladies osseuses et les modifications de la surface osseuse associées18, évaluer l’évolution de la fibrose pulmonaire dans le temps19, diagnostiquer le cancer du poumon et sa stadification20, ou encore examiner les pathologies dentaires21, sans aucune préparation particulière (ou destruction) des échantillons à imager.
La technologie d’imagerie de la micro-tomodensitométrie est basée sur les différentes propriétés d’atténuation de divers organes en termes d’interaction des rayons X avec la matière. Les organes présentant de fortes différences d’atténuation des rayons X sont représentés avec un contraste élevé dans les images de tomodensitométrie (c’est-à-dire que les poumons semblent sombres et les os clairs). Les organes présentant des propriétés d’atténuation très similaires (tissus mous différents) sont difficiles à distinguer sur les images de tomodensitométrie22. Pour remédier à cette limitation, des agents de contraste spécialisés à base d’iode, d’or et de bismuth ont fait l’objet d’études approfondies en vue d’une utilisation in vivo . Ces agents modifient les propriétés d’atténuation des tissus dans lesquels ils s’accumulent, sont éliminés lentement de la circulation et permettent l’opacification uniforme et stable de l’ensemble du système vasculaire ou de tissus choisis23.
Dans le domaine du diagnostic humain, l’imagerie par tomodensitométrie et des techniques comparables, telles que la fraction de graisse de densité protonique dérivée de l’IRM, sont déjà utilisées pour la détermination de la teneur en graisse hépatique24,25. Dans le contexte de la stéatose hépatique non alcoolique, un contraste élevé des tissus mous est essentiel pour distinguer avec précision les lésions pathologiques ou les petits vaisseaux. À cette fin, des agents de contraste offrant un contraste accru des caractéristiques du tissu hépatique sont utilisés. Ces outils et matériaux permettent d’étudier de multiples caractéristiques hépatiques et des expressions pathologiques possibles, telles que l’architecture et la densité du réseau vasculaire, le dépôt/la stéatose lipidique et l’absorption tissulaire fonctionnelle/le transfert de lipides (chylomicron) dans le foie. De plus, le volume sanguin relatif hépatique et le diamètre de la veine porte peuvent également être évalués. En un temps d’analyse très court, tous ces paramètres fournissent des informations différentes et complémentaires sur l’évaluation et la progression de la NAFLD, qui peuvent être utilisées pour développer un diagnostic non invasif et détaillé.
Dans cet article, nous fournissons un protocole étape par étape pour l’utilisation de nouvelles techniques d’imagerie micro-CT in vivo comme méthode non invasive pour évaluer les stades de progression de la NAFLD. À l’aide de ce protocole, l’analyse longitudinale de la stéatose hépatique et de l’absorption des tissus fonctionnels, ainsi que l’évaluation du volume sanguin relatif, du diamètre de la veine porte et de la densité du réseau vasculaire, peuvent être effectuées et appliquées dans des modèles murins de maladie hépatique.
Protocole
Toutes les procédures ont été effectuées par le personnel de BIOEMTECH conformément aux réglementations européennes et nationales en matière de bien-être et ont été approuvées par les autorités nationales (numéro de licence EL 25, BIOexp 45/PN 49553 du 21/01/20). Toutes les expériences ont été conçues et rapportées dans le respect des lignes directrices ARRIVE26. Les souris ont été achetées à l’Institut Pasteur hellénique d’Athènes, en Grèce.
REMARQUE : Les animaux ont été logés en groupe dans des cages ventilées individuellement enrichies de rails et de tubes en carton dans une pièce à 20-22 °C, avec une humidité relative de 50 % à 60 % et un cycle lumière/obscurité de 12 h (lumière 07h00-19h00). Une combinaison d’un régime riche en graisses (HFD) et de sirop de maïs à haute teneur en fructose (HFCS), un édulcorant contenant du fructose et du glucose largement utilisé dans les types modernes de régimes enrichis en graisses, a été utilisée pour induire la NAFLD en tant que modèle fiable reconnu 27,28,29,30. À l’âge de 7-8 semaines, les souris mâles C57BL/6 ont eu accès ad libitum soit à un régime normal (n = 2) contenant 10 % de kilocalories provenant des graisses, soit à un HFD (n = 2) contenant 60 % des kilocalories provenant des graisses supplémentées à 5 % de HFCS dans l’eau pendant 22 semaines. Le poids corporel a été mesuré chaque semaine à l’aide d’une balance numérique et, pendant la période expérimentale, le bien-être des animaux a été surveillé un jour sur deux à l’aide d’une feuille de score. À la fin du protocole d’imagerie, les souris ont été euthanasiées par luxation cervicale.
1. Préparation des animaux
REMARQUE : Le protocole d’imagerie est résumé à la figure 1.
- Anesthésiez la souris à l’aide de 3 à 4 % d’isoflurane (dans l’air ambiant) et maintenez sa température corporelle à l’aide d’un coussin chauffant dédié.
REMARQUE : L’absence d’un réflexe de retrait de la pédale doit être utilisée pour confirmer une profondeur d’anesthésie suffisante avant de commencer l’examen. - Appliquez une pommade ophtalmique sur les yeux de l’animal avant l’expérimentation.
- Placez l’animal dans le berceau du tomodensitomètre, fixez le cône nasal et passez à 1,5 % à 3 % d’isoflurane (dans l’air ambiant) pour l’entretien.
REMARQUE : L’absence d’un réflexe de retrait de la pédale doit être utilisée pour confirmer le pourcentage approprié d’isoflurane pour le maintien de l’anesthésie. - Surveillez la souris en permanence.
2. Préparation avant la numérisation
REMARQUE : L’imagerie est réalisée en deux phases expérimentales pour permettre au premier agent de contraste d’être éliminé de manière adéquate de la circulation et des tissus. L’eXIA (premier agent de contraste) est administré dans la première phase et l’ExiTron (deuxième agent de contraste) dans la deuxième phase, comme décrit dans la section « Flux de travail d’imagerie » (section 3) ci-dessous.
- Laisser l’agent de contraste (eXIA ou ExiTron, selon la phase expérimentale) atteindre la température ambiante pendant 3 h.
- Réglez les paramètres de balayage suivants sur le tomodensitomètre : protocole haute résolution sous une tension de tube de 50 kVp et un courant de 460 μA, sans spirale, 720 projections/rotation, quatre rotations et un temps d’acquisition de 4 min.
3. Flux de travail d’imagerie
- Phase expérimentale 1
- Calculer et préparer le volume du premier produit de contraste à administrer à une dose non diluée de 6 μL/g de poids corporel pour un contraste maximal.
- Préparez le cathéter de la veine caudale en le remplissant de solution saline et en le connectant à la seringue remplie d’agent de contraste.
- Acquérir une scintigraphie de base du corps entier et du foie avant le contraste.
- Assurez-vous qu’il n’y a pas de bulles ou d’obstructions dans la seringue ou le cathéter.
- Insérez le cathéter prérempli dans la veine caudale et administrez l’agent de contraste par une injection effectuée lentement et manuellement, d’une durée de 1 à 3 minutes (et non sous forme d’injection en bolus). Un pousse-seringue peut être utilisé lorsqu’il est réglé sur le débit de perfusion approprié.
REMARQUE : La queue de l’animal peut être placée dans de l’eau tiède pour induire une vasodilatation et aider à l’insertion du cathéter - Obtenir des scintigraphies WB et hépatiques à différents moments, comme indiqué dans le tableau 1.
REMARQUE : Si l’acquisition de tous les points n’est pas possible, l’accent doit être mis sur 45 minutes après l’injection (IP), qui est le point d’absorption hépatique maximale, et 48 h IP, qui est le moment où la clairance est atteinte.
- Phase expérimentale 2
- Préparer à nouveau la souris comme décrit à la rubrique 1 pour l’administration du deuxième produit de contraste 10 jours après la lecture finale avec le premier produit de contraste (48 h IP).
- Effectuez les étapes 2.1 à 2.2.
- Calculer et préparer le volume du deuxième produit de contraste à administrer à une dose non diluée de 8 μL/g de poids corporel pour un contraste maximal.
- Préparez le cathéter de la veine caudale en le remplissant de solution saline et en le connectant à la seringue remplie d’agent de contraste.
- Obtenir une WB pré-contraste et une scintigraphie de base du foie pour évaluer le volume sanguin relatif et la stéatose hépatique.
- Assurez-vous qu’aucun produit de contraste n’est détectable dans le balayage afin d’indiquer le jeu complet du premier produit de contraste.
- Insérez le cathéter prérempli dans la veine de la queue et administrez l’agent de contraste par injection intraveineuse effectuée lentement et manuellement, d’une durée de 1 à 3 minutes (et non en bolus). Un pousse-seringue peut être utilisé lorsqu’il est réglé sur le débit de perfusion approprié.
- Obtenir des scintigraphies WB et hépatiques à différents moments, comme indiqué dans le tableau 1.
REMARQUE : Les scintigraphies WB sont acquises à 10 min et 4 h PI. L’important laps de temps qui les sépare permet d’évaluer la biodistribution du traceur dans l’organisme ainsi que sa clairance relative.
4. Extraction et analyse des données
NOTE : Dans ce protocole, les étapes d’extraction et d’analyse des données basées sur un logiciel de traitement d’imagerie spécifique (voir Tableau des matériaux) sont fournies. Il peut être nécessaire d’adapter les étapes décrites lors de l’utilisation d’un logiciel différent.
- Évaluation du dépôt/stéatose lipidique hépatique.
REMARQUE : Pour l’évaluation de la stéatose hépatique, aucun agent de contraste n’est utilisé et une comparaison entre le contrôle et la pathologie est effectuée. En raison des écarts relativement élevés dans les propriétés d’atténuation tissulaire entre les différentes souris, les valeurs de densité sont normalisées pour le foie par rapport à la rate (tissu sans graisse) et à la graisse (tissus adipeux absolus) selon l’équation suivante et comme décrit précédemment25 :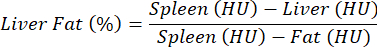
- Pour effectuer l’analyse, chargez le fichier DICOM de la pré-analyse de contraste et ajustez la barre/le contraste pour voir clairement le foie, la rate et le tissu adipeux blanc (WAT).
- Accédez à l’outil Opérateur de modélisation via le menu déroulant de l’outil sur le panneau avant, puis sélectionnez Outil ROI 3D.
- Sous l’opérateur ROI 3D, sélectionnez Ajouter un retour sur investissement pour générer plusieurs ROI (jusqu’à huit pour chaque tissu) afin d’effectuer un échantillonnage dans les zones où le foie (de préférence dans les zones du lobe médial gauche, du lobe médial droit et du lobe latéral gauche) et la rate semblent clairs, sans vaisseaux sanguins ni graisse apparents.
REMARQUE : Pour le WAT, les ROI sont sélectionnés au milieu du dépôt de tissu adipeux viscéral. Les zones recommandées sont illustrées à la figure 2. Des méthodes de normalisation utilisant le rapport foie/rate et sans inclure le WAT peuvent également être appliquées comme indiqué précédemment31. - Sous la fonction Mode de peinture 3D et Érosion/Dilate , sélectionnez 2D et utilisez l’interface qui s’affiche pour spécifier un nom et une couleur pour chaque retour sur investissement.
- Utilisez l’outil ROI de peinture Sphère d’un diamètre de 8 pixels pour dessiner manuellement les ROI 2D.
- Effectuez l’échantillonnage en segmentant les ROI 2D sur les zones d’intérêt à l’aide de l’outil Réticule sur le plan transversal, comme illustré à la Figure 3A.
- Cliquez sur le point sélectionné au niveau du plan sagittal et coronal pour terminer la segmentation du ROI 2D, comme illustré à la figure 3B.
- Répétez le processus de définition du reste des ROI.
REMARQUE : Lors de l’échantillonnage, évitez les régions de bordure de l’organe, car cela peut introduire du bruit et affecter la fiabilité de la valeur calculée de l’unité de Hounsfield (HU) de chaque ROI. - Une fois satisfait des ROI segmentés, accédez à Navigation, puis sélectionnez Afficher le tableau pour afficher le tableau de quantification contenant les valeurs HU calculées pour chaque ROI.
REMARQUE : Les valeurs d’intérêt sont répertoriées dans la colonne « Moyenne », qui contient les valeurs moyennes numériques des voxels (HU) contenus dans les ROI pour les organes d’intérêt. Notez les valeurs qui vous intéressent ou enregistrez l’intégralité de la table en sélectionnant Exporter la table. - Calculez l’HU moyen pour le foie, la rate et l’WAT, et insérez les valeurs dans l’équation ci-dessus pour calculer le pourcentage de graisse hépatique.
- Absorption tissulaire fonctionnelle/transfert de lipides (chylomicron) dans le foie
REMARQUE : L’absorption tissulaire fonctionnelle/transfert de lipides (chylomicron) est analysé à partir des scans acquis à 45 min et 48 h après la première perfusion d’agent de contraste, sur la base d’une méthode publiée précédemment32. Le contraste est calculé pour les différents tissus et points temporels à l’aide de l’équation ci-dessous :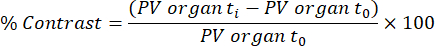
L’organe PV t i est la valeur moyenne des pixels de l’organe à l’instant t i (allant de 0 h à 48 h), et l’organe PV t 0 est la valeur moyenne des pixels de l’organe de l’image sans contraste.- Pour effectuer cette analyse, chargez le fichier DICOM de balayage eXIA et ajustez la barre/le contraste pour voir clairement le foie, la rate et le ventricule gauche.
- Accédez à l’opérateur de modélisation via le menu déroulant de l’outil sur le panneau avant, puis sélectionnez Outil de retour sur investissement 3D.
- Sous l’opérateur de retour sur investissement 3D, sélectionnez Ajouter un retour sur investissement pour segmenter plusieurs retours sur investissement pour le foie.
- Sous la fonction Mode de peinture 3D et Érosion/Dilate , utilisez l’outil ROI de la peinture Sphère avec un diamètre de 8 pixels et une érosion de −1.
REMARQUE : Sélectionnez plusieurs ROI sur des tranches où chaque organe apparaît clairement. Évitez les régions frontalières, car cela peut introduire du bruit et affecter la fiabilité de la valeur HU calculée de chaque ROI. Cela se traduira par l’échantillonnage de plusieurs ROI 3D, qui correspondent à de petits volumes d’organes. - Utilisez l’interface qui s’affiche pour spécifier un nom et une couleur pour chaque retour sur investissement.
- Une fois satisfait des ROI conçus, accédez à Navigation, puis sélectionnez Afficher le tableau pour afficher le tableau de quantification contenant les valeurs HU calculées pour chaque ROI.
REMARQUE : Les valeurs d’intérêt sont répertoriées dans la colonne « Moyenne », qui affiche les valeurs moyennes numériques des voxels (HU) inclus dans le ROI. La valeur moyenne HU des ROI de chaque organe correspond à l’organe PV ti. Notez les valeurs qui vous intéressent ou enregistrez l’intégralité de la table en sélectionnant Exporter la table. - Pour obtenir l’organe PV t0, répétez toutes les étapes ci-dessus à l’aide du fichier DICOM de pré-contraste pour calculer la luminosité moyenne du foie, de la rate et du ventricule gauche avant l’injection de produit de contraste.
- Insérez les valeurs dans l’équation ci-dessus pour extraire le pourcentage de contraste correspondant à l’absorption tissulaire fonctionnelle/transfert de lipides (chylomicron).
- Architecture et densité du réseau vasculaire hépatique
NOTE : L’analyse de l’architecture et de la densité du réseau vasculaire hépatique est basée sur une méthodologie publiée précédemment33 et est réalisée sur les scintigraphies hépatiques obtenues 10 min IP du deuxième agent de contraste.- Pour effectuer cette analyse, chargez le fichier DICOM de balayage ExiTron et ajustez la barre/le contraste pour voir clairement le réseau vasculaire hépatique.
- Accédez à l’opérateur de modélisation via le menu déroulant de l’outil sur le panneau avant, puis sélectionnez Outil de retour sur investissement 3D.
- Sous l’opérateur ROI 3D, sélectionnez Ajouter un ROI pour générer un ROI 3D pour le foie.
- Sous la fonction Mode de peinture 3D et érosion/dilatation , sélectionnez 3D.
REMARQUE : Utilisez l’outil ROI de la peinture Sphère avec −1 érosion pour définir les couches de segmentation sur le plan coronal. Le diamètre de l’outil de peinture ROI doit être ajusté en fonction de chaque couche (pour ajouter/supprimer des sélections de voxels souhaitées/indésirables). Il est recommandé de définir d’abord le volume hépatique sur le plan coronal, puis d’utiliser les plans transverse et sagittal pour corriger le retour sur investissement. Ce processus nécessite de la précision. L’utilisateur doit faire très attention à ne pas inclure d’autres tissus, vaisseaux et os lors de la segmentation de chaque couche de ROI tout en s’assurant que toutes les zones du foie sont incluses dans le ROI défini. Pour cette raison, la familiarisation avec les limites anatomiques du foie est cruciale. - Une fois satisfait du retour sur investissement hépatique qui en résulte, effectuez une coupe afin de supprimer tous les voxels des données d’image qui n’appartiennent pas au retour sur investissement hépatique initialement segmenté. Pour cela, choisissez le ROI du foie dans le sélecteur de ROI, et cliquez sur l’icône Effectuer la coupe . Cette opération supprime l’arrière-plan et laisse le retour sur investissement du foie inchangé.
REMARQUE : Bien que les fonctions d’annulation/rétablissement s’appliquent à toutes les opérations effectuées sous l’outil ROI 3D, l’action de couper un ROI ne peut pas être annulée. Ainsi, avant cette action, l’utilisateur peut envisager d’enregistrer le retour sur investissement initial du foie au format DICOM. - Le retour sur investissement hépatique qui en résulte comprend le réseau vasculaire et les tissus environnants, qui doivent être retirés. Pour cela, réinitialisez le ROI du foie en cliquant sur le bouton Réinitialiser le ROI du balai.
- Utilisez l’interface qui apparaît pour transférer tous les pixels du ROI du foie vers l’arrière-plan.
REMARQUE : Le ROI du foie existera toujours après cette opération, mais il ne contiendra plus de voxels. - Pour resegmenter le retour sur investissement du foie afin qu’il ne contienne que les pixels associés au système vasculaire, accédez à Algorithmes de segmentation indiqués par l’icône de la baguette magique, puis sélectionnez Seuillage connecté.
- Définissez le retour sur investissement en tant que sortie et l’arrière-plan en tant qu’entrée dans le menu déroulant d’entrée avant d’appliquer le seuillage.
- Définissez les seuils en cliquant sur les icônes Min et Max à gauche de chaque champ de seuil pour renseigner les valeurs maximales et minimales et obtenir le réseau vasculaire.
REMARQUE : Seuls les pixels compris dans la plage choisie seront inclus dans le retour sur investissement résultant. L’ajustement des valeurs seuils entre les différents animaux permet de s’assurer que les mêmes régions anatomiques sont prises en compte en ce qui concerne la quantité exacte de produit de contraste injectée dans chaque animal. Ceci est constant entre les tissus sélectionnés, même si les valeurs numériques ne sont pas identiques. - Utilisez l’outil Réticule pour cliquer sur un point où le réseau vasculaire apparaît clair, puis cliquez sur Appliquer pour effectuer la segmentation.
- Activez la visionneuse de projection d’intensité maximale (MIP).
- Évaluez le retour sur investissement hépatique résultant en termes de clarté du réseau vasculaire dans la vue MIP.
- Si le tissu reste dans certaines parties du ROI du foie, répétez les étapes 4.3.5 à 4.3.11 en ajustant la valeur du seuil Min jusqu’à ce que le ROI du foie segmenté représente clairement le réseau vasculaire.
- Une fois satisfait du retour sur investissement hépatique résultant, générez le tableau de quantification contenant le volume de retour sur investissement hépatique calculé en millimètres cubes.
REMARQUE : Les valeurs d’intérêt sont répertoriées dans la colonne « mm3 », qui contient la valeur numérique du volume des voxels (HU) contenus dans le ROI du foie. Notez les valeurs qui vous intéressent ou enregistrez l’intégralité de la table en sélectionnant Exporter la table.
- Volume sanguin relatif hépatique
REMARQUE : Pour la mesure du volume sanguin relatif hépatique (rBV), qui est significativement corrélé à la quantité de vaisseaux sanguins nouvellement formés au cours de la progression de la fibrose, des scintigraphies de pré-contraste et des scintigraphies à 4 h après la deuxième injection d’agent de contraste sont utilisées. L’analyse est effectuée comme décrit précédemment34.- Pour effectuer cette analyse, chargez le fichier DICOM de balayage ExiTron et ajustez la barre/le contraste.
REMARQUE : Désactiver la visionneuse MIP : sous Préférences, cochez la case pour désactiver la visionneuse MIP lors du chargement. Pour les jeux de données volumineux, cela peut améliorer la vitesse de chargement. - Accédez à l’opérateur de modélisation via le menu déroulant de l’outil sur le panneau avant, puis sélectionnez Outil de retour sur investissement 3D. Cet outil offre des options avancées pour dessiner, visualiser, enregistrer et quantifier les régions 2D et 3D.
- Sous l’opérateur de retour sur investissement 3D, sélectionnez Ajouter un retour sur investissement, puis segmentez deux retours sur investissement : un pour le foie et un pour un gros vaisseau sanguin.
- Sous la fonction Mode de peinture 3D et érosion/dilatation , sélectionnez 2D.
REMARQUE : Il est recommandé d’utiliser l’outil ROI de peinture Sphère avec un diamètre de 8 à 10 pixels pour le foie et de 4 à 6 pixels pour le vaisseau sanguin. Cependant, le diamètre de l’outil de peinture peut être ajusté en fonction de la taille de la zone à sélectionner. - Utilisez l’interface qui s’affiche pour spécifier un nom et une couleur pour chaque retour sur investissement.
REMARQUE : Sélectionnez deux à cinq tranches des parties centrales des tissus d’intérêt et définissez les couches de segmentation pour générer des ROI 2D pour chaque tissu. Lors de la sélection des zones de chaque coupe, évitez les régions de bordure de l’organe, comme le montre la figure 4, car cela peut introduire du bruit et affecter la fiabilité de la valeur HU calculée de chaque ROI. - Une fois satisfait des ROI conçus, accédez à Navigation, puis sélectionnez Afficher le tableau pour afficher le tableau de quantification contenant les valeurs HU calculées pour chaque ROI.
REMARQUE : Les valeurs d’intérêt sont répertoriées dans la colonne « Moyenne », qui affiche les valeurs moyennes numériques des voxels (HU) inclus dans le ROI. Notez les valeurs qui vous intéressent ou enregistrez l’intégralité de la table en sélectionnant Exporter la table. - Répétez toutes les étapes du fichier DICOM de pré-contraste pour obtenir la luminosité moyenne du foie avant l’injection de produit de contraste. Pour cela, effectuez les étapes 4.4.2-4.4.5 pour le foie uniquement.
- Calculez les valeurs moyennes de HU pour chaque tissu à des points de temps équivalents et insérez les valeurs obtenues dans l’équation ci-dessous :
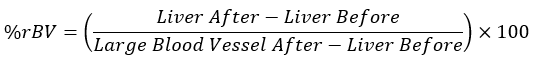
REMARQUE : Un gros vaisseau sanguin après l’injection d’un produit de contraste est considéré comme un rBV à 100 %, et le foie, avant l’administration d’un agent de contraste, est considéré comme un rBV à 0 %.
- Pour effectuer cette analyse, chargez le fichier DICOM de balayage ExiTron et ajustez la barre/le contraste.
- Diamètre de la veine porte
REMARQUE : Pour les mesures du diamètre de la veine porte, les mêmes scintigraphies que celles utilisées pour les mesures de la vBVR hépatique sont analysées comme décrit précédemment35.- Chargez le fichier DICOM de numérisation ExiTron et ajustez la barre/le contraste.
- Repérez les plans transversaux de trois à quatre coupes au-dessus de la jonction des veines mésentérique et splénique supérieures (Figure 5).
- Utilisez l’outil Règle pour mesurer la distance exacte entre deux points (c’est-à-dire le diamètre de la région de la veine circulaire).
REMARQUE : La distance est extraite sur l’image, mais on peut également aller dans Navigation et sélectionner Afficher la table pour afficher la table de quantification contenant la distance calculée ou sélectionner Exporter la table pour enregistrer le résultat.
Résultats
Dans cette étude représentative, l’imagerie micro-TDM sans agent de contraste a indiqué un pourcentage plus élevé de graisse hépatique chez les souris atteintes de NAFLD par rapport aux témoins (tableau 2), confirmant la pathologie. À l’aide de l’agent de contraste ExiTron et de l’analyse de l’architecture et de la densité du réseau vasculaire hépatique décrites ci-dessus, la densité volumique totale du réseau vasculaire hépatique s’est avérée plus élevée chez les souris at...
Discussion
La méthode actuellement recommandée pour le diagnostic et la stadification de la NAFLD chez l’homme est la biopsie hépatique, qui présente un risque de complexités hémorragiques, ainsi que des inexactitudes d’échantillonnage40. Au contraire, dans les modèles animaux, un tel diagnostic est effectué par histologie post-mortem, bien que des protocoles pour la biopsie hépatique survivable soient maintenant disponibles et soient recommandés lorsque la conception de l’étude le permet
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
La figure 1 a été créée avec BioRender.com. Ce travail a été soutenu par la Fondation hellénique pour la recherche et l’innovation (#3222 à A.C.). Anna Hadjihambi est financée par l’Institut Roger Williams d’hépatologie, Fondation pour la recherche sur le foie.
matériels
| Name | Company | Catalog Number | Comments |
| eXIA160 | Binitio Biomedical, Inc. | https://www.binitio.com/?Page=Products | |
| High fat diet with 60% of kilocalories from fat | Research Diets, New Brunswick, NJ, USA | D12492 | |
| High-fructose corn syrup | Best flavors, CA | hfcs-1gallon | |
| Lacrinorm ophthalmic ointment | Bausch & Lomb | ||
| Normal diet with 10% of kilocalories from fat | Research Diets, New Brunswick, NJ, USA | D12450 | |
| Viscover ExiTron nano 12000 | Milteny Biotec, Bergisch Gladbach, Germany | 130-095-698 | |
| VivoQuant | Invicro | ||
| X-CUBE | Molecubes, Belgium | https://www.molecubes.com/systems/ |
Références
- Lazarus, J. V., et al. Advancing the global public health agenda for NAFLD: A consensus statement. Nature Reviews. Gastroenterology & Hepatology. 19 (1), 60-78 (2022).
- Takahashi, Y., Fukusato, T. Histopathology of non-alcoholic fatty liver disease/non-alcoholic steatohepatitis. World Journal of Gastroenterology. 20 (42), 15539-15548 (2014).
- Huang, D. Q., El-Serag, H. B., Loomba, R. Global epidemiology of NAFLD-related HCC: Trends, predictions, risk factors and prevention. Nature Reviews Gastroenterology & Hepatology. 18 (4), 223-238 (2021).
- Niederseer, D., Wernly, B., Aigner, E., Stickel, F., Datz, C. NAFLD and cardiovascular diseases: Epidemiological, mechanistic and therapeutic considerations. Journal of Clinical Medicine. 10 (3), 467 (2021).
- Lefere, S., et al. Differential effects of selective- and pan-PPAR agonists on experimental steatohepatitis and hepatic macrophages. Journal of Hepatology. 73 (4), 757-770 (2020).
- Chrysavgis, L., Papatheodoridi, A. M., Chatzigeorgiou, A., Cholongitas, E. The impact of sodium glucose co-transporter 2 inhibitors on non-alcoholic fatty liver disease.Journal of Gastroenterology and Hepatology. Journal of Gastroenterology and Hepatology. 36 (4), 893-909 (2021).
- Li, M., Qian, M., Xu, J. Vascular endothelial regulation of obesity-associated insulin resistance. Frontiers in Cardiovascular Medicine. 4, 51 (2017).
- Pi, X., Xie, L., Patterson, C. Emerging roles of vascular endothelium in metabolic homeostasis. Circulation Research. 123 (4), 477-494 (2018).
- Chiu, J. J., Chien, S. Effects of disturbed flow on vascular endothelium: Pathophysiological basis and clinical perspectives. Physiological Reviews. 91 (1), 327-387 (2011).
- Koyama, Y., Brenner, D. A. Liver inflammation and fibrosis. The Journal of Clinical Investigation. 127 (1), 55-64 (2017).
- Nasiri-Ansari, N., et al. Endothelial cell dysfunction and non-alcoholic fatty liver disease (NAFLD): A concise review. Cells. 11 (16), 2511 (2022).
- Lefere, S., et al. Angiopoietin-2 promotes pathological angiogenesis and is a therapeutic target in murine non-alcoholic fatty liver disease. Hepatology. 69 (3), 1087-1104 (2019).
- Pasarin, M., et al. Insulin resistance and liver microcirculation in a rat model of early NAFLD. Journal of Hepatology. 55 (5), 1095-1102 (2011).
- Hammoutene, A., Rautou, P. E. Role of liver sinusoidal endothelial cells in non-alcoholic fatty liver disease. Journal of Hepatology. 70 (6), 1278-1291 (2019).
- Sun, X., Harris, E. N. New aspects of hepatic endothelial cells in physiology and non-alcoholic fatty liver disease. American Journal of Physiology. Cell Physiology. 318 (6), C1200-C1213 (2020).
- Iwakiri, Y., Shah, V., Rockey, D. C. Vascular pathobiology in chronic liver disease and cirrhosis - current status and future directions. Journal of Hepatology. 61 (4), 912-924 (2014).
- Baffy, G. Origins of portal hypertension in non-alcoholic fatty liver disease. Digestive Diseases and Sciences. 63 (3), 563-576 (2018).
- Ruhli, F. J., Kuhn, G., Evison, R., Muller, R., Schultz, M. Diagnostic value of micro-CT in comparison with histology in the qualitative assessment of historical human skull bone pathologies. American Journal of Physical Anthropology. 133 (4), 1099-1111 (2007).
- Rodt, T., et al. Micro-computed tomography of pulmonary fibrosis in mice induced by adenoviral gene transfer of biologically active transforming growth factor-beta1. Respiratory Research. 11 (1), 181 (2010).
- Deng, L., Xiao, S. M., Qiang, J. W., Li, Y. A., Zhang, Y. Early lung adenocarcinoma in mice: Micro-computed tomography manifestations and correlation with pathology. Translational Oncology. 10 (3), 311-317 (2017).
- Feng, J., et al. Abnormalities in the enamel in bmp2-deficient mice. Cells, Tissues, Organs. 194 (2-4), 216-221 (2011).
- Kagadis, G. C., Loudos, G., Katsanos, K., Langer, S. G., Nikiforidis, G. C. In vivo small animal imaging: current status and future prospects. Medical Physics. 37 (12), 6421-6442 (2010).
- Starosolski, Z., et al. Ultra high-resolution in vivo computed tomography imaging of mouse cerebrovasculature using a long circulating blood pool contrast agent. Scientific Reports. 5, 10178 (2015).
- Caussy, C., Reeder, S. B., Sirlin, C. B., Noninvasive Loomba, R. quantitative assessment of liver fat by MRI-PDFF as an endpoint in NASH trials. Hepatology. 68 (2), 763-772 (2018).
- Lubura, M., et al. Non-invasive quantification of white and brown adipose tissues and liver fat content by computed tomography in mice. PLoS One. 7 (5), e37026 (2012).
- Perciedu Sert, N., et al. The ARRIVE guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biology. 18 (7), e3000410 (2020).
- Tetri, L. H., Basaranoglu, M., Brunt, E. M., Yerian, L. M., Neuschwander-Tetri, B. A. Severe NAFLD with hepatic necroinflammatory changes in mice fed trans fats and a high-fructose corn syrup equivalent. American Journal of Physiology. Gastrointestinal and Liver Physiology. 295 (5), G987-G995 (2008).
- Machado, M. V., et al. Mouse models of diet-induced non-alcoholic steatohepatitis reproduce the heterogeneity of the human disease. PLoS One. 10 (5), 0127991 (2015).
- Jensen, T., et al. Fructose and sugar: A major mediator of non-alcoholic fatty liver disease. Journal of Hepatology. 68 (5), 1063-1075 (2018).
- Nevzorova, Y. A., Boyer-Diaz, Z., Cubero, F. J., Gracia-Sancho, J. Animal models for liver disease - A practical approach for translational research. Journal of Hepatology. 73 (2), 423-440 (2020).
- De Rudder, M., et al. Automated computerized image analysis for the user-independent evaluation of disease severity in preclinical models of NAFLD/NASH. Laboratory Investigation. 100 (1), 147-160 (2020).
- Willekens, I., et al. Time-course of contrast enhancement in spleen and liver with Exia 160, Fenestra LC, and VC. Molecular Imaging and Biology. 11 (2), 128-135 (2009).
- Das, N. M., et al. In vivo quantitative microcomputed tomographic analysis of vasculature and organs in a normal and diseased mouse model. PLoS One. 11 (2), e0150085 (2016).
- Ehling, J., et al. CCL2-dependent infiltrating macrophages promote angiogenesis in progressive liver fibrosis. Gut. 63 (12), 1960-1971 (2014).
- Zhang, J., et al. Gamna-Gandy bodies of the spleen detected with susceptibility weighted imaging: maybe a new potential non-invasive marker of esophageal varices. PLoS One. 8 (1), e55626 (2013).
- Chen, Y., Li, J., Zhou, Q., Lyu, G., Li, S. Detection of liver and spleen stiffness in rats with portal hypertension by two-dimensional shear wave elastography. BMC Medical Imaging. 22 (1), 68 (2022).
- Lessa, A. S., et al. Ultrasound imaging in an experimental model of fatty liver disease and cirrhosis in rats. BMC Veterinary Research. 6, 6 (2010).
- Abikhzer, G., Alabed, Y. Z., Azoulay, L., Assayag, J., Rush, C. Altered hepatic metabolic activity in patients with hepatic steatosis on FDG PET/CT. AJR. American Journal of Roentgenology. 196 (1), 176-180 (2011).
- Newman, E. M., Rowland, A. A physiologically based pharmacokinetic model to predict the impact of metabolic changes associated with metabolic associated fatty liver disease on drug exposure. International Journal of Molecular Sciences. 23 (19), 11751 (2022).
- Tsai, E., Lee, T. P. Diagnosis and evaluation of non-alcoholic fatty liver disease/non-alcoholic steatohepatitis, including noninvasive biomarkers and transient elastography. Clinics in Liver Disease. 22 (1), 73-92 (2018).
- Oldham, S., Rivera, C., Boland, M. L., Trevaskis, J. L. Incorporation of a survivable liver biopsy procedure in mice to assess non-alcoholic steatohepatitis (NASH) resolution. Journal of Visualized Experiments. 146, e59130 (2019).
- Boll, H., et al. Comparison of Fenestra LC, ExiTron nano 6000, and ExiTron nano 12000 for micro-CT imaging of liver and spleen in mice. Academic Radiology. 20 (9), 1137-1143 (2013).
- Ashton, J. R., West, J. L., Badea, C. T. In vivo small animal micro-CT using nanoparticle contrast agents. Frontiers in Pharmacology. 6, 256 (2015).
- Rothe, J. H., et al. Time course of contrast enhancement by micro-CT with dedicated contrast agents in normal mice and mice with hepatocellular carcinoma: Comparison of one iodinated and two nanoparticle-based agents. Academic Radiology. 22 (2), 169-178 (2015).
- Toczek, J., et al. Computed tomography imaging of macrophage phagocytic activity in abdominal aortic aneurysm. Theranostics. 11 (12), 5876-5888 (2021).
- Mannheim, J. G., et al. Comparison of small animal CT contrast agents. Contrast Media & Molecular Imaging. 11 (4), 272-284 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon