Methods Article
小鼠肠隐窝和单个干细胞的类器官的3D培养用于类器官研究
摘要
我们描述了一种从隐窝中分离小鼠小肠隐窝和培养肠道3D类器官的方案。此外,我们描述了一种在没有上皮下细胞生态位的情况下从单个肠道干细胞生成类器官的方法。
摘要
目前,类器官培养是 体外 研究不同生物学方面和不同器官疾病的重要工具。小鼠小肠隐窝在3D细胞外基质中培养时可以形成类器官,模仿肠上皮。类器官由实现各种肠道稳态功能的所有细胞类型组成。这些包括潘氏细胞、肠内分泌细胞、肠细胞、杯状细胞和簇状细胞。将表征良好的分子添加到培养基中以富集含有G蛋白偶联受体5的富含亮氨酸的重复标记的肠道干细胞(ISC),并用于驱动特定谱系的分化;这些分子包括表皮生长因子,Noggin(一种骨形态发生蛋白)和R-spondin 1。此外,还详细介绍了从单个产生促红细胞生成素的肝细胞受体 B2 (EphB2) 阳性 ISC 生成类器官的方案。在这种方法的文章中,描述了从组织中分离小肠隐窝和单个ISC并确保类器官有效建立的技术。
引言
肠道类器官于2009年首次建立,鉴于其与成熟组织的形态和功能相似性,已成为研究肠道生物学的强大体外工具。最近,源自成体组织干细胞的培养类器官的技术进步使得具有自我更新和分化潜力的肠道干细胞(ISC)的长期培养成为可能。这些类器官已被广泛用于胃肠道生理学和病理生理学的基础和转化研究1,2,3,4,5,6。Clevers小组开发的3D类器官为研究肠上皮提供了强大的工具,提高了生理相关性7。由于肠道类器官来源于组织干细胞,由多种细胞类型组成,因此它们概括了肠上皮的功能。值得注意的是,单分选富含亮氨酸的重复序列含有G蛋白偶联受体5阳性(Lgr5+)的干细胞也可以产生没有任何Paneth细胞或ISC生态位(例如上皮生态位或基质生态位)的3D类器官7。然而,与隐窝和ISC-Paneth细胞双联8相比,单分选Lgr5+细胞的类器官形成能力较低。
越来越多的研究表明,乙二胺四乙酸(EDTA)孵育或胶原酶解离的方法会导致上皮松动和隐窝释放。由于酶解离可能对隐窝的细胞状态有影响,因此通常使用机械分离方法来解离组织。虽然机械消化是一种快速技术,但这种方法可能与不一致的隐窝产量或细胞活力差有关9。因此,EDTA处理和机械解离可以结合起来,产生更好的隐窝产量。本文所示方法的一个特点是在EDTA螯合10后对组织碎片进行剧烈摇动。剧烈摇动允许从小肠中的隐窝绒毛复合物中有效地分离隐窝。手动摇晃的程度决定了分离。因此,从复合体中获得隐窝对于该领域的实验者很重要。此外,适当的技能可以将绒毛污染减少到最低限度,并增加隐窝的数量。
因此,该实验方案采用小鼠来源的小肠类器官,可以在用EDTA处理后更好地分离具有物理力的隐窝进行解离。已知产促红细胞生成素肝细胞受体B2(EphB2)的表达模式部分反映了隐窝环境。例如,EphB2阳性细胞从下到上11个组织。基于EphB2表达进行荧光激活细胞分选(FACS),将获得的细胞分为4组:EphB2高、EphB2中、EphB2低和EphB2阴性。然后,证明了野生型(WT)小鼠中单分选EphB2高细胞的类器官生长。
研究方案
所有小鼠实验均由三得利动物伦理委员会(APRV000561)批准,所有动物均按照委员会关于实验动物护理和使用指南进行维护。使用 肌肉肌肉的标准 WT菌株(C57BL6 / J)。使用10周至20周龄的雄性和雌性小鼠。用CO2 窒息对小鼠实施安乐死。
1.小肠隔离
- 用实验室剪刀切除小肠,包括十二指肠和空肠近半部分。
- 将组织转移到培养皿中,并在5mL注射器中用5mL冷PBS-ABx(PBS +青霉素 - 链霉素[1%] + 庆大霉素[0.5%])冲洗小肠以清除管腔内容物。
- 用实验室剪刀纵向切开组织,并在摇晃时用冷PBS-ABx手动清洗。
注意:通过用载玻片刮掉绒毛,可以减少绒毛污染12. - 使用实验室剪刀收集大约 5 mm x 5 mm 的肠段碎片。将片段转移到带镊子的 50 mL 管中,并加入 25 mL 冷 PBS-ABx。
- 用 25 mL 冷 PBS-ABx 来回搅拌 10 次以去除 50 mL 管中的肠道内容物,从而洗涤碎片。
2. 隐窝隔离
- 将碎片在含有2mM EDTA的PBS-ABx中在冰上孵育30分钟,不摇晃。
- 为了便于细胞外基质(ECM)固化,事先在37°C组织培养箱中孵育24孔板。
- 用真空泵从细胞培养系统中吸出EDTA溶液,加入25mL新鲜,冷的PBS-ABx,然后用手用力上下摇动30x-40x以释放隐窝绒毛复合物。
注意:分离的隐窝和绒毛可以通过在4倍放大镜下对悬浮液中的25μL液滴进行显微镜观察来检查。 - 接下来,通过70μm过滤器过滤悬浮液一次。
- 在4°C下以390× g 离心悬浮液3分钟。
- 用移液将隐窝沉淀重悬于20 mL山梨醇DMEM(高级DMEM / F12 +青霉素 - 链霉素[1%]+庆大霉素[0.5%]+胎牛血清[1%]+山梨糖醇[2%])中,并将隐窝悬浮液转移到两个新的15 mL管中,分成两个10 mL溶液以低速离心。
注意:可以使用低速离心分离大细胞团和细胞/碎片。大细胞团在沉淀中,细胞/碎片在上清液中。 - 在4°C下以80× g 离心两个隐窝悬浮液3分钟,然后轻轻吸出上清液。
注意:由于颗粒形成较弱,因此不要吸气太多。在每个试管中留下 2 mL 上清液。 - 再次向每个试管中加入 10 mL 山梨糖醇 DMEM。将悬浮液在4°C下以80× g 离心3分钟。
- 吸出上清液后,在每个管中留下2mL上清液,加入10mL山梨醇DMEM用于重悬,并在4°C下以80× g 离心隐窝悬浮液最后3分钟。
- 吸出上清液后,在每个管中留下2mL上清液,加入10mL完全DMEM(高级DMEM / F12 +青霉素 - 链霉素[1%]+庆大霉素[0.5%] +胎牛血清[1%])通过上下移液重悬沉淀,并放置1分钟。
注意:等待1分钟以有效地获得浮动地穴。 - 1分钟后,收集每个10mL悬浮液,总共20mL,并用70μm细胞过滤器过滤一次以纯化隐窝。
- 在接种基本上纯的隐窝之前,计算过滤后的完全DMEM中的隐窝数量,然后在4°C下以290× g 离心3分钟。
- 将 25 μL 液滴滴入 6 cm 培养皿中的三个点。在显微镜下以 4 倍放大倍率计算隐窝的数量,并计算每 25 μL 液滴的隐窝浓度。
- 用每孔 40 μL ECM 悬浮 100 个隐窝。上下移液5x-10x以获得ECM中隐窝的均匀悬浮液,然后在37°C预热的24孔板中接种。
注意:始终将ECM放在冰上以避免聚合。小心移液以避免在ECM中产生气泡。 - 将24孔板在37°C,5%CO2 培养箱中孵育15分钟,用于ECM的聚合。
- 最后,在室温下用含有小鼠表皮生长因子 (EGF)、重组小鼠 R-spondin 1 和重组小鼠 Noggin 的 500 μL 培养基覆盖 ECM。每孔材料的最终浓度如下:青霉素-链霉素(1%),每个50 U/mL;庆大霉素(0.5%),25微克/毫升;EGF, 20 纳克/毫升;诺金,100纳克/毫升;R-斯庞丁 1,500 纳克/毫升;L-谷氨酰胺,2毫米。
- 在5%CO2 培养箱中于37°C开始地穴培养。
注意:对于24孔板中类器官的培养基,请参见 表1。 - 使用配备每3小时20倍物镜的记录延时图像显微镜进行长期实时成像以观察类器官形态发生,最长可达7天。以 1 μm(1 μm x 5 步)的 z 步长获取连续 z 堆叠图像。
- 每隔一天更换一次培养基。
3. 荧光激活细胞分选 (FACS)
- 从小鼠中分离隐窝(见第2节)。
- 用2mL胰蛋白酶在37°C下处理分离的隐窝30分钟。
- 用10mL PBS停止反应,然后通过20μm细胞过滤器。
- 将溶液在4°C下以390× g 离心3分钟,并用100μL完全DMEM重悬。
- 加入抗EphB2 APC偶联抗体(1/50),并在冰上孵育30分钟。
- 用PBS洗涤细胞3次,最后加入7-氨基放线菌素D(7-AAD)(1/100)。
- 通过 FACS 对 染色细胞进行分选。
- 调整面积比例因子,并根据像元大小(前向散射,FSC-A)与粒度(侧向散射,SSC-A)进行排序。
- 使用波长为 488 nm 和 50 mV 功率的激光对 7-AAD 阴性和阳性细胞进行活力分类。
- 划定门以对EphB2高(EphB2高),EphB2中(EphB2med),EphB2低(EphB2低)和EphB2阴性(EphB2负)细胞进行分类,激光设置为640 nm波长和100 mV功率。
- 在5%CO2培养箱中于37°C开始EphB2高细胞培养。
4. 单细胞培养类器官
- 根据分级的EphB2表面水平11进行细胞分离方法,然后获得四个不同的群体(高,中,低和阴性)。
- 收集,在4°C下以390× g 离心3分钟沉淀,并通过移液将单分选的EphB2高 细胞嵌入ECM中,然后接种在24孔板上(100单线管/ 40μLECM /孔)。
- 如步骤2.14所示,让ECM聚合,并在前2天用含有Rho相关激酶(ROCK)抑制剂(10μM)的培养基覆盖ECM,以维持EphB2高 细胞。
注意:ROCK抑制剂对肛门虫有效。 - 使用倒置显微镜在40倍放大倍率下手动检查细胞,并观察具有球状体形成和隐窝突出的活类器官。
结果
为了产生小鼠小肠类器官,可以使用EDTA处理和机械分离方法的组合来有效地分离隐窝10,13。这项研究的结果表明,几乎所有孤立的隐窝在从上皮壁龛中挤出后立即被密封并呈现锥形(图1A)。为了尽量减少绒毛污染,将所得悬浮液通过70μm细胞过滤器,然后离心滤液。由于一些隐窝在过滤和悬浮过程中被破坏,因此应仔细执行这些步骤。结果表明,最终部分的几乎所有隐窝都是整合的,适合用于培养(图1B)。为了单独可视化所有铺板的地穴,每孔镀100个地穴(图1C)。加入特定的隐窝培养基(图1D)后,每天用显微镜监测类器官的发育。此外,通过延时图像观察来自隐窝的类器官生长,以监测其发育(图1E和补充视频S1)。培养的地穴以刻板的方式行事。类器官的内腔充满了大量凋亡细胞。ISC的活跃增殖和分化发生在有出芽的隐窝区域(图1E和补充视频S1)。出芽与ISC迁移和增殖以及Paneth细胞分化相结合。分化的潘氏细胞始终位于出芽位点(补充图S1)。由于使用倒置显微镜在10倍放大镜下确认类器官在培养物中是稳定的,因此该技术可用于检查发育中的小肠中的隐窝形成,并确定组织再生能力和ISC长期存活率,以产生新的肠上皮细胞14,15,16。
Lgr5被定义为ISC标志物,小鼠Lgr5+ 细胞形成3D类器官7。然而,由于LGR5蛋白的细胞表面丰度低,并且缺乏高亲和力的抗LGR5抗体,因此通过FACS有效分离鼠ISC具有挑战性。EphB2先前已被确定为从肠道组织中纯化小鼠和人类ISC的表面标志物17,18。EphB2的表达模式增加了ISC标志物的复杂性。EphB2阳性细胞在整个增殖区室中组织,在隐窝底部达到峰值,而它们在隐窝顶部以梯度减小11。潘氏细胞和祖细胞也位于隐窝。潘氏细胞主要表达其定位所需的EphB3,隐窝中它们上方的祖细胞主要表达EphB2。因此,在使用抗EphB2抗体进行ISC纯化过程中,两种细胞类型的污染都可能发生。因此,应评估其标记基因表达和通过FACS使用EphB2分离的细胞的类器官形成能力。
基于这些事实,使用FACS分析,可以从WT隐窝19中分离出EphB2表面标记的细胞。已经研究了EphB2表达是否可以区分具有特定标记表达的四组,例如ISC特异性标记基因(Lgr5,Ascl2和Olfm4)和祖细胞特异性标记基因(Ki67,Myc和FoxM1)。该实验表明,与EphB2医学细胞20,21不同,EphB2高细胞主要是ISC。最后,基于细胞分离方法,将获得的细胞分为四组(EphB2高,EphB2中,EphB2低和EphB2阴性细胞)(图2)。然后,通过FACS分选表达高水平EphB2的单细胞进行类器官生长培养。单个EphB2高细胞可以独立地应用于局部治疗,并重建让人联想到正常小肠的自组织隐绒结构(图3)。然而,来自其他组(EphB2med,EphB2low和EphB2neg)的细胞不会产生类器官20。
在之前的一项研究中,~6%的单分选Lgr5-GFPhi 细胞能够启动隐绒毛类器官7。然而,剩余的细胞无法产生类器官并在前12小时内死亡7。提交人推测,这是隔离程序固有的身体和/或生物压力的结果7。从WT小鼠的单分选EphB2高 细胞中获得的类器官生长也少于6%。到培养的第5天,形成球状结构(图3)。从第7天到第9天,发生了斑点的阴道形成隐窝(图3)。重要的是,将选定的ROCK抑制剂应用于单分选的EphB2高 细胞可减少解离诱导的细胞凋亡并提高类器官生长的效率。
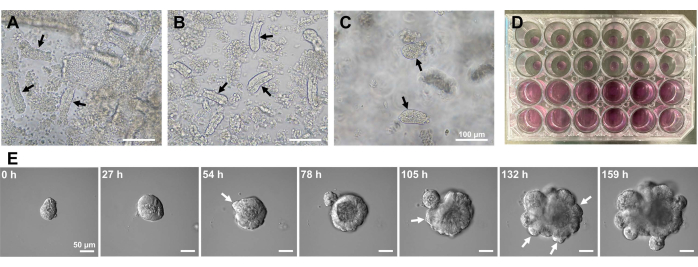
图1:小鼠小肠类器官的产生。 (A)通过EDTA螯合和机械解离组合制备的隐窝。(B)所得净化的地穴。(C)嵌入细胞外基质中的隐窝。(A-C)黑色箭头表示地穴。(D)隐窝和类器官的三维培养。(E)来自地穴的生长类器官的代表性图像。白色箭头表示地穴萌芽。比例尺 = (A-C) 100 μm 和 (E) 50 μm。 请点击此处查看此图的大图。
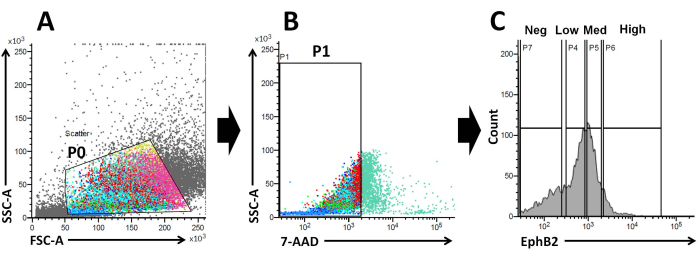
图 2:流式细胞术门控策略,以获得野生型小鼠中 EphB2 阳性 (EphB2+) 细胞群。 (A)前向散点图和侧向散点图分别用于根据细胞的大小和粒度分离细胞。(B)荧光散射用于根据细胞的7-AAD(PerCP)荧光强度分离活细胞。选择7-AAD阴性细胞群的门。(C)选择EphB2高(EphB2高),EphB2中(EphB2中),EphB2低(EphB2低)和EphB2阴性(EphB2阴性)细胞群的门。缩写:FSC-A = 前向散射峰面积;SSC-A = 侧散射峰面积;7-AAD = 7-氨基放线菌素 D. 请点击此处查看此图的大图。
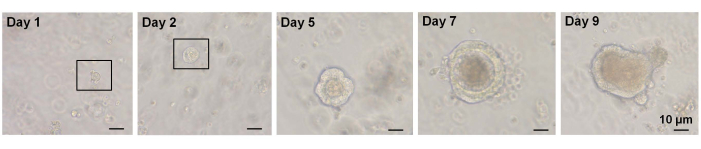
图3:野生型小鼠中单分选EphB2高 细胞类器官生长的时间过程。 请点击此处查看此图的大图。
表1:24孔板的培养基。请按此下载此表格。
补充视频S1:生长中的类器官的延时图像。 比例尺 = 50 μm。 请点击这里下载此文件。
补充图S1:类器官中抗溶菌酶抗体染色的代表性图像。 白色箭头表示潘氏细胞。缩写:DIC = 微分干涉对比显微镜。比例尺 = 10 μm。 请点击这里下载此文件。
讨论
该协议描述了一种一致分离小肠隐窝和随后培养3D类器官的方法。为提高隐窝释放速率,建立了EDTA处理后剧烈摇晃的机械分离方法。培养基组成与Sato等人的原始方案不同7。原始介质相对昂贵。因此,含有药理抑制剂、重组生长因子和/或条件培养基的小鼠小肠类器官的培养基和定制培养基如 表1所示。Wnt3A和 N-乙酰半胱氨酸不包括在本协议的培养基中。当Paneth细胞表达Wnt3时,细胞产生Wnt3并支持ISC维持。此外,在隐窝隔离过程中,不使用条件培养基。类器官模型是动态的,具有细胞和结构异质性(潘氏细胞、肠细胞、杯状细胞、肠内分泌细胞、簇状细胞和 ISC)。因此,这些类器官可以大规模用于研究类器官生物学的基本问题。
EphB2梯度维持成人小肠中沿隐窝绒毛轴的ISC干性和增殖18。与分离的隐窝相比,从单个EphB2细胞制造类器官的优势与了解小鼠ISC的生物学有关,因为ISC在各种人类肠道疾病中起着关键作用。单个EphB2高表达ISC可以培养以形成类器官,其方式类似于从单个表达Lgr5的ISC开发类器官。最重要的一步是使用FACS根据隐窝中的EphB2表达将细胞精确地分为四组(EphB2高,EphB2中,EphB2低和EphB2阴性)。前向散射与侧向散射(FSC 与 SSC)图通常用于根据其大小和粒度识别感兴趣的细胞。FSC 表示单元大小,SSC 与 P0 门中单元的复杂性或粒度相关(图 2A)。在这项工作中,随后分析了落在定义门(P0)内的细胞的活力。接下来,根据7-AAD荧光信号的阴性和阳性群体确定其活力。严格决定7-AAD阴性和阳性细胞之间的边界,以获得阴性细胞,并将阳性细胞污染降至最低。EphB2门大致基于EphB2分级表达式设置。
为了确认这四个组被精确划分,分析了所选基因的mRNA表达。ISC标志物的mRNA水平在EphB2高细胞20中很高。此外,祖细胞特异性标记物的mRNA水平在EphB2医学细胞20中相对较高。然而,与EphB2高和EphB2医疗细胞2相比,EphB2低和EphB2阴性细胞中的EphB2抑制较低或为负20。应采取上述措施,以确保在铺板前富集EphB2高细胞群。然而,EphB2高细胞的类器官生长小于6%可能是由于培养过程中干细胞的死亡,而不是隐窝分离期间的剧烈摇晃。已经表明,将选择性Rho相关激酶(ROCK)抑制剂应用于人类胚胎干细胞可显着减少解离诱导的细胞凋亡22。因此,作为技术变化,值得尝试以更高的浓度和更长的孵育时间添加ROCK抑制剂以提高活性。
ISC旁边的Wnt3A分泌Paneth细胞为ISC提供必要的支持8。事实上,与单个ISC相比,ISC-Paneth细胞双联体显示出强烈增加的类器官形成能力8。此外,在培养的前 3 天添加浓度为 100 ng/mL 的 Wnt3A 已被证明可以增加类器官形成能力8。因此,作为另一项技术变化,添加外源性Wnt3A可以提高单个EphB2高表达ISC的类器官形成能力。
与 体内 方法相比,类器官可以很容易地用于遗传操作、恶性肿瘤表型分析和药物筛选20,23。EDTA螯合法和机械分离方法的组合对于从隐窝中创建小肠类器官是有效、可重复和省时的,并且没有任何高级经验的实验室工作人员可以很容易地遵循。因此,在EDTA处理后加入剧烈振荡的机械分离可以有效地在 体外建立 小鼠小肠类器官,并为其他成人上皮组织的类器官培养和疾病建模提供潜在的工具。
肠上皮细胞极化并定向,顶端侧朝向管腔。然而,面向3D类器官腔的顶端一侧位于其内部。因此,这种组织阻止了对顶端的访问,这在研究管腔成分(如营养物质、微生物和代谢物)对上皮细胞的影响时是一个问题。为了规避这一缺点,已经开发出将类器官细胞培养为2D单层24。就未来的应用而言,将利用类器官细胞单层的培养,因为这代表了最有效和最容易处理的系统。
披露声明
作者没有利益冲突需要声明。
致谢
这项工作得到了T.T.科学研究补助金(C)的支持(资助号JP17K07495和JP20K06751)。我们感谢峰子健学教授使用设备进行长期延时成像(LCV100;奥林巴斯)。
材料
| Name | Company | Catalog Number | Comments |
| 1.5 mL Eppendorf tube | Eppendorf | 0030 125.215 | |
| 5 mL syringe | TERUMO | SS-05SZ | |
| 15 mL Falcon tube | Iwaki | 2325-015 | |
| 20 μm cell strainer | Sysmex | 04-004-2325 | |
| 24-well plate | Iwaki | 3820-024 | |
| 50 mL Falcon tube | Iwaki | 2345-050 | |
| 60 mm tissue culture dish | FALCON | 353002 | |
| 70 μm cell strainer | Falcon | 352350 | |
| 100 mm Petri dish | Iwaki | 3020-100 | |
| 7-AAD | BD Biosciences | 559925 | |
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| Alexa Fluor 568 Goat Anti-Mouse IgG (H+L) | Invitrogen | A-11004 | |
| Anti-EphB2 APC-conjugated antibody | BD Biosciences | 564699 | |
| C57BL6/J mice | Japan SLC, Inc. | ||
| Clean bench | HITACHI | CCV-1306E | |
| Confocal laser scanning microscope | Olympus | FV3000 | |
| EDTA (0.5 mol/L) | Nacalai Tesque | 06894-14 | 2 mM |
| FACSMelody | BD Life Sciences-Biosciences | 661762 | |
| Fetal bovine serum | Sigma | 173012 | 1% (v/v) |
| Fiji (software) | https://fiji.sc/ | ||
| Gentamicin (10 mg/mL) | Nacalai Tesque | 16672-04 | 25 μg/mL |
| Hammacher laboratory scissor | SANSYO | 91-1538 | |
| Incubator | Panasonic | MCO-170-PJ | |
| Laboratory tweezer | AS-ONE | 7-164-04 | |
| L-Glutamine 200 mM | Gibco | 25030081 | 2 mM |
| Matrigel | BD Biosciences | 354230 | ECM for 3D organoids |
| Mouse Anti-Human Lysozyme | LSBio | LS-B8704-100 | |
| Murine EGF (20 μg/mL stock solution) | PeproTech | 315-09 | 20 ng/mL |
| PBS 1x | Gibco | 10010-023 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140-122 | 50 U/mL |
| Pipetman (10 μL, 20 μL, 200 μL, and 1,000 μL) | GILSON | 1-6855-12, -13, -15, and -16 | |
| Recombinant murine Noggin (20 μg/mL stock solution | R&D Systems | 1967-NG-025 | 100 ng/mL |
| Recombinant murine R-Spondin 1 (250 μg/mL stock solution) | R&D Systems | 3474-RS-050 | 500 ng/mL |
| Sorbitol | Nacalai Tesque | 32021-95 | 2% (w/v) |
| TE2000-S (inverted microscope) | Nikon | 24131 | |
| Time-lapse image microscope | Olympus | LCV100 | |
| TrypLE Express 1x | Gibco | 12605-010 | |
| ULVAC | ULVAC KIKO Inc. | 100073 | |
| Y-27632 | Fujifilm | 331752-47-7 | 10 μM |
参考文献
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Seidlitz, T., et al. Human gastric cancer modelling using organoids. Gut. 68 (2), 207-217 (2019).
- Nikolaev, M., et al. Homeostatic mini-intestines through scaffold-guided organoid morphogenesis. Nature. 585 (7826), 574-578 (2020).
- Artegiani, B., Clevers, H. Use and application of 3D-organoid technology. Human Molecular Genetics. 27, R99-R107 (2018).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Dedhia, P. H., Bertaux-Skeirik, N., Zavros, Y., Spence, J. R. Organoid models of human gastrointestinal development and disease. Gastroenterology. 150 (5), 1098-1112 (2016).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts. Nature. 469 (7330), 415-418 (2011).
- Aronowitz, J. A., Lockhart, R. A., Hakakian, C. S. Mechanical versus enzymatic isolation of stromal vascular fraction cells from adipose tissue. Springerplus. 4 (1), 713 (2015).
- Takahashi, T. New trends and perspectives in the function of non-neuronal acetylcholine in crypt-villus organoids in mice. Methods in Molecular Biology. 1576, 145-155 (2019).
- Batlle, E., et al. β-catenin and TCF mediate cell positioning in the intestinal epithelium by controlling the expression of EphB/ephrinB. Cell. 111 (2), 251-263 (2002).
- Baghdadi, M. B., Kim, T. -. H. Analysis of mouse intestinal organoid culture with conditioned media isolated from mucosal enteric glial cells. STAR Protocols. 3 (2), 101351 (2022).
- Takahashi, T., et al. Non-neuronal acetylcholine as an endogenous regulator of proliferation and differentiation of Lgr5-positive stem cells in mice. FEBS Journal. 281 (20), 4672-4690 (2014).
- Barker, N. Adult intestinal stem cells: Critical drivers of epithelial homeostasis and regeneration. Nature Reviews Molecular Cell Biology. 15 (1), 19-33 (2014).
- Fordham, R. P., et al. Transplantation of expanded fetal intestinal progenitors contributes to colon regeneration after injury. Cell Stem Cell. 13 (6), 734-744 (2013).
- Miyoshi, H., et al. Wnt5a potentiates TGF-β signaling to promote colonic crypt regeneration after tissue injury. Science. 338 (6103), 108-113 (2012).
- Jung, P., et al. Isolation and in vitro expansion of human colonic stem cells. NatureMedicine. 17 (10), 1225-1227 (2011).
- Merlos-Suárez, A., et al. The intestinal stem cell signature identifies colorectal cancer stem cells and predicts disease relapse. Cell Stem Cell. 8 (5), 511-524 (2011).
- Mao, W., et al. EphB2 as a therapeutic antibody drug target for the treatment of colorectal cancer. Cancer Research. 64 (3), 781-788 (2004).
- Takahashi, T., et al. Muscarinic receptor M3 contributes to intestinal stem cell maintenance via EphB/ephrin-B signaling. Life Science Alliance. 4 (9), e202000962 (2021).
- Jung, P., et al. Isolation of human colon stem cells using surface expression of PTK7. Stem Cell Reports. 5 (6), 979-987 (2015).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Schulte, L., Hohwieler, M., Müller, M., Klaus, J. Intestinal organoids as a novel complementary model to dissect inflammatory bowel disease. Stem Cells International. 2019, 8010645 (2019).
- Puzan, M., Hosic, S., Ghio, C., Koppes, A. Enteric nervous system regulation of intestinal stem cell differentiation and epithelial monolayer function. Scientific Reports. 8 (1), 6313 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。