Methods Article
La coltura 3D di organoidi da cripte intestinali murine e una singola cellula staminale per la ricerca sugli organoidi
In questo articolo
Riepilogo
Descriviamo un protocollo per isolare le piccole cripte intestinali murine e la coltura di organoidi 3D intestinali dalle cripte. Inoltre, descriviamo un metodo per generare organoidi da una singola cellula staminale intestinale in assenza di una nicchia cellulare sub-epiteliale.
Abstract
Attualmente, la coltura organoide rappresenta uno strumento importante per studi in vitro di diversi aspetti biologici e malattie in diversi organi. Le piccole cripte intestinali murine possono formare organoidi che imitano l'epitelio intestinale quando coltivate in una matrice extracellulare 3D. Gli organoidi sono composti da tutti i tipi di cellule che svolgono varie funzioni omeostatiche intestinali. Questi includono cellule di Paneth, cellule enteroendocrine, enterociti, cellule caliciformi e cellule ciuffo. Molecole ben caratterizzate vengono aggiunte nel terreno di coltura per arricchire le cellule staminali intestinali (ISC) marcate con ripetizioni ricche di leucina contenenti il recettore 5 accoppiato alla proteina G e vengono utilizzate per guidare la differenziazione verso il basso linee specifiche; queste molecole includono il fattore di crescita epidermico, Noggin (una proteina morfogenetica ossea) e R-spondina 1. Inoltre, è anche dettagliato un protocollo per generare organoidi da un singolo ISC positivo al recettore epatocellulare B2 (EphB2) produttore di eritropoietina. In questo articolo sui metodi sono descritte le tecniche per isolare le piccole cripte intestinali e un singolo ISC dai tessuti e garantire l'efficiente creazione di organoidi.
Introduzione
Gli organoidi intestinali, che sono stati istituiti per la prima volta nel 2009, sono emersi come un potente strumento in vitro per studiare la biologia intestinale data la loro somiglianza morfologica e funzionale con i tessuti maturi. Recentemente, i progressi tecnologici negli organoidi in coltura derivati da cellule staminali dei tessuti adulti hanno permesso la coltura a lungo termine di cellule staminali intestinali (ISC) con potenziale di auto-rinnovamento e differenziazione. Questi organoidi sono stati ampiamente utilizzati per studi di ricerca di base e traslazionali sulla fisiologia gastrointestinale e fisiopatologia 1,2,3,4,5,6. Gli organoidi 3D sviluppati dal gruppo Clevers forniscono un potente strumento per studiare l'epitelio intestinale con una migliore rilevanza fisiologica7. Poiché gli organoidi intestinali derivano da cellule staminali tissutali e sono composti da più tipi di cellule, ricapitolano la funzionalità dell'epitelio intestinale. Da notare che una cellula staminale 5-positiva (Lgr5+) contenente ripetizioni contenenti proteine G può anche generare organoidi 3D senza cellule di Paneth o una nicchia ISC come la nicchia epiteliale o la nicchia stromale7. Tuttavia, la capacità di formare organoidi delle cellule Lgr5+ a singolo ordinamento è bassa rispetto a quelle delledoppiette 8 della cripta e delle cellule ISC-Paneth.
Un numero crescente di studi ha dimostrato che i metodi di incubazione dell'acido etilendiamminotetraacetico (EDTA) o di dissociazione della collagenasi causano allentamento nell'epitelio e il rilascio di cripte. Poiché la dissociazione enzimatica può avere un effetto sullo stato cellulare delle cripte, viene solitamente utilizzato un metodo di isolamento meccanico per dissociare il tessuto. Sebbene la digestione meccanica sia una tecnica rapida, questo metodo può essere associato a rese di cripta incoerenti o scarsa vitalità cellulare9. Pertanto, il trattamento EDTA e la dissociazione meccanica possono essere combinati per generare migliori rese di cripta. Una caratteristica della metodologia mostrata in questo articolo è l'uso di uno scuotimento vigoroso dei frammenti di tessuto dopo chelazione EDTA10. Uno scuotimento vigoroso consente l'isolamento efficiente delle cripte dai complessi crypt-villus nell'intestino tenue. Il grado di scuotimento manuale determina la separazione. Pertanto, ottenere cripte da complessi è importante per gli sperimentatori in questo campo. Inoltre, un'abilità adeguata può ridurre al minimo la contaminazione dei villi e aumentare il numero di cripte.
Quindi, questo protocollo sperimentale, che impiega organoidi intestinali piccoli derivati dalla murina, può isolare meglio le cripte con forza fisica dopo il trattamento con EDTA per la dissociazione. È noto che il pattern di espressione del recettore epatocellulare B2 produttore di eritropoietina (EphB2) riflette in parte l'ambiente della cripta. Ad esempio, le cellule EphB2-positive sono organizzate dal basso verso l'alto11. Il sequenziamento cellulare attivato dalla fluorescenza (FACS) è stato effettuato sulla base dell'espressione di EphB2 e le cellule ottenute sono state divise in quattro gruppi: EphB2high, EphB2med, EphB2low ed EphB2neg. Quindi, è stata dimostrata la crescita organoide da cellulealte di EphB2 a selezione singola in topi wild-type (WT).
Protocollo
Tutti gli esperimenti sui topi sono stati approvati dal Suntory Animal Ethics Committee (APRV000561) e tutti gli animali sono stati mantenuti in conformità con le linee guida del comitato per la cura e l'uso di animali da laboratorio. È stato utilizzato un ceppo WT standard di Mus musculus (C57BL6/J). Sono stati utilizzati topi maschi e femmine da 10 settimane a 20 settimane di età. I topi sono stati sottoposti a eutanasia con asfissia da CO2 .
1. Isolamento dell'intestino tenue
- Asportare l'intestino tenue, compreso il duodeno e la metà prossimale del digiuno, con forbici da laboratorio.
- Trasferire il tessuto in una capsula di Petri e lavare l'intestino tenue con 5 ml di PBS-ABx freddo (PBS + penicillina-streptomicina [1%] + gentamicina [0,5%]) in una siringa da 5 ml per eliminare il contenuto luminale.
- Tagliare il tessuto aperto longitudinalmente con le forbici da laboratorio e lavare manualmente con PBS-ABx freddo mentre si agita.
NOTA: Raschiando i villi con un vetrino, la contaminazione dei villi può essere ridotta12. - Raccogliere circa 5 mm x 5 mm pezzi del segmento intestinale usando forbici da laboratorio. Trasferire i frammenti in un tubo da 50 mL con una pinzetta e aggiungere 25 mL di PBS-ABx freddo.
- Lavare i frammenti agitando avanti e indietro 10 volte con 25 ml di PBS-ABx freddo per rimuovere il contenuto intestinale nel tubo da 50 ml.
2. Isolamento della cripta
- Incubare i pezzi in PBS-ABx contenente 2 mM EDTA per 30 minuti su ghiaccio senza agitazione.
- Per una facile solidificazione della matrice extracellulare (ECM), incubare preventivamente una piastra a 24 pozzetti in un incubatore per colture tissutali a 37 °C.
- Aspirare la soluzione di EDTA dal sistema di coltura cellulare con una pompa per vuoto, aggiungere 25 ml di PBS-ABx fresco e freddo, quindi agitare i pezzi su e giù vigorosamente a mano 30x-40x per rilasciare i complessi crypt-villus.
NOTA: Le cripte e i villi separati possono essere controllati mediante l'osservazione microscopica di una goccia da 25 μL dalla sospensione con ingrandimento 4x. - Quindi, filtrare la sospensione attraverso un filtro da 70 μm una volta.
- Centrifugare la sospensione a 390 × g per 3 minuti a 4 °C.
- Risospendere il pellet criptato in 20 ml di sorbitolo DMEM (DMEM/F12 avanzato + penicillina-streptomicina [1%] + gentamicina [0,5%] + siero fetale bovino [1%] + sorbitolo [2%]) con pipettaggio, e trasferire la sospensione della cripta in due nuove provette da 15 ml per la divisione in due soluzioni da 10 ml per centrifugare a bassa velocità.
NOTA: La grande massa cellulare e le celle/detriti possono essere separati utilizzando la centrifugazione a bassa velocità. La grande massa cellulare è nel pellet e le cellule / detriti sono nel surnatante. - Centrifugare le due sospensioni della cripta a 80 × g per 3 minuti a 4 °C, quindi aspirare delicatamente il surnatante .
NOTA: Poiché la formazione di pellet è debole, non aspirare troppo. Lasciare 2 ml di surnatante in ogni tubo. - Aggiungere nuovamente 10 ml di sorbitolo DMEM a ciascun tubo. Centrifugare la sospensione a 80 × g per 3 minuti a 4 °C.
- Dopo aver aspirato il surnatante, lasciando 2 mL di surnatante in ciascuna provetta, aggiungere 10 mL di sorbitolo DMEM per la sospensione e centrifugare la sospensione della cripta a 80 × g per 3 minuti finali a 4 °C.
- Dopo aver aspirato il surnatante, lasciando 2 ml di surnatante in ciascuna provetta, aggiungere 10 ml di DMEM completo (DMEM avanzato / F12 + penicillina-streptomicina [1%] + gentamicina [0,5%] + siero fetale bovino [1%]) per la risospensione del pellet mediante pipettaggio su e giù, e lasciare agire per 1 minuto.
NOTA: Attendere 1 minuto per ottenere le cripte galleggianti in modo efficiente. - Dopo 1 minuto, raccogliere ogni sospensione da 10 ml per un totale di 20 ml e filtrare una volta con un filtro cellulare da 70 μm per purificare le cripte.
- Prima di seminare cripte essenzialmente pure, contare il numero di cripte nel DMEM completo filtrato e quindi centrifugare a 290 × g per 3 minuti a 4 °C.
- Gocciolare 25 μL di goccioline in un piatto da 6 cm in tre punti. Contare il numero di cripte al microscopio con un ingrandimento 4x e calcolare la concentrazione di cripte per goccia da 25 μL.
- Sospendi 100 cripte con 40 μL di ECM per pozzetto. Pipet su e giù 5x-10x per ottenere una sospensione omogenea delle cripte nell'ECM, quindi seminare in una piastra preriscaldata a 37 °C a 24 pozzetti.
NOTA: Tenere sempre l'ECM sul ghiaccio per evitare la polimerizzazione. Pipettare con attenzione per evitare di formare bolle d'aria nell'ECM. - Incubare la piastra a 24 pozzetti per 15 minuti in un incubatore a 37 °C, 5% CO2 per la polimerizzazione dell'ECM.
- Infine, coprire l'ECM con 500 μL di terreno di coltura contenente il fattore di crescita epidermico di topo (EGF), il topo ricombinante R-spondina 1 e il topo ricombinante Noggin a temperatura ambiente. La concentrazione finale di materiali per pozzetto è la seguente: penicillina-streptomicina (1%), 50 U/mL ciascuno; gentamicina (0,5%), 25 μg/ml; EGF, 20 ng/ml; Noggin, 100 ng/ml; R-spondina 1.500 ng/ml; L-glutammina, 2 mM.
- Avviare la coltura della cripta a 37 °C in un incubatore al 5% di CO2 .
NOTA: Per il terreno di coltura per organoidi in una piastra da 24 pozzetti, vedere la tabella 1. - Eseguire immagini dal vivo a lungo termine per osservare la morfogenesi organoide con un microscopio a immagine time-lapse dotato di un obiettivo 20x ogni 3 ore per un massimo di 7 giorni. Ottenere immagini seriali con stack z a passi z di 1 μm (1 μm x cinque passi).
- Cambia il mezzo a giorni alterni.
3. Selezione cellulare attivata da fluorescenza (FACS)
- Isolare le cripte dai topi (vedere sezione 2).
- Trattare le cripte isolate con 2 ml di tripsina per 30 minuti a 37 °C.
- Interrompere la reazione con 10 ml di PBS, quindi passare attraverso un filtro cellulare da 20 μm.
- Centrifugare la soluzione a 390 × g per 3 minuti a 4 °C e risospendere con 100 μL di DMEM completo.
- Aggiungere l'anticorpo anticoniugato anti-EphB2 APC (1/50) e incubare per 30 minuti su ghiaccio.
- Lavare le cellule 3 volte con PBS e infine aggiungere 7-ammino-actinomicina D (7-AAD) (1/100).
- Ordinare le celle colorate tramite FACS.
- Regolare il fattore di ridimensionamento dell'area e ordinare in base alla dimensione della cella (diffusione diretta, FSC-A) rispetto alla granularità (dispersione laterale, SSC-A).
- Ordinare le celle negative e positive 7-AAD per la vitalità con il laser impostato a una lunghezza d'onda di 488 nm e 50 mV di potenza.
- Demarcare le porte per ordinare le celle EphB2-high (EphB2high), EphB2-medium (EphB2med), EphB2-low (EphB2low) ed EphB2-negative (EphB2neg) con il laser impostato su una lunghezza d'onda di 640 nm e 100 mV di potenza.
- Avviare la colturaad alto contenuto cellulare di EphB2 a 37 °C in un incubatore al 5% di CO2 .
4. Organoidi in coltura unicellulare
- Eseguire il metodo di isolamento cellulare secondo i livelli di superficie graduati EphB211, e quindi ottenere quattro popolazioni distinte (alta, media, bassa e negativa).
- Raccogliere, pellet con centrifugazione a 390 × g per 3 minuti a 4 °C e incorporare le cellealte EphB2 single-sorted nell'ECM mediante pipettaggio, seguito da semina su una piastra a 24 pozzetti (100 singoletti / 40 μL di ECM / pozzetto).
- Come nella fase 2.14, lasciare polimerizzare l'ECM e coprire l'ECM con un terreno di coltura contenente un inibitore della chinasi Rho-associata (ROCK) (10 μM) per i primi 2 giorni per mantenere le cellulealte di EphB2.
NOTA: L'inibitore ROCK è efficace contro l'anoikis. - Ispezionare manualmente le cellule utilizzando un microscopio invertito con ingrandimento 40x e osservare organoidi vitali con formazione di sferoidi e protrusione della cripta.
Risultati
Per generare organoidi intestinali di topo, è possibile utilizzare una combinazione di trattamento EDTA e un metodo di isolamento meccanico per isolare in modo efficiente le cripte10,13. I risultati di questo studio hanno mostrato che quasi tutte le cripte isolate sono state immediatamente sigillate e sono apparse a forma di cono dopo essere state spremute dalle nicchie epiteliali (Figura 1A). Per ridurre al minimo la contaminazione dei villi, la sospensione risultante è stata fatta passare attraverso un filtro cellulare da 70 μm, quindi il filtrato è stato centrifugato. Poiché alcune cripte vengono interrotte durante la filtrazione e la sospensione, questi passaggi devono essere eseguiti con attenzione. I risultati hanno mostrato che quasi tutte le cripte nella frazione finale erano integrate e adatte all'uso in coltura (Figura 1B). Per visualizzare tutte le cripte placcate singolarmente, sono state placcate 100 cripte per pozzo (Figura 1C). Dopo aver aggiunto il terreno di coltura crittografico specifico (Figura 1D), lo sviluppo degli organoidi è stato monitorato quotidianamente con un microscopio. Inoltre, la crescita organoide dalle cripte è stata osservata da immagini time-lapse per monitorare il loro sviluppo (Figura 1E e Video supplementare S1). Le cripte colte si comportavano in modo stereotipato. Il lume interno dell'organoide era pieno di una massa di cellule apoptotiche. La proliferazione attiva e la differenziazione delle ISC si sono verificate nella regione della cripta con gemmazione (Figura 1E e Video supplementare S1). Il germogliamento è stato accoppiato con la migrazione e la proliferazione ISC e la differenziazione delle cellule di Paneth. Le cellule di Paneth differenziate erano sempre situate nel sito di gemmazione (Figura supplementare S1). Poiché gli organoidi sono stati confermati stabili in coltura utilizzando un microscopio invertito con un ingrandimento 10x, la tecnica potrebbe essere utilizzata per esaminare la formazione di cripte nell'intestino tenue in via di sviluppo e per determinare la capacità di rigenerazione dei tessuti e la sopravvivenza ISC a lungo termine per la produzione di nuove cellule epiteliali intestinali14,15,16.
Lgr5 è definito come un marcatore ISC e le cellule Lgr5+ murine formano organoidi 3D7. Tuttavia, poiché l'abbondanza della superficie cellulare della proteina LGR5 è bassa e vi è una mancanza di anticorpi anti-LGR5 ad alta affinità, è difficile isolare in modo efficiente le ISC murine mediante FACS. EphB2 è stato precedentemente identificato come marker di superficie per la purificazione di ISC murine e umane dai tessuti intestinali17,18. Il pattern di espressione di EphB2 aumenta la complessità dei marcatori ISC. Le cellule EphB2-positive sono organizzate in tutto il compartimento proliferativo, raggiungendo il picco nella parte inferiore delle cripte, mentre diminuiscono in un gradiente verso la parte superiore delle cripte11. Anche le cellule di Paneth e le cellule progenitrici sono localizzate nella cripta. Le cellule di Paneth esprimono principalmente EphB3, che è necessario per il loro posizionamento, e le cellule progenitrici sopra di loro nella cripta esprimono principalmente EphB2. Pertanto, la contaminazione di entrambi i tipi di cellule può verificarsi durante il corso della purificazione ISC utilizzando l'anticorpo anti-EphB2. Di conseguenza, devono essere valutate la loro espressione genica marcatrice e la capacità organoide di cellule isolate utilizzando EphB2 mediante FACS.
Sulla base di questi fatti, utilizzando l'analisi FACS, le cellule marcate in superficie EphB2 possono essere isolate dalle cripte WT19. È stato studiato se l'espressione di EphB2 può distinguere tra quattro gruppi con l'espressione di marcatori specifici, come i geni marcatori ISC-specifici (Lgr5, Ascl2 e Olfm4) e i geni marcatori specifici delle cellule progenitrici (Ki67, Myc e FoxM1). Questo esperimento ha dimostrato che le cellulealte di EphB2 erano prevalentemente ISC, a differenza delle cellulemediche EphB220,21. Infine, sulla base del metodo di isolamento cellulare, le cellule ottenute sono state divise in quattro gruppi (EphB2high, EphB2med, EphB2low e EphB2neg cells) (Figura 2). Quindi, singole cellule che esprimono alti livelli di EphB2 ordinati da FACS sono state coltivate per la crescita degli organoidi. Una singola cellulaalta EphB2 può essere applicata indipendentemente per il trattamento localizzato e ricreare strutture cripto-villose auto-organizzanti che ricordano il normale intestino tenue (Figura 3). Tuttavia, le cellule derivate da altri gruppi (EphB2med, EphB2low ed EphB2neg) non generano organoidi20.
In uno studio precedente, ~ 6%delle cellule Lgr5-GFP hi single-sorted sono state in grado di avviare organoidi cripta-villosi7. Tuttavia, le cellule rimanenti non sono state in grado di generare organoidi e sono morte entro le prime 12 ore7. Gli autori presumevano che questo fosse il risultato di stress fisico e/o biologico inerente alla procedura di isolamento7. Meno del 6% di crescita organoide è stata ottenuta anche da cellulealte di EphB2 single-sorted nei topi WT. Entro il giorno 5 della cultura, si formarono strutture simili a sferoidi (Figura 3). Dal giorno 7 al giorno 9, si è verificata l'evaginazione delle macchie per formare cripte (Figura 3). È importante sottolineare che l'applicazione di un inibitore ROCK selezionato alle cellulealte EphB2 single-sorted ha diminuito l'apoptosi indotta dalla dissociazione e aumentato l'efficienza della crescita organoide.
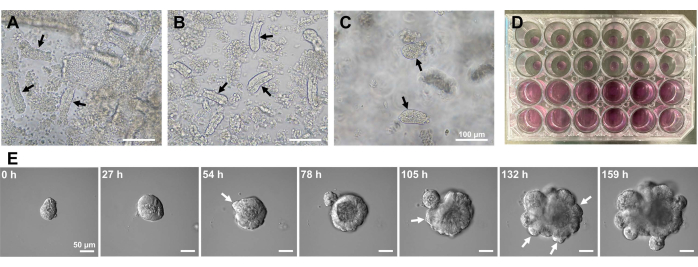
Figura 1: Generazione di organoidi intestinali del topo. (A) Cripte preparate mediante una combinazione di chelazione con EDTA e dissociazione meccanica. (B) Cripte purificate risultanti. (C) Cripte incorporate nella matrice extracellulare. (A-C) Le frecce nere indicano le cripte. (D) Coltura tridimensionale di cripte e organoidi. (E) Immagini rappresentative di un organoide in crescita derivato da una cripta. Le frecce bianche indicano il germogliamento della cripta. Barre di scala = (A-C) 100 μm e (E) 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
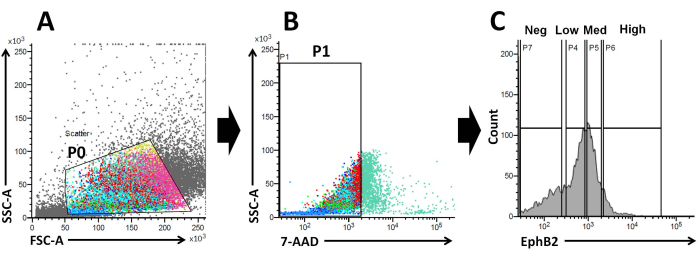
Figura 2: Strategia di gating della citometria a flusso per ottenere una popolazione di cellule EphB2-positive (EphB2+) in topi wild-type. (A) I grafici a dispersione in avanti e laterali sono utilizzati per separare le celle in base alle loro dimensioni e granularità, rispettivamente. (B) La dispersione di fluorescenza viene utilizzata per separare le cellule vitali in base all'intensità di fluorescenza 7-AAD (PerCP) delle cellule. È stato scelto il cancello per la popolazione cellulare 7-AAD-negativa. (C) Sono state scelte le porte per le popolazioni cellulari EphB2-high (EphB2high), EphB2-medium (EphB2med), EphB2-low (EphB2low) ed EphB2-negative (EphB2neg). Abbreviazioni: FSC-A = area di picco di dispersione in avanti; SSC-A = area laterale del picco di dispersione; 7-AAD = 7-ammino-actinomicina D. Fare clic qui per visualizzare una versione ingrandita di questa figura.
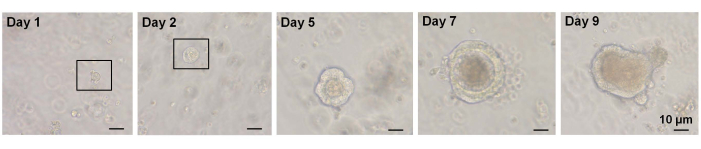
Figura 3: Andamento temporale della crescita di organoidiad alte cellule EphB2 single-sorted in topi wild-type. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Tabella 1: Terreno di coltura per una piastra da 24 pozzetti. Clicca qui per scaricare questa tabella.
Video supplementare S1: Immagini time-lapse di un organoide in crescita. Barra di scala = 50 μm. Clicca qui per scaricare questo file.
Figura supplementare S1: Immagine rappresentativa della colorazione anticorpale anti-lisozima in un organoide. Le frecce bianche indicano le celle di Paneth. Abbreviazione: DIC = microscopio a contrasto di interferenza differenziale. Barra di scala = 10 μm. Clicca qui per scaricare questo file.
Discussione
Questo protocollo descrive un metodo per isolare costantemente le piccole cripte intestinali e la successiva coltura di organoidi 3D. Per migliorare il tasso di rilascio della cripta, è stato stabilito un metodo di isolamento meccanico che prevede uno scuotimento vigoroso dopo il trattamento con EDTA. La composizione del mezzo è diversa dal protocollo originale di Sato et al.7. Il mezzo originale è relativamente costoso. Pertanto, un terreno di coltura e terreni personalizzati per organoidi murini dell'intestino tenue contenenti inibitori farmacologici, fattori di crescita ricombinanti e / o terreni condizionati sono mostrati nella Tabella 1. Wnt3A e N-acetilcisteina non sono inclusi nel terreno di coltura in questo protocollo. Poiché le celle di Paneth esprimono Wnt3, le celle producono Wnt3 e supportano il mantenimento di ISC. Inoltre, durante il corso dell'isolamento della cripta, il mezzo condizionato non viene utilizzato. Il modello organoide è dinamico e presenta eterogeneità cellulare e strutturale (cellule Paneth, enterociti, cellule caliciformi, cellule enteroendocrine, cellule ciuffo e ISC). Quindi, questi organoidi possono essere utilizzati su larga scala per studiare questioni fondamentali della biologia degli organoidi.
Il gradiente EphB2 mantiene la staminalità e la proliferazione ISC lungo l'asse crypt-villus nell'intestino tenue adulto18. Il vantaggio di produrre organoidi da una singola cellula EphB2 rispetto alle cripte isolate riguarda la comprensione della biologia delle ISC murine, poiché le ISC svolgono ruoli chiave in vari disturbi intestinali umani. Le singole ISC adalta espressione EphB2 possono essere coltivate per formare organoidi in modo simile allo sviluppo di organoidi da singole ISC che esprimono Lgr5. Il passo più importante è quello di dividere precisamente le cellule in quattro gruppi (EphB2alto, EphB2med, EphB2basso ed EphB2neg) secondo l'espressione EphB2 nelle cripte usando FACS. I grafici di dispersione diretta rispetto a quelli laterali (FSC vs. SSC) sono comunemente usati per identificare le celle di interesse in base alle loro dimensioni e granularità. FSC indica la dimensione della cella e SSC si riferisce alla complessità o granularità della cella nel gate P0 (Figura 2A). In questo lavoro, le cellule che rientravano all'interno del cancello definito (P0) sono state successivamente analizzate per la vitalità. Successivamente, la loro vitalità è stata determinata in base alle popolazioni negative e positive di segnali di fluorescenza 7-AAD. Il confine tra le cellule 7-AAD-negative e -positive è stato rigorosamente deciso per ottenere quelle negative con una contaminazione cellulare positiva minima. Le porte EphB2 sono state impostate approssimativamente in base all'espressione graduata EphB2.
Per confermare che i quattro gruppi erano divisi con precisione, è stata analizzata l'espressione dell'mRNA di geni selezionati. I livelli di mRNA dei marcatori ISC sono alti nelle cellulealte di EphB220. Inoltre, i livelli di mRNA dei marcatori specifici delle cellule progenitrici sono relativamente alti nelle cellulemediche EphB220. Tuttavia, l'espressione di EphB2 nelle cellule EphB2basse ed EphB2neg è bassa o negativa rispetto a quella delle cellule EphB2alte e EphB2med 20. Le misure precedenti devono essere prese per garantire l'arricchimento della popolazione adalte cellule EphB2 prima della placcatura. Tuttavia, la crescita organoide inferiore al 6% da cellulealte di EphB2 può essere dovuta alla morte delle cellule staminali durante il processo di coltura, non al vigoroso scuotimento durante l'isolamento della cripta. È stato dimostrato che l'applicazione di un inibitore selettivo della chinasi Rho-associata (ROCK) alle cellule staminali embrionali umane riduce notevolmente l'apoptosi22 indotta dalla dissociazione. Pertanto, come modifica tecnica, vale la pena provare ad aggiungere l'inibitore ROCK a una concentrazione più elevata e con un'incubazione più lunga per migliorare la vitalità.
Le cellule di Paneth che secernono Wnt3A accanto alle ISC forniscono un supporto essenziale alle ISC8. Infatti, i doppietti cellulari ISC-Paneth mostrano una capacità organoide fortemente aumentata rispetto alle singole ISC8. Inoltre, l'aggiunta di Wnt3A alla concentrazione di 100 ng/mL per i primi 3 giorni di coltura ha dimostrato di aumentare la capacità di formazione di organoidi8. Pertanto, come ulteriore cambiamento tecnico, l'aggiunta di Wnt3A esogeno potrebbe migliorare la capacità di formazione di organoidi di singole ISC ad alta espressione EphB2.
Rispetto agli approcci in vivo, gli organoidi possono essere facilmente utilizzati per la manipolazione genetica, l'analisi dei fenotipi maligni e lo screening dei farmaci20,23. Una combinazione di chelazione con EDTA e un metodo di isolamento meccanico è efficace, riproducibile ed efficiente in termini di tempo per creare piccoli organoidi intestinali dalle cripte e può essere facilmente seguita dal personale di laboratorio senza alcuna esperienza avanzata. Pertanto, l'aggiunta dell'isolamento meccanico con scuotimento vigoroso dopo il trattamento con EDTA può stabilire efficacemente organoidi murini del piccolo intestino ex vivo e fornire un potenziale strumento per la coltivazione di organoidi e la modellazione della malattia di altri tessuti epiteliali adulti.
Le cellule epiteliali intestinali sono polarizzate e orientate con il lato apicale diretto verso il lume. Tuttavia, il lato apicale rivolto verso il lume degli organoidi 3D è al loro interno. Pertanto, questa organizzazione impedisce l'accesso al lato apicale, che è un problema quando si studiano gli effetti dei componenti luminali, come nutrienti, microbi e metaboliti sulle cellule epiteliali. Per aggirare questo svantaggio, è stata sviluppata una coltura di cellule organoidi come monostrati2D 24. In termini di applicazioni future, verrà utilizzata la coltura di monostrati di cellule organoidi, in quanto rappresenta il sistema più efficiente e trattabile.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Questo lavoro è stato sostenuto da Grants-in-Aid for Scientific Research (C) a T.T. (numeri di sovvenzione JP17K07495 e JP20K06751). Si ringrazia il Prof. Mineko Kengaku per l'utilizzo delle apparecchiature per l'imaging time-lapse a lungo termine (LCV100; Olimpo).
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5 mL Eppendorf tube | Eppendorf | 0030 125.215 | |
| 5 mL syringe | TERUMO | SS-05SZ | |
| 15 mL Falcon tube | Iwaki | 2325-015 | |
| 20 μm cell strainer | Sysmex | 04-004-2325 | |
| 24-well plate | Iwaki | 3820-024 | |
| 50 mL Falcon tube | Iwaki | 2345-050 | |
| 60 mm tissue culture dish | FALCON | 353002 | |
| 70 μm cell strainer | Falcon | 352350 | |
| 100 mm Petri dish | Iwaki | 3020-100 | |
| 7-AAD | BD Biosciences | 559925 | |
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| Alexa Fluor 568 Goat Anti-Mouse IgG (H+L) | Invitrogen | A-11004 | |
| Anti-EphB2 APC-conjugated antibody | BD Biosciences | 564699 | |
| C57BL6/J mice | Japan SLC, Inc. | ||
| Clean bench | HITACHI | CCV-1306E | |
| Confocal laser scanning microscope | Olympus | FV3000 | |
| EDTA (0.5 mol/L) | Nacalai Tesque | 06894-14 | 2 mM |
| FACSMelody | BD Life Sciences-Biosciences | 661762 | |
| Fetal bovine serum | Sigma | 173012 | 1% (v/v) |
| Fiji (software) | https://fiji.sc/ | ||
| Gentamicin (10 mg/mL) | Nacalai Tesque | 16672-04 | 25 μg/mL |
| Hammacher laboratory scissor | SANSYO | 91-1538 | |
| Incubator | Panasonic | MCO-170-PJ | |
| Laboratory tweezer | AS-ONE | 7-164-04 | |
| L-Glutamine 200 mM | Gibco | 25030081 | 2 mM |
| Matrigel | BD Biosciences | 354230 | ECM for 3D organoids |
| Mouse Anti-Human Lysozyme | LSBio | LS-B8704-100 | |
| Murine EGF (20 μg/mL stock solution) | PeproTech | 315-09 | 20 ng/mL |
| PBS 1x | Gibco | 10010-023 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140-122 | 50 U/mL |
| Pipetman (10 μL, 20 μL, 200 μL, and 1,000 μL) | GILSON | 1-6855-12, -13, -15, and -16 | |
| Recombinant murine Noggin (20 μg/mL stock solution | R&D Systems | 1967-NG-025 | 100 ng/mL |
| Recombinant murine R-Spondin 1 (250 μg/mL stock solution) | R&D Systems | 3474-RS-050 | 500 ng/mL |
| Sorbitol | Nacalai Tesque | 32021-95 | 2% (w/v) |
| TE2000-S (inverted microscope) | Nikon | 24131 | |
| Time-lapse image microscope | Olympus | LCV100 | |
| TrypLE Express 1x | Gibco | 12605-010 | |
| ULVAC | ULVAC KIKO Inc. | 100073 | |
| Y-27632 | Fujifilm | 331752-47-7 | 10 μM |
Riferimenti
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Seidlitz, T., et al. Human gastric cancer modelling using organoids. Gut. 68 (2), 207-217 (2019).
- Nikolaev, M., et al. Homeostatic mini-intestines through scaffold-guided organoid morphogenesis. Nature. 585 (7826), 574-578 (2020).
- Artegiani, B., Clevers, H. Use and application of 3D-organoid technology. Human Molecular Genetics. 27, R99-R107 (2018).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Dedhia, P. H., Bertaux-Skeirik, N., Zavros, Y., Spence, J. R. Organoid models of human gastrointestinal development and disease. Gastroenterology. 150 (5), 1098-1112 (2016).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts. Nature. 469 (7330), 415-418 (2011).
- Aronowitz, J. A., Lockhart, R. A., Hakakian, C. S. Mechanical versus enzymatic isolation of stromal vascular fraction cells from adipose tissue. Springerplus. 4 (1), 713 (2015).
- Takahashi, T. New trends and perspectives in the function of non-neuronal acetylcholine in crypt-villus organoids in mice. Methods in Molecular Biology. 1576, 145-155 (2019).
- Batlle, E., et al. β-catenin and TCF mediate cell positioning in the intestinal epithelium by controlling the expression of EphB/ephrinB. Cell. 111 (2), 251-263 (2002).
- Baghdadi, M. B., Kim, T. -. H. Analysis of mouse intestinal organoid culture with conditioned media isolated from mucosal enteric glial cells. STAR Protocols. 3 (2), 101351 (2022).
- Takahashi, T., et al. Non-neuronal acetylcholine as an endogenous regulator of proliferation and differentiation of Lgr5-positive stem cells in mice. FEBS Journal. 281 (20), 4672-4690 (2014).
- Barker, N. Adult intestinal stem cells: Critical drivers of epithelial homeostasis and regeneration. Nature Reviews Molecular Cell Biology. 15 (1), 19-33 (2014).
- Fordham, R. P., et al. Transplantation of expanded fetal intestinal progenitors contributes to colon regeneration after injury. Cell Stem Cell. 13 (6), 734-744 (2013).
- Miyoshi, H., et al. Wnt5a potentiates TGF-β signaling to promote colonic crypt regeneration after tissue injury. Science. 338 (6103), 108-113 (2012).
- Jung, P., et al. Isolation and in vitro expansion of human colonic stem cells. NatureMedicine. 17 (10), 1225-1227 (2011).
- Merlos-Suárez, A., et al. The intestinal stem cell signature identifies colorectal cancer stem cells and predicts disease relapse. Cell Stem Cell. 8 (5), 511-524 (2011).
- Mao, W., et al. EphB2 as a therapeutic antibody drug target for the treatment of colorectal cancer. Cancer Research. 64 (3), 781-788 (2004).
- Takahashi, T., et al. Muscarinic receptor M3 contributes to intestinal stem cell maintenance via EphB/ephrin-B signaling. Life Science Alliance. 4 (9), e202000962 (2021).
- Jung, P., et al. Isolation of human colon stem cells using surface expression of PTK7. Stem Cell Reports. 5 (6), 979-987 (2015).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Schulte, L., Hohwieler, M., Müller, M., Klaus, J. Intestinal organoids as a novel complementary model to dissect inflammatory bowel disease. Stem Cells International. 2019, 8010645 (2019).
- Puzan, M., Hosic, S., Ghio, C., Koppes, A. Enteric nervous system regulation of intestinal stem cell differentiation and epithelial monolayer function. Scientific Reports. 8 (1), 6313 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon