需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
桡�支气管内超声和电磁导航支气管镜透视透视诊断外周肺病变
摘要
仅使用支气管镜诊断小肺肿瘤非常困难。电磁导航支气管镜检查用于定位病变,类似于全球定位系统。桡支气管内超声和透视确认正确位置并监测取样。
摘要
使用可弯曲支气管镜诊断肺癌是一种安全的手术,并发症的风险非常低。支气管镜检查对支气管内病变的诊断准确性高,但在对外周病灶进行采样时却达不到要求。因此,已经发明了几种方法来引导支气管镜到病灶并在组织取样之前确认肿瘤的位置。
支气管镜检查期间使用透视技术,在手术过程中提供胸部的 2D X 射线图像。支气管镜和工具将可见,如果大于 2.0-2.5 厘米,则可以看到病变。桡支气管内超声 (rEBUS) 由一个超声探头组成,该探头足够小,可以插入支气管镜的工作通道。超声探头用于区分实变组织(如肿瘤组织)和正常的充满空气的肺实质。电磁导航支气管镜检查 (ENB) 根据患者的计算机断层扫描 (CT) 扫描创建支气管树的 3D 模型。在支气管镜检查之前,会规划一条从气管到病灶的路线,以便在手术过程中实时引导支气管镜到病灶,类似于全球定位系统。本文的目的是描述一种使用 rEBUS 和透视进行支气管镜检查、使用 ENB、rEBUS 和透视进行支气管镜检查的逐步方法。在讨论部分,将讨论每种模式的优缺点。
引言
肺癌是全球最常见的癌症类型之一,也是癌症相关死亡的主要原因1。因此,建议使用低剂量计算机断层扫描 (CT) 筛查肺癌,以便在症状出现之前诊断患者2。低分期通常被检测为小的肺部病变或结节。从荷兰进行的最大规模的筛查研究之一中,我们了解到这些病变通常位于肺实质的外侧 2/3,因此被定义为外周肺癌 3,4。为了确定病变是否恶性,需要组织样本。这可以通过几种不同的方式获得,例如手术切除活检、经胸穿刺活检或使用支气管镜进行内窥镜检查5,6,与手术和经胸入路相比,后者的并发症风险较低,是诊断具有大量合并症的老年人口的首选方法。然而,诊断率仍然低于其他方式5。
支气管镜允许目视检查气管和主支气管,但当支气管分支成节段和亚节段时,定位一个小病灶就像大海捞针一样。因此,已经开发了几种额外的方式来引导支气管镜到病灶并在组织取样之前确认肿瘤的位置7。这些方法的目的是提高内窥镜组织取样的诊断率,并将支气管镜的范围扩大到胸膜,否则会进行经胸穿刺活检 8,9。
使用 C 型臂的透视可在支气管镜检查期间提供胸部的 2D X 射线图像。它可用于可视化经支气管活检 (TBB) 的支气管镜和镊子的位置,以避免在进行随机 TBB 时对胸膜和肺实质中间 1/3 的血管结构进行取样。在诊断肺癌时,可以使用透视将内窥镜引导到病变的“大致”位置。当直径约为 2-2.5 cm 或大于10 时,通常在透视上可以看到病变。透视的缺点是 2D 图像特性,这使得无法知道范围是在病灶的前面、后面还是中心11。然而,如果已通过桡支气管内超声 (rEBUS) 证实存在肿瘤,则透视也用于确认活检工具在取样期间是否位于所需位置12。
rEBUS 于 1992 年由 Hürter 等人首次描述,并越来越多地用于外周肺病变的诊断检查13。这种方式利用了这样一个事实,即充满空气的肺组织不传导超声波,而当使用超声探头扫描时,较致密的组织将显示为实变。rEBUS 由一个圆形和旋转的超声探头、一个超声驱动装置和一个导向鞘组成,用于保护探头,同时确保活检工具的正确位置14。rEBUS 可以单独使用,也可以与其他方式一起使用,例如电磁导航支气管镜检查 (ENB)15,16,17。
ENB 用于定位外周肺病变18。该系统使用软件程序和患者的 CT 扫描。从 CT 扫描生成患者气道的虚拟模型,作员设计从气管到病变的路线。然后在患者胸部周围创建一个电磁场,软件将该电磁场与 CT 扫描生成的虚拟场同步,从而帮助作员在支气管镜检查期间遵循预先计划的路线,类似于全球定位系统技术。ENB 不提供肿瘤位置的实时确认。ENB 可与透视和 rEBUS19,20 结合使用。虚拟导航支气管镜检查 (VBN) 是 ENB 的前身,由用于创建支气管树虚拟模型以及病变路径的软件组成。该系统不包括实时导航,但可以在支气管镜检查期间显示路线21,22。新系统将 VBN 与透视相结合,但 VBN 的使用不会在以下方案23 中描述。
ENB 系统
目前,有两家公司为 ENB 生产系统,奥林巴斯的 SPiN 系统以及美敦力销售的 superDimension 系统和 ILLUMISITE。该协议将描述使用 superDimension 系统的过程,该系统目前拥有最多的出版物。但是,该程序的许多步骤是可以互换的。
以下方案将描述如何在临床环境中在透视下进行 rEBUS 和在透视下进行 ENB + rEBUS。这些程序可以在清醒镇静和全身麻醉下轻松进行。该协议不会描述任何镇静方法。在讨论部分,将介绍每个程序的优缺点。
研究方案
本文中的方案描述了标准的临床实践。不需要道德委员会的许可。协议中的图像不包含可用于识别患者的信息。
1. 桡支气管内超声
- 手术准备
- 手术前检查 CT 扫描以检查支气管体征和病变位置。
- 检查前校准所选的超声探头、导套和活检工具,确保工具在插入导套时能够到达与超声探头相同的位置。
- 按照“系统支气管镜检查:4 个标志性方法”24 中所述对支气管树和节段进行系统检查。
- 将 C 臂放在患者身上并进行调整,直到在图像中可以看到病变。
- 将支气管镜的尖端插入最可能存在病变的节段或子节段。
- 在透视引导下推进导向鞘和探头,直到金属导向片尖端靠近或位于病变内。
- 推进并激活探针。现在,显示器上将出现超声波图像。
- 如果探针被肿瘤或致密组织包围,则会出现同心巩固(参见 图 1A)。寻找灰色和均匀的实变,具有朝向正常肺组织的高回声边界。
- 如果探头放置在病灶附近,图像将是偏心的(见 图 1B)。
- 如果将探针放置在正常的肺组织中,则只会出现空气的散射图像(参见 图 1C)。
- 对于密度较小的病变,例如毛玻璃病灶、炎症组织或肺不张,将呈现更异质且更不清晰的图像(见 图 1D)。这是由支气管中的空气(高回声)或液体(低回声)引起的。
- 如果 CT 扫描未出现与病灶匹配的实变,请调整导鞘和探头,直到获得正确的位置。
- 保存超声探头提供最佳巩固位置的透视图像(将在步骤 1.3.2 中使用)。
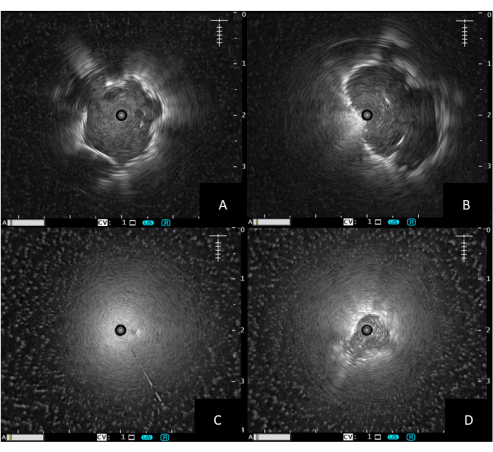
图 1:径向 EBUS 超声图像。 (A) 同心实变,(B) 偏心实变,(C) 空气散射超声图像,(D) 不规则实变。缩写:EBUS = 支气管内超声。 请单击此处查看此图的较大版本。
- 组织取样
- 从导管护套中取出超声探头,插入镊子或其他选择的采样工具。
- 将镊子的位置与超声探头在 C 臂屏幕上的位置进行比较,确保在正确的位置进行采样(见 图 2)。验证镊子的位置,尤其是在患者咳嗽时。使用镊子收集至少 10-15 个样本,并通过取下镊子并每 4 到 5 个样本插入超声探头来确认正确的位置。
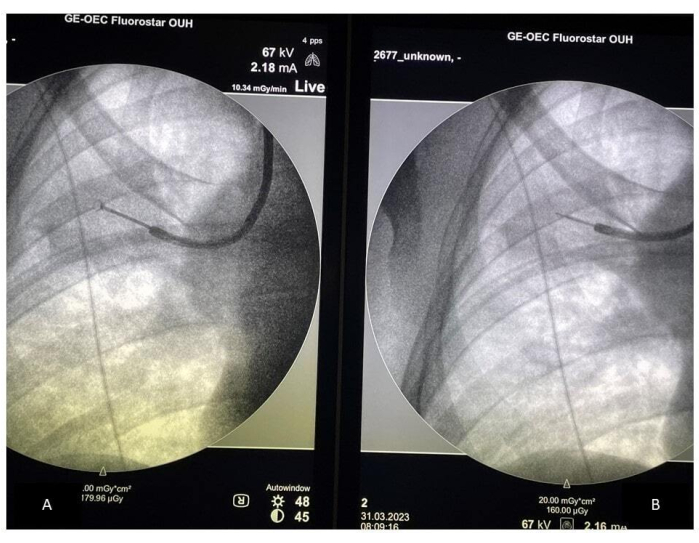
图 2:透视引导下采样。 (A) 采样过程中镊子的放置;(B) rEBUS 探针的放置。缩写:rEBUS = 径向支气管内超声。 请单击此处查看此图的较大版本。
2. 电磁导航支气管镜检查
注意: 以下过程基于 Medtronic 的 superDimension 系统。
- 规划阶段
- 手术前,评估 CT 图像。确保图像是高质量的,最好是厚度不超过 1.5 毫米的切片,并在吸气期间记录以充分扩张气道,露出通向病变的支气管25。
- 使用该软件创建支气管树的 3D 模型,其中规划了通往病变的路线,从病变开始,向气管移动。
注意:如果无法根据扫描确定通往病灶的通路,则 ENB 不是适合患者的模式。
- 注册
- 将患者放在板上。将三个传感器放在胸部,以补偿呼吸过程中的运动。
- 从系统支气管镜检查24 开始手术。
- 将扩展工作通道 (EWC) 和可定位导轨插入支气管镜的工作通道,直到可见可定位导轨的尖端。
- 锁定可定位的参考线。
- 按 计算机上的 Start registration(开始注册 )或使用脚踏板。
- 将支气管镜逐步插入每个肺叶支气管中,从对侧开始,到有病变的肺叶结束。位置和运动由系统记录,信息用于将患者气道的记录与基于 CT 扫描创建的支气管树的 3D 模型相匹配。从病灶的另一侧开始配准,并在最靠近目标的地方完成。
- 当系统显示所有波瓣都已配准时,按 Review registration(查看配准)以查看 配准点是否与虚拟 3D 模型匹配。如果存在不匹配,请重复步骤 2.2.5-2.2.7(参见 图 3D)。
- 导航
- 踩下脚踏板开始导航。该软件将演示到目标的路线。在较大的气道中使用中央导航,在气道的 3D 模型中沿着路线图像显示来自摄像头的视频图像(见 图 3A)。
- 遵循预先计划的路线,直到无法进一步推进范围。
- 解锁 EWC 和可定位指南。
- 通过踩下脚踏板从中央导航切换到外围导航。
注意:推进 EWC 时,将使用外围导航。在这部分,气道的 3D 模型与扫描的 CT 图像一起可见。目标用绿球和标线标记,提供与目标的方向和距离(参见 图 3B)。 - 将目标保持在右侧,同时确保路线被照亮(“正确且明亮”)。推进 EWC,确保通往支气管的路线在 CT 图像上显示开放。
注意:EWC 是可纵的,可以沿所需方向(X、Y 和 Z 轴)转动以到达目标。 - 一旦目标位于标线中心,距离目标 0.4-0.9 毫米,导航就完成了。
注意:建议可定位的导板距离距离不要 0.0 毫米,因为这会导致活检工具超出目标。 - 将 EWC 锁定到位并从示波器中缩回可定位导向。

图 3:电磁导航支气管镜导航。 (A) 中央导航,(B) 外围导航,(C) 对准良好的审查配准,(D) CT 到身体发散。缩写:CT = 计算机断层扫描。 请单击此处查看此图的较大版本。
3. 透视、rEBUS 和组织取样
注意:一旦可定位的导板缩回,就可以在不干扰电磁场的情况下使用透视。
- 将 C 臂放在患者身上并进行调整,直到在图像中可以看到病变。
- 使用透视确认 EWC 的正确位置,并按照步骤 1.2.5 中的说明插入 rEBUS 探针。如果透视下 EWC 不在病灶中或使用 rEBUS 未出现实变,则必须按照步骤 1.2.4-1.2.6 中的说明调整位置。
注意:当构建的 3D 模型与实时配准点之间的对齐倾斜时,就会发生 CT 到体的发散;标记的目标不会位于病变的位置。 - 到达并确认正确位置后,按照步骤 1.3.1-1.3.2 中的说明进行组织采样。
结果
所描述的技术有助于对外周肺病变进行采样。放射状 EBUS 和透视将帮助支气管镜医师在对肿瘤进行取样之前确认病变的存在(见 图 1 和 图 2)。通过添加 ENB,支气管镜医师被引导到正确的位置,而不是寻找病变。计划阶段为支气管镜医师提供前往病灶的路线、使用导航系统实时引导病灶、通过 rEBUS 确认肿瘤的存在以及通过透...
讨论
本文提出了一种用透视进行 rEBUS 和 ENB 的实用方法。以下讨论是作者的观点,基于两个中心的实际临床经验。
提示和技巧
画谜
在手术之前,胸部 CT 分段助行器应用程序可用于检查病变位于哪个节段14.但是,由于患者的解剖结构不同,病变可能位于应用程序上显示的另一个部分。
...
披露声明
美敦力已将 ENB 设备借给欧登塞大学医院的模拟中心,用于 A. Juul 进行的一项研究。美敦力没有参与撰写本文
致谢
作者要感谢欧登塞大学医院呼吸内科的所有支气管镜医师为本文提供图片。
材料
| Name | Company | Catalog Number | Comments |
| Bronchoschope | Olympus | ||
| Edge Extended working channel | Medtronic | ||
| Edge locatable guide | Medtronic | ||
| Guide sheath kit | Olympus | ||
| OEC fluorostar | GE healthcare | C-arm for fluoroscopy | |
| Probe Driving Unit | Olympus | ||
| Radial EBUS probes | Olympus | ||
| superDimension | Medtronic | Navigation system |
参考文献
- Ferlay, J., et al. Cancer statistics for the year 2020: an overview. Int J Cancer. , (2021).
- Adams, S. J., et al. Lung cancer screening. Lancet. 401 (10374), 390-408 (2022).
- Horeweg, N., et al. Characteristics of lung cancers detected by computer tomography screening in the randomized NELSON trial. Am J Respir Crit Care Med. 187 (8), 848-854 (2013).
- Vilmann, P., et al. Combined endobronchial and oesophageal endosonography for the diagnosis and staging of lung cancer. Eur Resp J. 46 (1), 40-60 (2015).
- Schreiber, G., McCrory, D. C. Performance characteristics of different modalities for diagnosis of suspected lung cancer: summary of published evidence. Chest. 123, 115-128 (2003).
- Callister, M. E. J., et al. British Thoracic Society guidelines for the investigation and management of pulmonary nodules: accredited by NICE. Thorax. 70, (2015).
- Shulman, L., Ost, D. Advances in bronchoscopic diagnosis of lung cancer. Curr Opin Pulm Med. 13 (4), 271-277 (2007).
- Eberhardt, R., Gompelmann, D., Herth, F. J. Electromagnetic navigation in lung cancer: research update. Expert Rev Respir Med. 3 (5), 469-473 (2009).
- Han, Y., et al. Diagnosis of small pulmonary lesions by transbronchial lung biopsy with radial endobronchial ultrasound and virtual bronchoscopic navigation versus CT-guided transthoracic needle biopsy: A systematic review and meta-analysis. PLoS One. 13 (1), 0191590 (2018).
- Deng, C., et al. Small lung lesions invisible under fluoroscopy are located accurately by three-dimensional localization technique on chest wall surface and performed bronchoscopy procedures to increase diagnostic yields. BMC Pulm Med. 16 (1), 166 (2016).
- Sánchez-Font, A., et al. Endobronchial ultrasound for the diagnosis of peripheral pulmonary lesions. A controlled study with fluoroscopy. Arch Bronconeumol. 50 (5), 166-171 (2014).
- Tanner, N. T., et al. Standard bronchoscopy with fluoroscopy vs thin bronchoscopy and radial endobronchial ultrasound for biopsy of pulmonary lesions: a multicenter, prospective, randomized trial. Chest. 154 (5), 1035-1043 (2018).
- Hürter, T., Hanrath, P. Endobronchial sonography: feasibility and preliminary results. Thorax. 47 (7), 565-567 (1992).
- Zhang, L., Wu, H., Wang, G. Endobronchial ultrasonography using a guide sheath technique for diagnosis of peripheral pulmonary lesions. Endosc Ultrasound. 6 (5), 292-299 (2017).
- Song, J. Y., et al. Efficacy of combining multiple electromagnetic navigation bronchoscopy modalities for diagnosing lung nodules. J Clin Med. 11 (24), 7341 (2022).
- Zheng, X., et al. A novel electromagnetic navigation bronchoscopy system for the diagnosis of peripheral pulmonary nodules: a randomized clinical trial. Ann Am Thorac Soc. 19 (10), 1730-1739 (2022).
- Sainz Zuñiga, P. V., Vakil, E., Molina, S., Bassett, R. L., Ost, D. E. Sensitivity of radial endobronchial ultrasound-guided bronchoscopy for lung cancer in patients with peripheral pulmonary lesions: an updated meta-analysis. Chest. 157 (4), 994-1011 (2020).
- Criner, G. J., et al. Interventional bronchoscopy. Am J Respir Crit Care Med. 202 (1), 29-50 (2020).
- Eberhardt, R., Anantham, D., Ernst, A., Feller-Kopman, D., Herth, F. Multimodality bronchoscopic diagnosis of peripheral lung lesions: a randomized controlled trial. Am J Respir Crit Care Med. 176 (1), 36-41 (2007).
- Folch, E. E., et al. Electromagnetic navigation bronchoscopy for peripheral pulmonary lesions: one-year results of the prospective, multicenter NAVIGATE study. J Thorac Oncol. 14 (3), 445-458 (2019).
- Asano, F., et al. A virtual bronchoscopic navigation system for pulmonary peripheral lesions. Chest. 130 (2), 559-566 (2006).
- Asano, F., et al. Virtual bronchoscopic navigation without X-ray fluoroscopy to diagnose peripheral pulmonary lesions: a randomized trial. BMC Pulm Med. 17 (1), 184 (2017).
- Tsai, Y. M., Kuo, Y. S., Lin, K. H., Chen, Y. Y., Huang, T. W. Diagnostic performance of electromagnetic navigation versus virtual navigation bronchoscopy-guided biopsy for pulmonary lesions in a single institution: potential role of artificial intelligence for navigation planning. Diagnostics (Basel). 13 (6), 1124 (2023).
- Cold, K. M., Vamadevan, A., Nielsen, A. O., Konge, L., Clementsen, P. F. Systematic bronchoscopy: the four landmarks approach). J Vis Exp. (196), (2023).
- Pritchett, M. A., Bhadra, K., Calcutt, M., Folch, E. Virtual or reality: Divergence between preprocedural computed tomography scans and lung anatomy during guided bronchoscopy. J Thorac Dis. 12 (4), 1595-1611 (2020).
- Ost, D. E., et al. Diagnostic yield and complications of bronchoscopy for peripheral lung lesions. Results of the AQuIRE Registry. Am J Resp Crit Care Med. 193 (1), 68-77 (2016).
- McGuire, A. L., Myers, R., Grant, K., Lam, S., Yee, J. The diagnostic accuracy and sensitivity for malignancy of radial-endobronchial ultrasound and electromagnetic navigation bronchoscopy for sampling of peripheral pulmonary lesions: Systematic review and meta-analysis. J Bronchology Interv Pulmonol. 27 (2), 106-121 (2020).
- Oki, M., et al. Guide sheath versus non-guide sheath method for endobronchial ultrasound-guided biopsy of peripheral pulmonary lesions: a multicentre randomised trial. Eur Respir J. 59 (5), 2101678 (2022).
- Korevaar, D. A., et al. Added value of combined endobronchial and oesophageal endosonography for mediastinal nodal staging in lung cancer: a systematic review and meta-analysis. Lancet Respir Med. 4 (12), 960-968 (2016).
- Micames, C. G., McCrory, D. C., Pavey, D. A., Jowell, P. S., Gress, F. G. Endoscopic ultrasound-guided fine-needle aspiration for non-small cell lung cancer staging: A systematic review and metaanalysis. Chest. 131 (2), 539-548 (2007).
- Farr, A., et al. Endobronchial ultrasound: launch of an ERS structured training programme. Breathe. 12 (3), 217 (2016).
- Bellinger, C., Poon, R., Dotson, T., Sharma, D. Lesion characteristics affecting yield of electromagnetic navigational bronchoscopy. Respir Med. 180, 106357 (2021).
- Laursen, C. B., et al. Ultrasound-guided lung biopsy in the hands of respiratory physicians: diagnostic yield and complications in 215 consecutive patients in 3 centers. J Bronchology Interv Pulmonol. 23 (3), 220-228 (2016).
- Oki, M., et al. Value of adding ultrathin bronchoscopy to thin bronchoscopy for peripheral pulmonary lesions: A multicentre prospective study. Respirology. 28 (2), 152-158 (2023).
- McGuire, A. L., Myers, R., Grant, K., Lam, S., Yee, J. The diagnostic accuracy and sensitivity for malignancy of radial-endobronchial ultrasound and electromagnetic navigation bronchoscopy for sampling of peripheral pulmonary lesions: Systematic review and meta-analysis. J Bronchology Interv Pulmonol. 27 (2), 106-121 (2020).
- Folch, E. E., et al. Electromagnetic navigation bronchoscopy for peripheral pulmonary lesions: one-year results of the prospective, multicenter NAVIGATE study. J Thorac Oncol. 14 (3), 445-458 (2019).
- Pritchett, M. A., Bhadra, K., Calcutt, M., Folch, E. Virtual or reality: divergence between preprocedural computed tomography scans and lung anatomy during guided bronchoscopy. J Thorac Dis. 12 (4), 1595-1611 (2020).
- Dunn, B. K., et al. Evaluation of electromagnetic navigational bronchoscopy using tomosynthesis-assisted visualization, intraprocedural positional correction and continuous guidance for evaluation of peripheral pulmonary nodules. J Bronchology Interv Pulmonol. 30 (1), 16-23 (2023).
- Juul, A. D., et al. Does the addition of radial endobronchial ultrasound improve the diagnostic yield of electromagnetic navigation bronchoscopy? A systematic review. Respiration. 101 (9), 869-877 (2022).
- Silvestri, G. A., et al. An evaluation of diagnostic yield from bronchoscopy: the impact of clinical/radiographic factors, procedure type, and degree of suspicion for cancer. Chest. 157 (6), 1656-1664 (2020).
- Silvestri, G. A., et al. A bronchial genomic classifier for the diagnostic evaluation of lung cancer. N Engl J Med. 373 (3), 243-251 (2015).
- Rozman, A., Zuccatosta, L., Gasparini, S. Dancing in the dark. Respiration. 101 (9), 814-815 (2022).
- Casal, R. F., et al. What exactly is a centrally located lung tumor? Results of an online survey. Ann Am Thorac Soc. 14 (1), 118-123 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。