Method Article
为众多应用构建皮肤模型 - 从二维 (2D) 单一培养到三维 (3D) 多培养
摘要
在这里,我们提出了廉价且简单的程序,以引入各种 3D 皮肤模型,用于细胞培养实验室的常规研究。研究人员可以创建根据其需求量身定制的模型,而无需依赖市售模型。
摘要
由于皮肤结构复杂且功能重要,是化妆品、制药和医疗行业的有趣研究模式。在欧盟,已完全禁止在动物身上测试化妆品及其成分。在医学和制药的情况下,这种可能性也一直受到限制。根据 3R 原则,在人工创建的模型上测试单个化合物以及整个配方变得越来越普遍。最便宜和使用最广泛的是 2D 模型,它由细胞单层组成,但不能反映组织中细胞之间的真实相互作用。尽管市售的 3D 模型可以更好地表示组织,但它们并未大规模使用。这是因为它们价格昂贵,等待时间相当长,而且可用的型号通常仅限于通常使用的型号。
为了将正在进行的研究提升到更高的水平,我们优化了各种 3D 皮肤模型的准备程序。所描述的程序便宜且易于制备,因为它们可以应用于众多实验室和具有不同细胞培养经验的研究人员。
引言
皮肤是一个连续的结构,具有多细胞相互作用,揭示了这个复杂器官的正常功能和稳态。它由形态学上不同的层构成:内层 - 真皮,外层 - 表皮。在表皮的顶部,我们还区分了角质层(由扁平的死细胞 - 角质细胞组成),它对外部环境提供了最大的保护。皮肤一些最重要的被动和主动功能是保护身体免受外部因素的影响、参与免疫过程、分泌、吸收、体温调节和感应 1,2,3。因为它被认为是人体最大的器官之一,所以无法避免接触各种病原体、过敏原、化学物质以及紫外线 (UV) 辐射。因此,它由许多具有特定功能的细胞组成。表皮中存在的主要细胞类型是角质形成细胞(几乎占所有细胞的 90%,在表皮的更深处具有结构和免疫功能,但随后经历角质化过程,在表皮顶层转化为角质细胞)、黑色素细胞(仅占表皮细胞群的 3%-7%,产生紫外线防护色素黑色素)和朗格汉斯细胞(来自免疫系统)。在真皮的情况下,主要细胞是成纤维细胞(产生生长因子和蛋白质)、树突状细胞和肥大细胞(免疫系统的两种细胞类型)4,5,6。此外,皮肤配备了几种细胞外蛋白(如 I 型和 IV 型胶原蛋白、纤连蛋白和层粘连蛋白;图 1)和蛋白质纤维(胶原蛋白和弹性蛋白),它们确保皮肤的特定结构,但也促进细胞结合、细胞粘附和其他相互作用7。
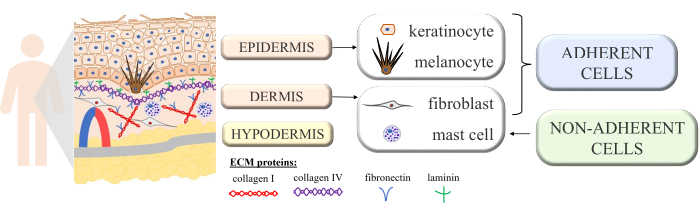
图 1:显示皮肤结构的示意图。 皮肤结构标志着出现在其各个层中的四种基本细胞类型和细胞外基质的区分蛋白质。此图是使用 MS PowerPoint 创建的。 请单击此处查看此图的较大版本。
化妆品和药品的安全是一个非常重要的问题,保护消费者和患者的健康是重中之重8。直到最近,它还应该通过许多测试来保证,包括对动物进行的研究。不幸的是,这些通常需要使用激烈的方法,导致用于研究目的的动物(通常是小鼠、大鼠和猪)感到痛苦和痛苦。1959 年,引入了人道实验技术的原则(3Rs 原则):(1 - 替代)用 体外、 sillico 或 离体 模型替换研究中的动物,(2 - 减少)减少用于研究的动物数量,以及 (3 - 改进)改善研究仍然需要的动物的健康状况,同时改进开发的替代方法9.此外,在欧盟 (EU),动物化妆品测试受法律监管。从 2004 年 9 月 11 日起,对动物试验化妆品的禁令开始生效。2009 年 3 月 11 日,欧盟禁止对化妆品成分进行动物试验。不允许销售由新动物测试成分制成的化妆品;然而,在动物身上测试产品是否存在复杂的人类健康问题(如重复剂量毒性、生殖毒性和毒代动力学)仍然是可以接受的。自 2013 年 3 月 11 日起,在欧盟,销售成品或其成分已在动物身上进行测试的化妆品属于违法行为 10。因此,目前,在美容学中,研究在三个层面进行: 体外 (细胞)、离体 (真实组织)和 体内 (志愿者)11。就药品而言,仍然需要进行动物试验;然而,它显着减少并受到严格控制12。
作为动物试验的替代方法和对新型活性成分有效性的初步评估,使用 体外 皮肤细胞培养物。分离不同类型的皮肤细胞及其在无菌实验室条件下的培养可以评估活性物质的安全性和毒性。皮肤细胞系也是广泛认可的研究模型,因为这些细胞由经过认证的公司销售,并且结果可以在不同的实验室中进行比较。这些测试通常在人类皮肤细胞单一培养的简单 2D 模型上进行。一些更先进的模型是它们的共培养物(例如角质形成细胞与成纤维细胞和角质形成细胞与黑色素细胞),以及三维模型,包括无支架培养物(球体)和基于支架的皮肤等效物表皮、真皮甚至皮肤的全层替代品13。值得一提的是,除了最后一种类型(皮肤等效物)外,其余的都不是市售的,如果需要,科学家必须自己准备它们。
尽管这些模型中的许多已经得到维护,并且现在经常出售(表 1),但仍然需要额外的模型来验证大多数结果。因此,新设计的模型应该更好地再现人体中发生的真实交互。当使用不同类型的细胞混合物形成此类模型时 ,可以实现 体内组织多细胞方面的复制。结果,开发了器官型培养物(图 2)。
| 名字 | 描述 | |||||
| 中性皮肤 | 表皮 | 重建的人类表皮 - 胶原膜上的角质形成细胞 | ||||
| SkinEthic RHE | 重建的人类表皮 - 聚碳酸酯膜上的角质形成细胞 | |||||
| SkinEthic RHE-LC | 人表皮模型朗格汉斯细胞 - 聚碳酸酯膜上的角质形成细胞和朗格汉斯细胞 | |||||
| SkinEthic RHPE | 重建的人类色素表皮 - 聚碳酸酯膜上的角质形成细胞和黑色素细胞 | |||||
| T 型皮肤 | 重建的人类全层皮肤模型 - 在聚碳酸酯膜上生长的成纤维细胞层上的角质形成细胞 | |||||
| Phenion FT 皮肤模型 | 水凝胶中的角质形成细胞和成纤维细胞 | |||||
| 患有疾病的皮肤 | 黑色素瘤 FT 皮肤模型 | 具有人恶性黑色素瘤细胞系 A375 的正常人源性角质形成细胞和成纤维细胞 | ||||
| 银屑病组织模型 | 正常人角质形成细胞和成纤维细胞 | |||||
表 1:各种研究中最受欢迎的商业皮肤等效物。
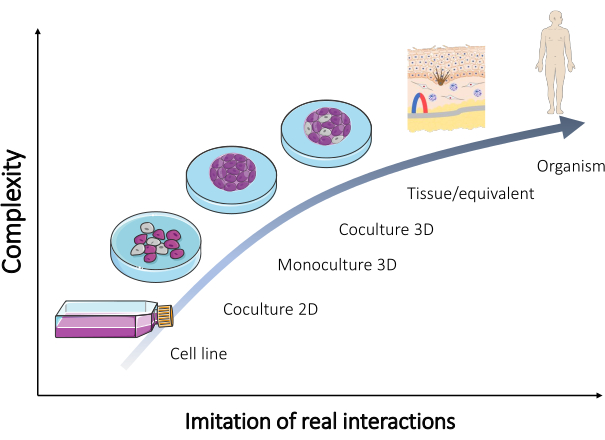
图 2:不同 体外 模型的复杂性。 用于重建生物体的不同 体外 模型的复杂性与直接在人体中发生的真实相互作用之间的关系。该图是从施维雅医学艺术 (https://smart.servier.com/) 的 “微生物学和细胞培养” 套装修改而来的。请单击此处查看此图的较大版本。
商业等价物最重要的限制之一是只能获得具有几种类型细胞(通常为 1-2 个,很少 3 个)的非常通用的研究模型。然而,皮肤中存在更多的细胞,它们之间的相互作用可以确保对各种成分的耐受性更好或更差14。缺乏一些免疫成分会降低其在包括免疫疗法在内的多种研究中的价值。这是一个严重的问题,因为黑色素瘤是一种危及生命的皮肤癌,因为转移发生得早并且经常对应用的治疗产生耐药性 15。为了改进人造皮肤模型,研究人员尝试建立免疫细胞与细胞系和类器官16 的共培养,这被认为是对所研究模型的一大改进。例如,肥大细胞参与皮肤中的许多生理(伤口愈合、组织重塑)和病理(炎症、血管生成和肿瘤进展)过程17。因此,它们在模型中的出现可以显著改变模型对所研究化合物的响应。最后,还有很多与皮肤相关的信息缺失,只能通过进行基础研究来发现。这就是为什么创建和改进不同的人造皮肤模型(表 2)是一项如此重要的工作。本文介绍了创建高级蒙皮模型的几个过程,包括球体和等效蒙皮。
| 体外 皮肤模型 | 尝试重现组织中发生的相互作用 | 使用单元格的示例 |
| 2D 或 3D 细胞培养 | 表皮 | 角质形成细胞 |
| 黑色素细胞 | ||
| 角质形成细胞 + 黑色素细胞 | ||
| 真皮 | 成纤维细胞 | |
| 肥大细胞 | ||
| 成纤维细胞 + 肥大细胞 | ||
| 皮肤 | 角质形成细胞 + 成纤维细胞 | |
| 角质形成细胞 + 肥大细胞 | ||
| 黑色素细胞 + 成纤维细胞 | ||
| 黑色素细胞 + 肥大细胞 | ||
| 角质形成细胞 + 成纤维细胞 + 黑色素细胞 | ||
| 角质形成细胞 + 成纤维细胞 + 肥大细胞 |
表 2:在 2D 和 3D 培养中重建皮肤组织的细胞类型混合物示例。
研究方案
该研究是根据赫尔辛基宣言的指导方针进行的,并获得了华沙医科大学伦理委员会 (KB/7/2022) 的批准。已获得参与研究的所有受试者的知情同意。
注意:高级皮肤模型制备的描述程序可以使用市售的原代皮肤细胞和细胞系或从患者身上分离的原代细胞进行。商业细胞随相关文件一起提供,在大多数国家/地区的研究中使用它们不需要任何额外的批准。但是,对于某些国家/地区,这是强制性的,因此必须根据当地道德委员会的规定进行检查。如果应该将患者身上分离的原代细胞用于研究,首先,该研究必须得到当地伦理委员会的批准,并且需要根据他们的严格指导方针进行。此外,必须从所有皮肤组织捐献者那里获得书面知情同意书。原代皮肤细胞的分离不是本文的主题,但示例性分离程序可以在 Kosten 等人(角质形成细胞)18、Ścieżyńska 等人(黑色素细胞)19、Kröger 等人(成纤维细胞和肥大细胞)20 中找到。大多数正常皮肤细胞和细胞系的安全水平为 BSL1 级;他们不会造成任何威胁。然而,二手实验室设备需要满足受控条件下动物和人类细胞培养的标准。
1. 皮肤细胞培养
注:皮肤细胞培养必须在 37 °C 的贴壁或悬浮细胞专用培养瓶(取决于细胞类型)中进行,培养箱中二氧化碳含量为 5%。与它们的培养和用于研究相关的活动需要无菌条件,并且必须在暴露于紫外线 C (UVC) 射线 15-30 分钟后在层流室中进行。获得细胞悬液,然后用于创建二维和三维模型,需要根据细胞类型实施程序(对于贴壁细胞,如角质形成细胞、成纤维细胞和黑色素细胞 - 步骤 1.1,对于肥大细胞的非贴壁细胞 - 步骤 1.2)(图 3)。对于不同的培养瓶尺寸, 表3列出了所述方法中使用的所有试剂(如培养基、磷酸盐缓冲盐水或胰蛋白酶溶液)的体积。取决于细胞类型的参数(例如,试剂的浓度和组成、离心方法等)在 表 4 中排序。用于接种的细胞密度如 表 5 所示。所有这些表都包含在本节的末尾。
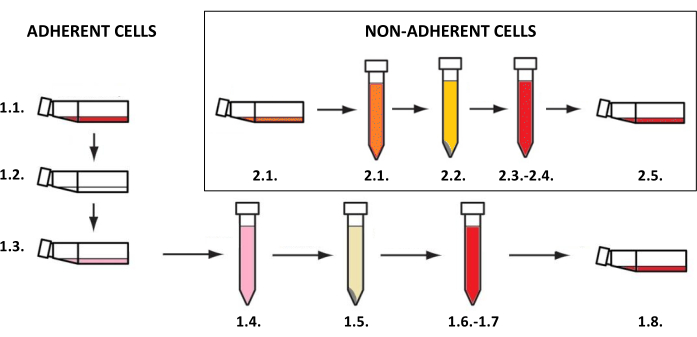
图 3:贴壁和非贴壁细胞培养。 贴壁和非贴壁细胞培养的一般分步程序(数字与步骤 1.1 和 1.2 的描述相对应)。该图是使用 MS PowerPoint 创建的。 请单击此处查看此图的较大版本。
- 获得贴壁细胞的悬浮液
- 从培养瓶中取出培养基。
- 用磷酸盐缓冲盐水(PBS, 表 3)轻轻洗涤细胞。
- 在乙二胺四乙酸中加入胰蛋白酶溶液(胰蛋白酶-EDTA 溶液, 表 3)。将培养瓶在 37 °C 下孵育,并在光学显微镜上控制细胞从表面分离。
- 将分离的细胞悬浮在至少双倍量的全生长培养基或胰蛋白酶中和剂中,以使胰蛋白酶失活 (2:1)(体积参见表 3,试剂参见 表 4)。将培养瓶的内容物定量转移到 15 mL 试管中。
- 将少量 (20 μL) 细胞悬液放入 1.5 mL 试管中,用手动或自动血球计数器对细胞进行计数。
- 离心试管( 表 4 中的参数),去除大部分上清液,并将细胞沉淀重悬于少量剩余液体中。然后,如果细胞密度适合接种或重新计算新培养基的所需体积,则添加足够的新鲜培养基以获得预离心体积( 表 3 中的体积)。
注:某些细胞(如黑色素细胞)对离心非常敏感,因此无需在短时间内再次离心。 - 为实验准备所需密度(细胞/mL, 表 5 中的细胞密度)的细胞悬液(皮肤细胞的 2D/3D 单培养物或多培养物)。
注:如果要进一步培养细胞,请将 5,000-8,000 个细胞/mL 放回新培养瓶中,并添加新鲜培养基( 体积见表 3)。
- 获得非贴壁细胞的悬液
- 从培养瓶中取出含有细胞悬液的培养基,并将其定量转移到 15 mL 试管中。
- 将小体积 (20 μL) 细胞悬液放入新的 1.5 mL 试管中。用手动或自动血细胞计数器计数细胞。
- 离心试管( 表 4 中的参数),去除大部分上清液,并将细胞重悬于少量剩余液体中。然后,如果细胞密度适合接种或重新计算新培养基的所需体积,则添加新鲜培养基以获得预离心体积(如 表 3 所示)。
- 为实验准备所需密度的细胞悬液(每 mL 细胞数,如 表 5 所示)(皮肤细胞的 2D/3D 单培养物或多培养物)。
注:如果要进一步培养细胞,请将 5,000-8,000 个细胞/mL 放回新培养瓶中,并加入新鲜培养基。
| 25 cm2 培养瓶 | 75 cm2 培养瓶 | |
| 培养基 [mL] | 4–5 | 8–12 |
| PBS [毫升] | 5 | 10 |
| 胰蛋白酶-EDTA [mL] | 0.5–1 | 1–2 |
| 中和培养基 [mL] | 1–2 | 2–4 |
表 3:细胞悬液培养和制备过程中使用的试剂体积。
| 皮肤细胞的单一培养 | 胰蛋白酶 | 胰蛋白酶钝化剂 | 离心 | 用于 2D 单一培养的培养基类型 | |
| 角质形成细胞 | 0.25% | 含胰蛋白酶中和剂 | 300 x g,5 分钟,RT | 角质形成细胞生长培养基 2 | |
| 成纤维细胞 | 0.25% | 带介质 | 300 x g,5 分钟,RT | DMEM,10% FBS | |
| 黑色素细胞 | 0.025% | 含胰蛋白酶中和剂 | 300 x g,3 分钟,RT | 培养基 254,不含 PMA 的人黑素细胞生长添加剂-2 | |
| 肥大细胞 | 不需要 | 不需要 | 300 x g,3 分钟,RT | IMDM、10% FBS、1% 非必需氨基酸、226 μM α-单硫甘油 | |
表 4:胰蛋白酶消化、离心参数和培养基类型取决于细胞类型。
| 型号类型 | 细胞密度 [cell/mL] | ||
| 二 维和 | 单层 | 成纤维细胞 | 2 x 105 |
| 肥大细胞 | |||
| 角质形成细胞 | |||
| 黑色素细胞 | |||
| 三维 | 球体(悬挂放置法) | 成纤维细胞 | 5 x 105 |
| 肥大细胞 | |||
| 角质形成细胞 | |||
| 黑色素细胞 | |||
| 细胞混合 | |||
| 球体(限制细胞粘附法) | 成纤维细胞 | 2 x 105 | |
| 肥大细胞 | |||
| 角质形成细胞 | |||
| 黑色素细胞 | |||
| 细胞混合 | |||
| 等效 | 成纤维细胞 | 1 x 105 | |
| 肥大细胞 | 1 x 104 | ||
| 角质形成细胞 | 8 x 105 | ||
| 黑色素细胞 | 5 x 104 | ||
表 5:不同类型皮肤模型的细胞接种密度。
2. 皮肤细胞球的制备
注:为了创建球体,步骤 2.1 中描述了悬滴法的使用(图 4),而侧重于限制细胞粘附的方法在步骤 2.2 中显示(图 5)。然而,由于球体非常小且可能不稳定,因此在这些方法下进行的活动需要耐心、细腻和缓慢的行动。
- 悬挂式方法
- 使用适当的细胞密度以达到所需的球体大小(推荐细胞密度 5 x 105 个细胞/mL, 表 5)。
- 将 20 μL 细胞悬液移液到培养皿或多孔板的盖子上(图 4A)。
- 用底部盖住盘子/盘子并轻轻翻转它(盖子上会自动产生悬滴, 图 4B)。
- 用无菌水/PBS 溶液填充培养皿/板的孔,以避免培养基从液滴中蒸发。
- 将液滴在 37 °C 下孵育 48-72 小时。
注:重力将细胞向下拉,而缺乏可接近的表面会阻止细胞附着在血管上并促进细胞聚集。然而,某些细胞类型可能需要更长的孵育时间。 - 在执行下一步之前,用完整的生长培养基 (100 μL) 填充新板的孔(或使用从孔中去除水/PBS 的旧板)。
注:下一步时,取 200 μL 吸头,去除每个吸头末端的 1/5,并在使用前消毒。 - 使用带有切割端的无菌移液器吸头将细胞球转移到多孔板的孔中。取 200 μL 吸头,去除每个吸头末端的 1/5,并在使用前消毒(图 4C)。
注意:此步骤可能很困难,因为培养皿/盘子翻转过程中的液体流动会损坏球体。 - 在进行任何进一步的实验(例如,化合物添加、细胞毒性测定、球体引入等效物)之前,将转移的球体在 37 °C 下孵育 1 天(图 4D)。
- 限制细胞粘附的方法
- 在细胞接种之前,用表面活性剂溶液(例如 Pluronic F-127、聚乙二醇、聚乙烯醇)覆盖 U 底板的孔21。准备并向每个孔中加入 100 μL 的 1% 表面活性剂溶液的 PBS 溶液。将板与溶液在 37 °C 下孵育 24 小时(图 5A-C)。如果需要,将板储存更长时间,但通过添加更多 PBS 缓冲液来保持液位。
- 以 50 μL/孔的所需细胞密度制备细胞悬液(接种 2 x 105/mL 时的推荐细胞密度, 表 5)。
- 在接种细胞之前从孔中取出表面活性剂溶液,以避免裂解破坏细胞膜(图 5D)。
- 将细胞溶液添加到板中,并在 37 °C 下孵育 24 小时以达到细胞聚集体(图 5E)。大约 1-3 天后,将形成球体(图 5F)并准备好用于任何进一步的实验。
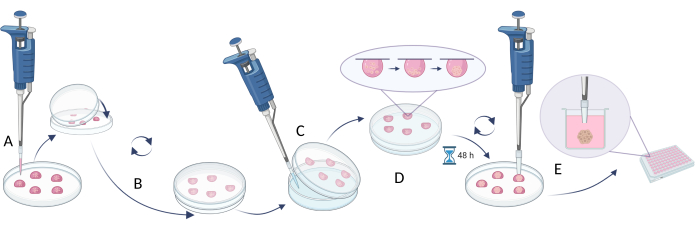
图 4:悬滴法。 (A) 将细胞悬液移液放在盖子上,并用培养皿的底部覆盖盖子;(B) 旋转培养皿以产生悬垂的液滴;(C) 在培养皿底部添加水/PBS(限制液体蒸发);(D) 用悬滴孵育培养皿以产生细胞球;(E) 在多孔板中收集具有形成球体的液滴和转移球体的稳定性。该图是用 Biorender.com 创建的。 请单击此处查看此图的较大版本。
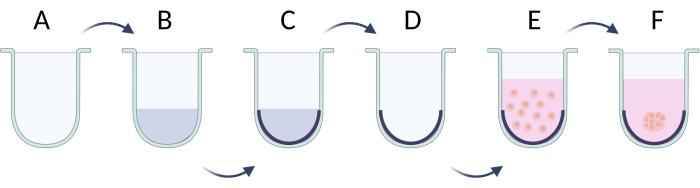
图 5:通过限制细胞粘附法逐步制备球体。(A) U 形底孔;(B,C) 通过表面活性剂溶液限制细胞粘附;(D) 从孔中取出溶液;(E) 接种细胞;(F) 细胞聚集和球体的形成。该图是用 Biorender.com 创建的。请单击此处查看此图的较大版本。
3. 制备全层皮肤等效物
注意:全层(表皮和真皮)皮肤等效物的发育可分为三个步骤(图 6):准备人造真皮层,出现典型的真皮细胞(如成纤维细胞和肥大细胞, 图 6A),接种人工表皮中包含的细胞(主要是角质形成细胞和黑色素细胞, 图 6B)和角质形成细胞的垂直生长,可能具有角质化过程(角质层的形成, 图 6C)。全层皮肤当量的制备在步骤 3.1 (3.1.1-3.1.10) 中描述。如果需要不太高级的皮肤等效物(例如,仅表皮类型),则可以将选定的细胞类型(例如角质形成细胞)直接接种到市售的胶原蛋白或聚碳酸酯膜上,并且还可以培养以诱导角质化过程的可能性(直接进入步骤 3.1.9-3.1.10)。
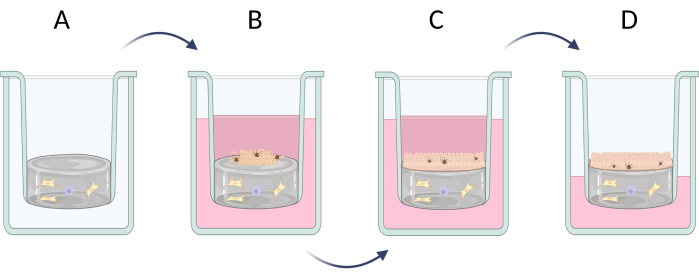
图 6:插入物中全层皮肤当量的逐步制备。 (A) 用真皮细胞制备假真皮层,(B) 表皮细胞接种,(C) 在培养基中进一步培养等效物,(D) 气液界面培养促进分层上皮的形成。该图是用 Biorender.com 创建的。 请单击此处查看此图的较大版本。
- 在 24 孔板中制备全层皮肤当量
- 将装有水、PBS (10x)、1 M NaOH 和 I 型胶原蛋白溶液的试管放在冰上。
- 确定适当数量的真皮细胞(例如,成纤维细胞和肥大细胞;以 10:1 的比例接种)接种到水凝胶中。将适当数量的真皮细胞转移到 1.5 mL 管中(根据 表 5 中的细胞密度,500 μL 成纤维细胞和 500 μL 肥大细胞)并离心细胞(300 x g,3 分钟,RT)。
- 去除上清液,将细胞轻轻重悬于 695 μL 水/100 μL PBS (10x)/5 μL NaOH 的混合物中。
注:如果 1 mL 总溶液不够,请使用 表 6 重新计算每种试剂的体积。 - 向混合物中加入 200 μL 胶原蛋白溶液,并通过移液轻轻混合。
注意:要小心,因为混合物的稠度会很浓。 - 将 200 μL 制备的混合物添加到 24 孔板中的插入物中。对于没有角质层的模型, 向 24 孔板的每个孔中加入 500 μL。
- 在室温 (RT) 下孵育板 10 分钟,然后将其转移到培养箱中 30 分钟。
注意:在执行任何其他操作之前,请检查水凝胶是否已聚合。 - 在水凝胶表面接种细胞之前,用 PBS 缓冲液(500 μL/孔)冲洗。
- 确定适当数量的表皮细胞(例如,角质形成细胞和黑色素细胞;以 15:1 的比例接种)接种在水凝胶顶部。在 500 μL 补充有 10% FBS(添加 250 μL 角质形成细胞和 250 μL 黑色素细胞,细胞密度见 表 4)的 DMEM 培养基中制备细胞混合物,并将其轻轻加入孔中。
注意:在某些情况下,最好先接种黑色素细胞,让它们在水凝胶上很好地扩散,再过 24 小时后,去除培养基并接种角质形成细胞。在这种情况下,添加 250 μL 细胞悬液和 250 μL 培养基。 - 根据细胞生长的速度,将板在 37 °C 下孵育 2-5 天,每 48 小时更换培养基(FBS 浓度从 10% 降低到 1%),并在光学显微镜上进行细胞监测。
- 如果要在水凝胶顶部获得单层角质形成细胞后诱导角化过程,请使用额外补充钙离子和 L-抗坏血酸的无 FBS 培养基 2-7 周(浓度为 1.5 μM CaCl2 和 50 μg/mL L-抗坏血酸)。
注意:孵育时间取决于使用的角质形成细胞及其分化速度。
| 试剂 | 用于计算试剂体积的方程 | 示例计算 | |
| (最终体积 = V总计 1 mL) | |||
| I 型胶原蛋白溶液 | 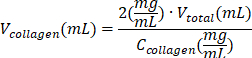 | (C胶原蛋白 = 10 毫克/毫升) | |
| 0.2 mL = 200 μL | |||
| PBS (10x) | 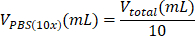 | 0.1 mL = 100 μL | |
| 1 M 氢氧化钠 | 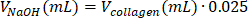 | 0.005 mL = 5 μL | |
| 无菌 H2O | 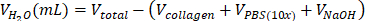 | 0.695 mL = 695 μL | |
表 6:2 mg/mL I 型胶原水凝胶制备所需的试剂体积计算。
4. 通过细胞染色方法鉴定 3D 皮肤模型中的细胞类型
注意:为了确认开发的皮肤模型由预期的细胞组成,最好进行细胞染色。在给定模型22 上执行任何目标实验之前,这是一个关键步骤。在 3D 皮肤模型的情况下,有必要将给定模型嵌入石蜡中,并在细胞染色前准备显微镜载玻片,并在切片机上切割人工组织(步骤 4.1)(图 7)。
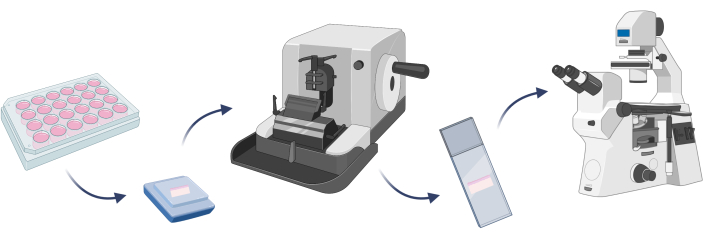
图 7:3D 皮肤模型包埋、细胞染色和显微镜观察的基本步骤。 该图是用 Biorender.com 创建的。 请单击此处查看此图的较大版本。
- 嵌入 3D 皮肤模型
- 用 PBS 在 RT 下洗涤皮肤当量 5 分钟,两次,并使用 PBS 中的 3.7% 多聚甲醛溶液固定(30 分钟,RT)。用 PBS 重复洗涤步骤。
- 包埋前,通过在增加浓度的乙醇溶液中孵育来脱水皮肤等效物:50%(15 分钟)、70%(15 分钟)、96%(2 次,30 分钟)和 99.8%(2 次,30 分钟)。
- 将固定和脱水的皮肤等效物放入填充有石蜡的模具中。
注意: 将等效物放置在适当的方向。 - 用盒盖住模具,并在顶部添加更多石蜡。让它在 RT 下凝固长达 30 分钟。
- 将石蜡包埋的皮肤等效物在 -80 °C 下冷冻至少 1 小时。
- 打开切片机,插入石蜡包埋的皮肤等效物,并切下 5 μm 切片。将切下的人工组织切片放在显微镜载玻片上,并在 37 °C 下干燥至少 8 小时。
- 将载玻片浸入二甲苯中(2 次,10 分钟),然后用降低的乙醇浓度 99.8%(5 分钟)、96%(5 分钟)、70%(5 分钟)和 50%(5 分钟)对载玻片再水化。
- 从乙醇溶液中取出载玻片,用水冲洗两次(5 分钟)。
注:传统的细胞染色是通过应用特定染料(苏木精、伊红23)或使用选择性靶向生物标志物的抗体(包括用于成纤维细胞的胶原蛋白 1A2、用于角质形成细胞的细胞角蛋白 14、用于黑色素细胞的黑色素 A 或酪氨酸酶24)进行的。可以按照不同公司准备的方案进行常规苏木精和伊红染色(步骤 4.2)。另一方面,如果需要免疫荧光或免疫组织化学染色,则程序不同且明显更长(步骤 4.3 和 4.4)。为避免非特异性反应,请使用不同物种产生的一抗,然后使用专用的二抗。
- 3D 皮肤模型的苏木精和伊红染色
- 在 RT 下,将显微镜载玻片在苏木精溶液中染色 3 分钟。
- 在酸化酒精溶液中洗涤载玻片 1 分钟。
注:将 2 mL 35%-38% 盐酸与 98 mL 99.8% 乙醇混合,制备酸化醇溶液。 - 接下来,在 0.1% 碳酸氢钠溶液中洗涤玻片,以获得可见、细腻的蓝紫色。
注:要获得 0.1% 碳酸氢钠溶液,请将 100 mg 碳酸氢钠溶解在 100 mL 超纯水中。 - 用 95% 乙醇洗涤载玻片 1 分钟。
- 在 RT 下将显微镜载玻片在伊红溶液中染色 1 分钟。
- 用 95% 乙醇洗涤载玻片 1 分钟,用 99.8% 乙醇洗涤 2 分钟。
- 用二甲苯洗涤载玻片 2 分钟,每次 2 分钟,两次。
- 安装香脂并在载玻片顶部放置盖玻片。样品已准备好进行显微镜观察。
- 3D 皮肤模型的免疫荧光染色
- 用 PBS 冲洗玻片(5 分钟)。
- 准备封闭溶液(3% 牛血清白蛋白 [BSA] 或脱脂牛奶,加入 0.1% Triton X-100 和 0.1% Tween 20 的 PBS 缓冲液),并在室温下孵育载玻片 1 小时。
- 用 PBS 缓冲液洗涤载玻片两次(5 分钟)。
- 在 PBS 缓冲液中稀释一抗(根据生产商的建议, 表 7),并将载玻片在 RT 下孵育 1-2 小时或在 4 °C 下过夜。
- 用 PBS 缓冲液洗涤载玻片两次(5 分钟)。
- 在 PBS 缓冲液中稀释二抗(根据生产商的建议, 表 7),并在 RT 下孵育载玻片 1 小时。
- 用 PBS 洗涤载玻片两次(5 分钟)。
- 准备用于细胞核染色的染料溶液(例如,Hoechst 33342 或 DAPI, 表 7),并在 RT 下孵育载玻片长达 15 分钟。
- 用 PBS 洗涤载玻片(5 分钟)。
- 封固在香脂中,用盖玻片覆盖切片,并使用荧光显微镜观察细胞染色的效果。
- 3D 皮肤模型的免疫组化染色
- 执行步骤 4.3.1-4.3.5。
- 此外,使用适合二抗偶联酶的缓冲液进行洗涤步骤。
- 在适合偶联酶的缓冲液中稀释二抗(根据生产商的建议),并在 RT 下孵育载玻片 1 小时。
- 用 PBS 洗涤载玻片两次(5 分钟)。
- 为所用酶准备适当底物的溶液,并根据生产商的建议孵育载玻片。
- 用缓冲液洗涤载玻片(5 分钟)并将它们安装在香脂中。
- 使用明场显微镜观察细胞染色的影响。
| 检测到细胞类型/细胞类器官 | 染色剂 | 测定/浓度 | ||
| 肥大细胞 | 亲和素-磺酰罗丹明 101 | 1 微克/毫升 | ||
| 成纤维细胞 | 兔中产生的 Col1A2 抗体 | 1:50 | ||
| 与 FITC 偶联的山羊抗兔二抗 | 1:250 | |||
| 角质形成细胞 | 小鼠中产生的细胞角蛋白 14 抗体 | 1:50 | ||
| 与 FITC 偶联的山羊抗小鼠二抗 | 1:250 | |||
| 黑色素细胞 | 小鼠中产生的 Melan-A 抗体 | 1:50 | ||
| 与 FITC 偶联的山羊抗小鼠二抗 | 1:250 | |||
| 核 | 赫斯特 33342 | 1 微克/毫升 | ||
| DAPI | 1 微克/毫升 | |||
表 7:用于细胞染色的试剂的浓度和稀释度。
结果
在开始在实验室中创建皮肤模型之前,必须决定要使用的细胞类型(原代/细胞系)并为这些细胞选择合适的培养基。大多数细胞库推荐并可以为所有类型的细胞培养提供培养基。在多培养模型的情况下,有必要选择一种适合培养物中存在的所有细胞类型的培养基。用于原代皮肤细胞培养和最常见皮肤细胞系的一些典型细胞培养基收集在表 818、19、20、25、26、27 中。用于原代细胞培养的典型培养基相当昂贵,并且其组成很复杂。另一方面,细胞系通常对成分简单的培养基感到满意。一些细胞类型(主要是成纤维细胞和肥大细胞)可以产生和分泌刺激其他细胞(如角质形成细胞和黑色素细胞)生长的因子28,29。如果计划在模型中存在它们,则无需额外补充培养基。
| 电池类型 | 单元格名称 | 中等 | 参考 | ||||
| 角质形成细胞 | HaCaT cel 生产线 | DMEM、10% FBS、100 U/mL 青霉素、100 μg/mL 链霉素 | 根据卖家的说法 | ||||
| 原代正常人表皮角质形成细胞 (NHEK) | 角质形成细胞生长培养基 2(基础培养基 + 补充剂混合物) | 根据卖家的说法 | |||||
| 原代人表皮角质形成细胞;正常,成人 (HEKa) | 真皮细胞基础培养基、0.4% 牛垂体提取物、0.5 ng/mL rh-转化生长因子-α、6 mM L-谷氨酰胺、100 ng/mL 氢化可的松半琥珀酸酯、5 mg/mL rh-胰岛素、1 mM 肾上腺素、5 mg/mL 载脂蛋白-转铁蛋白、100 U/mL 青霉素(如果需要)、100 μg/mL 链霉素(如果需要) | 根据卖家的说法 | |||||
| 原代角质形成细胞 | DMEM/F-12 (3:1),1% Ultroser G,1 μM 氢化可的松,1 μM 异丙肾上腺素,0.1 μM 胰岛素,1 ng/mL 角质形成细胞生长因子,1% 青霉素-链霉素 | 18 | |||||
| 黑色素细胞 | 原代黑色素细胞 | 培养基 254,不含 PMA 的人黑素细胞生长补充剂-2,1% 抗生素溶液 | 19 | ||||
| 原代黑色素细胞 | RPMI-1640,10% FBS,14.7 μg/mL 酚红溶液,1% L-谷氨酰胺,1% 青霉素/链霉素 | 27 | |||||
| HEMa-LP 细胞系 | 培养基 254、5 μg/mL rh-胰岛素、50 μg/mL 抗坏血酸、6 mM L-谷氨酰胺、1 μM 肾上腺素、1.5 mM 氯化钙、100 U/mL 青霉素(如果需要)、100 μg/mL 链霉素(如果需要) | 根据卖家的说法 | |||||
| 原代正常人表皮黑素细胞 (NHEM) | 黑色素细胞生长培养基(基础培养基 + 补充剂混合物) | 根据卖家的说法 | |||||
| 成纤维细胞 | 原代人 Tenon 成纤维细胞 (HTF) | EMEM、5% FBS、5 ng/mL rh-碱性成纤维细胞生长因子、5 μg/mL rh-胰岛素、50 μg/mL 抗坏血酸、7 mM L-谷氨酰胺、100 U/mL 青霉素、100 μg/mL 链霉素、0.25 μg/mL 两性霉素 B | 28 | ||||
| 初级 HTF,以及 | DMEM、10% FBS、100 U/mL 青霉素、100 μg/mL 链霉素、0.25 μg/mL 两性霉素 B | 20.28 | |||||
| 原代人真皮成纤维细胞 | |||||||
| HFF-1 细胞系 | DMEM、15% FBS、100 U/mL 青霉素、100 μg/mL 链霉素 | 根据卖家的说法 | |||||
| BJ 细胞系 | EMEM、10% FBS、100 U/mL 青霉素、100 μg/mL 链霉素 | 根据卖家的说法 | |||||
| 肥大细胞 | 原代人皮肤肥大细胞 (hsMCs) | IMDM、10% FBS、1% 非必需氨基酸、226 μM α-单硫甘油、100 U/mL 青霉素、100 μg/mL 链霉素 | 20 | ||||
| LAD2 细胞系 | StemPro-34、2.5% StemPro-34 营养补充剂、2 mM L-谷氨酰胺、100 ng/mL rh-干细胞因子、100 U/mL 青霉素、100 μg/mL 链霉素 | 29 | |||||
| HMC-1.1 和 1.2 细胞系 | IMDM、10% FBS、2 mM L-谷氨酰胺、25 mM HEPES、100 U/mL 青霉素、100 μg/mL 链霉素 | 29 | |||||
表 8:用于培养原代皮肤细胞和细胞系的最常用培养基概述。
图例:Dulbecco 最低必需培养基 (DMEM)、Eagle 最低必需培养基 (EMEM)、胎牛血清 (FBS)、营养混合物火腿 F-12 (F12)、Iscove 改良 Dulbecco 培养基 (IMDM)、重组人 (rh)、罗斯威尔公园纪念研究所 (RPMI)。
在本文中,用角质形成细胞、黑素细胞、成纤维细胞和肥大细胞的原代细胞创建了皮肤模型。它们的要求略高于细胞系,用于单细胞培养的推荐培养培养基为:补充的角质形成细胞生长培养基 2(用于角质形成细胞)、补充的培养基 254(用于黑素细胞)、补充的 DMEM 培养基(用于成纤维细胞)和补充的 IMDM 培养基(用于肥大细胞)。在这些培养基上,细胞呈现其分配给其类型的典型形态(代表性图像如图 8 所示)。在两种或多种细胞类型的多重培养的情况下,选择所有培养细胞类型都可以生长的培养基非常重要。经过几次测试,选择含有 10% FBS 和 1% 抗生素混合物的 DMEM 培养基来制备更高级的球体和等效物 3D 模型。
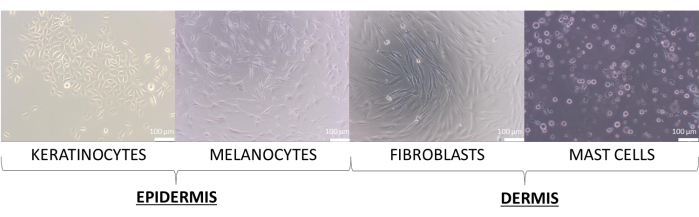
图 8:在 2D 单一培养过程中观察到的皮肤细胞呈现不同的形态。 比例尺:100 μm。 请点击此处查看此图的较大版本。
球体(通常称为球体)是细胞和组织工程研究人员开发的最简单的 3D 模型之一,尽管由皮肤细胞创建的球体并不那么受欢迎。在此模型中,可以创建单一文化和多文化的球体。文献中描述了多种球体制备方法(例如,使用悬滴、限制细胞粘附、磁悬浮、旋转、微流体等)30。由于制备简单、成本低、材料和设备容易获得,前两种方法推荐给三维 (3D) 细胞模型初学者,其性能的协议可以在上面找到(步骤 2.1 和 2.2)。根据文献31,32,这些方法中最重要的参数是细胞数量、细胞悬液体积和孵育时间。
可以用不同数量的细胞创建球体,但应分别针对每种细胞类型以及细胞共培养优化用于接种的细胞密度。对角质形成细胞和成纤维细胞的单一培养进行的优化过程表明,每孔接种 1 x 104 个细胞可为两种细胞类型提供最佳结果。 图 9 中所示的球体是使用限制 U 形底板中细胞粘附的方法制备的(步骤 2.2)。建议至少准备 4 个孔,并进行技术重复(最佳为 6 个孔)。由 1 x 104 个细胞组成的球体更容易操作,因为它们在孔中可见。因此,甚至可以在分析过程中从孔中去除旧培养基,而不会排空球体。在描述的操作之后,球体的形状基本保持不变且可重复。在此过程中,较大球体的稳定性较低。还值得一提的是,不同的细胞类型可以形成不同颜色的球体(例如, 角质形成细胞形成较暗的球体,而成纤维细胞球体明显更浅)。
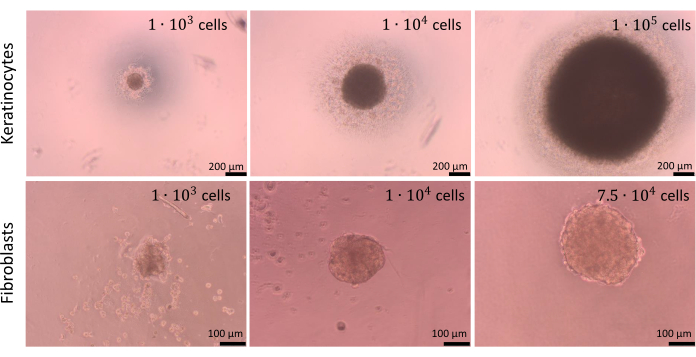
图 9:球体的创建。 由不同类型和数量的皮肤细胞使用限制细胞粘附方法创建的球体。比例尺(顶板):200 μm。比例尺(底板):100 μm。 请点击此处查看此图的较大版本。
如悬滴法(步骤 2.1)中所述,在某个点上,球体需要从盖子转移到孔中。这个过程可能会对球体造成潜在损害。因此,对于此步骤,高精度的工作是必不可少的。如果不小心处理,创建的球体很容易失去适当的形状(图 10)。第一张图片(图 10A)展示了一个四边均圆的良好球体。在第二张和第三张图像(图 10B,C)中观察到球体轻微变形,但细胞聚集体保持圆形。最后三张图片(图 10D-F)显示了球体损伤的不同阶段。需要获得经验才能获得所创建球体形状和结构的可重复性。在第一次尝试开发球体时,建议对没有经验的研究人员使用限制细胞粘附的方法(步骤 2.2),因为它在研究人员活动的影响有限的情况下提供了更具可比性的结果。
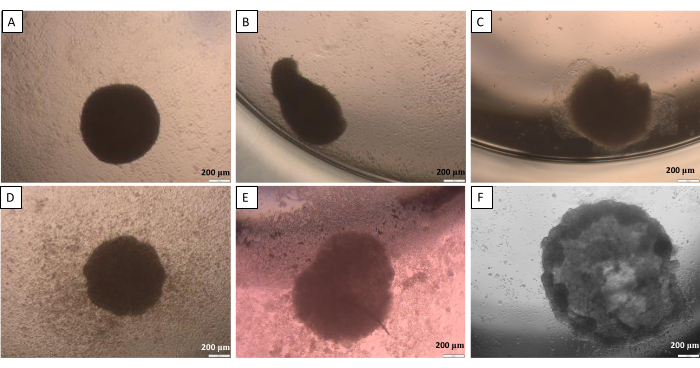
图 10:球体从盖子转移到井中可能遇到的困难 - 悬滴法。(A) 一个好的球体,(B,C) 轻微损坏的球体,(D-F) 高度损坏的球体。转移后 24 小时拍摄图像。比例尺:200 μm。请点击此处查看此图的较大版本。
等效物是比球体更高级的人造皮肤 3D 模型。在构建皮肤模型的过程中,应考虑各个方面,包括模型中的层数(仅表皮、仅真皮、带表皮和角质层的真皮)、使用的细胞类型、应用的材料、等效物的优选大小、将进一步使用的研究类型等14。皮肤等价物可以排列在放置在所需尺寸(96、48、24 孔等)的标准多孔板中的特殊插件中。尽管插件更容易从一个孔转移到另一个孔,并且在介质更换过程中,不会损坏等效插件;它们相当昂贵。如果模型不需要角质层的存在,则更便宜的解决方案是在多孔板的孔中制备等效物。
人工真皮层通常通过使用天然(明胶、胶原蛋白、纤维蛋白、透明质酸、壳聚糖-藻酸盐等)或合成(聚乙二醇二丙烯酸酯和聚乳酸)水凝胶构建为基于支架的模型33。为了与真实的皮肤真皮相似,该层必须主要包含水和一些细胞外基质 (ECM) 成分(包括胶原蛋白或纤连蛋白),这些成分介导细胞结合、细胞间相互作用和其他细胞作用34。在这项研究中,选择了 I 型胶原蛋白,因为它易于以水凝胶的形式制备,其灵活的结构确保了进一步潜在研究活动的便利性(例如,将等效物从一个培养皿转移到另一个培养皿)。从大鼠尾巴获得的 I 型胶原蛋白溶液通常通过粉末溶解在 20 mM 乙酸中来制备。为了实现胶原蛋白聚合步骤,必须提供 6.5-7.5 的适当 pH 条件。这可以通过添加严格量的氢氧化钠来保证。为方便起见,一些公司引入了特定的计算方法,这可能有助于确定制备此类水凝胶所需的确切体积(表 6)。尽管在文献中,水凝胶中会遇到不同浓度的胶原蛋白(例如,0.5-2 mg/mL35;5-30 mg/mL36;低胶原蛋白含量和高胶原蛋白含量37),但在所描述的模型中,使用 2 mg/mL 溶液,因为水凝胶仍然具有柔性结构,但足够紧凑,必要时可以从井中取出。
为了准备一个非常逼真的全层皮肤,应该以可能接近我们体内存在的比例接种等效细胞。在表皮的情况下,根据身体部位的不同,黑色素细胞与相关角质形成细胞池之间的关系约为 1:36,这被定义为表皮黑色素单位 (EMU)38。因此,在人工表皮中的应用比例为 1 个黑色素细胞对 15 个角质形成细胞(表5)。为了创建人造真皮层,使用了 1 型胶原蛋白水凝胶,其中成纤维细胞和肥大细胞以 1 个肥大细胞对 10 个成纤维细胞的比例掺入。通过改变观察到的样品的深度,可以在倒置光学显微镜上实时监测构建等效物的每一层(示例图像如图 11 所示)。
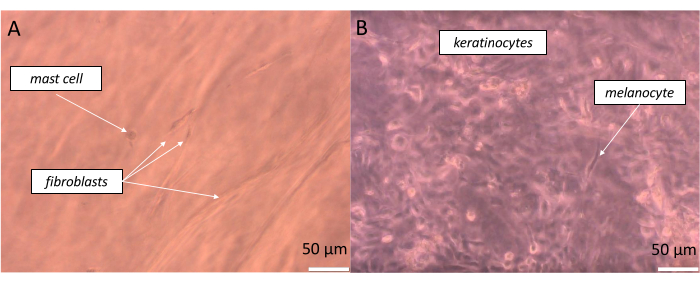
图 11:实时观察所创建的全层皮肤等效物的特定层中的不同细胞。 (A) 假真皮和 (B) 假表皮)通过明场显微镜可视化。比例尺:50 μm。 请点击此处查看此图的较大版本。
通过对等效物进行染色,可以进行更准确的观察,并确认获得模型的预期结构。固定的等效物需要先包埋在石蜡中,然后在切片机上切割。带有薄人工组织的载玻片稍后可以用不同的染料染色,包括苏木精和伊红(在医学实验室进行的基本染色)。由于该作用,可以区分等效物中的人造真皮和表皮,以及识别单个皮肤细胞(图12)。在图 12 中,不仅显示了特定的细胞类型,而且还可以看到处于细胞分裂过程不同阶段(末期和中期)的角质形成细胞。在肥大细胞的情况下,特定颗粒在细胞内很容易识别。这些图像最初证实创建的皮肤等效物是活的(细胞在其中生长),并且它们能够在开发的模型中正常工作。然而,对于皮肤的 3D 表皮和全层模型,检查所获得结构的质量和功能尤为重要。为了检查角质层的通透性,应应用跨上皮电阻 (TEER) 测量或路西法黄染色39,40。此外,在成分适当的人造皮肤中,应存在特异性标志物,包括分化标志物(例如,丝聚蛋白、Involucrin、Loricrin、角蛋白 10、角蛋白 5、包含神经酰胺的脂质类别)、真皮-表皮交界标志物(例如,IV 型胶原蛋白、层粘连蛋白 V、Alpha6Beta4-整合素、BP 抗原)41、表皮层中的紧密连接标志物(例如,密蛋白-1、咬合素、咬合带蛋白 (ZO)-1)42以及基底层增殖标志物 (Ki67)41。

图 12:皮肤细胞形态和功能。 用苏木精和伊红染色的全层皮肤当量中的皮肤细胞形态和功能(观察细胞分裂)概述。比例尺:100 μm(上图)、50 μm(中图,左)、100 μm(中图,右)、50 μm(下图)。 请单击此处查看此图的较大版本。
确认生物标志物存在的最常用方法是进行特异性染色,例如免疫组织化学或免疫荧光。不同的抗体和荧光染料可用于模型中特定细胞的显微镜观察。培养细胞的示例性染色结果如图 13 所示。为了观察角质形成细胞,使用了抗细胞角蛋白 14 的抗体。在黑色素细胞的情况下,它是黑色素 A 特异性抗体。胶原 1A2 抗体用于成纤维细胞染色,与亲和素偶联的荧光磺酰罗丹明 101 检测到肥大细胞中存在的肝素。
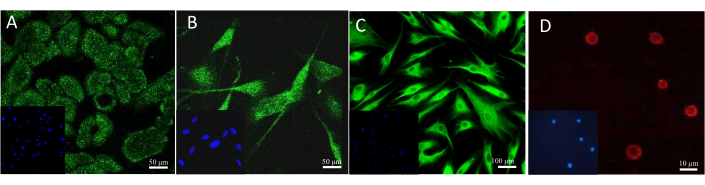
图 13:荧光细胞染色结果。 (A) 角质形成细胞中的细胞角蛋白 14。比例尺:50 μm。(B) 黑色素细胞中的 Melan-A。比例尺:50 μm。(C) 成纤维细胞中的胶原蛋白 1A2。比例尺:100 μm。(D) 肥大细胞中的肝素。比例尺:10 μm。 请点击此处查看此图的较大版本。
讨论
本文介绍了可用于准备自己的高级人工皮肤模型的方法。每当计划的研究需要严格定义的研究模型时,这是一个很好的解决方案,这些模型可能会在市场上不可用或非常昂贵。如前所述,市场上有几种商业皮肤等效物(例如 EpiSkin、EpiDerm FT)。然而,它们的成本(每件 100 至 400 欧元)和交货时间(几天至几周)可能会鼓励研究人员尝试自己准备这样的模型。即使对于没有经验的科学家来说,所提出的程序也很容易执行,同时允许获得非常先进的皮肤模型。值得强调的是,对给定模型的细胞组成的决定完全取决于研究人员。除了创建的模型外,它还可以进一步开发和改进,从而开辟全新的研究前景。对于商业模型,有必要购买不同的等效产品。
尽管 3D 细胞培养物可能具有多种细胞类型、易于处理和可及性,但它们仍然只是人工模型,无法完全重现组织的复杂性和功能(例如,免疫功能、血管形成)。这就是为什么在大多数研究中,需要几个模型来确认获得的结果。 表 9 中收集了这些模型的一些优点和缺点,以及它们的局限性。另一方面,商业模式保证了高质量标准,具有实验的可重复性和实验室之间的数据可比性。为了实施使用新化合物进行研究,肯定有必要购买适当的商业等效物。但在准备阶段,这种自制的皮肤 3D 模型(多细胞型球体或等效物)可以帮助减少需要在商业等效物上进行的实验次数。生成和使用所述模型的目标不是绕过应用认证研究模型的需要,而是促进研究并减少相关费用。
| 模型对比较 | 优势 | 弊 | ||||
| 细胞培养 vs. 动物 | 最大限度地减少动物的痛苦 | 关于测试因子对全身影响的信息有限 | ||||
| 实验标准化程度高 - 结果的可重复性更高 | 单一模型不足以反映体内发生的过程 | |||||
| 对整个生物体无副作用 | - | |||||
| 更好地控制实验条件 | - | |||||
| 自动化的可能性(例如,生物打印) | - | |||||
| 降低成本 | - | |||||
| 所需的样品体积小 | - | |||||
| 产生的废物量有限 | - | |||||
| 3D 与 2D 培养物 | 更好地反映完整的有机体 | 耗时的文化 | ||||
| 可以创建功能性组织 | 成本较高 | |||||
| 可以创建适合所进行研究需求的模型 | 自发形成 3D 结构几乎是不可能的 | |||||
| - | 缺乏量化各种化合物影响的标准化测试 | |||||
| - | 对市场上可用的不同 3D 培养物的访问有限 | |||||
| 细胞系 vs. 原代细胞 | 经过认证和批准的型号 | 只有有限数量的细胞系可用 | ||||
| 实验标准化程度高 - 结果的可重复性更高 | 从同一供体获得多种类型细胞的可能性有限 | |||||
| 更长的使用寿命 | 可能具有天然细胞的改变特性 | |||||
| 相当快的增殖速度 | 细胞功能经常受到干扰 | |||||
| 对多种活动(例如冷冻、离心)不太敏感 | - | |||||
表 9:不同模型在研究中的使用情况比较 - 优点与缺点
几篇文章描述了如何准备 3D 皮肤模型(除了总结市售模型14、43、44 的评论文章外,它们通常侧重于获得球体45 或等效物46 的单一方法)。
在本文中,描述了两种用皮肤细胞形成球体的方法。悬滴法被广泛使用,但在某些情况下其可重复性和稳定性可能不足。大多数步骤都需要特定的操作,例如由于传输过程中液滴中的水分蒸发而导致高速工作。还建议轻柔地移动,因为缺乏这种技能可能会导致细胞聚集体损伤31,32。因此,一种更简单的球体制备方法侧重于限制细胞粘附。缺乏良好的细胞附着表面会促进细胞之间的相互作用。结果,产生了细胞聚集体。它的可重复性要高得多,因为不需要球体转移。通过这些方法,将创建球体的最佳皮肤细胞数量确定为 1 x 104 个细胞/球体。
接下来,展示了描述皮肤等效物制备的程序。它们在研究中的外观和功能可能在很大程度上取决于构建它们的元素,包括细胞(表 2)、支架和培养基。用于制备人造皮肤的 3D 支架可分为合成水凝胶和由天然来源形成的水凝胶。根据用于组成水凝胶的材料及其特性,可能需要额外补充培养基。合成水凝胶需要将生物活性分子(蛋白质、酶和生长因子)掺入合成水凝胶网络,以介导特定的细胞功能47。文献中介绍的实现生长因子受控递送到水凝胶的主要方法包括直接加载、静电相互作用、共价结合和使用载体48。由 ECM 蛋白和聚合物等天然来源形成的水凝胶可以在整个 3D 支架中产生流体通路,加速营养物质的分布;因此,无需额外添加培养基。研究表明,小分子(如细胞因子和生长因子)和大分子(包括糖胺聚糖和蛋白聚糖)可以通过扩散通过 ECM 运输47。然而,氧、营养物质和其他生物活性分子的分子扩散可能会受到 ECM 水凝胶本身特性的阻碍。较低的扩散与较高的水凝胶厚度相关,但也与非常高浓度的胶原蛋白相关37。在这项研究中,为了创建皮肤等效物,使用了等于 2 mg/mL 的低胶原蛋白浓度,这表明通过水凝胶的分子扩散应该是良好且快速的。因此,在此阶段没有向培养基或水凝胶本身提供额外的补充。为了模拟真皮,将肥大细胞和成纤维细胞 (1:10) 嵌入胶原水凝胶中。接下来,将黑色素细胞和角质形成细胞 (1:15) 接种到水凝胶上,并在培养基中培养整个等效物。值得一提的是,该基础培养基由几种氨基酸、无机酸和维生素组成,还补充有血清(由多种组成:细胞、脂质、激素、营养物质和能量来源的生长和附着因子、载体、结合和转移蛋白等)。为了获得表皮的适当结构,应在一定时间向培养基中添加不同的补充剂。启动表皮分化的最重要刺激物是钙,因为它激活细胞内信号传导。抗坏血酸刺激与钙介导的信号通路相似的信号通路,但其作用还伴随着抗坏血酸转运的增强和亲水性抗氧化剂消耗的预防41。此外,当向培养基中添加其他成分(如咖啡因、氢化可的松、三碘甲状腺原氨酸、腺嘌呤和霍乱毒素)时,细胞分化得到改善41,44。重要的是,应始终检查制备的模型在适当的层中是否存在给定的细胞类型。通过 H&E 染色在创建的等效物的结构中证实了所有四种类型皮肤细胞的存在。
遇到的最常见的问题是处理所获得模型时的细腻和直觉。一些困难可能与细胞球的形成以及水凝胶制备有关。在细胞培养过程中,还可能出现其他几个问题;这些因素包括微生物感染、细胞增殖率低、模型中使用的原代细胞老化、从原代细胞与细胞系重建的 2D 和 3D 模型的最大培养时间等。 在表 10 中,收集了一些关于遇到以下问题之一时该怎么做的实用建议。
| 细胞培养中的常见问题 | 建议 | |||
| 微生物感染 | 如果其中一个装有细胞的培养瓶/培养皿中发生微生物感染,最好尽快去除受感染的培养物(不要用细胞污染剩余的培养瓶/培养皿)。重新冷冻带有细胞的新小瓶。 如果感染复发,最好尝试扩大所应用抗生素的光谱并增加其浓度。 | |||
| 细胞增殖率低 | 有些细胞的倍增时间很长。为了刺激它们的增殖,可以在基础培养基中添加几种细胞特异性生长因子。此外,增加基础培养基中 FBS 或 L-谷氨酰胺的浓度可能有助于刺激细胞的生长。 | |||
| 模型中使用的原代细胞的老化 | 几次传代后,原代细胞进入衰老并停止分裂。为了在模型中克服这个问题,建议使用尽可能早期传代的细胞来构建模型。 | |||
| 从原代细胞与细胞系重建的 2D 和 3D 模型的最大培养时间 | 模型的培养时间在很大程度上取决于所用细胞的类型。对于原代细胞,由于寿命短,培养时间会更短。 | |||
| 细胞球形成的困难 | 有些细胞可能需要更长的时间才能形成球体。如果几天后球体仍未形成,请从样品中收集细胞并检查其活力,例如台盼蓝染色。 | |||
| 球体稳定性问题 | 如果球体不稳定并在处理时被破坏,请尝试从较少数量的单元中创建球体。确保始终轻轻地转移球体生长的培养皿。 | |||
| 水凝胶制备的困难 | 检查成分(水、PBS [10x]、NaOH、1 型胶原蛋白)的比例是否正确。胶原蛋白的储备溶液通常非常稠密,因此请确保缓慢移液。气泡会扰乱水凝胶的形态,因此凝胶的反向移液可能有助于解决这个问题。 | |||
表 10:细胞培养故障排除
制造后建立的模型可用于多个领域,首先是 (1) 用于药物和化妆品的具有生物活性的新型化合物的细胞毒性和遗传毒性实验49,(2) 各种因子刺激实验50,(3) 基础研究增加了我们对皮肤细胞、它们的生物学功能、与其他细胞和环境的相互作用的了解51,52,(4) 对选定的疾病实体的研究,其中特定类型的细胞可以被引入到创建的模型中(癌细胞、给定基因突变的细胞等 14,53)等等。毋庸置疑,这些模型的应用符合 3R 原则,即在产品测试和科学研究中更合乎道德地使用动物,并且不违反化妆品动物测试的禁止法。
披露声明
作者声明没有利益冲突。
致谢
作者感谢华沙理工大学以两项资助的形式从“卓越倡议 - 研究型大学”计划中提供的财政支持:POB BIB BIOTECHMED-2 start(编号 1820/2/ZO1/POB4/2021)和学生研究小组校长资助(SKIN-ART,编号 1820/116/Z16/2021)。此外,作者要感谢华沙理工大学化学学院药物和化妆品生物技术主席 Joanna Cieśla 教授以及生物技术科学俱乐部“Herbion”提供的支持。特别感谢 Michał Stepulak 博士提供化合物 Pluronic F-127。
材料
| Name | Company | Catalog Number | Comments |
| 24-well plate for adherent cell culture | Biologix Europe GmbH | 07-6024 | - |
| 35%–38% HCL | Chempur | 115752837 | - |
| 60 mm cell culture Petri dish | Nest | 705001 | - |
| Avidin−Sulforhodamine 101 | Sigma Aldrich | A2348-5MG | - |
| Bright-field inverted microscope | Olympus | CKX41 | - |
| Calcium chloride | Avantor | 874870116 | - |
| Cell culture flask T75 for adherent cells | Genoplast | G77080033 | - |
| Centrifuge tube 15 mL | GoogLab Scientific | G66010522 | - |
| CO2 Incubator | Heal Force | Galaxy 170R | - |
| Col1A2 antibody produced in rabbit | Novus | NBP2-92790 | - |
| Corning(R) Transwell(R) Polycarbonate | Corning | CLS3422-48EA | - |
| Cytokeratin 14 antibody produced in mouse | Novus | NBP1-79069 | - |
| DPX Mountant for histology | Sigma Aldrich | 06522-100ML | - |
| Dulbecco's Modified Eagle Medium (DMEM) | VWR Chemicals | L0102-500 | - |
| Eosine Y | Kolchem | - | 0.5 % aquatic solution |
| Eppendorf tube 1.5 mL | Sarstedt | 72.690.001 | - |
| Eppendorf tube 2 mL | Sarstedt | 72.691 | - |
| Ethyl alcohol absolute 99.8% | Avantor | 396480111 | diluted in ultrapure water to the needed concentrations |
| Fetal bovine serum | Gibco | 10270106 | - |
| Fluorescent inverted microscope | Olympus | IX71 | - |
| Goat anti-mouse secondary antibody conjugated with FITC | Sigma Aldrich | F0257-1mL | |
| Goat anti-rabbit secondary antibody conjugated with FITC | Novus | NB7159 | - |
| Harris Hematoxylin | Kolchem | - | 1 mg/mL in 95% ethanol |
| Hoechst 33342 | ThermoFisher | H3570 | - |
| Laminar chamber | Heal Force | HFSafe-1200 | - |
| Melan-A antibody produced in mouse | Santa Cruz Biotechnology | sc-20032 | - |
| Microtome | Microm | HM355S | - |
| NaOH | Avantor | 810981997 | - |
| Paraffin pastilles | Sigma Aldrich | 1.07164 | - |
| Paraformaldehyde | Sigma Aldrich | 1581227 | - |
| Penicillin/Streptomycin solution | Sigma Aldrich | P4333 | - |
| Pipette tip, 1000 µL | Sarstedt | 70.305 | - |
| Pipette tip, 20 µL | Sarstedt | 70.3021 | - |
| Pipette tip, 200 µL | Sarstedt | 70.303 | - |
| Pluronic F-127 | BASF | 50401036 | - |
| Serological pipette 10 mL | GoogLab Scientific | G33270011 | - |
| Serological pipette 25 mL | GoogLab Scientific | G33280011 | - |
| Serological pipette 5 mL | GoogLab Scientific | G33260011 | - |
| Sodium bicarbonate | Sigma Aldrich | S5761 | - |
| Sodium bicarbonate | Chempur | 118105307 | |
| Trypsin-EDTA 0.25% solution, phenol red | Sigma Aldrich | 25200072 | - |
| Type 1 collagen | IBIDI | 50201 | - |
| U-bottom 96-well plate | Sarstedt | 83.3925500 | - |
| Xylene | Sigma Aldrich | 534056 | - |
参考文献
- Farage, M. A., Miller, K. W., Elsner, P., Maibach, H. I. Characteristics of the aging skin. Advances in Wound Care. 2 (1), 5-10 (2013).
- Zhu, H., Alikhan, A., Maibach, H. I. Biology of Stratum Corneum: Tape Stripping and Protein Quantification. Textbook of Aging Skin. Farage, M. A., Miller, K. W., Maibach, H. I. , Springer Berlin Heidelberg. Berlin, Heidelberg. (2015).
- Boer, M., Duchnik, E., Maleszka, R., Marchlewicz, M. Structural and biophysical characteristics of human skin in maintaining proper epidermal barrier function. Postepy Dermatogogii I Alergologii. 33 (1), 1-5 (2016).
- De Falco, M., Pisano, M. M., De Luca, A. Embryology and Anatomy of the Skin. In Skin Cancer: A Practical Approach. Current Clinical Pathology. Baldi, A., Pasquali, P., Spugnini, E. P. , Springer. New York. (2014).
- Dehdashtian, A., Stringer, T. P., Warren, A. J., Mu, E. W., Amirlak, B., Shahabi, L. Anatomy and Physiology of the Skin. Melanoma: A Modern Multidisciplinary Approach. Riker, A. I. , Springer International Publishing: Cham. 15-26 (2018).
- Graham, H. K., Eckersley, A., Ozols, M., Mellody, K. T., Sherratt, M. J. Human Skin: Composition, Structure and Visualisation Methods. Skin Biophysics; Studies in Mechanobiology, Tissue Engineering, and Biomaterials. Limbert, G. 22, Springer International Publishing: Cham. 1-18 (2019).
- Piasek, A. M., Musolf, P., Sobiepanek, A. Aptamer-based advances in skin cancer research. Current Medicinal Chemistry. 30 (8), 953-973 (2023).
- Bergfeld, W. F., Belsito, D. V., Marks, J. G., Andersen, F. A. Safety of ingredients used in cosmetics. Journal of the American Academy of Dermatology. 52 (1), 125-132 (2005).
- Hubrecht, R. C., Carter, E. The 3Rs and humane experimental technique: Implementing change. Animals. 9 (10), 754(2019).
- Sreedhar, D., Manjula, N., Ajay, P., Shilpa, P., Ligade, V. Ban of cosmetic testing on animals: A brief overview. International Journal of Current Research and Review. 12 (14), 113-116 (2020).
- Silva, R. J., Tamburic, S. A state-of-the-art review on the alternatives to animal testing for the safety assessment of cosmetics. Cosmetics. 9 (5), 90(2022).
- Xu, Y., Shrestha, N., Préat, V., Beloqui, A. An overview of in vitro, ex vivo and in vivo models for studying the transport of drugs across intestinal barriers. Advanced Drug Delivery Reviews. 175, 113795(2021).
- Boelsma, E., Ponec, M. Basics (Guidelines) on Cell Culture Testing for Topical/Dermatological Drugs/Products and Cosmetics With Regard to Efficacy and Safety of the Preparations. In Dermatopharmacology of Topical Preparations. Gabard, B., Surber, C., Elsner, P., Treffel, P. , Springer Berlin Heidelberg. Berlin, Heidelberg. 37-57 (2000).
- Suhail, S., Sardashti, N., Jaiswal, D., Rudraiah, S., Misra, M., Kumbar, S. G. Engineered skin tissue equivalents for product evaluation and therapeutic applications. Biotechnology Journal. 14 (7), 1900022(2019).
- Sobiepanek, A., et al. Novel diagnostic and prognostic factors for the advanced melanoma based on the glycosylation-related changes studied by biophysical profiling methods. Biosensors and Bioelectronics. 203, 114046(2022).
- Yang, H., Sun, L., Liu, M., Mao, Y. Patient-derived organoids: A promising model for personalized cancer treatment. Gastroenterology Report. 6 (4), 243-245 (2018).
- Baran, J., et al. Mast cells as a target-A comprehensive review of recent therapeutic approaches. Cells. 12 (8), 1187(2023).
- Kosten, I. J., Buskermolen, J. K., Spiekstra, S. W., de Gruijl, T. D., Gibbs, S. Gingiva equivalents secrete negligible amounts of key chemokines involved in langerhans cell migration compared to skin equivalents. Journal of Immunology Research. 2015, 627125(2015).
- cieżyńska, A., et al. A novel and effective method for human primary skin melanocytes and metastatic melanoma cell isolation. Cancers. 13 (24), 6244(2021).
- Kröger, M., et al. In vivo non-invasive staining-free visualization of dermal mast cells in healthy, allergy and mastocytosis humans using two-photon fluorescence lifetime imaging. Scientific Reports. 10 (1), 14930(2020).
- Liu, D., Chen, S., Win Naing, M. A review of manufacturing capabilities of cell spheroid generation technologies and future development. Biotechnology and Bioengineering. 118 (2), 542-554 (2021).
- Rossi, A., Appelt-Menzel, A., Kurdyn, S., Walles, H., Groeber, F. Generation of a three-dimensional full thickness skin equivalent and automated wounding. Journal of Visualized Experiments: JoVE. (96), e52576(2015).
- Kim, K., Kim, J., Kim, H., Sung, G. Y. Effect of α-lipoic acid on the development of human skin equivalents using a pumpless skin-on-a-chip model. International Journal of Molecular Sciences. 22 (4), 2160(2021).
- Curto, E. V., Lambert, G. W., Davis, R. L., Wilborn, T. W., Dooley, T. P. Biomarkers of human skin cells identified using DermArray DNA arrays and new bioinformatics methods. Biochemical and Biophysical Research Communications. 291 (4), 1052-1064 (2002).
- Godwin, L. S., et al. Isolation, culture, and transfection of melanocytes. Current Protocols in Cell Biology. 63, 1-20 (2014).
- Przekora, A., Zarnowski, T., Ginalska, G. A simple and effective protocol for fast isolation of human tenon's fibroblasts from a single trabeculectomy biopsy - a comparison of cell behaviour in different culture media. Cellular & Molecular Biology Letters. 22, 5(2017).
- Rådinger, M., Jensen, B. M., Kuehn, H. S., Kirshenbaum, A., Gilfillan, A. M. Generation, Isolation, and Maintenance of Human Mast Cells and Mast Cell Lines Derived from Peripheral Blood or Cord Blood. Current Protocols in Immunology. Coligan, J. E., Bierer, B. E., Margulies, D. H., Shevach, E. M., Strober, W. , John Wiley & Sons, Inc. Hoboken, NJ. (2010).
- Artuc, M., Muscha Steckelings, U., Henz, B. M. Mast cell-fibroblast interactions: Human mast cells as source and inducers of fibroblast and epithelial growth factors. Journal of Investigative Dermatology. 118 (3), 391-395 (2002).
- Panos, R. J., Rubin, J. S., Csaky, K. G., Aaronson, S. A., Mason, R. J. Keratinocyte growth factor and hepatocyte growth factor/scatter factor are heparin-binding growth factors for alveolar type ii cells in fibroblast-conditioned medium. Journal of Clinical Investigation. 92 (2), 969-977 (1993).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Threedimensional cell culture: A powerful tool in tumor research and drug discovery (Review). Oncology Letters. 14 (6), 6999-7010 (2017).
- Amaral, R. L. F., Miranda, M., Marcato, P. D., Swiech, K. Comparative analysis of 3D bladder tumor spheroids obtained by forced floating and hanging drop methods for drug screening. Frontiers in Physiology. 8, 605(2017).
- Gao, B., Jing, C., Ng, K., Pingguan-Murphy, B., Yang, Q. Fabrication of three-dimensional islet models by the geometry-controlled hanging-drop method. Acta Mechanica Sinica. 35 (2), 329-337 (2019).
- Zhang, C., et al. 3D culture technologies of cancer stem cells: Promising ex vivo tumor models. Journal of Tissue Engineering. 11, (2020).
- Sobiepanek, A., Paone, A., Cutruzzolà, F., Kobiela, T. Biophysical characterization of melanoma cell phenotype markers during metastatic progression. European Biophysics Journal: EBJ. 50 (3-4), 523-542 (2021).
- Jin, G. -Z., Kim, H. -W. Effects of Type I collagen concentration in hydrogel on the growth and phenotypic expression of rat chondrocytes. Tissue Engineering and Regenerative. 14 (4), 383-391 (2017).
- Osidak, E. O., et al. Concentrated collagen hydrogels: A new approach for developing artificial tissues. Materialia. 20, 101217(2021).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: Characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Jimbow, K., Salopek, T. G., Dixon, W. T., Searles, G. E., Yamada, K. The epidermal melanin unit in the pathophysiology of malignant melanoma. The American Journal of Dermatopathology. 13 (2), 179-188 (1991).
- Van Den Bogaard, E., et al. Perspective and consensus opinion: Good practices for using organotypic skin and epidermal equivalents in experimental dermatology research. Journal of Investigative Dermatology. 141 (1), 203-205 (2021).
- Bednarek, R. In vitro methods for measuring the permeability of cell monolayers. Methods and Protocols. 5 (1), 17(2022).
- Idrees, A., et al. Fundamental in vitro 3D human skin equivalent tool development for assessing biological safety and biocompatibility - towards alternative for animal experiments. 4 Open. 4, (2021).
- Park, H. -Y., Kweon, D. -K., Kim, J. -K. Upregulation of tight junction-related proteins by hyaluronic acid in human HaCaT keratinocytes. Bioactive Carbohydrates and Dietary Fibre. 30, 100374(2023).
- Choudhury, S., Das, A. Advances in generation of three-dimensional skin equivalents: Pre-clinical studies to clinical therapies. Cytotherapy. 23 (1), 1-9 (2021).
- Zhang, Z., Michniak-Kohn, B. B. Tissue engineered human skin equivalents. Pharmaceutics. 4 (1), 26-41 (2012).
- Woappi, Y., Altomare, D., Creek, K. E., Pirisi, L. Self-assembling 3D spheroid cultures of human neonatal keratinocytes have enhanced regenerative properties. Stem Cell Research. 49, 102048(2020).
- Ouwehand, K., Spiekstra, S. W., Waaijman, T., Scheper, R. J., de Gruijl, T. D., Gibbs, S. Technical advance: Langerhans cells derived from a human cell line in a full-thickness skin equivalent undergo allergen-induced maturation and migration. Journal of Leukocyte Biology. 90 (5), 1027-1033 (2011).
- Akther, F., Little, P., Li, Z., Nguyen, N. -T., Ta, H. T. Hydrogels as artificial matrices for cell seeding in microfluidic devices. RSC Advances. 10 (71), 43682-43703 (2020).
- Silva, A. K. A., Richard, C., Bessodes, M., Scherman, D., Merten, O. -W. Growth factor delivery approaches in hydrogels. Biomacromolecules. 10 (1), 9-18 (2009).
- Lee, H. -R., et al. Effect of Aronia extract on collagen synthesis in human skin cell and dermal equivalent. Oxidative Medicine and Cellular Longevity. 2022, 4392256(2022).
- Mulder, P. P. G., Raktoe, R. S., Vlig, M., Elgersma, A., Middelkoop, E., Boekema, B. K. H. L. Full skin equivalent models for simulation of burn wound healing, exploring skin regeneration and cytokine response. Journal of Functional Biomaterials. 14 (1), 29(2023).
- Goncalves, K., et al. Investigation into the effect of skin tone modulators and exogenous stress on skin pigmentation utilizing a novel bioengineered skin equivalent. Bioengineering & Translational Medicine. 8 (2), 10415(2023).
- Michel, M., L'Heureux, N., Pouliot, R., Xu, W., Auger, F. A., Germain, L. Characterization of a New Tissue-Engineered Human Skin Equivalent with Hair. In Vitro Cellular & Developmental Biology. Animal. 35 (6), 318-326 (1999).
- Müller, I., Kulms, D. A 3D organotypic melanoma spheroid skin model. Journal of Visualized Experiments: JoVE. (135), e57500(2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。