Method Article
2次元(2D)単一培養から3次元(3D)多文化まで、さまざまな用途に対応するスキンモデルの構築
* これらの著者は同等に貢献しました
要約
ここでは、細胞培養ラボでの日常的な研究のためのさまざまな3Dスキンモデルを導入するための安価で簡単な手順を紹介します。研究者は、市販のモデルに頼ることなく、自分のニーズに合わせたモデルを作成することができます。
要約
皮膚の複雑な構造と重要な機能のために、それは化粧品、製薬、および医療業界にとって興味深い研究モデルです。欧州連合(EU)では、化粧品とその成分の動物実験が全面的に禁止されています。医学や医薬品の場合、この可能性も常に限られています。3Rの原則に従って、人工的に作成されたモデル上で個々の化合物だけでなく、全体の製剤をテストすることがますます一般的になっています。最も安価で最も広く使用されているのは2Dモデルで、これは細胞単層で構成されていますが、組織内の細胞間の実際の相互作用を反映していません。市販の3Dモデルは組織をよりよく表現していますが、大規模には使用されていません。これは、高価で待ち時間がかなり長く、利用可能なモデルが通常使用されるものだけに制限されることが多いためです。
実施した研究をより高いレベルに引き上げるために、さまざまな3Dスキンモデル製剤の手順を最適化しました。記載されている手順は、細胞培養のさまざまな経験を持つ多くの研究室や研究者が適用できるため、安価で簡単に調製できます。
概要
皮膚は、この複雑な臓器の適切な機能と恒常性を明らかにする多細胞相互作用を伴う連続構造です。それは形態学的に異なる層から構築されています:内側の層 - 真皮、そして外側の層 - 表皮。表皮の上に、角質層(平らにされた死んだ細胞 - 角質細胞からなる)をさらに区別し、外部環境に対して最大の保護を提供します。皮膚の最も重要な受動的および能動的機能のいくつかは、外的要因に対する身体の保護、免疫学的プロセスへの参加、分泌、吸収、体温調節、およびセンシング1,2,3です。それは体内で最大の臓器の1つと考えられているため、さまざまな病原体、アレルゲン、化学物質、および紫外線(UV)放射との接触を避けることは不可能です。したがって、特定の機能を持つ多くの種類の細胞で構成されています。表皮に存在する細胞の主な種類は、ケラチノサイト(全細胞のほぼ90%、表皮の深部に構造的および免疫学的機能を持つが、後に角質化プロセスを経て表皮の最上層の角質細胞に変わる)、メラノサイト(表皮細胞集団のわずか3%〜7%で、UV保護色素メラニンを産生する)およびランゲルハンス細胞(免疫系から)です。真皮の場合、主な細胞は線維芽細胞(成長因子とタンパク質を産生する)、樹状細胞、および肥満細胞(免疫系の細胞タイプ)である4,5,6。さらに、皮膚にはいくつかの細胞外タンパク質(I型およびIV型コラーゲン、フィブロネクチン、ラミニンなど)が備わっています。図1)タンパク質繊維(コラーゲンとエラスチン)は、皮膚の特定の構造を確保するだけでなく、細胞結合、細胞接着、およびその他の相互作用を促進します7。
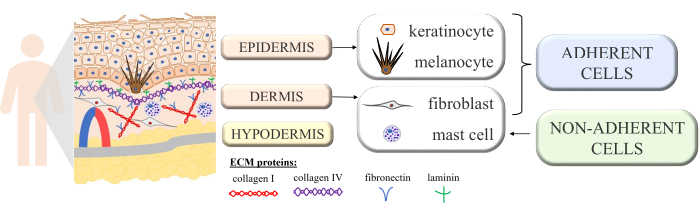
図 1: スキン構造を示す概略図。 皮膚の構造は、その個々の層で発生する4つの基本的な細胞タイプを示し、細胞外マトリックスのタンパク質を区別しました。この図はMS PowerPointで作成されました。 この図の拡大版を表示するには、ここをクリックしてください。
化粧品や医薬品の安全性は非常に重要な問題であり、消費者と患者の健康を保護することは優先事項です8。最近まで、動物で行われた研究を含む多数のテストによって保証されることになっていました。残念ながら、これらはしばしば抜本的な方法の使用を必要とし、研究目的で使用される動物(多くの場合、マウス、ラット、ブタ)に痛みと苦しみを引き起こしました。1959年、人道的実験技術の原則(3Rの原則)が導入されました:(1 - 交換)研究中の動物を in vitro、 in sillico、 または ex vivo モデルに置き換える、(2 - 削減)研究に使用する動物の数を減らす、(3 - 改良)研究にまだ必要な動物の健康を改善すると同時に、開発された代替方法を改善する9.さらに、欧州連合(EU)では、動物に対する化粧品試験は法律で規制されています。2004年9月11日から、動物実験による化粧品の禁止が施行されました。2009年3月11日、EUは化粧品原料の動物実験を禁止しました。新たに動物実験された成分で作られた化粧品の販売は許可されていませんでした。しかし、反復投与毒性、生殖毒性、トキシコキネティクスなどの複雑なヒトの健康問題について、動物で製品をテストすることは依然として許容されていました。2013年3月11日以降、EUでは、完成品またはその成分が動物実験された化粧品の販売は違法です10。そのため、現在、美容学では、 in vitro (細胞)、ex vivo (実組織)、 in vivo (ボランティア)の3つのレベルで研究が行われています11。医薬品の場合、動物実験の必要性は依然として残っています。ただし、大幅に削減され、厳密に管理されています12。
動物実験の代替方法として、また新規有効成分の有効性の初期評価には、 in vitro 皮膚細胞培養が使用されます。さまざまな種類の皮膚細胞を分離し、無菌の実験室条件でそれらを培養することで、活性物質の安全性と毒性を評価できます。また、皮膚細胞株は、認定企業から販売されており、その結果を異なる研究室で比較できるため、研究のモデルとして広く認識されています。これらの試験は通常、ヒト皮膚細胞の単一培養の単純な2Dモデルで実施されます。より高度なモデルのいくつかは、それらの共培養(例えば、線維芽細胞を有するケラチノサイトおよびメラノサイトを有するケラチノサイトなど)であり、ならびに、足場フリー培養(球体)および表皮、真皮、あるいは皮膚の全層代替品の足場ベースの皮膚同等物を含む3次元モデルである13。最後のタイプ(皮膚同等物)を除いて、残りは市販されておらず、必要に応じて科学者が自分で準備する必要があることに言及する価値があります。
これらのモデルの多くが維持され、今日では日常的に販売されていますが(表1)、ほとんどの結果を検証するためには常に追加のモデルが必要です。したがって、新たに設計されたモデルは、人体で起こっている実際の相互作用をよりよく再現する必要があります。このようなモデルを形成するために異なる種類の細胞の混合物を用いると、生体 内で の組織の多細胞性側面の再現が達成できます。その結果、器官型培養物が開発されます(図2)。
| 名前 | 形容 | |||||
| 普通肌 | エピスキン | 再構築されたヒト表皮 - コラーゲン膜上のケラチノサイト | ||||
| スキンエシックRHE | 再構築されたヒト表皮 - ポリカーボネート膜上のケラチノサイト | |||||
| スキンエシック RHE-LC | ヒト表皮モデルランゲルハンス細胞 - ポリカーボネート膜上のケラチノサイトとランゲルハンス細胞 | |||||
| SkinEthic RHPEの | 再構築されたヒト色素性表皮 - ポリカーボネート膜上のケラチノサイトとメラノサイト | |||||
| Tスキン | 再構築されたヒト全層皮膚モデル - ポリカーボネート膜上に成長した線維芽細胞の層上のケラチノサイト | |||||
| フェニオンFTスキンモデル | ハイドロゲル中のケラチノサイトと線維芽細胞 | |||||
| 病気のある肌 | メラノーマFTスキンモデル | 正常なヒト由来のケラチノサイトおよびヒト悪性黒色腫細胞株A375の線維芽細胞 | ||||
| 乾癬組織モデル | 正常なヒトケラチノサイトと線維芽細胞 | |||||
表1:さまざまな研究で最も人気のある市販の皮膚同等物。
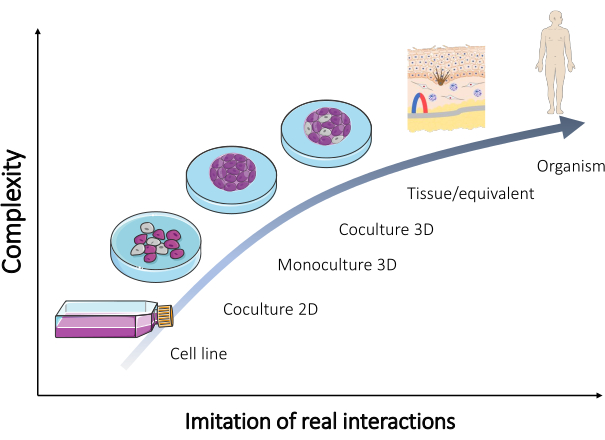
図2:さまざまな in vitro モデルの複雑さ。 生物を再現するためのさまざまな in vitro モデルの複雑さと、人体で直接発生する実際の相互作用との関係。この図は、セルヴィエ(https://smart.servier.com/)のセルヴィエメディカルアートのセット「微生物学と細胞培養」から変更されています。この図の拡大版を表示するには、ここをクリックしてください。
商用の同等物の最も重要な制限の1つは、数種類の細胞(通常は1〜2個、まれに3個)を持つ非常に一般的な研究モデルのみが利用できることです。それでも、皮膚にはさらに多くの細胞が存在し、それらの相互作用により、さまざまな成分の耐性が良好または悪くなる可能性があります14。一部の免疫成分が不足していると、免疫療法を含むいくつかの種類の研究でその価値が低下する可能性があります。黒色腫は、転移が早期に発症し、適用された治療に対する頻繁な耐性により生命を脅かす皮膚がんです15。人工皮膚モデルを改善するために、研究者は免疫細胞と細胞株およびオルガノイドとの共培養を確立しようと試みています16、これは研究されたモデルの大きな改善と考えられています。例えば、肥満細胞は、皮膚における多くの生理学的(創傷治癒、組織リモデリング)および病理学的(炎症、血管新生、および腫瘍進行)プロセスに関与している17。したがって、モデル内でのそれらの発生は、調査対象の化合物に対するモデルの応答を大幅に変化させる可能性があります。最後に、肌に関する情報はまだたくさん欠けており、それは基礎研究を行うことによってのみ発見することができます。そのため、さまざまな人工皮膚モデル(表2)を作成し、改良することが非常に重要な取り組みです。この記事では、球体やスキン同等物など、高度なスキン モデルを作成するためのいくつかの手順について説明します。
| in vitro 皮膚モデル | 組織内で発生する相互作用の再現を試みる | 使用したセルの例 |
| 2Dまたは3D細胞培養 | 表皮 | ケラチノサイト |
| メラノサイト | ||
| ケラチノサイト + メラノサイト | ||
| 真皮 | 線維芽細胞 | |
| 肥満細胞 | ||
| 線維芽細胞+肥満細胞 | ||
| 皮膚 | ケラチノサイト+線維芽細胞 | |
| ケラチノサイト+マスト細胞 | ||
| メラノサイト + 線維芽細胞 | ||
| メラノサイト + マスト細胞 | ||
| ケラチノサイト + 線維芽細胞 + メラノサイト | ||
| ケラチノサイト + 線維芽細胞 + 肥満細胞 |
表2:2Dおよび3D培養で皮膚組織を再現するための細胞型混合物の例。
プロトコル
この研究は、ヘルシンキ宣言のガイドラインに従って実施され、ワルシャワ医科大学の倫理委員会 (KB/7/2022) によって承認されました。インフォームドコンセントは、研究に関与するすべての被験者から得られました。
注:高度な皮膚モデル調製物に記載されている手順は、市販の初代皮膚細胞および細胞株のいずれかを使用して、または患者から単離された初代細胞を用いて実施することができる。市販のセルには関連文書が付属しており、ほとんどの国での研究での使用には追加の承認は必要ありません。ただし、一部の国では義務であるため、地方倫理委員会の規則で確認する必要があります。患者から単離された初代細胞を研究に使用する必要がある場合、まず、研究は地元の倫理委員会によって承認されなければならず、それは彼らの厳格なガイドラインに従って実施される必要があります。さらに、書面によるインフォームドコンセントは、すべての皮膚組織ドナーから収集する必要があります。初代皮膚細胞の単離は本稿の主題ではなかったが、例示的な単離手順は、Kostenら(ケラチノサイト)18、Ścieżyńskaら(メラノサイト)19、Krögerら(線維芽細胞および肥満細胞)20に見出すことができる。正常な皮膚細胞と細胞株のほとんどは、BSL1クラスの安全性レベルを持っています。彼らは脅威を引き起こさない。ただし、使用される実験装置は、制御された条件下での動物およびヒトの細胞培養の基準を満たす必要があります。
1. 皮膚細胞培養
注:皮膚細胞の培養は、接着細胞または浮遊細胞専用のフラスコ(細胞の種類によって異なります)で、インキュベーター内で37°C、二酸化炭素含有量5%で実施する必要があります。それらの栽培および研究のための使用に関連する活動は、無菌状態を必要とし、紫外線C(UVC)に15〜30分間さらされた後、層流チャンバーで行わなければなりません。細胞懸濁液を採取し、それを用いて二次元モデルおよび三次元モデルを作成するには、細胞の種類に応じた手順を実施する必要があります(ケラチノサイト、線維芽細胞、メラノサイトなどの接着細胞の場合はステップ1.1、肥満細胞の非接着細胞の場合はステップ1.2)(図3)。異なる培養フラスコサイズについて、記載されている方法で使用したすべての試薬(培地、リン酸緩衝生理食塩水、トリプシン溶液など)の容量を 表3に示します。細胞の種類(試薬の濃度と組成、遠心分離方法など)に依存するパラメータを 表4に示します。播種に用いた細胞密度を 表5に示します。これらの表はすべて、このセクションの最後にあります。
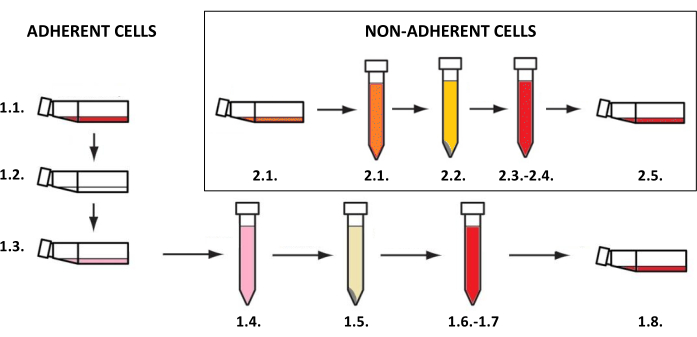
図3:接着細胞培養と非接着細胞培養。 接着細胞培養と非接着細胞培養の一般的なステップバイステップの手順(番号はステップ1.1および1.2の説明に対応しています)。図はMS PowerPointで作成されました。 この図の拡大版を表示するには、ここをクリックしてください。
- 接着細胞の懸濁液を得る
- 培養フラスコから培地を取り出します。
- リン酸緩衝生理食塩水で細胞を穏やかに洗浄します(PBS、 表3)。
- エチレンジアミンテトラ酢酸にトリプシン溶液を添加します(トリプシン-EDTA溶液、 表3)。フラスコを37°Cでインキュベートし、光学顕微鏡で表面からの細胞の剥離を制御します。
- 分離した細胞を少なくとも2倍の全増殖培地またはトリプシン中和剤に懸濁して、トリプシン(2:1)を不活性化します(容量については表3を、試薬については 表4を参照してください)。フラスコの内容物を15mLチューブに定量的に移します。
- 少量(20 μL)の細胞懸濁液を1.5 mLチューブに取り、手動または自動の血球計算盤で細胞をカウントします。
- チューブを遠心分離し( 表4のパラメータ)、上清の大部分を取り除き、細胞ペレットを残りの液体の少量に再懸濁します。次に、細胞密度が新しい培地の必要量を播種または再計算するのに適切な場合は、遠心分離前の容量( 表3の容量)を得るのに十分な新鮮な培地を追加します。
注:メラノサイトなどの一部の細胞は遠心分離に非常に敏感であるため、短時間の距離で再度遠心分離する必要がなくなります。 - 実験(皮膚細胞の2D/3D単培養または多培養)に必要な密度(細胞/mL、 表5の細胞密度)の細胞懸濁液を調製します。
注:細胞をさらに培養する場合は、5,000〜8,000細胞/ mLを新しいフラスコに戻し、新しい培地( 表3の容量)を追加します。
- 非接着性細胞の懸濁液を得る
- 細胞懸濁液を入れた培地を培養フラスコから取り出し、15 mLチューブに定量的に移します。
- 少量(20 μL)の細胞懸濁液を新しい1.5 mLチューブに取ります。手動または自動の血球計算盤で細胞をカウントします。
- チューブを遠心分離し( 表4のパラメータ)、上清の大部分を取り除き、細胞を残りの液体の少量に再懸濁します。次に、新しい培地の必要量を播種または再計算するのに細胞密度が適切である場合は、新鮮な培地を添加して予備遠心分離容量( 表3を参照)を得ます。
- 実験(皮膚細胞の2D/3D単培養または多培養)に必要な密度( 表5で提案されているように、mLあたりの細胞数)の細胞懸濁液を調製します。
注:細胞をさらに培養する場合は、5,000〜8,000細胞/ mLを新しいフラスコに戻し、新しい培地を追加します。
| 25 cm2 カルチャーフラスコ | 75 cm2 カルチャーフラスコ | |
| 培地 [mL] | 4–5 | 8–12 |
| PBS樹脂 [mL] | 5 | 10 |
| トリプシン-EDTA [mL] | 0.5–1 | 1–2 |
| 中和媒体 [mL] | 1–2 | 2–4 |
表3:細胞懸濁液の培養および調製中に使用される試薬の量。
| 皮膚細胞の単一培養 | トリプシン | トリプシン不活性化剤 | 遠心分離 | 2Dモノカルチャー用のミディアムタイプ | |
| ケラチノサイト | 0.25% | トリプシン中和剤付き | 300 x g、5分、室温 | ケラチノサイト増殖培地2 | |
| 線維芽細胞 | 0.25% | ミディアム付き | 300 x g、5分、室温 | DMEM、10%FBS | |
| メラノサイト | 0.025% | トリプシン中和剤付き | 300 x g、3分、室温 | Medium 254、PMAフリーヒトメラノサイト成長サプリメント-2 | |
| 肥満細胞 | 必須ではありません | 必須ではありません | 300 x g、3分、室温 | IMDM、10% FBS、1% 非必須アミノ酸、226 μM α-モノチオグリセロール | |
表4:トリプシン処理、遠心分離パラメータ、および培地の種類は、細胞の種類によって異なります。
| モデルタイプ | 細胞密度 [cell/mL] | ||
| 2Dの | 単層 | 線維芽細胞 | 2 x 105 |
| 肥満細胞 | |||
| ケラチノサイト | |||
| メラノサイト | |||
| 3D(3D) | スフィア(吊り下げ式) | 線維芽細胞 | 5×105 |
| 肥満細胞 | |||
| ケラチノサイト | |||
| メラノサイト | |||
| セルの混合 | |||
| スフィア(リミッティングセル接着法) | 線維芽細胞 | 2 x 105 | |
| 肥満細胞 | |||
| ケラチノサイト | |||
| メラノサイト | |||
| セルの混合 | |||
| 同等 | 線維芽細胞 | 1 x 105 | |
| 肥満細胞 | 1 x 104 | ||
| ケラチノサイト | 8×105 | ||
| メラノサイト | 5×104 | ||
表5:さまざまなタイプの皮膚モデルの細胞播種密度。
2. 皮膚細胞球の調製
注:球体を作成するために、ハンギングドロップ法の使用はステップ2.1(図4)で説明され、細胞接着の制限に焦点を当てたアプローチはステップ2.2(図5)に示されています。それにもかかわらず、球体は非常に小さく、不安定である可能性があるため、これらの方法で実行される活動には、忍耐力、繊細さ、そしてゆっくりとした行動が必要です。
- 吊り下げ式
- 適切な細胞密度を使用して、目的の球サイズを達成します(推奨細胞密度5 x 105 細胞/mL、 表5)。
- 細胞懸濁液20 μLをペトリ皿またはマルチウェルプレートの蓋にピペットで移します(図4A)。
- 皿/プレートを底の部分で覆い、そっと裏返します(ぶら下がっている滴が蓋に自動的に作成されます、 図4B)。
- プレートのペトリ皿/ウェルに滅菌水/ PBS溶液を入れて、液滴による培地の蒸発を防ぎます。
- 液滴を37°Cで48〜72時間インキュベートします。
注:重力によって細胞が引き下げられ、アクセス可能な表面がないため、細胞が血管に付着するのを防ぎ、細胞凝集を促進します。ただし、一部の細胞タイプでは、より長いインキュベーションが必要になる場合があります。 - 次のステップを実行する前に、新しいプレートのウェルを満たします(または、ウェルから水/ PBSを取り除いた古いプレートを使用)完全な増殖培地(100μL)を入れます。
注:次のステップとして、200μLのチップを取り、各チップエンドの1/5を取り外し、使用前に滅菌してください。 - 細胞球をマルチウェルプレートのウェルに移し、カットエンド付きの滅菌ピペットチップを使用します。200 μLのチップを取り、各チップエンドの1/5を取り外し、使用前に滅菌してください(図4C)。
注意: この手順は、皿/プレートの反転中の液体の流れが球体を損傷する可能性があるため、難しい場合があります。 - 移した球体をマルチウェルプレートで37°Cの1日間インキュベートしてから、さらなる実験(化合物の添加、細胞毒性アッセイ、等価物への球体導入など)を行います(図4D)。
- 細胞接着を制限する方法
- 細胞播種の前に、U底プレートのウェルを界面活性剤溶液(例えば、プルロニックF−127、ポリエチレングリコール、ポリビニルアルコール)で覆う21。PBS中の1%界面活性剤溶液100 μLを調製し、各ウェルに加えます。プレートを溶液と共溶かして37°Cで24時間インキュベートします(図5A-C)。必要に応じてプレートを長く保管しますが、PBSバッファーを追加することで液面を維持します。
- ウェルあたり50 μLで、所望の細胞密度で細胞懸濁液を調製します(2 x 105/mLを播種する際の推奨細胞密度、 表5)。
- 細胞を播種する前に、ウェルから界面活性剤溶液を取り出して、溶解による細胞膜の破壊を回避します(図5D)。
- 細胞溶液をプレートに加え、37°Cで24時間インキュベートして細胞凝集体に到達させます(図5E)。約1〜3日後、球体が形成され(図5F)、さらなる実験に使用できるようになります。
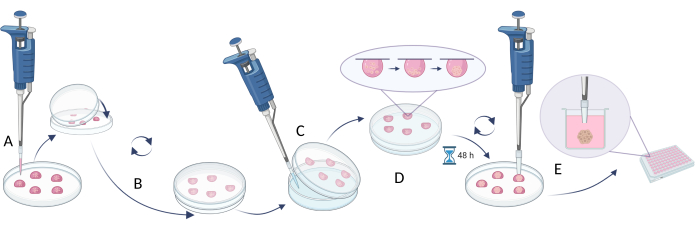
図4:吊り下げ式 (A)セル懸濁液を蓋にピペッティングし、蓋を皿の底部で覆います。(B)皿を回転させて吊り下げる液滴を作成する。(C)皿の底部に水/ PBSを追加する(液体の蒸発を制限する)。(D)細胞球を作成するための吊り下げ滴による皿のインキュベーション。(E)形成された球体を有する液滴の収集およびマルチウェルプレート中の転写球体の安定化。フィギュアは Biorender.com で作成しました。 この図の拡大版を表示するには、ここをクリックしてください。
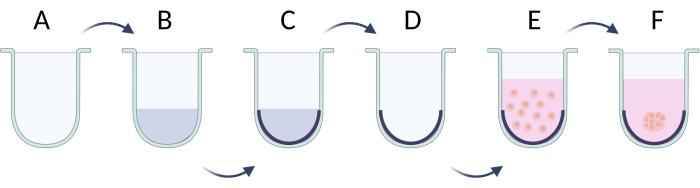
図5:制限細胞接着法による球体の段階的な調製(A)U底ウェル;(b,c)界面活性剤溶液による細胞接着の制限;(D)井戸から溶液を除去する。(e)播種細胞;(F)細胞の凝集と球の形成。フィギュアは Biorender.com で作成しました。この図の拡大版を表示するには、ここをクリックしてください。
3. 全層皮膚当量物の調製
注:全層(表皮および真皮)皮膚同等物の発達は、3つのステップに分けることができます(図6)典型的な真皮細胞(線維芽細胞および肥満細胞など、 図6A)の発生を伴う人工真皮層の調製、人工表皮に含まれる細胞(主にケラチノサイトおよびメラノサイト、 図6B)に含まれる細胞の播種)および角質化プロセスの可能性を伴うケラチノサイトの垂直成長(角質層の形成、 図6C)。全層皮膚当物の調製は、ステップ3.1(3.1.1-3.1.10)に記載されている。それほど進化していない皮膚同等物が必要な場合(例えば、表皮型のみ)、選択した細胞型(ケラチノサイトなど)を市販のコラーゲンまたはポリカーボネート膜に直接播種し、角質化プロセスを誘導する可能性のある培養も行うことができます(ステップ3.1.9-3.1.10に直接進んでください)。
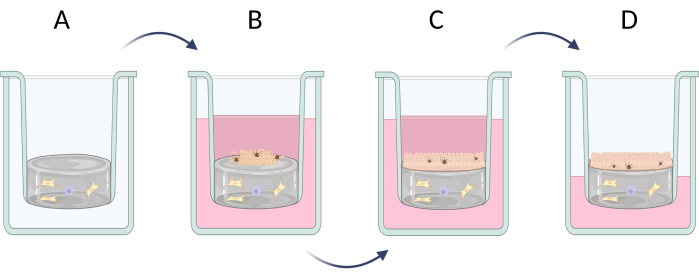
図6:インサートにおける全層皮膚同等物の段階的調製 (A)真皮細胞による偽真皮層の調製、(B)表皮細胞の播種、(C)培地での同等物のさらなる培養、(D)空気液界面培養は、層状上皮の形成を促進する。フィギュアは Biorender.com で作成しました。 この図の拡大版を表示するには、ここをクリックしてください。
- 24ウェルプレートにおける全層皮膚当量物の調製
- 水、PBS(10倍)、1 M NaOH、I型コラーゲン溶液を入れたチューブを氷の上に置きます。
- ハイドロゲルに播種する真皮細胞(線維芽細胞や肥満細胞など、10:1の比率)の適切な数を決定します。適切な数の真皮細胞を1.5 mLチューブ( 表5の細胞密度に応じて、500 μLの線維芽細胞と500 μLの肥満細胞)に移し、細胞を遠心分離します(300 x g、3分間、RT)。
- 上清を取り除き、695 μLの水/100 μLのPBS(10x)/5 μLのNaOHの混合物に細胞を穏やかに再懸濁します。
注:全溶液1 mLが十分でない場合は、 表6 を使用して各試薬の容量を再計算してください。 - 混合物に200μLのコラーゲン溶液を加え、ピペッティングで穏やかに混合します。
注:混合物の一貫性が密集するため、注意してください。 - 調製した混合物200μLを24ウェルプレートのインサートに加えます。角質層のないモデルの場合は、 24ウェルプレートの各ウェルに500μLを添加します。
- プレートを室温(RT)で10分間インキュベートした後、インキュベーターに30分間移します。
注:他のアクションの前に、ヒドロゲルが重合したかどうかを確認してください。 - ハイドロゲルの表面に細胞を播種する前に、PBSバッファー(500 μL/well)ですすいでください。
- ハイドロゲルの上に播種する表皮細胞(ケラチノサイトやメラノサイトなど、15:1の比率)の適切な数を決定します。10% FBSを添加したDMEM培地500 μLに細胞混合物を調製し(ケラチノサイト250 μLとメラノサイト250 μLを添加し、細胞密度は 表4に記載)、ウェルに穏やかに加えます。
注:場合によっては、最初にメラノサイトを播種し、それらがハイドロゲル上によく広がるのを許し、さらに24時間後に培地を取り除き、ケラチノサイトを播種する方が良い場合があります。その場合は、250 μLの細胞懸濁液と250 μLの培地を加えます。 - 細胞増殖の速度に応じて、プレートを37°Cで2〜5日間インキュベートし、48時間ごとに培地交換(FBSの濃度が10%から1%に減少)を行い、光学顕微鏡で細胞モニタリングを行います。
- ヒドロゲルの上にケラチノサイトの単層を取得した後に角質化プロセスを誘導する場合は、カルシウムイオンとL-アスコルビン酸を追加で2〜7週間(1.5μM CaCl2 および50μg/mL L-アスコルビン酸の濃度)追加で補充したFBSフリー培地を使用します。
注:インキュベーションの時間は、使用するケラチノサイトとその分化速度によって異なります。
| 試薬 | 試薬の体積を計算するための方程式 | 計算例 | |
| (最終容量 = V合計 1 mL の場合) | |||
| I型コラーゲン溶液 | 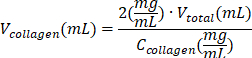 | (Cコラーゲン =10mg/mL) | |
| 0.2 mL = 200 μL | |||
| PBSの(10倍) | 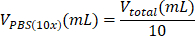 | 0.1 mL = 100 μL | |
| 1 M NaOH | 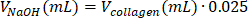 | 0.005 mL = 5 μL | |
| 滅菌 H2O | 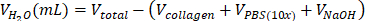 | 0.695 mL = 695 μL | |
表6:2 mg/mLコラーゲンI型ハイドロゲル調製に必要な試薬量の計算。
4. 細胞染色法による3次元皮膚モデルにおける細胞種の同定
注:開発された皮膚モデルが予想される細胞で構成されていることを確認するには、細胞染色を行うのが良いでしょう。これは、特定のモデル22でターゲット実験を行う前に重要なステップです。3D皮膚モデルの場合、細胞染色の前に、パラフィンに所定のモデルを埋め込み、人工組織をミクロトーム上に切断した顕微鏡スライドを作製する必要があります(ステップ4.1)。
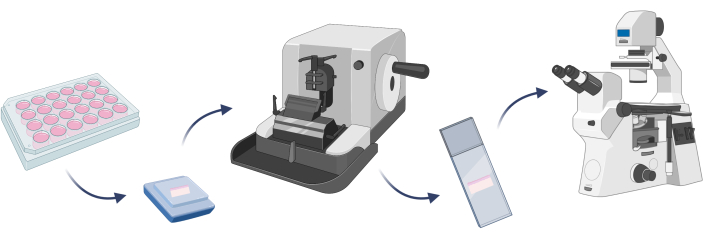
図7:3Dスキンモデルの埋め込み、細胞染色、顕微鏡観察の基本ステップ。 フィギュアは Biorender.com で作成しました。 この図の拡大版を表示するには、ここをクリックしてください。
- 3Dスキンモデルの埋め込み
- 皮膚相当物をPBSで5分間RTで2回洗浄し、PBS中の3.7%パラホルムアルデヒド溶液を使用して固定します(30分、RT)。PBSで洗浄手順を繰り返します。
- 包埋する前に、エタノール溶液の濃度を上げることでインキュベートすることにより、皮膚相当物を脱水します:50%(15分)、70%(15分)、96%(2回、30分)、および99.8%(2回、30分)。
- 固定および脱水皮膚相当物をパラフィンで満たされた型に入れます。
注意: 同等のものを適切な向きに置きます。 - 型をカセットで覆い、その上にパラフィンを追加します。RTで最大30分間固化させます。
- パラフィン包埋皮膚相当物を-80°Cで少なくとも1時間凍結します。
- ミクロトームの電源を入れ、パラフィン包埋皮膚当量を挿入し、5μm切片を切開します。切断した人工組織スライスを顕微鏡スライドに置き、37°Cで少なくとも8時間乾燥させます。
- スライドをキシレンに浸し(2回、10分)、次に、減少するエタノール濃度99.8%(5分)、96%(5分)、70%(5分)、および50%(5分)でスライドを再水和します。
- スライドをエタノール溶液から取り出し、水で2回(5分間)すすぎます。
注:従来の細胞染色は、特定の色素(ヘマトキシリン、エオシン23)を適用するか、バイオマーカーを選択的に標的とする抗体(線維芽細胞のコラーゲン1A2、ケラチノサイトのサイトケラチン14、メラノサイト24のメランAまたはチロシナーゼを含む)を使用して行われます。定期的なヘマトキシリンおよびエオシン染色は、さまざまな企業が作成したプロトコルに従うことで行うことができます(ステップ4.2)。一方、免疫蛍光染色または免疫組織化学染色が必要な場合、手順は異なり、大幅に長くなります(ステップ4.3および4.4)。非特異的な反応を避けるためには、異なる動物種で産生された一次抗体を使用し、次に専用の二次抗体を使用します。
- 3D皮膚モデルのヘマトキシリンおよびエオシン染色
- 顕微鏡スライドをヘマトキシリン溶液中でRTで3分間染色します。
- スライドを酸性アルコール溶液で1分間洗浄します。
注:2 mLの35%〜38%塩酸と98 mLの99.8%エチルアルコールを混合して、酸性アルコール溶液を調製します。 - 次に、スライドを0.1%重炭酸ナトリウム溶液で洗浄して、目に見える繊細な青紫色にします。
注:0.1%重炭酸ナトリウム溶液を得るには、100 mgの重炭酸ナトリウムを100 mLの超純水に溶解します。. - スライドを95%エタノールで1分間洗浄します。
- 顕微鏡スライドをエオシン溶液中でRTで1分間染色します。
- スライドを95%エタノールで1分間、99.8%エタノールで2分間洗浄します。
- スライドをキシレンで2分間ずつ2回洗います。
- バルサムをマウントし、スライドの上部にカバースリップを置きます。サンプルは顕微鏡観察の準備ができています。
- 3D皮膚モデルの免疫蛍光染色
- スライドをPBSですすいでください(5分)。
- ブロッキング溶液(3%ウシ血清アルブミン[BSA]またはPBSバッファー中の無脂肪乳に0.1% Triton X-100および0.1% Tween 20を添加)を調製し、スライドを室温で1時間インキュベートします。
- スライドをPBSバッファーで2回洗浄します(5分)。
- 一次抗体をPBSバッファーで希釈し(生産者の推奨、 表7)、スライドを室温で1〜2時間、または4°Cで一晩インキュベートします。
- スライドをPBSバッファーで2回洗浄します(5分)。
- 二次抗体をPBSバッファーで希釈し(生産者の推奨、 表7による)、スライドを室温で1時間インキュベートします。
- スライドをPBSで2回洗います(5分)。
- 核染色用の色素溶液(Hoechst 33342またはDAPI、 表7など)を調製し、スライドを室温で最大15分間インキュベートします。
- スライドをPBSで洗浄します(5分)。
- バルサムに封入し、切片をカバーガラスで覆い、蛍光顕微鏡を用いて細胞染色の影響を可視化します。
- 3D皮膚モデルの免疫組織化学染色
- 手順4.3.1〜4.3.5を実行します。
- さらに、二次抗体が結合する酵素に適したバッファーで洗浄ステップを実行します。
- 二次抗体を標識酵素に適したバッファーで希釈し(生産者の推奨による)、スライドを室温で1時間インキュベートします。
- スライドをPBSで2回洗います(5分)。
- 使用した酵素に適した基質の溶液を調製し、生産者の推奨に従ってスライドをインキュベートします。
- スライドをバッファーで洗浄し(5分)、バルサムにマウントします。
- 明視野顕微鏡を用いて細胞染色の影響を可視化します。
| 細胞タイプ/細胞オルガノイドが検出されました | 染色剤 | ディリューション/集中力 | ||
| 肥満細胞 | アビジン-スルフォロダミン101 | 1 μg/mL | ||
| 線維芽細胞 | ウサギで産生されたCol1A2抗体 | 1:50 | ||
| FITCと結合したヤギ抗ウサギ二次抗体 | 1:250 | |||
| ケラチノサイト | マウスで産生されたサイトケラチン14抗体 | 1:50 | ||
| FITCと結合したヤギ抗マウス二次抗体 | 1:250 | |||
| メラノサイト | マウスで産生されたMelan-A抗体 | 1:50 | ||
| FITCと結合したヤギ抗マウス二次抗体 | 1:250 | |||
| 核 | ヘキスト33342 | 1 μg/mL | ||
| ダピ | 1 μg/mL | |||
表7:細胞染色に使用した試薬の濃度と希釈率。
結果
研究室で皮膚モデルの作成を開始する前に、使用する細胞の種類(初代/細胞株)と、これらの細胞に適した培地の選択を決定する必要があります。ほとんどのセルバンクは、すべてのタイプの細胞培養に培地を推奨し、提供することができます。多重培養モデルの場合、培養物に存在するすべての細胞タイプに適した培地を1つ選択する必要があります。初代皮膚細胞培養および最も一般的な皮膚細胞株の両方に使用されるいくつかの典型的な細胞培地を、表8 18,19,20,25,26,27にまとめました。初代細胞培養に使用される一般的な培地は、かなり高価であり、その組成は複雑です。一方、細胞株は通常、単純な組成の培地で満足します。いくつかの細胞タイプ(主に線維芽細胞および肥満細胞)は、他の細胞(ケラチノサイトおよびメラノサイトなど)の増殖を刺激する因子を産生および分泌することができる28,29。モデルにそれらが存在することが計画されている場合、培地の追加補充は必要ありません。
| 細胞の種類 | セル名 | 中程度 | 参考 | ||||
| ケラチノサイト | HaCaTセルライン | DMEM、10% FBS、100 U/mL ペニシリン、100 μg/mL ストレプトマイシン | 売り手によると | ||||
| 一次正常ヒト表皮ケラチノサイト(NHEK) | ケラチノサイト増殖培地2(基礎培地+サプリメントミックス) | 売り手によると | |||||
| 一次ヒト表皮ケラチノサイト;ノーマル、アダルト(HEKa) | Dermal Cell Basal Medium、0.4% ウシ下垂体抽出物、0.5 ng/mL rh-トランスフォーミング成長因子-α、6 mM L-グルタミン、100 ng/mLヒドロコルチゾンヘミスコハク酸、5 mg/mL rh-インスリン、1 mM エピネフリン、5 mg/mL アポトランスフェリン、100 U/mL ペニシリン(必要な場合)、100 μg/mL ストレプトマイシン(必要な場合) | 売り手によると | |||||
| 初代ケラチノサイト | DMEM/F-12 (3:1)、1% Ultroser G、1 μM ヒドロコルチゾン、1 μM イソプロテレノール、0.1 μM インスリン、1 ng/mL ケラチノサイト成長因子、1% ペニシリン-ストレプトマイシン | 18 | |||||
| メラノサイト | 初代メラノサイト | ミディアム 254、PMA フリーのヒト メラノサイト成長サプリメント-2、1% 抗生物質溶液 | 19 | ||||
| 初代メラノサイト | RPMI-1640、10% FBS、14.7 μg/mL フェノールレッド溶液、1% L-グルタミン、1% ペニシリン/ストレプトマイシン | 27 | |||||
| HEMa-LP細胞株 | 中程度 254、5 μg/mL rh-インスリン、50 μg/mL アスコルビン酸、6 mM L-グルタミン、1 μM エピネフリン、1.5 mM 塩化カルシウム、100 U/mL ペニシリン (必要な場合)、100 μg/mL ストレプトマイシン (必要な場合) | 売り手によると | |||||
| 一次正常ヒト表皮メラノサイト(NHEM) | メラノサイト増殖培地(基礎培地+サプリメントミックス) | 売り手によると | |||||
| 線維芽細胞 | 一次ヒトほぞ線維芽細胞(HTF) | EMEM、5% FBS、5 ng/mL rh-塩基性線維芽細胞増殖因子、5 μg/mL rh-インスリン、50 μg/mL アスコルビン酸、7 mM L-グルタミン、100 U/mL ペニシリン、100 μg/mL ストレプトマイシン、0.25 μg/mL アムホテリシン B | 28 | ||||
| プライマリ HTF、および | DMEM、10% FBS、100 U/mL ペニシリン、100 μg/mL ストレプトマイシン、0.25 μg/mL アムホテリシン B | 20.28 | |||||
| 一次ヒト真皮線維芽細胞 | |||||||
| HFF-1細胞株 | DMEM、15% FBS、100 U/mL ペニシリン、100 μg/mL ストレプトマイシン | 売り手によると | |||||
| BJ細胞株 | EMEM、10% FBS、100 U/mL ペニシリン、100 μg/mL ストレプトマイシン | 売り手によると | |||||
| 肥満細胞 | 初代ヒト皮膚肥満細胞(hsMC) | IMDM、10% FBS、1% 非必須アミノ酸、226 μM α-モノチオグリセロール、100 U/mL ペニシリン、100 μg/mL ストレプトマイシン | 20 | ||||
| LAD2細胞株 | StemPro-34、2.5% StemPro-34 栄養補助食品、2 mM L-グルタミン、100 ng/mL rh-幹細胞因子、100 U/mL ペニシリン、100 μg/mL ストレプトマイシン | 29 | |||||
| HMC-1.1 および 1.2 細胞株 | IMDM、10% FBS、2 mM L-グルタミン、25 mM HEPES、100 U/mL ペニシリン、100 μg/mL ストレプトマイシン | 29 | |||||
表8:初代皮膚細胞および細胞株の培養に最も使用されている培地の概要。
凡例:ダルベッコの最小エッセンシャルミディアム(DMEM)、イーグルの最小エッセンシャルミディアム(EMEM)、ウシ胎児血清(FBS)、栄養混合物ハムのF-12(F12)、イスコーブの修正ダルベッコ培地(IMDM)、組換えヒト(rh)、ロズウェルパークメモリアルインスティテュート(RPMI)。
この記事では、ケラチノサイト、メラノサイト、線維芽細胞、および肥満細胞の初代細胞を使用して皮膚モデルを作成しました。これらの培地は細胞株よりもわずかに要求が厳しく、シングルセル培養に使用された彼らの培養に推奨される培地は、補充されたケラチノサイト増殖培地2(ケラチノサイト用)、補充された培地254(メラノサイト用)、補充されたDMEM培地(線維芽細胞用)、および補充されたIMDM培地(肥満細胞用)です。これらの培地では、細胞はそのタイプに割り当てられた典型的な形態を示します(代表的な画像を 図8に示します)。2種類以上の細胞型の多重培養の場合、すべての培養細胞型が増殖できる培地を選択することが重要でした。数回のテストの後、10% FBS と 1% の抗生物質混合物を含む DMEM 培地を選択し、球体と同等物のより高度な 3D モデルを調製しました。
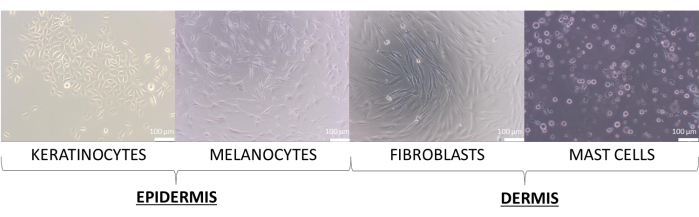
図8:皮膚細胞は、2Dモノカルチャー中に観察された異なる形態を示します。 スケールバー:100μmこの 図の拡大版を表示するには、ここをクリックしてください。
球体(一般にスフェロイドと呼ばれる)は、細胞および組織工学の研究者によって開発された最も単純な3Dモデルの1つですが、皮膚細胞から作成された球体はそれほど人気がありません。このモデル内では、単一文化と多文化の両方の球体の作成が可能です。球体調製のための複数の方法(例えば、吊り下げ滴を用いる、細胞接着を制限する、磁気浮上、回転、マイクロ流体工学など)が文献30に記載されている。調製の容易さ、低コスト、容易に入手できる材料と機器により、最初の2つの方法は3次元(3D)細胞モデルの初心者に推奨され、その性能に関するプロトコルは上記(ステップ2.1および2.2)にあります。文献31,32によると、これらの方法で最も重要なパラメータは、細胞数、細胞懸濁液の量、およびインキュベーション時間です。
球体は異なる数の細胞で作製できますが、播種用の細胞密度は、細胞共培養だけでなく、細胞タイプごとに個別に最適化する必要があります。ケラチノサイトと線維芽細胞の単一培養に対して実施した最適化プロセスにより、ウェルごとに1 x 104 細胞を播種すると、両方の細胞タイプに最良の結果が得られることが明らかになりました。 図9 に示す球体は、U底プレート内の細胞接着を制限する方法(ステップ2.2)を使用して調製しました。技術的な繰り返しで少なくとも4つのウェルを準備することをお勧めします(最適は6ウェルです)。1 x 104 個の細胞からなる球体は、ウェルで見えるため、操作が容易でした。その結果、アッセイ中に球体を排出することなく、古い培地をウェルから取り除くことさえ可能でした。説明された操作の後、球体の形状はほとんど変化せず、再現性がありました。プロセス中、大きな球体の安定性は低かった。また、異なる細胞タイプが異なる色の球体を形成する可能性があることにも言及する価値があります(たとえば、 ケラチノサイトはより暗い球体を形成しますが、線維芽細胞球は著しく明るい)。
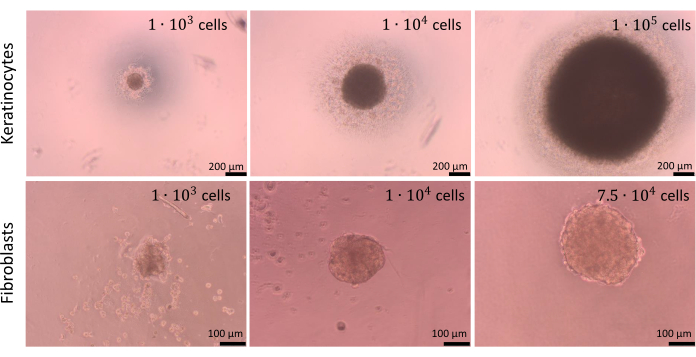
図9:球体の作成。 制限細胞接着法を使用して、さまざまな種類と数の皮膚細胞によって作成された球体。スケールバー(トップパネル):200μm。スケールバー(下部パネル):100μmこの 図の拡大版を表示するには、ここをクリックしてください。
吊り下げ方法(ステップ2.1)で述べたように、ある時点で球体を蓋からウェルに移す必要があります。このプロセスは、球体に損傷を与える可能性があります。したがって、このステップでは、作業の精度が高くなります。作成された球体は、慎重に取り扱わないと、適切な形状を失う傾向があります(図10)。最初の画像(図10A)は、すべての辺が均等に丸みを帯びた良好な球体を示しています。2番目と3番目の画像(図10B、C)では、球体による形状の緩やかな損失が観察されましたが、細胞凝集体は丸みを帯びたままです。最後の 3 つの画像 (図 10D-F) は、球体の損傷のさまざまなフェーズを示しています。作成した球体の形状や構造の再現性を得るためには、経験を積む必要があります。球体を開発する最初の試みでは、経験の浅い研究者のために細胞接着を制限する方法(ステップ2.2)を使用することをお勧めします。これは、研究者の活動の影響が限定的でより比較可能な結果を提供するためです。
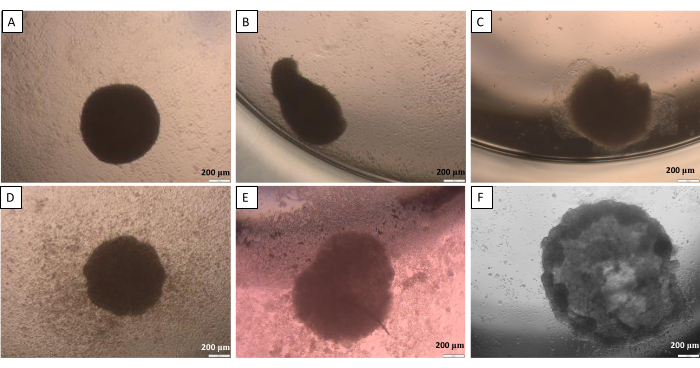
図10:蓋から井戸への球体の移動に起こりうる困難 - 吊り下げ式 (A)良好な球体、(B,C)わずかに損傷した球体、(D-F)高度に損傷した球体。画像は転送から24時間後に撮影されました。スケールバー:200μmこの図の拡大版を表示するには、ここをクリックしてください。
同等のものは、球体よりもはるかに高度な人工皮膚の3Dモデルです。皮膚モデルの構築過程では、モデル内の層数(表皮のみ、真皮のみ、表皮と角質層を持つ真皮)、使用される細胞の種類、適用材料、同等の望ましいサイズ、それがさらに使用される研究の種類など、さまざまな側面を考慮する必要があります14。スキン同等物は、所望のサイズ(96ウェル、48ウェル、24ウェルなど)の標準的なマルチウェルプレートに配置された特別なインサートに配置できます。インサートは、あるウェルから別のウェルへの移し替えや培地交換の際に容易ですが、同等品を損傷することはありません。彼らはかなり高価です。モデルが角質層の存在を必要としない場合、より安価な解決策は、マルチウェルプレートのウェルに同等のものを調製することです。
人工真皮層は、典型的には、天然(ゼラチン、コラーゲン、フィブリン、ヒアルロン酸、キトサン-アルギン酸など)または合成(ポリエチレングリコールジアクリレートおよびポリ乳酸)ハイドロゲル33を使用して、足場ベースのモデルとして構築される。実際の皮膚の真皮に類似するためには、この層は、細胞結合、細胞間相互作用、および他の細胞作用を媒介するいくつかの細胞外マトリックス(ECM)成分(コラーゲンまたはフィブロネクチンを含む)を含む主に水を含んでいなければならない34。本研究では、I型コラーゲンはハイドロゲルの形で調製が容易で、その柔軟な構造により、さらなる研究活動(例えば、ある皿から別の皿への等価物の移し替え)が容易であるため、I型コラーゲンを選択した。ラットテールから得られるI型コラーゲンの溶液は、通常、20mM酢酸に粉末溶解して調製します。コラーゲン重合ステップを達成するためには、6.5〜7.5の範囲の適切なpH条件を提供する必要があります。これは、厳密な量の水酸化ナトリウムを添加することで保証できます。手軽さのために、一部の企業は特定の計算を導入しており、これはそのようなハイドロゲルの調製に必要な正確な量を決定するのに役立つ場合があります(表6)。文献では、ハイドロゲル中のコラーゲンの濃度が異なることがありますが(例えば、0.5-2 mg/mL35;5-30 mg/mL36;低コラーゲン含有量と高コラーゲン含有量37)、記載されたモデルでは、ハイドロゲルがまだ柔軟な構造を持っていたため、2 mg/mL溶液が使用されましたが、必要に応じてウェルから移動できるほどコンパクトでした。
非常に現実的な全層の皮膚を準備するには、同等の細胞を、おそらく私たちの体に存在するこの比率に近い割合で播種する必要があります。表皮の場合、体の部位にもよりますが、メラノサイトと関連するケラチノサイトのプールとの関係は約1:36の比率であり、これは表皮メラニンユニット(EMU)38として定義されます。したがって、人工表皮に適用された割合は、15個のケラチノサイトに対して1個のメラノサイトでした(表5)。人工真皮層を作製するために、線維芽細胞と肥満細胞を線維芽細胞10個に対して肥満細胞1個の割合で組み込んだコラーゲン1型ハイドロゲルを用いた。構成された等価物の各層は、観察された試料の深さを変更することにより、倒立光学顕微鏡上でリアルタイムに監視することが可能です(例示的な画像を 図11に示します)。
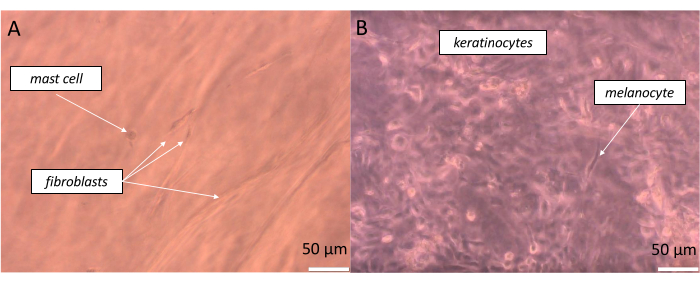
図11:明視野顕微鏡で可視化された、(A)偽真皮および(B)偽表皮)に形成された全層皮膚相当物の特定の層における異なる細胞のリアルタイム観察。スケールバー:50μmこの図の拡大版を表示するには、ここをクリックしてください。
モデルの意図された構造を得ることの確認を伴うより正確な観察は、同等の染色を行うことによって行うことができる。固定等価物は、最初にパラフィンに包埋し、次にミクロトームにカットする必要があります。薄い人工組織を含むスライドは、後でヘマトキシリンやエオシンなどのさまざまな色素で染色できます(医療検査室で行われる基本的な染色)。この作用により、人工真皮と表皮を同等物で区別したり、個々の皮膚細胞を同定したりすることが可能になります(図12)。図12では、特定の細胞タイプが示されているだけでなく、細胞分裂プロセスの異なる段階(終期および中期)のケラチノサイトを見ることも可能である。肥満細胞の場合、特定の顆粒は細胞内でよく認識できます。これらの画像は、最初に、作成された皮膚同等物が生きていること(細胞がその中で成長していること)と、開発されたモデルで正常に機能できることを確認します。ただし、皮膚の3D表皮モデルと全層モデルでは、得られたコンストラクトの品質と機能を確認することが特に重要です。角質層の透過性を確認するには、経上皮電気抵抗(TEER)測定またはLucifer-Yellow染色を適用する必要があります39,40。さらに、適切に構成された人工皮膚には、分化マーカー(例えば、フィラグリン、インボルクリン、ロリクリン、ケラチン10、ケラチン5、セラミドを含む脂質クラス)、真皮-表皮接合マーカー(例えば、IV型コラーゲン、ラミニンV、アルファ6ベータ4-インテグリン、BP抗原)41、表皮層のタイトジャンクションマーカー(例えば、クローディン-1、オクルージン、ゾヌラオクルーデンスタンパク質(ZO)-1)42基底層増殖マーカー(Ki67)41。

図12:皮膚細胞の形態と機能。 ヘマトキシリンとエオシンで染色した全層皮膚当量における皮膚細胞の形態と機能(細胞分裂の観察)の概要。スケールバー:100μm(トップパネル)、50μm(中央パネル、左)、100μm(中央パネル、右)、50μm(ボトムパネル)。 この図の拡大版を表示するには、ここをクリックしてください。
バイオマーカーの存在を確認するために最も頻繁に使用される方法は、免疫組織化学や免疫蛍光などの特異的染色を行うことです。モデル内の特定の細胞を顕微鏡で可視化するために、さまざまな抗体や蛍光色素を適用することができます。培養中の細胞の例示的な染色の結果は、 図13に見ることができる。ケラチノサイトを観察するために、サイトケラチン14に対する抗体を使用しました。メラノサイトの場合、それはメランA特異的抗体でした。コラーゲン1A2抗体を使用して線維芽細胞を染色し、アビジンと結合した蛍光スルフォロダミン101は肥満細胞に存在するヘパリンを検出しました。
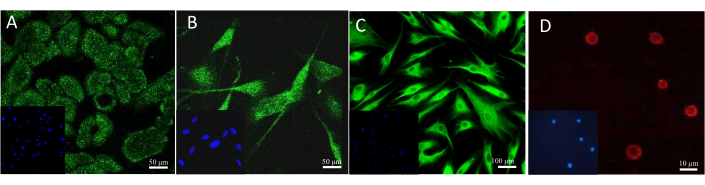
図13:蛍光細胞染色の結果(A)ケラチノサイト中のサイトケラチン14。スケールバー:50μm.(B)メラノサイト中のMelan-A。スケールバー:50μm.(C)線維芽細胞中のコラーゲン1A2。スケールバー:100μm.(D)肥満細胞中のヘパリン。スケールバー:10μmこの図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
この記事では、独自の高度な人工皮膚モデルを準備するために適用できる方法論を紹介します。これは、計画された研究が厳密に定義された研究モデルを必要とする場合、市場で入手できなかったり、非常に高価であることが判明したりする場合に適したソリューションです。前述のように、いくつかの市販の皮膚同等物が市場で入手できます(例: EpiSkin、EpiDerm FT)。しかし、そのコスト(1個あたり100ユーロから400ユーロ)と納期(数日から数週間)は、研究者が自分でそのようなモデルを準備しようとすることを奨励するかもしれません。提案された手順は、経験の浅い科学者でも簡単に実行できると同時に、非常に高度な皮膚モデルを取得することができます。特定のモデルの細胞組成に関する決定は、研究者に完全に依存していることを強調する価値があります。作成されたモデルとは別に、さらに開発および改善することができ、まったく新しい研究の視点が開かれます。市販モデルの場合は、別の同等品を購入する必要があります。
3D細胞培養は、複数の細胞タイプで進行し、取り扱いが容易でアクセスしやすいかもしれませんが、それらはまだ人工的なモデルに過ぎず、組織の複雑さと機能(免疫機能、血管新生など)を完全に再現することはできません。そのため、ほとんどの研究では、得られた結果を確認するためにいくつかのモデルが必要です。これらのモデルのいくつかの長所と短所、およびそれらの制限を 表9にまとめました。一方、商用モデルは、実験の再現性とラボ間のデータの比較可能性を備えた高い定性基準を保証します。新しい化合物を研究に使用するためには、適切な市販の同等物を購入する必要があります。しかし、準備段階では、このような自作の皮膚の3Dモデル(マルチセルタイプの球体または同等のもの)は、市販の同等物に対して実施する必要がある実験の数を減らすのに役立ちます。記載されているモデルを作成および使用する目標は、認定された研究モデルを適用する必要性を回避することではなく、研究を促進し、関連費用を削減することです。
| モデルのペアの比較 | 利点 | 欠点 | ||||
| 細胞培養 vs. 動物 | 動物の苦しみを最小限に抑えた | テストされた因子が全身に及ぼす影響に関する限られた情報 | ||||
| 実験の標準化性が高い - 結果の再現性が向上 | 単一のモデルでは、体内で発生するプロセスを反映するには不十分です | |||||
| 生物全体に対する副作用はありません | - | |||||
| 実験の条件をより適切に制御 | - | |||||
| 自動化の可能性(バイオプリンティングなど) | - | |||||
| コストの削減 | - | |||||
| 必要なサンプルの小さなサイズ | - | |||||
| 発生する廃棄物の量が限られている | - | |||||
| 3D培養と2D培養 | 完全な生物をよりよく反映する | 時間のかかる文化 | ||||
| 機能的な組織を作成する可能性 | コストの高騰 | |||||
| 実施される研究のニーズに合わせたモデルを作成する可能性 | 3D構造の自発的な形成はほとんど不可能です | |||||
| - | さまざまな化合物の影響を定量化するための標準化されたテストの欠如 | |||||
| - | 市場に出回っているさまざまな3Dカルチャーへのアクセスが限られている | |||||
| 細胞株 vs. 初代細胞 | 認定および承認されたモデル | 限られた数の細胞株のみが利用可能です | ||||
| 実験の標準化性が高い - 結果の再現性が向上 | 同じドナーから数種類の細胞を採取する可能性が限られている | |||||
| より長い寿命 | ネイティブセルから変更されたプロパティを持っている可能性があります | |||||
| かなり速い増殖速度 | 細胞の機能が頻繁に乱される | |||||
| いくつかの活動(凍結、遠心分離など)に対する感度が低い | - | |||||
表9:研究におけるさまざまなモデルの使用の比較-長所と短所
いくつかの記事は、3Dスキンモデルを準備する方法を説明しています(市販のモデル14、43、44を要約したレビュー記事は別として、それらは通常、球体45 または同等のもの46を得るための単一の方法論に焦点を当てています)。
この記事では、皮膚細胞による球体形成について2つの方法論について説明しました。吊り下げ式は広く用いられていますが、その再現性や安定性が不十分な場合もあります。ほとんどのステップでは、移送中に液滴から水が蒸発するため、高速作業を行うなど、特定のアクションが必要です。穏やかな動きも推奨されます、そのようなスキルの欠如は細胞凝集体の損傷を引き起こす可能性があるためです31,32。したがって、球体調製のより簡単な方法は、細胞接着を制限することに焦点を当てています。細胞接着に適した表面がないと、細胞間の相互作用が高くなります。その結果、セル凝集体が生成されます。球体転送の必要がないため、その再現性ははるかに高くなります。これらの方法により、球体を作るのに最適な皮膚細胞の数は、1 x 104細胞/球体に確立されました。
次に、皮膚同等物の調製について説明する手順が示されました。研究におけるそれらの外観と機能は、細胞(表2)、足場、培地など、それらが構成される要素に強く依存する可能性があります。人工皮膚の調製に使用される3D足場は、合成ヒドロゲルと天然源から形成されたものに分けることができます。ヒドロゲルを構成するために使用される材料とその特性によっては、培地を追加で補充する必要が生じる場合があります。合成ハイドロゲルは、特定の細胞機能を媒介するために、生物活性分子(タンパク質、酵素、および成長因子)を合成ハイドロゲルネットワークに組み込む必要がある47。ハイドロゲルへの成長因子の制御された送達を達成するための文献で提示された主なアプローチには、直接ローディング、静電相互作用、共有結合、およびキャリアの使用が含まれる48。ECMタンパク質やポリマーなどの天然源から形成されたハイドロゲルは、3D足場全体に流体経路を生成し、栄養素の分布を加速します。したがって、培地の追加補給の必要はありません。研究により、低分子(サイトカインや成長因子など)と高分子(グリコサミノグリカンやプロテオグリカンを含む)は、拡散によってECMを介して輸送できることが示されています47。しかし、酸素、栄養素、その他の生理活性分子の分子拡散は、ECMハイドロゲル自体の特性によって妨げられる可能性があります。拡散率が低いことは、ヒドロゲルの厚さが高いことだけでなく、コラーゲンの濃度が非常に高いこととも相関していました37。この研究では、皮膚同等物を作成するために、2 mg / mLに等しい低コラーゲン濃度が使用されました。これは、ハイドロゲルを介した分子拡散が良好で迅速であるべきであることを示唆しています。したがって、この段階では、培地への追加の補充もハイドロゲル自体への添加も提供されませんでした。真皮を模倣するために、肥満細胞と線維芽細胞(1:10)をコラーゲンハイドロゲルに埋め込みました。次に、メラノサイトとケラチノサイト(1:15)をハイドロゲルに播種し、全当量を培地で培養しました。特筆すべきは、塩基性培地はいくつかのアミノ酸、無機酸、ビタミンで構成されており、さらに血清(細胞、脂質、ホルモン、栄養素、エネルギー源、キャリア、結合および移動タンパク質などの成長因子および付着因子からなる)が補充されていることです。表皮の適切な構造を達成するために、培地に異なるサプリメントを特定の時間に追加する必要があります。表皮の分化を開始するための最も重要な刺激因子は、細胞内シグナル伝達を活性化するカルシウムです。アスコルビン酸は、カルシウムによって媒介されるものと同様のシグナル伝達経路を刺激するが、その効果はアスコルビン酸の輸送の増強と親水性抗酸化物質の枯渇の防止も伴う41。さらに、他の成分(カフェイン、ヒドロコルチゾン、トリヨードチロニン、アデニン、コレラ毒素など)を培地に添加すると、細胞の分化が改善された41,44。準備したモデルは、適切な層に特定の細胞タイプが存在するかどうかを常にチェックすることが重要です。H&E染色により、作製した同等物の構造に4種類の皮膚細胞すべてが存在することを確認しました。
遭遇する最も一般的な問題は、取得したモデルの取り扱いにおける繊細さと直感です。いくつかの困難は、細胞球の形成およびヒドロゲル調製に関連している可能性があります。細胞培養中に、他のいくつかの問題も発生する可能性があります。これには、微生物感染、細胞の低増殖率、モデルに使用した初代細胞の老化、初代細胞と細胞株から再構築された2Dおよび3Dモデルの最大培養時間などが含まれます。 表10では、次のいずれかの問題が発生した場合の対処方法について、いくつかの実践的なアドバイスが集められています。
| 細胞培養における一般的な問題 | 提案 | |||
| 微生物感染 | 細胞を含むフラスコ/ディッシュの1つで微生物感染が発生した場合は、感染した培養物をできるだけ早く取り除くことをお勧めします(残りのフラスコ/ディッシュを細胞で汚染しないようにするため)。新しいバイアルを細胞で再凍結します。 感染が再発した場合は、適用された抗生物質のスペクトルを広げて、それらの濃度を上げるように試みるのが良いでしょう。 | |||
| 細胞の増殖率が低い | 一部の細胞は倍加時間が長いです。それらの増殖を刺激するために、いくつかの細胞特異的成長因子を塩基性培地に添加することができます。また、基礎培地中のFBSまたはL-グルタミンの濃度を上げると、細胞の成長を刺激するのに役立つ可能性があります。 | |||
| モデルに使用した初代細胞の老化 | 数回の継代の後、初代細胞は老化に入り、分裂を停止します。モデルでこの問題を解決するには、できるだけ早い時期に継代したセルを使用してモデルを構築することをお勧めします。 | |||
| 初代細胞と細胞株から再構築された2Dおよび3Dモデルの最大培養時間 | モデルの培養時間は、使用する細胞の種類に大きく依存します。初代細胞では、寿命が短いため、培養時間が短くなります。 | |||
| 細胞球形成の難しさ | 一部の細胞は、球体の形成に長い時間を必要とする場合があります。さらに数日経っても球体が形成されない場合は、サンプルから細胞を採取し、例えばトリパンブルー染色で生存率を確認します。 | |||
| 球体の安定性の問題 | 球体が安定しておらず、取り扱い中に破壊される場合は、より少ない数のセルから球体を作成してみてください。球体が成長している皿は常にそっと移すようにしてください。 | |||
| ハイドロゲル調製の問題 | 成分(水、PBS[10x]、NaOH、コラーゲン1型)の割合が正しいか確認してください。コラーゲンの原液は通常、非常に密度が高いため、ゆっくりとピペッティングするようにしてください。気泡はハイドロゲルの形態を乱すため、ゲルのリバースピペッティングがこの問題を解決するのに役立つ場合があります。 | |||
表10:細胞培養のトラブルシューティング
(1)医薬品や化粧品に利用するための生物活性を有する新規化合物の細胞毒性・遺伝毒性実験49、(2)種々の因子刺激実験50、(3)皮膚細胞、その生体機能、他の細胞や環境との相互作用に関する知識を深める基礎研究51、52、(4)特定の種類の細胞を作成されたモデルに導入できる選択された疾患実体に関する研究(癌細胞、特定の遺伝子に変異を持つ細胞など14,53)など。言うまでもなく、これらのモデルの適用は、製品試験や科学研究における動物のより倫理的な使用のための3Rの原則と一致しており、化粧品の動物試験の禁止法に違反していないことは言うまでもありません。
開示事項
著者は、利益相反を宣言しません。
謝辞
著者らは、ワルシャワ工科大学が「Excellence Initiative - Research University」プログラムから、POB BIB BIOTECHMED-2 start(no. 1820/2/ZO1/POB4/2021)と学長の学生研究グループ助成金(SKIN-ART, no. 1820/116/Z16/2021)の2つの助成金の形で財政支援を提供してくれたことに感謝しています。さらに、著者らは、ワルシャワ工科大学化学科のJoanna Cieśla教授とDrug and Cosmetics BiotechnologyのChair、およびBiotechnology Science Club 'Herbion'から受けた支援に感謝したいと思います。特に、コンパウンドPluronic F-127を提供してくださったMichał Stepulak博士に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 24-well plate for adherent cell culture | Biologix Europe GmbH | 07-6024 | - |
| 35%–38% HCL | Chempur | 115752837 | - |
| 60 mm cell culture Petri dish | Nest | 705001 | - |
| Avidin−Sulforhodamine 101 | Sigma Aldrich | A2348-5MG | - |
| Bright-field inverted microscope | Olympus | CKX41 | - |
| Calcium chloride | Avantor | 874870116 | - |
| Cell culture flask T75 for adherent cells | Genoplast | G77080033 | - |
| Centrifuge tube 15 mL | GoogLab Scientific | G66010522 | - |
| CO2 Incubator | Heal Force | Galaxy 170R | - |
| Col1A2 antibody produced in rabbit | Novus | NBP2-92790 | - |
| Corning(R) Transwell(R) Polycarbonate | Corning | CLS3422-48EA | - |
| Cytokeratin 14 antibody produced in mouse | Novus | NBP1-79069 | - |
| DPX Mountant for histology | Sigma Aldrich | 06522-100ML | - |
| Dulbecco's Modified Eagle Medium (DMEM) | VWR Chemicals | L0102-500 | - |
| Eosine Y | Kolchem | - | 0.5 % aquatic solution |
| Eppendorf tube 1.5 mL | Sarstedt | 72.690.001 | - |
| Eppendorf tube 2 mL | Sarstedt | 72.691 | - |
| Ethyl alcohol absolute 99.8% | Avantor | 396480111 | diluted in ultrapure water to the needed concentrations |
| Fetal bovine serum | Gibco | 10270106 | - |
| Fluorescent inverted microscope | Olympus | IX71 | - |
| Goat anti-mouse secondary antibody conjugated with FITC | Sigma Aldrich | F0257-1mL | |
| Goat anti-rabbit secondary antibody conjugated with FITC | Novus | NB7159 | - |
| Harris Hematoxylin | Kolchem | - | 1 mg/mL in 95% ethanol |
| Hoechst 33342 | ThermoFisher | H3570 | - |
| Laminar chamber | Heal Force | HFSafe-1200 | - |
| Melan-A antibody produced in mouse | Santa Cruz Biotechnology | sc-20032 | - |
| Microtome | Microm | HM355S | - |
| NaOH | Avantor | 810981997 | - |
| Paraffin pastilles | Sigma Aldrich | 1.07164 | - |
| Paraformaldehyde | Sigma Aldrich | 1581227 | - |
| Penicillin/Streptomycin solution | Sigma Aldrich | P4333 | - |
| Pipette tip, 1000 µL | Sarstedt | 70.305 | - |
| Pipette tip, 20 µL | Sarstedt | 70.3021 | - |
| Pipette tip, 200 µL | Sarstedt | 70.303 | - |
| Pluronic F-127 | BASF | 50401036 | - |
| Serological pipette 10 mL | GoogLab Scientific | G33270011 | - |
| Serological pipette 25 mL | GoogLab Scientific | G33280011 | - |
| Serological pipette 5 mL | GoogLab Scientific | G33260011 | - |
| Sodium bicarbonate | Sigma Aldrich | S5761 | - |
| Sodium bicarbonate | Chempur | 118105307 | |
| Trypsin-EDTA 0.25% solution, phenol red | Sigma Aldrich | 25200072 | - |
| Type 1 collagen | IBIDI | 50201 | - |
| U-bottom 96-well plate | Sarstedt | 83.3925500 | - |
| Xylene | Sigma Aldrich | 534056 | - |
参考文献
- Farage, M. A., Miller, K. W., Elsner, P., Maibach, H. I. Characteristics of the aging skin. Advances in Wound Care. 2 (1), 5-10 (2013).
- Zhu, H., Alikhan, A., Maibach, H. I. Biology of Stratum Corneum: Tape Stripping and Protein Quantification. Textbook of Aging Skin. Farage, M. A., Miller, K. W., Maibach, H. I. , Springer Berlin Heidelberg. Berlin, Heidelberg. (2015).
- Boer, M., Duchnik, E., Maleszka, R., Marchlewicz, M. Structural and biophysical characteristics of human skin in maintaining proper epidermal barrier function. Postepy Dermatogogii I Alergologii. 33 (1), 1-5 (2016).
- De Falco, M., Pisano, M. M., De Luca, A. Embryology and Anatomy of the Skin. In Skin Cancer: A Practical Approach. Current Clinical Pathology. Baldi, A., Pasquali, P., Spugnini, E. P. , Springer. New York. (2014).
- Dehdashtian, A., Stringer, T. P., Warren, A. J., Mu, E. W., Amirlak, B., Shahabi, L. Anatomy and Physiology of the Skin. Melanoma: A Modern Multidisciplinary Approach. Riker, A. I. , Springer International Publishing: Cham. 15-26 (2018).
- Graham, H. K., Eckersley, A., Ozols, M., Mellody, K. T., Sherratt, M. J. Human Skin: Composition, Structure and Visualisation Methods. Skin Biophysics; Studies in Mechanobiology, Tissue Engineering, and Biomaterials. Limbert, G. 22, Springer International Publishing: Cham. 1-18 (2019).
- Piasek, A. M., Musolf, P., Sobiepanek, A. Aptamer-based advances in skin cancer research. Current Medicinal Chemistry. 30 (8), 953-973 (2023).
- Bergfeld, W. F., Belsito, D. V., Marks, J. G., Andersen, F. A. Safety of ingredients used in cosmetics. Journal of the American Academy of Dermatology. 52 (1), 125-132 (2005).
- Hubrecht, R. C., Carter, E. The 3Rs and humane experimental technique: Implementing change. Animals. 9 (10), 754(2019).
- Sreedhar, D., Manjula, N., Ajay, P., Shilpa, P., Ligade, V. Ban of cosmetic testing on animals: A brief overview. International Journal of Current Research and Review. 12 (14), 113-116 (2020).
- Silva, R. J., Tamburic, S. A state-of-the-art review on the alternatives to animal testing for the safety assessment of cosmetics. Cosmetics. 9 (5), 90(2022).
- Xu, Y., Shrestha, N., Préat, V., Beloqui, A. An overview of in vitro, ex vivo and in vivo models for studying the transport of drugs across intestinal barriers. Advanced Drug Delivery Reviews. 175, 113795(2021).
- Boelsma, E., Ponec, M. Basics (Guidelines) on Cell Culture Testing for Topical/Dermatological Drugs/Products and Cosmetics With Regard to Efficacy and Safety of the Preparations. In Dermatopharmacology of Topical Preparations. Gabard, B., Surber, C., Elsner, P., Treffel, P. , Springer Berlin Heidelberg. Berlin, Heidelberg. 37-57 (2000).
- Suhail, S., Sardashti, N., Jaiswal, D., Rudraiah, S., Misra, M., Kumbar, S. G. Engineered skin tissue equivalents for product evaluation and therapeutic applications. Biotechnology Journal. 14 (7), 1900022(2019).
- Sobiepanek, A., et al. Novel diagnostic and prognostic factors for the advanced melanoma based on the glycosylation-related changes studied by biophysical profiling methods. Biosensors and Bioelectronics. 203, 114046(2022).
- Yang, H., Sun, L., Liu, M., Mao, Y. Patient-derived organoids: A promising model for personalized cancer treatment. Gastroenterology Report. 6 (4), 243-245 (2018).
- Baran, J., et al. Mast cells as a target-A comprehensive review of recent therapeutic approaches. Cells. 12 (8), 1187(2023).
- Kosten, I. J., Buskermolen, J. K., Spiekstra, S. W., de Gruijl, T. D., Gibbs, S. Gingiva equivalents secrete negligible amounts of key chemokines involved in langerhans cell migration compared to skin equivalents. Journal of Immunology Research. 2015, 627125(2015).
- cieżyńska, A., et al. A novel and effective method for human primary skin melanocytes and metastatic melanoma cell isolation. Cancers. 13 (24), 6244(2021).
- Kröger, M., et al. In vivo non-invasive staining-free visualization of dermal mast cells in healthy, allergy and mastocytosis humans using two-photon fluorescence lifetime imaging. Scientific Reports. 10 (1), 14930(2020).
- Liu, D., Chen, S., Win Naing, M. A review of manufacturing capabilities of cell spheroid generation technologies and future development. Biotechnology and Bioengineering. 118 (2), 542-554 (2021).
- Rossi, A., Appelt-Menzel, A., Kurdyn, S., Walles, H., Groeber, F. Generation of a three-dimensional full thickness skin equivalent and automated wounding. Journal of Visualized Experiments: JoVE. (96), e52576(2015).
- Kim, K., Kim, J., Kim, H., Sung, G. Y. Effect of α-lipoic acid on the development of human skin equivalents using a pumpless skin-on-a-chip model. International Journal of Molecular Sciences. 22 (4), 2160(2021).
- Curto, E. V., Lambert, G. W., Davis, R. L., Wilborn, T. W., Dooley, T. P. Biomarkers of human skin cells identified using DermArray DNA arrays and new bioinformatics methods. Biochemical and Biophysical Research Communications. 291 (4), 1052-1064 (2002).
- Godwin, L. S., et al. Isolation, culture, and transfection of melanocytes. Current Protocols in Cell Biology. 63, 1-20 (2014).
- Przekora, A., Zarnowski, T., Ginalska, G. A simple and effective protocol for fast isolation of human tenon's fibroblasts from a single trabeculectomy biopsy - a comparison of cell behaviour in different culture media. Cellular & Molecular Biology Letters. 22, 5(2017).
- Rådinger, M., Jensen, B. M., Kuehn, H. S., Kirshenbaum, A., Gilfillan, A. M. Generation, Isolation, and Maintenance of Human Mast Cells and Mast Cell Lines Derived from Peripheral Blood or Cord Blood. Current Protocols in Immunology. Coligan, J. E., Bierer, B. E., Margulies, D. H., Shevach, E. M., Strober, W. , John Wiley & Sons, Inc. Hoboken, NJ. (2010).
- Artuc, M., Muscha Steckelings, U., Henz, B. M. Mast cell-fibroblast interactions: Human mast cells as source and inducers of fibroblast and epithelial growth factors. Journal of Investigative Dermatology. 118 (3), 391-395 (2002).
- Panos, R. J., Rubin, J. S., Csaky, K. G., Aaronson, S. A., Mason, R. J. Keratinocyte growth factor and hepatocyte growth factor/scatter factor are heparin-binding growth factors for alveolar type ii cells in fibroblast-conditioned medium. Journal of Clinical Investigation. 92 (2), 969-977 (1993).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Threedimensional cell culture: A powerful tool in tumor research and drug discovery (Review). Oncology Letters. 14 (6), 6999-7010 (2017).
- Amaral, R. L. F., Miranda, M., Marcato, P. D., Swiech, K. Comparative analysis of 3D bladder tumor spheroids obtained by forced floating and hanging drop methods for drug screening. Frontiers in Physiology. 8, 605(2017).
- Gao, B., Jing, C., Ng, K., Pingguan-Murphy, B., Yang, Q. Fabrication of three-dimensional islet models by the geometry-controlled hanging-drop method. Acta Mechanica Sinica. 35 (2), 329-337 (2019).
- Zhang, C., et al. 3D culture technologies of cancer stem cells: Promising ex vivo tumor models. Journal of Tissue Engineering. 11, (2020).
- Sobiepanek, A., Paone, A., Cutruzzolà, F., Kobiela, T. Biophysical characterization of melanoma cell phenotype markers during metastatic progression. European Biophysics Journal: EBJ. 50 (3-4), 523-542 (2021).
- Jin, G. -Z., Kim, H. -W. Effects of Type I collagen concentration in hydrogel on the growth and phenotypic expression of rat chondrocytes. Tissue Engineering and Regenerative. 14 (4), 383-391 (2017).
- Osidak, E. O., et al. Concentrated collagen hydrogels: A new approach for developing artificial tissues. Materialia. 20, 101217(2021).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: Characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Jimbow, K., Salopek, T. G., Dixon, W. T., Searles, G. E., Yamada, K. The epidermal melanin unit in the pathophysiology of malignant melanoma. The American Journal of Dermatopathology. 13 (2), 179-188 (1991).
- Van Den Bogaard, E., et al. Perspective and consensus opinion: Good practices for using organotypic skin and epidermal equivalents in experimental dermatology research. Journal of Investigative Dermatology. 141 (1), 203-205 (2021).
- Bednarek, R. In vitro methods for measuring the permeability of cell monolayers. Methods and Protocols. 5 (1), 17(2022).
- Idrees, A., et al. Fundamental in vitro 3D human skin equivalent tool development for assessing biological safety and biocompatibility - towards alternative for animal experiments. 4 Open. 4, (2021).
- Park, H. -Y., Kweon, D. -K., Kim, J. -K. Upregulation of tight junction-related proteins by hyaluronic acid in human HaCaT keratinocytes. Bioactive Carbohydrates and Dietary Fibre. 30, 100374(2023).
- Choudhury, S., Das, A. Advances in generation of three-dimensional skin equivalents: Pre-clinical studies to clinical therapies. Cytotherapy. 23 (1), 1-9 (2021).
- Zhang, Z., Michniak-Kohn, B. B. Tissue engineered human skin equivalents. Pharmaceutics. 4 (1), 26-41 (2012).
- Woappi, Y., Altomare, D., Creek, K. E., Pirisi, L. Self-assembling 3D spheroid cultures of human neonatal keratinocytes have enhanced regenerative properties. Stem Cell Research. 49, 102048(2020).
- Ouwehand, K., Spiekstra, S. W., Waaijman, T., Scheper, R. J., de Gruijl, T. D., Gibbs, S. Technical advance: Langerhans cells derived from a human cell line in a full-thickness skin equivalent undergo allergen-induced maturation and migration. Journal of Leukocyte Biology. 90 (5), 1027-1033 (2011).
- Akther, F., Little, P., Li, Z., Nguyen, N. -T., Ta, H. T. Hydrogels as artificial matrices for cell seeding in microfluidic devices. RSC Advances. 10 (71), 43682-43703 (2020).
- Silva, A. K. A., Richard, C., Bessodes, M., Scherman, D., Merten, O. -W. Growth factor delivery approaches in hydrogels. Biomacromolecules. 10 (1), 9-18 (2009).
- Lee, H. -R., et al. Effect of Aronia extract on collagen synthesis in human skin cell and dermal equivalent. Oxidative Medicine and Cellular Longevity. 2022, 4392256(2022).
- Mulder, P. P. G., Raktoe, R. S., Vlig, M., Elgersma, A., Middelkoop, E., Boekema, B. K. H. L. Full skin equivalent models for simulation of burn wound healing, exploring skin regeneration and cytokine response. Journal of Functional Biomaterials. 14 (1), 29(2023).
- Goncalves, K., et al. Investigation into the effect of skin tone modulators and exogenous stress on skin pigmentation utilizing a novel bioengineered skin equivalent. Bioengineering & Translational Medicine. 8 (2), 10415(2023).
- Michel, M., L'Heureux, N., Pouliot, R., Xu, W., Auger, F. A., Germain, L. Characterization of a New Tissue-Engineered Human Skin Equivalent with Hair. In Vitro Cellular & Developmental Biology. Animal. 35 (6), 318-326 (1999).
- Müller, I., Kulms, D. A 3D organotypic melanoma spheroid skin model. Journal of Visualized Experiments: JoVE. (135), e57500(2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved