Method Article
Çok Sayıda Uygulama için Cilt Modelleri Oluşturma - İki Boyutlu (2D) Monokültürden Üç Boyutlu (3D) Çoklu Kültüre
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, bir hücre kültürü laboratuvarında rutin araştırmalar için çeşitli 3D cilt modellerini tanıtmak için ucuz ve basit prosedürler sunuyoruz. Araştırmacılar, ticari olarak mevcut modellere güvenmeden ihtiyaçlarına göre uyarlanmış modeller oluşturabilirler.
Özet
Cildin karmaşık yapısı ve önemli işlevleri nedeniyle kozmetik, ilaç ve tıp endüstrileri için ilginç bir araştırma modelidir. Avrupa Birliği'nde, kozmetik ürünlerin ve içeriklerinin hayvanlar üzerinde test edilmesi tamamen yasaklanmıştır. Tıp ve eczacılık söz konusu olduğunda, bu olasılık da sürekli olarak sınırlıdır. 3Rs ilkesine uygun olarak, yapay olarak oluşturulmuş modellerde tek tek bileşiklerin yanı sıra tüm formülasyonları test etmek giderek daha yaygın hale geliyor. En ucuz ve en yaygın kullanılanı, bir hücre tek tabakasından oluşan ancak dokudaki hücreler arasındaki gerçek etkileşimleri yansıtmayan 2D modellerdir. Ticari olarak temin edilebilen 3D modeller dokunun daha iyi bir temsilini sağlasa da, büyük ölçekte kullanılmazlar. Bunun nedeni, pahalı olmaları, bekleme süresinin oldukça uzun olması ve mevcut modellerin genellikle yalnızca tipik olarak kullanılanlarla sınırlı olmasıdır.
Yapılan araştırmaları daha üst seviyelere taşımak için çeşitli 3D cilt modeli hazırlıklarının prosedürlerini optimize ettik. Açıklanan prosedürler, çok sayıda laboratuvarda ve hücre kültüründe farklı deneyimlere sahip araştırmacılar tarafından uygulanabildiği için ucuz ve hazırlanması kolaydır.
Giriş
Deri, bu karmaşık organın düzgün işleyişini ve homeostazını ortaya çıkaran çok hücreli etkileşimlere sahip sürekli bir yapıdır. Morfolojik olarak farklı katmanlardan inşa edilmiştir: iç katman - dermis ve dış katman - epidermis. Epidermisin üstünde, dış ortama karşı en büyük korumayı sağlayan stratum corneum'u (düzleştirilmiş ölü hücrelerden - korneositlerden oluşan) ek olarak ayırt ederiz. Derinin en önemli pasif ve aktif fonksiyonlarından bazıları vücudun dış etkenlere karşı korunması, immünolojik süreçlere katılım, salgılanması, rezorpsiyon, termoregülasyon ve algılamadır 1,2,3. Vücuttaki en büyük organlardan biri olarak kabul edildiğinden, çeşitli patojenler, alerjenler, kimyasallar ve ultraviyole (UV) radyasyon ile temastan kaçınmak imkansızdır. Bu nedenle, belirli işlevlere sahip birçok hücre türü ile yapılandırılmıştır. Epidermiste bulunan ana hücre türleri keratinositlerdir (epidermisin daha derin kısımlarında yapısal ve immünolojik işlevlere sahip, ancak daha sonra epidermisin üst tabakasındaki korneositlere dönüşmek için keratinizasyon işlemine tabi tutulan tüm hücrelerin neredeyse% 90'ı), melanositler (UV koruyucu pigment melanin üreten epidermal hücre popülasyonunun sadece% 3-7'si) ve Langerhans hücreleri (bağışıklık sisteminden). Dermis söz konusu olduğunda, ana hücreler fibroblastlar (büyüme faktörleri ve proteinler üreten), dendritik hücreler ve mast hücreleridir (bağışıklık sisteminin her iki hücre tipi)4,5,6. Ayrıca, cilt birkaç hücre dışı protein (kollajen tip I ve IV, fibronektin ve laminin gibi; Şekil 1) ve cildin spesifik yapısını sağlayan ancak aynı zamanda hücre bağlanmasını, hücre yapışmasını ve diğer etkileşimleri teşvik eden protein lifleri (kolajen ve elastin)7.
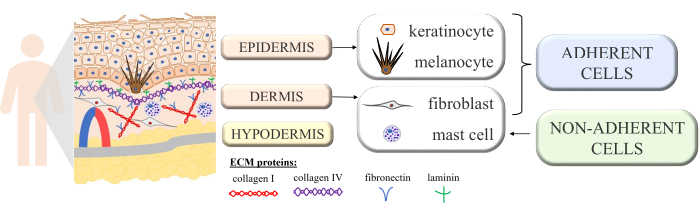
Şekil 1: Cilt yapısını gösteren şematik. Cilt yapısı, tek tek katmanlarında meydana gelen dört temel hücre tipini ve hücre dışı matrisin ayırt edici proteinlerini işaretledi. Bu şekil MS PowerPoint ile oluşturulmuştur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Kozmetik ve farmasötik ürünlerin güvenliği çok önemli bir konudur ve tüketicilerin ve hastaların sağlığının korunması önceliklidir8. Yakın zamana kadar, hayvanlar üzerinde yapılan çalışmalar da dahil olmak üzere çok sayıda testle garanti altına alınması gerekiyordu. Ne yazık ki, bunlar genellikle araştırma amaçlı kullanılan hayvanlarda (sıklıkla fareler, sıçanlar ve domuzlar) acı ve ıstıraba neden olan sert yöntemlerin kullanılmasını gerektirdi. 1959'da, İnsancıl Deney Tekniğinin İlkeleri (3R ilkesi) tanıtıldı: (1 - Değiştirme) araştırmadaki hayvanları in vitro, sillico veya ex vivo modellerle değiştirmek, (2 - Azaltma) araştırma için kullanılan hayvan sayısını azaltmak ve (3 - İyileştirme) araştırma için hala ihtiyaç duyulan hayvanların refahını iyileştirmek ve aynı zamanda geliştirilen alternatif yöntemleri geliştirmek9. Ayrıca Avrupa Birliği'nde (AB) hayvanlar üzerinde yapılan kozmetik testler yasalarla düzenlenmektedir. 11 Eylül 2004'ten itibaren hayvanlar üzerinde test edilen kozmetik ürünlere yönelik yasak yürürlüğe girdi. 11 Mart 2009'da AB, kozmetik bileşenlerin hayvanlar üzerinde test edilmesini yasakladı. Hayvanlar üzerinde test edilmiş yeni bileşenlerden yapılmış kozmetik ürünlerin satışına izin verilmedi; Bununla birlikte, ürünlerin tekrar doz toksisitesi, üreme toksisitesi ve toksikokinetik gibi karmaşık insan sağlığı sorunları için hayvanlar üzerinde test edilmesi hala kabul edilebilirdi. 11 Mart 2013 tarihinden itibaren AB'de, bitmiş ürünün veya bileşenlerinin hayvanlar üzerinde test edildiği kozmetik ürünlerinin satışı yasa dışıdır10. Bu nedenle, şu anda kozmetolojide araştırma üç düzeyde yürütülmektedir: in vitro (hücreler), ex vivo (gerçek dokular) ve in vivo (gönüllüler)11. Farmasötikler söz konusu olduğunda, hayvanlar üzerinde test etme ihtiyacı devam etmektedir; Bununla birlikte, önemli ölçüde azaltılır ve sıkı bir şekilde kontrol edilir12.
Hayvan testlerine alternatif yöntemler olarak ve yeni bir aktif bileşenin etkinliğinin ilk değerlendirmesi için in vitro deri hücre kültürleri kullanılır. Farklı tipteki cilt hücrelerinin izolasyonu ve steril laboratuvar koşullarında yetiştirilmesi, aktif maddelerin güvenliğini ve toksisitesini değerlendirmeye izin verir. Deri hücre hatları, hücreler sertifikalı şirketler tarafından satıldığından ve sonuçlar farklı laboratuvarlarda karşılaştırılabilir olduğundan, araştırma için yaygın olarak tanınan modellerdir. Bu testler genellikle insan derisi hücresi monokültürlerinin basit 2D modelleri üzerinde gerçekleştirilir. Daha gelişmiş modellerden bazıları, ko-kültürleri (fibroblastlı keratinositler ve melanositli keratinositler gibi) ve ayrıca iskelesiz kültürler (küreler) ve epidermisin, dermisin ve hatta cildin tam kalınlıktaki ikamelerinin iskele tabanlı deri eşdeğerleri dahil olmak üzere üç boyutlu modellerdir13. Son tip (cilt eşdeğerleri) dışında, geri kalanının ticari olarak mevcut olmadığını ve gerekirse bir bilim adamının bunları kendi başına hazırlaması gerektiğini belirtmekte fayda var.
Bu modellerin birçoğu korunmuş ve günümüzde rutin olarak satılmış olsa da (Tablo 1), sonuçların çoğunu doğrulamak için sürekli olarak ek modellere ihtiyaç duyulmaktadır. Bu nedenle, yeni tasarlanmış modeller, insan vücudunda meydana gelen gerçek etkileşimleri daha iyi yeniden yaratmalıdır. Bu tür modelleri oluşturmak için farklı tipteki hücrelerin bir karışımı kullanıldığında, dokunun çok hücreli yönünün in vivo olarak çoğaltılması sağlanabilir. Sonuç olarak, organotipik bir kültür geliştirilmiştir (Şekil 2).
| Ad | Açıklama | |||||
| Normal cilt | Epi Cilt | Yeniden Yapılandırılmış İnsan Epidermisi - Kollajen zarı üzerindeki keratinositler | ||||
| SkinEthic RHE | Yeniden Yapılandırılmış İnsan Epidermisi - Polikarbonat membran üzerinde keratinositler | |||||
| Cilt Etiği RHE-LC | İnsan Epidermal Model Langerhans Hücreleri - Polikarbonat membran üzerinde keratinositler ve Langerhans hücreleri | |||||
| Cilt Etiği RHPE | Yeniden Yapılandırılmış İnsan Pigmentli Epidermis - Polikarbonat membran üzerinde Keratinositler ve Melanositler | |||||
| T-Cilt | Yeniden Yapılandırılmış İnsan Tam Kalınlıkta Cilt Modeli - Polikarbonat bir zar üzerinde büyütülen bir Fibroblast tabakası üzerindeki keratinositler | |||||
| Phenion FT Dış Görünüm modeli | Hidrojeldeki Keratinositler ve Fibroblastlar | |||||
| Hastalıklı cilt | Melanom FT Cilt Modeli | İnsan Malign Melanom hücre hattı A375 ile normal insan kaynaklı Keratinositler ve Fibroblastlar | ||||
| Sedef Hastalığı Doku Modeli | Normal insan Keratinositleri ve Fibroblastları | |||||
Tablo 1: Çeşitli çalışmalar için en popüler ticari cilt eşdeğerleri.
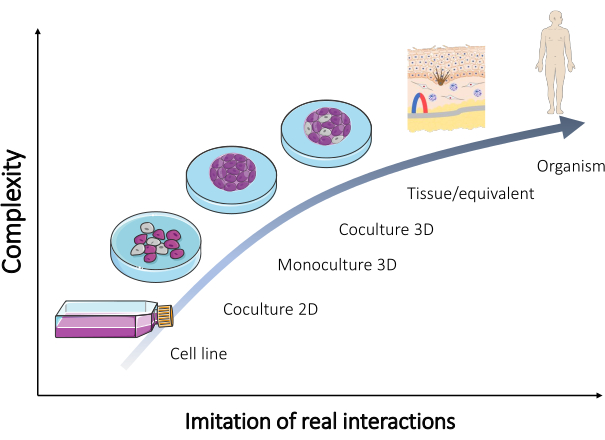
Şekil 2: Farklı in vitro modellerin karmaşıklığı. Bir organizmayı yeniden yaratmak için farklı in vitro modellerin karmaşıklığı ile doğrudan insan vücudunda meydana gelen gerçek etkileşimler arasındaki ilişki. Figür, Servier (https://smart.servier.com/) tarafından Servier Medical Art'ın "Mikrobiyoloji ve hücre kültürü" setinden değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ticari eşdeğerlerin en önemli sınırlamalarından biri, birkaç hücre tipine (tipik olarak 1-2, nadiren 3) sahip çok genel araştırma modellerinin mevcudiyetidir. Yine de, ciltte çok daha fazla hücre bulunur ve bunların birbirleriyle etkileşimi, çeşitli bileşenlerin daha iyi veya daha kötü toleransını sağlayabilir14. Bazı bağışıklık bileşenlerinin eksikliği, immünoterapi de dahil olmak üzere çeşitli araştırma türlerinde değerini azaltabilir. Melanomun metastaz başlangıcı ve uygulanan tedaviye sık direnç göstermesi nedeniyle hayatı tehdit eden bir deri kanseri olması nedeniyle bu durum ciddi bir sorundur15. Yapay deri modelini geliştirmek için, araştırmacılar hücre hatları ve organoidler16 ile bağışıklık hücrelerinin bir ko-kültürünü oluşturmaya çalışırlar ve bu, incelenen modellerin büyük bir gelişimi olarak kabul edilir. Örneğin, mast hücreleri deride birçok fizyolojik (yara iyileşmesi, dokunun yeniden şekillenmesi) ve patolojik (iltihaplanma, anjiyogenez ve tümör ilerlemesi) süreçte yer alır17. Bu nedenle, modeldeki oluşumları, modelin incelenen bileşiğe verdiği tepkiyi önemli ölçüde değiştirebilir. Son olarak, ciltle ilgili pek çok bilgi hala eksiktir ve bunlar yalnızca temel araştırmalar yapılarak keşfedilebilir. Bu nedenle farklı yapay cilt modelleri oluşturmak ve rafine etmek (Tablo 2) çok önemli bir çabadır. Bu makale, küreler ve cilt eşdeğerleri dahil olmak üzere gelişmiş cilt modelleri oluşturmak için çeşitli prosedürler sunar.
| İn vitro cilt modeli | Dokuda meydana gelen etkileşimleri yeniden yaratmaya çalışın | Kullanılan hücrelere örnekler |
| 2D veya 3D hücre kültürü | Epidermis | Keratinositler |
| Melanositler | ||
| Keratinositler + Melanositler | ||
| Dermıs | Fibroblastlar | |
| Mast hücreleri | ||
| Fibroblastlar + Mast hücreleri | ||
| Cilt | Keratinositler + Fibroblastlar | |
| Keratinositler + Mast hücreleri | ||
| Melanositler + Fibroblastlar | ||
| Melanositler + Mast hücreleri | ||
| Keratinositler + Fibroblastlar + Melanositler | ||
| Keratinositler + Fibroblastlar + Mast hücreleri |
Tablo 2: 2D ve 3D kültürde cilt dokusunu yeniden oluşturmak için hücre tipi karışım örnekleri.
Protokol
Çalışma, Helsinki Bildirgesi yönergelerine göre yürütülmüş ve Varşova Tıp Üniversitesi Etik Kurulu tarafından onaylanmıştır (KB/7/2022). Çalışmaya dahil olan tüm deneklerden bilgilendirilmiş onam alındı.
NOT: Gelişmiş cilt modeli hazırlığının açıklanan prosedürleri, ticari olarak temin edilebilen birincil cilt hücreleri ve hücre dizileri kullanılarak veya hastalardan izole edilen birincil hücrelerle gerçekleştirilebilir. Ticari hücreler ilgili belgelerle birlikte verilir ve çoğu ülke için araştırmalarda kullanımları herhangi bir ek onay gerektirmez. Ancak bazı ülkeler için zorunludur, bu nedenle Yerel Etik Kurul düzenlemeleri ile kontrol edilmesi gerekmektedir. Hastalardan izole edilen birincil hücrelerin araştırmada kullanılması gerekiyorsa, öncelikle çalışmanın Yerel Etik Kurul tarafından onaylanması ve onların katı yönergelerine göre yürütülmesi gerekir. Ayrıca, tüm cilt dokusu bağışçılarından yazılı bilgilendirilmiş onam alınmalıdır. Birincil cilt hücrelerinin izolasyonu bu makalenin konusu değildi, ancak örnek izolasyon prosedürleri Kosten ve ark. (keratinositler)18, Ścieżyńska ve ark. (melanositler)19, Kröger ve ark. (fibroblastlar ve mast hücreleri)20. Normal cilt hücrelerinin ve hücre hatlarının çoğu BSL1 sınıfı güvenlik seviyesine sahiptir; Herhangi bir tehdide neden olmazlar. Bununla birlikte, kullanılan laboratuvar ekipmanının kontrollü koşullar altında hayvan ve insan hücre kültürü standartlarını karşılaması gerekir.
1. Cilt hücre kültürü
NOT: Deri hücre kültürleri, 37 °C'de ve bir inkübatörde %5'lik bir karbondioksit içeriğinde, yapışık veya süspansiyon hücrelerine (hücre tipine bağlı olarak) ayrılmış şişelerde gerçekleştirilmelidir. Yetiştirilmeleri ve araştırma amaçlı kullanımları ile ilgili faaliyetler steril koşullar gerektirir ve 15-30 dakika boyunca ultraviyole C (UVC) ışınlarına maruz kaldıktan sonra laminer bir odada yapılmalıdır. Daha sonra iki ve üç boyutlu modelleri oluşturmak için kullanılan hücre süspansiyonlarının elde edilmesi, hücre tipine bağlı olarak prosedürlerin uygulanmasını gerektirir (keratinositler, fibroblastlar ve melanositler gibi yapışık hücreler için - adım 1.1, mast hücrelerinin yapışık olmayan hücreleri için - adım 1.2) (Şekil 3). Farklı kültür şişesi boyutları için, açıklanan yöntemlerde kullanılan tüm reaktiflerin (orta, fosfat tamponlu salin veya tripsin çözeltisi gibi) hacimleri Tablo 3'te listelenmiştir. Hücre tipine bağlı parametreler (örneğin, reaktiflerin konsantrasyonu ve bileşimi, santrifüjleme yöntemi, vb.) Tablo 4'te sıralanmıştır. Tohumlama için kullanılan hücre yoğunlukları Tablo 5'te gösterilmiştir. Tüm bu tablolar bu bölümün sonunda yer almaktadır.
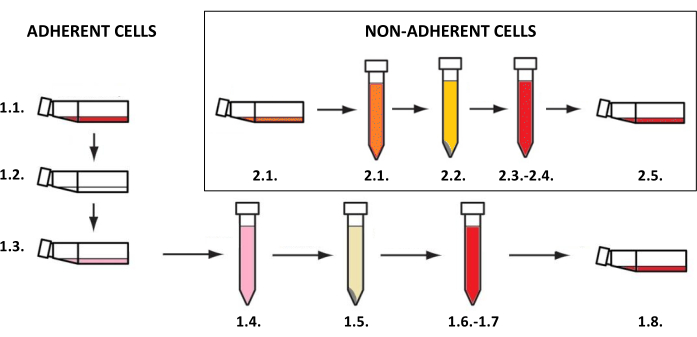
Şekil 3: Yapışık ve yapışık olmayan hücre ekimi. Yapışık ve yapışık olmayan hücre ekiminin genel adım adım prosedürü (sayılar, adım 1.1 ve 1.2'nin açıklamalarına karşılık gelir). Şekil MS PowerPoint ile oluşturulmuştur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Yapışık hücrelerin bir süspansiyonunun elde edilmesi
- Ortamı kültür şişesinden çıkarın.
- Hücreleri fosfat tamponlu tuzlu su ile nazikçe yıkayın (PBS, Tablo 3).
- Etilen diamin tetra asetik asit içinde tripsin çözeltisi ekleyin (tripsin-EDTA çözeltisi, Tablo 3). Şişeyi 37 °C'de inkübe edin ve optik mikroskopta hücrelerin yüzeyden ayrılmasını kontrol edin.
- Tripsini (2: 1) devre dışı bırakmak için ayrılmış hücreleri en az iki kat miktarda tam büyüme ortamı veya tripsin nötrleştiricide askıya alın (hacimler için Tablo 3'e bakın ve reaktifler için Tablo 4'e bakın). Şişenin içeriğini kantitatif olarak 15 mL'lik tüpe aktarın.
- 1.5 mL'lik bir tüpe küçük bir hacim (20 μL) hücre süspansiyonu alın ve hücreleri manuel veya otomatik bir hemositometre ile sayın.
- Tüpü santrifüjleyin ( Tablo 4'teki parametreler), süpernatantın çoğunu çıkarın ve kalan sıvının küçük bir miktarında hücre peletini yeniden süspanse edin. Ardından, hücre yoğunluğu tohumlamak veya yeni ortamın gerekli hacmini yeniden hesaplamak için uygunsa, ön santrifüjleme hacmini ( Tablo 3'teki hacim) elde etmek için yeterli miktarda taze ortam ekleyin.
NOT: Melanositler gibi bazı hücreler santrifüjlemeye karşı çok hassastır, bu nedenle kısa bir süre içinde tekrar santrifüj etme gerekliliğini ortadan kaldırır. - Deney için gerekli yoğunlukta (hücreler / mL, Tablo 5'teki hücre yoğunluğu) hücre süspansiyonunu hazırlayın (2D / 3D mono veya çoklu cilt hücreleri kültürleri).
NOT: Hücreler daha fazla kültürlenecekse, 5.000-8.000 hücre / mL'yi yeni bir şişeye geri koyun ve taze ortam ekleyin ( Tablo 3'teki hacim).
- Yapışmayan hücrelerin bir süspansiyonunun elde edilmesi
- Hücre süspansiyonu ile ortamı kültür şişesinden çıkarın ve kantitatif olarak 15 mL'lik tüpe aktarın.
- Küçük bir hacimde (20 μL) hücre süspansiyonunu 1.5 mL'lik yeni bir tüpe alın. Hücreleri manuel veya otomatik hemositometre ile sayın.
- Tüpü santrifüjleyin ( Tablo 4'teki parametreler), süpernatantın çoğunu çıkarın ve hücreleri kalan sıvının küçük bir miktarında yeniden süspanse edin. Ardından, hücre yoğunluğu tohumlamak için uygunsa ön santrifüjleme hacmini elde etmek için ( Tablo 3'te belirtildiği gibi) taze ortam ekleyin veya yeni ortamın gerekli hacmini yeniden hesaplayın.
- Deney için gerekli yoğunlukta hücre süspansiyonunu hazırlayın ( Tablo 5'te önerildiği gibi mL başına hücreler) (2D / 3D mono veya çoklu cilt hücreleri kültürleri).
NOT: Hücreler daha fazla kültürlenecekse, 5.000-8.000 hücre / mL'yi yeni bir şişeye geri koyun ve taze ortam ekleyin.
| 25 cm2 kültür şişesi | 75 cm2 kültür şişesi | |
| Kültür ortamı [mL] | 4–5 | 8–12 |
| PBS [mL] | 5 | 10 |
| Tripsin-EDTA [mL] | 0.5–1 | 1–2 |
| Nötralizasyon ortamı [mL] | 1–2 | 2–4 |
Tablo 3: Hücre süspansiyonlarının yetiştirilmesi ve hazırlanması sırasında kullanılan reaktiflerin hacimleri.
| Deri hücrelerinin monokültürü | Tripsin | Tripsin devre dışı bırakıcı | Santrifüj | 2D monokültür için orta tip | |
| Keratinositler | 0.25% | tripsin nötralizatörü ile | 300 x g, 5 dk, RT | Keratinosit Büyüme Ortamı 2 | |
| Fibroblastlar | 0.25% | orta ile | 300 x g, 5 dk, RT | DMEM, %10 FBS | |
| Melanositler | 0.025% | tripsin nötralizatörü ile | 300 x g, 3 dk, RT | Orta 254, PMA İçermeyen İnsan Melanosit Büyüme Takviyesi-2 | |
| Mast hücreleri | gerekli değil | gerekli değil | 300 x g, 3 dk, RT | IMDM, %10 FBS, %1 esansiyel olmayan amino asitler, 226 μM α-monotiogliserol | |
Tablo 4: Tripsinizasyon, santrifüjleme parametreleri ve ortam türü hücre tipine bağlıdır.
| Model türü | Hücre yoğunluğu [hücre/mL] | ||
| 2D | Tek katmanlı | Fibroblastlar | 2 x 105 |
| Mast hücreleri | |||
| Keratinositler | |||
| Melanositler | |||
| 3D | Küre (asılı bırakma yöntemi) | Fibroblastlar | 5 x 105 |
| Mast hücreleri | |||
| Keratinositler | |||
| Melanositler | |||
| Hücrelerin karışımı | |||
| Küre (sınırlayıcı hücre yapışması yöntemi) | Fibroblastlar | 2 x 105 | |
| Mast hücreleri | |||
| Keratinositler | |||
| Melanositler | |||
| Hücrelerin karışımı | |||
| Eşdeğer | Fibroblastlar | 1 x 105 | |
| Mast hücreleri | 1 x 104 | ||
| Keratinositler | 8 x 105 | ||
| Melanositler | 5 x 104 | ||
Tablo 5: Farklı cilt modelleri için hücre tohumlama yoğunluğu.
2. Deri hücresi kürelerinin hazırlanması
NOT: Küreler oluşturmak için, asılı damla yönteminin kullanımı adım 2.1'de (Şekil 4) açıklanırken, hücre yapışmasını sınırlamaya odaklanan yaklaşım adım 2.2'de (Şekil 5) gösterilmiştir. Bununla birlikte, küreler çok küçük olduğundan ve kararsız olabileceğinden, bu yöntemler altında gerçekleştirilen faaliyetler sabır, incelik ve yavaş eylemler gerektirir.
- Asılı bırakma yöntemi
- İstenen küre boyutunu elde etmek için uygun bir hücre yoğunluğu kullanın (önerilen hücre yoğunluğu 5 x 105 hücre/mL, Tablo 5).
- Bir Petri kabının veya çok kuyulu bir plakanın kapağına 20 μL hücre süspansiyonu pipetleyin (Şekil 4A).
- Tabağı/tabağı alt kısımla örtün ve yavaşça çevirin (kapaklarda otomatik olarak asılı damlalar oluşturulacaktır, Şekil 4B).
- Ortamın damlacıklardan buharlaşmasını önlemek için plakanın Petri kabını/kuyularını steril bir su/PBS solüsyonu ile doldurun.
- Damlacıkları 37 °C'de 48-72 saat inkübe edin.
NOT: Yerçekimi hücreleri aşağı çeker ve erişilebilir yüzeyin olmaması, hücrenin damara bağlanmasını önler ve hücre agregasyonunu destekler. Bununla birlikte, bazı hücre tipleri daha uzun inkübasyon gerektirebilir. - Bir sonraki adımı gerçekleştirmeden önce, yeni plakanın kuyularını doldurun (veya eski plakayı kuyulardan çıkarılan su / PBS ile kullanın) tam büyüme ortamı (100 μL) ile doldurun.
NOT: Bir sonraki adım için 200 μL uç alın, her bir uç ucunun 1 / 5'ini çıkarın ve kullanmadan önce sterilize edin. - Kesik uçlu steril pipet uçları kullanarak hücre kürelerini çok kuyulu plakanın kuyularına aktarın. 200 μL uç alın, her bir uç ucunun 1/5'ini çıkarın ve kullanmadan önce sterilize edin (Şekil 4C).
NOT: Tabak/tabak çevirme sırasında sıvı akışı kürelere zarar verebileceğinden bu adım zor olabilir. - Daha fazla deney yapmadan önce transfer edilen küreleri çok kuyulu plakada 37 ° C'de 1 gün boyunca inkübe edin (örneğin, bileşik ilavesi, sitotoksisite deneyleri, eşdeğerlere küre girişi) (Şekil 4D).
- Hücre yapışmasını sınırlama yöntemi
- Hücre tohumlamadan önce, U-alt plakanın kuyularını bir yüzey aktif madde çözeltisi ile örtün (örneğin, Pluronic F-127, polietilen glikol, polivinil alkol)21. Her bir kuyucuğa PBS'de 100 μL% 1 yüzey aktif madde çözeltisi hazırlayın ve ekleyin. Plakayı çözelti ile 37 ° C'de 24 saat inkübe edin (Şekil 5A-C). Gerekirse plakayı daha uzun süre saklayın, ancak daha fazla PBS tamponu ekleyerek sıvı seviyesini koruyun.
- Hücre süspansiyonunu oyuk başına 50 μL'de istenen hücre yoğunluğunda hazırlayın (tohumlama sırasında önerilen hücre yoğunluğu 2 x 105 / mL, Tablo 5).
- Lizis yoluyla hücre zarının bozulmasını önlemek için hücreleri tohumlamadan önce yüzey aktif madde çözeltisini kuyucuklardan çıkarın (Şekil 5D).
- Hücre çözeltisini plakaya ekleyin ve hücre agregalarına ulaşmak için 37 ° C'de 24 saat inkübe edin (Şekil 5E). Yaklaşık 1-3 gün sonra, küreler oluşturulacak (Şekil 5F) ve daha sonraki deneyler için kullanıma hazır hale gelecektir.
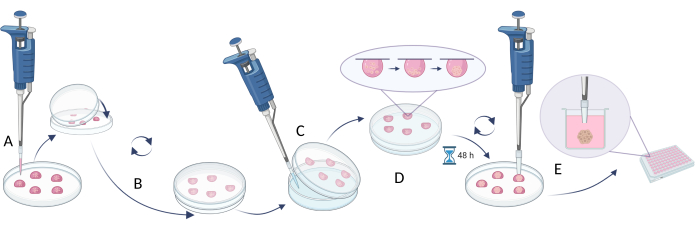
Şekil 4: Asılı bırakma yöntemi. (A) kapak üzerine hücre süspansiyonunun pipetlenmesi ve kapağın tabağın alt kısmı ile kapatılması; (B) asılı damlaları oluşturmak için tabağı döndürmek; (C) çanağın alt kısmına su/PBS ilavesi (sıvı buharlaşmasının sınırlandırılması); (D) hücre küreleri oluşturmak için bulaşıkların asılı damlalarla inkübe edilmesi; (E) şekillendirilmiş küreler ile damlacıkların toplanması ve çok kuyulu plakalarda transfer edilen kürelerin stabilizasyonu. Figür Biorender.com ile oluşturulmuştur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
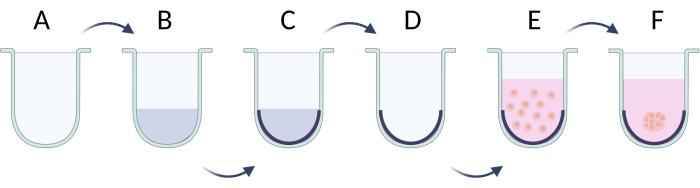
Şekil 5: Sınırlayıcı hücre adezyon yöntemi ile kürelerin adım adım hazırlanması. (A) U-dip kuyusu; (B, C) yüzey aktif madde çözeltisi ile hücre bağlanmasının sınırlandırılması; (D) çözeltinin kuyulardan çıkarılması; (E) tohumlama hücreleri; (F) hücrelerin toplanması ve bir kürenin oluşumu. Figür Biorender.com ile oluşturulmuştur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Tam kalınlıkta deri eşdeğerlerinin hazırlanması
NOT: Tam kalınlıkta (epidermis ve dermis) deri eşdeğerlerinin geliştirilmesi üç aşamaya ayrılabilir (Şekil 6): tipik dermal hücrelerin (fibroblastlar ve mast hücreleri gibi) oluşumu ile yapay dermis tabakasının hazırlanması, yapay epidermise dahil olan hücrelerin tohumlanması (çoğunlukla keratinositler ve melanositler, Şekil 6B) ve olası bir keratinizasyon süreci ile keratinositlerin dikey büyümesi (stratum corneum'un oluşumu, Şekil 6C). Tam kalınlıkta deri eşdeğerlerinin hazırlanması adım 3.1'de (3.1.1-3.1.10) açıklanmıştır. Daha az gelişmiş bir cilt eşdeğerine ihtiyaç duyulursa (örneğin, sadece epidermis tipi), seçilen hücre tipi (keratinositler gibi) doğrudan ticari olarak temin edilebilen kollajen veya polikarbonat membranlara ekilebilir ve ayrıca keratinizasyon sürecini indükleme olasılığı ile yetiştirilebilir (doğrudan adım 3.1.9-3.1.10'a geçin).
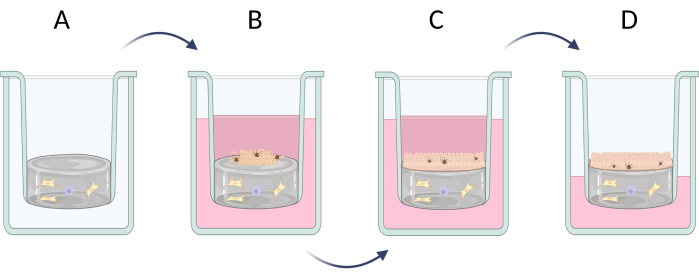
Şekil 6: Eklerde tam kalınlıkta deri eşdeğerlerinin adım adım hazırlanması. (A) dermal hücrelerle psödo-dermis tabakasının hazırlanması, (B) epidermal hücrelerin tohumlanması, (C) ortamda eşdeğer daha fazla kültür, (D) hava-sıvı arayüz kültürü, tabakalı epitel oluşumunu teşvik eder. Figür Biorender.com ile oluşturulmuştur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- 24 oyuklu bir plakada tam kalınlıkta cilt eşdeğerlerinin hazırlanması
- Su, PBS (10x), 1 M NaOH ve tip I kollajen solüsyonu içeren tüpleri buz üzerine yerleştirin.
- Hidrojelde tohumlanacak uygun sayıda dermal hücre (örneğin, fibroblastlar ve mast hücreleri; 10: 1 oranında) belirleyin. Uygun sayıda dermal hücreyi 1.5 mL'lik bir tüpe aktarın ( Tablo 5'teki hücre yoğunluklarına göre 500 μL fibroblast ve 500 μL mast hücresi) ve hücreleri santrifüjleyin (300 x g, 3 dk, RT).
- Süpernatanı çıkarın ve hücreleri 695 μL su / 100 μL PBS (10x) / 5 μL NaOH karışımında nazikçe yeniden süspanse edin.
NOT: Toplam çözeltinin 1 mL'si yeterli değilse, her bir reaktifin hacimlerini yeniden hesaplamak için Tablo 6'yı kullanın. - Karışıma 200 μL kollajen solüsyonu ekleyin ve pipetleyerek nazikçe karıştırın.
NOT: Karışımın kıvamı yoğun olacağından dikkatli olun. - Hazırlanan karışımdan 200 μL'yi 24 oyuklu plakadaki ek parçaya ekleyin. Stratum corneum olmayan bir model için, 24 oyuklu plakanın her bir oyuğuna 500 μL ekleyin.
- Plakayı oda sıcaklığında (RT) 10 dakika inkübe edin ve ardından 30 dakika boyunca inkübatöre aktarın.
NOT: Başka herhangi bir işlemden önce hidrojelin polimerize olup olmadığını kontrol edin. - Hidrojelin yüzeyinde hücre tohumlanmasından önce, bir PBS tamponu (500 μL / kuyucuk) ile durulayın.
- Hidrojelin üzerine ekilecek uygun epidermal hücre sayısını (örneğin, keratinositler ve melanositler; 15: 1 oranında) belirleyin. Hücre karışımını% 10 FBS ile desteklenmiş 500 μL DMEM ortamında hazırlayın (250 μL keratinosit ve 250 μL melanosit ekleyin, hücre yoğunlukları Tablo 4'te belirtilmiştir) ve yavaşça kuyucuklara ekleyin.
NOT: Bazı durumlarda, önce melanositleri tohumlamak ve hidrojel üzerinde iyice yayılmalarına izin vermek daha iyidir ve 24 saat daha sonra ortamı ve tohum keratinositlerini çıkarın. Bu durumda, 250 μL hücre süspansiyonu ve 250 μL ortam ekleyin. - Plakaları 37 ° C'de 2-5 gün boyunca inkübe edin, hücre büyümesinin hızına bağlı olarak, her 48 saatte bir orta değişim (% 10'dan% 1'e% 1'e kadar azalan FBS konsantrasyonu ile) ve optik mikroskopta hücre izleme ile.
- Keratinizasyon işlemi, hidrojelin üzerine tek katmanlı bir keratinosit tabakası elde edildikten sonra indüklenecekse, ek olarak kalsiyum iyonları ve L-askorbik asit ile takviye edilmiş FBS içermeyen ortamı 2-7 hafta daha kullanın (1.5 μM CaCl2 ve 50 μg / mL L-askorbik asit konsantrasyonunda).
NOT: İnkübasyon süresi, kullanılan keratinositlere ve farklılaşma hızlarına bağlıdır.
| Reaktif | Bir reaktifin hacmini hesaplamak için denklem | Örnek hesaplamalar | |
| (son hacim için = Vtoplam 1 mL) | |||
| tip I kollajen çözeltisi | 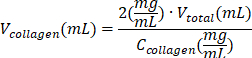 | (Ckollajen = 10 mg/mL) | |
| 0.2 mL = 200 μL | |||
| PBS (10 kat) | 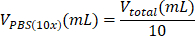 | 0.1 mL = 100 μL | |
| 1 M NaOH | 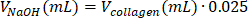 | 0.005 mL = 5 μL | |
| steril H2O | 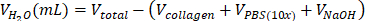 | 0.695 mL = 695 μL | |
Tablo 6: 2 mg / mL kollajen tip I hidrojel preparatı için gerekli reaktif hacimlerinin hesaplanması.
4. Hücre boyama yöntemleri ile 3 boyutlu deri modelinde hücre tiplerinin tanımlanması
NOT: Geliştirilen cilt modelinin beklenen hücrelerden oluştuğunu doğrulamak için hücre boyama yapmak iyidir. Belirli bir model22 üzerinde herhangi bir hedef deney gerçekleştirilmeden önce çok önemli bir adımdır. 3D deri modelleri söz konusu olduğunda, hücre boyamadan önce belirli bir modeli parafine gömmek ve bir mikrotom üzerinde kesilen yapay doku ile mikroskobik slaytlar hazırlamak (adım 4.1) gereklidir (Şekil 7).
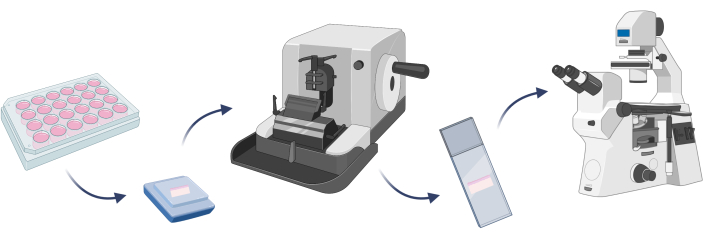
Şekil 7: 3B cilt modeli gömme, hücre boyama ve mikroskobik gözlemlerin temel adımları. Figür Biorender.com ile oluşturulmuştur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- 3D dış görünüm modellerinin gömülmesi
- Cildi PBS ile eşdeğerini RT'de iki kez 5 dakika boyunca yıkayın ve PBS'de% 3.7 paraformaldehit çözeltisi kullanarak sabitleyin (30 dakika, RT). Yıkama adımını PBS ile tekrarlayın.
- Gömmeden önce, artan konsantrasyonlarda etanol çözeltilerinde inkübe ederek cilt eşdeğerini kurutun: %50 (15 dakika), %70 (15 dakika), %96 (2x, 30 dakika) ve %99.8 (2x, 30 dakika).
- Sabit ve susuz kalmış cilt eşdeğerini parafin ile doldurulmuş kalıba koyun.
NOT: Eşdeğerini uygun bir yöne yerleştirin. - Kalıbı kasetle örtün ve üstüne daha fazla parafin ekleyin. RT'de 30 dakikaya kadar katılaşmasına izin verin.
- Parafine gömülü cilt eşdeğerini -80 °C'de en az 1 saat dondurun.
- Mikrotomu açın, parafine gömülü cilt eşdeğerini yerleştirin ve 5 μm'lik dilimler kesin. Kesilen yapay doku dilimlerini mikroskobik slaytların üzerine yerleştirin ve 37 °C'de en az 8 saat kurutun.
- Slaytları ksilene (2x, 10 dakika) batırın ve ardından slaytları azalan etanol konsantrasyonları %99.8 (5 dakika), %96 (5 dakika), %70 (5 dakika) ve %50 (5 dakika) ile yeniden sulandırın.
- Slaytları etanol çözeltisinden çıkarın ve iki kez suyla durulayın (5 dakika).
NOT: Geleneksel hücre boyama, ya spesifik boyalar (Hematoksilen, Eosin23) uygulanarak ya da seçici olarak biyobelirteçleri hedefleyen antikorlar (fibroblastlar için kollajen 1A2, keratinositler için sitokeratin 14, melanositler için melan-A veya tirozinaz24 dahil) kullanılarak gerçekleştirilir. Farklı firmalar tarafından hazırlanan protokoller takip edilerek rutin bir hematoksilen ve eozin boyaması yapılabilir (adım 4.2). Öte yandan, immünofloresan veya immünohistokimyasal boyama gerekiyorsa, prosedür farklıdır ve önemli ölçüde daha uzundur (adım 4.3 ve 4.4). Spesifik olmayan reaksiyonlardan kaçınmak için, farklı türlerde üretilen birincil antikorları ve daha sonra özel ikincil antikorları kullanın.
- 3D cilt modellerinin hematoksilen ve eozin boyaması
- Mikroskobik slaytı hematoksilen çözeltisinde RT'de 3 dakika boyunca boyayın.
- Slaytları asitlenmiş bir alkol solüsyonunda 1 dakika yıkayın.
NOT: 2 mL %35-%38 hidroklorik asit ile 98 mL %99,8 etil alkolü karıştırarak asitleştirilmiş alkol çözeltisini hazırlayın. - Ardından, görünür, hassas mavi-mor bir renk elde etmek için slaytı% 0.1 sodyum bikarbonat çözeltisinde yıkayın.
NOT:% 0.1 sodyum bikarbonat çözeltisi elde etmek için 100 mg sodyum bikarbonatı 100 mL ultra saf suda çözün. - Slaytları 1 dakika% 95 etanol ile yıkayın.
- Mikroskobik slaytı eozin çözeltisinde RT'de 1 dakika boyunca boyayın.
- Slaytları 1 dakika boyunca %95 etanol ve 2 dakika boyunca %99,8 etanol ile yıkayın.
- Slaytları her seferinde 2 dakika boyunca ksilen ile yıkayın.
- Balzam içine monte edin ve sürgünün üstüne bir lamel koyun. Numuneler mikroskobik gözlemler için hazırdır.
- 3D cilt modellerinin immünofloresan boyaması
- Slaytı PBS ile durulayın (5 dk).
- Bloke edici çözeltiyi (% 0.1 Triton X-100 ve% 0.1 Tween 20 ilavesiyle bir PBS tamponunda %3 sığır serum albümini [BSA] veya yağsız süt) hazırlayın ve slaytı RT'de 1 saat inkübe edin.
- Slaytları bir PBS tamponu ile iki kez yıkayın (5 dakika).
- PBS tamponundaki birincil antikoru seyreltin (üreticinin tavsiyelerine göre, Tablo 7) ve slaytları RT'de 1-2 saat veya gece boyunca 4 ° C'de inkübe edin.
- Slaytları bir PBS tamponu ile iki kez yıkayın (5 dakika).
- İkincil antikoru PBS tamponunda seyreltin (üreticinin tavsiyelerine göre, Tablo 7) ve slaytları RT'de 1 saat inkübe edin.
- Slaytları PBS ile iki kez yıkayın (5 dakika).
- Çekirdek boyama için boya çözeltisini hazırlayın (örneğin, Hoechst 33342 veya DAPI, Tablo 7) ve slaytları RT'de 15 dakikaya kadar inkübe edin.
- Slaytları PBS ile yıkayın (5 dk).
- Balzam içine monte edin, bölümü bir lamel ile örtün ve bir floresan mikroskobu kullanarak hücre lekelenmesinin etkilerini görselleştirin.
- 3D deri modellerinin immünohistokimya boyaması
- 4.3.1-4.3.5 adımlarını gerçekleştirin.
- Ek olarak, ikincil antikorun konjuge edildiği enzim için uygun bir tampon ile bir yıkama adımı gerçekleştirin.
- İkincil antikoru, konjuge enzim için uygun bir tamponda seyreltin (üreticinin tavsiyelerine göre) ve slaytları RT'de 1 saat inkübe edin.
- Slaytları PBS ile iki kez yıkayın (5 dakika).
- Kullanılan enzim için uygun bir substrat çözeltisini hazırlayın ve slaytları üreticinin tavsiyelerine göre inkübe edin.
- Slaytları bir tamponla (5 dakika) yıkayın ve balzam içine monte edin.
- Parlak alan mikroskobu kullanarak hücre lekelenmesinin etkilerini görselleştirin.
| Hücre tipi/ hücre organoidi tespit edildi | Boyama maddesi | Dilüsyon / Konsantrasyon | ||
| Mast hücreleri | Avidin−Sülforhodamin 101 | 1 μg/mL | ||
| Fibroblastlar | Tavşanda üretilen Col1A2 antikoru | 1:50 | ||
| FITC ile konjuge edilmiş keçi anti-tavşan ikincil antikoru | 1:250 | |||
| Keratinositler | Farede üretilen sitokeratin 14 antikoru | 1:50 | ||
| FITC ile konjuge keçi anti-fare ikincil antikoru | 1:250 | |||
| Melanositler | Farede üretilen Melan-A antikoru | 1:50 | ||
| FITC ile konjuge keçi anti-fare ikincil antikoru | 1:250 | |||
| Çekirdek | Hoechst 33342 | 1 μg/mL | ||
| DAPI (DAPI) | 1 μg/mL | |||
Tablo 7: Hücre boyama için kullanılan reaktiflerin konsantrasyonları ve seyreltmeleri.
Sonuçlar
Laboratuvarda cilt modelleri oluşturmaya başlamadan önce, kullanılacak hücrelerin türüne (birincil/hücre hattı) karar verilmeli ve bu hücreler için uygun bir ortam seçimi yapılmalıdır. Çoğu hücre bankası, her tür hücre kültürü için ortam önerir ve sağlayabilir. Çok kültürlü bir model söz konusu olduğunda, kültürde bulunan tüm hücre tiplerine uyan bir ortam seçmek gerekir. Hem primer cilt hücresi kültürü hem de en yaygın cilt hücresi hatları için kullanılan bazı tipik hücre ortamları Tablo 8 18,19,20,25,26,27'de toplanmıştır. Birincil hücre kültürleri için kullanılan tipik ortamlar oldukça pahalıdır ve bileşimleri karmaşıktır. Öte yandan, hücre hatları genellikle basit bir bileşime sahip ortamdan memnun kalır. Bazı hücre tipleri (esas olarak fibroblastlar ve mast hücreleri), diğer hücrelerin (keratinositler ve melanositler gibi) büyümesini uyaran faktörler üretebilir ve salgılayabilir28,29. Bir modeldeki mevcudiyetleri planlanıyorsa, ortamın ek takviyesi gerekli değildir.
| Hücre tipi | Hücre adı | Orta | Referans | ||||
| Keratinositler | HaCaT hücre hattı | DMEM, %10 FBS, 100 U/mL penisilin, 100 μg/mL streptomisin | Satıcıya göre | ||||
| primer Normal İnsan Epidermal Keratinositleri (NHEK) | Keratinosit Büyüme Ortamı 2 (bazal ortam + takviye karışımı) | Satıcıya göre | |||||
| primer İnsan Epidermal Keratinositleri; Normal, Yetişkin (HEKa) | Dermal Hücreli Bazal Ortam, %0.4 sığır hipofiz ekstresi, 0.5 ng/mL rh dönüştürücü büyüme faktörü-alfa, 6 mM L-glutamin, 100 ng/mL hidrokortizon Hemisuccinat, 5 mg/mL rh-insülin, 1 mM epinefrin, 5 mg/mL Apo-Transferrin, 100 U/mL penisilin (gerekirse), 100 μg/mL streptomisin (gerekirse) | Satıcıya göre | |||||
| Birincil keratinositler | DMEM/F-12 (3:1), %1 Ultroser G, 1 μM hidrokortizon, 1 μM izoproterenol, 0.1 μM insülin, 1 ng/mL keratinosit büyüme faktörü, %1 penisilin-streptomisin | 18 | |||||
| Melanositler | birincil melanositler | Orta 254, PMA İçermeyen İnsan Melanosit Büyüme Takviyesi-2,% 1 antibiyotik çözeltisi | 19 | ||||
| birincil melanositler | RPMI-1640, %10 FBS, 14.7 μg/mL fenol kırmızı solüsyon, %1 L-glutamin, %1 penisilin/streptomisin | 27 | |||||
| HEMa-LP hücre hattı | Orta 254, 5 μg/mL rh-insülin, 50 μg/mL askorbik asit, 6 mM L-glutamin, 1 μM epinefrin, 1.5 mM kalsiyum klorür, 100 U/mL penisilin (gerekirse), 100 μg/mL streptomisin (gerekirse) | Satıcıya göre | |||||
| birincil Normal İnsan Epidermal Melanositleri (NHEM) | Melanosit Büyüme Ortamı (bazal ortam + takviye karışımı) | Satıcıya göre | |||||
| Fibroblastlar | primer İnsan Tenon'un Fibroblastları (HTF'ler) | EMEM, %5 FBS, 5 ng/mL rh-bazik fibroblast büyüme faktörü, 5 μg/mL rh-insülin, 50 μg/mL askorbik asit, 7 mM L-glutamin, 100 U/mL penisilin, 100 μg/mL streptomisin, 0.25 μg/mL amfoterisin B | 28 | ||||
| birincil HTF'ler ve | DMEM, %10 FBS, 100 U/mL penisilin, 100 μg/mL streptomisin, 0.25 μg/mL amfoterisin B | 20.28 | |||||
| Primer insan dermal fibroblastları | |||||||
| HFF-1 hücre hattı | DMEM, %15 FBS, 100 U/mL penisilin, 100 μg/mL streptomisin | Satıcıya göre | |||||
| BJ hücre hattı | EMEM, %10 FBS, 100 U/mL penisilin, 100 μg/mL streptomisin | Satıcıya göre | |||||
| Mast hücreleri | birincil İnsan derisi mast hücreleri (hsMC'ler) | IMDM, %10 FBS, %1 esansiyel olmayan amino asitler, 226 μM α-monotiogliserol, 100 U/mL penisilin, 100 μg/mL streptomisin | 20 | ||||
| LAD2 hücre hattı | StemPro-34, %2,5 StemPro-34 Besin Takviyesi, 2 mM L-glutamin, 100 ng/mL rh-kök hücre faktörü, 100 U/mL penisilin, 100 μg/mL streptomisin | 29 | |||||
| HMC-1.1 ve 1.2 hücre hatları | IMDM, %10 FBS, 2 mM L-glutamin, 25 mM HEPES, 100 U/mL penisilin, 100 μg/mL streptomisin | 29 | |||||
Tablo 8: Birincil deri hücrelerini ve hücre hatlarını kültürlemek için en çok kullanılan ortamlara genel bakış.
Açıklama: Dulbecco'nun Minimum Esansiyel Ortamı (DMEM), Eagle'ın Minimum Esansiyel Ortamı (EMEM), Fetal Sığır Serumu (FBS), Besin Karışımı Jambonunun F-12'si (F12), Iscove'un Modifiye Dulbecco'nun Ortamı (IMDM), rekombinant insan (rh), Roswell Park Memorial Enstitüsü (RPMI).
Bu makalede, keratinositler, melanositler, fibroblastlar ve mast hücrelerinin primer hücreleri ile cilt modelleri oluşturulmuştur. Hücre hatlarından biraz daha talepkardırlar ve tek hücreli kültür için kullanılan kültürleri için önerilen ortamlar şunlardır: takviyeli Keratinosit Büyüme Ortamı 2 (keratinositler için), takviyeli Orta 254 (melanositler için), takviye edilmiş DMEM ortamı (fibroblastlar için) ve takviye edilmiş IMDM ortamı (mast hücreleri için). Bu ortamlarda, hücreler kendi türlerine atanmış tipik morfolojilerini sunar (temsili görüntüler Şekil 8'de gösterilmiştir). İki veya daha fazla hücre tipinin çoklu kültürleri söz konusu olduğunda, tüm kültürlenmiş hücre tiplerinin büyüyebileceği bir ortam seçmek önemliydi. Birkaç testten sonra, kürelerin ve eşdeğerlerinin daha gelişmiş 3D modellerini hazırlamak için% 10 FBS ve% 1 antibiyotik karışımı içeren bir DMEM ortamı seçildi.
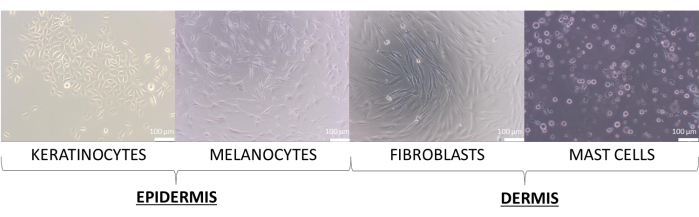
Şekil 8: Deri hücreleri, 2D monokültür sırasında gözlemlenen farklı morfolojiyi sunar. Ölçek çubukları: 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Küreler (genellikle sferoidler olarak adlandırılır), hücre ve doku mühendisliği araştırmacıları tarafından geliştirilen en basit 3D modellerden biridir, ancak cilt hücrelerinden oluşturulan küreler o kadar popüler değildir. Bu model içinde, hem tek hem de çok kültürlü kürelerin yaratılması mümkündür. Kürelerin hazırlanması için birden fazla yöntem (örneğin, asılı bir damla ile, hücre yapışmasını sınırlayıcı, manyetik levitasyon, rotasyon, mikroakışkanlar, vb.) literatürde tanımlanmıştır30. Hazırlama kolaylığı, düşük maliyetli, kolayca bulunabilen malzemeler ve ekipman nedeniyle, üç boyutlu (3D) hücre modeline yeni başlayanlar için ilk iki yöntem önerilir ve performansları için protokoller yukarıda bulunabilir (adım 2.1 ve 2.2). Literatüregöre 31,32, bu yöntemlerde en önemli parametreler hücre sayısı, hücre süspansiyonunun hacmi ve inkübasyon süresidir.
Küreler farklı sayıda hücre ile oluşturulabilir, ancak tohumlama için hücre yoğunluğu, hücre ko-kültürleri için olduğu kadar her hücre tipi için ayrı ayrı optimize edilmelidir. Keratinositlerin ve fibroblastların monokültürleri için yapılan optimizasyon işlemi, oyuk başına 1 x 104 hücrenin tohumlanmasının her iki hücre tipi için de en iyi sonuçları sağladığını ortaya koydu. Şekil 9'da sunulan küreler, U-alt plakalarda hücre yapışmasını sınırlama yöntemi kullanılarak hazırlandı (adım 2.2). Teknik tekrarlarla en az 4 kuyu hazırlanması tavsiye edilir (en uygun 6 kuyudur). 1 x 104 hücreden oluşan küreler, kuyucuklarda görülebildikleri için manipüle etmek daha kolaydı. Sonuç olarak, tahliller sırasında küreleri boşaltmadan eski ortamı kuyulardan çıkarmak bile mümkün oldu. Açıklanan işlemlerden sonra, kürelerin şekilleri çoğunlukla değişmedi ve tekrarlanabilirdi. İşlem sırasında daha büyük kürelerin stabilitesi düşüktü. Farklı hücre tiplerinin farklı renklerde küreler oluşturabildiğini de belirtmekte fayda var (örneğin, keratinositler daha koyu küreler oluştururken, fibroblast küreleri önemli ölçüde daha açık).
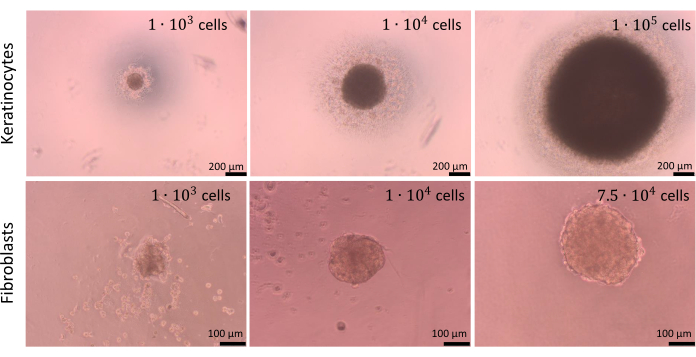
Şekil 9: Kürelerin oluşturulması. Farklı tip ve sayıdaki cilt hücrelerinin sınırlayıcı hücre adezyonu yöntemi ile oluşturulduğu küreler. Ölçek çubukları (üst panel): 200 μm. Ölçek çubukları (alt panel): 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Asılı damla yönteminde (adım 2.1) belirtildiği gibi, belirli bir noktada kürelerin kapaktan kuyuya aktarılması gerekir. Bu işlem küreler için potansiyel olarak zararlı olabilir. Bu nedenle, bu adım için yüksek iş doğruluğu esastır. Oluşturulan küreler, dikkatli bir şekilde ele alınmazlarsa uygun şeklini kaybetmeye eğilimlidir (Şekil 10). İlk görüntü (Şekil 10A), her tarafı eşit olarak yuvarlatılmış iyi bir küre sunar. İkinci ve üçüncü görüntülerde (Şekil 10B,C) küre tarafından hafif bir şekil kaybı gözlendi, ancak hücre agregası yuvarlak kaldı. Son üç görüntü (Şekil 10D-F) küre hasarının farklı aşamalarını göstermektedir. Oluşturulan küre şekillerinin ve yapılarının tekrarlanabilirliğini elde etmek için deneyim kazanmak gerekir. Küreleri geliştirmeye yönelik ilk girişimlerde, araştırmacının aktivitesinin sınırlı etkisi ile daha karşılaştırılabilir sonuçlar sağladığı için deneyimsiz araştırmacılar için hücre yapışmasını sınırlama yönteminin kullanılması önerilir (adım 2.2).
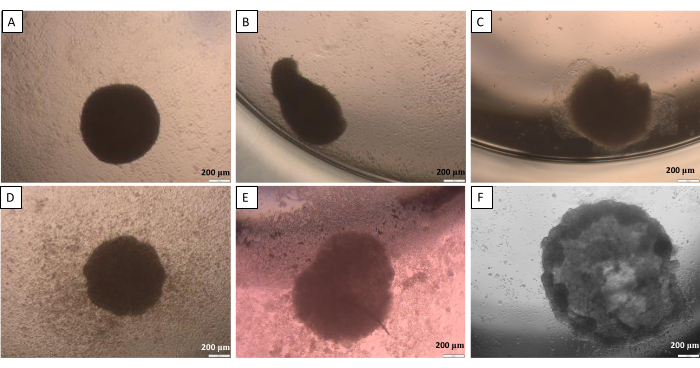
Şekil 10: Kapaktan kuyuya küre transferinde olası zorluklar - asılı bırakma yöntemi. (A) iyi bir küre, (B,C) hafif hasarlı küreler, (D-F) çok hasarlı küreler. Görüntüler aktarımdan 24 saat sonra çekildi. Ölçek çubukları: 200 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Eşdeğerler, yapay cildin kürelerden çok daha gelişmiş 3D modelleridir. Bir deri modelinin yapım sürecinde, modeldeki katman sayısı (sadece epidermis, sadece dermis, epidermis ve stratum corneum ile dermis), kullanılan hücre tipleri, uygulanan malzemeler, eşdeğerin tercih edilen boyutu, daha fazla kullanılacağı araştırma türü vb. dahil olmak üzere çeşitli hususlar dikkate alınmalıdır.14. Deri eşdeğerleri, istenen boyuttaki (96, 48, 24 oyuklu vb.) standart çok kuyulu plakalara yerleştirilen özel ekler halinde düzenlenebilir. Eklerin bir kuyudan diğerine aktarılması daha kolay olsa da ve ortam değişimi sırasında eşdeğeri zarar göremez; Oldukça pahalıdırlar. Model, stratum corneum'un varlığını gerektirmiyorsa, eşdeğerini çok kuyulu plakanın bir kuyusunda hazırlamak daha ucuz bir çözümdür.
Yapay dermis tabakası tipik olarak doğal (jelatin, kollajen, fibrin, hyaluronik asit, kitosan-aljinat, vb.) veya sentetik (polietilen glikol diakrilat ve polilaktik asit) hidrojeller kullanılarak iskele bazlı bir model olarak oluşturulur33. Gerçek cilt dermisine benzer olması için, bu tabakanın çoğunlukla hücre bağlanmasına, hücre-hücre etkileşimlerine ve diğer hücre eylemlerine aracılık eden bazı hücre dışı matris (ECM) bileşenleri (kollajen veya fibronektin dahil) ile su içermesi gerekir34. Bu araştırmada, tip I kollajen, hidrojel şeklinde hazırlanmasının kolay olması ve esnek yapısının, daha fazla potansiyel araştırma faaliyetinin (örneğin, eşdeğerin bir tabaktan diğerine aktarılması) kolaylığını sağlaması nedeniyle seçilmiştir. Sıçan kuyruğundan elde edilen tip I kollajen çözeltisi normalde 20 mM asetik asit içinde toz çözündürme ile hazırlanır. Kollajen polimerizasyon basamağını elde etmek için 6.5-7.5 arasında değişen uygun pH koşullarının sağlanması gerekir. Bu, sıkı miktarda sodyum hidroksit ilavesiyle sağlanabilir. Kolaylık sağlamak için, bazı şirketler bu tür hidrojelleri hazırlamak için gereken tam hacimleri belirlemeye yardımcı olabilecek özel hesaplamalar yapmıştır (Tablo 6). Literatürde, hidrojellerde farklı kollajen konsantrasyonlarıyla karşılaşılabilirken (örneğin, 0.5-2 mg / mL35; 5-30 mg / mL36; düşük ve yüksek kollajen içeriği37), tarif edilen modelde, hidrojel hala esnek bir yapıya sahip olduğundan, ancak gerektiğinde kuyudan dışarı atılabilecek kadar kompakt olduğundan 2 mg / mL çözelti kullanılmıştır.
Oldukça gerçekçi bir tam kalınlıkta cilt hazırlamak için, eşdeğer hücreler muhtemelen vücudumuzda bulunan bu miktara yakın oranda tohumlanmalıdır. Epidermis durumunda, vücut bölgesine bağlı olarak, bir melanosit ile ilişkili keratinositlerden oluşan bir havuz arasındaki ilişki, Epidermal Melanin Birimi (EMU)38 olarak tanımlanan yaklaşık 1:36'lık bir orandır. Bu nedenle, yapay epidermiste uygulanan oran 1 melanosit ila 15 keratinosit idi (Tablo 5). Yapay bir dermis tabakası oluşturmak için, 1 mast hücresi ila 10 fibroblast oranında fibroblastların ve mast hücrelerinin dahil edildiği kollajen tip 1 hidrojel kullanıldı. Oluşturulan eşdeğerin her katmanının, gözlemlenen numunenin derinliği değiştirilerek ters çevrilmiş optik mikroskopta gerçek zamanlı olarak izlenmesi mümkündür (örnek görüntüler Şekil 11'de gösterilmiştir).
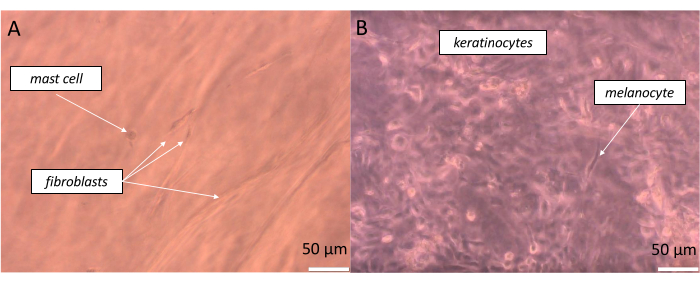
Şekil 11: Oluşturulan tam kalınlıkta deri eşdeğerinin belirli katmanlarında farklı hücrelerin gerçek zamanlı gözlemi. (A) psödo-dermis ve (B) yalancı epidermis) parlak alan mikroskobu ile görselleştirildiği gibi. Ölçek çubukları: 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Modelin amaçlanan yapısının elde edildiğinin doğrulanması ile daha doğru gözlemler, eşdeğerinin boyanması ile yapılabilir. Sabit eşdeğerin önce parafine gömülmesi ve ardından bir mikrotom üzerinde kesilmesi gerekir. İnce yapay dokuya sahip slaytlar daha sonra hematoksilen ve eozin (tıbbi laboratuvarlarda gerçekleştirilen temel boyama) dahil olmak üzere farklı boyalarla boyanabilir. Bu etki sayesinde, eşdeğerlerdeki yapay dermis ve epidermisi ayırt etmek ve tek tek cilt hücrelerini tanımlamak mümkündür (Şekil 12). Şekil 12'de sadece spesifik hücre tipleri gösterilmemiş, aynı zamanda keratinositleri hücre bölünmesi sürecinin farklı fazlarında (telofaz ve metafaz) görmek de mümkündür. Mast hücreleri söz konusu olduğunda, spesifik granüller hücre içinde iyi tanınabilir. Bu görüntüler başlangıçta oluşturulan cilt eşdeğerinin canlı olduğunu (hücrelerin içinde büyüdüğünü) ve geliştirilen modelde normal şekilde işlev görebildiklerini doğrular. Bununla birlikte, cildin 3D epidermisi ve tam kalınlıktaki modelleri ile, elde edilen yapının kalitesini ve işlevselliğini kontrol etmek özellikle önemlidir. Stratum corneum'un geçirgenliğini kontrol etmek için Transepitelyal Elektriksel Direnç (TEER) ölçümleri veya Lucifer-Yellow boyama uygulanmalıdır39,40. Ayrıca, uygun şekilde oluşturulmuş bir yapay deride, farklılaşma belirteçleri (örneğin, Filaggrin, Involucrin, Loricrin, Keratin 10, Keratin 5, seramidleri içeren lipid sınıfları), dermal-epidermal bağlantı belirteçleri (örneğin, Tip IV kollajen, Laminin V, Alpha6Beta4-integrin, BP antijeni)41, epidermal katmanlardaki sıkı bağlantı belirteçleri (örneğin, claudin-1, oklüdin, zonula oklüdens protein (ZO)-1)42 yanı sıra bazal tabaka proliferasyon belirteçleri (Ki67)41.

Şekil 12: Deri hücresi morfolojisi ve işleyişi. Hematoksilen ve eozin ile boyanmış tam kalınlıkta cilt eşdeğerinde cilt hücresi morfolojisine ve işleyişine (hücre bölünmelerinin gözlemlenmesi) genel bakış. Ölçek çubukları: 100 μm (üst panel), 50 μm (orta panel, sol), 100 μm (orta panel, sağ), 50 μm (alt panel). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Bir biyobelirteçin varlığını doğrulamanın en sık kullanılan yolu, immünohistokimyasal veya immünofloresan gibi spesifik boyama yapmaktır. Modellerdeki belirli hücrelerin mikroskobik görüntülenmesi için farklı antikorlar ve floresan boyalar uygulanabilir. Kültürdeki hücrelerin örnek olarak boyanmasının sonucu Şekil 13'te görülebilir. Keratinositleri gözlemlemek için sitokeratin 14'e karşı bir antikor kullanıldı. Melanositler söz konusu olduğunda, melan-A'ya özgü bir antikordu. Fibroblastları boyamak için kollajen 1A2 antikoru kullanıldı ve avidin ile konjuge edilmiş floresan Sulforhodamine 101, mast hücrelerinde bulunan heparini tespit etti.
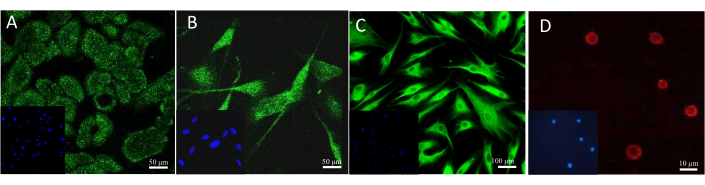
Şekil 13: Floresan hücre boyama sonuçları. (A) Keratinositlerde sitokeratin 14. Ölçek çubuğu: 50 μm. (B) Melanositlerde Melan-A. Ölçek çubuğu: 50 μm. (C) Fibroblastlarda kollajen 1A2. Ölçek çubuğu: 100 μm. (D) Mast hücrelerinde heparin. Ölçek çubuğu: 10 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu makale, kişinin kendi gelişmiş yapay cilt modellerini hazırlamak için uygulanabilecek metodolojiyi sunmaktadır. Planlanan araştırma, piyasada bulunamayacak veya çok pahalı olabilecek kesin olarak tanımlanmış araştırma modellerine ihtiyaç duyduğunda iyi bir çözümdür. Daha önce de belirtildiği gibi, piyasada birkaç ticari cilt eşdeğeri mevcuttur (örneğin, EpiSkin, EpiDerm FT). Bununla birlikte, maliyetleri (parça başına 100-400 €) ve teslim süreleri (birkaç gün-hafta) araştırmacıyı böyle bir modeli kendi başına hazırlamaya teşvik edebilir. Önerilen prosedürlerin deneyimsiz bilim adamları için bile gerçekleştirilmesi kolaydır ve aynı zamanda çok gelişmiş cilt modelleri elde edilmesine izin verir. Belirli bir modelin hücresel bileşimi hakkındaki kararın tamamen araştırmacıya bağlı olduğunu vurgulamakta fayda var. Oluşturulan modelin yanı sıra, daha da geliştirilebilir ve iyileştirilebilir, bu da tamamen yeni araştırma perspektifleri açar. Ticari modeller söz konusu olduğunda, farklı bir eşdeğer satın almak gerekir.
Her ne kadar 3D hücre kültürleri birden fazla hücre tipi ile ilerletilebilse de, kullanımı kolay ve erişilebilir olsa da, bunlar hala dokunun karmaşıklığını ve işlevselliğini (örneğin, immünolojik fonksiyonlar, vaskülarizasyon) tam olarak yeniden yaratamayan yapay modellerdir. Bu nedenle, çoğu çalışmada, elde edilen sonuçları doğrulamak için birkaç model gereklidir. Bu modellerin bazı avantaj ve dezavantajları ile sınırlamaları Tablo 9'da toplanmıştır. Öte yandan, ticari modeller, deneylerin tekrarlanabilirliği ve verilerin laboratuvarlar arasında karşılaştırılabilirliği ile yüksek kalitatif standartları garanti eder. Araştırma için yeni bir bileşiğin kullanımını uygulamak için, uygun ticari eşdeğeri satın almak kesinlikle gerekli olacaktır. Ancak hazırlık aşamasında, cildin böyle bir kendi kendine yapılan 3D modeli (çok hücreli tip küre veya eşdeğeri), ticari bir eşdeğer üzerinde yapılması gereken deney sayısını azaltmaya yardımcı olabilir. Açıklanan modellerin üretilmesi ve kullanılmasının amacı, sertifikalı araştırma modellerinin uygulanması ihtiyacını atlamak değil, araştırmayı kolaylaştırmak ve ilgili masrafları azaltmaktır.
| Karşılaştırılan model çifti | Avantaj -ları | Dezavantaj -ları | ||||
| Hücre Kültürü ve Hayvanlar | Asgari düzeyde hayvan ıstırabı | Test edilen bir faktörün tüm vücut üzerindeki etkisi hakkında sınırlı bilgi | ||||
| Yüksek deney standardizasyonu - sonuçların daha iyi tekrarlanabilirliği | Vücutta meydana gelen süreçleri yansıtmak için tek bir model yeterli değildir | |||||
| Tüm organizma için yan etki yoktur | - | |||||
| Deneyin koşulları üzerinde daha iyi kontrol | - | |||||
| Otomasyon imkanı (örn. biyo-baskı) | - | |||||
| Daha düşük maliyetler | - | |||||
| İhtiyaç duyulan numunenin küçük boyutu | - | |||||
| Sınırlı miktarda atık üretildi | - | |||||
| 3B ve 2B kültürler | Tüm organizmayı daha iyi yansıtır | Zaman alıcı kültür | ||||
| Fonksiyonel bir doku oluşturma imkanı | Daha yüksek maliyetler | |||||
| Yürütülen araştırmanın ihtiyaçlarına göre uyarlanmış bir model oluşturma imkanı | 3 boyutlu bir yapının kendiliğinden oluşumu neredeyse mümkün değildir | |||||
| - | Çeşitli bileşiklerin etkilerini ölçmek için standartlaştırılmış testlerin eksikliği | |||||
| - | Piyasada bulunan farklı 3D kültürlere sınırlı erişim | |||||
| Hücre Hattı ve Birincil Hücreler | Sertifikalı ve onaylı modeller | Yalnızca sınırlı sayıda hücre hattı mevcuttur | ||||
| Yüksek deney standardizasyonu - sonuçların daha iyi tekrarlanabilirliği | Aynı donörden birkaç tip hücre elde etmek için sınırlı olasılık | |||||
| Daha uzun kullanım ömrü | Doğal hücrelerden değişen özelliklere sahip olabilir | |||||
| Oldukça hızlı çoğalma oranı | Hücrelerin sık sık bozulan işlevselliği | |||||
| Çeşitli aktivitelere karşı daha az hassastır (örn. dondurma, santrifüjleme) | - | |||||
Tablo 9: Araştırmada farklı modellerin kullanımının karşılaştırılması - avantajlar ve dezavantajlar
Birkaç makale, 3B cilt modellerinin nasıl hazırlanacağını açıklar (ticari olarak mevcut modelleri 14,43,44 özetleyen inceleme makalelerinin yanı sıra, bunlar genellikle küre 45 veya eşdeğerleri46 elde etmek için tek bir metodolojiye odaklanır).
Bu makalede, deri hücreleri ile küre oluşumu için iki metodoloji tanımlanmıştır. Asarak bırakma yöntemi yaygın olarak kullanılmaktadır ancak tekrarlanabilirliği ve kararlılığı bazı durumlarda yetersiz kalabilmektedir. Çoğu adım, aktarım sırasında damlacıklardan suyun buharlaşması nedeniyle yüksek hızlı çalışma gibi özel eylemler gerektirir. Nazik hareketler de önerilir, çünkü böyle bir becerinin eksikliği hücre agrega hasarınaneden olabilir 31,32. Bu nedenle, küre hazırlama için daha kolay bir yöntem, hücre yapışmasını sınırlamaya odaklanır. Hücre bağlanması için iyi bir yüzeyin olmaması, hücreler arasında daha yüksek etkileşimleri teşvik eder. Sonuç olarak, hücre agregaları üretilir. Küre transferine gerek olmadığı için tekrarlanabilirliği çok daha yüksektir. Bu yöntemlerle, bir küre oluşturmak için en uygun cilt hücresi sayısı 1 x 104 hücre/küre olarak belirlenmiştir.
Daha sonra, cilt eşdeğerlerinin hazırlanmasını açıklayan prosedürler gösterildi. Araştırmadaki görünümleri ve işlevleri, hücreler (Tablo 2), iskeleler ve ortamlar dahil olmak üzere inşa edildikleri unsurlara büyük ölçüde bağlı olabilir. Yapay derinin hazırlanması için kullanılan 3D iskeleler, sentetik hidrojeller ve doğal kaynaklardan oluşturulanlar olarak ikiye ayrılabilir. Hidrojeli oluşturmak için kullanılan malzemeye ve özelliklerine bağlı olarak, ortamın ek olarak takviye edilmesi gerekliliği ortaya çıkabilir. Sentetik hidrojeller, belirli hücre fonksiyonlarına aracılık etmek için biyoaktif moleküllerin (proteinler, enzimler ve büyüme faktörleri) sentetik hidrojel ağına dahil edilmesini gerektirir47. Büyüme faktörlerinin hidrojellere kontrollü bir şekilde verilmesini sağlamak için literatürde sunulan ana yaklaşımlar arasında doğrudan yükleme, elektrostatik etkileşim, kovalent bağlanma ve taşıyıcıların kullanımı yer almaktadır48. ECM proteinleri ve polimerleri gibi doğal kaynaklardan oluşturulan hidrojeller, 3D iskele boyunca sıvı yolları oluşturarak besinlerin dağılımını hızlandırabilir; Bu nedenle, ortamın ek takviyesine gerek yoktur. Araştırmalar, küçük moleküllerin (sitokinler ve büyüme faktörleri gibi) ve makromoleküllerin (glikozaminoglikanlar ve proteoglikanlar dahil) difüzyon47 yoluyla ECM boyunca taşınabileceğini göstermiştir. Bununla birlikte, oksijenin, besinlerin ve diğer biyoaktif moleküllerin moleküler difüzyonu, ECM hidrojelin kendisinin özellikleri tarafından engellenebilir. Daha düşük difüzyon, hidrojelin daha yüksek kalınlığı ile ve aynı zamanda çok yüksek bir kollajenkonsantrasyonu 37 ile ilişkilendirildi. Bu çalışmada, cilt eşdeğerini oluşturmak için 2 mg/mL'ye eşit düşük bir kollajen konsantrasyonu kullanıldı, bu da hidrojel yoluyla moleküler difüzyonun iyi ve hızlı olması gerektiğini düşündürmektedir. Bu nedenle, bu aşamada ortama veya hidrojelin kendisine ek bir takviye sağlanmamıştır. Dermisi taklit etmek için, mast hücreleri ve fibroblastlar (1:10) kollajen hidrojelin içine gömüldü. Daha sonra, melanositler ve keratinositler (1:15) hidrojel üzerine ekildi ve tüm eşdeğeri ortamda kültürlendi. Bazik ortamın birkaç amino asit, inorganik asit ve vitaminden oluştuğunu ve ayrıca serum ile desteklendiğini belirtmekte fayda var (birden fazla kişiden oluşur: hücreler, lipitler, hormonlar, besinler ve enerji kaynakları için büyüme ve bağlanma faktörleri, taşıyıcılar, bağlanma ve transfer proteinleri vb.). Epidermisin uygun yapısını elde etmek için, belirli bir zamanda ortama farklı takviyeler eklenmelidir. Epidermal farklılaşmayı başlatmak için en önemli uyarıcı, hücre içi sinyalizasyonu aktive ettiği için kalsiyumdur. Askorbik asit, kalsiyumun aracılık ettiği yola benzer bir sinyal yolunu uyarır, ancak etkisine aynı zamanda gelişmiş askorbat taşınması ve hidrofilik antioksidan tükenmesinin önlenmesi de eşlik eder41. Ayrıca, ortama başka bileşenler eklendiğinde (kafein, hidrokortizon, triiyodotironin, adenin ve kolera toksini gibi) hücrelerin farklılaşması iyileştirildi41,44. Hazırlanan modellerin her zaman uygun katmanda belirli bir hücre tipinin varlığı açısından kontrol edilmesi önemlidir. Dört tip cilt hücresinin tümünün varlığı, H & E boyama ile oluşturulan eşdeğerin yapısında doğrulandı.
Karşılaşılan en yaygın sorun, elde edilen modellerin ele alınmasındaki incelik ve sezgidir. Bazı zorluklar, hücre küresi oluşumunun yanı sıra hidrojel hazırlığı ile de bağlantılı olabilir. Hücre kültürü sırasında, başka birkaç sorun da ortaya çıkabilir; bunlar arasında mikrobiyal enfeksiyonlar, hücrelerin düşük çoğalma hızı, modellerde kullanılan birincil hücrelerin yaşlanması, birincil hücrelerden hücre hatlarına karşı yeniden yapılandırılan 2B ve 3B modellerin maksimum yetiştirme süresi vb. yer alır. Tablo 10'da, aşağıdaki sorunlardan biriyle karşılaşıldığında ne yapılması gerektiğine dair bazı pratik tavsiyeler toplanmıştır.
| Hücre kültüründe sık karşılaşılan problemler | Öneri | |||
| Mikrobiyal enfeksiyon | Hücreli şişelerden/tabaklardan birinde mikrobiyal bir enfeksiyon meydana gelirse, enfekte olmuş kültürü mümkün olduğunca hızlı bir şekilde çıkarmak daha iyidir (kalan şişeleri/tabakları hücrelerle kontamine etmemek). Yeni bir şişeyi hücrelerle yeniden dondurun. Enfeksiyon geri dönerse, uygulanan antibiyotiklerin spektrumlarını genişletmeye ve konsantrasyonlarını arttırmaya çalışmak iyidir. | |||
| Hücrelerin düşük çoğalma hızı | Bazı hücrelerin uzun bir ikiye katlanma süresi vardır. Proliferasyonlarını uyarmak için, temel ortama birkaç hücreye özgü büyüme faktörü eklenebilir. Ayrıca, bazal ortamdaki FBS veya L-glutamin konsantrasyonunun arttırılması, hücrelerin büyümesini uyarmaya yardımcı olabilir. | |||
| Modellerde kullanılan primer hücrelerin yaşlanması | Birkaç geçişten sonra, birincil hücreler yaşlanmaya girer ve bölünmeyi durdurur. Modellerde bu sorunun üstesinden gelmek için, modeli oluşturmak için hücrelerin mümkün olduğunca erken geçişten kullanılması önerilir. | |||
| Birincil hücrelerden ve hücre hatlarından yeniden yapılandırılan 2B ve 3B modellerin maksimum yetiştirme süresi | Bir modelin yetiştirilme süresi, kullanılan hücrelerin türüne büyük ölçüde bağlıdır. Birincil hücrelerde, kısa ömürleri nedeniyle yetiştirme süresi daha kısa olacaktır. | |||
| Hücre küresi oluşumundaki zorluklar | Bazı hücreler küre oluşumu için daha uzun bir zamana ihtiyaç duyabilir. Birkaç gün sonra küreler oluşmadıysa, hücreleri numuneden toplayın ve örneğin tripan mavisi boyama ile canlılıklarını kontrol edin. | |||
| Küre stabilitesi ile ilgili sorunlar | Küreler kararlı değilse ve kullanım sırasında tahrip oluyorsa, daha az sayıda hücreden küreler oluşturmaya çalışın. Kürelerin büyüdüğü bulaşıkları her zaman nazikçe aktardığınızdan emin olun. | |||
| Hidrojel hazırlığı ile ilgili zorluklar | Bileşenlerin oranının (su, PBS [10x], NaOH, kollajen tip 1) doğru olup olmadığını kontrol edin. Kollajen stok çözeltisi genellikle çok yoğundur, bu nedenle yavaşça pipetlediğinizden emin olun. Hava kabarcıkları hidrojelin morfolojisini bozar, bu nedenle jelin ters pipetlenmesi bu soruna yardımcı olabilir. | |||
Tablo 10: Hücre kültürü sorun giderme
İmalattan sonra kurulan modeller, (1) ilaç ve kozmetikte kullanım için biyolojik aktiviteye sahip yeni bileşiklerin sitotoksisite ve genotoksisite deneyleri49, (2) çeşitli faktör stimülasyonu ile deneyler50, (3) cilt hücreleri, biyolojik işlevleri, diğer hücreler ve çevre ile etkileşimleri hakkındaki bilgilerimizi artıran temel araştırmalar51, 52, (4) oluşturulan modele belirli bir hücre tipinin dahil edilebileceği seçilmiş hastalık varlıkları (kanser hücreleri, belirli bir gende mutasyona sahip hücreler vb.14,53) ve daha pek çok şey üzerine araştırma. Bu modellerin uygulanmasının, ürün testlerinde ve bilimsel araştırmalarda hayvanların daha etik kullanımı için 3R ilkesine uygun kaldığını ve hayvanlar üzerinde kozmetik ürün testlerinin yasaklanması yasasını ihlal etmediğini söylemeye gerek yoktur.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Yazarlar, Varşova Teknoloji Üniversitesi tarafından 'Mükemmellik Girişimi - Araştırma Üniversitesi' programından iki hibe şeklinde verilen mali destek için minnettardır: POB BIB BIOTECHMED-2 başlangıcı (no. 1820/2/ZO1/POB4/2021) ve Rektörün Öğrenci Araştırma Grupları için hibesi (SKIN-ART, no. 1820/116/Z16/2021). Ayrıca Yazarlar, Prof. Joanna Cieśla ve İlaç ve Kozmetik Biyoteknoloji Kürsüsü Başkanı'nın yanı sıra Varşova Teknoloji Üniversitesi Kimya Fakültesi'ndeki Biyoteknoloji Bilim Kulübü 'Herbion'dan aldıkları desteğe teşekkür etmek isterler. Pluronic F-127 bileşiğini sağladığı için Dr. Michał Stepulak'a özel teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 24-well plate for adherent cell culture | Biologix Europe GmbH | 07-6024 | - |
| 35%–38% HCL | Chempur | 115752837 | - |
| 60 mm cell culture Petri dish | Nest | 705001 | - |
| Avidin−Sulforhodamine 101 | Sigma Aldrich | A2348-5MG | - |
| Bright-field inverted microscope | Olympus | CKX41 | - |
| Calcium chloride | Avantor | 874870116 | - |
| Cell culture flask T75 for adherent cells | Genoplast | G77080033 | - |
| Centrifuge tube 15 mL | GoogLab Scientific | G66010522 | - |
| CO2 Incubator | Heal Force | Galaxy 170R | - |
| Col1A2 antibody produced in rabbit | Novus | NBP2-92790 | - |
| Corning(R) Transwell(R) Polycarbonate | Corning | CLS3422-48EA | - |
| Cytokeratin 14 antibody produced in mouse | Novus | NBP1-79069 | - |
| DPX Mountant for histology | Sigma Aldrich | 06522-100ML | - |
| Dulbecco's Modified Eagle Medium (DMEM) | VWR Chemicals | L0102-500 | - |
| Eosine Y | Kolchem | - | 0.5 % aquatic solution |
| Eppendorf tube 1.5 mL | Sarstedt | 72.690.001 | - |
| Eppendorf tube 2 mL | Sarstedt | 72.691 | - |
| Ethyl alcohol absolute 99.8% | Avantor | 396480111 | diluted in ultrapure water to the needed concentrations |
| Fetal bovine serum | Gibco | 10270106 | - |
| Fluorescent inverted microscope | Olympus | IX71 | - |
| Goat anti-mouse secondary antibody conjugated with FITC | Sigma Aldrich | F0257-1mL | |
| Goat anti-rabbit secondary antibody conjugated with FITC | Novus | NB7159 | - |
| Harris Hematoxylin | Kolchem | - | 1 mg/mL in 95% ethanol |
| Hoechst 33342 | ThermoFisher | H3570 | - |
| Laminar chamber | Heal Force | HFSafe-1200 | - |
| Melan-A antibody produced in mouse | Santa Cruz Biotechnology | sc-20032 | - |
| Microtome | Microm | HM355S | - |
| NaOH | Avantor | 810981997 | - |
| Paraffin pastilles | Sigma Aldrich | 1.07164 | - |
| Paraformaldehyde | Sigma Aldrich | 1581227 | - |
| Penicillin/Streptomycin solution | Sigma Aldrich | P4333 | - |
| Pipette tip, 1000 µL | Sarstedt | 70.305 | - |
| Pipette tip, 20 µL | Sarstedt | 70.3021 | - |
| Pipette tip, 200 µL | Sarstedt | 70.303 | - |
| Pluronic F-127 | BASF | 50401036 | - |
| Serological pipette 10 mL | GoogLab Scientific | G33270011 | - |
| Serological pipette 25 mL | GoogLab Scientific | G33280011 | - |
| Serological pipette 5 mL | GoogLab Scientific | G33260011 | - |
| Sodium bicarbonate | Sigma Aldrich | S5761 | - |
| Sodium bicarbonate | Chempur | 118105307 | |
| Trypsin-EDTA 0.25% solution, phenol red | Sigma Aldrich | 25200072 | - |
| Type 1 collagen | IBIDI | 50201 | - |
| U-bottom 96-well plate | Sarstedt | 83.3925500 | - |
| Xylene | Sigma Aldrich | 534056 | - |
Referanslar
- Farage, M. A., Miller, K. W., Elsner, P., Maibach, H. I. Characteristics of the aging skin. Advances in Wound Care. 2 (1), 5-10 (2013).
- Zhu, H., Alikhan, A., Maibach, H. I. Biology of Stratum Corneum: Tape Stripping and Protein Quantification. Textbook of Aging Skin. Farage, M. A., Miller, K. W., Maibach, H. I. , Springer Berlin Heidelberg. Berlin, Heidelberg. (2015).
- Boer, M., Duchnik, E., Maleszka, R., Marchlewicz, M. Structural and biophysical characteristics of human skin in maintaining proper epidermal barrier function. Postepy Dermatogogii I Alergologii. 33 (1), 1-5 (2016).
- De Falco, M., Pisano, M. M., De Luca, A. Embryology and Anatomy of the Skin. In Skin Cancer: A Practical Approach. Current Clinical Pathology. Baldi, A., Pasquali, P., Spugnini, E. P. , Springer. New York. (2014).
- Dehdashtian, A., Stringer, T. P., Warren, A. J., Mu, E. W., Amirlak, B., Shahabi, L. Anatomy and Physiology of the Skin. Melanoma: A Modern Multidisciplinary Approach. Riker, A. I. , Springer International Publishing: Cham. 15-26 (2018).
- Graham, H. K., Eckersley, A., Ozols, M., Mellody, K. T., Sherratt, M. J. Human Skin: Composition, Structure and Visualisation Methods. Skin Biophysics; Studies in Mechanobiology, Tissue Engineering, and Biomaterials. Limbert, G. 22, Springer International Publishing: Cham. 1-18 (2019).
- Piasek, A. M., Musolf, P., Sobiepanek, A. Aptamer-based advances in skin cancer research. Current Medicinal Chemistry. 30 (8), 953-973 (2023).
- Bergfeld, W. F., Belsito, D. V., Marks, J. G., Andersen, F. A. Safety of ingredients used in cosmetics. Journal of the American Academy of Dermatology. 52 (1), 125-132 (2005).
- Hubrecht, R. C., Carter, E. The 3Rs and humane experimental technique: Implementing change. Animals. 9 (10), 754(2019).
- Sreedhar, D., Manjula, N., Ajay, P., Shilpa, P., Ligade, V. Ban of cosmetic testing on animals: A brief overview. International Journal of Current Research and Review. 12 (14), 113-116 (2020).
- Silva, R. J., Tamburic, S. A state-of-the-art review on the alternatives to animal testing for the safety assessment of cosmetics. Cosmetics. 9 (5), 90(2022).
- Xu, Y., Shrestha, N., Préat, V., Beloqui, A. An overview of in vitro, ex vivo and in vivo models for studying the transport of drugs across intestinal barriers. Advanced Drug Delivery Reviews. 175, 113795(2021).
- Boelsma, E., Ponec, M. Basics (Guidelines) on Cell Culture Testing for Topical/Dermatological Drugs/Products and Cosmetics With Regard to Efficacy and Safety of the Preparations. In Dermatopharmacology of Topical Preparations. Gabard, B., Surber, C., Elsner, P., Treffel, P. , Springer Berlin Heidelberg. Berlin, Heidelberg. 37-57 (2000).
- Suhail, S., Sardashti, N., Jaiswal, D., Rudraiah, S., Misra, M., Kumbar, S. G. Engineered skin tissue equivalents for product evaluation and therapeutic applications. Biotechnology Journal. 14 (7), 1900022(2019).
- Sobiepanek, A., et al. Novel diagnostic and prognostic factors for the advanced melanoma based on the glycosylation-related changes studied by biophysical profiling methods. Biosensors and Bioelectronics. 203, 114046(2022).
- Yang, H., Sun, L., Liu, M., Mao, Y. Patient-derived organoids: A promising model for personalized cancer treatment. Gastroenterology Report. 6 (4), 243-245 (2018).
- Baran, J., et al. Mast cells as a target-A comprehensive review of recent therapeutic approaches. Cells. 12 (8), 1187(2023).
- Kosten, I. J., Buskermolen, J. K., Spiekstra, S. W., de Gruijl, T. D., Gibbs, S. Gingiva equivalents secrete negligible amounts of key chemokines involved in langerhans cell migration compared to skin equivalents. Journal of Immunology Research. 2015, 627125(2015).
- cieżyńska, A., et al. A novel and effective method for human primary skin melanocytes and metastatic melanoma cell isolation. Cancers. 13 (24), 6244(2021).
- Kröger, M., et al. In vivo non-invasive staining-free visualization of dermal mast cells in healthy, allergy and mastocytosis humans using two-photon fluorescence lifetime imaging. Scientific Reports. 10 (1), 14930(2020).
- Liu, D., Chen, S., Win Naing, M. A review of manufacturing capabilities of cell spheroid generation technologies and future development. Biotechnology and Bioengineering. 118 (2), 542-554 (2021).
- Rossi, A., Appelt-Menzel, A., Kurdyn, S., Walles, H., Groeber, F. Generation of a three-dimensional full thickness skin equivalent and automated wounding. Journal of Visualized Experiments: JoVE. (96), e52576(2015).
- Kim, K., Kim, J., Kim, H., Sung, G. Y. Effect of α-lipoic acid on the development of human skin equivalents using a pumpless skin-on-a-chip model. International Journal of Molecular Sciences. 22 (4), 2160(2021).
- Curto, E. V., Lambert, G. W., Davis, R. L., Wilborn, T. W., Dooley, T. P. Biomarkers of human skin cells identified using DermArray DNA arrays and new bioinformatics methods. Biochemical and Biophysical Research Communications. 291 (4), 1052-1064 (2002).
- Godwin, L. S., et al. Isolation, culture, and transfection of melanocytes. Current Protocols in Cell Biology. 63, 1-20 (2014).
- Przekora, A., Zarnowski, T., Ginalska, G. A simple and effective protocol for fast isolation of human tenon's fibroblasts from a single trabeculectomy biopsy - a comparison of cell behaviour in different culture media. Cellular & Molecular Biology Letters. 22, 5(2017).
- Rådinger, M., Jensen, B. M., Kuehn, H. S., Kirshenbaum, A., Gilfillan, A. M. Generation, Isolation, and Maintenance of Human Mast Cells and Mast Cell Lines Derived from Peripheral Blood or Cord Blood. Current Protocols in Immunology. Coligan, J. E., Bierer, B. E., Margulies, D. H., Shevach, E. M., Strober, W. , John Wiley & Sons, Inc. Hoboken, NJ. (2010).
- Artuc, M., Muscha Steckelings, U., Henz, B. M. Mast cell-fibroblast interactions: Human mast cells as source and inducers of fibroblast and epithelial growth factors. Journal of Investigative Dermatology. 118 (3), 391-395 (2002).
- Panos, R. J., Rubin, J. S., Csaky, K. G., Aaronson, S. A., Mason, R. J. Keratinocyte growth factor and hepatocyte growth factor/scatter factor are heparin-binding growth factors for alveolar type ii cells in fibroblast-conditioned medium. Journal of Clinical Investigation. 92 (2), 969-977 (1993).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Threedimensional cell culture: A powerful tool in tumor research and drug discovery (Review). Oncology Letters. 14 (6), 6999-7010 (2017).
- Amaral, R. L. F., Miranda, M., Marcato, P. D., Swiech, K. Comparative analysis of 3D bladder tumor spheroids obtained by forced floating and hanging drop methods for drug screening. Frontiers in Physiology. 8, 605(2017).
- Gao, B., Jing, C., Ng, K., Pingguan-Murphy, B., Yang, Q. Fabrication of three-dimensional islet models by the geometry-controlled hanging-drop method. Acta Mechanica Sinica. 35 (2), 329-337 (2019).
- Zhang, C., et al. 3D culture technologies of cancer stem cells: Promising ex vivo tumor models. Journal of Tissue Engineering. 11, (2020).
- Sobiepanek, A., Paone, A., Cutruzzolà, F., Kobiela, T. Biophysical characterization of melanoma cell phenotype markers during metastatic progression. European Biophysics Journal: EBJ. 50 (3-4), 523-542 (2021).
- Jin, G. -Z., Kim, H. -W. Effects of Type I collagen concentration in hydrogel on the growth and phenotypic expression of rat chondrocytes. Tissue Engineering and Regenerative. 14 (4), 383-391 (2017).
- Osidak, E. O., et al. Concentrated collagen hydrogels: A new approach for developing artificial tissues. Materialia. 20, 101217(2021).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: Characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Jimbow, K., Salopek, T. G., Dixon, W. T., Searles, G. E., Yamada, K. The epidermal melanin unit in the pathophysiology of malignant melanoma. The American Journal of Dermatopathology. 13 (2), 179-188 (1991).
- Van Den Bogaard, E., et al. Perspective and consensus opinion: Good practices for using organotypic skin and epidermal equivalents in experimental dermatology research. Journal of Investigative Dermatology. 141 (1), 203-205 (2021).
- Bednarek, R. In vitro methods for measuring the permeability of cell monolayers. Methods and Protocols. 5 (1), 17(2022).
- Idrees, A., et al. Fundamental in vitro 3D human skin equivalent tool development for assessing biological safety and biocompatibility - towards alternative for animal experiments. 4 Open. 4, (2021).
- Park, H. -Y., Kweon, D. -K., Kim, J. -K. Upregulation of tight junction-related proteins by hyaluronic acid in human HaCaT keratinocytes. Bioactive Carbohydrates and Dietary Fibre. 30, 100374(2023).
- Choudhury, S., Das, A. Advances in generation of three-dimensional skin equivalents: Pre-clinical studies to clinical therapies. Cytotherapy. 23 (1), 1-9 (2021).
- Zhang, Z., Michniak-Kohn, B. B. Tissue engineered human skin equivalents. Pharmaceutics. 4 (1), 26-41 (2012).
- Woappi, Y., Altomare, D., Creek, K. E., Pirisi, L. Self-assembling 3D spheroid cultures of human neonatal keratinocytes have enhanced regenerative properties. Stem Cell Research. 49, 102048(2020).
- Ouwehand, K., Spiekstra, S. W., Waaijman, T., Scheper, R. J., de Gruijl, T. D., Gibbs, S. Technical advance: Langerhans cells derived from a human cell line in a full-thickness skin equivalent undergo allergen-induced maturation and migration. Journal of Leukocyte Biology. 90 (5), 1027-1033 (2011).
- Akther, F., Little, P., Li, Z., Nguyen, N. -T., Ta, H. T. Hydrogels as artificial matrices for cell seeding in microfluidic devices. RSC Advances. 10 (71), 43682-43703 (2020).
- Silva, A. K. A., Richard, C., Bessodes, M., Scherman, D., Merten, O. -W. Growth factor delivery approaches in hydrogels. Biomacromolecules. 10 (1), 9-18 (2009).
- Lee, H. -R., et al. Effect of Aronia extract on collagen synthesis in human skin cell and dermal equivalent. Oxidative Medicine and Cellular Longevity. 2022, 4392256(2022).
- Mulder, P. P. G., Raktoe, R. S., Vlig, M., Elgersma, A., Middelkoop, E., Boekema, B. K. H. L. Full skin equivalent models for simulation of burn wound healing, exploring skin regeneration and cytokine response. Journal of Functional Biomaterials. 14 (1), 29(2023).
- Goncalves, K., et al. Investigation into the effect of skin tone modulators and exogenous stress on skin pigmentation utilizing a novel bioengineered skin equivalent. Bioengineering & Translational Medicine. 8 (2), 10415(2023).
- Michel, M., L'Heureux, N., Pouliot, R., Xu, W., Auger, F. A., Germain, L. Characterization of a New Tissue-Engineered Human Skin Equivalent with Hair. In Vitro Cellular & Developmental Biology. Animal. 35 (6), 318-326 (1999).
- Müller, I., Kulms, D. A 3D organotypic melanoma spheroid skin model. Journal of Visualized Experiments: JoVE. (135), e57500(2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır