Method Article
Construire des modèles de peau pour de nombreuses applications - de la monoculture bidimensionnelle (2D) à la multiculture tridimensionnelle (3D)
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ici, nous présentons des procédures simples et peu coûteuses pour introduire divers modèles de peau 3D pour la recherche de routine dans un laboratoire de culture cellulaire. Les chercheurs peuvent créer des modèles adaptés à leurs besoins sans s’appuyer sur des modèles disponibles dans le commerce.
Résumé
En raison de la structure complexe et des fonctions importantes de la peau, il s’agit d’un modèle de recherche intéressant pour les industries cosmétiques, pharmaceutiques et médicales. Dans l’Union européenne, il est totalement interdit de tester les produits cosmétiques et leurs ingrédients sur les animaux. Dans le cas de la médecine et de la pharmacie, cette possibilité est également constamment limitée. Conformément au principe des 3R, il est de plus en plus courant de tester des composés individuels ainsi que des formulations entières sur des modèles créés artificiellement. Les modèles 2D les moins chers et les plus largement utilisés sont les modèles 2D, qui consistent en une monocouche cellulaire mais ne reflètent pas les interactions réelles entre les cellules du tissu. Bien que les modèles 3D disponibles dans le commerce offrent une meilleure représentation du tissu, ils ne sont pas utilisés à grande échelle. En effet, ils sont chers, le temps d’attente est assez long et les modèles disponibles sont souvent limités à ceux généralement utilisés.
Afin de faire passer la recherche menée à un niveau supérieur, nous avons optimisé les procédures de diverses préparations de modèles de peau 3D. Les procédures décrites sont peu coûteuses et simples à préparer car elles peuvent être appliquées dans de nombreux laboratoires et par des chercheurs ayant des expériences différentes dans la culture cellulaire.
Introduction
La peau est une structure continue avec des interactions multicellulaires révélant le bon fonctionnement et l’homéostasie de cet organe complexe. Il est construit à partir de couches morphologiquement différentes : la couche interne - le derme et la couche externe - l’épiderme. Au-dessus de l’épiderme, on distingue en outre la couche cornée (composée de cellules mortes aplaties - cornéocytes), qui offre la plus grande protection contre l’environnement extérieur. Certaines des fonctions passives et actives les plus importantes de la peau sont la protection du corps contre les facteurs externes, la participation aux processus immunologiques, la sécrétion, la résorption, la thermorégulation et la détection 1,2,3. Parce qu’il est considéré comme l’un des plus grands organes du corps, il est impossible d’éviter le contact avec divers agents pathogènes, allergènes, produits chimiques, ainsi que les rayons ultraviolets (UV). Ainsi, il est structuré avec de nombreux types de cellules aux fonctions spécifiques. Les principaux types de cellules présentes dans l’épiderme sont les kératinocytes (près de 90% de toutes les cellules, avec des fonctions structurelles et immunologiques dans les parties profondes de l’épiderme, mais qui subissent ensuite le processus de kératinisation pour se transformer en cornéocytes dans la couche supérieure de l’épiderme), les mélanocytes (seulement 3% à 7% de la population cellulaire de l’épiderme, qui produisent le pigment protecteur UV mélanine) et les cellules de Langerhans (du système immunitaire). Dans le cas du derme, les cellules principales sont les fibroblastes (produisant des facteurs de croissance et des protéines), les cellules dendritiques et les mastocytes (les deux types de cellules du système immunitaire)4,5,6. De plus, la peau est équipée de plusieurs protéines extracellulaires (telles que le collagène de type I et IV, la fibronectine et la laminine ; Graphique 1) et les fibres protéiques (collagène et élastine), qui assurent la structure spécifique de la peau mais favorisent également la liaison cellulaire, l’adhésion cellulaire et d’autres interactions7.
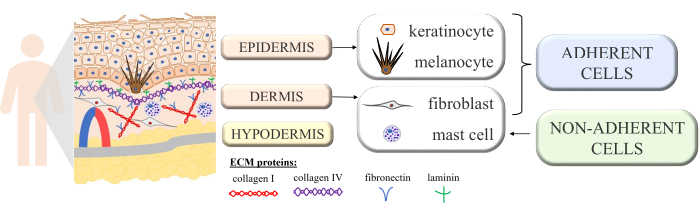
Figure 1 : Schéma montrant la structure de la peau. La structure de la peau marquait quatre types de cellules de base présentes dans ses couches individuelles et distinguait les protéines de la matrice extracellulaire. Cette figure a été créée avec MS PowerPoint. Veuillez cliquer ici pour voir une version agrandie de cette figure.
La sécurité des cosmétiques et des produits pharmaceutiques est une question très importante, et la protection de la santé des consommateurs et des patients est une priorité8. Jusqu’à récemment, elle était censée être garantie par de nombreux tests, y compris des études menées sur des animaux. Malheureusement, ceux-ci nécessitaient souvent l’utilisation de méthodes drastiques, causant de la douleur et de la souffrance chez les animaux utilisés à des fins de recherche (souvent des souris, des rats et des porcs). En 1959, les Principes de la Technique Expérimentale Humaine (le principe des 3R) ont été introduits : (1 - Remplacement) remplacement des animaux en recherche par des modèles in vitro, in silico ou ex vivo, (2 - Réduction) réduction du nombre d’animaux utilisés pour la recherche, et (3 - Raffinement) amélioration du bien-être des animaux qui sont encore nécessaires à la recherche et en même temps amélioration des méthodes alternatives développées9. De plus, dans l’Union européenne (UE), les tests cosmétiques sur les animaux sont réglementés par la loi. À partir du 11 septembre 2004, l’interdiction des produits cosmétiques testés sur les animaux est entrée en vigueur. Le 11 mars 2009, l’UE a interdit l’expérimentation animale des ingrédients cosmétiques. La vente de produits cosmétiques fabriqués à partir d’ingrédients nouvellement testés sur les animaux n’était pas autorisée ; Cependant, il était tout de même acceptable d’analyser les produits sur des animaux pour des problèmes complexes de santé humaine tels que la toxicité à doses répétées, la toxicité pour la reproduction et la toxicocinétique. Depuis le 11 mars 2013, dans l’UE, il est illégal de vendre des cosmétiques dont le produit fini ou ses ingrédients ont été testés sur desanimaux10. Par conséquent, actuellement, en cosmétologie, la recherche est menée à trois niveaux : in vitro (cellules), ex vivo (tissus réels) et in vivo (volontaires)11. Dans le cas des produits pharmaceutiques, il reste nécessaire de recourir à des tests sur les animaux ; Cependant, il est considérablement réduit et strictement contrôlé12.
Comme méthodes alternatives à l’expérimentation animale et pour l’évaluation initiale de l’efficacité d’un nouvel ingrédient actif, les cultures de cellules cutanées in vitro sont utilisées. L’isolement de différents types de cellules cutanées et leur culture dans des conditions de laboratoire stériles permettent d’évaluer l’innocuité et la toxicité des substances actives. Les lignées cellulaires de la peau sont également des modèles largement reconnus pour la recherche, car les cellules sont vendues par des entreprises certifiées et les résultats peuvent être comparables dans différents laboratoires. Ces tests sont généralement effectués sur des modèles 2D simples de monocultures de cellules de peau humaine. Certains des modèles les plus avancés sont leurs co-cultures (telles que les kératinocytes avec les fibroblastes et les kératinocytes avec les mélanocytes), ainsi que les modèles tridimensionnels, y compris les cultures sans échafaudage (sphères) et les équivalents cutanés basés sur l’échafaudage de l’épiderme, du derme ou même des substituts de pleine épaisseur de la peau13. Il convient de mentionner qu’à part le dernier type (équivalents de peau), le reste n’est pas disponible dans le commerce, et si nécessaire, un scientifique doit les préparer lui-même.
Même si beaucoup de ces modèles ont été entretenus et sont régulièrement vendus de nos jours (tableau 1), des modèles supplémentaires sont constamment nécessaires pour valider la plupart des résultats. Ainsi, les modèles nouvellement conçus devraient mieux recréer les interactions réelles qui ont lieu dans le corps humain. Lorsqu’un mélange de cellules de différents types est utilisé pour former de tels modèles, la reproduction de l’aspect multicellulaire des tissus in vivo peut être réalisée. En conséquence, une culture organotypique est développée (Figure 2).
| Nom | Description | |||||
| Peau normale | ÉpiSkin | Épiderme humain reconstruit - Kératinocytes sur une membrane de collagène | ||||
| SkinEthic RHE | Épiderme humain reconstruit - Kératinocytes sur membrane de polycarbonate | |||||
| SkinEthic RHE-LC | Cellules de Langerhans modèle épidermique humain - Kératinocytes et cellules de Langerhans sur une membrane en polycarbonate | |||||
| SkinEthic RHPE | Épiderme pigmenté humain reconstruit - Kératinocytes et mélanocytes sur une membrane en polycarbonate | |||||
| Peau en T | Modèle de peau humaine reconstruite de pleine épaisseur - Kératinocytes sur une couche de fibroblastes, qui ont été cultivés sur une membrane de polycarbonate | |||||
| Modèle Phenion FT Skin | Kératinocytes et fibroblastes dans l’hydrogel | |||||
| Peau atteinte d’une maladie | Modèle de peau de mélanome FT | Kératinocytes et fibroblastes normaux d’origine humaine avec la lignée cellulaire de mélanome malin humain A375 | ||||
| Modèle de tissu du psoriasis | Kératinocytes et fibroblastes humains normaux | |||||
Tableau 1 : Les équivalents cutanés commerciaux les plus populaires pour diverses études.
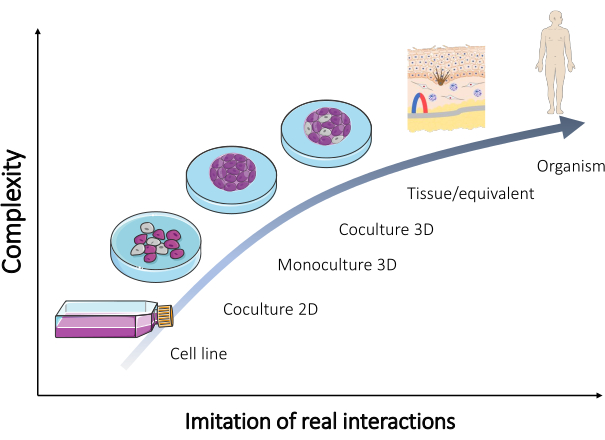
Figure 2 : Complexité des différents modèles in vitro. La relation entre la complexité des différents modèles in vitro pour recréer un organisme et les interactions réelles se produisant directement dans le corps humain. La figure a été modifiée à partir du set « Microbiologie et culture cellulaire » de Servier Medical Art par Servier (https://smart.servier.com/). Veuillez cliquer ici pour voir une version agrandie de cette figure.
L’une des limites les plus importantes des équivalents commerciaux est la disponibilité de modèles de recherche très généraux avec quelques types de cellules (généralement 1-2, rarement 3). Pourtant, il y a beaucoup plus de cellules présentes dans la peau, et leur interaction les unes avec les autres peut assurer une meilleure ou une moins bonne tolérance de divers ingrédients14. L’absence de certains composants immunitaires peut diminuer sa valeur dans plusieurs types de recherches, y compris l’immunothérapie. Il s’agit d’un problème grave car le mélanome est un cancer de la peau potentiellement mortel en raison de l’apparition précoce de métastases et d’une résistance fréquente au traitement appliqué15. Pour améliorer le modèle de peau artificielle, les chercheurs tentent d’établir une co-culture de cellules immunitaires avec des lignées cellulaires et des organoïdes16, ce qui est considéré comme une grande amélioration des modèles étudiés. Par exemple, les mastocytes participent à de nombreux processus physiologiques (cicatrisation, remodelage tissulaire) et pathologiques (inflammation, angiogenèse et progression tumorale) de la peau17. Ainsi, leur apparition dans le modèle peut modifier considérablement la réponse du modèle au composé étudié. Enfin, il manque encore beaucoup d’informations relatives à la peau, qui ne peuvent être découvertes qu’en effectuant des recherches fondamentales. C’est pourquoi la création et le perfectionnement de différents modèles de peau artificielle (tableau 2) sont une entreprise si importante. Cet article présente plusieurs procédures pour créer des modèles de peau avancés, y compris des sphères et des équivalents de peau.
| Modèle de peau in vitro | Tenter de recréer des interactions se produisant dans le tissu | Exemples de cellules utilisées |
| Culture cellulaire 2D ou 3D | Épiderme | Kératinocytes |
| Mélanocytes | ||
| Kératinocytes + Mélanocytes | ||
| Derme | Fibroblastes | |
| Mastocytes | ||
| Fibroblastes + Mastocytes | ||
| Peau | Kératinocytes + Fibroblastes | |
| Kératinocytes + Mastocytes | ||
| Mélanocytes + Fibroblastes | ||
| Mélanocytes + Mastocytes | ||
| Kératinocytes + Fibroblastes + Mélanocytes | ||
| Kératinocytes + Fibroblastes + Mastocytes |
Tableau 2 : Exemples de mélange de types cellulaires pour recréer du tissu cutané en culture 2D et 3D.
Protocole
L’étude a été menée conformément aux lignes directrices de la Déclaration d’Helsinki et approuvée par le Comité d’éthique de l’Université de médecine de Varsovie (KB/7/2022). Le consentement éclairé a été obtenu de tous les sujets participant à l’étude.
REMARQUE : Les procédures décrites pour la préparation avancée du modèle de peau peuvent être effectuées à l’aide de cellules cutanées primaires et de lignées cellulaires disponibles dans le commerce ou avec des cellules primaires isolées de patients. Les cellules commerciales sont fournies avec les documents pertinents, et leur utilisation dans la recherche pour la plupart des pays ne nécessite aucune approbation supplémentaire. Cependant, pour certains pays, c’est obligatoire, il doit donc être vérifié avec les règlements du comité d’éthique local. Si les cellules primaires isolées chez les patients doivent être utilisées dans la recherche, l’étude doit d’abord être approuvée par le comité d’éthique local, et elle doit être menée conformément à leurs directives strictes. De plus, un consentement éclairé écrit doit être recueilli auprès de tous les donneurs de tissus cutanés. L’isolement des cellules primaires de la peau n’a pas fait l’objet de cet article, mais des procédures d’isolement exemplaires peuvent être trouvées chez Kosten et al. (kératinocytes)18, Ścieżyńska et al. (mélanocytes)19, Kröger et al. (fibroblastes et mastocytes)20. La plupart des cellules et lignées cellulaires normales de la peau ont un niveau de sécurité de classe BSL1 ; Ils ne causent aucune menace. Cependant, l’équipement de laboratoire utilisé doit répondre aux normes de culture de cellules animales et humaines dans des conditions contrôlées.
1. Culture de cellules cutanées
REMARQUE : Les cultures de cellules cutanées doivent être effectuées dans des flacons dédiés aux cellules adhérentes ou en suspension (selon le type de cellule) à 37 °C et à une teneur en dioxyde de carbone de 5 % dans un incubateur. Les activités liées à leur culture et à leur utilisation pour la recherche nécessitent des conditions stériles et doivent être effectuées dans une chambre laminaire après une exposition aux rayons ultraviolets C (UVC) pendant 15 à 30 minutes. L’obtention de suspensions cellulaires, qui sont ensuite utilisées pour créer les modèles bidimensionnels et tridimensionnels, nécessite la mise en œuvre de procédures en fonction du type de cellule (pour les cellules adhérentes telles que les kératinocytes, les fibroblastes et les mélanocytes - étape 1.1, pour les cellules non adhérentes des mastocytes - étape 1.2) (Figure 3). Pour différentes tailles de flacons de culture, les volumes de tous les réactifs (tels que le milieu, la solution saline tamponnée au phosphate ou la solution de trypsine) utilisés dans les méthodes décrites sont indiqués dans le tableau 3. Les paramètres dépendant du type de cellules (p. ex., concentration et composition des réactifs, méthode de centrifugation, etc.) sont classés dans le tableau 4. Les densités cellulaires utilisées pour l’ensemencement sont indiquées au tableau 5. Tous ces tableaux sont inclus à la fin de cette section.
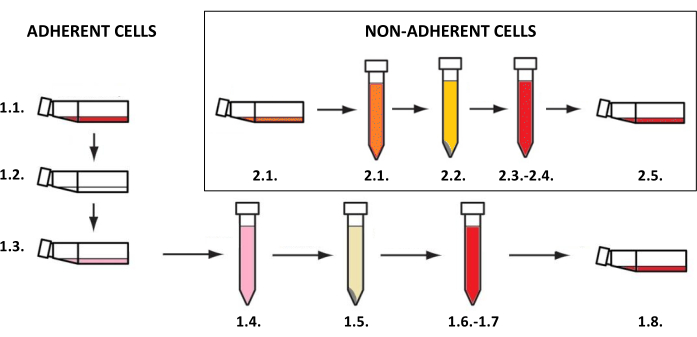
Figure 3 : Culture cellulaire adhérente et non adhérente. Procédure générale étape par étape de la culture cellulaire adhérente et non adhérente (les numéros correspondent aux descriptions des étapes 1.1 et 1.2). La figure a été créée avec MS PowerPoint. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Obtention d’une suspension de cellules adhérentes
- Retirer le milieu de la fiole de culture.
- Lavez doucement les cellules avec une solution saline tamponnée au phosphate (PBS, tableau 3).
- Ajouter une solution de trypsine dans de l’acide éthylène-diamine tétraacétique (solution trypsine-EDTA, tableau 3). Incuber le ballon à 37 °C et contrôler le détachement des cellules de la surface au microscope optique.
- Suspendre les cellules détachées dans au moins le double de milieu de croissance complète ou de neutralisant de trypsine pour désactiver la trypsine (2:1) (pour les volumes, voir le tableau 3, et pour les réactifs, voir le tableau 4). Transvaser quantitativement le contenu de la fiole dans le tube de 15 mL.
- Prélever un petit volume (20 μL) de suspension cellulaire dans un tube de 1,5 mL et compter les cellules à l’aide d’un hémocytomètre manuel ou automatique.
- Centrifugez le tube (paramètres du tableau 4), retirez la majeure partie du surnageant et remettez en suspension la pastille cellulaire dans la petite quantité de liquide restant. Ensuite, ajoutez suffisamment de milieu frais pour obtenir le volume de précentrifugation (volume dans le tableau 3) si la densité cellulaire est appropriée pour l’ensemencement ou recalculez le volume requis du nouveau milieu.
REMARQUE : Certaines cellules, comme les mélanocytes, sont très sensibles à la centrifugation, évitant ainsi la nécessité de les centrifuger à nouveau dans un court laps de temps. - Préparer la suspension cellulaire de la densité requise (cellules/mL, densité cellulaire dans le tableau 5) pour l’expérience (mono- ou multi-cultures 2D/3D de cellules cutanées).
REMARQUE : Si des cellules doivent être cultivées davantage, retourner 5 000 à 8 000 cellules/mL dans une nouvelle fiole et ajouter du milieu frais (volume au tableau 3).
- Obtention d’une suspension de cellules non adhérentes
- Retirer le milieu avec la suspension cellulaire du ballon de culture et le transférer quantitativement dans le tube de 15 ml.
- Prélever un petit volume (20 μL) de la suspension cellulaire dans un nouveau tube de 1,5 mL. Comptez les cellules à l’aide d’un hémocytomètre manuel ou automatique.
- Centrifugez le tube (paramètres du tableau 4), retirez la majeure partie du surnageant et remettez les cellules en suspension dans une petite quantité du liquide restant. Ensuite, ajoutez du milieu frais pour obtenir le volume de précentrifugation (comme indiqué dans le tableau 3) si la densité cellulaire est appropriée pour l’ensemencement ou recalculez le volume requis du nouveau milieu.
- Préparez la suspension cellulaire de la densité requise (cellules par ml, comme suggéré dans le tableau 5) pour l’expérience (mono- ou multi-cultures 2D/3D de cellules cutanées).
REMARQUE : Si des cellules doivent être cultivées davantage, retournez 5 000 à 8 000 cellules/mL dans une nouvelle fiole et ajoutez du milieu frais.
| 25 cm 2 flacons de culture | 75 cm 2 flacons de culture | |
| Milieu de culture [mL] | 4–5 | 8–12 |
| PBS [mL] | 5 | 10 |
| Trypsine-EDTA [mL] | 0.5–1 | 1–2 |
| Milieu de neutralisation [mL] | 1–2 | 2–4 |
Tableau 3 : Volumes de réactifs utilisés lors de la culture et de la préparation des suspensions cellulaires.
| Monoculture de cellules cutanées | Trypsine | Désactivateur de trypsine | Centrifugation | Type de milieu pour la monoculture 2D | |
| Kératinocytes | 0.25% | avec neutralisant de trypsine | 300 x g, 5 min, RT | Milieu de croissance des kératinocytes 2 | |
| Fibroblastes | 0.25% | avec | 300 x g, 5 min, RT | DMEM, 10 % FBS | |
| Mélanocytes | 0.025% | avec neutralisant de trypsine | 300 x g, 3 min, RT | Medium 254, Supplément de croissance de mélanocytes humains sans PMA-2 | |
| Mastocytes | non requis | non requis | 300 x g, 3 min, RT | IMDM, 10 % FBS, 1 % d’acides aminés non essentiels, 226 μM α-monothioglycérol | |
Tableau 4 : La trypsinisation, les paramètres de centrifugation et le type de milieu dépendent du type de cellule.
| Type de modèle | Densité cellulaire [cellule/mL] | ||
| 2D | Monocouche | Fibroblastes | 2 x 105 |
| Mastocytes | |||
| Kératinocytes | |||
| Mélanocytes | |||
| 3D | Sphère (méthode de la chute suspendue) | Fibroblastes | 5 x 105 |
| Mastocytes | |||
| Kératinocytes | |||
| Mélanocytes | |||
| Mélange de cellules | |||
| Sphère (méthode d’adhésion cellulaire limitante) | Fibroblastes | 2 x 105 | |
| Mastocytes | |||
| Kératinocytes | |||
| Mélanocytes | |||
| Mélange de cellules | |||
| Équivalent | Fibroblastes | 1 x 105 | |
| Mastocytes | 1 x 104 | ||
| Kératinocytes | 8 x 105 | ||
| Mélanocytes | 5 x 104 | ||
Tableau 5 : Densité d’ensemencement cellulaire pour différents types de modèles de peau.
2. Préparation des sphères cellulaires de la peau
REMARQUE : Pour créer des sphères, l’utilisation de la méthode de la goutte suspendue est décrite à l’étape 2.1 (Figure 4), tandis que l’approche axée sur la limitation de l’adhésion cellulaire est illustrée à l’étape 2.2 (Figure 5). Néanmoins, comme les sphères sont très petites et peuvent être instables, les activités menées selon ces méthodes nécessitent de la patience, de la délicatesse et des actions lentes.
- La méthode du pendaison
- Utilisez une densité de cellules appropriée pour obtenir la taille de sphère souhaitée (densité cellulaire recommandée 5 x 105 cellules/ml, tableau 5).
- Pipette de 20 μL de suspension cellulaire sur le couvercle d’une boîte de Pétri ou d’une plaque multipuits (figure 4A).
- Couvrez le plat/l’assiette avec la partie inférieure et retournez-le doucement (des gouttes suspendues seront automatiquement créées sur les couvercles, Figure 4B).
- Remplissez la boîte de Pétri avec une solution d’eau stérile ou de PBS pour éviter l’évaporation du milieu à partir de gouttelettes.
- Incuber les gouttelettes pendant 48 à 72 h à 37 °C.
REMARQUE : La gravité tire les cellules vers le bas et le manque de surface accessible empêche la fixation des cellules au vaisseau et favorise l’agrégation cellulaire. Cependant, certains types de cellules peuvent nécessiter une incubation plus longue. - Avant d’effectuer l’étape suivante, remplissez les puits de la nouvelle plaque (ou utilisez l’ancienne plaque avec l’eau/PBS retirée des puits) avec le milieu de croissance complet (100 μL).
REMARQUE : Avant l’étape suivante, prenez des pointes de 200 μL, retirez 1/5 de chaque extrémité de pointe et stérilisez avant utilisation. - Transférez les sphères cellulaires dans les puits de la plaque multipuits à l’aide d’embouts de pipette stériles à extrémité coupée. Prenez des pointes de 200 μL, retirez 1/5 de chaque extrémité de pointe et stérilisez-les avant utilisation (Figure 4C).
REMARQUE : Cette étape peut être difficile, car l’écoulement du liquide lors du retournement du plat/assiette peut endommager les sphères. - Incuber les sphères transférées pendant 1 jour dans la plaque multipuits à 37 °C avant d’effectuer d’autres expériences (par exemple, ajout de composés, essais de cytotoxicité, introduction de sphères à des équivalents) (figure 4D).
- La méthode de limitation de l’adhésion cellulaire
- Avant l’ensemencement cellulaire, recouvrez les puits de la plaque inférieure en U d’une solution de surfactant (p. ex., Pluronic F-127, polyéthylène glycol, alcool polyvinylique)21. Préparez et ajoutez 100 μL de solution de surfactant à 1 % dans du PBS dans chaque puits. Incuber la plaque avec la solution pendant 24 h à 37 °C (Figure 5A-C). Stockez la plaque plus longtemps si nécessaire, mais maintenez le niveau de liquide en ajoutant plus de tampon PBS.
- Préparez la suspension cellulaire à la densité cellulaire désirée dans 50 μL par puits (densité cellulaire recommandée lors de l’ensemencement 2 x 105/mL, tableau 5).
- Retirer la solution de surfactant des puits avant d’ensemencer les cellules pour éviter la rupture de la membrane cellulaire par lyse (figure 5D).
- Ajouter la solution cellulaire dans la plaque et incuber pendant 24 h à 37 °C pour atteindre les agrégats cellulaires (figure 5E). Après environ 1 à 3 jours, des sphères se formeront (Figure 5F) et seront prêtes à être utilisées pour d’autres expériences.
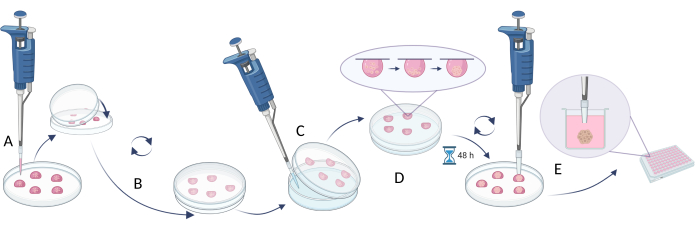
Figure 4 : La méthode de la goutte suspendue. (A) la suspension de la cellule de pipetage sur le couvercle et le recouvrement du couvercle avec la partie inférieure de la boîte ; (B) faire pivoter le plat pour créer les gouttes suspendues ; (C) ajout d’eau/PBS dans la partie inférieure du plat (limitant l’évaporation du liquide) ; (D) l’incubation des plats avec des gouttes suspendues pour créer des sphères cellulaires ; (E) collecte de gouttelettes avec des sphères formées et stabilisation des sphères transférées dans des plaques multi-puits. La figure a été créée avec Biorender.com. Veuillez cliquer ici pour voir une version agrandie de cette figure.
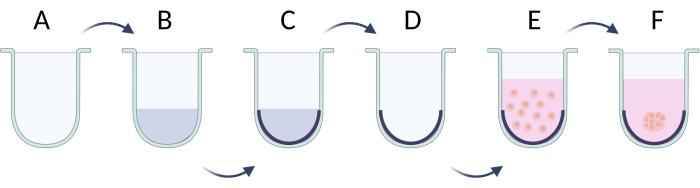
Figure 5 : Préparation étape par étape des sphères par la méthode d’adhésion des cellules limites. (A) Puits à fond en U ; (B,C) limitation de la fixation des cellules par une solution de tensioactif ; (D) l’élimination de la solution des puits ; (E) cellules d’ensemencement ; (F) l’agrégation de cellules et la formation d’une sphère. La figure a été créée avec Biorender.com. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Préparation des équivalents peau pleine épaisseur
REMARQUE : Le développement des équivalents cutanés de pleine épaisseur (épiderme et derme) peut être divisé en trois étapes (Figure 6) : la préparation de la couche de derme artificiel avec l’apparition de cellules dermiques typiques (telles que les fibroblastes et les mastocytes, Figure 6A), l’ensemencement des cellules incluses dans l’épiderme artificiel (principalement des kératinocytes et des mélanocytes, Figure 6B) et la croissance verticale des kératinocytes avec un processus de kératinisation possible (formation de la couche cornée, Figure 6C). La préparation des équivalents de peau de pleine épaisseur est décrite à l’étape 3.1 (3.1.1-3.1.10). Si un équivalent cutané moins avancé est nécessaire (par exemple, uniquement le type d’épiderme), le type de cellule sélectionné (comme les kératinocytes) peut être ensemencé directement sur les membranes de collagène ou de polycarbonate disponibles dans le commerce et également cultivé avec la possibilité d’induire le processus de kératinisation (passez directement aux étapes 3.1.9-3.1.10).
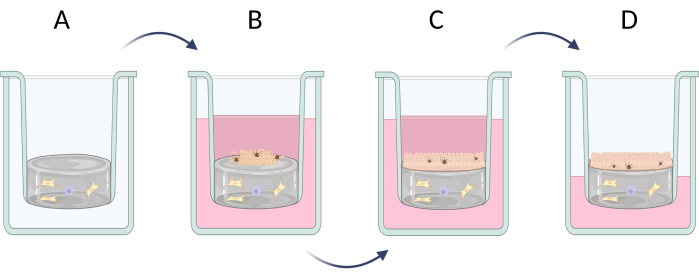
Figure 6 : Préparation étape par étape des équivalents cutanés de pleine épaisseur dans les inserts. (A) préparation de la couche de pseudo-derme avec des cellules dermiques, (B) ensemencement de cellules épidermiques, (C) culture ultérieure d’équivalents en milieu, (D) culture d’interface air-liquide favorise la formation d’épithélium stratifié. La figure a été créée avec Biorender.com. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Préparation d’équivalents de peau pleine épaisseur dans une plaque de 24 puits
- Placez les tubes avec de l’eau, du PBS (10x), 1 M de NaOH et une solution de collagène de type I sur de la glace.
- Déterminez le nombre approprié de cellules dermiques (p. ex., fibroblastes et mastocytes, dans un rapport de 10:1) à ensemencer dans l’hydrogel. Transférez un nombre approprié de cellules dermiques dans un tube de 1,5 mL (500 μL de fibroblastes et 500 μL de mastocytes, selon les densités cellulaires du tableau 5) et centrifugez les cellules (300 x g, 3 min, RT).
- Retirez le surnageant et remettez doucement les cellules en suspension dans le mélange de 695 μL d’eau/100 μL de PBS (10x)/5 μL de NaOH.
REMARQUE : Si 1 mL de la solution totale ne suffit pas, utilisez le tableau 6 pour recalculer les volumes de chaque réactif. - Ajoutez 200 μL de solution de collagène au mélange et mélangez-le doucement par pipetage.
REMARQUE : Soyez prudent, car la consistance du mélange sera dense. - Ajouter 200 μL du mélange préparé dans l’insert dans une plaque à 24 puits. Pour un modèle sans la couche cornée, ajoutez 500 μL dans chaque puits de la plaque à 24 puits.
- Incuber la plaque pendant 10 min à température ambiante (RT) puis la transférer dans l’incubateur pendant 30 min.
REMARQUE : Vérifiez si l’hydrogel s’est polymérisé avant toute autre action. - Avant l’ensemencement cellulaire à la surface de l’hydrogel, rincez-le avec un tampon PBS (500 μL/puits).
- Déterminez le nombre approprié de cellules épidermiques (par exemple, kératinocytes et mélanocytes ; dans un rapport de 15:1) à ensemencer sur l’hydrogel. Préparez le mélange cellulaire dans 500 μL de milieu DMEM complété par 10 % de FBS (ajoutez 250 μL de kératinocytes et 250 μL de mélanocytes, les densités cellulaires sont mentionnées dans le tableau 4) et ajoutez-le doucement dans les puits.
REMARQUE : Dans certains cas, il est préférable d’ensemencer d’abord les mélanocytes et de les laisser bien se répartir sur l’hydrogel, et après 24 heures supplémentaires, retirer le milieu et semer les kératinocytes. Dans ce cas, ajoutez 250 μL de suspension cellulaire et 250 μL de milieu. - Incuber les plaques à 37 °C pendant 2 à 5 jours, en fonction de la vitesse de croissance cellulaire, avec un échange de fluide (avec une concentration décroissante de FBS de 10% à 1%) toutes les 48 h et une surveillance cellulaire effectuée au microscope optique.
- Si le processus de kératinisation doit être induit après l’obtention d’une monocouche de kératinocytes sur l’hydrogel, utilisez le milieu sans FBS complété en plus par des ions calcium et de l’acide L-ascorbique pendant 2 à 7 semaines supplémentaires (à la concentration de 1,5 μM CaCl2 et 50 μg/mL d’acide L-ascorbique).
REMARQUE : Le temps d’incubation dépend des kératinocytes utilisés et de leur vitesse de différenciation.
| Réactif | L’équation de calcul du volume d’un réactif | Exemples de calculs | |
| (pour un volume final = Vtotal de 1 mL) | |||
| solution de collagène de type I | 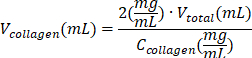 | (Collagène C = 10 mg/mL) | |
| 0,2 mL = 200 μL | |||
| PBS (10x) | 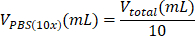 | 0,1 mL = 100 μL | |
| 1 M NaOH | 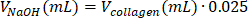 | 0,005 mL = 5 μL | |
| stérile H2O | 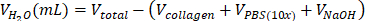 | 0,695 mL = 695 μL | |
Tableau 6 : Calcul des volumes de réactifs nécessaires pour la préparation d’hydrogel de collagène de type I à 2 mg/mL.
4. Identification des types de cellules dans un modèle de peau 3D par des méthodes de coloration cellulaire
REMARQUE : Pour confirmer que le modèle de peau développé se compose des cellules attendues, il est bon d’effectuer une coloration cellulaire. Il s’agit d’une étape cruciale avant que toute expérience cible puisse être réalisée sur un modèle donné22. Dans le cas de modèles de peau 3D, il est nécessaire d’intégrer un modèle donné dans de la paraffine et de préparer des lames microscopiques avec le tissu artificiel découpé sur un microtome (étape 4.1) avant la coloration cellulaire (Figure 7).
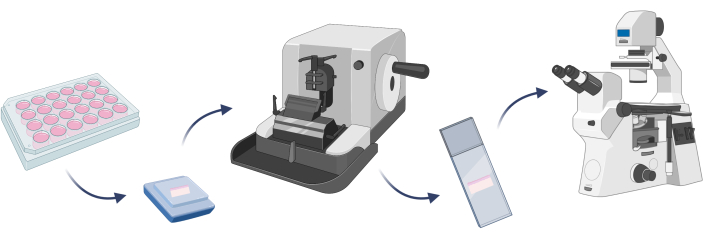
Figure 7 : Étapes de base de l’intégration d’un modèle de peau 3D, coloration cellulaire et observations microscopiques. La figure a été créée avec Biorender.com. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Intégration de modèles de peau 3D
- Lavez l’équivalent cutané avec du PBS pendant 5 min à RT deux fois et fixez-le à l’aide d’une solution de paraformaldéhyde à 3,7% dans du PBS (30 min, RT). Répétez l’étape de lavage avec du PBS.
- Avant l’enrobage, déshydratez l’équivalent cutané en l’incubant dans des concentrations croissantes de solutions d’éthanol : 50 % (15 min), 70 % (15 min), 96 % (2x, 30 min) et 99,8 % (2x, 30 min).
- Mettez l’équivalent de la peau fixe et déshydratée dans le moule rempli de paraffine.
REMARQUE : Placez l’équivalent dans une orientation appropriée. - Couvrez le moule avec la cassette et ajoutez plus de paraffine sur le dessus. Laissez-le se solidifier jusqu’à 30 min à RT.
- Congelez l’équivalent cutané incrusté de paraffine pendant au moins 1 h à -80 °C.
- Allumez le microtome, insérez l’équivalent cutané incrusté de paraffine et coupez des tranches de 5 μm. Placez les tranches de tissu artificiel découpées sur les lames microscopiques et séchez-les pendant au moins 8 h à 37 °C.
- Immergez les lames dans du xylène (2x, 10 min), puis réhydratez-les avec les concentrations d’éthanol décroissantes de 99,8 % (5 min), 96 % (5 min), 70 % (5 min) et 50 % (5 min).
- Retirez les lames de la solution d’éthanol et rincez-les deux fois à l’eau (5 min).
REMARQUE : La coloration cellulaire traditionnelle est réalisée soit par l’application de colorants spécifiques (hématoxyline, éosine23), soit par l’utilisation d’anticorps ciblant sélectivement des biomarqueurs (notamment le collagène 1A2 pour les fibroblastes, la cytokératine 14 pour les kératinocytes, la mélan-A ou la tyrosinase pour les mélanocytes24). Une coloration régulière à l’hématoxyline et à l’éosine peut être effectuée en suivant les protocoles préparés par différentes entreprises (étape 4.2). En revanche, si une coloration immunofluorescente ou immunohistochimique est nécessaire, la procédure est différente et nettement plus longue (étapes 4.3 et 4.4). Pour éviter les réactions non spécifiques, utilisez les anticorps primaires produits chez les différentes espèces et ensuite les anticorps secondaires dédiés.
- Coloration à l’hématoxyline et à l’éosine de modèles de peau 3D
- Colorer la lame microscopique dans une solution d’hématoxyline pendant 3 min à RT.
- Lavez les lames dans une solution d’alcool acidifié pendant 1 min.
REMARQUE : Préparez la solution d’alcool acidifié en mélangeant 2 ml d’acide chlorhydrique à 35 % à 38 % avec 98 ml d’alcool éthylique à 99,8 %. - Ensuite, lavez la lame dans une solution de bicarbonate de sodium à 0,1 % pour obtenir une couleur bleu-violet visible et délicate.
REMARQUE : Pour obtenir une solution de bicarbonate de sodium à 0,1 %, dissoudre 100 mg de bicarbonate de sodium dans 100 ml d’eau ultrapure. - Lavez les lames avec de l’éthanol à 95 % pendant 1 min.
- Colorer la lame microscopique dans une solution d’éosine pendant 1 min à RT.
- Lavez les lames avec de l’éthanol à 95 % pendant 1 min et de l’éthanol à 99,8 % pendant 2 min.
- Lavez les lames avec du xylène pendant 2 minutes chacune deux fois.
- Montez dans du baume et placez une lamelle en haut de la glissière. Les échantillons sont prêts pour des observations microscopiques.
- Coloration immunofluorescente de modèles de peau 3D
- Rincez la lame avec du PBS (5 min).
- Préparez la solution bloquante (3 % d’albumine sérique bovine [BSA] ou lait écrémé dans un tampon PBS avec l’ajout de 0,1 % de Triton X-100 et de 0,1 % de Tween 20) et incubez la lame pendant 1 h à RT.
- Lavez les lames deux fois avec un tampon PBS (5 min).
- Diluer l’anticorps primaire dans le tampon PBS (selon les recommandations du fabricant, tableau 7) et incuber les lames pendant 1 à 2 h à RT ou toute la nuit à 4 °C.
- Lavez les lames deux fois avec un tampon PBS (5 min).
- Diluer l’anticorps secondaire dans le tampon PBS (selon les recommandations du fabricant, tableau 7) et incuber les lames pendant 1 h à RT.
- Lavez les lames deux fois avec du PBS (5 min).
- Préparez la solution de colorant pour la coloration des noyaux (par exemple, Hoechst 33342 ou DAPI, tableau 7) et incubez les lames jusqu’à 15 minutes à RT.
- Lavez les lames avec du PBS (5 min).
- Montez dans du baumier, couvrez la section avec une lamelle et visualisez les effets de la coloration cellulaire à l’aide d’un microscope fluorescent.
- Coloration immunohistochimique de modèles de peau 3D
- Effectuez les étapes 4.3.1 à 4.3.5.
- De plus, effectuez une étape de lavage avec un tampon approprié à l’enzyme avec laquelle l’anticorps secondaire est conjugué.
- Diluer l’anticorps secondaire dans un tampon adapté à l’enzyme conjuguée (selon les recommandations du fabricant) et incuber les lames pendant 1 h à RT.
- Lavez les lames deux fois avec du PBS (5 min).
- Préparez la solution d’un substrat approprié pour l’enzyme utilisée et incubez les lames selon les recommandations du fabricant.
- Lavez les lames à l’aide d’un tampon (5 min) et montez-les dans du baumier.
- Visualisez les effets de la coloration cellulaire à l’aide de la microscopie à fond clair.
| Type de cellule/organoïde cellulaire détecté | Agent colorant | Dillution / Concentration | ||
| Mastocytes | Avidin−Sulforhodamine 101 | 1 μg/mL | ||
| Fibroblastes | Anticorps Col1A2 produit chez le lapin | 1:50 | ||
| Anticorps secondaire anti-lapin de chèvre conjugué à la FITC | 1:250 | |||
| Kératinocytes | Anticorps anti-cytokératine 14 produit chez la souris | 1:50 | ||
| Anticorps secondaire anti-souris de chèvre conjugué à la FITC | 1:250 | |||
| Mélanocytes | Anticorps anti-mélan-A produit chez la souris | 1:50 | ||
| Anticorps secondaire anti-souris de chèvre conjugué à la FITC | 1:250 | |||
| Noyaux | Hoechst 33342 | 1 μg/mL | ||
| DAPI | 1 μg/mL | |||
Tableau 7 : Concentrations et dilutions des réactifs utilisés pour la coloration cellulaire.
Résultats
Avant de commencer à créer des modèles de peau en laboratoire, il faut prendre une décision sur le type de cellules à utiliser (primaire/lignée cellulaire) et choisir un milieu approprié pour ces cellules. La plupart des banques de cellules recommandent et peuvent fournir des milieux pour tous les types de culture cellulaire. Dans le cas d’un modèle de multiculture, il est nécessaire de sélectionner un milieu qui convient à tous les types de cellules présentes dans la culture. Certains milieux cellulaires typiques utilisés à la fois pour la culture de cellules cutanées primaires et les lignées cellulaires cutanées les plus courantes ont été rassemblés dans le tableau 8 18,19,20,25,26,27. Les milieux typiques utilisés pour les cultures cellulaires primaires sont assez coûteux et leur composition est complexe. D’autre part, les lignées cellulaires se contentent généralement de milieux de composition simple. Certains types de cellules (principalement les fibroblastes et les mastocytes) peuvent produire et sécréter des facteurs stimulant la croissance d’autres cellules (comme les kératinocytes et les mélanocytes)28,29. Si leur présence dans un modèle est prévue, une supplémentation supplémentaire du support n’est pas nécessaire.
| Type de cellule | Nom de la cellule | Douleur moyenne | Référence | ||||
| Kératinocytes | Ligne HaCaT cel | DMEM, 10 % FBS, 100 U/mL de pénicilline, 100 μg/mL de streptomycine | Selon le vendeur | ||||
| kératinocytes épidermiques humains normaux primaires (NHEK) | Milieu de croissance des kératinocytes 2 (milieu de base + mélange de suppléments) | Selon le vendeur | |||||
| kératinocytes épidermiques humains primaires ; Normal, Adulte (HEKa) | Milieu basal à cellules cutanées, 0,4 % d’extrait hypophysaire bovin, 0,5 ng/mL de facteur de croissance transformant le rh-alpha, 6 mM de L-glutamine, 100 ng/mL d’hémisuccinate d’hydrocortisone, 5 mg/mL d’insuline rh, 1 mM d’épinéphrine, 5 mg/mL d’apo-transferrine, 100 U/mL de pénicilline (si nécessaire), 100 μg/mL de streptomycine (si nécessaire) | Selon le vendeur | |||||
| Kératinocytes primaires | DMEM/F-12 (3:1), 1 % d’Ultroser G, 1 μM d’hydrocortisone, 1 μM d’isoprotérénol, 0,1 μM d’insuline, 1 ng/mL de facteur de croissance des kératinocytes, 1 % de pénicilline-streptomycine | 18 | |||||
| Mélanocytes | Mélanocytes primaires | Medium 254, Supplément de croissance de mélanocytes humains sans PMA-2, solution antibiotique à 1 % | 19 | ||||
| Mélanocytes primaires | RPMI-1640, 10 % FBS, 14,7 μg/mL de solution de rouge de phénol, 1 % de L-glutamine, 1 % de pénicilline/streptomycine | 27 | |||||
| Lignée cellulaire HEMa-LP | Moyen 254, 5 μg/mL d’insuline rh, 50 μg/mL d’acide ascorbique, 6 mM de L-glutamine, 1 μM d’épinéphrine, 1,5 mM de chlorure de calcium, 100 U/mL de pénicilline (si nécessaire), 100 μg/mL de streptomycine (si nécessaire) | Selon le vendeur | |||||
| Mélanocytes épidermiques humains normaux primaires (NHEM) | Milieu de croissance des mélanocytes (milieu de base + mélange de suppléments) | Selon le vendeur | |||||
| Fibroblastes | Fibroblastes de Tenon humain primaires (HTF) | EMEM, 5 % FBS, 5 ng/mL de facteur de croissance des fibroblastes rh-basiques, 5 μg/mL d’insuline rh, 50 μg/mL d’acide ascorbique, 7 mM de L-glutamine, 100 U/mL de pénicilline, 100 μg/mL de streptomycine, 0,25 μg/mL d’amphotéricine B | 28 | ||||
| les FASS primaires ; | DMEM, 10 % FBS, 100 U/mL de pénicilline, 100 μg/mL de streptomycine, 0,25 μg/mL d’amphotéricine B | 20.28 | |||||
| Fibroblastes dermiques humains primaires | |||||||
| Lignée cellulaire HFF-1 | DMEM, 15 % FBS, 100 U/mL de pénicilline, 100 μg/mL de streptomycine | Selon le vendeur | |||||
| Lignée cellulaire BJ | EMEM, 10 % FBS, 100 U/mL de pénicilline, 100 μg/mL de streptomycine | Selon le vendeur | |||||
| Mastocytes | mastocytes primaires de la peau humaine (hsMC) | IMDM, 10 % FBS, 1 % d’acides aminés non essentiels, 226 μM α-monothioglycérol, 100 μg/mL de pénicilline, 100 μg/mL de streptomycine | 20 | ||||
| Lignée cellulaire LAD2 | StemPro-34, supplément nutritif StemPro-34 à 2,5 %, 2 mM de L-glutamine, 100 ng/mL de facteur de cellules souches rh, 100 U/mL de pénicilline, 100 μg/mL de streptomycine | 29 | |||||
| Lignées cellulaires HMC-1.1 et 1.2 | IMDM, 10 % FBS, 2 mM de L-glutamine, 25 mM d’HEPES, 100 U/mL de pénicilline, 100 μg/mL de streptomycine | 29 | |||||
Tableau 8 : Aperçu des milieux les plus utilisés pour la culture de cellules cutanées primaires et de lignées cellulaires.
Légende : Milieu minimum essentiel de Dulbecco (DMEM), milieu essentiel minimum d’Eagle (EMEM), sérum de veau fœtal (FBS), mélange nutritif Ham’s F-12 (F12), milieu de Dulbecco modifié d’Iscove (IMDM), humain recombinant (rh), Roswell Park Memorial Institute (RPMI).
Dans cet article, des modèles de peau ont été créés avec les cellules primaires des kératinocytes, des mélanocytes, des fibroblastes et des mastocytes. Ils sont légèrement plus exigeants que les lignées cellulaires, et les milieux recommandés pour leur culture, qui ont été utilisés pour la culture de cellules uniques, sont les suivants : milieu de croissance de kératinocytes 2 (pour les kératinocytes), milieu 254 (pour les mélanocytes), milieu DMEM (pour les fibroblastes) et milieu IMDM (pour mastocytes). Sur ces milieux, les cellules présentent leur morphologie typique attribuée à leur type (des images représentatives sont présentées sur la figure 8). Dans le cas de multicultures de deux types de cellules ou plus, il était important de choisir un milieu dans lequel tous les types de cellules cultivées peuvent se développer. Après quelques tests, un milieu DMEM avec 10% de FBS et un mélange d’antibiotiques 1% a été sélectionné pour préparer les modèles 3D les plus avancés de sphères et d’équivalents.
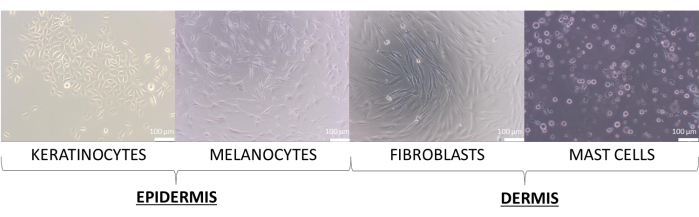
Figure 8 : Les cellules de la peau présentent une morphologie différente observée lors de la monoculture 2D. Barres d’échelle : 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Les sphères (communément appelées sphéroïdes) sont l’un des modèles 3D les plus simples développés par les chercheurs en ingénierie cellulaire et tissulaire, bien que les sphères créées à partir de cellules de la peau ne soient pas très populaires. Dans ce modèle, la création de mono- et multi-cultures de sphères est possible. De multiples méthodes de préparation de sphères (par exemple, avec une goutte suspendue, une adhésion cellulaire limite, une lévitation magnétique, une rotation, une microfluidique, etc.) ont été décrites dans la littérature30. En raison de la facilité de préparation, du faible coût, des matériaux et de l’équipement facilement disponibles, les deux premières méthodes sont recommandées pour les débutants en modèles cellulaires tridimensionnels (3D) et des protocoles pour leur performance peuvent être trouvés ci-dessus (étapes 2.1 et 2.2). Selon la littérature 31,32, les paramètres les plus importants de ces méthodes sont le nombre de cellules, le volume de la suspension cellulaire et le temps d’incubation.
Les sphères peuvent être créées avec un nombre différent de cellules, mais la densité cellulaire pour l’ensemencement doit être optimisée pour chaque type de cellule séparément ainsi que pour les co-cultures cellulaires. Le processus d’optimisation mené pour les monocultures de kératinocytes et de fibroblastes a révélé que l’ensemencement de 1 x 104 cellules par puits donnait les meilleurs résultats pour les deux types de cellules. Les sphères présentées à la figure 9 ont été préparées à l’aide de la méthode de limitation de l’adhésion cellulaire dans les plaques à fond en U (étape 2.2). Il est conseillé de préparer au moins 4 puits avec des répétitions techniques (l’optimal est de 6 puits). Les sphères composées de 1 x 104 cellules étaient plus faciles à manipuler car elles étaient visibles dans les puits. En conséquence, il a même été possible d’éliminer l’ancien milieu des puits pendant les analyses sans drainer les sphères. Après les opérations décrites, les formes des sphères étaient pour la plupart inchangées et reproductibles. La stabilité des sphères plus grandes était faible au cours du processus. Il convient également de mentionner que différents types de cellules peuvent former des sphères de couleurs différentes (par exemple, les kératinocytes forment des sphères plus foncées, tandis que les sphères de fibroblastes sont nettement plus claires).
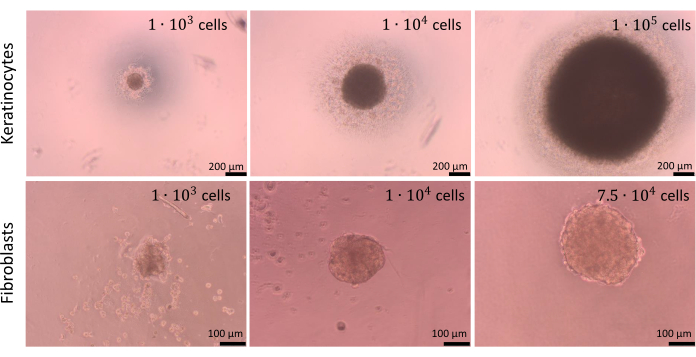
Figure 9 : Création de sphères. Sphères créées par différents types et nombres de cellules cutanées avec l’utilisation de la méthode d’adhésion cellulaire limitante. Barres d’échelle (panneau supérieur) : 200 μm. Barres d’échelle (panneau inférieur) : 100 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Comme mentionné dans la méthode de la goutte suspendue (étape 2.1), à un certain point, les sphères doivent être transférées du couvercle au puits. Ce processus peut être potentiellement dommageable pour les sphères. Ainsi, pour cette étape, une grande précision de travail est essentielle. Les sphères créées ont tendance à perdre leur forme si elles ne sont pas manipulées avec soin (Figure 10). La première image (Figure 10A) présente une bonne sphère également arrondie de tous les côtés. Dans les deuxième et troisième images (Figure 10B,C), une légère perte de forme de la sphère a été observée, mais l’agrégat cellulaire reste arrondi. Les trois dernières images (Figure 10D-F) montrent différentes phases d’endommagement des sphères. L’acquisition d’expérience est nécessaire pour obtenir la répétabilité des formes et des structures de sphère créées. Lors des premières tentatives de développement des sphères, il est recommandé d’utiliser la méthode de limitation de l’adhésion cellulaire pour les chercheurs inexpérimentés (étape 2.2) car elle fournit des résultats plus comparables avec l’influence limitée de l’activité du chercheur.
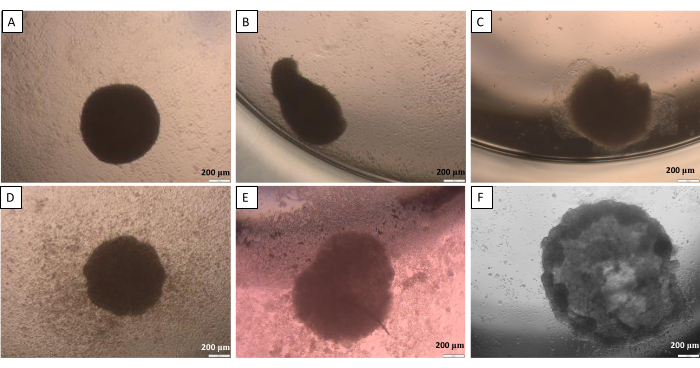
Figure 10 : Difficultés possibles dans le transfert des sphères du couvercle au puits - la méthode de la goutte suspendue. (A) une bonne sphère, (B,C) des sphères légèrement endommagées, (D-F) des sphères très endommagées. Les images ont été prises 24 h après le transfert. Barres d’échelle : 200 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Les équivalents sont des modèles 3D de peau artificielle beaucoup plus avancés que les sphères. Au cours du processus de construction d’un modèle de peau, divers aspects doivent être pris en compte, notamment le nombre de couches dans le modèle (uniquement l’épiderme, uniquement le derme, le derme avec l’épiderme et la couche cornée), les types de cellules utilisés, les matériaux appliqués, la taille préférable de l’équivalent, le type de recherche dans lequel il sera utilisé ultérieurement, etc.14. Les équivalents de peau peuvent être disposés dans des inserts spéciaux placés dans les plaques multipuits standard d’une taille souhaitée (96, 48, 24 puits, etc.). Même si les inserts sont plus faciles à transférer d’un puits à un autre et lors du remplacement du fluide, l’équivalent ne peut pas être endommagé ; Ils sont assez chers. Si le modèle ne nécessite pas la présence de la couche cornée, une solution moins coûteuse consiste à préparer l’équivalent dans un puits de la plaque multi-puits.
La couche de derme artificiel est généralement construite comme un modèle basé sur un échafaudage en utilisant des hydrogels naturels (gélatine, collagène, fibrine, acide hyaluronique, chitosan-alginate, etc.) ou synthétiques (diacrylate de polyéthylène glycol et acide polylactique)33. Pour être similaire au derme de la peau réelle, cette couche doit contenir principalement de l’eau avec certains composants de la matrice extracellulaire (MEC) (y compris le collagène ou la fibronectine), qui médient la liaison cellulaire, les interactions cellule-cellule et d’autres actions cellulaires34. Dans cette recherche, le collagène de type I a été sélectionné car il est facile à préparer sous forme d’hydrogel et sa structure flexible garantit la facilité d’autres activités de recherche potentielles (par exemple, le transfert de l’équivalent d’un plat à un autre). La solution de collagène de type I obtenue à partir de la queue de rat est normalement préparée par dissolution de poudre dans 20 mM d’acide acétique. Pour réaliser l’étape de polymérisation du collagène, il est nécessaire de fournir des conditions de pH appropriées allant de 6,5 à 7,5. Cela peut être assuré par l’ajout d’une quantité stricte d’hydroxyde de sodium. Par souci de facilité, certaines entreprises ont introduit des calculs spécifiques, qui peuvent aider à déterminer les volumes exacts nécessaires à la préparation de ces hydrogels (tableau 6). Bien que dans la littérature, différentes concentrations de collagène dans les hydrogels puissent être observées (par exemple, 0,5-2 mg/mL35 ; 5-30 mg/mL36 ; teneur faible et élevée en collagène37), dans le modèle décrit, la solution de 2 mg/mL a été utilisée car l’hydrogel avait encore une structure flexible, mais était suffisamment compact pour être retiré du puits si nécessaire.
Pour préparer une peau pleine épaisseur tout à fait réaliste, il faut ensemencer des cellules équivalentes dans la proportion possiblement aussi proche que celle présente dans notre corps. Dans le cas de l’épiderme, selon le site du corps, la relation entre un mélanocyte et un pool de kératinocytes associés est un rapport d’environ 1:36, qui est défini comme l’unité de mélanine épidermique (EMU)38. Ainsi, la proportion appliquée dans l’épiderme artificiel était de 1 mélanocyte pour 15 kératinocytes (tableau 5). Pour créer une couche de derme artificiel, l’hydrogel de collagène de type 1 a été utilisé dans lequel les fibroblastes et les mastocytes ont été incorporés dans la proportion de 1 mastocyte pour 10 fibroblastes. Chaque couche de l’équivalent construit peut être surveillée en temps réel sur le microscope optique inversé en modifiant la profondeur de l’échantillon observé (des images exemplaires sont montrées à la figure 11).
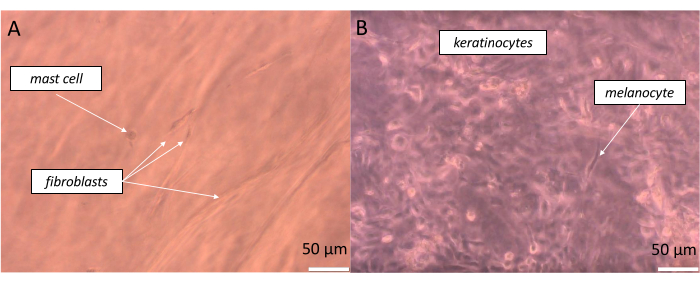
Figure 11 : Observation en temps réel de différentes cellules dans des couches particulières de l’équivalent cutané de pleine épaisseur créé (A) pseudo-derme et (B) pseudo-épiderme) tels que visualisés par la microscopie à fond clair. Barres d’échelle : 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Des observations plus précises avec la confirmation de l’obtention de la structure prévue du modèle peuvent être faites en effectuant la coloration de l’équivalent. L’équivalent fixe doit d’abord être incorporé dans de la paraffine et ensuite coupé sur un microtome. Les lames avec un tissu artificiel mince peuvent être colorées ultérieurement avec différents colorants, notamment l’hématoxyline et l’éosine (coloration de base effectuée dans les laboratoires médicaux). Grâce à cette action, il est possible de distinguer le derme artificiel et l’épiderme chez les équivalents ainsi que d’identifier les cellules individuelles de la peau (Figure 12). La figure 12 montre non seulement les types cellulaires spécifiques, mais aussi les kératinocytes dans différentes phases du processus de division cellulaire (télophase et métaphase). Dans le cas des mastocytes, des granules spécifiques sont bien reconnaissables à l’intérieur de la cellule. Ces images confirment d’abord que l’équivalent cutané créé est vivant (les cellules s’y développent) et qu’il est capable de fonctionner normalement dans le modèle développé. Cependant, avec l’épiderme 3D et les modèles pleine épaisseur de la peau, il est particulièrement important de vérifier la qualité et la fonctionnalité de la construction obtenue. Pour vérifier la perméabilité de la couche cornée, il faut appliquer les mesures de résistance électrique transépithéliale (TEER) ou la coloration Lucifer-Yellow39,40. De plus, dans une peau artificielle correctement composée, des marqueurs spécifiques doivent être présents, notamment des marqueurs de différenciation (par exemple, la filaggrine, l’involucrine, la loricirine, la kératine 10, la kératine 5, les classes lipidiques comprenant les céramides), les marqueurs de la jonction dermo-épidermique (par exemple, le collagène de type IV, la laminine V, l’intégrine alpha6Beta4, l’antigène BP)41, les marqueurs de jonction serrée dans les couches épidermiques (par exemple, la claudine-1, l’occludine, la protéine zonula occludens (ZO)-1)42 ainsi que des marqueurs de prolifération de la couche basale (Ki67)41.

Figure 12 : Morphologie et fonctionnement des cellules cutanées. Vue d’ensemble de la morphologie et du fonctionnement des cellules cutanées (observation des divisions cellulaires) dans l’équivalent cutané de pleine épaisseur coloré à l’hématoxyline et à l’éosine. Barres d’échelle : 100 μm (panneau supérieur), 50 μm (panneau central, gauche), 100 μm (panneau central, droite), 50 μm (panneau inférieur). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Le moyen le plus fréquemment utilisé pour confirmer la présence d’un biomarqueur est d’effectuer une coloration spécifique, telle que l’immunohistochimie ou l’immunofluorescence. Différents anticorps et colorants fluorescents peuvent être appliqués pour la visualisation microscopique de cellules particulières dans les modèles. Le résultat d’une coloration exemplaire des cellules en culture peut être vu sur la figure 13. Pour observer les kératinocytes, un anticorps contre la cytokératine 14 a été utilisé. Dans le cas des mélanocytes, il s’agissait d’un anticorps spécifique au mélano-A. L’anticorps anti-collagène 1A2 a été utilisé pour colorer les fibroblastes et la sulforhodamine 101 fluorescente conjuguée à l’avidine a détecté l’héparine présente dans les mastocytes.
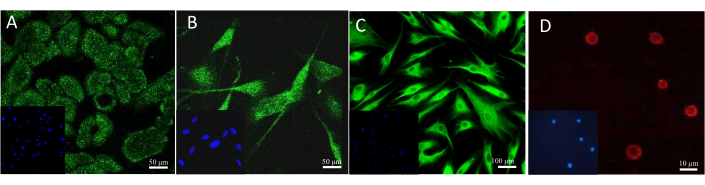
Figure 13 : Résultats de la coloration cellulaire fluorescente. (A) Cytokératine 14 dans les kératinocytes. Barre d’échelle : 50 μm. (B) Melan-A dans les mélanocytes. Barre d’échelle : 50 μm. (C) Collagène 1A2 dans les fibroblastes. Barre d’échelle : 100 μm. (D) Héparine dans les mastocytes. Barre d’échelle : 10 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Cet article présente la méthodologie qui peut être appliquée pour préparer ses propres modèles avancés de peau artificielle. C’est une bonne solution lorsque la recherche prévue nécessite des modèles de recherche strictement définis qui peuvent s’avérer indisponibles sur le marché ou très coûteux. Comme mentionné précédemment, plusieurs équivalents commerciaux de la peau sont disponibles sur le marché (par exemple, EpiSkin, EpiDerm FT). Cependant, leur coût (100 à 400 € l’unité) et leur délai de livraison (quelques jours-semaines) peuvent inciter le chercheur à tenter de préparer un tel modèle par lui-même. Les procédures proposées sont faciles à réaliser même pour les scientifiques inexpérimentés, et en même temps, permettent d’obtenir des modèles de peau très avancés. Il convient de souligner que la décision sur la composition cellulaire d’un modèle donné dépend entièrement du chercheur. Outre le modèle créé, il peut être développé et amélioré, ce qui ouvre de toutes nouvelles perspectives de recherche. Dans le cas des modèles commerciaux, il est nécessaire d’acheter un équivalent différent.
Bien que les cultures cellulaires 3D puissent être avancées avec plusieurs types de cellules, faciles à manipuler et accessibles, elles ne sont encore que des modèles artificiels qui ne peuvent pas recréer entièrement la complexité et la fonctionnalité du tissu (par exemple, les fonctions immunologiques, la vascularisation). C’est pourquoi, dans la plupart des études, plusieurs modèles sont nécessaires pour confirmer les résultats obtenus. Certains avantages et inconvénients de ces modèles ont été rassemblés dans le tableau 9, ainsi que leurs limites. D’autre part, les modèles commerciaux garantissent des normes qualitatives élevées avec une reproductibilité des expériences et une comparabilité des données entre les laboratoires. Pour mettre en œuvre l’utilisation d’un nouveau composé à des fins de recherche, il sera certainement nécessaire d’acheter l’équivalent commercial approprié. Mais au stade préparatoire, un tel modèle 3D de la peau (sphère de type multicellulaire ou équivalent) peut contribuer à réduire le nombre d’expériences nécessaires à réaliser sur un équivalent commercial. L’objectif de la production et de l’utilisation des modèles décrits n’est pas de contourner la nécessité d’appliquer des modèles de recherche certifiés, mais de faciliter la recherche et de réduire les dépenses connexes.
| Paire de modèles comparée | Avantages | Inconvénients | ||||
| Culture cellulaire vs animaux | Souffrance animale minimisée | Informations limitées sur l’influence d’un facteur testé sur l’ensemble du corps | ||||
| Standardisation élevée des expériences - meilleure reproductibilité des résultats | Un seul modèle ne suffit pas à refléter les processus qui se produisent dans le corps | |||||
| Pas d’effets secondaires pour l’ensemble de l’organisme | - | |||||
| Meilleur contrôle des conditions de l’expérience | - | |||||
| Possibilité d’automatisation (par exemple, bio-impression) | - | |||||
| Réduction des coûts | - | |||||
| La petite taille de l’échantillon nécessaire | - | |||||
| Quantité limitée de déchets générés | - | |||||
| Cultures 3D et 2D | Mieux refléter l’organisme dans son ensemble | Une culture chronophage | ||||
| Possibilité de créer un tissu fonctionnel | Coûts plus élevés | |||||
| Possibilité de créer un modèle adapté aux besoins de la recherche menée | La formation spontanée d’une structure 3D n’est presque pas possible | |||||
| - | Manque de tests standardisés pour quantifier les effets de divers composés | |||||
| - | Accès limité aux différentes cultures 3D disponibles sur le marché | |||||
| Lignée cellulaire vs cellules primaires | Modèles certifiés et approuvés | Seul un nombre limité de lignées cellulaires est disponible | ||||
| Standardisation élevée des expériences - meilleure reproductibilité des résultats | Possibilité limitée d’obtenir plusieurs types de cellules d’un même donneur | |||||
| Durée de vie plus longue | Peut posséder des propriétés modifiées des cellules natives | |||||
| Taux de prolifération assez rapide | Fonctionnalité fréquemment perturbée des cellules | |||||
| Moins sensible à plusieurs activités (ex. : congélation, centrifugation) | - | |||||
Tableau 9 : Comparaison de l’utilisation de différents modèles dans la recherche - avantages et inconvénients
Plusieurs articles décrivent comment préparer des modèles de peau 3D (en dehors des articles de synthèse résumant les modèles disponibles dans le commerce 14,43,44, ils sont généralement axés sur une seule méthodologie pour obtenir les sphères 45 ou équivalentes46).
Dans cet article, deux méthodologies ont été décrites pour la formation de sphères avec des cellules cutanées. La méthode de la goutte suspendue est largement utilisée, mais sa répétabilité et sa stabilité peuvent être insuffisantes dans certains cas. La plupart des étapes nécessitent des actions spécifiques, telles que le travail à grande vitesse en raison de l’évaporation de l’eau des gouttelettes pendant le transfert. Des mouvements doux sont également recommandés, car l’absence d’une telle compétence peut entraîner des dommages globaux cellulaires31,32. Ainsi, une méthode plus simple pour la préparation des sphères est axée sur la limitation de l’adhésion cellulaire. L’absence d’une bonne surface pour la fixation cellulaire favorise des interactions plus élevées entre les cellules. En conséquence, des agrégats de cellules sont générés. Sa répétabilité est beaucoup plus élevée car il n’est pas nécessaire de transférer des sphères. Avec ces méthodes, le nombre optimal de cellules cutanées pour créer une sphère a été établi à 1 x 104 cellules/sphère.
Ensuite, des procédures décrivant la préparation des équivalents de peau ont été présentées. Leur apparence et leur fonctionnalité dans la recherche peuvent dépendre fortement des éléments à partir desquels ils sont construits, notamment les cellules (tableau 2), les échafaudages et les supports. Les échafaudages 3D utilisés pour la préparation de la peau artificielle peuvent être divisés en hydrogels synthétiques et ceux formés à partir de sources naturelles. En fonction du matériau utilisé et de ses propriétés pour composer l’hydrogel, la nécessité de compléter le milieu peut survenir. Les hydrogels synthétiques nécessitent l’incorporation de molécules bioactives (protéines, enzymes et facteurs de croissance) dans le réseau d’hydrogels synthétiques pour assurer des fonctions cellulaires spécifiques47. Les principales approches présentées dans la littérature pour obtenir une livraison contrôlée de facteurs de croissance aux hydrogels comprennent la charge directe, l’interaction électrostatique, la liaison covalente et l’utilisation de supports48. Les hydrogels formés à partir de sources naturelles telles que les protéines ECM et les polymères peuvent générer des voies fluides tout au long de l’échafaudage 3D, accélérant ainsi la distribution des nutriments ; Ainsi, il n’est pas nécessaire de compléter le média. Des recherches ont montré que de petites molécules (comme les cytokines et les facteurs de croissance) et des macromolécules (y compris les glycosaminoglycanes et les protéoglycanes) peuvent être transportées à travers l’ECM par diffusion47. Cependant, la diffusion moléculaire de l’oxygène, des nutriments et d’autres molécules bioactives peut être entravée par les propriétés de l’hydrogel ECM lui-même. Une diffusion plus faible était corrélée à l’épaisseur plus élevée de l’hydrogel, mais aussi à une très forte concentration de collagène37. Dans cette étude, pour créer l’équivalent cutané, une faible concentration de collagène égale à 2 mg/mL a été utilisée, ce qui suggère que la diffusion moléculaire à travers l’hydrogel devrait être bonne et rapide. Ainsi, aucune supplémentation supplémentaire n’a été fournie au milieu à ce stade ni à l’hydrogel lui-même. Pour imiter le derme, des mastocytes et des fibroblastes (1:10) ont été intégrés dans l’hydrogel de collagène. Ensuite, des mélanocytes et des kératinocytes (1:15) ont été ensemencés sur l’hydrogel et l’équivalent entier a été cultivé dans le milieu. Il convient de mentionner que le milieu de base est composé de plusieurs acides aminés, d’acides inorganiques et de vitamines, et qu’il est en outre complété par du sérum (composé de plusieurs facteurs de croissance et d’attachement pour les cellules, les lipides, les hormones, les nutriments et les sources d’énergie, les transporteurs, les protéines de liaison et de transfert, etc.). Pour obtenir la bonne structure de l’épiderme, différents suppléments au milieu doivent être ajoutés à un certain moment. Le stimulateur le plus important pour initier la différenciation épidermique est le calcium, car il active la signalisation intracellulaire. L’acide ascorbique stimule une voie de signalisation similaire à celle médiée par le calcium, mais son effet s’accompagne également d’un transport accru de l’ascorbate et de la prévention de l’épuisement des antioxydants hydrophiles41. De plus, la différenciation des cellules a été améliorée lorsque d’autres composants ont été ajoutés au milieu (tels que la caféine, l’hydrocortisone, la triiodothyronine, l’adénine et la toxine cholérique)41,44. Il est important que les modèles préparés soient toujours vérifiés pour la présence d’un type de cellule donné dans la couche appropriée. La présence des quatre types de cellules cutanées a été confirmée dans la structure de l’équivalent créé par coloration H&E.
Le problème le plus courant rencontré est la délicatesse et l’intuition dans la manipulation des modèles obtenus. Certaines difficultés peuvent être liées à la formation de la sphère cellulaire ainsi qu’à la préparation de l’hydrogel. Au cours de la culture cellulaire, plusieurs autres problèmes peuvent également survenir ; il s’agit notamment des infections microbiennes, du faible taux de prolifération des cellules, du vieillissement des cellules primaires utilisées dans les modèles, du temps de culture maximal des modèles 2D et 3D reconstruits à partir de cellules primaires par rapport aux lignées cellulaires, etc. Le tableau 10 contient des conseils pratiques sur ce qu’il faut faire lorsque l’un des problèmes suivants se pose.
| Problèmes courants en culture cellulaire | Suggestions | |||
| Infection microbienne | Si une infection microbienne se produit dans l’un des flacons/boîtes contenant des cellules, il est préférable de retirer la culture infectée le plus rapidement possible (pour ne pas contaminer les flacons/boîtes restants avec des cellules). Recongelez un nouveau flacon avec des cellules. Si l’infection revient, il est bon d’essayer d’élargir le spectre des antibiotiques appliqués et d’augmenter leur concentration. | |||
| Faible taux de prolifération des cellules | Certaines cellules ont un long temps de doublement. Pour stimuler leur prolifération, plusieurs facteurs de croissance spécifiques aux cellules peuvent être ajoutés au milieu de base. De plus, l’augmentation de la concentration de FBS ou de L-glutamine dans le milieu basal peut aider à stimuler la croissance des cellules. | |||
| Vieillissement des cellules primaires utilisées dans les modèles | Après quelques passages, les cellules primaires entrent en sénescence et cessent de se diviser. Pour pallier ce problème dans les modèles, il est recommandé d’utiliser les cellules dès le passage le plus tôt possible pour construire le modèle. | |||
| Temps de culture maximal des modèles 2D et 3D reconstruits à partir de cellules primaires par rapport aux lignées cellulaires | Le temps de culture d’un modèle dépend fortement du type de cellules utilisées. Avec les cellules primaires, le temps de culture sera plus court en raison de leur courte durée de vie. | |||
| Difficultés dans la formation de la sphère cellulaire | Certaines cellules peuvent nécessiter plus de temps pour la formation de sphères. Si, après quelques jours supplémentaires, les sphères ne se sont pas formées, prélevez les cellules de l’échantillon et vérifiez leur viabilité avec, par exemple, une coloration au bleu de trypan. | |||
| Problèmes de stabilité de la sphère | Si les sphères ne sont pas stables et sont détruites lors de la manipulation, essayez de créer des sphères à partir d’un nombre inférieur de cellules. Assurez-vous de toujours transférer doucement les plats dans lesquels les sphères poussent. | |||
| Difficultés avec la préparation de l’hydrogel | Vérifiez si la proportion des ingrédients (eau, PBS [10x], NaOH, collagène de type 1) était correcte. La solution mère de collagène est généralement très dense, assurez-vous donc de la pipeter lentement. Les bulles d’air perturbent la morphologie de l’hydrogel, donc le pipetage inversé du gel peut aider à résoudre ce problème. | |||
Tableau 10 : Dépannage de la culture cellulaire
Les modèles établis après la fabrication peuvent être utilisés dans de multiples domaines, en commençant par (1) les expériences de cytotoxicité et de génotoxicité de nouveaux composés ayant une activité biologique pour une utilisation dans les médicaments et les cosmétiques49, (2) les expériences avec stimulation de divers facteurs50, (3) la recherche fondamentale augmentant nos connaissances sur les cellules de la peau, leurs fonctions biologiques, leurs interactions avec d’autres cellules et l’environnement51, 52, (4) la recherche sur des entités pathologiques sélectionnées où un type spécifique de cellule peut être introduit dans le modèle créé (cellules cancéreuses, cellules avec une mutation dans un gène donné, etc.14,53) et bien d’autres. Il va sans dire que l’application de ces modèles reste en accord avec le principe des 3R pour une utilisation plus éthique des animaux dans les tests de produits et la recherche scientifique et ne viole pas la loi d’interdiction des tests de produits cosmétiques sur les animaux.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Les auteurs sont reconnaissants du soutien financier apporté par l’Université de technologie de Varsovie dans le cadre du programme « Initiative d’excellence - Université de recherche » sous la forme de deux subventions : POB BIB BIOTECHMED-2 start (n° 1820/2/ZO1/POB4/2021) et la bourse du recteur pour les groupes de recherche d’étudiants (SKIN-ART, n° 1820/116/Z16/2021). En outre, les auteurs tiennent à remercier le professeur Joanna Cieśla et la chaire de biotechnologie des médicaments et des cosmétiques, ainsi que le club des sciences de la biotechnologie « Herbion » de la faculté de chimie de l’Université de technologie de Varsovie, pour leur soutien. Nous remercions tout particulièrement le Dr Michał Stepulak d’avoir fourni le composé Pluronic F-127.
matériels
| Name | Company | Catalog Number | Comments |
| 24-well plate for adherent cell culture | Biologix Europe GmbH | 07-6024 | - |
| 35%–38% HCL | Chempur | 115752837 | - |
| 60 mm cell culture Petri dish | Nest | 705001 | - |
| Avidin−Sulforhodamine 101 | Sigma Aldrich | A2348-5MG | - |
| Bright-field inverted microscope | Olympus | CKX41 | - |
| Calcium chloride | Avantor | 874870116 | - |
| Cell culture flask T75 for adherent cells | Genoplast | G77080033 | - |
| Centrifuge tube 15 mL | GoogLab Scientific | G66010522 | - |
| CO2 Incubator | Heal Force | Galaxy 170R | - |
| Col1A2 antibody produced in rabbit | Novus | NBP2-92790 | - |
| Corning(R) Transwell(R) Polycarbonate | Corning | CLS3422-48EA | - |
| Cytokeratin 14 antibody produced in mouse | Novus | NBP1-79069 | - |
| DPX Mountant for histology | Sigma Aldrich | 06522-100ML | - |
| Dulbecco's Modified Eagle Medium (DMEM) | VWR Chemicals | L0102-500 | - |
| Eosine Y | Kolchem | - | 0.5 % aquatic solution |
| Eppendorf tube 1.5 mL | Sarstedt | 72.690.001 | - |
| Eppendorf tube 2 mL | Sarstedt | 72.691 | - |
| Ethyl alcohol absolute 99.8% | Avantor | 396480111 | diluted in ultrapure water to the needed concentrations |
| Fetal bovine serum | Gibco | 10270106 | - |
| Fluorescent inverted microscope | Olympus | IX71 | - |
| Goat anti-mouse secondary antibody conjugated with FITC | Sigma Aldrich | F0257-1mL | |
| Goat anti-rabbit secondary antibody conjugated with FITC | Novus | NB7159 | - |
| Harris Hematoxylin | Kolchem | - | 1 mg/mL in 95% ethanol |
| Hoechst 33342 | ThermoFisher | H3570 | - |
| Laminar chamber | Heal Force | HFSafe-1200 | - |
| Melan-A antibody produced in mouse | Santa Cruz Biotechnology | sc-20032 | - |
| Microtome | Microm | HM355S | - |
| NaOH | Avantor | 810981997 | - |
| Paraffin pastilles | Sigma Aldrich | 1.07164 | - |
| Paraformaldehyde | Sigma Aldrich | 1581227 | - |
| Penicillin/Streptomycin solution | Sigma Aldrich | P4333 | - |
| Pipette tip, 1000 µL | Sarstedt | 70.305 | - |
| Pipette tip, 20 µL | Sarstedt | 70.3021 | - |
| Pipette tip, 200 µL | Sarstedt | 70.303 | - |
| Pluronic F-127 | BASF | 50401036 | - |
| Serological pipette 10 mL | GoogLab Scientific | G33270011 | - |
| Serological pipette 25 mL | GoogLab Scientific | G33280011 | - |
| Serological pipette 5 mL | GoogLab Scientific | G33260011 | - |
| Sodium bicarbonate | Sigma Aldrich | S5761 | - |
| Sodium bicarbonate | Chempur | 118105307 | |
| Trypsin-EDTA 0.25% solution, phenol red | Sigma Aldrich | 25200072 | - |
| Type 1 collagen | IBIDI | 50201 | - |
| U-bottom 96-well plate | Sarstedt | 83.3925500 | - |
| Xylene | Sigma Aldrich | 534056 | - |
Références
- Farage, M. A., Miller, K. W., Elsner, P., Maibach, H. I. Characteristics of the aging skin. Advances in Wound Care. 2 (1), 5-10 (2013).
- Zhu, H., Alikhan, A., Maibach, H. I., Farage, M. A., Miller, K. W., Maibach, H. I. Biology of Stratum Corneum: Tape Stripping and Protein Quantification. Textbook of Aging Skin. , (2015).
- Boer, M., Duchnik, E., Maleszka, R., Marchlewicz, M. Structural and biophysical characteristics of human skin in maintaining proper epidermal barrier function. Postepy Dermatogogii I Alergologii. 33 (1), 1-5 (2016).
- De Falco, M., Pisano, M. M., De Luca, A., Baldi, A., Pasquali, P., Spugnini, E. P. Embryology and Anatomy of the Skin. In Skin Cancer: A Practical Approach. Current Clinical Pathology. , (2014).
- Dehdashtian, A., Stringer, T. P., Warren, A. J., Mu, E. W., Amirlak, B., Shahabi, L., Riker, A. I. Anatomy and Physiology of the Skin. Melanoma: A Modern Multidisciplinary Approach. , 15-26 (2018).
- Graham, H. K., Eckersley, A., Ozols, M., Mellody, K. T., Sherratt, M. J., Limbert, G. Human Skin: Composition, Structure and Visualisation Methods. Skin Biophysics; Studies in Mechanobiology, Tissue Engineering, and Biomaterials. 22, 1-18 (2019).
- Piasek, A. M., Musolf, P., Sobiepanek, A. Aptamer-based advances in skin cancer research. Current Medicinal Chemistry. 30 (8), 953-973 (2023).
- Bergfeld, W. F., Belsito, D. V., Marks, J. G., Andersen, F. A. Safety of ingredients used in cosmetics. Journal of the American Academy of Dermatology. 52 (1), 125-132 (2005).
- Hubrecht, R. C., Carter, E. The 3Rs and humane experimental technique: Implementing change. Animals. 9 (10), 754 (2019).
- Sreedhar, D., Manjula, N., Ajay, P., Shilpa, P., Ligade, V. Ban of cosmetic testing on animals: A brief overview. International Journal of Current Research and Review. 12 (14), 113-116 (2020).
- Silva, R. J., Tamburic, S. A state-of-the-art review on the alternatives to animal testing for the safety assessment of cosmetics. Cosmetics. 9 (5), 90 (2022).
- Xu, Y., Shrestha, N., Préat, V., Beloqui, A. An overview of in vitro, ex vivo and in vivo models for studying the transport of drugs across intestinal barriers. Advanced Drug Delivery Reviews. 175, 113795 (2021).
- Boelsma, E., Ponec, M., Gabard, B., Surber, C., Elsner, P., Treffel, P. Basics (Guidelines) on Cell Culture Testing for Topical/Dermatological Drugs/Products and Cosmetics With Regard to Efficacy and Safety of the Preparations. In Dermatopharmacology of Topical Preparations. , 37-57 (2000).
- Suhail, S., Sardashti, N., Jaiswal, D., Rudraiah, S., Misra, M., Kumbar, S. G. Engineered skin tissue equivalents for product evaluation and therapeutic applications. Biotechnology Journal. 14 (7), 1900022 (2019).
- Sobiepanek, A., et al. Novel diagnostic and prognostic factors for the advanced melanoma based on the glycosylation-related changes studied by biophysical profiling methods. Biosensors and Bioelectronics. 203, 114046 (2022).
- Yang, H., Sun, L., Liu, M., Mao, Y. Patient-derived organoids: A promising model for personalized cancer treatment. Gastroenterology Report. 6 (4), 243-245 (2018).
- Baran, J., et al. Mast cells as a target-A comprehensive review of recent therapeutic approaches. Cells. 12 (8), 1187 (2023).
- Kosten, I. J., Buskermolen, J. K., Spiekstra, S. W., de Gruijl, T. D., Gibbs, S. Gingiva equivalents secrete negligible amounts of key chemokines involved in langerhans cell migration compared to skin equivalents. Journal of Immunology Research. 2015, 627125 (2015).
- cieżyńska, A., et al. A novel and effective method for human primary skin melanocytes and metastatic melanoma cell isolation. Cancers. 13 (24), 6244 (2021).
- Kröger, M., et al. In vivo non-invasive staining-free visualization of dermal mast cells in healthy, allergy and mastocytosis humans using two-photon fluorescence lifetime imaging. Scientific Reports. 10 (1), 14930 (2020).
- Liu, D., Chen, S., Win Naing, M. A review of manufacturing capabilities of cell spheroid generation technologies and future development. Biotechnology and Bioengineering. 118 (2), 542-554 (2021).
- Rossi, A., Appelt-Menzel, A., Kurdyn, S., Walles, H., Groeber, F. Generation of a three-dimensional full thickness skin equivalent and automated wounding. Journal of Visualized Experiments: JoVE. (96), e52576 (2015).
- Kim, K., Kim, J., Kim, H., Sung, G. Y. Effect of α-lipoic acid on the development of human skin equivalents using a pumpless skin-on-a-chip model. International Journal of Molecular Sciences. 22 (4), 2160 (2021).
- Curto, E. V., Lambert, G. W., Davis, R. L., Wilborn, T. W., Dooley, T. P. Biomarkers of human skin cells identified using DermArray DNA arrays and new bioinformatics methods. Biochemical and Biophysical Research Communications. 291 (4), 1052-1064 (2002).
- Godwin, L. S., et al. Isolation, culture, and transfection of melanocytes. Current Protocols in Cell Biology. 63, 1-20 (2014).
- Przekora, A., Zarnowski, T., Ginalska, G. A simple and effective protocol for fast isolation of human tenon's fibroblasts from a single trabeculectomy biopsy - a comparison of cell behaviour in different culture media. Cellular & Molecular Biology Letters. 22, 5 (2017).
- Rådinger, M., Jensen, B. M., Kuehn, H. S., Kirshenbaum, A., Gilfillan, A. M., Coligan, J. E., Bierer, B. E., Margulies, D. H., Shevach, E. M., Strober, W. Generation, Isolation, and Maintenance of Human Mast Cells and Mast Cell Lines Derived from Peripheral Blood or Cord Blood. Current Protocols in Immunology. , (2010).
- Artuc, M., Muscha Steckelings, U., Henz, B. M. Mast cell-fibroblast interactions: Human mast cells as source and inducers of fibroblast and epithelial growth factors. Journal of Investigative Dermatology. 118 (3), 391-395 (2002).
- Panos, R. J., Rubin, J. S., Csaky, K. G., Aaronson, S. A., Mason, R. J. Keratinocyte growth factor and hepatocyte growth factor/scatter factor are heparin-binding growth factors for alveolar type ii cells in fibroblast-conditioned medium. Journal of Clinical Investigation. 92 (2), 969-977 (1993).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Threedimensional cell culture: A powerful tool in tumor research and drug discovery (Review). Oncology Letters. 14 (6), 6999-7010 (2017).
- Amaral, R. L. F., Miranda, M., Marcato, P. D., Swiech, K. Comparative analysis of 3D bladder tumor spheroids obtained by forced floating and hanging drop methods for drug screening. Frontiers in Physiology. 8, 605 (2017).
- Gao, B., Jing, C., Ng, K., Pingguan-Murphy, B., Yang, Q. Fabrication of three-dimensional islet models by the geometry-controlled hanging-drop method. Acta Mechanica Sinica. 35 (2), 329-337 (2019).
- Zhang, C., et al. 3D culture technologies of cancer stem cells: Promising ex vivo tumor models. Journal of Tissue Engineering. 11, (2020).
- Sobiepanek, A., Paone, A., Cutruzzolà, F., Kobiela, T. Biophysical characterization of melanoma cell phenotype markers during metastatic progression. European Biophysics Journal: EBJ. 50 (3-4), 523-542 (2021).
- Jin, G. -. Z., Kim, H. -. W. Effects of Type I collagen concentration in hydrogel on the growth and phenotypic expression of rat chondrocytes. Tissue Engineering and Regenerative. 14 (4), 383-391 (2017).
- Osidak, E. O., et al. Concentrated collagen hydrogels: A new approach for developing artificial tissues. Materialia. 20, 101217 (2021).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: Characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Jimbow, K., Salopek, T. G., Dixon, W. T., Searles, G. E., Yamada, K. The epidermal melanin unit in the pathophysiology of malignant melanoma. The American Journal of Dermatopathology. 13 (2), 179-188 (1991).
- Van Den Bogaard, E., et al. Perspective and consensus opinion: Good practices for using organotypic skin and epidermal equivalents in experimental dermatology research. Journal of Investigative Dermatology. 141 (1), 203-205 (2021).
- Bednarek, R. In vitro methods for measuring the permeability of cell monolayers. Methods and Protocols. 5 (1), 17 (2022).
- Idrees, A., et al. Fundamental in vitro 3D human skin equivalent tool development for assessing biological safety and biocompatibility - towards alternative for animal experiments. 4 Open. 4, (2021).
- Park, H. -. Y., Kweon, D. -. K., Kim, J. -. K. Upregulation of tight junction-related proteins by hyaluronic acid in human HaCaT keratinocytes. Bioactive Carbohydrates and Dietary Fibre. 30, 100374 (2023).
- Choudhury, S., Das, A. Advances in generation of three-dimensional skin equivalents: Pre-clinical studies to clinical therapies. Cytotherapy. 23 (1), 1-9 (2021).
- Zhang, Z., Michniak-Kohn, B. B. Tissue engineered human skin equivalents. Pharmaceutics. 4 (1), 26-41 (2012).
- Woappi, Y., Altomare, D., Creek, K. E., Pirisi, L. Self-assembling 3D spheroid cultures of human neonatal keratinocytes have enhanced regenerative properties. Stem Cell Research. 49, 102048 (2020).
- Ouwehand, K., Spiekstra, S. W., Waaijman, T., Scheper, R. J., de Gruijl, T. D., Gibbs, S. Technical advance: Langerhans cells derived from a human cell line in a full-thickness skin equivalent undergo allergen-induced maturation and migration. Journal of Leukocyte Biology. 90 (5), 1027-1033 (2011).
- Akther, F., Little, P., Li, Z., Nguyen, N. -. T., Ta, H. T. Hydrogels as artificial matrices for cell seeding in microfluidic devices. RSC Advances. 10 (71), 43682-43703 (2020).
- Silva, A. K. A., Richard, C., Bessodes, M., Scherman, D., Merten, O. -. W. Growth factor delivery approaches in hydrogels. Biomacromolecules. 10 (1), 9-18 (2009).
- Lee, H. -. R., et al. Effect of Aronia extract on collagen synthesis in human skin cell and dermal equivalent. Oxidative Medicine and Cellular Longevity. 2022, 4392256 (2022).
- Mulder, P. P. G., Raktoe, R. S., Vlig, M., Elgersma, A., Middelkoop, E., Boekema, B. K. H. L. Full skin equivalent models for simulation of burn wound healing, exploring skin regeneration and cytokine response. Journal of Functional Biomaterials. 14 (1), 29 (2023).
- Goncalves, K., et al. Investigation into the effect of skin tone modulators and exogenous stress on skin pigmentation utilizing a novel bioengineered skin equivalent. Bioengineering & Translational Medicine. 8 (2), 10415 (2023).
- Michel, M., L'Heureux, N., Pouliot, R., Xu, W., Auger, F. A., Germain, L. Characterization of a New Tissue-Engineered Human Skin Equivalent with Hair. In Vitro Cellular & Developmental Biology. Animal. 35 (6), 318-326 (1999).
- Müller, I., Kulms, D. A 3D organotypic melanoma spheroid skin model. Journal of Visualized Experiments: JoVE. (135), e57500 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon