Method Article
Aufbau von Hautmodellen für zahlreiche Anwendungen - von der zweidimensionalen (2D) Monokultur bis zur dreidimensionalen (3D) Multikultur
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier stellen wir Ihnen kostengünstige und einfache Verfahren vor, um verschiedene 3D-Hautmodelle für die Routineforschung in einem Zellkulturlabor einzuführen. Forscher können Modelle erstellen, die auf ihre Bedürfnisse zugeschnitten sind, ohne auf kommerziell erhältliche Modelle angewiesen zu sein.
Zusammenfassung
Aufgrund der komplexen Struktur und der wichtigen Funktionen der Haut ist es ein interessantes Forschungsmodell für die Kosmetik-, Pharma- und Medizinindustrie. In der Europäischen Union gibt es ein vollständiges Verbot, kosmetische Mittel und ihre Inhaltsstoffe an Tieren zu testen. Im Falle von Medizin und Pharmazeutika ist diese Möglichkeit ebenfalls ständig eingeschränkt. Nach dem 3R-Prinzip wird es immer üblicher, sowohl einzelne Compounds als auch ganze Formulierungen an künstlich erzeugten Modellen zu testen. Am billigsten und am weitesten verbreitet sind die 2D-Modelle, die aus einer Zellmonoschicht bestehen, aber nicht die realen Wechselwirkungen zwischen den Zellen im Gewebe widerspiegeln. Die kommerziell erhältlichen 3D-Modelle bieten zwar eine bessere Darstellung des Gewebes, werden aber nicht in großem Maßstab eingesetzt. Das liegt daran, dass sie teuer sind, die Wartezeit recht lang ist und die verfügbaren Modelle häufig auf die üblicherweise verwendeten Modelle beschränkt sind.
Um die durchgeführte Forschung auf ein höheres Niveau zu heben, haben wir die Verfahren verschiedener 3D-Hautmodellpräparationen optimiert. Die beschriebenen Verfahren sind kostengünstig und einfach herzustellen, da sie in zahlreichen Labors und von Forschern mit unterschiedlichen Erfahrungen in der Zellkultur angewendet werden können.
Einleitung
Die Haut ist eine kontinuierliche Struktur mit mehrzelligen Wechselwirkungen, die das reibungslose Funktionieren und die Homöostase dieses komplexen Organs offenbaren. Sie besteht aus morphologisch unterschiedlichen Schichten: der inneren Schicht - der Dermis - und der äußeren Schicht - der Epidermis. Neben der Epidermis unterscheiden wir zusätzlich das Stratum corneum (bestehend aus abgeflachten abgestorbenen Zellen - Korneozyten), das den größten Schutz gegen die äußere Umgebung bietet. Einige der wichtigsten passiven und aktiven Funktionen der Haut sind der Schutz des Körpers vor äußeren Einflüssen, die Teilnahme an den immunologischen Prozessen, die Sekretion, die Resorption, die Thermoregulation und die Wahrnehmung 1,2,3. Da es als eines der größten Organe des Körpers gilt, ist es unmöglich, den Kontakt mit verschiedenen Krankheitserregern, Allergenen, Chemikalien sowie ultravioletter (UV) Strahlung zu vermeiden. Daher ist es mit vielen Zelltypen mit spezifischen Funktionen strukturiert. Die wichtigsten Zelltypen in der Epidermis sind Keratinozyten (fast 90% aller Zellen mit strukturellen und immunologischen Funktionen in den tieferen Teilen der Epidermis, die aber später den Keratinisierungsprozess durchlaufen, um sich in der obersten Schicht der Epidermis in Korneozyten zu verwandeln), Melanozyten (nur 3%-7% der epidermalen Zellpopulation, die das UV-Schutzpigment Melanin produzieren) und die Langerhans-Zellen (aus dem Immunsystem). Im Falle der Dermis sind die Hauptzellen Fibroblasten (die Wachstumsfaktoren und Proteine produzieren), dendritische Zellen und Mastzellen (beides Zelltypen des Immunsystems)4,5,6. Darüber hinaus ist die Haut mit mehreren extrazellulären Proteinen ausgestattet (wie Kollagen Typ I und IV, Fibronektin und Laminin; Abbildung 1) und Proteinfasern (Kollagen und Elastin), die die spezifische Struktur der Haut gewährleisten, aber auch die Zellbindung, die Zelladhäsion und andere Wechselwirkungen fördern7.
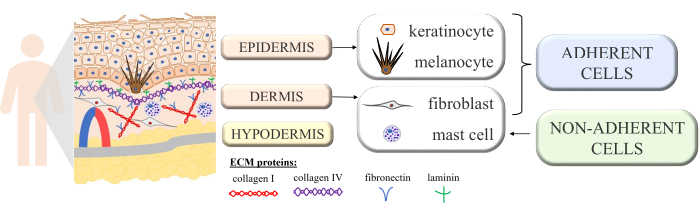
Abbildung 1: Schematische Darstellung der Hautstruktur. Die Hautstruktur kennzeichnete vier Grundzelltypen, die in ihren einzelnen Schichten vorkommen und Proteine der extrazellulären Matrix unterschieden. Diese Abbildung wurde mit MS PowerPoint erstellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die Sicherheit von Kosmetika und pharmazeutischen Produkten ist ein sehr wichtiges Thema, und der Schutz der Gesundheit von Verbrauchern und Patienten hat Priorität8. Bis vor kurzem sollte dies durch zahlreiche Tests, auch an Tierversuchen, gewährleistet werden. Leider erforderten diese oft den Einsatz drastischer Methoden, die bei Tieren, die zu Forschungszwecken eingesetzt wurden (häufig Mäuse, Ratten und Schweine), Schmerzen und Leiden verursachten. Im Jahr 1959 wurden die Prinzipien der humanen Versuchstechnik (das 3R-Prinzip) eingeführt: (1 - Ersatz) Ersatz von Tieren in der Forschung durch In-vitro-, In-Sillico - oder ex vivo-Modelle , (2 - Reduzierung) Verringerung der Anzahl der für die Forschung verwendeten Tiere und (3 - Verfeinerung) Verbesserung des Wohlergehens der Tiere, die noch für die Forschung benötigt werden, und gleichzeitige Verbesserung der entwickelten Alternativmethoden9. Darüber hinaus sind kosmetische Tierversuche in der Europäischen Union (EU) gesetzlich geregelt. Am 11. September 2004 trat das Verbot von an Tieren getesteten Kosmetika in Kraft. Am 11. März 2009 hat die EU Tierversuche für kosmetische Inhaltsstoffe verboten. Der Verkauf von kosmetischen Mitteln, die aus neu an Tieren getesteten Inhaltsstoffen hergestellt wurden, war nicht erlaubt; Die Prüfung der Produkte an Tieren auf komplexe Probleme der menschlichen Gesundheit wie Toxizität bei wiederholter Verabreichung, Reproduktionstoxizität und Toxikokinetik war jedoch weiterhin akzeptabel. Seit dem 11. März 2013 ist es in der EU illegal, Kosmetika zu verkaufen, bei denen das fertige Produkt oder seine Inhaltsstoffe an Tieren getestet wurden10. Daher wird in der Kosmetik derzeit auf drei Ebenen geforscht: in vitro (Zellen), ex vivo (reale Gewebe) und in vivo (Freiwillige)11. Im Falle von Arzneimitteln besteht weiterhin die Notwendigkeit von Tierversuchen; Es wird jedoch deutlich reduziert und streng kontrolliert12.
Als Alternativmethoden zum Tierversuch und zur ersten Beurteilung der Wirksamkeit eines neuartigen Wirkstoffs werden die in vitro Hautzellkulturen eingesetzt. Die Isolierung verschiedener Arten von Hautzellen und ihre Kultivierung unter sterilen Laborbedingungen ermöglicht es, die Sicherheit und Toxizität von Wirkstoffen zu beurteilen. Hautzelllinien sind auch weithin anerkannte Modelle für die Forschung, da die Zellen von zertifizierten Unternehmen verkauft werden und die Ergebnisse in verschiedenen Labors vergleichbar sein können. Diese Tests werden in der Regel an einfachen 2D-Modellen der Monokulturen der menschlichen Hautzellen durchgeführt. Einige der fortschrittlicheren Modelle sind ihre Co-Kulturen (wie Keratinozyten mit Fibroblasten und Keratinozyten mit Melanozyten) sowie die dreidimensionalen Modelle, einschließlich gerüstfreier Kulturen (Kugeln) und gerüstbasierter Hautäquivalente der Epidermis, der Dermis oder sogar der Hautersatzstoffe in voller Dicke13. Es ist erwähnenswert, dass außer dem letzten Typ (Hautäquivalente) die übrigen nicht im Handel erhältlich sind und der Wissenschaftler sie bei Bedarf selbst herstellen muss.
Obwohl viele dieser Modelle gewartet wurden und heutzutage routinemäßig verkauft werden (Tabelle 1), werden ständig zusätzliche Modelle benötigt, um die meisten Ergebnisse zu validieren. Daher sollten die neu entwickelten Modelle die realen Interaktionen, die im menschlichen Körper stattfinden, besser nachbilden. Wenn eine Mischung von Zellen verschiedener Typen verwendet wird, um solche Modelle zu bilden, kann die Reproduktion des mehrzelligen Aspekts des Gewebes in vivo erreicht werden. Als Ergebnis entwickelt sich eine organotypische Kultur (Abbildung 2).
| Name | Beschreibung | |||||
| Normale Haut | EpiSkin | Rekonstruierte menschliche Epidermis - Keratinozyten auf einer Kollagenmembran | ||||
| SkinEthic RHE | Rekonstruierte menschliche Epidermis - Keratinozyten auf einer Polycarbonat-Membran | |||||
| SkinEthic RHE-LC | Humanes epidermales Modell Langerhans-Zellen - Keratinozyten und Langerhans-Zellen auf einer Polycarbonat-Membran | |||||
| SkinEthic RHPE | Rekonstruierte menschliche pigmentierte Epidermis - Keratinozyten und Melanozyten auf einer Polycarbonatmembran | |||||
| T-Haut | Rekonstruiertes humanes Hautmodell in voller Dicke - Keratinozyten auf einer Schicht von Fibroblasten, die auf einer Polycarbonatmembran gezüchtet wurden | |||||
| Modell Phenion FT Skin | Keratinozyten und Fibroblasten im Hydrogel | |||||
| Haut mit einer Krankheit | Melanom FT Hautmodell | Normale humane Keratinozyten und Fibroblasten mit humaner maligner Melanom-Zelllinie A375 | ||||
| Psoriasis-Gewebemodell | Normale humane Keratinozyten und Fibroblasten | |||||
Tabelle 1: Die beliebtesten kommerziellen Hautäquivalente für verschiedene Studien.
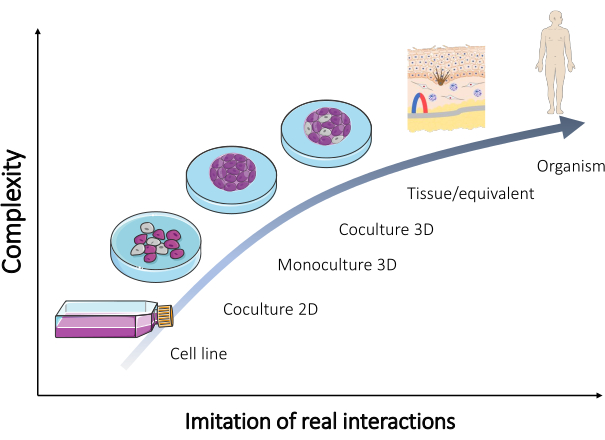
Abbildung 2: Komplexität verschiedener in vitro Modelle. Die Beziehung zwischen der Komplexität verschiedener In-vitro-Modelle , um einen Organismus nachzubilden, und den realen Wechselwirkungen, die direkt im menschlichen Körper stattfinden. Die Figur wurde aus dem Set "Mikrobiologie und Zellkultur" von Servier Medical Art by Servier (https://smart.servier.com/) modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Eine der wichtigsten Einschränkungen der kommerziellen Äquivalente ist die Verfügbarkeit von nur sehr allgemeinen Forschungsmodellen mit wenigen Zelltypen (typischerweise 1-2, selten 3). Es gibt jedoch viel mehr Zellen in der Haut, und ihre Wechselwirkung miteinander kann eine bessere oder schlechtere Verträglichkeit verschiedener Inhaltsstoffe gewährleisten14. Das Fehlen einiger Immunkomponenten kann seinen Wert in verschiedenen Arten der Forschung, einschließlich der Immuntherapie, verringern. Dies ist ein ernstes Problem, da das Melanom aufgrund des frühen Auftretens von Metastasen und der häufigen Resistenz gegen die angewandte Behandlung ein lebensbedrohlicher Hautkrebs ist15. Um das Modell der künstlichen Haut zu verbessern, versuchen die Forscher, eine Co-Kultur von Immunzellen mit Zelllinien und Organoiden zu etablieren16, was als große Verbesserung der untersuchten Modelle angesehen wird. Zum Beispiel sind Mastzellen an vielen physiologischen (Wundheilung, Gewebeumbau) und pathologischen (Entzündung, Angiogenese und Tumorprogression) Prozessen in der Haut beteiligt17. Daher kann ihr Vorkommen im Modell die Reaktion des Modells auf die untersuchte Verbindung erheblich verändern. Schließlich fehlen noch viele hautbezogene Informationen, die nur durch Grundlagenforschung entdeckt werden können. Aus diesem Grund ist die Entwicklung und Verfeinerung verschiedener künstlicher Hautmodelle (Tabelle 2) ein so wichtiges Unterfangen. In diesem Artikel werden verschiedene Verfahren zum Erstellen erweiterter Hautmodelle vorgestellt, einschließlich Kugeln und Hautäquivalenten.
| In-vitro-Hautmodell | Versuch, Wechselwirkungen im Gewebe nachzubilden | Beispiele für die verwendeten Zellen |
| 2D- oder 3D-Zellkultur | Epidermis | Keratinozyten |
| Melanozyten | ||
| Keratinozyten + Melanozyten | ||
| Lederhaut | Fibroblasten | |
| Mastzellen | ||
| Fibroblasten + Mastzellen | ||
| Haut | Keratinozyten + Fibroblasten | |
| Keratinozyten + Mastzellen | ||
| Melanozyten + Fibroblasten | ||
| Melanozyten + Mastzellen | ||
| Keratinozyten + Fibroblasten + Melanozyten | ||
| Keratinozyten + Fibroblasten + Mastzellen |
Tabelle 2: Beispiele für Zelltypmischungen zur Nachbildung von Hautgewebe in 2D- und 3D-Kulturen.
Protokoll
Die Studie wurde nach den Richtlinien der Deklaration von Helsinki durchgeführt und von der Ethikkommission der Medizinischen Universität Warschau genehmigt (KB/7/2022). Die Einverständniserklärung wurde von allen an der Studie beteiligten Probanden eingeholt.
HINWEIS: Die beschriebenen Verfahren der fortgeschrittenen Hautmodellpräparation können entweder unter Verwendung von kommerziell erhältlichen primären Hautzellen und Zelllinien oder mit den von Patienten isolierten Primärzellen durchgeführt werden. Kommerzielle Zellen werden mit den entsprechenden Dokumenten geliefert, und ihre Verwendung in der Forschung erfordert für die meisten Länder keine zusätzliche Genehmigung. In einigen Ländern ist es jedoch obligatorisch, so dass es mit den Vorschriften der Lokalen Ethikkommission überprüft werden muss. Wenn die von Patienten isolierten Primärzellen in der Forschung verwendet werden sollen, muss die Studie zunächst von der lokalen Ethikkommission genehmigt und nach deren strengen Richtlinien durchgeführt werden. Darüber hinaus muss von allen Hautgewebespendern eine schriftliche Einverständniserklärung eingeholt werden. Die Isolierung primärer Hautzellen war nicht Gegenstand dieses Artikels, beispielhafte Isolierungsverfahren finden sich jedoch bei Kosten et al. (Keratinozyten)18, Ścieżyńska et al. (Melanozyten)19, Kröger et al. (Fibroblasten und Mastzellen)20. Die meisten normalen Hautzellen und Zelllinien haben eine Sicherheitsstufe der BSL1-Klasse; Sie stellen keine Bedrohungen dar. Die verwendeten Laborgeräte müssen jedoch den Standards für die tierische und menschliche Zellkultur unter kontrollierten Bedingungen entsprechen.
1. Zellkultur der Haut
HINWEIS: Hautzellkulturen müssen in Kolben für adhärente Zellen oder Suspensionszellen (je nach Zelltyp) bei 37 °C und einem Kohlendioxidgehalt von 5 % in einem Inkubator durchgeführt werden. Die Tätigkeiten im Zusammenhang mit dem Anbau und der Verwendung zu Forschungszwecken erfordern sterile Bedingungen und müssen in einer laminaren Kammer durchgeführt werden, nachdem sie 15-30 Minuten lang ultravioletten C-Strahlen (UVC) ausgesetzt waren. Die Gewinnung von Zellsuspensionen, die dann zur Erstellung der zwei- und dreidimensionalen Modelle verwendet werden, erfordert die Implementierung von Verfahren, die vom Zelltyp abhängen (für adhärente Zellen wie Keratinozyten, Fibroblasten und Melanozyten - Schritt 1.1, für nicht-adhärente Zellen von Mastzellen - Schritt 1.2) (Abbildung 3). Für unterschiedliche Kulturkolbengrößen sind die Volumina aller Reagenzien (z. B. Medium, phosphatgepufferte Kochsalzlösung oder Trypsinlösung), die bei den beschriebenen Methoden verwendet werden, in Tabelle 3 aufgeführt. Parameter, die von der Art der Zellen abhängen (z. B. Konzentration und Zusammensetzung der Reagenzien, Zentrifugationsmethode usw.), sind in Tabelle 4 sortiert. Die für die Aussaat verwendeten Zelldichten sind in Tabelle 5 dargestellt. Alle diese Tabellen finden Sie am Ende dieses Abschnitts.
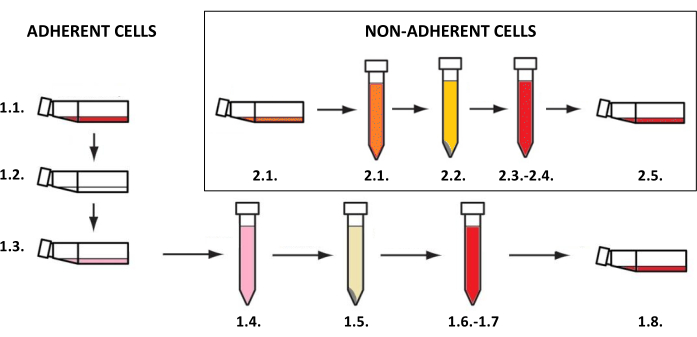
Abbildung 3: Adhärente und nicht-adhärente Zellkultivierung. Das allgemeine Schritt-für-Schritt-Verfahren der adhärenten und nicht-adhärenten Zellkultivierung (die Zahlen entsprechen den Beschreibungen der Schritte 1.1 und 1.2). Die Figur wurde mit MS PowerPoint erstellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Gewinnung einer Suspension von adhärenten Zellen
- Nehmen Sie das Medium aus dem Kulturkolben.
- Waschen Sie die Zellen vorsichtig mit phosphatgepufferter Kochsalzlösung (PBS, Tabelle 3).
- Trypsinlösung in Ethylendiamintetraessigsäure (Trypsin-EDTA-Lösung, Tabelle 3) zugeben. Der Kolben wird bei 37 °C inkubiert und die Ablösung der Zellen von der Oberfläche am Lichtmikroskop kontrolliert.
- Suspendieren Sie die abgelösten Zellen in mindestens der doppelten Menge Vollwachstumsmedium oder Trypsin-Neutralisator, um Trypsin (2:1) zu deaktivieren (für Volumina siehe Tabelle 3 und für Reagenzien siehe Tabelle 4). Der Inhalt des Kolbens wird quantitativ in das 15-ml-Röhrchen überführt.
- Nehmen Sie ein kleines Volumen (20 μl) Zellsuspension in ein 1,5-ml-Röhrchen und zählen Sie die Zellen mit einem manuellen oder automatischen Hämozytometer.
- Das Röhrchen zentrifugieren (Parameter in Tabelle 4), den größten Teil des Überstands entfernen und das Küvettenpellet in der kleinen Menge der verbleibenden Flüssigkeit resuspendieren. Fügen Sie dann genügend frisches Medium hinzu, um das Vorzentrifugationsvolumen (Volumen in Tabelle 3) zu erhalten, wenn die Zelldichte für die Aussaat geeignet ist, oder berechnen Sie das erforderliche Volumen des neuen Mediums neu.
HINWEIS: Einige Zellen, wie z. B. Melanozyten, reagieren sehr empfindlich auf Zentrifugation, so dass sie nicht in kurzer Zeit erneut zentrifugiert werden müssen. - Bereiten Sie die Zellsuspension mit der erforderlichen Dichte (Zellen/ml, Zelldichte in Tabelle 5) für das Experiment vor (2D/3D-Mono- oder Multikulturen von Hautzellen).
HINWEIS: Wenn Zellen weiter kultiviert werden sollen, geben Sie 5.000-8.000 Zellen/ml in einen neuen Kolben zurück und fügen Sie frisches Medium hinzu (Volumen in Tabelle 3).
- Gewinnung einer Suspension von nicht adhärenten Zellen
- Das Medium mit der Zellsuspension wird aus dem Kulturkolben entnommen und quantitativ in das 15-ml-Röhrchen überführt.
- Nehmen Sie ein kleines Volumen (20 μl) der Zellsuspension in ein neues 1,5-ml-Röhrchen. Zählen Sie die Zellen mit einem manuellen oder automatischen Hämozytometer.
- Das Röhrchen zentrifugieren (Parameter in Tabelle 4), den größten Teil des Überstands entfernen und die Zellen in einer kleinen Menge der restlichen Flüssigkeit resuspendieren. Fügen Sie dann frisches Medium hinzu, um das Vorzentrifugationsvolumen (wie in Tabelle 3 angegeben) zu erhalten, wenn die Zelldichte für die Aussaat geeignet ist, oder berechnen Sie das erforderliche Volumen des neuen Mediums neu.
- Bereiten Sie die Zellsuspension mit der erforderlichen Dichte (Zellen pro ml, wie in Tabelle 5 vorgeschlagen) für das Experiment vor (2D/3D-Mono- oder Multikulturen von Hautzellen).
HINWEIS: Wenn Zellen weiter kultiviert werden sollen, geben Sie 5.000-8.000 Zellen/ml in einen neuen Kolben zurück und fügen Sie frisches Medium hinzu.
| 25 cm2 Kulturflaschen | 75 cm2 Kulturflaschen | |
| Nährmedium [mL] | 4–5 | 8–12 |
| PBS [ml] | 5 | 10 |
| Trypsin-EDTA [ml] | 0.5–1 | 1–2 |
| Neutralisationsmedium [mL] | 1–2 | 2–4 |
Tabelle 3: Volumina der Reagenzien, die während der Kultivierung und Herstellung von Zellsuspensionen verwendet werden.
| Monokultur von Hautzellen | Trypsin | Trypsin-Deaktivator | Zentrifugation | Mediumtyp für 2D-Monokultur | |
| Keratinozyten | 0.25% | mit Trypsin-Neutralisator | 300 x g, 5 min, RT | Keratinozyten-Wachstumsmedium 2 | |
| Fibroblasten | 0.25% | mit mittlerem | 300 x g, 5 min, RT | DMEM, 10% FBS | |
| Melanozyten | 0.025% | mit Trypsin-Neutralisator | 300 x g, 3 min, RT | Medium 254, PMA-freies Nahrungsergänzungsmittel für humane Melanozyten-2 | |
| Mastzellen | nicht erforderlich | nicht erforderlich | 300 x g, 3 min, RT | IMDM, 10 % FBS, 1 % nicht-essentielle Aminosäuren, 226 μM α-Monothioglycerin | |
Tabelle 4: Die Trypsinisierung, die Zentrifugationsparameter und die Art des Mediums hängen vom Zelltyp ab.
| Modelltyp | Zelldichte [Zelle/ml] | ||
| 2D | Monolayer | Fibroblasten | 2 x 105 cm |
| Mastzellen | |||
| Keratinozyten | |||
| Melanozyten | |||
| 3D | Kugel (Hanging Drop-Methode) | Fibroblasten | 5 x 105 cm |
| Mastzellen | |||
| Keratinozyten | |||
| Melanozyten | |||
| Mischung von Zellen | |||
| Kugel (Methode zur Begrenzung der Zelladhäsion) | Fibroblasten | 2 x 105 cm | |
| Mastzellen | |||
| Keratinozyten | |||
| Melanozyten | |||
| Mischung von Zellen | |||
| Äquivalent | Fibroblasten | 1 x 105 cm | |
| Mastzellen | 1 x 104 Stück | ||
| Keratinozyten | 8 x 105 cm | ||
| Melanozyten | 5 x 104 cm | ||
Tabelle 5: Zellaussaatdichte für verschiedene Arten von Hautmodellen.
2. Vorbereitung der Hautzellkügelchen
HINWEIS: Um Kugeln zu erzeugen, wird die Verwendung der Hanging Drop-Methode in Schritt 2.1 beschrieben (Abbildung 4), während der Ansatz, der sich auf die Begrenzung der Zelladhäsion konzentriert, in Schritt 2.2 (Abbildung 5) gezeigt wird. Da Kugeln jedoch sehr klein sind und instabil sein können, erfordern Tätigkeiten, die mit diesen Methoden durchgeführt werden, Geduld, Feingefühl und langsames Handeln.
- Die Hanging-Drop-Methode
- Verwenden Sie eine geeignete Zelldichte, um die gewünschte Kugelgröße zu erreichen (empfohlene Zelldichte 5 x 105 Zellen/ml, Tabelle 5).
- Pipettieren Sie 20 μl der Zellsuspension auf den Deckel einer Petrischale oder einer Multiwell-Platte (Abbildung 4A).
- Decken Sie die Schale/den Teller mit dem unteren Teil ab und drehen Sie sie vorsichtig um (auf den Deckeln entstehen automatisch hängende Tropfen, Abbildung 4B).
- Füllen Sie die Petrischale/Vertiefungen der Platte mit einer sterilen Wasser/PBS-Lösung, um eine Verdunstung des Mediums durch Tröpfchen zu vermeiden.
- Inkubieren Sie die Tröpfchen 48-72 h bei 37 °C.
HINWEIS: Die Schwerkraft zieht die Zellen nach unten, und das Fehlen einer zugänglichen Oberfläche verhindert die Anhaftung der Zellen an das Gefäß und fördert die Zellaggregation. Einige Zelltypen können jedoch eine längere Inkubation erfordern. - Bevor Sie den nächsten Schritt durchführen, füllen Sie die Vertiefungen der neuen Platte (oder verwenden Sie die alte Platte mit entferntem Wasser/PBS aus den Vertiefungen) mit dem vollen Wachstumsmedium (100 μL).
HINWEIS: Nehmen Sie vor dem nächsten Schritt 200-μl-Spitzen, entfernen Sie 1/5 jedes Spitzenendes und sterilisieren Sie es vor der Verwendung. - Übertragen Sie die Zellkugeln in die Vertiefungen der Multi-Well-Platte, indem Sie sterile Pipettenspitzen mit einem abgeschnittenen Ende verwenden. Nehmen Sie 200 μl Spitzen, entfernen Sie 1/5 jedes Spitzenendes und sterilisieren Sie es vor Gebrauch (Abbildung 4C).
HINWEIS: Dieser Schritt kann schwierig sein, da der Flüssigkeitsfluss während des Wendens der Schüssel/Platte die Kugeln beschädigen kann. - Inkubieren Sie die übertragenen Kugeln 1 Tag lang in der Multiwell-Platte bei 37 °C, bevor Sie weitere Experimente durchführen (z. B. Zugabe von Verbindungen, Zytotoxizitätsassays, Einführung von Kugeln in Äquivalente) (Abbildung 4D).
- Die Methode zur Begrenzung der Zelladhäsion
- Decken Sie vor der Zellaussaat die Vertiefungen der U-Bodenplatte mit einer Tensidlösung ab (z. B. Pluronic F-127, Polyethylenglykol, Polyvinylalkohol)21. Bereiten Sie 100 μl 1%ige Tensidlösung in PBS vor und geben Sie sie in jede Vertiefung. Die Platte wird 24 Stunden lang bei 37 °C mit der Lösung inkubiert (Abbildung 5A-C). Lagern Sie die Platte bei Bedarf länger, aber halten Sie den Flüssigkeitsstand aufrecht, indem Sie mehr PBS-Puffer hinzufügen.
- Bereiten Sie die Zellsuspension in der gewünschten Zelldichte in 50 μl pro Vertiefung vor (empfohlene Zelldichte während der Aussaat 2 x 105/ml, Tabelle 5).
- Entfernen Sie die Tensidlösung aus den Vertiefungen, bevor Sie die Zellen aussäen, um eine Störung der Zellmembran durch die Lyse zu vermeiden (Abbildung 5D).
- Geben Sie die Zelllösung in die Platte und inkubieren Sie sie 24 Stunden lang bei 37 °C, um Zellaggregate zu erreichen (Abbildung 5E). Nach ca. 1-3 Tagen bilden sich Kugeln (Abbildung 5F) und können für weitere Experimente verwendet werden.
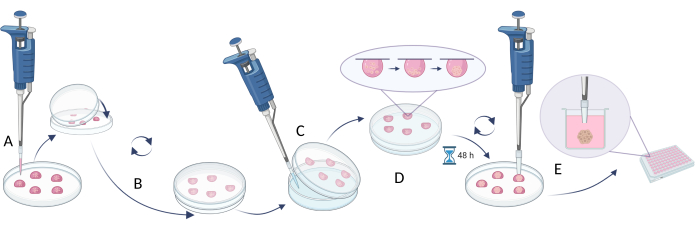
Abbildung 4: Die Methode des hängenden Tropfens. (A) Pipettieren der Zellsuspension auf dem Deckel und Abdecken des Deckels mit dem unteren Teil der Schale; (B) Drehen der Schale, um die hängenden Tropfen zu erzeugen; (C) Zugabe von Wasser/PBS in den unteren Teil der Schale (Begrenzung der Verdunstung von Flüssigkeiten); (D) Inkubation der Schalen mit hängenden Tropfen zur Bildung von Zellkugeln; (E) Sammlung von Tröpfchen mit gebildeten Kugeln und Stabilisierung der übertragenen Kugeln in Multi-Well-Platten. Die Figur ist mit Biorender.com entstanden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
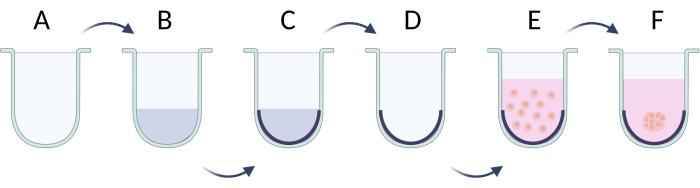
Abbildung 5: Schritt-für-Schritt-Präparation der Kugeln mit der Methode der limitierenden Zelladhäsion. (A) Vertiefung mit U-Boden; (B,C) Begrenzung der Zelladhäsion durch Tensidlösung; (D) Entfernen der Lösung aus den Bohrlöchern; (E) Aussaat von Zellen; (F) Aggregation von Zellen und Bildung einer Kugel. Die Figur ist mit Biorender.com entstanden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Herstellung von Hautäquivalenten in voller Dicke
HINWEIS: Die Entwicklung der Hautäquivalente in voller Dicke (Epidermis und Dermis) kann in drei Schritte unterteilt werden (Abbildung 6): die Vorbereitung der künstlichen Dermisschicht mit dem Vorkommen typischer Hautzellen (wie Fibroblasten und Mastzellen, Abbildung 6A), Aussaat von Zellen, die in der künstlichen Epidermis enthalten sind (hauptsächlich Keratinozyten und Melanozyten, Abbildung 6B) und vertikales Wachstum von Keratinozyten mit einem möglichen Verhornungsprozess (Bildung des Stratum corneum, Abbildung 6C). Die Herstellung von Hautäquivalenten in voller Dicke wird in Schritt 3.1 (3.1.1-3.1.10) beschrieben. Wenn ein weniger fortgeschrittenes Hautäquivalent benötigt wird (z. B. nur der Epidermistyp), kann der ausgewählte Zelltyp (z. B. Keratinozyten) direkt auf die kommerziell erhältlichen Kollagen- oder Polycarbonatmembranen ausgesät und auch mit der Möglichkeit kultiviert werden, den Keratinisierungsprozess zu induzieren (fahren Sie direkt mit den Schritten 3.1.9-3.1.10 fort).
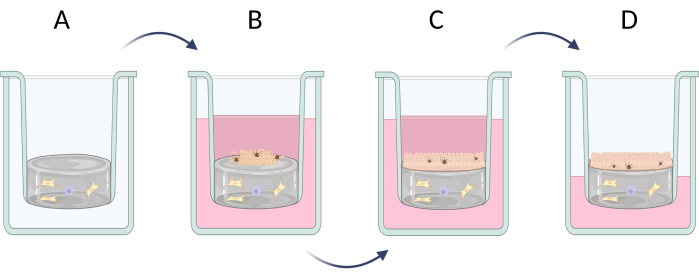
Abbildung 6: Schritt-für-Schritt-Präparation von Hautäquivalenten in voller Dicke in Inserts. (A) Vorbereitung der Pseudo-Dermisschicht mit Hautzellen, (B) Aussaat von Epidermiszellen, (C) weitere Kultivierung des Äquivalents in Medium, (D) Luft-Flüssigkeits-Grenzflächenkultur fördert die Bildung von geschichtetem Epithel. Die Figur ist mit Biorender.com entstanden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Präparation von Hautäquivalenten in voller Dicke in einer 24-Well-Platte
- Legen Sie die Röhrchen mit Wasser, PBS (10x), 1 M NaOH und Kollagenlösung Typ I auf Eis.
- Bestimmen Sie eine geeignete Anzahl von Hautzellen (z. B. Fibroblasten und Mastzellen; in einem Verhältnis von 10:1), die in das Hydrogel ausgesät werden sollen. Übertragen Sie eine angemessene Anzahl von Hautzellen in ein 1,5-ml-Röhrchen (500 μl Fibroblasten und 500 μl Mastzellen, entsprechend der Zelldichte in Tabelle 5) und zentrifugieren Sie die Zellen (300 x g, 3 min, RT).
- Entfernen Sie den Überstand und resuspendieren Sie die Zellen vorsichtig in der Mischung aus 695 μl Wasser/100 μl PBS (10x)/ 5 μl NaOH.
HINWEIS: Wenn 1 ml der Gesamtlösung nicht ausreicht, verwenden Sie Tabelle 6 , um die Volumina der einzelnen Reagenz neu zu berechnen. - Geben Sie 200 μl Kollagenlösung in die Mischung und mischen Sie sie vorsichtig durch Pipettieren.
HINWEIS: Seien Sie vorsichtig, da die Konsistenz der Mischung dicht wird. - Geben Sie 200 μl der vorbereiteten Mischung in den Einsatz in einer 24-Well-Platte. Für ein Modell ohne Stratum corneum geben Sie 500 μl in jede Vertiefung der 24-Well-Platte.
- Inkubieren Sie die Platte 10 Minuten lang bei Raumtemperatur (RT) und stellen Sie sie dann für 30 Minuten in den Inkubator.
HINWEIS: Überprüfen Sie, ob das Hydrogel polymerisiert ist, bevor Sie eine andere Aktion ausführen. - Spülen Sie das Hydrogel vor der Zellaussaat auf der Oberfläche mit einem PBS-Puffer (500 μL/Well).
- Bestimmen Sie die richtige Anzahl von Epidermiszellen (z. B. Keratinozyten und Melanozyten; im Verhältnis 15:1), die auf das Hydrogel ausgesät werden sollen. Bereiten Sie die Zellmischung in 500 μl des DMEM-Mediums zu, das mit 10 % FBS ergänzt wird, vor (fügen Sie 250 μl Keratinozyten und 250 μl Melanozyten hinzu, die Zelldichten sind in Tabelle 4 angegeben) und geben Sie es vorsichtig in die Vertiefungen.
HINWEIS: In einigen Fällen ist es besser, zuerst Melanozyten auszusäen und sie gut auf dem Hydrogel verteilen zu lassen, und nach weiteren 24 Stunden das Medium zu entfernen und Keratinozyten zu säen. In diesem Fall fügen Sie 250 μl Zellsuspension und 250 μl des Mediums hinzu. - Inkubieren Sie die Platten je nach Geschwindigkeit des Zellwachstums 2-5 Tage lang bei 37 °C, mit Medienaustausch (mit einer abnehmenden FBS-Konzentration von 10 % auf 1 %) alle 48 Stunden und Zellüberwachung am optischen Mikroskop.
- Wenn der Keratinisierungsprozess nach Erhalt einer Monoschicht von Keratinozyten auf dem Hydrogel induziert werden soll, verwenden Sie das FBS-freie Medium, das zusätzlich mit Calciumionen und L-Ascorbinsäure für weitere 2-7 Wochen ergänzt wird (in der Konzentration von 1,5 μM CaCl2 und 50 μg/ml L-Ascorbinsäure).
HINWEIS: Die Zeit der Inkubation hängt von den verwendeten Keratinozyten und ihrer Differenzierungsgeschwindigkeit ab.
| Reagenz | Die Gleichung zur Berechnung des Volumens eines Reagenzes | Beispielhafte Berechnungen | |
| (für ein Endvolumen = Vinsgesamt 1 mL) | |||
| Kollagenlösung Typ I | 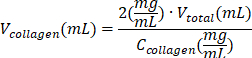 | (CKollagen = 10 mg/ml) | |
| 0,2 mL = 200 μL | |||
| PBS (10-fach) | 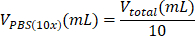 | 0,1 mL = 100 μL | |
| 1 M NaOH | 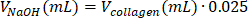 | 0,005 mL = 5 μL | |
| steril H2O | 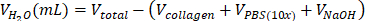 | 0,695 mL = 695 μL | |
Tabelle 6: Berechnung der für die Herstellung von Kollagen Typ I mit 2 mg/ml Kollagen Typ I erforderlichen Reagenzvolumina.
4. Identifizierung von Zelltypen in einem 3D-Hautmodell durch Zellfärbemethoden
HINWEIS: Um zu bestätigen, dass das entwickelte Hautmodell aus den erwarteten Zellen besteht, ist es gut, eine Zellfärbung durchzuführen. Es ist ein entscheidender Schritt, bevor Zielexperimente an einem bestimmten Modell durchgeführt werdenkönnen 22. Bei 3D-Hautmodellen ist es notwendig, ein bestimmtes Modell in Paraffin einzubetten und mikroskopische Objektträger mit dem auf einem Mikrotom geschnittenen künstlichen Gewebe vor der Zellfärbung herzustellen (Schritt 4.1) (Abbildung 7).
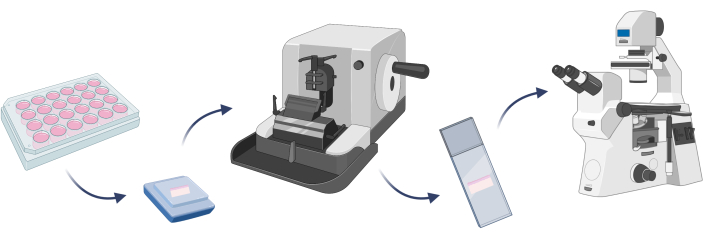
Abbildung 7: Grundlegende Schritte der Einbettung eines 3D-Hautmodells, Zellfärbung und mikroskopische Beobachtungen. Die Figur ist mit Biorender.com entstanden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Einbettung von 3D-Hautmodellen
- Waschen Sie das Hautäquivalent zweimal 5 Minuten lang bei RT mit PBS und fixieren Sie es mit einer 3,7%igen Paraformaldehydlösung in PBS (30 min, RT). Wiederholen Sie den Waschschritt mit PBS.
- Vor dem Einbetten das Hautäquivalent dehydrieren, indem Sie es in steigenden Konzentrationen von Ethanollösungen inkubieren: 50 % (15 min), 70 % (15 min), 96 % (2x, 30 min) und 99,8 % (2x, 30 min).
- Geben Sie das fixierte und dehydrierte Hautäquivalent in die mit Paraffin gefüllte Form.
HINWEIS: Platzieren Sie das Äquivalent in einer geeigneten Ausrichtung. - Decken Sie die Form mit der Kassette ab und fügen Sie mehr Paraffin hinzu. Lassen Sie es bis zu 30 min bei RT erstarren.
- Das in Paraffin eingebettete Hautäquivalent wird mindestens 1 h lang bei -80 °C eingefroren.
- Schalten Sie das Mikrotom ein, setzen Sie das in Paraffin eingebettete Hautäquivalent ein und schneiden Sie 5-μm-Scheiben. Legen Sie die geschnittenen künstlichen Gewebescheiben auf die mikroskopisch kleinen Objektträger und trocknen Sie diese mindestens 8 h bei 37 °C.
- Tauchen Sie die Objektträger in Xylol (2x, 10 min) und rehydrieren Sie die Objektträger anschließend mit den abnehmenden Ethanolkonzentrationen 99,8 % (5 min), 96 % (5 min), 70 % (5 min) und 50 % (5 min).
- Nehmen Sie die Objektträger aus der Ethanollösung und spülen Sie sie zweimal (5 min) mit Wasser ab.
HINWEIS: Die traditionelle Zellfärbung erfolgt entweder durch die Anwendung spezifischer Farbstoffe (Hämatoxylin, Eosin23) oder durch die Verwendung von Antikörpern, die selektiv auf Biomarker abzielen (einschließlich Kollagen 1A2 für Fibroblasten, Cytokeratin 14 für Keratinozyten, Melan-A oder Tyrosinase für Melanozyten24). Eine routinemäßige Hämatoxylin- und Eosinfärbung kann nach den von verschiedenen Unternehmen erstellten Protokollen (Schritt 4.2) durchgeführt werden. Ist hingegen eine Immunfluoreszenz- oder immunhistochemische Färbung erforderlich, ist das Verfahren anders und deutlich länger (Schritte 4.3 und 4.4). Um unspezifische Reaktionen zu vermeiden, verwenden Sie die Primärantikörper, die in verschiedenen Spezies hergestellt wurden, und dann die entsprechenden Sekundärantikörper.
- Hämatoxylin- und Eosin-Färbung von 3D-Hautmodellen
- Färben Sie den mikroskopischen Objektträger 3 Minuten lang bei RT in Hämatoxylinlösung.
- Waschen Sie die Objektträger 1 Minute lang in einer angesäuerten Alkohollösung.
HINWEIS: Bereiten Sie die angesäuerte Alkohollösung vor, indem Sie 2 ml 35%-38%ige Salzsäure mit 98 ml 99,8%igem Ethylalkohol mischen. - Waschen Sie den Objektträger anschließend in 0,1%iger Natriumbicarbonatlösung, um eine sichtbare, zarte blauviolette Farbe zu erhalten.
HINWEIS: Um 0,1%ige Natriumbicarbonatlösung zu erhalten, lösen Sie 100 mg Natriumbicarbonat in 100 ml Reinstwasser auf. - Waschen Sie die Objektträger 1 Minute lang mit 95% Ethanol.
- Färben Sie den mikroskopisch kleinen Objektträger 1 Minute lang bei RT in Eosinlösung.
- Waschen Sie die Objektträger 1 min lang mit 95% Ethanol und 2 min mit 99,8% Ethanol.
- Waschen Sie die Objektträger zweimal 2 Minuten lang mit Xylol.
- Setze Balsam ein und klebe ein Deckglas an den oberen Rand der Folie. Die Proben sind bereit für mikroskopische Beobachtungen.
- Immunfluoreszenzfärbung von 3D-Hautmodellen
- Spülen Sie den Objektträger mit PBS (5 min).
- Bereiten Sie die Blockierungslösung vor (3 % Rinderserumalbumin [BSA] oder fettfreie Milch in einem PBS-Puffer unter Zusatz von 0,1 % Triton X-100 und 0,1 % Tween 20) und inkubieren Sie den Objektträger darin 1 h lang bei RT.
- Waschen Sie die Objektträger zweimal mit einem PBS-Puffer (5 min).
- Der Primärantikörper wird im PBS-Puffer verdünnt (gemäß den Empfehlungen des Herstellers, Tabelle 7) und die Objektträger 1-2 h bei RT oder über Nacht bei 4 °C inkubiert.
- Waschen Sie die Objektträger zweimal mit einem PBS-Puffer (5 min).
- Verdünnen Sie den Sekundärantikörper im PBS-Puffer (gemäß den Empfehlungen des Herstellers, Tabelle 7) und inkubieren Sie die Objektträger 1 h lang bei RT.
- Waschen Sie die Objektträger zweimal mit PBS (5 min).
- Bereiten Sie die Farbstofflösung für die Zellkernfärbung vor (z. B. Hoechst 33342 oder DAPI, Tabelle 7) und inkubieren Sie die Objektträger bis zu 15 Minuten lang bei RT.
- Waschen Sie die Objektträger mit PBS (5 min).
- In Balsam einbetten, den Schnitt mit einem Deckglas abdecken und die Auswirkungen der Zellfärbung mit einem Fluoreszenzmikroskop visualisieren.
- Immunhistochemische Färbung von 3D-Hautmodellen
- Führen Sie die Schritte 4.3.1 bis 4.3.5 aus.
- Führen Sie zusätzlich einen Waschschritt mit einem Puffer durch, der für das Enzym geeignet ist, mit dem der Sekundärantikörper konjugiert ist.
- Der Sekundärantikörper wird in einem für das konjugierte Enzym geeigneten Puffer (gemäß den Empfehlungen des Herstellers) verdünnt und die Objektträger 1 h lang bei RT inkubiert.
- Waschen Sie die Objektträger zweimal mit PBS (5 min).
- Bereiten Sie die Lösung eines geeigneten Substrats für das verwendete Enzym vor und inkubieren Sie die Objektträger gemäß den Empfehlungen des Herstellers.
- Waschen Sie die Objektträger mit einem Puffer (5 min) und montieren Sie sie in Balsam.
- Visualisieren Sie die Auswirkungen der Zellfärbung mit Hilfe der Hellfeldmikroskopie.
| Zelltyp/Zellorganoid nachgewiesen | Färbemittel | Verdünnung / Konzentration | ||
| Mastzellen | Avidin-Sulforhodamin 101 | 1 μg/ml | ||
| Fibroblasten | Col1A2-Antikörper, der in Kaninchen hergestellt wird | 1:50 | ||
| Ziegen-Anti-Kaninchen-Sekundärantikörper, konjugiert mit FITC | 1:250 | |||
| Keratinozyten | Cytokeratin-14-Antikörper, der in der Maus hergestellt wird | 1:50 | ||
| Ziegen-Anti-Maus-Sekundärantikörper, konjugiert mit FITC | 1:250 | |||
| Melanozyten | Melan-A-Antikörper, der in der Maus hergestellt wird | 1:50 | ||
| Ziegen-Anti-Maus-Sekundärantikörper, konjugiert mit FITC | 1:250 | |||
| Kerne | Hoechst 33342 | 1 μg/ml | ||
| DAPI | 1 μg/ml | |||
Tabelle 7: Konzentrationen und Verdünnungen der für die Zellfärbung verwendeten Reagenzien.
Ergebnisse
Bevor mit der Erstellung von Hautmodellen im Labor begonnen wird, muss eine Entscheidung über die Art der zu verwendenden Zellen (Primär-/Zelllinie) und die Auswahl eines geeigneten Mediums für diese Zellen getroffen werden. Die meisten Zellbanken empfehlen und können Medien für alle Arten von Zellkulturen bereitstellen. Bei einem Multikulturmodell ist es notwendig, ein Medium auszuwählen, das für alle in der Kultur vorhandenen Zelltypen geeignet ist. Einige typische Zellmedien, die sowohl für die primäre Hautzellkultur als auch für die gängigsten Hautzelllinien verwendet werden, wurden in Tabelle 8 18,19,20,25,26,27 zusammengestellt. Typische Medien, die für die primären Zellkulturen verwendet werden, sind ziemlich teuer und ihre Zusammensetzung ist komplex. Auf der anderen Seite begnügen sich Zelllinien in der Regel mit Medien mit einfacher Zusammensetzung. Einige Zelltypen (hauptsächlich Fibroblasten und Mastzellen) können Faktoren produzieren und sezernieren, die das Wachstum anderer Zellen stimulieren (z. B. Keratinozyten und Melanozyten)28,29. Ist deren Präsenz in einem Modell geplant, ist eine zusätzliche Ergänzung des Mediums nicht notwendig.
| Zellentyp | Name der Zelle | Mittel | Referenz | ||||
| Keratinozyten | HaCaT-Cel-Linie | DMEM, 10 % FBS, 100 μg/ml Penicillin, 100 μg/ml Streptomycin | Nach Angaben des Verkäufers | ||||
| primäre normale humane epidermale Keratinozyten (NHEK) | Keratinozyten-Wachstumsmedium 2 (Basalmedium + Ergänzungsmischung) | Nach Angaben des Verkäufers | |||||
| primäre humane epidermale Keratinozyten; Normal, Erwachsene (HEKa) | Basalmedium für dermale Zellen, 0,4 % Rinder-Hypophysenextrakt, 0,5 ng/ml rh-transformierender Wachstumsfaktor-alpha, 6 mM L-Glutamin, 100 ng/ml Hydrocortison, Hemisuccinat, 5 mg/ml rh-Insulin, 1 mM Adrenalin, 5 mg/ml Apo-Transferrin, 100 μg/ml Penicillin (falls erforderlich), 100 μg/ml Streptomycin (falls erforderlich) | Nach Angaben des Verkäufers | |||||
| Primäre Keratinozyten | DMEM/F-12 (3:1), 1 % Ultroser G, 1 μM Hydrocortison, 1 μM Isoproterenol, 0,1 μM Insulin, 1 ng/ml Keratinozyten-Wachstumsfaktor, 1 % Penicillin-Streptomycin | 18 | |||||
| Melanozyten | Primäre Melanozyten | Medium 254, PMA-freies humanes Melanozyten-Wachstumsergänzungsmittel - 2, 1% ige Antibiotikalösung | 19 | ||||
| Primäre Melanozyten | RPMI-1640, 10 % FBS, 14,7 μg/ml Phenolrotlösung, 1 % L-Glutamin, 1 % Penicillin/Streptomycin | 27 | |||||
| HEMa-LP-Zelllinie | Medium 254, 5 μg/mL RH-Insulin, 50 μg/mL Ascorbinsäure, 6 mM L-Glutamin, 1 μM Adrenalin, 1,5 mM Calciumchlorid, 100 U/mL Penicillin (falls erforderlich), 100 μg/ml Streptomycin (falls erforderlich) | Nach Angaben des Verkäufers | |||||
| primäre normale humane epidermale Melanozyten (NHEM) | Melanozyten-Wachstumsmedium (Basalmedium + Ergänzungsmischung) | Nach Angaben des Verkäufers | |||||
| Fibroblasten | primäre humane Tenon-Fibroblasten (HTFs) | EMEM, 5 % FBS, 5 ng/mL rh-basischer Fibroblasten-Wachstumsfaktor, 5 μg/mL rh-Insulin, 50 μg/mL Ascorbinsäure, 7 mM L-Glutamin, 100 U/mL Penicillin, 100 μg/mL Streptomycin, 0,25 μg/mL Amphotericin B | 28 | ||||
| primäre HTFs und | DMEM, 10 % FBS, 100 μg/ml Penicillin, 100 μg/ml Streptomycin, 0,25 μg/ml Amphotericin B | 20.28 | |||||
| primäre humane dermale Fibroblasten | |||||||
| HFF-1 Zelllinie | DMEM, 15 % FBS, 100 μg/ml Penicillin, 100 μg/ml Streptomycin | Nach Angaben des Verkäufers | |||||
| BJ-Zelllinie | EMEM, 10 % FBS, 100 μg/ml Penicillin, 100 μg/ml Streptomycin | Nach Angaben des Verkäufers | |||||
| Mastzellen | primäre humane Hautmastzellen (hsMCs) | IMDM, 10 % FBS, 1 % nicht-essentielle Aminosäuren, 226 μM α-Monothioglycerin, 100 U/ml Penicillin, 100 μg/ml Streptomycin | 20 | ||||
| LAD2-Zelllinie | StemPro-34, 2,5 % StemPro-34 Nahrungsergänzungsmittel, 2 mM L-Glutamin, 100 ng/mL rh-Stammzellfaktor, 100 U/mL Penicillin, 100 μg/mL Streptomycin | 29 | |||||
| HMC-1.1 und 1.2 Zelllinien | IMDM, 10 % FBS, 2 mM L-Glutamin, 25 mM HEPES, 100 U/mL Penicillin, 100 μg/mL Streptomycin | 29 | |||||
Tabelle 8: Ein Überblick über die am häufigsten verwendeten Medien für die Kultivierung von primären Hautzellen und Zelllinien.
Legende: Dulbecco's Minimum Essential Medium (DMEM), Eagle's Minimum Essential Medium (EMEM), Fötales Rinderserum (FBS), Nährstoffmischung Ham's F-12 (F12), Iscove's Modifiziertes Dulbecco's Medium (IMDM), rekombinanter Mensch (RH), Roswell Park Memorial Institute (RPMI).
In diesem Artikel wurden Hautmodelle mit den Primärzellen von Keratinozyten, Melanozyten, Fibroblasten und Mastzellen erstellt. Sie sind etwas anspruchsvoller als die Zelllinien, und die empfohlenen Medien für ihre Kultur, die für Einzelzellkulturen verwendet wurden, sind: supplementiertes Keratinozyten-Wachstumsmedium 2 (für Keratinozyten), supplementiertes Medium 254 (für Melanozyten), supplementiertes DMEM-Medium (für Fibroblasten) und supplementiertes IMDM-Medium (für Mastzellen). Auf diesen Medien präsentieren die Zellen ihre typische Morphologie, die ihrem Typ zugeordnet ist (repräsentative Bilder sind in Abbildung 8 dargestellt). Bei Multikulturen mit zwei oder mehr Zelltypen war es wichtig, ein Medium zu wählen, in dem alle kultivierten Zelltypen wachsen können. Nach einigen Tests wurde ein DMEM-Medium mit 10 % FBS und einer 1 % Antibiotikamischung ausgewählt, um die fortschrittlicheren 3D-Modelle von Kugeln und Äquivalenten zu erstellen.
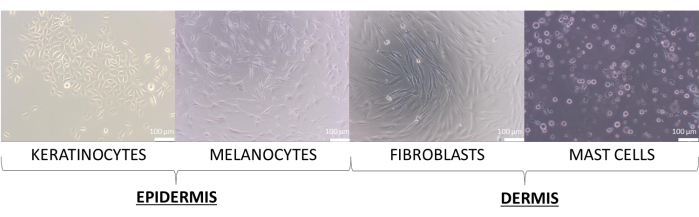
Abbildung 8: Hautzellen weisen eine unterschiedliche Morphologie auf, die während der 2D-Monokultur beobachtet wurde. Maßstabsbalken: 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Kugeln (allgemein als Sphäroide bezeichnet) sind eines der einfachsten 3D-Modelle, die von Zell- und Tissue-Engineering-Forschern entwickelt wurden, obwohl Kugeln, die aus Hautzellen hergestellt werden, nicht so beliebt sind. Innerhalb dieses Modells ist die Schaffung sowohl von Mono- als auch von Multikulturen von Sphären möglich. In der Literatur wurden mehrere Verfahren zur Herstellung von Kugeln (z. B. mit einem hängenden Tropfen, Begrenzung der Zelladhäsion, Magnetschwebe, Rotation, Mikrofluidik usw.) beschrieben30. Aufgrund der einfachen Vorbereitung, der geringen Kosten, der leicht verfügbaren Materialien und Geräte werden die ersten beiden Methoden für Anfänger in dreidimensionale (3D) Zellmodelle empfohlen und Protokolle für ihre Leistung finden Sie oben (Schritt 2.1 und 2.2). Laut Literatur31,32 sind die wichtigsten Parameter bei diesen Methoden die Zellzahl, das Volumen der Zellsuspension und die Inkubationszeit.
Kugeln können mit unterschiedlich vielen Zellen erzeugt werden, aber die Zelldichte für die Aussaat sollte für jeden Zelltyp separat sowie für Zellcokulturen optimiert werden. Der durchgeführte Optimierungsprozess für Monokulturen von Keratinozyten und Fibroblasten zeigte, dass die Aussaat von 1 x 104 Zellen pro Well die besten Ergebnisse für beide Zelltypen lieferte. Die in Abbildung 9 dargestellten Kugeln wurden unter Verwendung der Methode zur Begrenzung der Zelladhäsion in den U-Bodenplatten (Schritt 2.2) hergestellt. Es wird empfohlen, mindestens 4 Vertiefungen mit technischen Wiederholungen vorzubereiten (optimal sind 6 Vertiefungen). Kugeln, die aus 1 x 104 Zellen bestanden, waren leichter zu manipulieren, da sie in den Vertiefungen sichtbar waren. Dadurch war es sogar möglich, das Altmedium während des Assays aus den Vertiefungen zu entfernen, ohne die Kugeln zu entleeren. Nach den beschriebenen Operationen waren die Formen der Kugeln weitgehend unverändert und wiederholbar. Die Stabilität größerer Kugeln war während des Prozesses gering. Erwähnenswert ist auch, dass verschiedene Zelltypen unterschiedlich farbige Kugeln bilden können (z.B. bilden Keratinozyten dunklere Kugeln, während Fibroblastenkugeln deutlich heller sind).
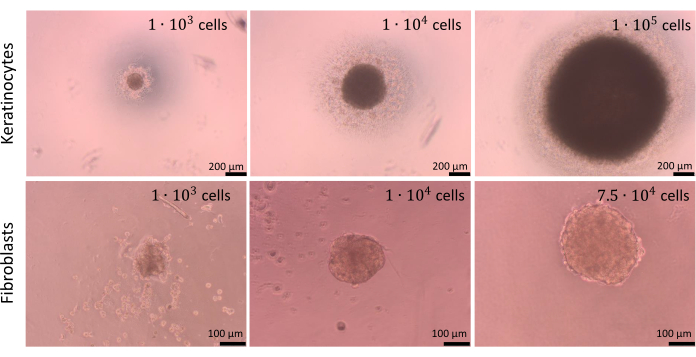
Abbildung 9: Erzeugung von Kugeln. Kugeln, die von verschiedenen Arten und einer unterschiedlichen Anzahl von Hautzellen unter Verwendung der Methode der begrenzenden Zelladhäsion erzeugt werden. Maßstabsleisten (Oberplatte): 200 μm. Maßstabsstäbe (unteres Bild): 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Wie bei der Methode des hängenden Tropfens (Schritt 2.1) erwähnt, müssen die Kugeln ab einem bestimmten Punkt vom Deckel in die Vertiefung übertragen werden. Dieser Prozess kann für die Kugeln potenziell schädlich sein. Für diesen Schritt ist daher eine hohe Arbeitsgenauigkeit unerlässlich. Die erzeugten Kugeln neigen dazu, ihre richtige Form zu verlieren, wenn sie nicht sorgfältig behandelt werden (Abbildung 10). Das erste Bild (Abbildung 10A) zeigt eine gute Kugel, die an allen Seiten gleichmäßig abgerundet ist. Im zweiten und dritten Bild (Abbildung 10B,C) wurde ein leichter Formverlust der Kugel beobachtet, aber das Zellaggregat bleibt rund. Die letzten drei Bilder (Abbildung 10D-F) zeigen unterschiedliche Phasen der Kugelschädigung. Das Sammeln von Erfahrung ist erforderlich, um die Wiederholbarkeit der erstellten Kugelformen und -strukturen zu erreichen. Bei den ersten Versuchen, die Kugeln zu entwickeln, wird empfohlen, die Methode zur Begrenzung der Zelladhäsion für unerfahrene Forscher (Schritt 2.2) zu verwenden, da sie mit dem begrenzten Einfluss der Aktivität des Forschers vergleichbarere Ergebnisse liefert.
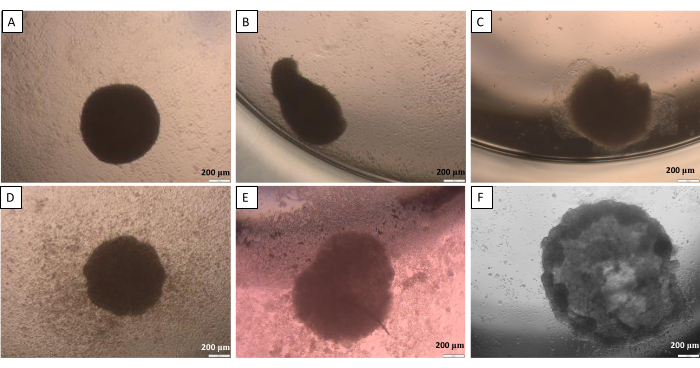
Abbildung 10: Mögliche Schwierigkeiten beim Transfer der Kugel vom Deckel in die Vertiefung - die Methode des hängenden Tropfens. (A) eine gute Kugel, (B,C) leicht beschädigte Kugeln, (D-F) stark beschädigte Kugeln. Die Bilder wurden 24 Stunden nach der Übergabe aufgenommen. Maßstabsleisten: 200 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Äquivalente sind weitaus fortschrittlichere 3D-Modelle von künstlicher Haut als Kugeln. Bei der Erstellung eines Hautmodells sollten verschiedene Aspekte berücksichtigt werden, darunter die Anzahl der Schichten im Modell (nur Epidermis, nur Dermis, Dermis mit Epidermis und Stratum corneum), verwendete Zelltypen, verwendete Materialien, bevorzugte Größe des Äquivalents, Art der Forschung, in der es weiter verwendet wird, usw.14. Die Hautäquivalente können in speziellen Einsätzen angeordnet werden, die in den Standard-Multiwell-Platten der gewünschten Größe (96-, 48-, 24-Wells usw.) platziert werden. Auch wenn die Einsätze leichter von einer Vertiefung in eine andere übertragen werden können und während des Medienwechsels, kann das Äquivalent nicht beschädigt werden. Sie sind ziemlich teuer. Wenn das Modell das Vorhandensein des Stratum corneum nicht erfordert, besteht eine billigere Lösung darin, das Äquivalent in einer Vertiefung der Multi-Well-Platte vorzubereiten.
Die künstliche Dermisschicht ist typischerweise als Gerüstmodell aufgebaut, indem natürliche (Gelatine, Kollagen, Fibrin, Hyaluronsäure, Chitosan-Alginat usw.) oder synthetische (Polyethylenglykoldiacrylat und Polymilchsäure) Hydrogele33 verwendet werden. Um der echten Hautdermis ähnlich zu sein, muss diese Schicht hauptsächlich Wasser mit einigen Komponenten der extrazellulären Matrix (EZM) (einschließlich Kollagen oder Fibronektin) enthalten, die die Zellbindung, Zell-Zell-Interaktionen und andere Zellaktionen vermitteln34. In dieser Forschung wurde Kollagen vom Typ I ausgewählt, da es in Form von Hydrogel leicht herzustellen ist und seine flexible Struktur die Erleichterung weiterer potenzieller Forschungsaktivitäten (z. B. Transfer des Äquivalents von einer Schale in eine andere) gewährleistet. Die aus dem Rattenschwanz gewonnene Lösung von Kollagen Typ I wird normalerweise durch Pulverauflösung in 20 mM Essigsäure hergestellt. Um den Schritt der Kollagenpolymerisation zu erreichen, ist es notwendig, geeignete pH-Bedingungen im Bereich von 6,5 bis 7,5 bereitzustellen. Dies kann durch die Zugabe einer strengen Menge an Natriumhydroxid sichergestellt werden. Zur Vereinfachung haben einige Unternehmen spezifische Berechnungen eingeführt, die helfen können, die genauen Mengen zu bestimmen, die für die Herstellung solcher Hydrogele erforderlich sind (Tabelle 6). Obwohl in der Literatur unterschiedliche Konzentrationen von Kollagen in den Hydrogelen anzutreffen sind (z. B. 0,5-2 mg/ml35; 5-30 mg/ml36; niedriger und hoher Kollagengehalt37), wurde in dem beschriebenen Modell die 2 mg/ml-Lösung verwendet, da das Hydrogel noch eine flexible Struktur hatte, aber kompakt genug war, um bei Bedarf aus der Vertiefung herausgenommen zu werden.
Um eine recht realistische Haut in voller Dicke zu erhalten, sollten äquivalente Zellen in dem Verhältnis ausgesät werden, das möglicherweise so nahe kommt wie das, was in unserem Körper vorhanden ist. Im Falle der Epidermis beträgt die Beziehung zwischen einem Melanozyten und einem Pool assoziierter Keratinozyten je nach Körperstelle ein Verhältnis von etwa 1:36, das als epidermale Melanineinheit (EMU) definiert ist38. Somit betrug das angewandte Verhältnis in der künstlichen Epidermis 1 Melanozyten zu 15 Keratinozyten (Tabelle 5). Um eine künstliche Dermisschicht zu erzeugen, wurde das Kollagen-Typ-1-Hydrogel verwendet, in das Fibroblasten und Mastzellen im Verhältnis von 1 Mastzelle zu 10 Fibroblasten eingebaut wurden. Jede Schicht des konstruierten Äquivalents kann in Echtzeit auf dem inversen optischen Mikroskop überwacht werden, indem die Tiefe der beobachteten Probe geändert wird (beispielhafte Bilder sind in Abbildung 11 dargestellt).
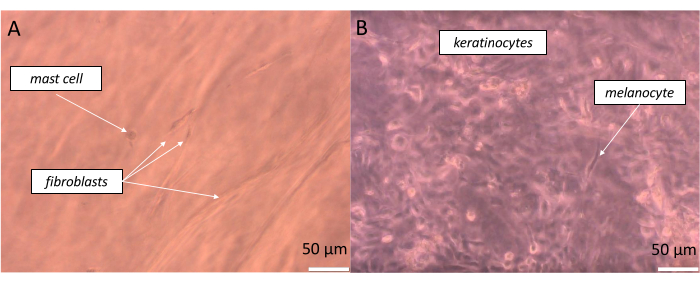
Abbildung 11: Echtzeit-Beobachtung verschiedener Zellen in bestimmten Schichten des erstellten Hautäquivalents (A) Pseudo-Dermis und (B) Pseudo-Epidermis), wie es durch die Hellfeldmikroskopie sichtbar gemacht wurde. Maßstabsstäbe: 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Genauere Beobachtungen mit der Bestätigung, dass die beabsichtigte Struktur des Modells erhalten wird, können durch die Färbung des Äquivalents durchgeführt werden. Das fixierte Äquivalent muss zuerst in Paraffin eingebettet und anschließend auf einem Mikrotom geschnitten werden. Die Objektträger mit dünnem künstlichem Gewebe können später mit verschiedenen Farbstoffen gefärbt werden, darunter Hämatoxylin und Eosin (Basisfärbung, die in medizinischen Laboratorien durchgeführt wird). Dank dieser Aktion ist es möglich, die künstliche Dermis und Epidermis in Äquivalenten zu unterscheiden und einzelne Hautzellen zu identifizieren (Abbildung 12). In Abbildung 12 sind nicht nur die spezifischen Zelltypen dargestellt, sondern es ist auch möglich, die Keratinozyten in verschiedenen Phasen des Zellteilungsprozesses (Telophase und Metaphase) zu sehen. Bei Mastzellen sind bestimmte Granulate im Inneren der Zelle gut zu erkennen. Diese Bilder bestätigen zunächst, dass das erstellte Hautäquivalent lebendig ist (die Zellen wachsen darin) und dass sie in dem entwickelten Modell normal funktionieren können. Bei der 3D-Epidermis und den Modellen der Haut in voller Dicke ist es jedoch besonders wichtig, die Qualität und Funktionalität des erhaltenen Konstrukts zu überprüfen. Um die Durchlässigkeit des Stratum corneum zu überprüfen, sollten die Messungen des transepithelialen elektrischen Widerstands (TEER) oder die Luzifer-Gelb-Färbung angewendet werden39,40. Darüber hinaus sollten in einer richtig zusammengesetzten künstlichen Haut spezifische Marker vorhanden sein, darunter Differenzierungsmarker (z. B. Filaggrin, Involucrin, Loricrin, Keratin 10, Keratin 5, Lipidklassen, die Ceramide umfassen), Marker für den dermal-epidermalen Übergang (z. B. Kollagen Typ IV, Laminin V, Alpha6Beta4-Integrin, BP-Antigen)41, Tight-Junction-Marker in den Epidermisschichten (z. B. Claudin-1, Occludin, Zonula occludens Protein (ZO)-1)42 sowie Marker für die Basalschichtproliferation (Ki67)41.

Abbildung 12: Morphologie und Funktion der Hautzellen. Überblick über die Morphologie und Funktion der Hautzellen (Beobachtung von Zellteilungen) im mit Hämatoxylin und Eosin gefärbten Hautäquivalent in voller Dicke. Maßstabsleisten: 100 μm (obere Platte), 50 μm (mittlere Platte, links), 100 μm (mittlere Platte, rechts), 50 μm (untere Platte). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die am häufigsten verwendete Methode zur Bestätigung des Vorhandenseins eines Biomarkers ist die Durchführung einer spezifischen Färbung, wie z. B. immunhistochemisch oder immunfluoreszierend. Verschiedene Antikörper und Fluoreszenzfarbstoffe können zur mikroskopischen Visualisierung bestimmter Zellen in den Modellen eingesetzt werden. Das Ergebnis der beispielhaften Färbung von Zellen in Kultur ist in Abbildung 13 zu sehen. Zur Beobachtung von Keratinozyten wurde ein Antikörper gegen Cytokeratin 14 verwendet. Im Fall der Melanozyten handelte es sich um Melan-A-spezifische Antikörper. Der Kollagen-1A2-Antikörper wurde verwendet, um Fibroblasten zu färben, und das fluoreszierende Sulforhodamin 101, das mit Avidin konjugiert ist, wies Heparin in Mastzellen nach.
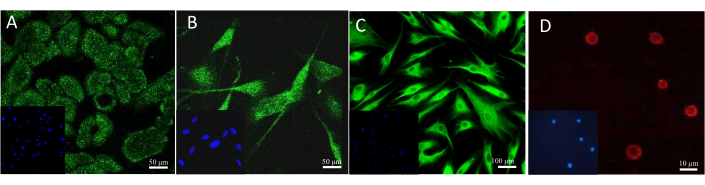
Abbildung 13: Ergebnisse der Fluoreszenzzellfärbung. (A) Cytokeratin 14 in Keratinozyten. Maßstab: 50 μm. (B) Melan-A in Melanozyten. Maßstab: 50 μm. (C) Kollagen 1A2 in Fibroblasten. Maßstab: 100 μm. (D) Heparin in Mastzellen. Maßstab: 10 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In diesem Artikel wird die Methodik vorgestellt, die angewendet werden kann, um eigene fortschrittliche künstliche Hautmodelle herzustellen. Es ist eine gute Lösung, wenn die geplante Forschung streng definierte Forschungsmodelle erfordert, die sich als nicht auf dem Markt verfügbar oder sehr teuer herausstellen können. Wie bereits erwähnt, sind mehrere kommerzielle Hautäquivalente auf dem Markt erhältlich (z. B. EpiSkin, EpiDerm FT). Die Kosten (100 bis 400 Euro pro Stück) und die Lieferzeit (einige Tage bis Wochen) können den Forscher jedoch dazu veranlassen, zu versuchen, ein solches Modell selbst zu erstellen. Die vorgeschlagenen Verfahren sind auch für unerfahrene Wissenschaftler einfach durchzuführen und ermöglichen es gleichzeitig, sehr fortschrittliche Hautmodelle zu erhalten. Es ist erwähnenswert, dass die Entscheidung über die zelluläre Zusammensetzung eines bestimmten Modells vollständig vom Forscher abhängt. Neben dem erstellten Modell kann es weiterentwickelt und verbessert werden, was völlig neue Forschungsperspektiven eröffnet. Bei kommerziellen Modellen ist es notwendig, ein anderes Äquivalent zu kaufen.
Obwohl die 3D-Zellkulturen mit mehreren Zelltypen weiterentwickelt werden können, die einfach zu handhaben und zugänglich sind, handelt es sich immer noch nur um künstliche Modelle, die die Komplexität und Funktionalität des Gewebes (z. B. immunologische Funktionen, Vaskularisation) nicht vollständig nachbilden können. Aus diesem Grund sind in den meisten Studien mehrere Modelle erforderlich, um die erzielten Ergebnisse zu bestätigen. Einige Vor- und Nachteile dieser Modelle sowie ihre Grenzen sind in Tabelle 9 zusammengefasst. Auf der anderen Seite garantieren kommerzielle Modelle hohe qualitative Standards mit Reproduzierbarkeit der Experimente und Vergleichbarkeit der Daten zwischen den Laboren. Um die Verwendung eines neuen Wirkstoffs für die Forschung zu realisieren, wird es sicherlich notwendig sein, das entsprechende kommerzielle Äquivalent zu erwerben. In der Vorbereitungsphase kann ein solches selbst erstelltes 3D-Modell der Haut (Kugel vom Typ Multicell oder Äquivalent) jedoch dazu beitragen, die Anzahl der Experimente zu reduzieren, die mit einem kommerziellen Äquivalent durchgeführt werden müssen. Ziel der Erstellung und Nutzung der beschriebenen Modelle ist es nicht, die Notwendigkeit der Anwendung zertifizierter Forschungsmodelle zu umgehen, sondern die Forschung zu erleichtern und die damit verbundenen Kosten zu reduzieren.
| Verglichenes Modellpaar | Vorteile | Benachteiligungen | ||||
| Zellkultur vs. Tiere | Minimiertes Leid der Tiere | Begrenzte Informationen über den Einfluss eines getesteten Faktors auf den gesamten Körper | ||||
| Hohe Standardisierung von Experimenten - bessere Reproduzierbarkeit der Ergebnisse | Ein einzelnes Modell reicht nicht aus, um die im Körper ablaufenden Prozesse abzubilden | |||||
| Keine Nebenwirkungen für den gesamten Organismus | - | |||||
| Bessere Kontrolle über die Bedingungen des Experiments | - | |||||
| Möglichkeit der Automatisierung (z.B. Bioprinting) | - | |||||
| Niedrigere Kosten | - | |||||
| Die geringe Größe der benötigten Probe | - | |||||
| Begrenztes Abfallaufkommen | - | |||||
| 3D- vs. 2D-Kulturen | Den gesamten Organismus besser widerspiegeln | Zeitaufwändige Kultur | ||||
| Möglichkeit, ein funktionelles Gewebe zu erstellen | Höhere Kosten | |||||
| Möglichkeit, ein Modell zu erstellen, das auf die Bedürfnisse der durchgeführten Forschung zugeschnitten ist | Eine spontane Bildung einer 3D-Struktur ist nahezu nicht möglich | |||||
| - | Mangel an standardisierten Tests zur Quantifizierung der Wirkungen verschiedener Verbindungen | |||||
| - | Eingeschränkter Zugang zu verschiedenen auf dem Markt erhältlichen 3D-Kulturen | |||||
| Zelllinie vs. Primärzellen | Zertifizierte und zugelassene Modelle | Es steht nur eine begrenzte Anzahl von Zelllinien zur Verfügung | ||||
| Hohe Standardisierung von Experimenten - bessere Reproduzierbarkeit der Ergebnisse | Begrenzte Möglichkeit, mehrere Zelltypen von ein und demselben Spender zu gewinnen | |||||
| Längere Lebensdauer | Kann veränderte Eigenschaften von den nativen Zellen besitzen | |||||
| Ziemlich schnelle Proliferationsrate | Häufig gestörte Funktionalität von Zellen | |||||
| Weniger empfindlich gegenüber verschiedenen Aktivitäten (z. B. Einfrieren, Zentrifugieren) | - | |||||
Tabelle 9: Vergleich der Nutzung verschiedener Modelle in der Forschung - Vor- und Nachteile
Mehrere Artikel beschreiben, wie 3D-Hautmodelle vorbereitet werden (abgesehen von Übersichtsartikeln, die kommerziell erhältliche Modelle14, 43, 44 zusammenfassen, konzentrieren sie sich in der Regel auf eine einzige Methode zur Erlangung von Kugeln45 oder Äquivalenten46).
In diesem Artikel wurden zwei Methoden für die Kugelbildung mit Hautzellen beschrieben. Die Hanging Drop-Methode ist weit verbreitet, aber ihre Wiederholbarkeit und Stabilität kann in einigen Fällen unzureichend sein. Die meisten Schritte erfordern spezielle Aktionen, wie z. B. Arbeiten mit hoher Geschwindigkeit aufgrund der Verdunstung von Wasser aus Tröpfchen während des Transfers. Sanfte Bewegungen werden ebenfalls empfohlen, da das Fehlen einer solchen Fähigkeit zu einer Schädigung des Zellaggregats führen kann31,32. Eine einfachere Methode zur Kugelpräparation konzentriert sich daher auf die Begrenzung der Zelladhäsion. Das Fehlen einer guten Oberfläche für die Zellanheftung begünstigt höhere Wechselwirkungen zwischen den Zellen. In der Folge werden Zellaggregate erzeugt. Die Wiederholgenauigkeit ist viel höher, da keine Kugelübertragung erforderlich ist. Mit diesen Methoden wurde die optimale Anzahl von Hautzellen zur Bildung einer Kugel auf 1 x 104 Zellen/Kugel festgelegt.
Anschließend wurden Verfahren zur Aufbereitung von Hautäquivalenten gezeigt. Ihr Aussehen und ihre Funktionalität in der Forschung können stark von den Elementen abhängen, aus denen sie aufgebaut sind, einschließlich Zellen (Tabelle 2), Gerüste und Medien. Die 3D-Gerüste, die für die Vorbereitung der künstlichen Haut verwendet werden, können in synthetische Hydrogele und solche aus natürlichen Quellen unterteilt werden. Abhängig von dem verwendeten Material und seinen Eigenschaften zur Zusammensetzung des Hydrogels kann die Notwendigkeit auftreten, das Medium zusätzlich zu ergänzen. Synthetische Hydrogele erfordern den Einbau bioaktiver Moleküle (Proteine, Enzyme und Wachstumsfaktoren) in das synthetische Hydrogel-Netzwerk, um spezifische Zellfunktionen zu vermitteln47. Zu den wichtigsten Ansätzen, die in der Literatur vorgestellt werden, um eine kontrollierte Abgabe von Wachstumsfaktoren an Hydrogele zu erreichen, gehören die direkte Beladung, die elektrostatische Wechselwirkung, die kovalente Bindung und die Verwendung von Ladungsträgern48. Hydrogele, die aus natürlichen Quellen wie ECM-Proteinen und Polymeren gebildet werden, können Flüssigkeitswege im gesamten 3D-Gerüst erzeugen und so die Verteilung von Nährstoffen beschleunigen. Somit ist keine zusätzliche Supplementierung des Mediums erforderlich. Untersuchungen haben gezeigt, dass kleine Moleküle (wie Zytokine und Wachstumsfaktoren) und Makromoleküle (einschließlich Glykosaminoglykane und Proteoglykane) durch Diffusion durch die EZM transportiert werden können47. Die molekulare Diffusion von Sauerstoff, Nährstoffen und anderen bioaktiven Molekülen kann jedoch durch die Eigenschaften des EZM-Hydrogels selbst behindert werden. Eine geringere Diffusion korrelierte mit der höheren Dicke des Hydrogels, aber auch mit einer sehr hohen Konzentration an Kollagen37. In dieser Studie wurde zur Herstellung des Hautäquivalents eine niedrige Kollagenkonzentration von 2 mg/ml verwendet, was darauf hindeutet, dass die molekulare Diffusion durch das Hydrogel gut und schnell sein sollte. Somit wurde weder dem Medium noch dem Hydrogel selbst eine zusätzliche Supplementierung zugeführt. Um die Dermis nachzuahmen, wurden Mastzellen und Fibroblasten (1:10) in das Kollagen-Hydrogel eingebettet. Als nächstes wurden Melanozyten und Keratinozyten (1:15) auf das Hydrogel ausgesät und das gesamte Äquivalent in dem Medium kultiviert. Es ist erwähnenswert, dass das Basismedium aus mehreren Aminosäuren, anorganischen Säuren und Vitaminen besteht und zusätzlich mit Serum ergänzt wird (bestehend aus mehreren: Wachstums- und Bindungsfaktoren für Zellen, Lipide, Hormone, Nährstoffe und Energiequellen, Träger, Bindungs- und Transferproteine usw.). Um die richtige Struktur der Epidermis zu erreichen, sollten zu einem bestimmten Zeitpunkt verschiedene Zusätze zum Medium hinzugefügt werden. Der wichtigste Stimulator zur Initiierung der epidermalen Differenzierung ist Kalzium, da es die intrazelluläre Signalübertragung aktiviert. Ascorbinsäure stimuliert einen ähnlichen Signalweg wie der durch Calcium vermittelte, aber ihre Wirkung geht auch mit einem verstärkten Ascorbattransport und der Verhinderung eines hydrophilen Abbaus von Antioxidantieneinher 41. Darüber hinaus wurde die Differenzierung der Zellen verbessert, wenn dem Medium andere Komponenten zugesetzt wurden (wie Koffein, Hydrocortison, Trijodthyronin, Adenin und Choleratoxin)41,44. Es ist wichtig, dass die vorbereiteten Modelle immer auf das Vorhandensein eines bestimmten Zelltyps in der entsprechenden Schicht überprüft werden. Das Vorhandensein aller vier Arten von Hautzellen wurde in der Struktur des hergestellten Äquivalents durch H&E-Färbung bestätigt.
Das häufigste Problem ist die Feinfühligkeit und Intuition bei der Handhabung der erhaltenen Modelle. Einige Schwierigkeiten können sowohl mit der Zellkugelbildung als auch mit der Hydrogelzubereitung verbunden sein. Während der Zellkultur können auch mehrere andere Probleme auftreten; Dazu gehören mikrobielle Infektionen, eine geringe Proliferationsrate von Zellen, die Alterung der in den Modellen verwendeten Primärzellen, die maximale Kultivierungszeit von 2D- und 3D-Modellen, die aus Primärzellen im Vergleich zu Zelllinien rekonstruiert wurden, usw. In Tabelle 10 wurden einige praktische Ratschläge zusammengestellt, was zu tun ist, wenn eines der folgenden Probleme auftritt.
| Häufige Probleme in der Zellkultur | Anregungen | |||
| Mikrobielle Infektion | Tritt eine mikrobielle Infektion in einem der Kolben/Schalen mit Zellen auf, ist es besser, die infizierte Kultur so schnell wie möglich zu entfernen (die restlichen Kolben/Schalen nicht mit Zellen zu kontaminieren). Frieren Sie ein neues Fläschchen mit Zellen wieder ein. Wenn die Infektion zurückkehrt, ist es gut, zu versuchen, die Spektren der angewendeten Antibiotika zu erweitern und ihre Konzentration zu erhöhen. | |||
| Geringe Proliferationsrate der Zellen | Einige Zellen haben eine lange Verdopplungszeit. Um deren Proliferation zu stimulieren, können dem Basismedium mehrere zellspezifische Wachstumsfaktoren zugesetzt werden. Auch eine Erhöhung der Konzentration von FBS oder L-Glutamin im Basalmedium kann dazu beitragen, das Wachstum der Zellen zu stimulieren. | |||
| Alterung der in den Modellen verwendeten Primärzellen | Nach einigen Passagen gehen die Primärzellen in die Seneszenz über und hören auf, sich zu teilen. Um dieses Problem in den Modellen zu lösen, empfiehlt es sich, die Zellen aus dem frühesten Durchgang für den Aufbau des Modells zu verwenden. | |||
| Maximale Kultivierungszeit von 2D- und 3D-Modellen, die aus Primärzellen im Vergleich zu Zelllinien rekonstruiert wurden | Der Zeitpunkt der Kultivierung eines Modells hängt stark von der Art der verwendeten Zellen ab. Bei Primärzellen ist die Kultivierungszeit aufgrund ihrer kurzen Lebensdauer kürzer. | |||
| Schwierigkeiten bei der Zellkugelbildung | Einige Zellen benötigen möglicherweise eine längere Zeit für die Kugelbildung. Wenn sich die Kügelchen nach einigen weiteren Tagen nicht gebildet haben, entnehmen Sie die Zellen aus der Probe und überprüfen Sie ihre Lebensfähigkeit, z. B. mit Trypanblau-Färbung. | |||
| Probleme mit der Kugelstabilität | Wenn die Kugeln nicht stabil sind und bei der Handhabung zerstört werden, versuchen Sie, Kugeln aus einer geringeren Anzahl von Zellen zu erstellen. Achten Sie darauf, die Schalen, in denen die Kugeln wachsen, immer vorsichtig zu übertragen. | |||
| Schwierigkeiten mit der Hydrogel-Zubereitung | Prüfen Sie, ob das Verhältnis der Inhaltsstoffe (Wasser, PBS [10x], NaOH, Kollagen Typ 1) korrekt war. Die Stammlösung von Kollagen ist in der Regel sehr dicht, also achten Sie darauf, sie langsam zu pipettieren. Luftblasen stören die Morphologie des Hydrogels, so dass das umgekehrte Pipettieren des Gels bei diesem Problem hilfreich sein kann. | |||
Tabelle 10: Fehlerbehebung bei Zellkulturen
Die etablierten Modelle können nach der Herstellung in mehreren Bereichen eingesetzt werden, beginnend mit (1) Zytotoxizitäts- und Genotoxizitätsexperimenten neuartiger Verbindungen mit biologischer Aktivität für den Einsatz in Arzneimitteln und Kosmetika49, (2) Experimenten mit verschiedenen Faktorenstimulation50, (3) Grundlagenforschung, die unser Wissen über Hautzellen, ihre biologischen Funktionen, Wechselwirkungen mit anderen Zellen und der Umwelterweitert 51, 52, (4) Forschung an ausgewählten Krankheitsentitäten, bei denen ein bestimmter Zelltyp in das erstellte Modell eingeführt werden kann (Krebszellen, Zellen mit einer Mutation in einem bestimmten Gen, etc.14,53) und viele mehr. Es versteht sich von selbst, dass die Anwendung dieser Modelle im Einklang mit dem 3R-Prinzip für eine ethischere Verwendung von Tieren in Produktversuchen und wissenschaftlicher Forschung steht und nicht gegen das Verbotsgesetz von Tierversuchen für kosmetische Mittel verstößt.
Offenlegungen
Die Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Die Autorinnen und Autoren danken für die finanzielle Unterstützung durch die Technische Universität Warschau aus dem Programm "Exzellenzinitiative - Forschungsuniversität" in Form von zwei Stipendien: POB BIB BIOTECHMED-2 start (Nr. 1820/2/ZO1/POB4/2021) und das Rektoratsstipendium für studentische Forschungsgruppen (SKIN-ART, Nr. 1820/116/Z16/2021). Darüber hinaus möchten sich die Autoren für die Unterstützung bedanken, die sie von Prof. Joanna Cieśla und dem Lehrstuhl für Arzneimittel- und Kosmetikbiotechnologie sowie dem Biotechnology Science Club "Herbion" an der Fakultät für Chemie der Technischen Universität Warschau erhalten haben. Ein besonderer Dank geht an Dr. Michał Stepulak für die Bereitstellung des Wirkstoffs Pluronic F-127.
Materialien
| Name | Company | Catalog Number | Comments |
| 24-well plate for adherent cell culture | Biologix Europe GmbH | 07-6024 | - |
| 35%–38% HCL | Chempur | 115752837 | - |
| 60 mm cell culture Petri dish | Nest | 705001 | - |
| Avidin−Sulforhodamine 101 | Sigma Aldrich | A2348-5MG | - |
| Bright-field inverted microscope | Olympus | CKX41 | - |
| Calcium chloride | Avantor | 874870116 | - |
| Cell culture flask T75 for adherent cells | Genoplast | G77080033 | - |
| Centrifuge tube 15 mL | GoogLab Scientific | G66010522 | - |
| CO2 Incubator | Heal Force | Galaxy 170R | - |
| Col1A2 antibody produced in rabbit | Novus | NBP2-92790 | - |
| Corning(R) Transwell(R) Polycarbonate | Corning | CLS3422-48EA | - |
| Cytokeratin 14 antibody produced in mouse | Novus | NBP1-79069 | - |
| DPX Mountant for histology | Sigma Aldrich | 06522-100ML | - |
| Dulbecco's Modified Eagle Medium (DMEM) | VWR Chemicals | L0102-500 | - |
| Eosine Y | Kolchem | - | 0.5 % aquatic solution |
| Eppendorf tube 1.5 mL | Sarstedt | 72.690.001 | - |
| Eppendorf tube 2 mL | Sarstedt | 72.691 | - |
| Ethyl alcohol absolute 99.8% | Avantor | 396480111 | diluted in ultrapure water to the needed concentrations |
| Fetal bovine serum | Gibco | 10270106 | - |
| Fluorescent inverted microscope | Olympus | IX71 | - |
| Goat anti-mouse secondary antibody conjugated with FITC | Sigma Aldrich | F0257-1mL | |
| Goat anti-rabbit secondary antibody conjugated with FITC | Novus | NB7159 | - |
| Harris Hematoxylin | Kolchem | - | 1 mg/mL in 95% ethanol |
| Hoechst 33342 | ThermoFisher | H3570 | - |
| Laminar chamber | Heal Force | HFSafe-1200 | - |
| Melan-A antibody produced in mouse | Santa Cruz Biotechnology | sc-20032 | - |
| Microtome | Microm | HM355S | - |
| NaOH | Avantor | 810981997 | - |
| Paraffin pastilles | Sigma Aldrich | 1.07164 | - |
| Paraformaldehyde | Sigma Aldrich | 1581227 | - |
| Penicillin/Streptomycin solution | Sigma Aldrich | P4333 | - |
| Pipette tip, 1000 µL | Sarstedt | 70.305 | - |
| Pipette tip, 20 µL | Sarstedt | 70.3021 | - |
| Pipette tip, 200 µL | Sarstedt | 70.303 | - |
| Pluronic F-127 | BASF | 50401036 | - |
| Serological pipette 10 mL | GoogLab Scientific | G33270011 | - |
| Serological pipette 25 mL | GoogLab Scientific | G33280011 | - |
| Serological pipette 5 mL | GoogLab Scientific | G33260011 | - |
| Sodium bicarbonate | Sigma Aldrich | S5761 | - |
| Sodium bicarbonate | Chempur | 118105307 | |
| Trypsin-EDTA 0.25% solution, phenol red | Sigma Aldrich | 25200072 | - |
| Type 1 collagen | IBIDI | 50201 | - |
| U-bottom 96-well plate | Sarstedt | 83.3925500 | - |
| Xylene | Sigma Aldrich | 534056 | - |
Referenzen
- Farage, M. A., Miller, K. W., Elsner, P., Maibach, H. I. Characteristics of the aging skin. Advances in Wound Care. 2 (1), 5-10 (2013).
- Zhu, H., Alikhan, A., Maibach, H. I. Biology of Stratum Corneum: Tape Stripping and Protein Quantification. Textbook of Aging Skin. Farage, M. A., Miller, K. W., Maibach, H. I. , Springer Berlin Heidelberg. Berlin, Heidelberg. (2015).
- Boer, M., Duchnik, E., Maleszka, R., Marchlewicz, M. Structural and biophysical characteristics of human skin in maintaining proper epidermal barrier function. Postepy Dermatogogii I Alergologii. 33 (1), 1-5 (2016).
- De Falco, M., Pisano, M. M., De Luca, A. Embryology and Anatomy of the Skin. In Skin Cancer: A Practical Approach. Current Clinical Pathology. Baldi, A., Pasquali, P., Spugnini, E. P. , Springer. New York. (2014).
- Dehdashtian, A., Stringer, T. P., Warren, A. J., Mu, E. W., Amirlak, B., Shahabi, L. Anatomy and Physiology of the Skin. Melanoma: A Modern Multidisciplinary Approach. Riker, A. I. , Springer International Publishing: Cham. 15-26 (2018).
- Graham, H. K., Eckersley, A., Ozols, M., Mellody, K. T., Sherratt, M. J. Human Skin: Composition, Structure and Visualisation Methods. Skin Biophysics; Studies in Mechanobiology, Tissue Engineering, and Biomaterials. Limbert, G. 22, Springer International Publishing: Cham. 1-18 (2019).
- Piasek, A. M., Musolf, P., Sobiepanek, A. Aptamer-based advances in skin cancer research. Current Medicinal Chemistry. 30 (8), 953-973 (2023).
- Bergfeld, W. F., Belsito, D. V., Marks, J. G., Andersen, F. A. Safety of ingredients used in cosmetics. Journal of the American Academy of Dermatology. 52 (1), 125-132 (2005).
- Hubrecht, R. C., Carter, E. The 3Rs and humane experimental technique: Implementing change. Animals. 9 (10), 754(2019).
- Sreedhar, D., Manjula, N., Ajay, P., Shilpa, P., Ligade, V. Ban of cosmetic testing on animals: A brief overview. International Journal of Current Research and Review. 12 (14), 113-116 (2020).
- Silva, R. J., Tamburic, S. A state-of-the-art review on the alternatives to animal testing for the safety assessment of cosmetics. Cosmetics. 9 (5), 90(2022).
- Xu, Y., Shrestha, N., Préat, V., Beloqui, A. An overview of in vitro, ex vivo and in vivo models for studying the transport of drugs across intestinal barriers. Advanced Drug Delivery Reviews. 175, 113795(2021).
- Boelsma, E., Ponec, M. Basics (Guidelines) on Cell Culture Testing for Topical/Dermatological Drugs/Products and Cosmetics With Regard to Efficacy and Safety of the Preparations. In Dermatopharmacology of Topical Preparations. Gabard, B., Surber, C., Elsner, P., Treffel, P. , Springer Berlin Heidelberg. Berlin, Heidelberg. 37-57 (2000).
- Suhail, S., Sardashti, N., Jaiswal, D., Rudraiah, S., Misra, M., Kumbar, S. G. Engineered skin tissue equivalents for product evaluation and therapeutic applications. Biotechnology Journal. 14 (7), 1900022(2019).
- Sobiepanek, A., et al. Novel diagnostic and prognostic factors for the advanced melanoma based on the glycosylation-related changes studied by biophysical profiling methods. Biosensors and Bioelectronics. 203, 114046(2022).
- Yang, H., Sun, L., Liu, M., Mao, Y. Patient-derived organoids: A promising model for personalized cancer treatment. Gastroenterology Report. 6 (4), 243-245 (2018).
- Baran, J., et al. Mast cells as a target-A comprehensive review of recent therapeutic approaches. Cells. 12 (8), 1187(2023).
- Kosten, I. J., Buskermolen, J. K., Spiekstra, S. W., de Gruijl, T. D., Gibbs, S. Gingiva equivalents secrete negligible amounts of key chemokines involved in langerhans cell migration compared to skin equivalents. Journal of Immunology Research. 2015, 627125(2015).
- cieżyńska, A., et al. A novel and effective method for human primary skin melanocytes and metastatic melanoma cell isolation. Cancers. 13 (24), 6244(2021).
- Kröger, M., et al. In vivo non-invasive staining-free visualization of dermal mast cells in healthy, allergy and mastocytosis humans using two-photon fluorescence lifetime imaging. Scientific Reports. 10 (1), 14930(2020).
- Liu, D., Chen, S., Win Naing, M. A review of manufacturing capabilities of cell spheroid generation technologies and future development. Biotechnology and Bioengineering. 118 (2), 542-554 (2021).
- Rossi, A., Appelt-Menzel, A., Kurdyn, S., Walles, H., Groeber, F. Generation of a three-dimensional full thickness skin equivalent and automated wounding. Journal of Visualized Experiments: JoVE. (96), e52576(2015).
- Kim, K., Kim, J., Kim, H., Sung, G. Y. Effect of α-lipoic acid on the development of human skin equivalents using a pumpless skin-on-a-chip model. International Journal of Molecular Sciences. 22 (4), 2160(2021).
- Curto, E. V., Lambert, G. W., Davis, R. L., Wilborn, T. W., Dooley, T. P. Biomarkers of human skin cells identified using DermArray DNA arrays and new bioinformatics methods. Biochemical and Biophysical Research Communications. 291 (4), 1052-1064 (2002).
- Godwin, L. S., et al. Isolation, culture, and transfection of melanocytes. Current Protocols in Cell Biology. 63, 1-20 (2014).
- Przekora, A., Zarnowski, T., Ginalska, G. A simple and effective protocol for fast isolation of human tenon's fibroblasts from a single trabeculectomy biopsy - a comparison of cell behaviour in different culture media. Cellular & Molecular Biology Letters. 22, 5(2017).
- Rådinger, M., Jensen, B. M., Kuehn, H. S., Kirshenbaum, A., Gilfillan, A. M. Generation, Isolation, and Maintenance of Human Mast Cells and Mast Cell Lines Derived from Peripheral Blood or Cord Blood. Current Protocols in Immunology. Coligan, J. E., Bierer, B. E., Margulies, D. H., Shevach, E. M., Strober, W. , John Wiley & Sons, Inc. Hoboken, NJ. (2010).
- Artuc, M., Muscha Steckelings, U., Henz, B. M. Mast cell-fibroblast interactions: Human mast cells as source and inducers of fibroblast and epithelial growth factors. Journal of Investigative Dermatology. 118 (3), 391-395 (2002).
- Panos, R. J., Rubin, J. S., Csaky, K. G., Aaronson, S. A., Mason, R. J. Keratinocyte growth factor and hepatocyte growth factor/scatter factor are heparin-binding growth factors for alveolar type ii cells in fibroblast-conditioned medium. Journal of Clinical Investigation. 92 (2), 969-977 (1993).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Threedimensional cell culture: A powerful tool in tumor research and drug discovery (Review). Oncology Letters. 14 (6), 6999-7010 (2017).
- Amaral, R. L. F., Miranda, M., Marcato, P. D., Swiech, K. Comparative analysis of 3D bladder tumor spheroids obtained by forced floating and hanging drop methods for drug screening. Frontiers in Physiology. 8, 605(2017).
- Gao, B., Jing, C., Ng, K., Pingguan-Murphy, B., Yang, Q. Fabrication of three-dimensional islet models by the geometry-controlled hanging-drop method. Acta Mechanica Sinica. 35 (2), 329-337 (2019).
- Zhang, C., et al. 3D culture technologies of cancer stem cells: Promising ex vivo tumor models. Journal of Tissue Engineering. 11, (2020).
- Sobiepanek, A., Paone, A., Cutruzzolà, F., Kobiela, T. Biophysical characterization of melanoma cell phenotype markers during metastatic progression. European Biophysics Journal: EBJ. 50 (3-4), 523-542 (2021).
- Jin, G. -Z., Kim, H. -W. Effects of Type I collagen concentration in hydrogel on the growth and phenotypic expression of rat chondrocytes. Tissue Engineering and Regenerative. 14 (4), 383-391 (2017).
- Osidak, E. O., et al. Concentrated collagen hydrogels: A new approach for developing artificial tissues. Materialia. 20, 101217(2021).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: Characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Jimbow, K., Salopek, T. G., Dixon, W. T., Searles, G. E., Yamada, K. The epidermal melanin unit in the pathophysiology of malignant melanoma. The American Journal of Dermatopathology. 13 (2), 179-188 (1991).
- Van Den Bogaard, E., et al. Perspective and consensus opinion: Good practices for using organotypic skin and epidermal equivalents in experimental dermatology research. Journal of Investigative Dermatology. 141 (1), 203-205 (2021).
- Bednarek, R. In vitro methods for measuring the permeability of cell monolayers. Methods and Protocols. 5 (1), 17(2022).
- Idrees, A., et al. Fundamental in vitro 3D human skin equivalent tool development for assessing biological safety and biocompatibility - towards alternative for animal experiments. 4 Open. 4, (2021).
- Park, H. -Y., Kweon, D. -K., Kim, J. -K. Upregulation of tight junction-related proteins by hyaluronic acid in human HaCaT keratinocytes. Bioactive Carbohydrates and Dietary Fibre. 30, 100374(2023).
- Choudhury, S., Das, A. Advances in generation of three-dimensional skin equivalents: Pre-clinical studies to clinical therapies. Cytotherapy. 23 (1), 1-9 (2021).
- Zhang, Z., Michniak-Kohn, B. B. Tissue engineered human skin equivalents. Pharmaceutics. 4 (1), 26-41 (2012).
- Woappi, Y., Altomare, D., Creek, K. E., Pirisi, L. Self-assembling 3D spheroid cultures of human neonatal keratinocytes have enhanced regenerative properties. Stem Cell Research. 49, 102048(2020).
- Ouwehand, K., Spiekstra, S. W., Waaijman, T., Scheper, R. J., de Gruijl, T. D., Gibbs, S. Technical advance: Langerhans cells derived from a human cell line in a full-thickness skin equivalent undergo allergen-induced maturation and migration. Journal of Leukocyte Biology. 90 (5), 1027-1033 (2011).
- Akther, F., Little, P., Li, Z., Nguyen, N. -T., Ta, H. T. Hydrogels as artificial matrices for cell seeding in microfluidic devices. RSC Advances. 10 (71), 43682-43703 (2020).
- Silva, A. K. A., Richard, C., Bessodes, M., Scherman, D., Merten, O. -W. Growth factor delivery approaches in hydrogels. Biomacromolecules. 10 (1), 9-18 (2009).
- Lee, H. -R., et al. Effect of Aronia extract on collagen synthesis in human skin cell and dermal equivalent. Oxidative Medicine and Cellular Longevity. 2022, 4392256(2022).
- Mulder, P. P. G., Raktoe, R. S., Vlig, M., Elgersma, A., Middelkoop, E., Boekema, B. K. H. L. Full skin equivalent models for simulation of burn wound healing, exploring skin regeneration and cytokine response. Journal of Functional Biomaterials. 14 (1), 29(2023).
- Goncalves, K., et al. Investigation into the effect of skin tone modulators and exogenous stress on skin pigmentation utilizing a novel bioengineered skin equivalent. Bioengineering & Translational Medicine. 8 (2), 10415(2023).
- Michel, M., L'Heureux, N., Pouliot, R., Xu, W., Auger, F. A., Germain, L. Characterization of a New Tissue-Engineered Human Skin Equivalent with Hair. In Vitro Cellular & Developmental Biology. Animal. 35 (6), 318-326 (1999).
- Müller, I., Kulms, D. A 3D organotypic melanoma spheroid skin model. Journal of Visualized Experiments: JoVE. (135), e57500(2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten