Method Article
Construindo modelos de pele para inúmeras aplicações - da monocultura bidimensional (2D) à multicultura tridimensional (3D)
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui, apresentamos procedimentos baratos e simples para introduzir vários modelos de pele 3D para pesquisa de rotina em um laboratório de cultura de células. Os pesquisadores podem criar modelos adaptados às suas necessidades sem depender de modelos disponíveis comercialmente.
Resumo
Devido à estrutura complexa e funções importantes da pele, é um modelo de pesquisa interessante para as indústrias cosmética, farmacêutica e médica. Na União Europeia, houve uma proibição total de testar produtos cosméticos e seus ingredientes em animais. No caso de medicamentos e produtos farmacêuticos, essa possibilidade também é constantemente limitada. De acordo com o princípio dos 3Rs, está se tornando cada vez mais comum testar compostos individuais, bem como formulações inteiras em modelos criados artificialmente. Os mais baratos e mais utilizados são os modelos 2D, que consistem em uma monocamada celular, mas não refletem as interações reais entre as células do tecido. Embora os modelos 3D disponíveis comercialmente forneçam uma melhor representação do tecido, eles não são usados em larga escala. Isso ocorre porque eles são caros, o tempo de espera é bastante longo e os modelos disponíveis são frequentemente limitados apenas aos normalmente usados.
Para levar a pesquisa conduzida a um nível superior, otimizamos os procedimentos de várias preparações de modelos de pele 3D. Os procedimentos descritos são baratos e simples de preparar, pois podem ser aplicados em inúmeros laboratórios e por pesquisadores com diferentes experiências em cultura celular.
Introdução
A pele é uma estrutura contínua com interações multicelulares revelando o bom funcionamento e homeostase desse órgão complexo. É construído a partir de camadas morfologicamente diferentes: a camada interna - derme e a camada externa - a epiderme. No topo da epiderme, distinguimos adicionalmente o estrato córneo (consistindo de células mortas achatadas - corneócitos), que fornece a maior proteção contra o ambiente externo. Algumas das funções passivas e ativas mais importantes da pele são a proteção do corpo contra fatores externos, a participação nos processos imunológicos, secreção, reabsorção, termorregulação e sensoriamento 1,2,3. Por ser considerado um dos maiores órgãos do corpo, é impossível evitar o contato com vários patógenos, alérgenos, produtos químicos, além da radiação ultravioleta (UV). Assim, é estruturado com muitos tipos de células com funções específicas. Os principais tipos de células presentes na epiderme são os queratinócitos (quase 90% de todas as células, com funções estruturais e imunológicas nas partes mais profundas da epiderme, mas que posteriormente passam pelo processo de queratinização para se transformar em corneócitos na camada superior da epiderme), melanócitos (apenas 3%-7% da população de células epidérmicas, que produzem o pigmento protetor UV melanina) e as células de Langerhans (do sistema imunológico). No caso da derme, as principais células são fibroblastos (produtores de fatores de crescimento e proteínas), células dendríticas e mastócitos (ambos tipos celulares do sistema imunológico)4,5,6. Além disso, a pele é equipada com várias proteínas extracelulares (como colágeno tipo I e IV, fibronectina e laminina; Figura 1) e fibras proteicas (colágeno e elastina), que garantem a estrutura específica da pele, mas também estimulam a ligação celular, a adesão celular e outras interações7.
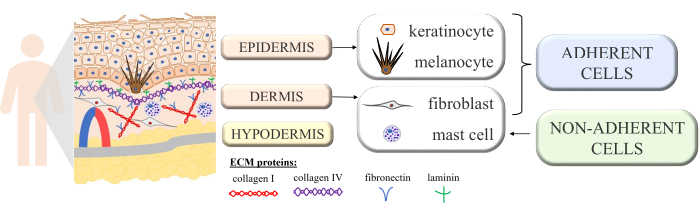
Figura 1: Esquema mostrando a estrutura da pele. A estrutura da pele marcou quatro tipos básicos de células que ocorrem em suas camadas individuais e proteínas distintas da matriz extracelular. Esta figura foi criada com o MS PowerPoint. Clique aqui para ver uma versão maior desta figura.
A segurança dos cosméticos e produtos farmacêuticos é uma questão muito importante, e a proteção da saúde dos consumidores e pacientes é uma prioridade8. Até recentemente, deveria ser garantido por vários testes, incluindo estudos realizados em animais. Infelizmente, muitas vezes exigiam o uso de métodos drásticos, causando dor e sofrimento em animais usados para fins de pesquisa (frequentemente camundongos, ratos e porcos). Em 1959, foram introduzidos os Princípios da Técnica Experimental Humana (princípio dos 3Rs): (1 - Substituição) substituição de animais em pesquisa por modelos in vitro, in sillico ou ex vivo, (2 - Redução) redução do número de animais utilizados para pesquisa e (3 - Refinamento) melhoria do bem-estar dos animais ainda necessários para pesquisa e, ao mesmo tempo, melhoria dos métodos alternativos desenvolvidos9. Além disso, na União Europeia (UE), os testes cosméticos em animais são regulamentados por lei. A partir de 11 de setembro de 2004, entrou em vigor a proibição de produtos cosméticos testados em animais. Em 11 de março de 2009, a UE proibiu os testes em animais de ingredientes cosméticos. A venda de produtos cosméticos feitos de ingredientes recém-testados em animais não era permitida; No entanto, testar os produtos em animais para problemas complexos de saúde humana, como toxicidade de dose repetida, toxicidade reprodutiva e toxicocinética, ainda era aceitável. A partir de 11 de março de 2013, na UE, é ilegal vender cosméticos quando o produto acabado ou seus ingredientes foram testados em animais10. Portanto, atualmente, em cosmetologia, a pesquisa é realizada em três níveis: in vitro (células), ex vivo (tecidos reais) e in vivo (voluntários)11. No caso dos produtos farmacêuticos, a necessidade de testes em animais permanece; no entanto, é significativamente reduzido e rigorosamente controlado12.
Como métodos alternativos aos ensaios em animais e para a avaliação inicial da eficácia de um novo ingrediente ativo, são utilizadas as culturas de células cutâneas in vitro . O isolamento de diferentes tipos de células da pele e seu cultivo em condições laboratoriais estéreis permite avaliar a segurança e a toxicidade das substâncias ativas. As linhagens celulares da pele também são modelos amplamente reconhecidos para pesquisa, pois as células são vendidas por empresas certificadas e os resultados podem ser comparáveis em diferentes laboratórios. Esses testes geralmente são realizados em modelos 2D simples das monoculturas de células da pele humana. Alguns dos modelos mais avançados são suas co-culturas (como queratinócitos com fibroblastos e queratinócitos com melanócitos), bem como os modelos tridimensionais, incluindo culturas livres de scaffold (esferas) e equivalentes cutâneos baseados em scaffold da epiderme, derme ou mesmo os substitutos de espessura total da pele13. Vale ressaltar que, além do último tipo (equivalentes de pele), os demais não estão disponíveis comercialmente e, se necessário, um cientista deve prepará-los por conta própria.
Embora muitos desses modelos tenham sido mantidos e sejam rotineiramente vendidos hoje em dia (Tabela 1), modelos adicionais são constantemente necessários para validar a maioria dos resultados. Assim, os modelos recém-projetados devem recriar melhor as interações reais que ocorrem no corpo humano. Quando uma mistura de células de diferentes tipos é usada para formar tais modelos, a reprodução do aspecto multicelular do tecido in vivo pode ser alcançada. Como resultado, desenvolve-se uma cultura organotípica (Figura 2).
| Nome | Descrição | |||||
| Pele normal | EpiSkin | Epiderme humana reconstruída - queratinócitos em uma membrana de colágeno | ||||
| SkinEthic RHE | Epiderme Humana Reconstruída - Queratinócitos em uma membrana de policarbonato | |||||
| SkinEthic RHE-LC | Células de Langerhans Modelo Epidérmico Humano - Queratinócitos e células de Langerhans em uma membrana de policarbonato | |||||
| SkinEthic RHPE | Epiderme pigmentada humana reconstruída - queratinócitos e melanócitos em uma membrana de policarbonato | |||||
| Pele em T | Modelo de pele humana reconstruída de espessura total - queratinócitos em uma camada de fibroblastos, que foram cultivados em uma membrana de policarbonato | |||||
| Modelo Phenion FT Skin | Queratinócitos e fibroblastos em hidrogel | |||||
| Pele com uma doença | Modelo de pele Melanoma FT | Queratinócitos e fibroblastos normais derivados de humanos com linha celular de melanoma maligno humano A375 | ||||
| Modelo de tecido de psoríase | Queratinócitos e fibroblastos humanos normais | |||||
Tabela 1: Os equivalentes comerciais de pele mais populares para vários estudos.
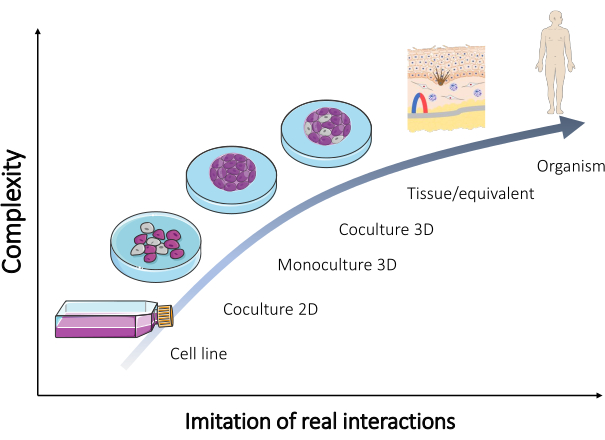
Figura 2: Complexidade de diferentes modelos in vitro . A relação entre a complexidade de diferentes modelos in vitro para recriar um organismo e as interações reais que ocorrem diretamente no corpo humano. A figura foi modificada a partir do conjunto "Microbiologia e cultura de células" da Servier Medical Art da Servier (https://smart.servier.com/). Clique aqui para ver uma versão maior desta figura.
Uma das limitações mais importantes dos equivalentes comerciais é a disponibilidade de apenas modelos de pesquisa muito gerais com alguns tipos de células (normalmente 1-2, raramente 3). No entanto, existem muito mais células presentes na pele, e sua interação entre si pode garantir melhor ou pior tolerância a vários ingredientes14. A falta de alguns componentes imunológicos pode diminuir seu valor em vários tipos de pesquisa, incluindo imunoterapia. Este é um problema sério, pois o melanoma é um câncer de pele com risco de vida devido ao início precoce da metástase e à resistência frequente ao tratamento aplicado15. Para melhorar o modelo de pele artificial, os pesquisadores tentam estabelecer uma co-cultura de células imunes com linhagens celulares e organoides16 e isso é considerado uma grande melhoria dos modelos estudados. Por exemplo, os mastócitos participam de muitos processos fisiológicos (cicatrização de feridas, remodelação tecidual) e patológicos (inflamação, angiogênese e progressão tumoral) na pele17. Assim, sua ocorrência no modelo pode alterar significativamente a resposta do modelo ao composto estudado. Finalmente, ainda faltam muitas informações relacionadas à pele, que só podem ser descobertas com a realização de pesquisas básicas. É por isso que criar e refinar diferentes modelos de pele artificial (Tabela 2) é um esforço tão importante. Este artigo apresenta vários procedimentos para criar modelos avançados de pele, incluindo esferas e equivalentes de pele.
| Modelo de pele in vitro | Tentativa de recriar interações que ocorrem no tecido | Exemplos das células usadas |
| Cultura de células 2D ou 3D | Epiderme | Queratinócitos |
| Melanócitos | ||
| Queratinócitos + Melanócitos | ||
| Derme | Fibroblastos | |
| Mastócitos | ||
| Fibroblastos + mastócitos | ||
| Pele | Queratinócitos + Fibroblastos | |
| Queratinócitos + mastócitos | ||
| Melanócitos + fibroblastos | ||
| Melanócitos + mastócitos | ||
| Queratinócitos + Fibroblastos + Melanócitos | ||
| Queratinócitos + Fibroblastos + Mastócitos |
Tabela 2: Exemplos de mistura de tipos de células para recriar tecido cutâneo em cultura 2D e 3D.
Protocolo
O estudo foi conduzido de acordo com as diretrizes da Declaração de Helsinque e aprovado pelo Comitê de Ética da Universidade Médica de Varsóvia (KB/7/2022). O consentimento informado foi obtido de todos os sujeitos envolvidos no estudo.
NOTA: Os procedimentos descritos da preparação avançada do modelo de pele podem ser realizados com o uso de células primárias da pele e linhagens celulares disponíveis comercialmente ou com as células primárias isoladas dos pacientes. As células comerciais são fornecidas com os documentos relevantes e seu uso em pesquisa para a maioria dos países não requer nenhuma aprovação adicional. No entanto, para alguns países, é obrigatório, portanto, deve ser verificado com os regulamentos do Comitê de Ética Local. Se as células primárias isoladas dos pacientes devem ser usadas na pesquisa, primeiro, o estudo deve ser aprovado pelo Comitê de Ética Local e precisa ser conduzido de acordo com suas diretrizes rígidas. Além disso, o consentimento informado por escrito deve ser coletado de todos os doadores de tecido cutâneo. O isolamento de células primárias da pele não foi o assunto deste artigo, mas procedimentos exemplares de isolamento podem ser encontrados em Kosten et al. (queratinócitos)18, Ścieżyńska et al. (melanócitos)19, Kröger et al. (fibroblastos e mastócitos)20. A maioria das células e linhagens celulares normais da pele tem um nível de segurança da classe BSL1; eles não causam nenhuma ameaça. No entanto, o equipamento de laboratório usado precisa atender aos padrões para cultura de células animais e humanas sob condições controladas.
1. Cultura de células da pele
NOTA: As culturas de células cutâneas devem ser realizadas em frascos dedicados a células aderentes ou em suspensão (dependendo do tipo de célula) a 37 °C e um teor de dióxido de carbono de 5% em uma incubadora. As atividades relacionadas ao seu cultivo e uso para pesquisa requerem condições estéreis e devem ser realizadas em câmara laminar após exposição aos raios ultravioleta C (UVC) por 15-30 min. A obtenção de suspensões celulares, que são então usadas para criar os modelos bidimensionais e tridimensionais, requer a implementação de procedimentos dependendo do tipo de célula (para células aderentes como queratinócitos, fibroblastos e melanócitos - etapa 1.1, para células não aderentes de mastócitos - etapa 1.2) (Figura 3). Para diferentes tamanhos de frascos de cultura, os volumes de todos os reagentes (como meio, solução salina tamponada com fosfato ou solução de tripsina) usados nos métodos descritos estão listados na Tabela 3. Os parâmetros dependentes do tipo de células (por exemplo, concentração e composição dos reagentes, método de centrifugação, etc.) são classificados na Tabela 4. As densidades celulares usadas para semeadura são mostradas na Tabela 5. Todas essas tabelas estão incluídas no final desta seção.
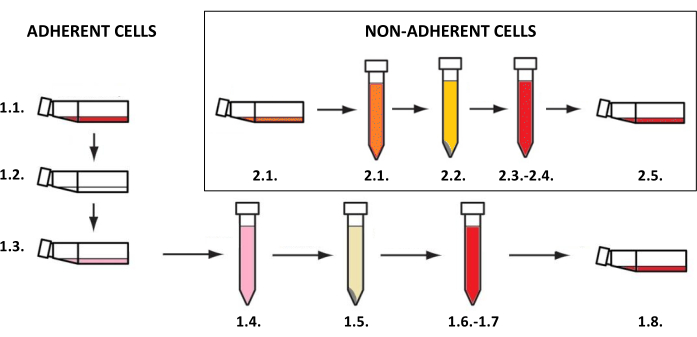
Figura 3: Cultivo de células aderentes e não aderentes. O procedimento geral passo a passo de cultivo celular aderente e não aderente (os números correspondem às descrições das etapas 1.1 e 1.2). A figura foi criada com o MS PowerPoint. Clique aqui para ver uma versão maior desta figura.
- Obtenção de uma suspensão de células aderentes
- Retirar o meio do balão de cultura.
- Lave suavemente as células com solução salina tamponada com fosfato (PBS, Tabela 3).
- Adicionar solução de tripsina em ácido etileno diamina tetraacético (solução de tripsina-EDTA, Tabela 3). Incubar o balão a 37 °C e controlar o desprendimento das células da superfície no microscópio óptico.
- Suspenda as células destacadas em pelo menos uma quantidade dupla de meio de crescimento total ou neutralizador de tripsina para desativar a tripsina (2:1) (para volumes, consulte a Tabela 3 e, para reagentes, consulte a Tabela 4). Transferir quantitativamente o conteúdo do balão para o tubo de 15 ml.
- Pegue um pequeno volume (20 μL) de suspensão celular em um tubo de 1,5 mL e conte as células com um hemocitômetro manual ou automático.
- Centrifugue o tubo (parâmetros na Tabela 4), remova a maior parte do sobrenadante e ressuspenda o pellet celular na pequena quantidade do líquido restante. Em seguida, adicione meio fresco suficiente para obter o volume de pré-centrifugação (volume na Tabela 3) se a densidade celular for apropriada para semear ou recalcular o volume necessário do novo meio.
NOTA: Algumas células, como os melanócitos, são muito sensíveis à centrifugação, evitando assim a necessidade de centrifugá-las novamente em um curto espaço de tempo. - Preparar a suspensão celular com a densidade necessária (células/ml, densidade celular no quadro 5) para a experiência (monoculturas ou multiculturas 2D/3D de células da pele).
NOTA: Se as células forem cultivadas posteriormente, devolva 5.000-8.000 células/mL a um novo frasco e adicione meio fresco (volume na Tabela 3).
- Obtenção de uma suspensão de células não aderentes
- Retirar o meio com a suspensão celular do balão de cultura e transferi-lo quantitativamente para o tubo de 15 ml.
- Leve um pequeno volume (20 μL) da suspensão celular para um novo tubo de 1,5 mL. Conte as células com um hemocitômetro manual ou automático.
- Centrifugue o tubo (parâmetros na Tabela 4), remova a maior parte do sobrenadante e ressuspenda as células em uma pequena quantidade do líquido restante. Em seguida, adicione meio fresco para obter o volume de pré-centrifugação (conforme indicado na Tabela 3) se a densidade celular for apropriada para semear ou recalcular o volume necessário do novo meio.
- Preparar a suspensão celular com a densidade necessária (células por ml, conforme sugerido no quadro 5) para a experiência (monoculturas ou multiculturas 2D/3D de células da pele).
NOTA: Se as células forem cultivadas posteriormente, devolva 5.000-8.000 células/mL a um novo frasco e adicione meio fresco.
| 25 cm2 frascos de cultura | 75 cm2 frascos de cultura | |
| Meio de cultura [mL] | 4–5 | 8–12 |
| PBS [mL] | 5 | 10 |
| Tripsina-EDTA [mL] | 0.5–1 | 1–2 |
| Meio de neutralização [mL] | 1–2 | 2–4 |
Quadro 3: Volumes de reagentes utilizados durante o cultivo e a preparação das suspensões celulares.
| Monocultura de células da pele | Tripsina | Desativador de tripsina | Centrifugação | Tipo médio para monocultura 2D | |
| Queratinócitos | 0.25% | com neutralizador de tripsina | 300 x g, 5 min, RT | Meio de Crescimento de Queratinócitos 2 | |
| Fibroblastos | 0.25% | com médio | 300 x g, 5 min, RT | DMEM, 10% FBS | |
| Melanócitos | 0.025% | com neutralizador de tripsina | 300 x g, 3 min, RT | Medium 254, suplemento de crescimento de melanócitos humanos sem PMA-2 | |
| Mastócitos | não é necessário | não é necessário | 300 x g, 3 min, RT | IMDM, 10% FBS, 1% aminoácidos não essenciais, 226 μM α-monotioglicerol | |
Tabela 4: Tripsinização, parâmetros de centrifugação e tipo de meio dependem do tipo de célula.
| Tipo de modelo | Densidade celular [célula/mL] | ||
| 2D | Monocamada | Fibroblastos | 2 x 105 |
| Mastócitos | |||
| Queratinócitos | |||
| Melanócitos | |||
| 3D | Esfera (método de soltar pendurado) | Fibroblastos | 5 x 105 |
| Mastócitos | |||
| Queratinócitos | |||
| Melanócitos | |||
| Mistura de células | |||
| Esfera (método de limitação de adesão celular) | Fibroblastos | 2 x 105 | |
| Mastócitos | |||
| Queratinócitos | |||
| Melanócitos | |||
| Mistura de células | |||
| Equivalente | Fibroblastos | 1 x 105 | |
| Mastócitos | 1 x 104 | ||
| Queratinócitos | 8 x 105 | ||
| Melanócitos | 5 x 104 | ||
Tabela 5: Densidade de semeadura celular para diferentes tipos de modelos de pele.
2. Preparação de esferas de células da pele
NOTA: Para criar esferas, o uso do método de gota suspensa é descrito na etapa 2.1 (Figura 4), enquanto a abordagem focada em limitar a adesão celular é mostrada na etapa 2.2 (Figura 5). No entanto, como as esferas são muito pequenas e podem ser instáveis, as atividades realizadas sob esses métodos exigem paciência, delicadeza e ações lentas.
- O método de suspensão
- Use uma densidade celular apropriada para atingir o tamanho desejado da esfera (densidade celular recomendada 5 x 105 células/mL, Tabela 5).
- Pipetar 20 μL da suspensão celular na tampa de uma placa de Petri ou de uma placa de vários poços (Figura 4A).
- Cubra o prato/prato com a parte inferior e vire-o suavemente (gotas penduradas serão criadas automaticamente nas tampas, Figura 4B).
- Encha a placa/poços de Petri da placa com uma solução estéril de água/PBS para evitar a evaporação do meio pelas gotículas.
- Incubar as gotículas durante 48-72 h a 37 °C.
NOTA: A gravidade puxa as células para baixo e a falta de superfície acessível impede a fixação das células ao vaso e promove a agregação celular. No entanto, alguns tipos de células podem exigir uma incubação mais longa. - Antes de realizar a próxima etapa, encha os poços da nova placa (ou use a placa antiga com água removida / PBS dos poços) com o meio de crescimento completo (100 μL).
NOTA: Antes da próxima etapa, pegue as pontas de 200 μL, remova 1/5 de cada extremidade da ponta e esterilize antes de usar. - Transfira as esferas celulares para os poços da placa de vários poços usando pontas de pipeta estéreis com uma extremidade cortada. Pegue pontas de 200 μL, remova 1/5 de cada extremidade da ponta e esterilize antes de usar ( Figura 4C ).
NOTA: Esta etapa pode ser difícil, pois o fluxo de líquido durante a inversão do prato/prato pode danificar as esferas. - Incubar as esferas transferidas durante 1 dia na placa de poços múltiplos a 37 °C antes de realizar quaisquer outras experiências (por exemplo, adição de compostos, ensaios de citotoxicidade, introdução de esferas em equivalentes) (Figura 4D).
- O método de limitar a adesão celular
- Antes da semeadura celular, cubra os poços da placa inferior em U com uma solução surfactante (por exemplo, Pluronic F-127, polietilenoglicol, álcool polivinílico) 21 . Prepare e adicione 100 μL de solução surfactante a 1% em PBS em cada poço. Incubar a placa com a solução durante 24 h a 37 °C (figura 5A-C). Armazene a placa por mais tempo, se necessário, mas mantenha o nível do fluido adicionando mais tampão PBS.
- Preparar a suspensão celular na densidade celular desejada em 50 μL por alvéolo (densidade celular recomendada durante a semeadura 2 x 105/ml, Tabela 5).
- Remova a solução de surfactante dos poços antes de semear as células para evitar a ruptura da membrana celular por lise ( Figura 5D ).
- Adicionar a solução celular à placa e incubar durante 24 h a 37 °C para atingir os agregados celulares (figura 5E). Após aproximadamente 1-3 dias, as esferas serão formadas (Figura 5F) e estarão prontas para uso em quaisquer experimentos futuros.
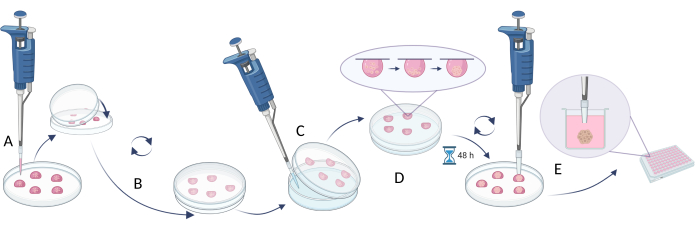
Figura 4: O método da gota suspensa. (A) suspensão da célula de pipetagem na tampa e cobrindo a tampa com a parte inferior do prato; (B) girar o prato para criar as gotas suspensas; (C) adição de água/PBS na parte inferior do prato (limitando a evaporação do líquido); (D) incubação dos pratos com gotas suspensas para criar esferas celulares; (E) coleta de gotículas com esferas formadas e estabilização de esferas transferidas em placas de múltiplos poços. A figura foi criada com Biorender.com. Clique aqui para ver uma versão maior desta figura.
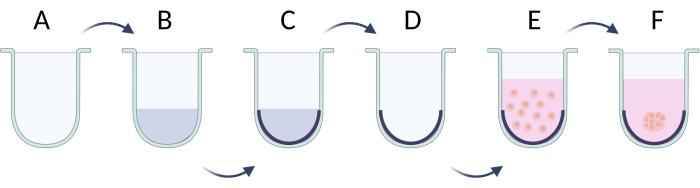
Figura 5: Preparação passo a passo das esferas pelo método de adesão celular limitante. (A) Poço de fundo em U; (B,C) limitando a ligação celular por solução surfactante; (D) remoção de solução de poços; (E) células de semeadura; (F) agregação de células e formação de uma esfera. A figura foi criada com Biorender.com. Clique aqui para ver uma versão maior desta figura.
3. Preparação de equivalentes de pele de espessura total
NOTA: O desenvolvimento dos equivalentes cutâneos de espessura total (epiderme e derme) pode ser dividido em três etapas (Figura 6): preparação da camada dérmica artificial com a ocorrência de células dérmicas típicas (como fibroblastos e mastócitos, Figura 6A), semeadura das células incluídas na epiderme artificial (principalmente queratinócitos e melanócitos, Figura 6B) e crescimento vertical de queratinócitos com possível processo de queratinização (formação do estrato córneo, Figura 6C). A preparação de equivalentes de pele de espessura total é descrita na etapa 3.1 (3.1.1-3.1.10). Se for necessário um equivalente de pele menos avançado (por exemplo, apenas o tipo de epiderme), o tipo de célula selecionado (como queratinócitos) pode ser semeado diretamente nas membranas de colágeno ou policarbonato disponíveis comercialmente e também cultivado com a possibilidade de induzir o processo de queratinização (vá diretamente para as etapas 3.1.9-3.1.10).
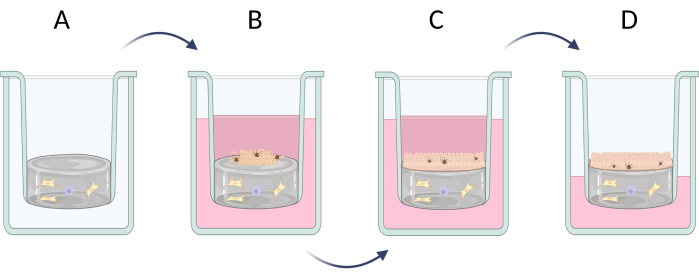
Figura 6: Preparação passo a passo de equivalentes de pele de espessura total em inserções. (A) preparação da camada pseudo-dérmica com células dérmicas, (B) semeadura de células epidérmicas, (C) cultura adicional de equivalente em meio, (D) cultura de interface ar-líquido promove a formação de epitélio estratificado. A figura foi criada com Biorender.com. Clique aqui para ver uma versão maior desta figura.
- Preparação de equivalentes de pele de espessura total em uma placa de 24 poços
- Coloque os tubos com água, PBS (10x), NaOH 1 M e solução de colágeno tipo I no gelo.
- Determine um número adequado de células dérmicas (por exemplo, fibroblastos e mastócitos; em uma proporção de 10:1) a serem semeadas no hidrogel. Transferir um número adequado de células dérmicas para um tubo de 1,5 mL (500 μL de fibroblastos e 500 μL de mastócitos, de acordo com as densidades celulares da Tabela 5) e centrifugar as células (300 x g, 3 min, RT).
- Remova o sobrenadante e ressuspenda suavemente as células na mistura de 695 μL de água / 100 μL de PBS (10x) / 5 μL de NaOH.
NOTA: Se 1 mL da solução total não for suficiente, use a Tabela 6 para recalcular os volumes de cada reagente. - Adicione 200 μL de solução de colágeno à mistura e misture delicadamente pipetando.
NOTA: Tenha cuidado, pois a consistência da mistura será densa. - Adicione 200 μL da mistura preparada ao inserto em placa de 24 poços. Para um modelo sem o estrato córneo, adicione 500 μL a cada poço da placa de 24 poços.
- Incubar a placa por 10 min em temperatura ambiente (RT) e depois transferi-la para a incubadora por 30 min.
NOTA: Verifique se o hidrogel polimerizou antes de qualquer outra ação. - Antes da semeadura celular na superfície do hidrogel, enxágue-o com um tampão PBS (500 μL/poço).
- Determine o número adequado de células epidérmicas (por exemplo, queratinócitos e melanócitos; na proporção de 15:1) a serem semeadas no topo do hidrogel. Prepare a mistura celular em 500 μL do meio DMEM suplementado com 10% de FBS (adicione 250 μL de queratinócitos e 250 μL de melanócitos, as densidades celulares são mencionadas na Tabela 4) e adicione-a suavemente aos poços.
NOTA: Em alguns casos, é melhor semear primeiro os melanócitos e permitir que eles se espalhem bem no hidrogel e, após mais 24 horas, remover os queratinócitos médios e semear. Nesse caso, adicione 250 μL de suspensão celular e 250 μL do meio. - Incubar as placas a 37 °C por 2-5 dias, dependendo da velocidade de crescimento celular, com troca de meio (com concentração decrescente de FBS de 10% a 1%) a cada 48 h e monitoramento celular realizado no microscópio óptico.
- Se o processo de queratinização for induzido após a obtenção de uma monocamada de queratinócitos sobre o hidrogel, use o meio livre de FBS adicionalmente suplementado por íons de cálcio e ácido L-ascórbico por mais 2-7 semanas (na concentração de 1,5 μM CaCl2 e 50 μg / mL de ácido L-ascórbico).
NOTA: O tempo de incubação depende dos queratinócitos utilizados e da sua velocidade de diferenciação.
| Reagente | A equação para calcular o volume de um reagente | Exemplos de cálculos | |
| (para um volume final = Vtotal de 1 mL) | |||
| solução de colágeno tipo I | 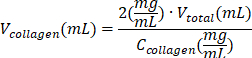 | (C colágeno = 10 mg/mL) | |
| 0,2 mL = 200 μL | |||
| PBS (10x) | 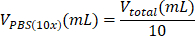 | 0,1 mL = 100 μL | |
| 1 M NaOH | 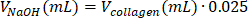 | 0,005 mL = 5 μL | |
| estéril H2O | 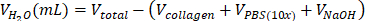 | 0,695 mL = 695 μL | |
Tabela 6: Cálculo dos volumes de reagentes necessários para a preparação de hidrogel de colágeno tipo I de 2 mg/mL.
4. Identificação de tipos celulares em um modelo de pele 3D por métodos de coloração celular
NOTA: Para confirmar que o modelo de pele desenvolvido consiste nas células esperadas, é bom realizar a coloração celular. É uma etapa crucial antes que qualquer experimento alvo possa ser realizado em um determinado modelo22. No caso de modelos de pele 3D, é necessário embutir um determinado modelo em parafina e preparar lâminas microscópicas com o tecido artificial cortado em micrótomo (etapa 4.1) antes da coloração celular (Figura 7).
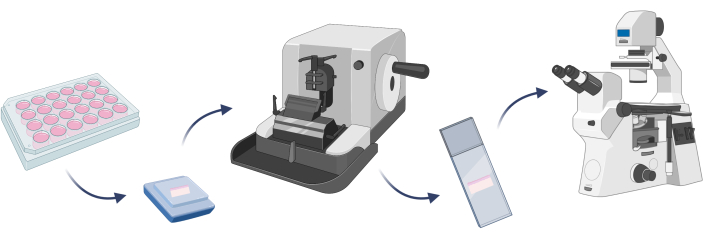
Figura 7: Etapas básicas de incorporação de um modelo de pele 3D, coloração de células e observações microscópicas. A figura foi criada com Biorender.com. Clique aqui para ver uma versão maior desta figura.
- Incorporação de modelos de pele 3D
- Lave o equivalente da pele com PBS por 5 min em RT duas vezes e fixe-o usando uma solução de paraformaldeído a 3,7% em PBS (30 min, RT). Repita a etapa de lavagem com PBS.
- Antes de incorporar, desidrate o equivalente da pele incubando em concentrações crescentes de soluções de etanol: 50% (15 min), 70% (15 min), 96% (2x, 30 min) e 99,8% (2x, 30 min).
- Coloque o equivalente de pele fixa e desidratada no molde preenchido com parafina.
NOTA: Coloque o equivalente em uma orientação apropriada. - Cubra o molde com o e adicione mais parafina por cima. Deixe solidificar por até 30 min em RT.
- Congelar o equivalente de pele embebido em parafina durante, pelo menos, 1 h a -80 °C.
- Ligue o micrótomo, insira o equivalente de pele embebido em parafina e corte fatias de 5 μm. Colocar as fatias de tecido artificial cortadas nas lâminas microscópicas e secá-las durante, pelo menos, 8 h a 37 °C.
- Mergulhe as lâminas em xileno (2x, 10 min) e, em seguida, reidrateie as lâminas com as concentrações decrescentes de etanol 99,8% (5 min), 96% (5 min), 70% (5 min) e 50% (5 min).
- Retire as lâminas da solução de etanol e lave-as duas vezes com água (5 min).
NOTA: A coloração celular tradicional é realizada pela aplicação de corantes específicos (hematoxilina, eosina23) ou usando anticorpos direcionados seletivamente a biomarcadores (incluindo colágeno 1A2 para fibroblastos, citoqueratina 14 para queratinócitos, melan-A ou tirosinase para melanócitos24). Uma coloração de hematoxilina e eosina de rotina pode ser feita seguindo os protocolos preparados por diferentes empresas (etapa 4.2). Por outro lado, se for necessária coloração imunofluorescente ou imuno-histoquímica, o procedimento é diferente e significativamente mais longo (etapas 4.3 e 4.4). Para evitar reações inespecíficas, use os anticorpos primários produzidos em diferentes espécies e, em seguida, os anticorpos secundários dedicados.
- Coloração de hematoxilina e eosina de modelos de pele 3D
- Manchar a lâmina microscópica em solução de hematoxilina por 3 min em RT.
- Lave as lâminas em uma solução de álcool acidificado por 1 min.
NOTA: Prepare a solução de álcool acidificado misturando 2 mL de ácido clorídrico a 35% -38% com 98 mL de álcool etílico a 99,8%. - Em seguida, lave a lâmina em solução de bicarbonato de sódio a 0,1% para obter uma cor azul-violeta visível e delicada.
NOTA: Para obter solução de bicarbonato de sódio a 0,1%, dissolva 100 mg de bicarbonato de sódio em 100 mL de água ultrapura. - Lave as lâminas com etanol a 95% por 1 min.
- Manchar a lâmina microscópica em solução de eosina durante 1 min à RT.
- Lave as lâminas com etanol a 95% por 1 min e etanol a 99,8% por 2 min.
- Lave as lâminas com xileno por 2 min cada duas vezes.
- Monte em bálsamo e coloque uma lamínula no topo do slide. As amostras estão prontas para observações microscópicas.
- Coloração imunofluorescente de modelos de pele 3D
- Enxágue a lâmina com PBS (5 min).
- Prepare a solução de bloqueio (albumina de soro bovino a 3% [BSA] ou leite desnatado em um tampão PBS com a adição de 0,1% de Triton X-100 e 0,1% de Tween 20) e incube a lâmina por 1 h em RT.
- Lave as lâminas duas vezes com um tampão PBS (5 min).
- Diluir o anticorpo primário no tampão PBS (de acordo com as recomendações do fabricante, Quadro 7) e incubar as lâminas durante 1-2 h em RT ou durante a noite a 4 °C.
- Lave as lâminas duas vezes com um tampão PBS (5 min).
- Diluir o anticorpo secundário no tampão PBS (de acordo com as recomendações do fabricante, Tabela 7) e incubar as lâminas por 1 h em RT.
- Lave as lâminas duas vezes com PBS (5 min).
- Prepare a solução de corante para a coloração dos núcleos (por exemplo, Hoechst 33342 ou DAPI, Tabela 7) e incube as lâminas por até 15 min em RT.
- Lave as lâminas com PBS (5 min).
- Monte em bálsamo, cubra a seção com uma lamínula e visualize os efeitos da coloração celular usando um microscópio fluorescente.
- Coloração imuno-histoquímica de modelos de pele 3D
- Execute as etapas 4.3.1 a 4.3.5.
- Além disso, execute uma etapa de lavagem com um tampão apropriado para a enzima com a qual o anticorpo secundário é conjugado.
- Diluir o anticorpo secundário num tampão adequado para a enzima conjugada (de acordo com as recomendações do produtor) e incubar as lâminas durante 1 h em RT.
- Lave as lâminas duas vezes com PBS (5 min).
- Preparar a solução de um substrato adequado para a enzima utilizada e incubar as lâminas de acordo com as recomendações do produtor.
- Lave as lâminas com um tampão (5 min) e monte-as em bálsamo.
- Visualize os efeitos da coloração celular usando microscopia de campo claro.
| Tipo de célula/organoide celular detectado | Agente de coloração | Dillution / Concentração | ||
| Mastócitos | Avidina-Sulforrodamina 101 | 1 μg/ml | ||
| Fibroblastos | Anticorpo Col1A2 produzido em coelho | 1:50 | ||
| Anticorpo secundário anti-coelho de cabra conjugado com FITC | 1:250 | |||
| Queratinócitos | Anticorpo citoqueratina 14 produzido em camundongo | 1:50 | ||
| Anticorpo secundário anti-camundongo de cabra conjugado com FITC | 1:250 | |||
| Melanócitos | Anticorpo Melan-A produzido em camundongo | 1:50 | ||
| Anticorpo secundário anti-camundongo de cabra conjugado com FITC | 1:250 | |||
| Núcleos | Hoechst 33342 | 1 μg/ml | ||
| DAPI | 1 μg/ml | |||
Quadro 7: Concentrações e diluições dos reagentes utilizados para a coloração celular.
Resultados
Antes de começar a criar modelos de pele em laboratório, deve-se tomar uma decisão sobre o tipo de células a serem utilizadas (primária/linhagem celular) e a seleção de um meio adequado para essas células. A maioria dos bancos de células recomenda e pode fornecer meios para todos os tipos de cultura de células. No caso de um modelo de multicultura, é necessário selecionar um meio que se adapte a todos os tipos de células presentes na cultura. Alguns meios celulares típicos usados tanto para a cultura primária de células da pele quanto para as linhagens celulares da pele mais comuns foram reunidos na Tabela 8 18,19,20,25,26,27. Os meios típicos usados para as culturas de células primárias são bastante caros e sua composição é complexa. Por outro lado, as linhagens celulares geralmente ficam satisfeitas com meios de composição simples. Alguns tipos celulares (principalmente fibroblastos e mastócitos) podem produzir e secretar fatores que estimulam o crescimento de outras células (como queratinócitos e melanócitos)28,29. Se sua presença em um modelo for planejada, a suplementação adicional do meio não é necessária.
| Tipo de célula | Nome da célula | Média | Referência | ||||
| Queratinócitos | Linha HaCaT cel | DMEM, 10% FBS, 100 U/mL de penicilina, 100 μg/mL de estreptomicina | De acordo com o vendedor | ||||
| primário Queratinócitos epidérmicos humanos normais (NHEK) | Meio de crescimento de queratinócitos 2 (meio basal + mistura de suplementos) | De acordo com o vendedor | |||||
| Queratinócitos Epidérmicos Humanos primários; Normal, Adulto (HEKa) | Meio Basal de Células Dérmicas, 0,4% de extrato de hipófise bovina, 0,5 ng/mL de fator de crescimento transformador rh-alfa, 6 mM de L-glutamina, 100 ng/mL de hidrocortisona Hemisuccinato, 5 mg/mL de insulina rh, 1 mM de epinefrina, 5 mg/mL de Apo-Transferrina, 100 U/mL de penicilina (se necessário), 100 μg/mL de estreptomicina (se necessário) | De acordo com o vendedor | |||||
| queratinócitos primários | DMEM/F-12 (3:1), Ultroser G a 1%, hidrocortisona 1 μM, isoproterenol 1 μM, insulina 0,1 μM, fator de crescimento de queratinócitos 1 ng/mL, penicilina-estreptomicina a 1% | 18 | |||||
| Melanócitos | melanócitos primários | Medium 254, suplemento de crescimento de melanócitos humanos livre de PMA-2, solução antibiótica a 1% | 19 | ||||
| melanócitos primários | RPMI-1640, FBS a 10%, solução de vermelho de fenol a 14,7 μg / mL, L-glutamina a 1%, penicilina / estreptomicina a 1% | 27 | |||||
| Linha celular HEMa-LP | Meio 254, 5 μg/mL de insulina rh, 50 μg/mL de ácido ascórbico, 6 mM de L-glutamina, 1 μM de epinefrina, 1,5 mM de cloreto de cálcio, 100 U/mL de penicilina (se necessário), 100 μg/mL de estreptomicina (se necessário) | De acordo com o vendedor | |||||
| Melanócitos epidérmicos humanos normais primários (NHEM) | Meio de crescimento de melanócitos (meio basal + mistura de suplementos) | De acordo com o vendedor | |||||
| Fibroblastos | fibroblastos primários de tenon humano (HTFs) | EMEM, 5% FBS, 5 ng/mL rh-fator de crescimento de fibroblastos básicos, 5 μg/mL rh-insulina, 50 μg/mL de ácido ascórbico, 7 mM de L-glutamina, 100 U/mL de penicilina, 100 μg/mL de estreptomicina, 0,25 μg/mL de anfotericina B | 28 | ||||
| HTFs primários e | DMEM, 10% FBS, penicilina 100 U/mL, estreptomicina 100 μg/mL, anfotericina B 0,25 μg/mL | 20.28 | |||||
| fibroblastos dérmicos humanos primários | |||||||
| Linha celular HFF-1 | DMEM, 15% FBS, penicilina 100 U/mL, estreptomicina 100 μg/mL | De acordo com o vendedor | |||||
| Linha celular BJ | EMEM, 10% FBS, 100 U/mL de penicilina, 100 μg/mL de estreptomicina | De acordo com o vendedor | |||||
| Mastócitos | mastócitos primários da pele humana (hsMCs) | IMDM, 10% FBS, 1% aminoácidos não essenciais, 226 μM α-monotioglicerol, 100 U/mL de penicilina, 100 μg/mL de estreptomicina | 20 | ||||
| Linha celular LAD2 | StemPro-34, suplemento nutritivo StemPro-34 a 2,5%, L-glutamina 2 mM, fator de células-tronco rh 100 ng/mL, penicilina 100 U/mL, estreptomicina 100 μg/mL | 29 | |||||
| Linhagens celulares HMC-1.1 e 1.2 | IMDM, 10% FBS, 2 mM de L-glutamina, 25 mM de HEPES, 100 U / mL de penicilina, 100 μg / mL de estreptomicina | 29 | |||||
Tabela 8: Uma visão geral dos meios mais usados para cultura de células primárias da pele e linhagens celulares.
Legenda: Meio Essencial Mínimo de Dulbecco (DMEM), Meio Essencial Mínimo de Eagle (EMEM), Soro Fetal Bovino (FBS), Mistura de Nutrientes F-12 de Ham (F12), Meio de Dulbecco Modificado de Iscove (IMDM), humano recombinante (rh), Roswell Park Memorial Institute (RPMI).
Neste artigo, foram criados modelos de pele com as células primárias de queratinócitos, melanócitos, fibroblastos e mastócitos. Eles são um pouco mais exigentes do que as linhagens celulares, e os meios recomendados para sua cultura, que foram usados para cultura unicelular, são: meio de crescimento de queratinócitos suplementado 2 (para queratinócitos), meio suplementado 254 (para melanócitos), meio DMEM suplementado (para fibroblastos) e meio IMDM suplementado (para mastócitos). Nesses meios, as células apresentam sua morfologia típica atribuída ao seu tipo (imagens representativas são mostradas na Figura 8). No caso de multiculturas de dois ou mais tipos de células, era importante escolher um meio no qual todos os tipos de células cultivadas pudessem crescer. Após alguns testes, um meio DMEM com 10% de FBS e uma mistura de antibiótico a 1% foi selecionado para a preparação dos modelos 3D mais avançados de esferas e equivalentes.
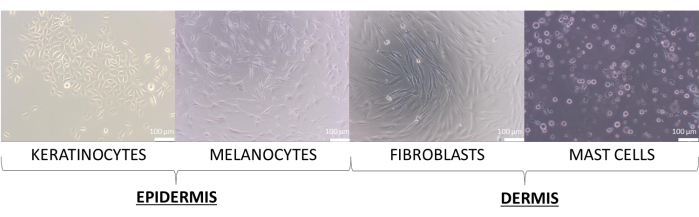
Figura 8: As células da pele apresentam morfologia diferente observada durante a monocultura 2D. Barras de escala: 100 μm. Clique aqui para ver uma versão ampliada desta figura.
As esferas (comumente chamadas de esferoides) são um dos modelos 3D mais simples desenvolvidos por pesquisadores de engenharia celular e de tecidos, embora as esferas criadas a partir de células da pele não sejam tão populares. Dentro desse modelo, é possível a criação de esferas mono e multicultura. Vários métodos para preparação de esferas (por exemplo, com uma gota suspensa, limitando a adesão celular, levitação magnética, rotação, microfluídica, etc.) foram descritos na literatura30. Devido à facilidade de preparação, baixo custo, materiais e equipamentos prontamente disponíveis, os dois primeiros métodos são recomendados para iniciantes em modelos de células tridimensionais (3D) e os protocolos para seu desempenho podem ser encontrados acima (etapas 2.1 e 2.2). De acordo com a literatura31,32, os parâmetros mais importantes nesses métodos são o número de células, o volume da suspensão celular e o tempo de incubação.
As esferas podem ser criadas com diferentes números de células, mas a densidade celular para semeadura deve ser otimizada para cada tipo de célula separadamente, bem como para co-culturas de células. O processo de otimização conduzido para monoculturas de queratinócitos e fibroblastos revelou que a semeadura de 1 x 104 células por poço proporcionou os melhores resultados para ambos os tipos celulares. As esferas apresentadas na Figura 9 foram preparadas usando o método de limitação da adesão celular nas placas de fundo em U (etapa 2.2). É aconselhável preparar pelo menos 4 poços com repetições técnicas (o ideal é 6 poços). Esferas consistindo de 1 x 104 células eram mais fáceis de manipular, pois eram visíveis nos poços. Como consequência, foi possível até mesmo remover o meio antigo dos poços durante os ensaios sem drenar as esferas. Após as operações descritas, as formas das esferas permaneceram praticamente inalteradas e repetíveis. A estabilidade de esferas maiores foi baixa durante o processo. Também vale a pena mencionar que diferentes tipos de células podem formar esferas de cores diferentes (por exemplo, os queratinócitos formam esferas mais escuras, enquanto as esferas de fibroblastos são significativamente mais claras).
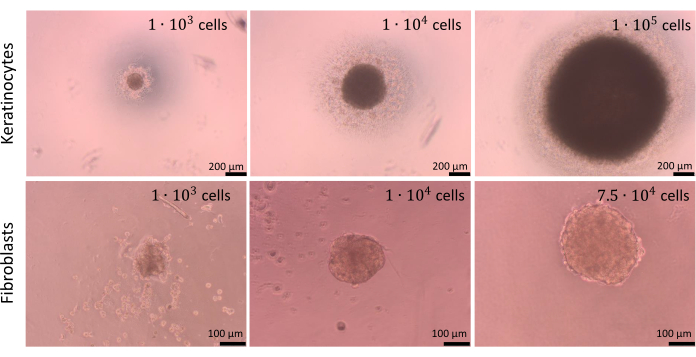
Figura 9: Criação de esferas. Esferas criadas por diferentes tipos e números de células da pele com o uso do método de adesão celular limitante. Barras de escala (painel superior): 200 μm. Barras de escala (painel inferior): 100 μm. Clique aqui para ver uma versão maior desta figura.
Conforme mencionado no método de gota suspensa (etapa 2.1), em um determinado ponto, as esferas precisam ser transferidas da tampa para o poço. Este processo pode ser potencialmente prejudicial para as esferas. Assim, para esta etapa, é essencial uma alta precisão do trabalho. As esferas criadas são propensas a perder a forma adequada se não forem manuseadas com cuidado (Figura 10). A primeira imagem (Figura 10A) apresenta uma boa esfera igualmente arredondada em todos os lados. Na segunda e terceira imagens (Figura 10B, C) foi observada uma leve perda de forma pela esfera, mas o agregado celular permanece arredondado. As últimas três imagens (Figura 10D-F) mostram diferentes fases de dano à esfera. É necessário ganhar experiência para obter a repetibilidade das formas e estruturas das esferas criadas. Com as primeiras tentativas de desenvolvimento das esferas, recomenda-se o uso do método de limitação da adesão celular para pesquisadores inexperientes (etapa 2.2), pois fornece resultados mais comparáveis com a influência limitada da atividade do pesquisador.
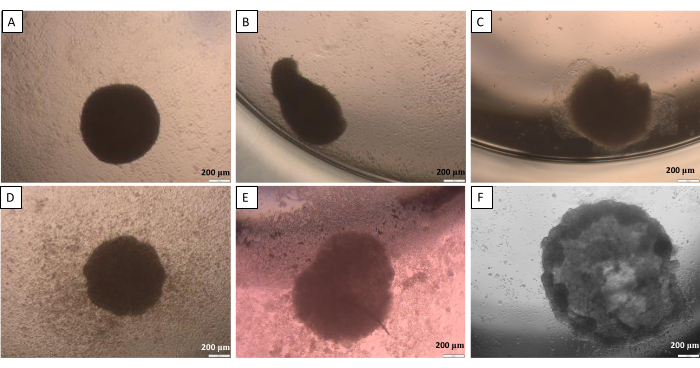
Figura 10: Possíveis dificuldades na transferência de esferas da tampa para o poço - o método da gota suspensa. (A) uma boa esfera, (B,C) esferas ligeiramente danificadas, (D-F) esferas altamente danificadas. As imagens foram realizadas 24 h após a transferência. Barras de escala: 200 μm. Clique aqui para ver uma versão maior desta figura.
Os equivalentes são modelos 3D muito mais avançados de pele artificial do que esferas. Durante o processo de construção de um modelo de pele, vários aspectos devem ser considerados, incluindo o número de camadas no modelo (apenas epiderme, apenas derme, derme com epiderme e estrato córneo), tipos de células utilizadas, materiais aplicados, tamanho preferencial do equivalente, tipo de pesquisa em que será posteriormente utilizado, etc.14. Os equivalentes de pele podem ser dispostos em insertos especiais colocados nas placas padrão de vários poços de um tamanho desejado (96, 48, 24 poços, etc.). Embora as pastilhas sejam mais fáceis de transferir de um poço para outro e durante a troca do meio, o equivalente não pode ser danificado; eles são muito caros. Se o modelo não requer a presença do estrato córneo, uma solução mais barata é preparar o equivalente em um poço da placa de vários poços.
A camada dérmica artificial é tipicamente construída como um modelo baseado em andaime usando hidrogéis naturais (gelatina, colágeno, fibrina, ácido hialurônico, quitosana-alginato, etc.) ou sintéticos (diacrilato de polietilenoglicol e ácido polilático)33. Para ser semelhante à derme da pele real, essa camada deve conter principalmente água com alguns componentes da matriz extracelular (MEC) (incluindo colágeno ou fibronectina), que medeiam a ligação celular, as interações célula-célula e outras ações celulares34. Nesta pesquisa, o colágeno tipo I foi selecionado por ser fácil de preparar na forma de hidrogel, e sua estrutura flexível garante a facilidade de outras atividades de pesquisa em potencial (por exemplo, transferência do equivalente de um prato para outro). A solução de colágeno tipo I obtida da cauda de rato é normalmente preparada por dissolução do pó em ácido acético 20 mM. Para atingir a etapa de polimerização do colágeno, é necessário fornecer condições de pH apropriadas variando de 6,5 a 7,5. Isso pode ser garantido pela adição de uma quantidade estrita de hidróxido de sódio. Para facilitar, algumas empresas introduziram cálculos específicos, que podem ajudar a determinar os volumes exatos necessários para preparar esses hidrogéis (Tabela 6). Embora na literatura possam ser encontradas diferentes concentrações de colágeno nos hidrogéis (por exemplo, 0,5-2 mg/mL35; 5-30 mg/mL36; baixo e alto teor de colágeno37), no modelo descrito, a solução de 2 mg/mL foi usada, pois o hidrogel ainda tinha uma estrutura flexível, mas era compacto o suficiente para ser removido do poço, se necessário.
Para preparar uma pele de espessura total bastante realista, células equivalentes devem ser semeadas na proporção possivelmente mais próxima da presente em nosso corpo. No caso da epiderme, dependendo do local do corpo, a relação entre um melanócito e um pool de queratinócitos associados é uma proporção de cerca de 1:36, que é definida como a Unidade de Melanina Epidérmica (EMU)38. Assim, a proporção aplicada na epiderme artificial foi de 1 melanócito para 15 queratinócitos (Tabela 5). Para criar uma camada dérmica artificial, foi utilizado o hidrogel de colágeno tipo 1, no qual fibroblastos e mastócitos foram incorporados na proporção de 1 mastócitos para 10 fibroblastos. Cada camada do equivalente construído pode ser monitorada em tempo real no microscópio óptico invertido, alterando a profundidade da amostra observada (imagens exemplares são mostradas na Figura 11).
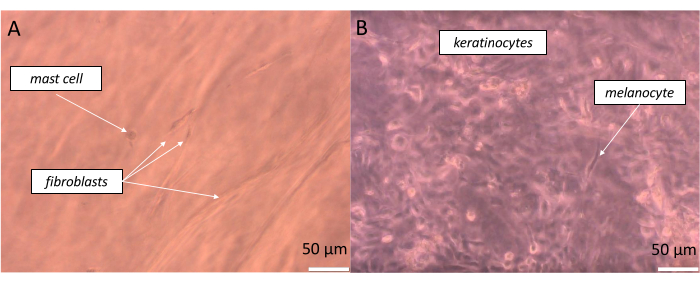
Figura 11: Observação em tempo real de diferentes células em camadas específicas do equivalente de pele de espessura total criado. (A) pseudo-derme e (B) pseudo-epiderme) conforme visualizado pela microscopia de campo claro. Barras de escala: 50 μm. Clique aqui para ver uma versão maior desta figura.
Observações mais precisas com a confirmação da obtenção da estrutura pretendida do modelo podem ser feitas realizando a coloração do equivalente. O equivalente fixo precisa ser primeiro embebido em parafina e depois cortado em um micrótomo. As lâminas com tecido artificial fino podem ser posteriormente coradas com diferentes corantes, incluindo hematoxilina e eosina (coloração básica realizada em laboratórios médicos). Graças a essa ação, é possível distinguir a derme artificial e a epiderme nos equivalentes, bem como identificar células individuais da pele (Figura 12). Na Figura 12, não apenas os tipos celulares específicos são mostrados, mas também é possível ver os queratinócitos em diferentes fases do processo de divisão celular (telófase e metáfase). No caso dos mastócitos, grânulos específicos são bem reconhecíveis dentro da célula. Essas imagens confirmam inicialmente que o equivalente da pele criado está vivo (as células estão crescendo nela) e são capazes de funcionar normalmente no modelo desenvolvido. No entanto, com a epiderme 3D e os modelos de espessura total da pele, é especialmente importante verificar a qualidade e a funcionalidade da construção obtida. Para verificar a permeabilidade do estrato córneo, devem ser aplicadas as medidas de resistência elétrica transepitelial (TEER) ou coloração amarelo-lúcifer39,40. Além disso, em uma pele artificial adequadamente composta, marcadores específicos devem estar presentes, incluindo marcadores de diferenciação (por exemplo, Filaggrina, Involucrina, Loricrina, Queratina 10, Queratina 5, classes lipídicas que compreendem ceramidas), marcadores de junção dermoepidérmica (por exemplo, colágeno tipo IV, Laminina V, Alfa6Beta4-integrina, antígeno BP)41, marcadores de junção apertada nas camadas epidérmicas (por exemplo, claudina-1, oclusina, proteína zonula occludens (ZO)-1)42 bem como marcadores de proliferação da camada basal (Ki67)41.

Figura 12: Morfologia e funcionamento das células da pele. Visão geral da morfologia e funcionamento das células da pele (observação de divisões celulares) no equivalente cutâneo de espessura total corado com hematoxilina e eosina. Barras de escala: 100 μm (painel superior), 50 μm (painel central, esquerda), 100 μm (painel central, direita), 50 μm (painel inferior). Clique aqui para ver uma versão maior desta figura.
A forma mais utilizada para confirmar a presença de um biomarcador é através da realização de colorações específicas, como imuno-histoquímica ou imunofluorescente. Diferentes anticorpos e corantes fluorescentes podem ser aplicados para visualização microscópica de células específicas nos modelos. O resultado da coloração exemplar de células em cultura pode ser visto na Figura 13. Para observar os queratinócitos, foi utilizado um anticorpo contra a citoqueratina 14. No caso dos melanócitos, foi um anticorpo específico para melan-A. O anticorpo colágeno 1A2 foi usado para corar fibroblastos e a sulforodamina fluorescente 101 conjugada com avidina detectou heparina presente nos mastócitos.
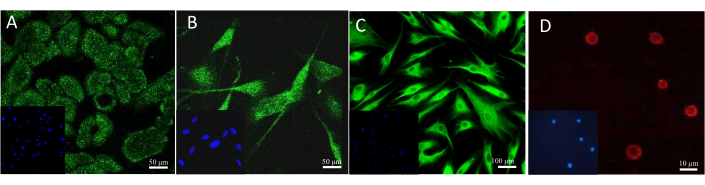
Figura 13: Resultados da coloração de células fluorescentes. (A) Citoqueratina 14 em queratinócitos. Barra de escala: 50 μm. (B) Melan-A em melanócitos. Barra de escala: 50 μm. (C) Colágeno 1A2 em fibroblastos. Barra de escala: 100 μm. (D) Heparina em mastócitos. Barra de escala: 10 μm. Clique aqui para ver uma versão ampliada desta figura.
Discussão
Este artigo apresenta a metodologia que pode ser aplicada para preparar os próprios modelos avançados de pele artificial. É uma boa solução sempre que a pesquisa planejada precisa de modelos de pesquisa estritamente definidos que podem vir a ser indisponíveis no mercado ou muito caros. Como mencionado anteriormente, vários equivalentes comerciais de pele estão disponíveis no mercado (por exemplo, EpiSkin, EpiDerm FT). No entanto, seu custo (€ 100 a € 400 por peça) e o prazo de entrega (alguns dias-semanas) podem encorajar o pesquisador a tentar preparar esse modelo por conta própria. Os procedimentos propostos são fáceis de realizar mesmo para cientistas inexperientes e, ao mesmo tempo, permitem obter modelos de pele muito avançados. Vale ressaltar que a decisão sobre a composição celular de um determinado modelo é totalmente dependente do pesquisador. Além do modelo criado, ele pode ser desenvolvido e aprimorado, o que abre perspectivas de pesquisa completamente novas. No caso de modelos comerciais, é necessário comprar um equivalente diferente.
Embora as culturas de células 3D possam ser avançadas com vários tipos de células, fáceis de manusear e acessíveis, elas ainda são apenas modelos artificiais que não podem recriar totalmente a complexidade e a funcionalidade do tecido (por exemplo, funções imunológicas, vascularização). É por isso que, na maioria dos estudos, vários modelos são necessários para confirmar os resultados obtidos. Algumas vantagens e desvantagens desses modelos foram reunidas na Tabela 9, bem como suas limitações. Por outro lado, os modelos comerciais garantem altos padrões qualitativos com reprodutibilidade dos experimentos e comparabilidade dos dados entre os laboratórios. Para implementar o uso de um novo composto para pesquisa, certamente será necessário adquirir o equivalente comercial adequado. Mas, na fase preparatória, esse modelo 3D feito por você mesmo da pele (esfera do tipo multicelular ou equivalente) pode ajudar a reduzir o número de experimentos necessários para serem realizados em um equivalente comercial. O objetivo de produzir e usar os modelos descritos não é contornar a necessidade de aplicar modelos de pesquisa certificados, mas facilitar a pesquisa e reduzir as despesas relacionadas.
| Par de modelos comparados | Vantagens | Desvantagens | ||||
| Cultura de células vs. animais | Sofrimento animal minimizado | Informações limitadas sobre a influência de um fator testado em todo o corpo | ||||
| Alta padronização do experimento - melhor reprodutibilidade dos resultados | Um único modelo não é suficiente para refletir os processos que ocorrem no corpo | |||||
| Sem efeitos colaterais para todo o organismo | - | |||||
| Melhor controle sobre as condições do experimento | - | |||||
| Possibilidade de automatização (por exemplo, bioimpressão) | - | |||||
| Custos mais baixos | - | |||||
| O tamanho pequeno da amostra necessária | - | |||||
| Quantidade limitada de resíduos gerados | - | |||||
| Culturas 3D vs. 2D | Refletir melhor o organismo completo | Cultura demorada | ||||
| Possibilidade de criar um tecido funcional | Custos mais altos | |||||
| Possibilidade de criar um modelo adaptado às necessidades da pesquisa realizada | A formação espontânea de uma estrutura 3D quase não é possível | |||||
| - | Falta de testes padronizados para quantificar os efeitos de vários compostos | |||||
| - | Acesso limitado a diferentes culturas 3D disponíveis no mercado | |||||
| Linha celular vs. células primárias | Modelos certificados e aprovados | Apenas um número limitado de linhagens celulares está disponível | ||||
| Alta padronização do experimento - melhor reprodutibilidade dos resultados | Possibilidade limitada de obter vários tipos de células do mesmo doador | |||||
| Vida útil mais longa | Pode possuir propriedades alteradas das células nativas | |||||
| Taxa de proliferação bastante rápida | Funcionalidade frequentemente perturbada das células | |||||
| Menos sensível a várias atividades (por exemplo, congelamento, centrifugação) | - | |||||
Tabela 9: Comparação do uso de diferentes modelos em pesquisa - vantagens vs. desvantagens
Vários artigos descrevem como preparar modelos de pele 3D (além de artigos de revisão resumindo modelos disponíveis comercialmente 14,43,44, eles geralmente são focados em uma única metodologia para obter esferas 45 ou equivalentes46).
Neste artigo, foram descritas duas metodologias para a formação de esferas com células da pele. O método de gota suspensa é amplamente utilizado, mas sua repetibilidade e estabilidade podem ser insuficientes em alguns casos. A maioria das etapas requer ações específicas, como trabalho em alta velocidade devido à evaporação da água das gotículas durante a transferência. Movimentos suaves também são recomendados, pois a falta dessa habilidade pode resultar em danos aos agregados celulares 31,32. Assim, um método mais fácil para a preparação da esfera é focado em limitar a adesão celular. A ausência de uma boa superfície para a fixação celular promove maiores interações entre as células. Como consequência, agregados celulares são gerados. Sua repetibilidade é muito maior, pois não há necessidade de transferência de esfera. Com esses métodos, o número ideal de células da pele para criar uma esfera foi estabelecido em 1 x 104 células/esfera.
Em seguida, foram apresentados procedimentos que descrevem a preparação de equivalentes cutâneos. Sua aparência e funcionalidade em pesquisa podem depender fortemente dos elementos a partir dos quais são construídos, incluindo células (Tabela 2), andaimes e mídias. Os andaimes 3D usados para a preparação de pele artificial podem ser divididos em hidrogéis sintéticos e aqueles formados a partir de fontes naturais. Dependendo do material utilizado e de suas propriedades para compor o hidrogel, pode ocorrer a necessidade de suplementar adicionalmente o meio. Os hidrogéis sintéticos requerem a incorporação de moléculas bioativas (proteínas, enzimas e fatores de crescimento) na rede de hidrogéis sintéticos para mediar funções celulares específicas47. As principais abordagens apresentadas na literatura para a entrega controlada de fatores de crescimento aos hidrogéis incluem carga direta, interação eletrostática, ligação covalente e uso de carreadores48. Hidrogéis formados a partir de fontes naturais, como proteínas e polímeros ECM, podem gerar vias de fluido em todo o andaime 3D, acelerando a distribuição de nutrientes; Assim, não há necessidade de suplementação adicional do meio. Investigações mostraram que pequenas moléculas (como citocinas e fatores de crescimento) e macromoléculas (incluindo glicosaminoglicanos e proteoglicanos) podem ser transportadas através da MEC por difusão47. No entanto, a difusão molecular de oxigênio, nutrientes e outras moléculas bioativas pode ser prejudicada pelas propriedades do próprio hidrogel da MEC. A menor difusão foi correlacionada com a maior espessura do hidrogel, mas também com uma concentração muito alta de colágeno37. Neste estudo, para criar o equivalente cutâneo, foi utilizada uma baixa concentração de colágeno igual a 2 mg/mL, o que sugere que a difusão molecular através do hidrogel deve ser boa e rápida. Assim, nenhuma suplementação adicional ao meio nesta fase nem ao hidrogel em si foi fornecida. Para mimetizar a derme, mastócitos e fibroblastos (1:10) foram incorporados ao hidrogel de colágeno. Em seguida, melanócitos e queratinócitos (1:15) foram semeados no hidrogel e todo o equivalente foi cultivado no meio. Vale ressaltar que o meio básico é composto por vários aminoácidos, ácidos inorgânicos e vitaminas, e é adicionalmente suplementado com soro (composto por múltiplos: fatores de crescimento e fixação para células, lipídios, hormônios, nutrientes e fontes de energia, transportadores, proteínas de ligação e transferência, etc.). Para obter a estrutura adequada da epiderme, diferentes suplementos ao meio devem ser adicionados em um determinado momento. O estimulador mais importante para iniciar a diferenciação epidérmica é o cálcio, pois ativa a sinalização intracelular. O ácido ascórbico estimula uma via de sinalização semelhante à mediada pelo cálcio, mas seu efeito também é acompanhado por um transporte aprimorado de ascorbato e prevenção da depleção de antioxidantes hidrofílicos41. Além disso, a diferenciação das células foi melhorada quando outros componentes foram adicionados ao meio (como cafeína, hidrocortisona, triiodotironina, adenina e toxina do cólera)41,44. É importante que os modelos preparados sejam sempre verificados quanto à presença de um determinado tipo de célula na camada apropriada. A presença de todos os quatro tipos de células da pele foi confirmada na estrutura do equivalente criado pela coloração H & E.
O problema mais comum encontrado é a delicadeza e intuição no manuseio dos modelos obtidos. Algumas dificuldades podem estar relacionadas com a formação da esfera celular, bem como com a preparação do hidrogel. Durante a cultura de células, vários outros problemas também podem ocorrer; estes incluem infecções microbianas, baixa taxa de proliferação de células, envelhecimento das células primárias usadas nos modelos, tempo máximo de cultivo de modelos 2D e 3D reconstruídos a partir de células primárias vs. linhagens celulares, etc. Na Tabela 10, foram reunidos alguns conselhos práticos sobre o que fazer quando um dos seguintes problemas é encontrado.
| Problemas comuns em cultura de células | Sugestões | |||
| Infecção microbiana | Se ocorrer uma infecção microbiana em um dos frascos/placas com células, é melhor remover a cultura infectada o mais rápido possível (para não contaminar os frascos/placas restantes com células). Congele novamente um novo frasco para injetáveis com células. Se a infecção retornar, é bom tentar ampliar o espectro dos antibióticos aplicados e aumentar sua concentração. | |||
| Baixa taxa de proliferação de células | Algumas células têm um longo tempo de duplicação. Para estimular sua proliferação, vários fatores de crescimento específicos da célula podem ser adicionados ao meio básico. Além disso, aumentar a concentração de FBS ou L-glutamina no meio basal pode ajudar a estimular o crescimento das células. | |||
| Envelhecimento das células primárias usadas nos modelos | Após algumas passagens, as células primárias entram em senescência e param de se dividir. Para superar esse problema nos modelos, recomenda-se usar as células desde a passagem mais precoce possível para construir o modelo. | |||
| Tempo máximo de cultivo de modelos 2D e 3D reconstruídos a partir de células primárias vs. linhagens celulares | O tempo de cultivo de um modelo depende fortemente do tipo de células utilizadas. Com células primárias, o tempo de cultivo será menor devido à sua curta vida útil. | |||
| Dificuldades na formação da esfera celular | Algumas células podem exigir mais tempo para a formação de esferas. Se depois de mais alguns dias as esferas não tiverem sido formadas, colete as células da amostra e verifique sua viabilidade com, por exemplo, coloração com azul de tripano. | |||
| Problemas com a estabilidade da esfera | Se as esferas não estiverem estáveis e forem destruídas durante o manuseio, tente criar esferas a partir de um número menor de células. Certifique-se de sempre transferir suavemente os pratos em que as esferas estão crescendo. | |||
| Dificuldades com a preparação do hidrogel | Verifique se a proporção dos ingredientes (água, PBS [10x], NaOH, colágeno tipo 1) estava correta. A solução estoque de colágeno geralmente é muito densa, portanto, certifique-se de pipetá-la lentamente. As bolhas de ar perturbam a morfologia do hidrogel, portanto, a pipetagem reversa do gel pode ajudar com esse problema. | |||
Tabela 10: Solução de problemas de cultura de células
Os modelos estabelecidos após a fabricação podem ser usados em vários campos, começando com (1) experimentos de citotoxicidade e genotoxicidade de novos compostos com atividade biológica para uso em medicamentos e cosméticos49, (2) experimentos com estimulação de vários fatores50, (3) pesquisa básica aumentando nosso conhecimento sobre células da pele, suas funções biológicas, interações com outras células e o meio ambiente51, 52, (4) pesquisa sobre entidades de doenças selecionadas onde um tipo específico de célula pode ser introduzido no modelo criado (células cancerígenas, células com uma mutação em um determinado gene, etc.14,53) e muito mais. É desnecessário dizer que a aplicação desses modelos está de acordo com o princípio dos 3Rs para uso mais ético de animais em testes de produtos e pesquisas científicas e não viola a lei de proibição de testes de produtos cosméticos em animais.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Os autores agradecem o apoio financeiro dado pela Universidade Tecnológica de Varsóvia do programa 'Iniciativa de Excelência - Universidade de Pesquisa' na forma de duas bolsas: POB BIB BIOTECHMED-2 start (nº 1820/2/ZO1/POB4/2021) e a bolsa do Reitor para Grupos de Pesquisa de Estudantes (SKIN-ART, nº 1820/116/Z16/2021). Além disso, os autores gostariam de agradecer o apoio recebido da Prof. Joanna Cieśla e da Cátedra de Biotecnologia de Medicamentos e Cosméticos, bem como do Clube de Ciências da Biotecnologia 'Herbion' da Faculdade de Química da Universidade de Tecnologia de Varsóvia. Agradecimentos especiais ao Dr. Michał Stepulak por fornecer o composto Pluronic F-127.
Materiais
| Name | Company | Catalog Number | Comments |
| 24-well plate for adherent cell culture | Biologix Europe GmbH | 07-6024 | - |
| 35%–38% HCL | Chempur | 115752837 | - |
| 60 mm cell culture Petri dish | Nest | 705001 | - |
| Avidin−Sulforhodamine 101 | Sigma Aldrich | A2348-5MG | - |
| Bright-field inverted microscope | Olympus | CKX41 | - |
| Calcium chloride | Avantor | 874870116 | - |
| Cell culture flask T75 for adherent cells | Genoplast | G77080033 | - |
| Centrifuge tube 15 mL | GoogLab Scientific | G66010522 | - |
| CO2 Incubator | Heal Force | Galaxy 170R | - |
| Col1A2 antibody produced in rabbit | Novus | NBP2-92790 | - |
| Corning(R) Transwell(R) Polycarbonate | Corning | CLS3422-48EA | - |
| Cytokeratin 14 antibody produced in mouse | Novus | NBP1-79069 | - |
| DPX Mountant for histology | Sigma Aldrich | 06522-100ML | - |
| Dulbecco's Modified Eagle Medium (DMEM) | VWR Chemicals | L0102-500 | - |
| Eosine Y | Kolchem | - | 0.5 % aquatic solution |
| Eppendorf tube 1.5 mL | Sarstedt | 72.690.001 | - |
| Eppendorf tube 2 mL | Sarstedt | 72.691 | - |
| Ethyl alcohol absolute 99.8% | Avantor | 396480111 | diluted in ultrapure water to the needed concentrations |
| Fetal bovine serum | Gibco | 10270106 | - |
| Fluorescent inverted microscope | Olympus | IX71 | - |
| Goat anti-mouse secondary antibody conjugated with FITC | Sigma Aldrich | F0257-1mL | |
| Goat anti-rabbit secondary antibody conjugated with FITC | Novus | NB7159 | - |
| Harris Hematoxylin | Kolchem | - | 1 mg/mL in 95% ethanol |
| Hoechst 33342 | ThermoFisher | H3570 | - |
| Laminar chamber | Heal Force | HFSafe-1200 | - |
| Melan-A antibody produced in mouse | Santa Cruz Biotechnology | sc-20032 | - |
| Microtome | Microm | HM355S | - |
| NaOH | Avantor | 810981997 | - |
| Paraffin pastilles | Sigma Aldrich | 1.07164 | - |
| Paraformaldehyde | Sigma Aldrich | 1581227 | - |
| Penicillin/Streptomycin solution | Sigma Aldrich | P4333 | - |
| Pipette tip, 1000 µL | Sarstedt | 70.305 | - |
| Pipette tip, 20 µL | Sarstedt | 70.3021 | - |
| Pipette tip, 200 µL | Sarstedt | 70.303 | - |
| Pluronic F-127 | BASF | 50401036 | - |
| Serological pipette 10 mL | GoogLab Scientific | G33270011 | - |
| Serological pipette 25 mL | GoogLab Scientific | G33280011 | - |
| Serological pipette 5 mL | GoogLab Scientific | G33260011 | - |
| Sodium bicarbonate | Sigma Aldrich | S5761 | - |
| Sodium bicarbonate | Chempur | 118105307 | |
| Trypsin-EDTA 0.25% solution, phenol red | Sigma Aldrich | 25200072 | - |
| Type 1 collagen | IBIDI | 50201 | - |
| U-bottom 96-well plate | Sarstedt | 83.3925500 | - |
| Xylene | Sigma Aldrich | 534056 | - |
Referências
- Farage, M. A., Miller, K. W., Elsner, P., Maibach, H. I. Characteristics of the aging skin. Advances in Wound Care. 2 (1), 5-10 (2013).
- Zhu, H., Alikhan, A., Maibach, H. I. Biology of Stratum Corneum: Tape Stripping and Protein Quantification. Textbook of Aging Skin. Farage, M. A., Miller, K. W., Maibach, H. I. , Springer Berlin Heidelberg. Berlin, Heidelberg. (2015).
- Boer, M., Duchnik, E., Maleszka, R., Marchlewicz, M. Structural and biophysical characteristics of human skin in maintaining proper epidermal barrier function. Postepy Dermatogogii I Alergologii. 33 (1), 1-5 (2016).
- De Falco, M., Pisano, M. M., De Luca, A. Embryology and Anatomy of the Skin. In Skin Cancer: A Practical Approach. Current Clinical Pathology. Baldi, A., Pasquali, P., Spugnini, E. P. , Springer. New York. (2014).
- Dehdashtian, A., Stringer, T. P., Warren, A. J., Mu, E. W., Amirlak, B., Shahabi, L. Anatomy and Physiology of the Skin. Melanoma: A Modern Multidisciplinary Approach. Riker, A. I. , Springer International Publishing: Cham. 15-26 (2018).
- Graham, H. K., Eckersley, A., Ozols, M., Mellody, K. T., Sherratt, M. J. Human Skin: Composition, Structure and Visualisation Methods. Skin Biophysics; Studies in Mechanobiology, Tissue Engineering, and Biomaterials. Limbert, G. 22, Springer International Publishing: Cham. 1-18 (2019).
- Piasek, A. M., Musolf, P., Sobiepanek, A. Aptamer-based advances in skin cancer research. Current Medicinal Chemistry. 30 (8), 953-973 (2023).
- Bergfeld, W. F., Belsito, D. V., Marks, J. G., Andersen, F. A. Safety of ingredients used in cosmetics. Journal of the American Academy of Dermatology. 52 (1), 125-132 (2005).
- Hubrecht, R. C., Carter, E. The 3Rs and humane experimental technique: Implementing change. Animals. 9 (10), 754(2019).
- Sreedhar, D., Manjula, N., Ajay, P., Shilpa, P., Ligade, V. Ban of cosmetic testing on animals: A brief overview. International Journal of Current Research and Review. 12 (14), 113-116 (2020).
- Silva, R. J., Tamburic, S. A state-of-the-art review on the alternatives to animal testing for the safety assessment of cosmetics. Cosmetics. 9 (5), 90(2022).
- Xu, Y., Shrestha, N., Préat, V., Beloqui, A. An overview of in vitro, ex vivo and in vivo models for studying the transport of drugs across intestinal barriers. Advanced Drug Delivery Reviews. 175, 113795(2021).
- Boelsma, E., Ponec, M. Basics (Guidelines) on Cell Culture Testing for Topical/Dermatological Drugs/Products and Cosmetics With Regard to Efficacy and Safety of the Preparations. In Dermatopharmacology of Topical Preparations. Gabard, B., Surber, C., Elsner, P., Treffel, P. , Springer Berlin Heidelberg. Berlin, Heidelberg. 37-57 (2000).
- Suhail, S., Sardashti, N., Jaiswal, D., Rudraiah, S., Misra, M., Kumbar, S. G. Engineered skin tissue equivalents for product evaluation and therapeutic applications. Biotechnology Journal. 14 (7), 1900022(2019).
- Sobiepanek, A., et al. Novel diagnostic and prognostic factors for the advanced melanoma based on the glycosylation-related changes studied by biophysical profiling methods. Biosensors and Bioelectronics. 203, 114046(2022).
- Yang, H., Sun, L., Liu, M., Mao, Y. Patient-derived organoids: A promising model for personalized cancer treatment. Gastroenterology Report. 6 (4), 243-245 (2018).
- Baran, J., et al. Mast cells as a target-A comprehensive review of recent therapeutic approaches. Cells. 12 (8), 1187(2023).
- Kosten, I. J., Buskermolen, J. K., Spiekstra, S. W., de Gruijl, T. D., Gibbs, S. Gingiva equivalents secrete negligible amounts of key chemokines involved in langerhans cell migration compared to skin equivalents. Journal of Immunology Research. 2015, 627125(2015).
- cieżyńska, A., et al. A novel and effective method for human primary skin melanocytes and metastatic melanoma cell isolation. Cancers. 13 (24), 6244(2021).
- Kröger, M., et al. In vivo non-invasive staining-free visualization of dermal mast cells in healthy, allergy and mastocytosis humans using two-photon fluorescence lifetime imaging. Scientific Reports. 10 (1), 14930(2020).
- Liu, D., Chen, S., Win Naing, M. A review of manufacturing capabilities of cell spheroid generation technologies and future development. Biotechnology and Bioengineering. 118 (2), 542-554 (2021).
- Rossi, A., Appelt-Menzel, A., Kurdyn, S., Walles, H., Groeber, F. Generation of a three-dimensional full thickness skin equivalent and automated wounding. Journal of Visualized Experiments: JoVE. (96), e52576(2015).
- Kim, K., Kim, J., Kim, H., Sung, G. Y. Effect of α-lipoic acid on the development of human skin equivalents using a pumpless skin-on-a-chip model. International Journal of Molecular Sciences. 22 (4), 2160(2021).
- Curto, E. V., Lambert, G. W., Davis, R. L., Wilborn, T. W., Dooley, T. P. Biomarkers of human skin cells identified using DermArray DNA arrays and new bioinformatics methods. Biochemical and Biophysical Research Communications. 291 (4), 1052-1064 (2002).
- Godwin, L. S., et al. Isolation, culture, and transfection of melanocytes. Current Protocols in Cell Biology. 63, 1-20 (2014).
- Przekora, A., Zarnowski, T., Ginalska, G. A simple and effective protocol for fast isolation of human tenon's fibroblasts from a single trabeculectomy biopsy - a comparison of cell behaviour in different culture media. Cellular & Molecular Biology Letters. 22, 5(2017).
- Rådinger, M., Jensen, B. M., Kuehn, H. S., Kirshenbaum, A., Gilfillan, A. M. Generation, Isolation, and Maintenance of Human Mast Cells and Mast Cell Lines Derived from Peripheral Blood or Cord Blood. Current Protocols in Immunology. Coligan, J. E., Bierer, B. E., Margulies, D. H., Shevach, E. M., Strober, W. , John Wiley & Sons, Inc. Hoboken, NJ. (2010).
- Artuc, M., Muscha Steckelings, U., Henz, B. M. Mast cell-fibroblast interactions: Human mast cells as source and inducers of fibroblast and epithelial growth factors. Journal of Investigative Dermatology. 118 (3), 391-395 (2002).
- Panos, R. J., Rubin, J. S., Csaky, K. G., Aaronson, S. A., Mason, R. J. Keratinocyte growth factor and hepatocyte growth factor/scatter factor are heparin-binding growth factors for alveolar type ii cells in fibroblast-conditioned medium. Journal of Clinical Investigation. 92 (2), 969-977 (1993).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Threedimensional cell culture: A powerful tool in tumor research and drug discovery (Review). Oncology Letters. 14 (6), 6999-7010 (2017).
- Amaral, R. L. F., Miranda, M., Marcato, P. D., Swiech, K. Comparative analysis of 3D bladder tumor spheroids obtained by forced floating and hanging drop methods for drug screening. Frontiers in Physiology. 8, 605(2017).
- Gao, B., Jing, C., Ng, K., Pingguan-Murphy, B., Yang, Q. Fabrication of three-dimensional islet models by the geometry-controlled hanging-drop method. Acta Mechanica Sinica. 35 (2), 329-337 (2019).
- Zhang, C., et al. 3D culture technologies of cancer stem cells: Promising ex vivo tumor models. Journal of Tissue Engineering. 11, (2020).
- Sobiepanek, A., Paone, A., Cutruzzolà, F., Kobiela, T. Biophysical characterization of melanoma cell phenotype markers during metastatic progression. European Biophysics Journal: EBJ. 50 (3-4), 523-542 (2021).
- Jin, G. -Z., Kim, H. -W. Effects of Type I collagen concentration in hydrogel on the growth and phenotypic expression of rat chondrocytes. Tissue Engineering and Regenerative. 14 (4), 383-391 (2017).
- Osidak, E. O., et al. Concentrated collagen hydrogels: A new approach for developing artificial tissues. Materialia. 20, 101217(2021).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: Characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Jimbow, K., Salopek, T. G., Dixon, W. T., Searles, G. E., Yamada, K. The epidermal melanin unit in the pathophysiology of malignant melanoma. The American Journal of Dermatopathology. 13 (2), 179-188 (1991).
- Van Den Bogaard, E., et al. Perspective and consensus opinion: Good practices for using organotypic skin and epidermal equivalents in experimental dermatology research. Journal of Investigative Dermatology. 141 (1), 203-205 (2021).
- Bednarek, R. In vitro methods for measuring the permeability of cell monolayers. Methods and Protocols. 5 (1), 17(2022).
- Idrees, A., et al. Fundamental in vitro 3D human skin equivalent tool development for assessing biological safety and biocompatibility - towards alternative for animal experiments. 4 Open. 4, (2021).
- Park, H. -Y., Kweon, D. -K., Kim, J. -K. Upregulation of tight junction-related proteins by hyaluronic acid in human HaCaT keratinocytes. Bioactive Carbohydrates and Dietary Fibre. 30, 100374(2023).
- Choudhury, S., Das, A. Advances in generation of three-dimensional skin equivalents: Pre-clinical studies to clinical therapies. Cytotherapy. 23 (1), 1-9 (2021).
- Zhang, Z., Michniak-Kohn, B. B. Tissue engineered human skin equivalents. Pharmaceutics. 4 (1), 26-41 (2012).
- Woappi, Y., Altomare, D., Creek, K. E., Pirisi, L. Self-assembling 3D spheroid cultures of human neonatal keratinocytes have enhanced regenerative properties. Stem Cell Research. 49, 102048(2020).
- Ouwehand, K., Spiekstra, S. W., Waaijman, T., Scheper, R. J., de Gruijl, T. D., Gibbs, S. Technical advance: Langerhans cells derived from a human cell line in a full-thickness skin equivalent undergo allergen-induced maturation and migration. Journal of Leukocyte Biology. 90 (5), 1027-1033 (2011).
- Akther, F., Little, P., Li, Z., Nguyen, N. -T., Ta, H. T. Hydrogels as artificial matrices for cell seeding in microfluidic devices. RSC Advances. 10 (71), 43682-43703 (2020).
- Silva, A. K. A., Richard, C., Bessodes, M., Scherman, D., Merten, O. -W. Growth factor delivery approaches in hydrogels. Biomacromolecules. 10 (1), 9-18 (2009).
- Lee, H. -R., et al. Effect of Aronia extract on collagen synthesis in human skin cell and dermal equivalent. Oxidative Medicine and Cellular Longevity. 2022, 4392256(2022).
- Mulder, P. P. G., Raktoe, R. S., Vlig, M., Elgersma, A., Middelkoop, E., Boekema, B. K. H. L. Full skin equivalent models for simulation of burn wound healing, exploring skin regeneration and cytokine response. Journal of Functional Biomaterials. 14 (1), 29(2023).
- Goncalves, K., et al. Investigation into the effect of skin tone modulators and exogenous stress on skin pigmentation utilizing a novel bioengineered skin equivalent. Bioengineering & Translational Medicine. 8 (2), 10415(2023).
- Michel, M., L'Heureux, N., Pouliot, R., Xu, W., Auger, F. A., Germain, L. Characterization of a New Tissue-Engineered Human Skin Equivalent with Hair. In Vitro Cellular & Developmental Biology. Animal. 35 (6), 318-326 (1999).
- Müller, I., Kulms, D. A 3D organotypic melanoma spheroid skin model. Journal of Visualized Experiments: JoVE. (135), e57500(2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados