Method Article
Создание моделей кожи для различных применений - от двумерной (2D) монокультуры до трехмерной (3D) мультикультуры
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы представляем недорогие и простые процедуры по внедрению различных 3D-моделей кожи для рутинных исследований в лаборатории клеточных культур. Исследователи могут создавать модели, адаптированные к их потребностям, не полагаясь на коммерчески доступные модели.
Аннотация
Благодаря сложной структуре и важным функциям кожи это интересная исследовательская модель для косметической, фармацевтической и медицинской промышленности. В Европейском Союзе действует тотальный запрет на тестирование косметической продукции и ее ингредиентов на животных. В случае с медициной и фармацевтикой эта возможность также постоянно ограничена. В соответствии с принципом 3R все чаще и чаще тестируются как отдельные соединения, так и целые рецептуры на искусственно созданных моделях. Самыми дешевыми и широко используемыми являются 2D-модели, которые состоят из клеточного монослоя, но не отражают реальных взаимодействий между клетками в ткани. Несмотря на то, что коммерчески доступные 3D-модели обеспечивают лучшее представление ткани, они не используются в больших масштабах. Это связано с тем, что они дорогие, время ожидания довольно долгое, а доступные модели часто ограничены только теми, которые обычно используются.
Для того, чтобы вывести проводимые исследования на более высокий уровень, мы оптимизировали процедуры подготовки различных 3D-моделей кожи. Описанные процедуры дешевы и просты в приготовлении, так как могут применяться в многочисленных лабораториях и исследователями с различным опытом в области клеточных культур.
Введение
Кожа представляет собой непрерывную структуру с многоклеточными взаимодействиями, раскрывающими правильное функционирование и гомеостаз этого сложного органа. Он строится из морфологически разных слоев: внутреннего слоя – дермы, а внешнего – эпидермиса. Поверх эпидермиса дополнительно выделяют роговой слой (состоящий из уплощенных мертвых клеток – корнеоцитов), который обеспечивает наибольшую защиту от внешней среды. Одними из важнейших пассивных и активных функций кожи являются защита организма от внешних факторов, участие в иммунологических процессах, секреция, резорбция, терморегуляция, а также чувствительность 1,2,3. Поскольку он считается одним из самых больших органов в организме, избежать контакта с различными болезнетворными микроорганизмами, аллергенами, химическими веществами, а также ультрафиолетовым (УФ) излучением невозможно. Таким образом, он структурирован со многими типами клеток с определенными функциями. Основными типами клеток, присутствующих в эпидермисе, являются кератиноциты (почти 90% всех клеток, со структурными и иммунологическими функциями в более глубоких частях эпидермиса, но которые позже подвергаются процессу кератинизации, превращаясь в корнеоциты в верхнем слое эпидермиса), меланоциты (только 3-7% популяции эпидермальных клеток, которые продуцируют защитный от ультрафиолета пигмент меланин) и клетки Лангерганса (из иммунной системы). В случае дермы основными клетками являются фибробласты (продуцирующие факторы роста и белки), дендритные клетки и тучные клетки (оба типа клеток иммунной системы)4,5,6. Кроме того, кожа снабжена несколькими внеклеточными белками (такими как коллаген I и IV типа, фибронектин и ламинин; Рисунок 1) и белковые волокна (коллаген и эластин), которые обеспечивают специфическую структуру кожи, а также способствуют связыванию клеток, клеточной адгезии и другим взаимодействиям7.
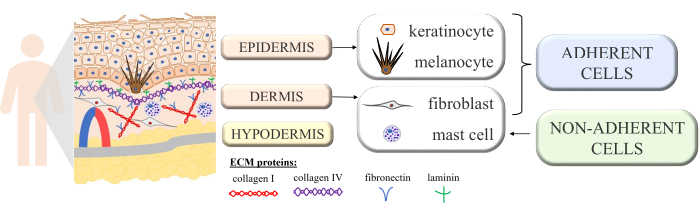
Рисунок 1: Схема, показывающая структуру кожи. Структура кожи выделяла четыре основных типа клеток, встречающихся в ее отдельных слоях, и выделяла белки внеклеточного матрикса. Этот рисунок был создан с помощью MS PowerPoint. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Безопасность косметики и фармацевтической продукции является очень важным вопросом, а защита здоровья потребителей и пациентов является приоритетом8. До недавнего времени его предполагалось гарантировать многочисленными испытаниями, в том числе исследованиями, проводимыми на животных. К сожалению, они часто требовали применения радикальных методов, причиняя боль и страдания животным, используемым в исследовательских целях (часто мышам, крысам и свиньям). В 1959 году были введены Принципы гуманной экспериментальной техники (принцип 3R): (1) замена животных в исследованиях моделями in vitro, in sillico или ex vivo , (2 - сокращение) сокращение числа животных, используемых для исследований, и (3 - совершенствование) улучшение благосостояния животных, которые все еще необходимы для исследований, и в то же время совершенствование разработанных альтернативных методов.. Кроме того, в Европейском союзе (ЕС) косметические испытания на животных регулируются законом. С 11 сентября 2004 года вступил в силу запрет на косметические продукты, протестированные на животных. 11 марта 2009 года ЕС запретил тестирование косметических ингредиентов на животных. Продажа косметических продуктов, изготовленных из новых ингредиентов, протестированных на животных, была запрещена; Тем не менее, тестирование продуктов на животных на предмет сложных проблем со здоровьем человека, таких как токсичность повторных доз, репродуктивная токсичность и токсикокинетика, по-прежнему было приемлемым. С 11 марта 2013 года в ЕС запрещена продажа косметики, в которой готовый продукт или его ингредиенты были протестированы на животных. Поэтому в настоящее время в косметологии исследования проводятся на трех уровнях: in vitro (клетки), ex vivo (реальные ткани) и in vivo (добровольцы)11. В случае с фармацевтическими препаратами необходимость в испытаниях на животных сохраняется; Однако он значительно снижен и строго контролируется12.
В качестве альтернативных методов тестирования на животных и для первоначальной оценки эффективности нового активного ингредиента используются культуры клеток кожи in vitro . Выделение различных типов клеток кожи и их культивирование в стерильных лабораторных условиях позволяет оценить безопасность и токсичность активных веществ. Линии клеток кожи также являются широко признанными моделями для исследований, поскольку клетки продаются сертифицированными компаниями, а результаты могут быть сопоставимы в разных лабораториях. Эти тесты обычно проводятся на простых 2D-моделях монокультур клеток кожи человека. Некоторые из более продвинутых моделей представляют собой их сокультуры (например, кератиноциты с фибробластами и кератиноциты с меланоцитами), а также трехмерные модели, включая культуры (сферы) без каркаса и кожные эквиваленты эпидермиса, дермы или даже полноразмерные заменители кожи13. Стоит отметить, что кроме последнего типа (кожных эквивалентов), остальные в продаже отсутствуют, и при необходимости ученый должен приготовить их самостоятельно.
Несмотря на то, что многие из этих моделей поддерживаются и регулярно продаются в настоящее время (Таблица 1), постоянно требуются дополнительные модели для проверки большинства результатов. Таким образом, новые модели должны лучше воссоздать реальные взаимодействия, происходящие в человеческом теле. Когда для формирования таких моделей используется смесь клеток разных типов, можно добиться воспроизводства многоклеточного аспекта ткани in vivo . В результате разрабатывается органотипическая культура (рисунок 2).
| Имя | Описание | |||||
| Нормальная кожа | ЭпиСкин | Реконструированный эпидермис человека - кератиноциты на коллагеновой мембране | ||||
| СкинЭтик RHE | Реконструированный эпидермис человека - кератиноциты на поликарбонатной мембране | |||||
| СкинЭтик RHE-LC | Эпидермальная модель человека Лангерганса - кератиноциты и клетки Лангерганса на поликарбонатной мембране | |||||
| SkinEthic RHPE | Реконструированный пигментированный эпидермис человека - кератиноциты и меланоциты на поликарбонатной мембране | |||||
| Т-кожа | Реконструированная модель кожи человека полной толщины - кератиноциты на слое фибробластов, которые были выращены на поликарбонатной мембране | |||||
| Модель Phenion FT Skin | Кератиноциты и фибробласты в гидрогеле | |||||
| Кожа с заболеванием | Модель кожи для лечения меланомы FT | Нормальные кератиноциты и фибробласты человеческого происхождения с клетками злокачественной меланомы человека A375 | ||||
| Тканевая модель псориаза | Нормальные кератиноциты и фибробласты человека | |||||
Таблица 1: Наиболее популярные коммерческие аналоги скинов для различных исследований.
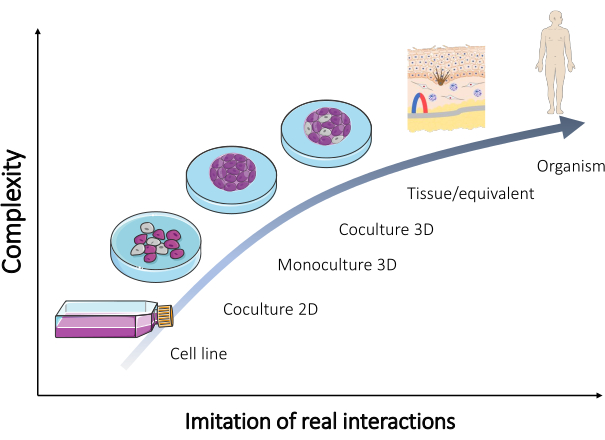
Рисунок 2: Сложность различных моделей in vitro . Связь между сложностью различных моделей in vitro для воссоздания организма и реальными взаимодействиями, происходящими непосредственно в организме человека. Рисунок был модифицирован из набора «Микробиология и клеточная культура» от Servier Medical Art by Servier (https://smart.servier.com/). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Одним из наиболее важных ограничений коммерческих эквивалентов является доступность только очень общих исследовательских моделей с несколькими типами клеток (обычно 1-2, редко 3). Тем не менее, в коже присутствует гораздо больше клеток, и их взаимодействие друг с другом может обеспечить лучшую или худшую переносимостьразличных ингредиентов. Недостаток некоторых иммунных компонентов может снизить его ценность в нескольких видах исследований, в том числе в иммунотерапии. Это серьезная проблема, так как меланома является опасным для жизни раком кожи из-за раннего начала метастазирования и частой резистентности к применяемому лечению15. Чтобы улучшить модель искусственной кожи, исследователи пытаются создать кокультуру иммунных клеток с клеточными линиями иорганоидами16, и это считается большим улучшением изученных моделей. Например, тучные клетки принимают участие во многих физиологических (заживление ран, ремоделирование тканей) и патологических (воспаление, ангиогенез и опухолевая прогрессия) процессах в коже17. Таким образом, их появление в модели может существенно изменить реакцию модели на изучаемое соединение. Наконец, до сих пор отсутствует много информации, связанной с кожей, которую можно обнаружить, только проведя фундаментальные исследования. Вот почему создание и совершенствование различных моделей искусственной кожи (Таблица 2) является таким важным делом. В данной статье представлено несколько процедур для создания продвинутых моделей кожи, в том числе сфер и кожных эквивалентов.
| Модель кожи in vitro | Попытка воссоздать взаимодействия, происходящие в ткани | Примеры используемых ячеек |
| 2D или 3D клеточная культура | Эпидермис | Кератиноциты |
| Меланоциты | ||
| Кератиноциты + меланоциты | ||
| Кожа | Фибробласты | |
| Тучные клетки | ||
| Фибробласты + тучные клетки | ||
| Кожа | Кератиноциты + фибробласты | |
| Кератиноциты + тучные клетки | ||
| Меланоциты + фибробласты | ||
| Меланоциты + тучные клетки | ||
| Кератиноциты + Фибробласты + Меланоциты | ||
| Кератиноциты + Фибробласты + Тучные клетки |
Таблица 2: Примеры смесей типов клеток для воссоздания тканей кожи в 2D и 3D культуре.
протокол
Исследование проводилось в соответствии с руководящими принципами Хельсинкской декларации и одобрено Комитетом по этике Варшавского медицинского университета (KB/7/2022). Информированное согласие было получено от всех субъектов, участвовавших в исследовании.
ПРИМЕЧАНИЕ: Описанные процедуры усовершенствованной подготовки модели кожи могут быть выполнены с использованием либо коммерчески доступных первичных клеток кожи и клеточных линий, либо первичных клеток, выделенных от пациентов. Коммерческие ячейки поставляются с соответствующими документами, и их использование в исследованиях для большинства стран не требует дополнительного согласования. Однако для некоторых стран это обязательно, поэтому это должно быть сверено с правилами Местного комитета по этике. Если в исследовании должны быть использованы первичные клетки, выделенные у пациентов, то сначала исследование должно быть одобрено местным этическим комитетом, и оно должно проводиться в соответствии с их строгими рекомендациями. Кроме того, письменное информированное согласие должно быть получено от всех доноров кожных тканей. Выделение первичных клеток кожи не было предметом данной статьи, но примеры процедур выделения можно найти у Kosten et al. (кератиноциты)18, Ścieżyńska et al. (меланоциты)19, Kröger et al. (фибробласты и тучные клетки)20. Большинство нормальных клеток кожи и клеточных линий имеют уровень безопасности класса BSL1; Они не вызывают никаких угроз. Тем не менее, используемое лабораторное оборудование должно соответствовать стандартам для культивирования клеток животных и человека в контролируемых условиях.
1. Культура клеток кожи
ПРИМЕЧАНИЕ: Культивирование клеток кожи необходимо проводить в колбах, предназначенных для адгезивных или суспензионных клеток (в зависимости от типа клеток) при температуре 37 °C и содержании углекислого газа 5% в инкубаторе. Мероприятия, связанные с их выращиванием и использованием в исследовательских целях, требуют стерильных условий и должны выполняться в ламинарной камере после воздействия ультрафиолетовых лучей С (УФС) в течение 15-30 минут. Получение клеточных суспензий, которые затем используются для создания двух- и трехмерных моделей, требует выполнения процедур в зависимости от типа клеток (для адгезивных клеток, таких как кератиноциты, фибробласты и меланоциты – шаг 1.1, для неадгезивных клеток тучных клеток – шаг 1.2) (рис. 3). Для колб с различными размерами культур объемы всех реагентов (таких как среда, фосфатно-солевой буфер или раствор трипсина), используемых в описанных методах, перечислены в таблице 3. Параметры, зависящие от типа клеток (например, концентрация и состав реагентов, метод центрифугирования и т.д.), отсортированы в таблице 4. Плотность ячеек, используемых для посева, приведена в таблице 5. Все эти таблицы приведены в конце этого раздела.
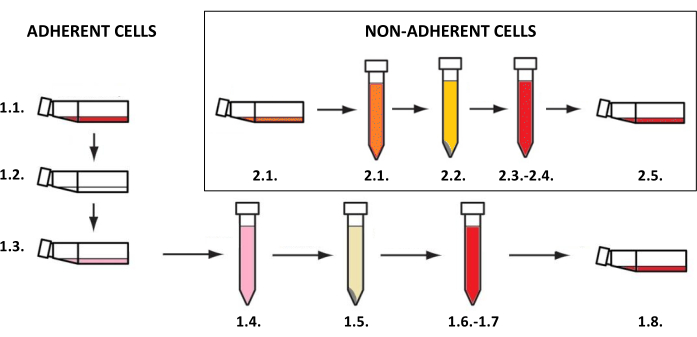
Рисунок 3: Культивирование адгезивных и неадгезивных клеток. Общая пошаговая процедура культивирования адгезивных и неадгезивных клеток (цифры соответствуют описаниям шагов 1.1 и 1.2). Рисунок был создан с помощью MS PowerPoint. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Получение суспензии адгезивных клеток
- Удалите среду из колбы с культурой.
- Аккуратно промойте клетки фосфатно-солевым буфером (PBS, табл. 3).
- Добавьте раствор трипсина в этилендиамин тетрауксусную кислоту (раствор трипсина-ЭДТА, табл. 3). Инкубируйте колбу при температуре 37 °C и контролируйте отрыв клеток от поверхности на оптическом микроскопе.
- Суспендируйте отделенные клетки по меньшей мере в двойном количестве полноценной питательной среды или нейтрализатора трипсина, чтобы деактивировать трипсин (2:1) (объемы см. в таблице 3, а реагенты в таблице 4). Количественно перенесите содержимое колбы в пробирку объемом 15 мл.
- Возьмите небольшой объем (20 мкл) клеточной суспензии в пробирку объемом 1,5 мл и подсчитайте клетки с помощью ручного или автоматического гемоцитометра.
- Центрифугируйте пробирку (параметры приведены в таблице 4), удалите большую часть надосадочной жидкости и повторно суспендируйте клеточную гранулу в небольшом количестве оставшейся жидкости. Затем добавьте достаточное количество свежей среды для получения объема предварительного центрифугирования (объем в таблице 3), если плотность клеток подходит для посева, или пересчитайте требуемый объем новой среды.
Примечание: Некоторые клетки, такие как меланоциты, очень чувствительны к центрифугированию, что позволяет избежать необходимости центрифугирования их повторно через короткое время. - Приготовьте клеточную суспензию необходимой плотности (кл/мл, плотность клеток в таблице 5) для проведения эксперимента (2D/3D моно- или мультикультуры клеток кожи).
Примечание: Если клетки должны быть подвергнуты дальнейшему культивированию, верните 5000-8000 клеток/мл в новую колбу и добавьте свежую среду (объем в таблице 3).
- Получение суспензии неадгезивных клеток
- Извлеките среду с клеточной суспензией из колбы с культурой и количественно перенесите ее в пробирку объемом 15 мл.
- Возьмите небольшой объем (20 мкл) клеточной суспензии в новую пробирку объемом 1,5 мл. Подсчитайте клетки с помощью ручного или автоматического гемоцитометра.
- Центрифугируйте пробирку (параметры приведены в таблице 4), удалите большую часть надосадочной жидкости и повторно суспендируйте клетки в небольшом количестве оставшейся жидкости. Затем добавьте свежую среду для получения объема предварительного центрифугирования (как указано в таблице 3), если плотность клеток подходит для затравки, или пересчитайте необходимый объем новой среды.
- Приготовьте клеточную суспензию необходимой плотности (клеток на мл, как предложено в таблице 5) для проведения эксперимента (2D/3D моно- или мультикультуры клеток кожи).
Примечание: Если клетки должны быть подвергнуты дальнейшему культивированию, верните 5000-8000 клеток/мл в новую колбу и добавьте свежую среду.
| 25 см2 колбы для культуры | 75 см2 колбы для культур | |
| Питательная среда [мл] | 4–5 | 8–12 |
| PBS [мл] | 5 | 10 |
| Трипсин–ЭДТА [мл] | 0.5–1 | 1–2 |
| Нейтрализующая среда [мл] | 1–2 | 2–4 |
Таблица 3: Объемы реагентов, используемых при культивировании и приготовлении клеточных суспензий.
| Монокультура клеток кожи | Трипсин | Деактиватор трипсина | Центрифугирование | Средний тип для 2D монокультуры | |
| Кератиноциты | 0.25% | с нейтрализатором трипсина | 300 x g, 5 мин, RT | Кератиноцитарная среда для роста 2 | |
| Фибробласты | 0.25% | со средним | 300 x g, 5 мин, RT | DMEM, 10% FBS | |
| Меланоциты | 0.025% | с нейтрализатором трипсина | 300 x g, 3 мин, RT | Medium 254, Добавка для роста меланоцитов человека без PMA-2 | |
| Тучные клетки | не требуется | не требуется | 300 x g, 3 мин, RT | IMDM, 10% FBS, 1% заменимые аминокислоты, 226 мкМ α-монотиоглицерин | |
Таблица 4: Трипсинизация, параметры центрифугирования и тип среды зависят от типа клетки.
| Тип модели | Плотность клеток [кл/мл] | ||
| 2D | Монослой | Фибробласты | 2 х 105 |
| Тучные клетки | |||
| Кератиноциты | |||
| Меланоциты | |||
| 3D | Сфера (метод висячей капли) | Фибробласты | 5 х 105 |
| Тучные клетки | |||
| Кератиноциты | |||
| Меланоциты | |||
| Микс ячеек | |||
| Сфера (метод предельной клеточной адгезии) | Фибробласты | 2 х 105 | |
| Тучные клетки | |||
| Кератиноциты | |||
| Меланоциты | |||
| Микс ячеек | |||
| Эквивалентный | Фибробласты | 1 х 105 | |
| Тучные клетки | 1 х 104 | ||
| Кератиноциты | 8 х 105 | ||
| Меланоциты | 5 х 104 | ||
Таблица 5: Плотность посева клеток для различных типов моделей кожи.
2. Подготовка сфер клеток кожи
ПРИМЕЧАНИЕ: Для создания сфер использование метода висячей капли описано в шаге 2.1 (Рисунок 4), в то время как подход, направленный на ограничение адгезии ячеек, показан в шаге 2.2 (Рисунок 5). Тем не менее, поскольку сферы очень малы и могут быть неустойчивыми, действия, проводимые с помощью этих методов, требуют терпения, деликатности и медленных действий.
- Метод подвешивания
- Используйте соответствующую плотность ячеек для достижения желаемого размера сферы (рекомендуемая плотность ячеек 5 x 105 клеток/мл, таблица 5).
- Пипетка 20 мкл клеточной суспензии на крышке чашки Петри или многолуночного планшета (рис. 4А).
- Накройте блюдо/тарелку нижней частью и аккуратно переверните ее (висячие капли автоматически созутся на крышках, рисунок 4B).
- Заполните чашку Петри/лунки тарелки стерильной водой/раствором PBS, чтобы избежать испарения среды из капель.
- Инкубируйте капли в течение 48-72 ч при 37 °C.
ПРИМЕЧАНИЕ: Сила тяжести тянет клетки вниз, а отсутствие доступной поверхности препятствует прикреплению клеток к сосуду и способствует агрегации клеток. Однако некоторые типы клеток могут требовать более длительной инкубации. - Перед выполнением следующего шага заполните лунки новой пластины (или используйте старую пластину с удаленной водой/PBS из лунок) полной питательной средой (100 μл).
ПРИМЕЧАНИЕ: Перед следующим шагом возьмите 200 μл наконечников, удалите 1/5 каждого конца наконечника и простерилизуйте перед использованием. - Перенесите клеточные сферы в лунки многолуночного планшета с помощью стерильных наконечников для пипеток с отрезанным концом. Возьмите наконечники объемом 200 мкл, удалите по 1/5 каждого конца наконечника и простерилизуйте перед использованием (Рисунок 4C).
ПРИМЕЧАНИЕ: Этот шаг может быть сложным, так как поток жидкости во время переворачивания тарелки может повредить сферы. - Инкубируйте перенесенные сферы в течение 1 дня в многолуночном планшете при температуре 37 °C перед проведением любых дальнейших экспериментов (например, добавление соединений, анализы цитотоксичности, введение сфер в эквиваленты) (рисунок 4D).
- Метод ограничения клеточной адгезии
- Перед посевом ячеек накройте лунки U-образной нижней пластины раствором поверхностно-активного вещества (например, Pluronic F-127, полиэтиленгликолем, поливиниловым спиртом)21. Приготовьте и добавьте в каждую лунку по 100 мкл 1% раствора поверхностно-активного вещества в PBS. Инкубируйте планшет с раствором в течение 24 ч при 37 °C (рис. 5A-C). При необходимости храните пластину дольше, но поддерживайте уровень жидкости, добавляя больше буфера PBS.
- Приготовьте клеточную суспензию в требуемой плотности клеток в 50 мкл на лунку (рекомендуемая плотность клеток при посеве 2 х 105/мл, табл. 5).
- Удалите раствор поверхностно-активного вещества из лунок перед посевом клеток, чтобы избежать разрушения клеточной мембраны в результате лизиса (рисунок 5D).
- Добавьте раствор клетки в планшет и инкубируйте в течение 24 ч при 37 °C, чтобы достичь клеточных агрегатов (рис. 5E). Примерно через 1-3 дня сферы будут сформированы (рисунок 5F) и готовы к использованию для любых дальнейших экспериментов.
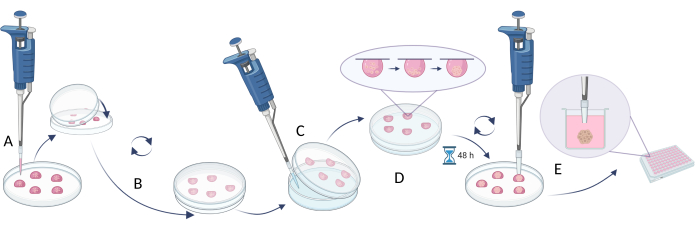
Рисунок 4: Метод подвешивания капель. (А) пипетирование клеточной суспензии на крышке и накрытие крышки нижней частью чашки; (В) вращение тарелки для создания свисающих капель; (C) добавление воды/PBS в нижнюю часть чашки (ограничение испарения жидкости); (Г) инкубация чашек с подвешенными каплями для создания клеточных сфер; (Д) сбор капель с образовавшимися сферами и стабилизация перенесенных сфер в многолуночных планшетах. Фигура создавалась с помощью Biorender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
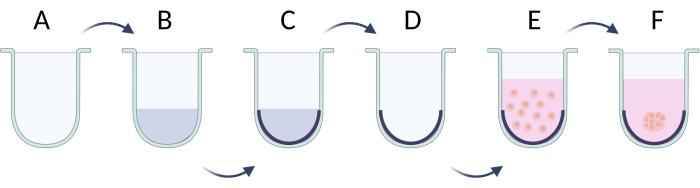
Рисунок 5: Поэтапная подготовка сфер методом предельной клеточной адгезии. (А) U-образная нижняя лунка; (B,C) ограничение присоединения клеток раствором поверхностно-активного вещества; (D) удаление раствора из скважин; (Д) посевные ячейки; (F) агрегация клеток и образование сферы. Фигура создавалась с помощью Biorender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
3. Приготовление полнослойных скин-эквивалентов
ПРИМЕЧАНИЕ: Разработку полноразмерных кожных эквивалентов (эпидермиса и дермы) можно разделить на три этапа (Рисунок 6): подготовка слоя искусственной дермы с возникновением типичных дермальных клеток (таких как фибробласты и тучные клетки, Рисунок 6А), посев клеток, входящих в состав искусственного эпидермиса (в основном кератиноцитов и меланоцитов, Рисунок 6В)) и вертикальный рост кератиноцитов с возможным процессом кератинизации (формирование рогового слоя, рисунок 6В). Приготовление полнослойных скин-эквивалентов описано на шаге 3.1 (3.1.1-3.1.10). Если требуется менее продвинутый эквивалент кожи (например, только тип эпидермиса), выбранный тип клеток (например, кератиноциты) может быть высажен непосредственно на коммерчески доступные коллагеновые или поликарбонатные мембраны, а также культивирован с возможностью индуцирования процесса кератинизации (перейдите непосредственно к шагам 3.1.9-3.1.10).
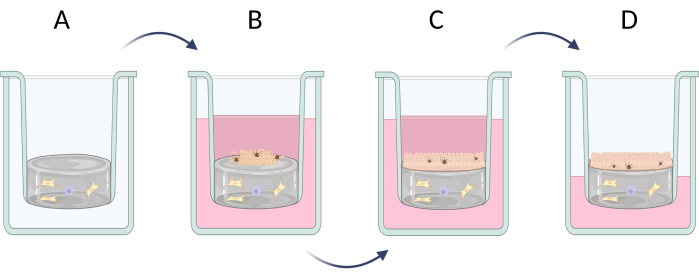
Рисунок 6: Поэтапное приготовление полнослойных кожных эквивалентов во вставках. (А) подготовка слоя псевдодермы с дермальными клетками, (В) посев эпидермальных клеток, (В) дальнейшая культивирование эквивалента в среде, (Г) культура воздушно-жидкостной границы раздела способствует образованию стратифицированного эпителия. Фигура создавалась с помощью Biorender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Приготовление полнослойных скин-эквивалентов в 24-луночном планшете
- Поместите пробирки с водой, PBS (10x), 1 М NaOH и раствором коллагена I типа на лед.
- Определите надлежащее количество дермальных клеток (например, фибробластов и тучных клеток; в соотношении 10:1) для посева в гидрогель. Перенесите нужное количество дермальных клеток в пробирку объемом 1,5 мл (500 мкл фибробластов и 500 мкл тучных клеток, в соответствии с плотностью клеток в таблице 5) и центрифугируйте клетки (300 x g, 3 мин, RT).
- Удалите надосадочную жидкость и аккуратно восстановите суспендию клеток в смеси 695 μл воды/100 μл PBS (10x)/ 5 μл NaOH.
ПРИМЕЧАНИЕ: Если 1 мл от общего объема раствора недостаточно, используйте таблицу 6 для пересчета объемов каждого реагента. - Добавьте в смесь 200 μл коллагенового раствора и аккуратно перемешайте его с помощью пипетирования.
ПРИМЕЧАНИЕ: Будьте осторожны, так как консистенция смеси будет плотной. - Добавьте 200 мкл приготовленной смеси во вкладыш в 24-луночный планшет. Для модели без рогового слоя добавьте по 500 мкл в каждую лунку 24-луночного планшета.
- Инкубируйте планшет в течение 10 минут при комнатной температуре (RT), а затем перенесите его в инкубатор на 30 минут.
ПРИМЕЧАНИЕ: Проверьте, полимеризовался ли гидрогель, прежде чем предпринимать какие-либо другие действия. - Перед затравливанием клеток на поверхность гидрогеля промойте его PBS-буфером (500 μл/лунка).
- Определите надлежащее количество клеток эпидермиса (например, кератиноцитов и меланоцитов; в соотношении 15:1), которые должны быть засеменены поверх гидрогеля. Приготовьте клеточную смесь в 500 мкл среды DMEM с добавлением 10% FBS (добавьте 250 мкл кератиноцитов и 250 мкл меланоцитов, плотности клеток указаны в таблице 4) и аккуратно добавьте ее в лунки.
ПРИМЕЧАНИЕ: В некоторых случаях лучше сначала засеменить меланоциты и дать им хорошо распределиться на гидрогеле, а еще через 24 ч удалить среду и семенные кератиноциты. В этом случае добавьте 250 мкл клеточной суспензии и 250 мкл среды. - Инкубировать планшеты при 37 °С в течение 2-5 дней, в зависимости от скорости роста клеток, со средним обменом (при снижении концентрации FBS от 10% до 1%) каждые 48 ч и проводить клеточный мониторинг на оптическом микроскопе.
- Если процесс кератинизации должен быть индуцирован после получения монослоя кератиноцитов поверх гидрогеля, используйте среду, не содержащую FBS, дополнительно дополненную ионами кальция и L-аскорбиновой кислотой, в течение дополнительных 2-7 недель (в концентрации 1,5 мкМ CaCl2и 50 мкг/мл L-аскорбиновой кислоты).
ПРИМЕЧАНИЕ: Время инкубации зависит от используемых кератиноцитов и скорости их дифференцировки.
| Реагент | Уравнение для расчета объема реагента | Примеры расчетов | |
| (для конечного объема =V всего 1 мл) | |||
| раствор коллагена I типа | 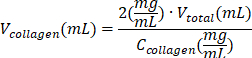 | (Сколлаген = 10 мг/мл) | |
| 0,2 мл = 200 мкл | |||
| ПБС (10 шт.) | 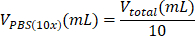 | 0,1 мл = 100 мкл | |
| 1 М NaOH | 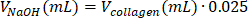 | 0,005 мл = 5 мкл | |
| стерильный H2O | 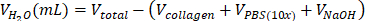 | 0,695 мл = 695 мкл | |
Таблица 6: Расчет объемов реагентов, необходимых для гидрогелевого препарата коллагена I типа 2 мг/мл.
4. Идентификация типов клеток в 3D-модели кожи методами окрашивания клеток
ПРИМЕЧАНИЕ: Чтобы подтвердить, что разработанная модель кожи состоит из ожидаемых клеток, хорошо провести окрашивание клеток. Это важный шаг перед тем, как можно будет провести какие-либо целевые эксперименты на данной модели22. В случае 3D моделей кожи перед окрашиванием клеток необходимо встроить данную модель в парафин и подготовить микроскопические слайды с вырезом искусственной ткани на микротоме (шаг 4.1) (рис. 7).
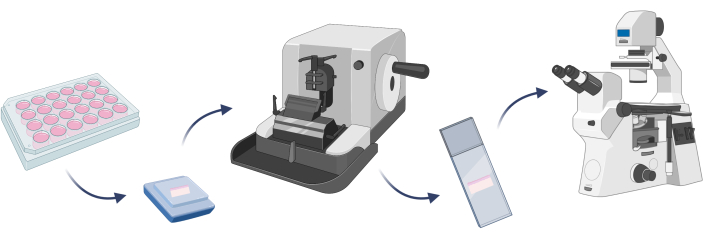
Рисунок 7: Основные этапы встраивания 3D-модели кожи, окрашивания клеток и микроскопических наблюдений. Фигура создавалась с помощью Biorender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Встраивание 3D моделей скинов
- Дважды промойте эквивалент кожи PBS в течение 5 мин при РТ и зафиксируйте с помощью 3,7% раствора параформальдегида в ПБС (30 мин, РТ). Повторите этап промывки с PBS.
- Перед внедрением обезвоживайте эквивалент кожи путем инкубации в возрастающих концентрациях растворов этанола: 50% (15 мин), 70% (15 мин), 96% (2x 30 мин) и 99,8% (2x 30 мин).
- Поместите неподвижный и обезвоженный эквивалент кожи в форму, наполненную парафином.
ПРИМЕЧАНИЕ: Разместите эквивалент в соответствующей ориентации. - Накройте форму кассетой и добавьте сверху еще парафина. Дайте ему застыть до 30 минут при RT.
- Заморозьте содержащийся в парафине эквивалент пленки не менее чем на 1 ч при -80 °C.
- Включите микротом, вставьте эквивалент скин-слоя, залитый парафином, и нарежьте ломтики толщиной 5 мкм. Поместите срезанные искусственные ткани на микроскопические предметные стекла и высушите их не менее 8 часов при температуре 37 °C.
- Погрузите предметные стекла в ксилол (2 раза, 10 минут), а затем регидратируйте горные стекла с уменьшающейся концентрацией этанола 99,8% (5 минут), 96% (5 минут), 70% (5 минут) и 50% (5 минут).
- Выньте предметные стекла из раствора этанола и дважды промойте их водой (5 мин).
Примечание: Традиционное окрашивание клеток проводится либо путем применения специфических красителей (Гематоксилин, Эозин23), либо с использованием антител, избирательно нацеленных на биомаркеры (включая коллаген 1А2 для фибробластов, цитокератин 14 для кератиноцитов, мелан-А или тирозиназу для меланоцитов24). Рутинное окрашивание гематоксилином и эозином может быть выполнено в соответствии с протоколами, разработанными различными компаниями (шаг 4.2). С другой стороны, если требуется иммунофлуоресцентное или иммуногистохимическое окрашивание, процедура отличается и значительно дольше (шаги 4.3 и 4.4). Чтобы избежать неспецифических реакций, используйте первичные антитела, вырабатываемые у разных видов, а затем специализированные вторичные антитела.
- Окрашивание гематоксилином и эозином 3D-моделей кожи
- Окрасьте микроскопическое предметное стекло в раствор гематоксилина на 3 мин по РТ.
- Промойте слайды в подкисленном спиртовом растворе в течение 1 мин.
ПРИМЕЧАНИЕ: Приготовьте раствор подкисленного спирта, смешав 2 мл 35%-38% соляной кислоты с 98 мл 99,8% этилового спирта. - Далее промойте предметное стекло в 0,1% растворе гидрокарбоната натрия для получения видимого, нежного сине-фиолетового цвета.
ПРИМЕЧАНИЕ: Для получения 0,1% раствора бикарбоната натрия растворите 100 мг бикарбоната натрия в 100 мл сверхчистой воды. - Промойте предметные стекла 95% этанолом в течение 1 минуты.
- Окрасьте микроскопическое предметное стекло в раствор эозина на 1 мин по РТ.
- Промойте предметные стекла 95% этанолом в течение 1 минуты и 99,8% этанолом в течение 2 минут.
- Промойте слайды ксилолом по 2 мин каждый дважды.
- Закрепите бальзамом и наденьте покровное стекло в верхней части горки. Образцы готовы к микроскопическим наблюдениям.
- Иммунофлуоресцентное окрашивание 3D моделей кожи
- Промойте предметное стекло PBS (5 мин).
- Приготовьте блокирующий раствор (3% бычий сывороточный альбумин [БСА] или обезжиренное молоко в буфере PBS с добавлением 0,1% Triton X-100 и 0,1% Tween 20) и инкубируйте в нем предметное стекло в течение 1 ч при РТ.
- Дважды промойте предметные стекла с помощью буфера PBS (5 минут).
- Развести первичное антитело в буфере PBS (в соответствии с рекомендациями производителя, табл. 7) и инкубировать предметные стекла в течение 1-2 ч при РТ или в течение ночи при 4 °С.
- Дважды промойте предметные стекла с помощью буфера PBS (5 минут).
- Вторичное антитело разводят в буфере PBS (согласно рекомендациям производителя, табл. 7) и инкубируют предметные стекла в течение 1 ч в режиме ЛТ.
- Дважды вымойте горки PBS (5 мин).
- Приготовьте раствор красителя для окрашивания ядер (например, Hoechst 33342 или DAPI, табл. 7) и инкубируйте предметные стекла в течение 15 мин при RT.
- Вымойте горки с помощью PBS (5 мин).
- Установите бальзам, накройте срез покровным стеклом и визуализируйте эффекты окрашивания клеток с помощью флуоресцентного микроскопа.
- Иммуногистохимическое окрашивание 3D моделей кожи
- Выполните шаги 4.3.1-4.3.5.
- Кроме того, выполняют стадию промывки буфером, подходящим для фермента, с которым конъюгировано вторичное антитело.
- Развести вторичное антитело в буфере, подходящем для конъюгированного фермента (в соответствии с рекомендациями производителя) и инкубировать предметные стекла в течение 1 ч при ЛТ.
- Дважды вымойте горки PBS (5 мин).
- Приготовьте раствор подходящего субстрата для используемого фермента и инкубируйте предметные стекла в соответствии с рекомендациями производителя.
- Вымойте горки с помощью буфера (5 мин) и закрепите их в бальзаме.
- Визуализируйте эффекты окрашивания клеток с помощью светлопольной микроскопии.
| Обнаружен тип клетки/органоид клетки | Краситель | Разведение / Концентрация | ||
| Тучные клетки | Авидин-сульфогодамин 101 | 1 мкг/мл | ||
| Фибробласты | Антитела к Col1A2 вырабатываются у кроликов | 1:50 | ||
| Козье вторичное антитело против кролика, конъюгированное с FITC | 1:250 | |||
| Кератиноциты | Антитело к цитокератину 14, вырабатываемое мышью | 1:50 | ||
| Козье вторичное антитело против мыши, конъюгированное с FITC | 1:250 | |||
| Меланоциты | Антитело к мелан-А вырабатывается у мышей | 1:50 | ||
| Козье вторичное антитело против мыши, конъюгированное с FITC | 1:250 | |||
| Ядер | Hoechst 33342 | 1 мкг/мл | ||
| DAPI | 1 мкг/мл | |||
Таблица 7: Концентрации и разведения реагентов, используемых для окрашивания клеток.
Результаты
Прежде чем приступить к созданию моделей кожи в лаборатории, необходимо принять решение о типе клеток, которые будут использоваться (первичные/клеточная линия) и выбрать подходящую среду для этих клеток. Большинство банков клеток рекомендуют и могут предоставить среду для всех типов клеточных культур. В случае мультикультурной модели необходимо выбрать одну среду, которая подходит для всех типов клеток, присутствующих в культуре. Некоторые типичные клеточные среды, используемые как для первичной культуры клеток кожи, так и для наиболее распространенных линий клеток кожи, были собраны в таблице 8 18,19,20,25,26,27. Типичные среды, используемые для первичных клеточных культур, довольно дороги, а их состав сложен. С другой стороны, клеточные линии обычно довольствуются средами с простым составом. Некоторые типы клеток (в основном фибробласты и тучные клетки) могут продуцировать и секретировать факторы, стимулирующие рост других клеток (таких как кератиноциты и меланоциты)28,29. Если их присутствие в модели планируется, дополнительная добавка среды не нужна.
| Тип ячейки | Имя ячейки | Терпимая | Ссылка | ||||
| Кератиноциты | Линия HaCaT cel | DMEM, 10% FBS, 100 ЕД/мл пенициллина, 100 мкг/мл стрептомицина | По словам продавца | ||||
| первичные эпидермальные кератиноциты человека в норме (NHEK) | Кератиноцитарная среда для роста 2 (базальная среда + смесь добавок) | По словам продавца | |||||
| первичные эпидермальные кератиноциты человека; Нормальный, взрослый (HEKa) | Базальная среда для дермальных клеток, 0,4% экстракт гипофиза крупного рогатого скота, 0,5 нг/мл rh-трансформирующий фактор роста-альфа, 6 мМ L-глутамин, 100 нг/мл гидрокортизона гемисукцината, 5 мг/мл резус-инсулина, 1 мМ адреналина, 5 мг/мл Апо-трансферрина, 100 Ед/мл пенициллина (при необходимости), 100 мкг/мл стрептомицина (при необходимости) | По словам продавца | |||||
| первичные кератиноциты | DMEM/F-12 (3:1), 1% Ультросер G, 1 мкМ гидрокортизон, 1 мкМ изопротеренол, 0,1 мкМ инсулина, 1 нг/мл кератиноцитарного фактора роста, 1% пенициллин-стрептомицин | 18 | |||||
| Меланоциты | первичные меланоциты | Medium 254, Добавка для роста меланоцитов человека без PMA-2, 1% раствор антибиотика | 19 | ||||
| первичные меланоциты | RPMI-1640, 10% FBS, 14,7 мкг/мл раствор фенола красного, 1% L-глутамин, 1% пенициллин/стрептомицин | 27 | |||||
| Клеточная линия HEMa-LP | Среда 254, 5 мкг/мл резус-инсулина, 50 мкг/мл аскорбиновой кислоты, 6 мМ L-глутамина, 1 мкМ адреналина, 1,5 мМ хлорида кальция, 100 Ед/мл пенициллина (при необходимости), 100 мкг/мл стрептомицина (при необходимости) | По словам продавца | |||||
| первичные эпидермальные меланоциты человека в норме (NHEM) | Меланоцитарная среда для роста (базальная среда + смесь добавок) | По словам продавца | |||||
| Фибробласты | первичные шиноновые фибробласты человека (HTF) | EMEM, 5% FBS, 5 нг/мл резус-фактора роста фибробластов, 5 мкг/мл резус-инсулина, 50 мкг/мл аскорбиновой кислоты, 7 мМ L-глютамина, 100 ЕД/мл пенициллина, 100 мкг/мл стрептомицина, 0,25 мкг/мл амфотерицина B | 28 | ||||
| первичные HTF, и | DMEM, 10% FBS, 100 ЕД/мл пенициллина, 100 мкг/мл стрептомицина, 0,25 мкг/мл амфотерицина B | 20.28 | |||||
| первичные дермальные фибробласты человека | |||||||
| Клеточная линия HFF-1 | DMEM, 15% FBS, 100 ЕД/мл пенициллина, 100 мкг/мл стрептомицина | По словам продавца | |||||
| Клеточная линия BJ | EMEM, 10% FBS, 100 Ед/мл пенициллина, 100 мкг/мл стрептомицина | По словам продавца | |||||
| Тучные клетки | первичные тучные клетки кожи человека (hsMCs) | IMDM, 10% FBS, 1% заменимые аминокислоты, 226 мкМ α-монотиоглицерин, 100 ед/мл пенициллина, 100 мкг/мл стрептомицина | 20 | ||||
| Клеточная линия LAD2 | StemPro-34, 2,5% питательная добавка StemPro-34, 2 мМ L-глутамина, 100 нг/мл резус-фактора стволовых клеток, 100 Ед/мл пенициллина, 100 мкг/мл стрептомицина | 29 | |||||
| Клеточные линии HMC-1.1 и 1.2 | IMDM, 10% FBS, 2 мМ L-глутамин, 25 мМ HEPES, 100 Ед/мл пенициллина, 100 мкг/мл стрептомицина | 29 | |||||
Таблица 8: Обзор наиболее часто используемых сред для культивирования первичных клеток кожи и клеточных линий.
Условные обозначения: Минимально необходимая среда Дульбекко (DMEM), Минимальная основная среда Eagle's (EMEM), Фетальная сыворотка крупного рогатого скота (FBS), Питательная смесь Ham's F-12 (F12), Модифицированная среда Дульбекко от Iscove (IMDM), рекомбинантная человеческая (rh), Мемориальный институт Розуэлл-Парк (RPMI).
В этой статье были созданы модели кожи с первичными клетками кератиноцитов, меланоцитов, фибробластов и тучных клеток. Они несколько более требовательны, чем клеточные линии, и рекомендуемыми средами для их культивирования, которые использовались для одноклеточной культуры, являются: дополненная среда роста кератиноцитов 2 (для кератиноцитов), дополненная среда 254 (для меланоцитов), дополненная среда DMEM (для фибробластов) и дополненная среда IMDM (для тучных клеток). На этих средах клетки демонстрируют свою типичную морфологию, соответствующую их типу (репрезентативные изображения показаны на рисунке 8). В случае мультикультур с двумя или более типами клеток важно было выбрать среду, в которой могут расти все типы культивируемых клеток. После нескольких тестов для подготовки более совершенных 3D-моделей сфер и их эквивалентов была выбрана среда DMEM с 10% FBS и 1% смесью антибиотиков.
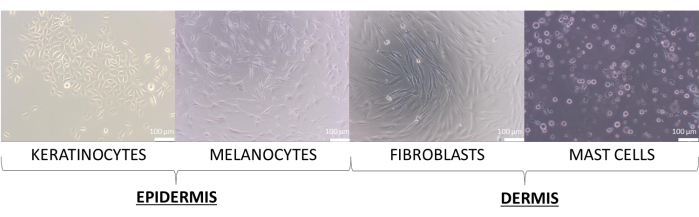
Рисунок 8: Клетки кожи имеют различную морфологию, наблюдаемую во время 2D-монокультуры. Масштабные линейки: 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Сферы (обычно называемые сфероидами) являются одними из самых простых 3D-моделей, разработанных исследователями в области клеточной и тканевой инженерии, хотя сферы, созданные из клеток кожи, не так популярны. В рамках этой модели возможно создание как моно-, так и мультикультур сфер. Влитературе описаны различные методы получения сфер (например, с помощью висячей капли, предельной адгезии клеток, магнитной левитации, вращения, микрофлюидики и т.д.). В связи с простотой подготовки, низкой стоимостью, легкодоступными материалами и оборудованием, первые два метода рекомендуются для начинающих специалистов по трехмерным (3D) моделям клеток, а протоколы их выполнения можно найти выше (шаги 2.1 и 2.2). Согласно литературе31,32, наиболее важными параметрами в этих методах являются количество клеток, объем клеточной суспензии и время инкубации.
Сферы могут быть созданы с разным количеством клеток, но плотность клеток для засеивания должна быть оптимизирована для каждого типа клеток отдельно, а также для сокультур клеток. Проведенный процесс оптимизации для монокультур кератиноцитов и фибробластов показал, что посев 1 х 104 клеток в лунку обеспечивает наилучшие результаты для обоих типов клеток. Сферы, представленные на рисунке 9 , были подготовлены с использованием метода ограничения адгезии ячеек в U-образных донных пластинах (шаг 2.2). Советуется подготовить не менее 4 лунок с техническими повторениями (оптимально – 6 лунок). Сферами, состоящими из4 ячеек 1 х 10, было легче манипулировать, так как они были видны в лунках. Как следствие, стало возможным даже удалить старую среду из скважин во время анализов без осушения сфер. После описанных операций формы сфер в основном не изменились и стали повторяемыми. Устойчивость более крупных сфер во время этого процесса была низкой. Также стоит упомянуть, что разные типы клеток могут образовывать сферы разного цвета (например, кератиноциты образуют более темные сферы, в то время как сферы фибробластов значительно светлее).
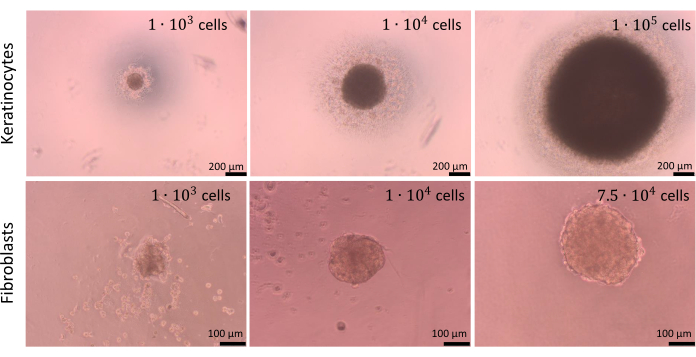
Рисунок 9: Создание сфер. Сферы, созданные различными типами и количеством клеток кожи с использованием метода предельной клеточной адгезии. Масштабные линейки (верхняя панель): 200 μм. Масштабные линейки (нижняя панель): 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Как уже говорилось в методе подвешенной капли (шаг 2.1), в определенный момент сферы требуют переноса из крышки в колодец. Этот процесс может быть потенциально вредным для сфер. Таким образом, для этого этапа важна высокая точность работы. Созданные сферы склонны терять надлежащую форму, если с ними не обращаться бережно (рисунок 10). На первом изображении (рис. 10А) представлена хорошая сфера, одинаково закругленная со всех сторон. На втором и третьем изображениях (рис. 10B, C) наблюдалась незначительная потеря формы сферой, но совокупность ячеек остается округлой. Последние три изображения (Рисунок 10D-F) показывают различные фазы повреждения сферы. Получение опыта необходимо для получения повторяемости создаваемых форм и структур сфер. При первых попытках разработки сфер неопытным исследователям рекомендуется использовать метод ограничения клеточной адгезии (шаг 2.2), так как он дает более сопоставимые результаты при ограниченном влиянии активности исследователя.
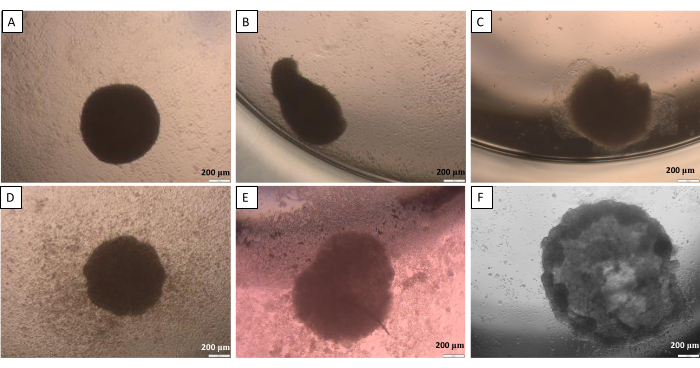
Рисунок 10: Возможные трудности при переносе сферы из крышки в колодец - метод висячей капли. (А) хорошая сфера, (В,В) слабо поврежденные сферы, (D-F) сильно поврежденные сферы. Снимки были сделаны через 24 часа после передачи. Масштабные линейки: 200 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Эквивалентами являются гораздо более совершенные 3D-модели искусственной кожи, чем сферы. В процессе построения модели кожи следует учитывать различные аспекты, в том числе количество слоев в модели (только эпидермис, только дерма, дерма с эпидермисом и роговым слоем), используемые типы клеток, применяемые материалы, предпочтительный размер эквивалента, тип исследования, в котором он будет использоваться в дальнейшем и т.д.14. Скин-эквиваленты могут быть располагаются в специальных вкладышах, размещаемых в стандартных многолуночных планшетах нужного размера (96-, 48-, 24-луночные и т.д.). Несмотря на то, что вкладыши легче переносить из одной скважины в другую и во время обмена среды, эквивалент не может быть поврежден; Стоят они достаточно дорого. Если модель не требует наличия рогового слоя, то более дешевым решением является приготовление эквивалента в лунке многолуночного планшета.
Слой искусственной дермы обычно изготавливают в виде модели на основе каркаса с использованием натуральных (желатин, коллаген, фибрин, гиалуроновая кислота, хитозан-альгинат и т.д.) или синтетических (диакрилат полиэтиленгликоля и полимолочная кислота) гидрогелей33. Чтобы быть похожим на настоящую дерму кожи, этот слой должен содержать в основном воду с некоторыми компонентами внеклеточного матрикса (ВКМ) (включая коллаген или фибронектин), которые опосредуют связывание клеток, межклеточные взаимодействия идругие клеточные действия. В данном исследовании был выбран коллаген I типа, так как он прост в приготовлении в виде гидрогеля, а его гибкая структура обеспечивает легкость дальнейшей потенциальной исследовательской деятельности (например, перенос эквивалента из одного блюда в другое). Раствор коллагена I типа, полученный из крысиного хвоста, обычно получают путем растворения порошка в 20 мМ уксусной кислоте. Для достижения стадии полимеризации коллагена необходимо обеспечить соответствующие условия pH в диапазоне 6,5-7,5. Это можно обеспечить, добавив строгое количество гидроксида натрия. Для простоты некоторые компании ввели специальные расчеты, которые могут помочь определить точные объемы, необходимые для приготовления таких гидрогелей (Таблица 6). Хотя в литературе можно встретить различные концентрации коллагена в гидрогелях (например, 0,5-2 мг/мл35; 5-30 мг/мл36; низкое и высокое содержание коллагена37), в описываемой модели использовался раствор 2 мг/мл, так как гидрогель имел еще гибкую структуру, но был достаточно компактным, чтобы его можно было вынести из лунки в случае необходимости.
Чтобы получить вполне реалистичную полноценную кожу, эквивалентные клетки должны быть засажены в пропорции, по возможности максимально приближенной к той, которая присутствует в нашем организме. В случае эпидермиса, в зависимости от участка тела, соотношение между меланоцитами и пулом ассоциированных кератиноцитов составляет примерно 1:36, что определяется как эпидермальная меланиновая единица (EMU)38. Таким образом, применяемая пропорция в искусственном эпидермисе составляла 1 меланоцит на 15 кератиноцитов (табл. 5). Для создания искусственного слоя дермы был использован гидрогель коллагена 1-го типа, в который были включены фибробласты и тучные клетки в пропорции 1 тучная клетка к 10 фибробластам. Каждый слой сконструированного эквивалента можно контролировать в режиме реального времени на инвертированном оптическом микроскопе, изменяя глубину наблюдаемого образца (примеры изображений приведены на рисунке 11).
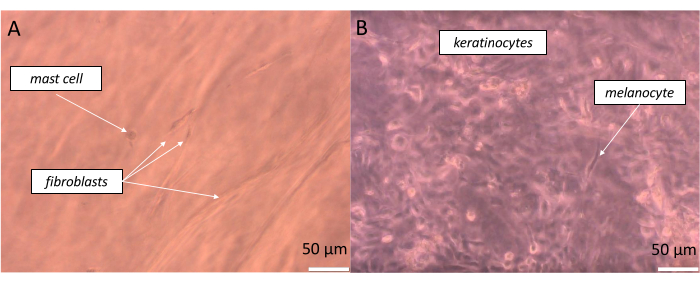
Рисунок 11: Наблюдение в режиме реального времени за различными клетками в определенных слоях созданного полнослойного кожного эквивалента (А) псевдодерма и (В) псевдоэпидермис), как это визуализировано с помощью светлопольной микроскопии. Масштабные линейки: 50 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Более точные наблюдения с подтверждением получения задуманной структуры модели можно произвести, выполнив окрашивание эквивалента. Фиксированный эквивалент нужно сначала затопить в парафине, а затем вырезать на микротоме. Предметные стекла с тонкой искусственной тканью в дальнейшем могут быть окрашены различными красителями, в том числе гематоксилином и эозином (базовое окрашивание выполняется в медицинских лабораториях). Благодаря этому действию можно различать искусственную дерму и эпидермис в эквивалентах, а также идентифицировать отдельные клетки кожи (рис. 12). На рисунке 12 показаны не только конкретные типы клеток, но и можно увидеть кератиноциты в различных фазах процесса деления клеток (телофаза и метафаза). В случае тучных клеток специфические гранулы хорошо узнаваемы внутри клетки. Эти изображения изначально подтверждают, что созданный аналог кожи является живым (клетки в нем растут) и они способны нормально функционировать в разработанной модели. Однако при использовании 3D-моделей эпидермиса и полнослойных моделей кожи особенно важно проверить качество и функциональность полученного конструкта. Чтобы проверить проницаемость рогового слоя, следует использовать измерения трансэпителиального электрического сопротивления (TEER) или окрашивание по цвету Lucifer-Yellow39,40. Кроме того, в правильно составленной искусственной коже должны присутствовать специфические маркеры, включая маркеры дифференцировки (например, филаггрин, инволюкрин, лорикрин, кератин 10, кератин 5, классы липидов, включающие церамиды), маркеры дермально-эпидермального соединения (например, коллаген IV типа, ламинин V, альфа6бета4-интегрин, антиген BP)41, маркеры плотных соединений в эпидермальных слоях (например, клаудин-1, окклюдин, белок zonula occludens (ZO)-1)42 а также маркеры пролиферации базального слоя (Ki67)41.

Рисунок 12: Морфология и функционирование клеток кожи. Обзор морфологии и функционирования клеток кожи (наблюдение за делением клеток) в эквиваленте кожи полной толщины, окрашенном гематоксилином и эозином. Масштабные линейки: 100 μм (верхняя панель), 50 μм (средняя панель, левая), 100 μм (средняя панель, правая), 50 μм (нижняя панель). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Наиболее часто используемым способом подтверждения наличия биомаркера является проведение специфического окрашивания, например, иммуногистохимического или иммунофлуоресцентного. Различные антитела и флуоресцентные красители могут быть применены для микроскопической визуализации конкретных клеток в моделях. Результат примерного окрашивания клеток в культуре можно увидеть на рисунке 13. Для наблюдения за кератиноцитами использовали антитело против цитокератина 14. В случае с меланоцитами это было специфическое антитело к мелан-А. Антитело к коллагену 1A2 использовалось для окрашивания фибробластов, а флуоресцентный сульфоходамин 101, конъюгированный с авидином, обнаруживал гепарин, присутствующий в тучных клетках.
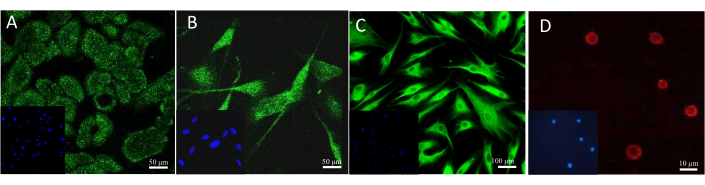
Рисунок 13: Результаты окрашивания флуоресцентных клеток. (A) Цитокератин 14 в кератиноцитах. Масштабная линейка: 50 мкм. (B) Мелан-А в меланоцитах. Масштабная линейка: 50 мкм. (C) Коллаген 1A2 в фибробластах. Масштабная линейка: 100 мкм. (D) Гепарин в тучных клетках. Масштабная линейка: 10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
В данной статье представлена методика, которую можно применять для подготовки собственных усовершенствованных моделей искусственной кожи. Это хорошее решение в тех случаях, когда запланированное исследование требует строго определенных моделей исследований, которые могут оказаться недоступными на рынке или очень дорогими. Как упоминалось ранее, на рынке доступно несколько коммерческих аналогов кожи (например, EpiSkin, EpiDerm FT). Однако их стоимость (€100-€400 за штуку) и сроки доставки (несколько дней-недель) могут побудить исследователя попытаться изготовить такую модель самостоятельно. Предлагаемые процедуры просты в выполнении даже неопытным ученым, и в то же время, позволяют получить весьма продвинутые модели кожи. Стоит подчеркнуть, что решение о клеточном составе той или иной модели полностью зависит от исследователя. Помимо созданной модели, она может быть доработана и усовершенствована, что открывает совершенно новые исследовательские перспективы. В случае с коммерческими моделями необходимо покупать другой аналог.
Несмотря на то, что 3D-клеточные культуры могут быть усовершенствованы с помощью нескольких типов клеток, просты в обращении и доступны, они все еще являются просто искусственными моделями, которые не могут полностью воссоздать сложность и функциональность ткани (например, иммунологические функции, васкуляризацию). Именно поэтому в большинстве исследований для подтверждения полученных результатов требуется несколько моделей. Некоторые достоинства и недостатки этих моделей были собраны в таблице 9, а также их ограничения. С другой стороны, коммерческие модели гарантируют высокие стандарты качества с воспроизводимостью экспериментов и сопоставимостью данных между лабораториями. Чтобы реализовать использование нового соединения для научных исследований, непременно потребуется приобрести соответствующий коммерческий аналог. Но на подготовительном этапе такая самодельная 3D-модель кожи (многоклеточного типа сфера или аналог) может помочь сократить количество экспериментов, которые необходимо проводить на коммерческом аналоге. Цель производства и использования описанных моделей заключается не в том, чтобы обойти необходимость применения сертифицированных исследовательских моделей, а в том, чтобы облегчить исследования и снизить связанные с этим расходы.
| Сравниваемая пара моделей | Преимущества | Недостатки | ||||
| Клеточные культуры в сравнении с животными | Минимизация страданий животных | Ограниченная информация о влиянии тестируемого фактора на весь организм в целом | ||||
| Высокая стандартизация эксперимента - лучшая воспроизводимость результатов | Одной модели недостаточно для отражения процессов, происходящих в организме | |||||
| Отсутствие побочных эффектов для всего организма | - | |||||
| Лучший контроль над условиями проведения эксперимента | - | |||||
| Возможность автоматизации (например, биопечать) | - | |||||
| Снижение затрат | - | |||||
| Небольшой размер необходимой выборки | - | |||||
| Ограниченное количество образующихся отходов | - | |||||
| 3D и 2D культуры | Лучше отражают весь организм | Трудоемкая культура | ||||
| Возможность создания функциональной ткани | Более высокие затраты | |||||
| Возможность создания модели, адаптированной к потребностям проводимого исследования | Самопроизвольное формирование 3D структуры практически невозможно | |||||
| - | Отсутствие стандартизированных тестов для количественной оценки эффектов различных соединений | |||||
| - | Ограниченный доступ к различным 3D-культурам, доступным на рынке | |||||
| Клеточная линия в сравнении с первичными клетками | Сертифицированные и утвержденные модели | Доступно только ограниченное количество клеточных линий | ||||
| Высокая стандартизация эксперимента - лучшая воспроизводимость результатов | Ограниченная возможность получения нескольких типов клеток от одного и того же донора | |||||
| Более длительный срок службы | Может обладать измененными свойствами от нативных клеток | |||||
| Довольно быстрый темп распространения | Часто нарушается функциональность клеток | |||||
| Менее чувствителен к нескольким видам деятельности (например, замораживанию, центрифугированию) | - | |||||
Таблица 9: Сравнение использования различных моделей в исследованиях - преимущества и недостатки
В нескольких статьях описывается, как подготовить 3D модели кожи (за исключением обзорных статей, обобщающих коммерчески доступные модели 14,43,44, они обычно сосредоточены на одной методологии получения сфер45 или эквивалентов 46).
В данной статье были описаны две методики формирования сфер с клетками кожи. Метод висячей капли широко используется, но его повторяемость и стабильность в некоторых случаях могут быть недостаточными. Большинство этапов требуют определенных действий, таких как высокая скорость работы из-за испарения воды из капель во время переноса. Также рекомендуются мягкие движения, так как отсутствие такого навыка может привести к повреждению клеточного агрегата 31,32. Таким образом, более простой метод препарирования сфер ориентирован на ограничение клеточной адгезии. Отсутствие хорошей поверхности для прикрепления клеток способствует более высокому взаимодействию между клетками. Как следствие, генерируются агрегаты ячеек. Его повторяемость значительно выше, так как нет необходимости в переносе сфер. С помощью этих методов было установлено оптимальное количество клеток кожи для создания сферы на уровне 1 х 104 клеток/сфера.
Далее были показаны процедуры, описывающие приготовление кожных эквивалентов. Их внешний вид и функциональность в исследованиях могут сильно зависеть от элементов, из которых они построены, включая клетки (табл. 2), каркасы и среды. 3D-скаффолды, используемые для подготовки искусственной кожи, можно разделить на синтетические гидрогели и те, которые сформированы из натуральных источников. В зависимости от используемого материала и его свойств для составления гидрогеля может возникнуть необходимость в дополнительном дополнении среды. Синтетические гидрогели требуют включения биоактивных молекул (белков, ферментов и факторов роста) в сеть синтетических гидрогелей для опосредования специфическихфункций клеток. Основные представленные в литературе подходы к достижению контролируемой доставки факторов роста к гидрогелям включают прямую нагрузку, электростатическое взаимодействие, ковалентное связывание и использование носителей48. Гидрогели, образованные из природных источников, таких как белки и полимеры ECM, могут генерировать жидкостные пути по всему 3D-каркасу, ускоряя распределение питательных веществ; Таким образом, отпадает необходимость в дополнительном дополнении среды. Исследования показали, что малые молекулы (такие как цитокины и факторы роста) и макромолекулы (включая гликозаминогликаны и протеогликаны) могут транспортироваться через ВКМ путем диффузии47. Тем не менее, молекулярная диффузия кислорода, питательных веществ и других биологически активных молекул может быть затруднена свойствами самого гидрогеля ECM. Более низкая диффузия коррелировала с большей толщиной гидрогеля, а также с очень высокой концентрацией коллагена37. В данном исследовании для создания кожного эквивалента использовалась низкая концентрация коллагена, равная 2 мг/мл, что говорит о том, что молекулярная диффузия через гидрогель должна быть хорошей и быстрой. Таким образом, никаких дополнительных добавок к среде на этом этапе, как и к самому гидрогелю не предусматривалось. Чтобы имитировать дерму, тучные клетки и фибробласты (1:10) были встроены в коллагеновый гидрогель. Затем меланоциты и кератиноциты (1:15) высевали на гидрогель, и весь их эквивалент культивировали в среде. Стоит отметить, что основная среда состоит из нескольких аминокислот, неорганических кислот и витаминов, а также дополнительно дополнена сывороткой (состоящей из множественных: факторов роста и прикрепления клеток, липидов, гормонов, питательных веществ и источников энергии, носителей, связывающих и переносных белков и т.д.). Чтобы добиться правильной структуры эпидермиса, следует добавлять в среду разные добавки в определенное время. Наиболее важным стимулятором для инициирования эпидермальной дифференцировки является кальций, так как он активирует внутриклеточную сигнализацию. Аскорбиновая кислота стимулирует сигнальный путь, аналогичный тому, который опосредован кальцием, но ее действие также сопровождается усилением транспорта аскорбата и предотвращением истощения гидрофильных антиоксидантов41. Кроме того, дифференцировка клеток улучшалась при добавлении в среду других компонентов (таких как кофеин, гидрокортизон, трийодтиронин, аденин и холерный токсин)41,44. Важно, что подготовленные модели всегда должны проверяться на наличие заданного типа ячеек в соответствующем слое. Наличие всех четырех типов клеток кожи было подтверждено в структуре созданного эквивалента с помощью H&E окрашивания.
Наиболее распространенной проблемой, с которой приходится сталкиваться, является деликатность и интуиция в обращении с полученными моделями. Некоторые трудности могут быть связаны с формированием клеточной сферы, а также с получением гидрогеля. Во время культивирования клеток также может возникнуть ряд других проблем; к ним относятся микробные инфекции, низкая скорость пролиферации клеток, старение первичных клеток, используемых в моделях, максимальное время культивирования 2D и 3D моделей, реконструированных из первичных клеток по сравнению с клеточными линиями, и т. д. В таблице 10 собраны некоторые практические советы о том, что делать при возникновении одной из следующих проблем.
| Распространенные проблемы в клеточных культурах | Предложения | |||
| Микробная инфекция | Если микробное заражение произошло в одной из колб/посуды с клетками, лучше как можно быстрее удалить зараженную культуру (чтобы не загрязнить оставшиеся колбы/посуду клетками). Повторно заморозьте новый флакон с ячейками. Если инфекция возвращается, хорошо попытаться расширить спектры применяемых антибиотиков и увеличить их концентрацию. | |||
| Низкая скорость пролиферации клеток | Некоторые клетки имеют длительное время удвоения. Чтобы стимулировать их пролиферацию, в основную среду можно добавить несколько специфических для клеток факторов роста. Кроме того, увеличение концентрации FBS или L-глутамина в базальной среде может помочь стимулировать рост клеток. | |||
| Старение первичных клеток, используемых в моделях | После нескольких проходов первичные клетки вступают в старение и перестают делиться. Чтобы преодолеть эту проблему в моделях, рекомендуется использовать для построения модели ячейки с как можно более раннего прохода. | |||
| Максимальное время культивирования 2D и 3D моделей, реконструированных из первичных клеток по сравнению с клеточными линиями | Время выращивания модели сильно зависит от типа используемых ячеек. С первичными клетками время культивирования будет короче из-за их короткой продолжительности жизни. | |||
| Трудности в формировании клеточной сферы | Некоторым ячейкам может потребоваться больше времени для формирования сфер. Если еще через несколько дней сферы не образовались, соберите клетки из образца и проверьте их жизнеспособность, например, окрашиванием трипановым синим. | |||
| Проблемы со стабильностью сфер | Если сферы нестабильны и разрушаются при обращении, попробуйте создать сферы из меньшего количества клеток. Обязательно всегда аккуратно перекладывайте посуду, в которой растут сферы. | |||
| Трудности с приготовлением гидрогеля | Проверьте правильность пропорции ингредиентов (вода, PBS [10x], NaOH, коллаген типа 1). Исходный раствор коллагена обычно очень густой, поэтому обязательно медленно пипетируйте его. Пузырьки воздуха нарушают морфологию гидрогеля, поэтому обратное пипетирование геля может помочь в решении этой проблемы. | |||
Таблица 10: Устранение неполадок с клеточными культурами
Созданные модели после изготовления могут быть использованы во многих областях, начиная с (1) экспериментов по цитотоксичности и генотоксичности новых соединений с биологической активностью для использования в лекарствах и косметике49, (2) экспериментов с различными факторами стимуляции50, (3) фундаментальных исследований, расширяющих наши знания о клетках кожи, их биологических функциях, взаимодействии с другими клетками и окружающей средой51, 52, (4) исследования отдельных патологических образований, в которых определенный тип клеток может быть введен в созданную модель (раковые клетки, клетки с мутацией в данном гене и т.д.14,53) и многое другое. Излишне говорить, что применение этих моделей согласуется с принципом 3R для более этичного использования животных при тестировании продукции и научных исследованиях и не нарушает закон о запрете тестирования косметической продукции на животных.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Авторы выражают благодарность за финансовую поддержку, оказанную Варшавским технологическим университетом в рамках программы «Excellence Initiative - Research University» в виде двух грантов: POB BIB BIOTECHMED-2 start (No 1820/2/ZO1/POB4/2021) и гранта ректора для студенческих научных групп (SKIN-ART, No 1820/116/Z16/2021). Кроме того, авторы хотели бы выразить признательность за поддержку, полученную от профессора Иоанны Цеслы и кафедры биотехнологии лекарств и косметики, а также от Научного клуба биотехнологии «Herbion» на химическом факультете Варшавского технологического университета. Особая благодарность доктору Михалу Степулаку за предоставление состава Pluronic F-127.
Материалы
| Name | Company | Catalog Number | Comments |
| 24-well plate for adherent cell culture | Biologix Europe GmbH | 07-6024 | - |
| 35%–38% HCL | Chempur | 115752837 | - |
| 60 mm cell culture Petri dish | Nest | 705001 | - |
| Avidin−Sulforhodamine 101 | Sigma Aldrich | A2348-5MG | - |
| Bright-field inverted microscope | Olympus | CKX41 | - |
| Calcium chloride | Avantor | 874870116 | - |
| Cell culture flask T75 for adherent cells | Genoplast | G77080033 | - |
| Centrifuge tube 15 mL | GoogLab Scientific | G66010522 | - |
| CO2 Incubator | Heal Force | Galaxy 170R | - |
| Col1A2 antibody produced in rabbit | Novus | NBP2-92790 | - |
| Corning(R) Transwell(R) Polycarbonate | Corning | CLS3422-48EA | - |
| Cytokeratin 14 antibody produced in mouse | Novus | NBP1-79069 | - |
| DPX Mountant for histology | Sigma Aldrich | 06522-100ML | - |
| Dulbecco's Modified Eagle Medium (DMEM) | VWR Chemicals | L0102-500 | - |
| Eosine Y | Kolchem | - | 0.5 % aquatic solution |
| Eppendorf tube 1.5 mL | Sarstedt | 72.690.001 | - |
| Eppendorf tube 2 mL | Sarstedt | 72.691 | - |
| Ethyl alcohol absolute 99.8% | Avantor | 396480111 | diluted in ultrapure water to the needed concentrations |
| Fetal bovine serum | Gibco | 10270106 | - |
| Fluorescent inverted microscope | Olympus | IX71 | - |
| Goat anti-mouse secondary antibody conjugated with FITC | Sigma Aldrich | F0257-1mL | |
| Goat anti-rabbit secondary antibody conjugated with FITC | Novus | NB7159 | - |
| Harris Hematoxylin | Kolchem | - | 1 mg/mL in 95% ethanol |
| Hoechst 33342 | ThermoFisher | H3570 | - |
| Laminar chamber | Heal Force | HFSafe-1200 | - |
| Melan-A antibody produced in mouse | Santa Cruz Biotechnology | sc-20032 | - |
| Microtome | Microm | HM355S | - |
| NaOH | Avantor | 810981997 | - |
| Paraffin pastilles | Sigma Aldrich | 1.07164 | - |
| Paraformaldehyde | Sigma Aldrich | 1581227 | - |
| Penicillin/Streptomycin solution | Sigma Aldrich | P4333 | - |
| Pipette tip, 1000 µL | Sarstedt | 70.305 | - |
| Pipette tip, 20 µL | Sarstedt | 70.3021 | - |
| Pipette tip, 200 µL | Sarstedt | 70.303 | - |
| Pluronic F-127 | BASF | 50401036 | - |
| Serological pipette 10 mL | GoogLab Scientific | G33270011 | - |
| Serological pipette 25 mL | GoogLab Scientific | G33280011 | - |
| Serological pipette 5 mL | GoogLab Scientific | G33260011 | - |
| Sodium bicarbonate | Sigma Aldrich | S5761 | - |
| Sodium bicarbonate | Chempur | 118105307 | |
| Trypsin-EDTA 0.25% solution, phenol red | Sigma Aldrich | 25200072 | - |
| Type 1 collagen | IBIDI | 50201 | - |
| U-bottom 96-well plate | Sarstedt | 83.3925500 | - |
| Xylene | Sigma Aldrich | 534056 | - |
Ссылки
- Farage, M. A., Miller, K. W., Elsner, P., Maibach, H. I. Characteristics of the aging skin. Advances in Wound Care. 2 (1), 5-10 (2013).
- Zhu, H., Alikhan, A., Maibach, H. I. Biology of Stratum Corneum: Tape Stripping and Protein Quantification. Textbook of Aging Skin. Farage, M. A., Miller, K. W., Maibach, H. I. , Springer Berlin Heidelberg. Berlin, Heidelberg. (2015).
- Boer, M., Duchnik, E., Maleszka, R., Marchlewicz, M. Structural and biophysical characteristics of human skin in maintaining proper epidermal barrier function. Postepy Dermatogogii I Alergologii. 33 (1), 1-5 (2016).
- De Falco, M., Pisano, M. M., De Luca, A. Embryology and Anatomy of the Skin. In Skin Cancer: A Practical Approach. Current Clinical Pathology. Baldi, A., Pasquali, P., Spugnini, E. P. , Springer. New York. (2014).
- Dehdashtian, A., Stringer, T. P., Warren, A. J., Mu, E. W., Amirlak, B., Shahabi, L. Anatomy and Physiology of the Skin. Melanoma: A Modern Multidisciplinary Approach. Riker, A. I. , Springer International Publishing: Cham. 15-26 (2018).
- Graham, H. K., Eckersley, A., Ozols, M., Mellody, K. T., Sherratt, M. J. Human Skin: Composition, Structure and Visualisation Methods. Skin Biophysics; Studies in Mechanobiology, Tissue Engineering, and Biomaterials. Limbert, G. 22, Springer International Publishing: Cham. 1-18 (2019).
- Piasek, A. M., Musolf, P., Sobiepanek, A. Aptamer-based advances in skin cancer research. Current Medicinal Chemistry. 30 (8), 953-973 (2023).
- Bergfeld, W. F., Belsito, D. V., Marks, J. G., Andersen, F. A. Safety of ingredients used in cosmetics. Journal of the American Academy of Dermatology. 52 (1), 125-132 (2005).
- Hubrecht, R. C., Carter, E. The 3Rs and humane experimental technique: Implementing change. Animals. 9 (10), 754(2019).
- Sreedhar, D., Manjula, N., Ajay, P., Shilpa, P., Ligade, V. Ban of cosmetic testing on animals: A brief overview. International Journal of Current Research and Review. 12 (14), 113-116 (2020).
- Silva, R. J., Tamburic, S. A state-of-the-art review on the alternatives to animal testing for the safety assessment of cosmetics. Cosmetics. 9 (5), 90(2022).
- Xu, Y., Shrestha, N., Préat, V., Beloqui, A. An overview of in vitro, ex vivo and in vivo models for studying the transport of drugs across intestinal barriers. Advanced Drug Delivery Reviews. 175, 113795(2021).
- Boelsma, E., Ponec, M. Basics (Guidelines) on Cell Culture Testing for Topical/Dermatological Drugs/Products and Cosmetics With Regard to Efficacy and Safety of the Preparations. In Dermatopharmacology of Topical Preparations. Gabard, B., Surber, C., Elsner, P., Treffel, P. , Springer Berlin Heidelberg. Berlin, Heidelberg. 37-57 (2000).
- Suhail, S., Sardashti, N., Jaiswal, D., Rudraiah, S., Misra, M., Kumbar, S. G. Engineered skin tissue equivalents for product evaluation and therapeutic applications. Biotechnology Journal. 14 (7), 1900022(2019).
- Sobiepanek, A., et al. Novel diagnostic and prognostic factors for the advanced melanoma based on the glycosylation-related changes studied by biophysical profiling methods. Biosensors and Bioelectronics. 203, 114046(2022).
- Yang, H., Sun, L., Liu, M., Mao, Y. Patient-derived organoids: A promising model for personalized cancer treatment. Gastroenterology Report. 6 (4), 243-245 (2018).
- Baran, J., et al. Mast cells as a target-A comprehensive review of recent therapeutic approaches. Cells. 12 (8), 1187(2023).
- Kosten, I. J., Buskermolen, J. K., Spiekstra, S. W., de Gruijl, T. D., Gibbs, S. Gingiva equivalents secrete negligible amounts of key chemokines involved in langerhans cell migration compared to skin equivalents. Journal of Immunology Research. 2015, 627125(2015).
- cieżyńska, A., et al. A novel and effective method for human primary skin melanocytes and metastatic melanoma cell isolation. Cancers. 13 (24), 6244(2021).
- Kröger, M., et al. In vivo non-invasive staining-free visualization of dermal mast cells in healthy, allergy and mastocytosis humans using two-photon fluorescence lifetime imaging. Scientific Reports. 10 (1), 14930(2020).
- Liu, D., Chen, S., Win Naing, M. A review of manufacturing capabilities of cell spheroid generation technologies and future development. Biotechnology and Bioengineering. 118 (2), 542-554 (2021).
- Rossi, A., Appelt-Menzel, A., Kurdyn, S., Walles, H., Groeber, F. Generation of a three-dimensional full thickness skin equivalent and automated wounding. Journal of Visualized Experiments: JoVE. (96), e52576(2015).
- Kim, K., Kim, J., Kim, H., Sung, G. Y. Effect of α-lipoic acid on the development of human skin equivalents using a pumpless skin-on-a-chip model. International Journal of Molecular Sciences. 22 (4), 2160(2021).
- Curto, E. V., Lambert, G. W., Davis, R. L., Wilborn, T. W., Dooley, T. P. Biomarkers of human skin cells identified using DermArray DNA arrays and new bioinformatics methods. Biochemical and Biophysical Research Communications. 291 (4), 1052-1064 (2002).
- Godwin, L. S., et al. Isolation, culture, and transfection of melanocytes. Current Protocols in Cell Biology. 63, 1-20 (2014).
- Przekora, A., Zarnowski, T., Ginalska, G. A simple and effective protocol for fast isolation of human tenon's fibroblasts from a single trabeculectomy biopsy - a comparison of cell behaviour in different culture media. Cellular & Molecular Biology Letters. 22, 5(2017).
- Rådinger, M., Jensen, B. M., Kuehn, H. S., Kirshenbaum, A., Gilfillan, A. M. Generation, Isolation, and Maintenance of Human Mast Cells and Mast Cell Lines Derived from Peripheral Blood or Cord Blood. Current Protocols in Immunology. Coligan, J. E., Bierer, B. E., Margulies, D. H., Shevach, E. M., Strober, W. , John Wiley & Sons, Inc. Hoboken, NJ. (2010).
- Artuc, M., Muscha Steckelings, U., Henz, B. M. Mast cell-fibroblast interactions: Human mast cells as source and inducers of fibroblast and epithelial growth factors. Journal of Investigative Dermatology. 118 (3), 391-395 (2002).
- Panos, R. J., Rubin, J. S., Csaky, K. G., Aaronson, S. A., Mason, R. J. Keratinocyte growth factor and hepatocyte growth factor/scatter factor are heparin-binding growth factors for alveolar type ii cells in fibroblast-conditioned medium. Journal of Clinical Investigation. 92 (2), 969-977 (1993).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Threedimensional cell culture: A powerful tool in tumor research and drug discovery (Review). Oncology Letters. 14 (6), 6999-7010 (2017).
- Amaral, R. L. F., Miranda, M., Marcato, P. D., Swiech, K. Comparative analysis of 3D bladder tumor spheroids obtained by forced floating and hanging drop methods for drug screening. Frontiers in Physiology. 8, 605(2017).
- Gao, B., Jing, C., Ng, K., Pingguan-Murphy, B., Yang, Q. Fabrication of three-dimensional islet models by the geometry-controlled hanging-drop method. Acta Mechanica Sinica. 35 (2), 329-337 (2019).
- Zhang, C., et al. 3D culture technologies of cancer stem cells: Promising ex vivo tumor models. Journal of Tissue Engineering. 11, (2020).
- Sobiepanek, A., Paone, A., Cutruzzolà, F., Kobiela, T. Biophysical characterization of melanoma cell phenotype markers during metastatic progression. European Biophysics Journal: EBJ. 50 (3-4), 523-542 (2021).
- Jin, G. -Z., Kim, H. -W. Effects of Type I collagen concentration in hydrogel on the growth and phenotypic expression of rat chondrocytes. Tissue Engineering and Regenerative. 14 (4), 383-391 (2017).
- Osidak, E. O., et al. Concentrated collagen hydrogels: A new approach for developing artificial tissues. Materialia. 20, 101217(2021).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: Characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Jimbow, K., Salopek, T. G., Dixon, W. T., Searles, G. E., Yamada, K. The epidermal melanin unit in the pathophysiology of malignant melanoma. The American Journal of Dermatopathology. 13 (2), 179-188 (1991).
- Van Den Bogaard, E., et al. Perspective and consensus opinion: Good practices for using organotypic skin and epidermal equivalents in experimental dermatology research. Journal of Investigative Dermatology. 141 (1), 203-205 (2021).
- Bednarek, R. In vitro methods for measuring the permeability of cell monolayers. Methods and Protocols. 5 (1), 17(2022).
- Idrees, A., et al. Fundamental in vitro 3D human skin equivalent tool development for assessing biological safety and biocompatibility - towards alternative for animal experiments. 4 Open. 4, (2021).
- Park, H. -Y., Kweon, D. -K., Kim, J. -K. Upregulation of tight junction-related proteins by hyaluronic acid in human HaCaT keratinocytes. Bioactive Carbohydrates and Dietary Fibre. 30, 100374(2023).
- Choudhury, S., Das, A. Advances in generation of three-dimensional skin equivalents: Pre-clinical studies to clinical therapies. Cytotherapy. 23 (1), 1-9 (2021).
- Zhang, Z., Michniak-Kohn, B. B. Tissue engineered human skin equivalents. Pharmaceutics. 4 (1), 26-41 (2012).
- Woappi, Y., Altomare, D., Creek, K. E., Pirisi, L. Self-assembling 3D spheroid cultures of human neonatal keratinocytes have enhanced regenerative properties. Stem Cell Research. 49, 102048(2020).
- Ouwehand, K., Spiekstra, S. W., Waaijman, T., Scheper, R. J., de Gruijl, T. D., Gibbs, S. Technical advance: Langerhans cells derived from a human cell line in a full-thickness skin equivalent undergo allergen-induced maturation and migration. Journal of Leukocyte Biology. 90 (5), 1027-1033 (2011).
- Akther, F., Little, P., Li, Z., Nguyen, N. -T., Ta, H. T. Hydrogels as artificial matrices for cell seeding in microfluidic devices. RSC Advances. 10 (71), 43682-43703 (2020).
- Silva, A. K. A., Richard, C., Bessodes, M., Scherman, D., Merten, O. -W. Growth factor delivery approaches in hydrogels. Biomacromolecules. 10 (1), 9-18 (2009).
- Lee, H. -R., et al. Effect of Aronia extract on collagen synthesis in human skin cell and dermal equivalent. Oxidative Medicine and Cellular Longevity. 2022, 4392256(2022).
- Mulder, P. P. G., Raktoe, R. S., Vlig, M., Elgersma, A., Middelkoop, E., Boekema, B. K. H. L. Full skin equivalent models for simulation of burn wound healing, exploring skin regeneration and cytokine response. Journal of Functional Biomaterials. 14 (1), 29(2023).
- Goncalves, K., et al. Investigation into the effect of skin tone modulators and exogenous stress on skin pigmentation utilizing a novel bioengineered skin equivalent. Bioengineering & Translational Medicine. 8 (2), 10415(2023).
- Michel, M., L'Heureux, N., Pouliot, R., Xu, W., Auger, F. A., Germain, L. Characterization of a New Tissue-Engineered Human Skin Equivalent with Hair. In Vitro Cellular & Developmental Biology. Animal. 35 (6), 318-326 (1999).
- Müller, I., Kulms, D. A 3D organotypic melanoma spheroid skin model. Journal of Visualized Experiments: JoVE. (135), e57500(2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены