Method Article
一种用于研究活细胞和模型膜中质膜修复的热等离子体方法
摘要
热等离子体穿刺方法集成了共聚焦显微镜、光学镊子和金纳米颗粒,以研究细胞和巨型单层囊泡质膜修复过程中的蛋白质反应。该技术能够实现快速和局部的膜穿刺,从而能够识别关键蛋白质及其在复杂的质膜修复机制中的功能作用。
摘要
细胞膜对细胞存活至关重要,确保其完整性至关重要,因为细胞在其整个生命周期中都会受到损伤。为了防止膜损伤,细胞已经开发出有效的质膜修复机制。这些修复机制可以通过结合共聚焦显微镜和纳米级热等离子体来研究,以识别和研究参与活细胞和膜模型系统表面修复的关键蛋白质(如膜联蛋白)的作用。
穿刺方法采用激光在纳米颗粒辐照下诱导高度局部加热。近红外光的使用最大限度地减少了生物样品中的光毒性,而大部分吸收发生在近红外共振等离子体纳米颗粒中。这种热等离子体方法已被用于潜在的光热和生物物理研究,以通过囊泡和细胞融合研究增强对细胞内机制和细胞反应的理解。该方法已被证明是对现有膜破坏方法的补充,例如机械、化学或光学诱导的损伤,并通过造成极度局部的损伤来提供高水平的控制。损伤的程度仅限于球形纳米颗粒附近,与使用不同波长的脉冲激光相比,沿光束路径不会发生有害损伤。尽管存在某些局限性,例如纳米气泡的形成,但热等离子体方法提供了一种独特的工具,用于在不影响细胞活力的情况下,在几乎天然的环境中研究质膜修复中的细胞反应。
当与共聚焦显微镜相结合时,穿刺方法可以提供对模型膜系统中膜动力学的机理理解,以及蛋白质对膜损伤反应的定量信息,包括蛋白质募集及其生物物理功能。总体而言,将该方法应用于简化模型系统可以增强我们对活细胞中复杂的质膜修复机制的理解。
引言
细胞膜既是物理屏障,又是信号传导平台,对细胞存活至关重要1。在整个细胞周期中,质膜 (PM) 会受到损伤,例如机械2、3、4、5 和化学6 应激诱导的损伤。为了保持膜的完整性并确保细胞存活,细胞已经开发出强大的质膜修复(PMR)机制。这些机制依赖于各种策略,例如细胞骨架重组、膜融合和膜置换策略 7,8,9,10,11,所有这些都依赖于特定蛋白质的募集。值得注意的是,膜联蛋白家族的成员已被确定为与 PMR1、9、12、13、14、15、16 过程相关的关键蛋白。PM 损伤后,细胞会经历钙离子 (Ca2+) 的涌入,这对细胞的存活构成直接威胁17。作为 PMR 策略的一部分,主要位于胞质溶胶中的膜联蛋白响应 Ca2+ 的内流,与受损质膜的内小叶结合18。膜联蛋白 A2 (ANXA2) 是与肌蛋白缺乏型肌营养不良症中 PMR 相关的膜联蛋白家族的首批成员之一,并建议通过将细胞内囊泡融合到损伤部位附近的 PM 来介导修复 5,19,20,21。随后,一些功能被归因于膜联蛋白22,它们在过去 20 年中在 PMR 中的作用引起了越来越多的关注。然而,膜联蛋白在PMR中的确切作用仍未完全清楚15,18,21,22。
本文提出了一种利用共聚焦显微镜、光镊和金纳米颗粒(AuNPs)的组合,以可控和高度局部的方式研究蛋白质-膜相互作用和膜动力学的方法。该方法可以定量研究蛋白质、脂质和小分子相互作用对膜损伤和 Ca2+ 流入的反应。尽管膜修复过程中涉及的成分复杂且多重,但模拟质膜的简化膜系统已被用于更深入地了解膜动力学和膜联蛋白对膜破坏的反应的机制 16。选择巨型单层脂质囊泡(GUV)作为具有特定脂质组成的模型膜系统。如Weinberger等人23所述,使用凝胶辅助水合方法(特别是聚乙烯醇凝胶水合)生成GUV,该方法允许将膜联蛋白有效地封装到GUV中。
利用近红外 (NIR) 激光照射对金属纳米颗粒 (NPs) 会引起 NP 的显着加热,使其成为建立生物医学应用中利用的局部热源的有效方法24.该方法最初用于在 2D 和 3D 仿生测定中直接测量单个 AuNP 周围的温度。在这些测定25,26中,等离子体纳米颗粒被照射在负载的脂质双层上,或光学捕获在局部加热时发生局部热相变的GUV附近,从而能够定量和控制颗粒周围的确切温度曲线。在研究或操作生物标本时,已使用该参考温度曲线。该方法的进一步进步促进了膜中纳米孔的诱导27,允许囊泡和细胞融合28,29。其他研究通过创建新型杂交囊泡来研究 GUVs29 和跨膜蛋白30 中外周膜蛋白的行为,同时还探索了细胞特异性药物递送来控制和研究细胞反应或基因表达28、29、31、32、33。最近,该方法已被用于研究蛋白质对膜损伤的反应32,34,35。
有几种方法可以破坏质膜以探索细胞反应和膜修复。这些包括微针穿刺、微珠摇晃和细胞刮擦,所有这些都可以机械地破坏细胞膜 14,36,37。通过添加洗涤剂 5,38 或细菌毒素39,40 可以实现化学诱导的损伤,这些洗涤剂会破坏脂质双层的稳定性并在质膜上产生膜孔。此外,连续波和脉冲激光的光学诱导损伤已被用于研究PMR组分,例如膜联蛋白5,14,21,41,与等离子体纳米颗粒42,43,44,45相结合.尽管高功率脉冲激光器效率很高,但它们可能会沿光束路径对电池内部造成重大伤害和损坏。此外,在脉冲激光照射下生物物质发生的详细变化以及它是否会产生明确的孔仍有待进一步研究。本文介绍了一种替代方法,利用热等离子体以受控方式在PM中诱导纳米孔34,35,而不会对内部结构造成重大损害。这是通过将等离子体NP暴露在高度聚焦的近红外激光下来实现的,导致极其局部的温度升高,很容易达到超过200°C的温度,这可能导致小的纳米爆炸25,46,47。该过程可以通过调整激光强度以及 NPs48 的尺寸、形状和成分来控制。通过采用这种技术,研究人员可以探索蛋白质在活细胞中PM修复中的作用,这可以帮助解决有关膜联蛋白参与膜修复的一些未解决的问题,而不会影响细胞活力。
先前的研究已经很好地确立了等离子体纳米粒子的光学捕获 25,49,50,51,52;然而,关于纳米粒子53,54,55的热等离子体性质的更多见解可以在补充材料(补充文件1)中获得。热等离子体方法可用于在PM中创建纳米孔,以研究细胞反应和修复机制。更准确地说,穿刺可以通过在膜附近对AuNPs进行光学加热来实现,如图1A和B所示。这种局部穿刺允许 Ca2+ 流入,这已通过钙传感器验证,从而激活了 PMR 机制。对于活细胞实验,将直径为 200 nm 的 AuNP 固定在细胞下方的表面上,以通过共聚焦显微镜监测 ANXA2 在 PMR 中的作用。波长为1064nm的近红外激光(图1A,B)利用其等离子体特性照射AuNP(图1C),在生物透明窗口49中产生大量的局部加热(图1D),同时对细胞本身造成最小的损害。如图1E所示,AuNP周围的高温区域在与NP半径相对应的距离处迅速减少30-40%,从而在所有三个维度上都存在极其有限的损伤。
补充文件 1. 请点击此处下载此文件。
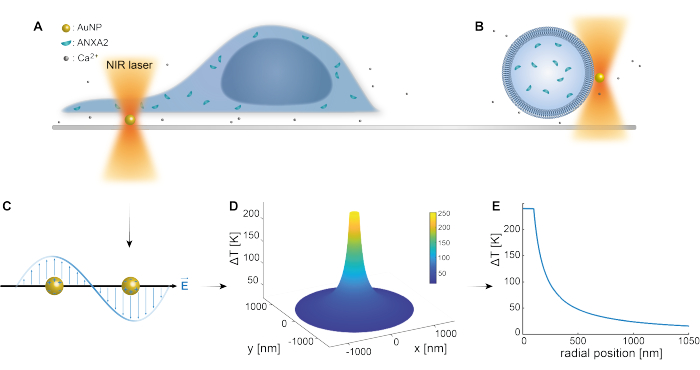
图1:实验方法示意图。 (A) ANXA 转染的细胞位于表面固定的金纳米颗粒 (AuNP) 的顶部,或 (B) 具有封装 ANXA 的巨型单层囊泡 (GUV) 悬浮在含有 AuNP 的培养基中。(C) 单个AuNP被近红外光阱照射,其中入射电磁场和传导电子之间的相互作用导致NP内电子的集体振荡。(D)该过程导致高度限制但显着的温度升高。为了估计NP表面的温度,采用Mie理论,计算直径为200 nm,激光强度I = 6.36 x 108 W/cm2的AuNP的(E)温度分布。请点击这里查看此图的较大版本.
为了尽量减少对细胞膜的热效应,AuNPs仅被照射~1秒。这会导致瞬态和局部加热爆发,从而减少对蛋白质的损害,而蛋白质通常需要更多时间才能展开。膜穿刺后,膜联蛋白在几分之一秒内被募集,并在几秒钟内在损伤部位周围形成膜联蛋白环状支架(图2)。这种方法也被应用于探索 ANXA5 在活细胞和模型膜16 中的参与,以阐明修复过程的完整方案。虽然主要关注的是各种膜联蛋白的相关募集,但修复机制的生物物理方面尚未阐明。
为了完全实现所提出的方法,需要三个关键组件:共聚焦显微镜、光学镊子和金属纳米颗粒。光镊用于捕获AuNPs,其构造可以通过遵循Neuman等人概述的程序来实现49。然而,如果制造光学镊子被证明太具有挑战性,则可以使用紧密聚焦的近红外激光器来照射固定在细胞下方的AuNP。虽然该协议选择了球形AuNP,但也可以利用具有可调吸收光谱的各种等离子体粒子来实现NIR区域48内的高度局部温度梯度。
荧光成像对于观察荧光标记蛋白质的作用是必要的,因此,全内反射显微镜 (TIRF)56 可以被视为共聚焦成像的替代方案。然而,该技术仅允许表面成像,与模型膜囊泡实验不兼容。因此,光学镊子和共聚焦显微镜对于纳米颗粒的精确定位和细胞损伤周围局部区域的详细研究都是必不可少的。为了用衍射极限激光焦点有效地照射纳米颗粒,有必要将纳米颗粒可视化。这可以通过反射显微镜实现最佳效果,反射显微镜是徕卡共聚焦显微镜的标准成像功能。然而,如果没有反射或散射成像,可以考虑其他方法,例如效率较低的荧光AuNP标记。
综上所述,本研究提出的高度可控和局部化的热等离子体方法有可能成为研究活细胞中参与细胞反应和PM修复机制的分子成分的良好平台。除了研究 PM 损伤后的蛋白质反应外,该方法还可用于局部刺穿囊泡,从而能够研究蛋白质-蛋白质和蛋白质-膜动力学中的蛋白质反应。此外,当膜被破坏时,该方法允许对蛋白质、脂质和小分子之间的相互作用进行定量分析。总的来说,这些进展有可能揭示一些关于错综复杂的质膜修复机制的未解决的问题。
研究方案
1. 细胞膜穿刺准备
- 细胞接种(第 1 天)
- 在37°C的5%CO2 加湿器培养箱中培养人胚胎肾(HEK293T)细胞,直至达到70%汇合度。
- 使用 500 μL 胰蛋白酶将细胞从表面分离,计数 200,000 个HEK293T细胞,并将它们接种在总体积为 3 mL 培养基的培养皿中。将细胞在37°C下在5%CO2 加湿器培养箱中孵育24小时。
注意:为防止细胞聚集在培养皿中心,请均匀分布细胞并避免旋转培养皿,因为这会降低转染效率。
- 细胞转染(第2天)
注意:转染的细胞可在转染后48小时内使用。- 使用前将目标质粒和转染试剂移液5秒。
- 在无菌的 2 mL 试管中,按特定顺序混合以下物质:500 μL 还原血清培养基、5 μL 转染试剂(比质粒多 4 倍)和 1.25 μL 质粒 (1 μg/μL)。
注意:要研究膜破裂时的钙内流,请遵循相同的程序,但使用膜结合的钙传感器探头GCaMP6-CAAX(1μg/μL)。 - 轻轻但彻底地移液转染混合物,并在室温(RT)下孵育30分钟,然后将其滴加到细胞中。
- 在加入转染混合物之前,从培养皿中取出培养基,用 2 mL 磷酸盐缓冲盐水轻轻洗涤细胞,然后向培养皿中加入 2000 μL 还原血清培养基。
- 在37°C下将细胞与转染混合物一起在5%CO2 加湿器培养箱中孵育2小时和45分钟,然后将培养基更换为3mL培养基。
- 金纳米颗粒(AuNP)溶液的制备(第2天)
- 将 200 nm AuNP 储备溶液在 10 级涡旋 10 秒(有关设备的进一步规格,请参阅 材料表 ),超声处理 5 分钟(最大振幅),然后再次涡旋 10 秒。
- 将 150 μL AuNP 与 850 μL 蒸馏水混合至总体积为 1 mL。
注意: 稀释的 AuNP 溶液可以存放在冰箱中并重复使用长达 1 个月。
- 准备实验皿(第2天)
- 用 150 μL 0.01%-0.1% 细胞附着溶液包覆微孔培养皿,并在室温下孵育 15 分钟。
- 用 500 μL 蒸馏水清洗玻璃表面两次,并使其风干 ~10 分钟。
- 将 80 μL AuNP 溶液滴加到干燥表面。
注意:涡旋(10 秒)、超声处理(5 分钟)和涡旋(10 秒)稀释的 AuNP 溶液,然后将其添加到镀膜玻璃表面以最大限度地减少 AuNP 聚集体。 - 等待 ~10 分钟,然后引入 1.5 mL 培养基。让培养皿在37°C下孵育过夜。
- 实验室的准备(第3天)
注意:实验室可以在第 3 天或第 4 天准备;但是,请确保在实验的同一天完成以下准备工作。- 从培养皿中的细胞中取出培养基,并用 2 mL 磷酸盐缓冲盐水洗涤细胞。
注意:此步骤对于去除任何可能干扰后续步骤的残留介质和碎屑至关重要。 - 向孔中加入 500 μL 基于酶的细胞分离溶液,孵育 1-3 分钟,直到细胞从培养皿中分离。
- 加入 1.5 mL 新鲜培养基并移液细胞溶液以获得均匀的细胞溶液,以最大程度地减少细胞簇的可能性。
- 小心地从实验微孔中的AuNP中除去培养基。
- 将细胞溶液(2mL)加入微孔中,并在进行实验前将其孵育至少5小时。
注意:为获得最佳实验条件,请避免旋转腔室,因为这可能会导致细胞聚集在腔室中间。
- 从培养皿中的细胞中取出培养基,并用 2 mL 磷酸盐缓冲盐水洗涤细胞。
2.细胞膜穿刺实验
- 实验的光学设置
- 使用共聚焦扫描显微镜结合 1064 nm 捕获激光57 进行实验。
- 使用数值孔径 (NA) 为 1.2 的 63 倍浸水物镜在焦平面上进行光学捕获。
- 假设焦点是艾里圆盘的大小,并且照射激光的焦束宽度半径为 ~540 nm。
- 通过计算每面积激光功率 (W/cm2) 将激光功率 (P) 转换为相应的激光强度 (I)。
- 利用声声分光器 (AOBS) 可视化使用光电倍增管检测到的多个荧光信号,并通过其散射信号同时检测金属 NP。
注意:并非所有共聚焦系统都配备了AOBS,它允许对金属NP进行反射成像。在这里,必须实施其他形式的检测,或者可以尝试对细胞下方区域的近红外激光器进行顺序扫描。 - 在实验过程中,在显微镜上安装一个包含细胞、分子荧光探针和金纳米颗粒的玻璃底开放式腔室。
- 通过平移安装在压电载物台上的样品,相对于细胞移动陷阱,实现纳米级精确的横向移动16。
注意: 光阱保持静止。
- 细胞膜穿刺的实验设置
- 将用膜联蛋白质粒和荧光蛋白转染的HEK293T细胞放在固定在玻璃表面的分离AuNPs上(图1A)。
- 利用氩气 488 nm 激光器可视化 GFP 荧光信号,利用氦氖 633 nm 激光器在扫描共聚焦显微镜中观察 AuNP 反射。
- 使用使用 1064 nm 近红外激光器操作的光学镊子照射单个 AuNP ~1 秒,引起局部温度显着升高,从而破坏质膜。
- 对聚焦颗粒施加 200-295 mW 的辐照,导致温度大幅升高。
注意:光学器件内部的功率损失很大,焦点处的激光功率达到规定毫瓦的 20% 左右,具体取决于具体设置。比强度(以 W/cm2 为单位测量)取决于系统的精确对准,特别是焦距大小。此外,玻璃的热传导高于电池和水的热传导,因此释放到质膜的热量减少略有减少48,58。 - 通过正确校准近红外激光焦点的定位,实现有效和局部的 PM 损伤和随后的蛋白质修复反应。这是通过捕获悬浮在同一成像介质中的单个AuNP并确保所选的AuNP在辐照前聚焦来实现的。
注意:当纳米颗粒的散射信号出现最清晰时,即在共聚焦显微镜中观察纳米颗粒时,纳米颗粒的散射信号最清晰,颗粒周围没有光晕,被认为是聚焦的(图2C(ii))。
- 电池和AuNP密度条件
- 选择单细胞而不是细胞簇,以防止质膜重叠。
注意:细胞应粘附在表面上,表现出扁平的形态(补充图1),这允许刺穿细胞外围,同时防止核膜受损(补充图2)。 - 根据方案孵育细胞或直到它们沉降并变平以防止 AuNP 细胞摄取。避免过长的孵育时间,并降低使用聚乙二醇化AuNPs进行AuNP内吞的可能性。
- 确保固定化的AuNP以单个颗粒的形式存在,彼此之间有足够的间隔以防止聚集。聚集体会导致热梯度显着增加,导致温度升高,从而可能破坏电池的很大一部分。
- 每 1-2 小时更换一次样品以保持细胞健康。
注意:长时间暴露会导致细胞健康状况恶化,从而损害它们在膜修复方面对损伤做出准确反应的能力。这种细胞健康的下降通常通过细胞形状的变化来观察,因为细胞看起来更球形,更坚硬,最终导致细胞死亡。
- 选择单细胞而不是细胞簇,以防止质膜重叠。
补充信息。请点击此处下载此文件。
3. 巨型单层囊泡(GUV)制备
- 脂质混合物的制备
- 通过将 1,2-二油酰基-sn-甘油-3-磷酸胆碱 (DOPC) 和 1,2-二油酰基-sn-甘油-3-磷酸-L-丝氨酸 (DOPS) 脂质以 4:1 的摩尔比组合制成 GUV 脂质组合物(见 表 1)。根据实验需要将脂质储备液分装到1.5 mL玻璃瓶中,并储存在-20°C。
注意:为了延长脂质保存时间并防止不饱和脂质氧化,请在等分瓶中用氩气代替空气。 - 在混合脂质之前,用氯仿彻底清洁 50 μL 和 500 μL 玻璃或金属注射器 5 次,以确保它们不含氯仿溶解脂质的污染物。
注意:由于氯仿的毒性,请在通风橱中处理氯仿。- 将计算体积的氯仿转移到干净的琥珀色玻璃小瓶中,然后转移每种脂质的指定量(见 表1)。
注意: 为避免脂质储备之间的交叉污染,请确保用氯仿清洁注射器。 - 最后,加入膜染料并通过移液充分混合脂质。将制备的脂质混合物储存在-20°C以备进一步使用;该混合物可存活 2-3 周,而不会造成任何明显的脂质损伤。
注意: 混合应使用金属或玻璃注射器进行。当脂质从冰箱中取出时,务必将脂质放在冰上。
- 将计算体积的氯仿转移到干净的琥珀色玻璃小瓶中,然后转移每种脂质的指定量(见 表1)。
- 通过将 1,2-二油酰基-sn-甘油-3-磷酸胆碱 (DOPC) 和 1,2-二油酰基-sn-甘油-3-磷酸-L-丝氨酸 (DOPS) 脂质以 4:1 的摩尔比组合制成 GUV 脂质组合物(见 表 1)。根据实验需要将脂质储备液分装到1.5 mL玻璃瓶中,并储存在-20°C。
- 聚乙烯醇(PVA)凝胶的制备
- 使用Weinberger等人23描述的凝胶辅助水化方法制备GUV,并稍作修改。
- 通过将 5 g PVA 溶解在含有 50 mM 蔗糖、25 mM NaCl 和 25 mM Tris (pH 7.4) 的 100 mL 缓冲液中来制备 PVA 凝胶。
- 将PVA溶液加热至85°C并搅拌至透明。让它冷却至温下,然后存放在冰箱中以备将来使用。
注意:PVA未正确溶解在缓冲液中,因此需要加热至85°C。
- 使用Weinberger等人23描述的凝胶辅助水化方法制备GUV,并稍作修改。
- 载玻片的制备
- 用乙醇清洁载玻片,让它们风干。然后,用空气等离子清洗器处理载玻片,以去除玻璃表面的任何残留污染物。
- PVA涂层载玻片的制备
- 将PVA凝胶(5%)加热至60°C30分钟以增加其流动性。将90μL温热的PVA涂在载玻片上,均匀铺开,并在50°C的加热柜中干燥50分钟。
- PVA载玻片准备就绪后,使用玻璃或金属注射器加入30μL制备的脂质混合物,并使用针头的边缘将其铺入薄膜中。
- 通过在温和的氮气压力下蒸发其氯仿含量来干燥脂质混合物。此外,将载玻片在真空下干燥1.5-2小时。
- 在腔室中生长 GUV
- 使用准备好的载玻片组装内部腔室,其设计类似于先前发布的报告59。
- 在单独的 2 mL 试管中,用由 80 mM 蔗糖、70 mM NaCl 和 25 mM Tris-HCl (pH 7.4) 组成的生长缓冲液 (GB) 将目标重组蛋白(在本例中为 ANXA5 或 ANXA4)稀释至终浓度为 500 nM。
- 向腔室中加入 400 μL 稀释的重组蛋白溶液。在室温下孵育室1小时,以使GUV从沉积的脂质层中生长。使用相同的缓冲液(不包括蛋白质)作为阴性对照。
注意:用聚烯烃薄膜包裹腔室以防止缓冲液蒸发。 - 通过将 400 μL 腔室内容物转移到 2 mL 管中来收集 GUV。
- 通过向收集的溶液中加入 1 mL 含有 55 mM 葡萄糖、70 mM NaCl 和 50 mM Tris-HCl (pH 7.4) 的观察缓冲液 (OB),去除 GUV 外的非包封蛋白。然后,将溶液在13°C下以600× g 离心10分钟。
- 离心后,用等体积的观察缓冲液替换 1 mL 上清液。通过轻轻移液分散GUV,并将它们存放在冰箱中,直到它们用于GUV实验。
4. GUV穿刺实验
- 腔室准备
- 使用 35 毫米玻璃底培养皿进行实验。为防止GUV粘附在表面并破裂,请用β酪蛋白(5mg / mL)涂覆表面15-30分钟。
- 对于β酪蛋白溶液,将 0.1 g 蛋白质溶解在 20 mM Tris (PH 7.5) 和 100 mM NaCl 的 20 mL 缓冲液中。过滤蛋白质溶液,将其等分装到小瓶中,然后冷冻以备将来使用。
- 用观察缓冲液清洗腔室两次,以去除表面多余的游离β酪蛋白,并在室温下晾干。
- 在单独的 2 mL 管中,将收集的 GUV 与 OB 混合。 将 CaCl2 添加到混合物中以获得所需的最终浓度(在本例中为 200 μM)。
- 以 1:100 的比例将 150 nm 金纳米壳 (AuNS) 引入混合物中。最终混合物包括 250 μL GUV、225 μL OB、20 μL CaCl2 (5 mM) 和 5 μL 指定的 AuNS。
- 使用 35 毫米玻璃底培养皿进行实验。为防止GUV粘附在表面并破裂,请用β酪蛋白(5mg / mL)涂覆表面15-30分钟。
- 实验装置
- 将混合物转移到腔室中并将其安装在显微镜载物台上。根据腔室的大小,添加整个混合物或部分混合物。
注意:时机至关重要,因为钙离子可以穿过膜并介导膜联蛋白与膜内小叶的结合。 - 采用与细胞穿刺实验相同的光学设置。
- 使用光镊通过施加 ~ 125 mW 的激光功率,将单个 AuNS 捕获在 GUV 附近或表面上。
- 随后,将激光功率增加到 ~ 300 mW。这会产生高度局部的温度升高,从而破坏和刺穿目标部位的膜。
注意:AuNS是GUV实验的首选,因为它们能够产生更高的瞬态温度升高,同时与固体AuNP相比保持更小的尺寸。
- 将混合物转移到腔室中并将其安装在显微镜载物台上。根据腔室的大小,添加整个混合物或部分混合物。
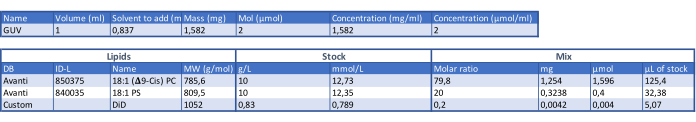
表 1:确定 GUV 成分的表格。请按此下载此表格。
5. 细胞穿刺实验中ANXA响应的测量和数据分析
- 使用MATLAB分析图像,并根据Mie方程60,61计算和绘制AuNP温度曲线(图1D,E)。
- 此外,使用FIJI ImageJ分布62,63处理所有共聚焦图像。
- ANXA环半径的计算
- 在膜损伤分析之前,从原始数据中裁剪包含穿刺区域的感兴趣区域。
- 使用内部MATLAB工作流程,通过手动标记ANXA环的中心及其外周长来处理每个图像。
- 使用这些标记来设置感兴趣区域的处理限值。
注意:随后在设定的限值内径向处理该区域,并且到中心特定距离处的荧光强度是具有相同中心距离的整个圆圈的平均值。此数字存储在每个半径步长中。 - 使用工作流程将整个扫描范围内的平均强度拟合到一维高斯曲线上,以分别识别对应于 Rext 和 Rint 的最大值 (Rp) 和半最大值全宽 (FWHM),如图 3A 所示。
- 使用这些标记来设置感兴趣区域的处理限值。
- 最后,通过MATLAB工作流程生成的绘图给出的从环中心到Rext 的距离来确定ANXA环的半径。
- 三维ANXA环半径计算
- 使用与步骤 5.1 相同的 MATLAB 分析工作流程跟踪 Z 方向上 ANXA 环半径的变化。将工作流程应用于膜伤口上的多个共聚焦 z 切片,如 图 3C、E 所示。
- 根据 z 截面上半径的变化计算每个伤口的斜率,如 图 3F 所示。
- ANXA环半径的时间演化
- 同样,使用步骤 5.1 中的 MATLAB 分析工作流程跟踪热等离子体膜穿刺后 ANXA 环的 ANXA 环的演变。分析连续的时间点以监控随时间的变化,如 图 3D、G、H 所示。
结果
本研究采用热等离子体法研究膜联蛋白对质膜破坏的反应;然而,任何可能在膜损伤时募集的蛋白质都可以使用该测定法进行研究,因为相应的蛋白质是荧光标记的。通过人胚胎肾 (HEK293T) 细胞和巨型单层囊泡 (GUV) 中的共聚焦成像监测蛋白质募集和功能。为了详细说明,图 2 说明了使用 1064 nm 的聚焦近红外激光束照射单个 AuNP 的实验条件(图 2A),导致膜损伤和 Ca2+ 流入细胞,激活 PMR 机制。随后,膜联蛋白被迅速募集到损伤部位,在那里它们与伤口周边带负电荷的磷脂结合,在几秒钟内形成环状结构(图2B,i-iv)。使用GUV的模型膜实验表明,在没有ANXA的情况下,膜穿刺被迅速重新密封,如图2C所示。然而,在ANXA存在的情况下,在膜穿刺后在损伤部位观察到ANXA的快速积累(图2D)。值得注意的是,ANXA继续滚动暴露的边缘,最终导致GUV爆裂。这种滚动机制被认为是由ANXA诱导曲率和弯曲脂质膜的能力引起的20。
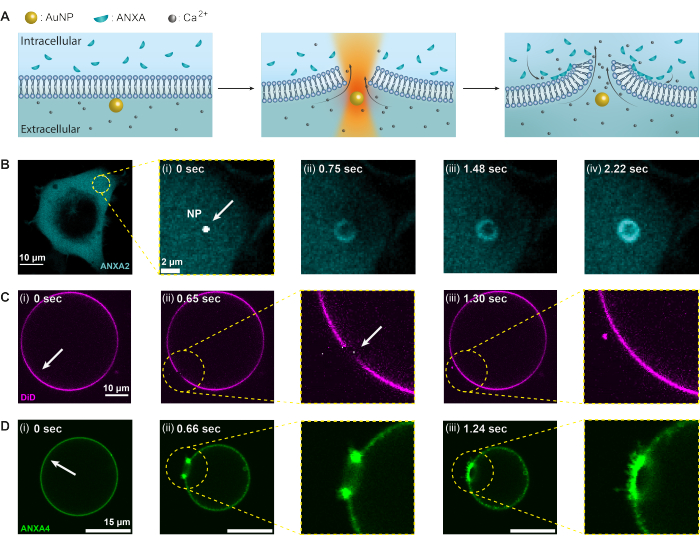
图 2:膜联蛋白 (ANXA) 对热等离子体诱导的膜破坏的反应。最初,(A) 质膜在含有高水平 Ca2+ 离子的细胞外环境和具有封装 ANXA 的细胞内环境之间充当屏障。在用近红外 (NIR) 激光照射时,AuNP 会产生大量热量,导致膜破裂并导致 Ca2+ 离子流入。因此,质膜修复 (PMR) 机制被激活,这涉及将 ANXA 募集到损伤部位,在那里它们与带负电荷的磷脂结合。(B-D)含有 ANXA2 的细胞和含有 ANXA4 的 GUV 的共聚焦显微镜图像展示了这一过程。(i) 在照射之前,图像显示一个完整的细胞或 GUV,照射部位用白色箭头表示。(ii)在纳米颗粒照射下,(B)ANXAs迅速募集到损伤部位,在膜伤口周围形成环状结构(B [ii-iv])。图(C)显示了没有ANXA的膜染色GUV,该GUV在穿刺后迅速重新密封,没有可观察到的膜重塑。另一方面,图(D)显示了含有重组ANXA4的GUV,由于Ca2+在膜上泄漏,在(i)辐照之前,该GUV已经与膜结合。(ii) 穿刺后,ANXA4 与游离边缘结合,导致 GUV 塌陷,因为膜从边缘。图 (B) 的比例尺测量值为 10 μm,B (i) 的比例尺为 2 μm,(C) 的比例尺为 10 μm,(D) 的比例尺为 15 μm。该图转载自Moreno-Pescador等人。al 16 经英国皇家化学学会许可。请点击这里查看此图的较大版本.
对完整的ANXA环状结构的分析(图2B和补充图1)为伤口的大小和形态提供了有用的见解。ANXA环结构的半径可以随时间和空间确定,如第5节所述。Moreno等人[16]分析了活细胞中超过135个质膜损伤,其中ANXA5环结构的分析如图3所示。半径是通过测量从环中心到曲线外半径的距离来确定的,该距离基于坍塌强度剖面的全宽半高值(图3A)。研究结果表明,ANXA5环尺寸(图3B)的异质分布随时间(图3D,G,H)和空间(图3C,E,F)保持不变。这些结果表明 ANXA5 在损伤部位周围积累,表明活细胞中 ANXA5 介导的 PMR 策略与假设的受损膜5 的漏斗状向内萌芽不同。
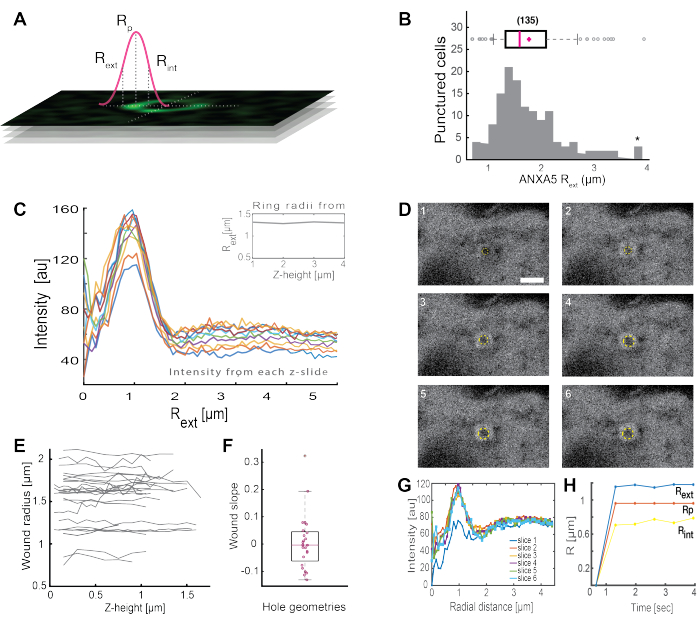
图 3:分析活细胞中损伤部位周围的 ANXA5 环结构。 (A) 示意图说明了基于ANXA强度线剖面的全宽半最大值的分析方法。(B) 直方图显示了 135 个测量的 ANXA5 环半径。(C) z-stack 的每个 z 部分的 ANXA5-GFP 环上的荧光强度线轮廓。(D)共聚焦图像说明了伤口的时间演变,其中ANXA5-GFP在受伤后立即在伤口周边积聚,然后伤口稳定。标记为 1-6 的时间帧以每帧 0.66 秒的间隔捕获。比例尺为 2 μm。(E) 根据图A中介绍的方法确定伤口的半径作为伤口深度的函数。 (F) 根据从图E中提取的数据,将伤口的斜率分析为ANXA5环半径作为z高度的函数。 (G)从图D测量ANXA5-GFP环的荧光强度线轮廓, 其中,每个时间间隔 1-6 表示为切片 1-6。最后,(H)ANXA5-GFP环半径的时间演变表示为根据图G中的数据计算的时间函数。该图转载自Moreno-Pescador等人。al 16 经英国皇家化学学会许可。 请点击这里查看此图的较大版本.
与单独破坏PM形成的环状结构(补充图1)相比,靠近细胞核的损伤(补充图2A)可能会影响伤口的演变和几何形状。有时,只有一小部分 ANXA 环是明显的(补充图 2B,C),也可以使用内部 MATLAB 分析工作流程进行分析(参见第 5 节),尽管可能会丢失其他数据。通常,在非贴壁细胞中观察到的ANXA环形成(补充图2C)位于细胞核和细胞外围附近。因此,可以观察到更细长的环结构,这对于所呈现的数据分析来说是次优的。此外,非贴壁细胞似乎更容易在PM损伤后发生细胞死亡。此外,在考虑AuNP聚集体辐照造成的伤害时,重要的是要注意这些伤害可能更严重且更难以控制。这是由于等离子体加热的显着增加,这会损坏大部分细胞。因此,此类损伤尚未纳入 ANXA5 环分析。
此外,初步研究结果表明,使用热等离子体破坏质膜会导致细胞内 Ca2+ 水平升高。即使在单个AuNPs的低强度辐照下也观察到了这一点,表明PM通透性35,如 图4所示。在表达膜结合钙探针GCaMP6s-CAAX的细胞中观察到Ca2+ 内流,该探针在Ca2+ 内流时发生构象变化,因此可以观察到其强度的增加64。随着时间的流逝,对细胞的整个足迹的钙强度进行了量化。为了消除背景噪声,在膜破坏和膜修复后减去背景 Ca2+ 水平。最大强度是通过对细胞内的平均 Ca2+ 强度进行归一化来确定的,导致强度曲线显示初始 Ca2+ 强度快速增加,然后缓慢降低,如 图 4B 所示。
细胞在~6.6 s时达到最大钙强度,这与Klenow等人64的发现一致,他们认为钙强度峰值的时间(t = tc)对应于伤口闭合所需的时间。然而,虽然需要进一步的研究来建立膜修复和伤口愈合的潜在机制,但初步研究结果表明,这种Ca2+ 过程仅在受伤细胞中观察到,而不是在用作阳性对照的未受伤细胞中观察到。这证实了细胞在热质离子膜破坏时经历了 Ca2+ 内流,其中过量的细胞内钙在成功 PMR 后被主动泵出,因为细胞内钙水平不再与 Ca2+ 内流竞争,最终实现细胞稳态64。
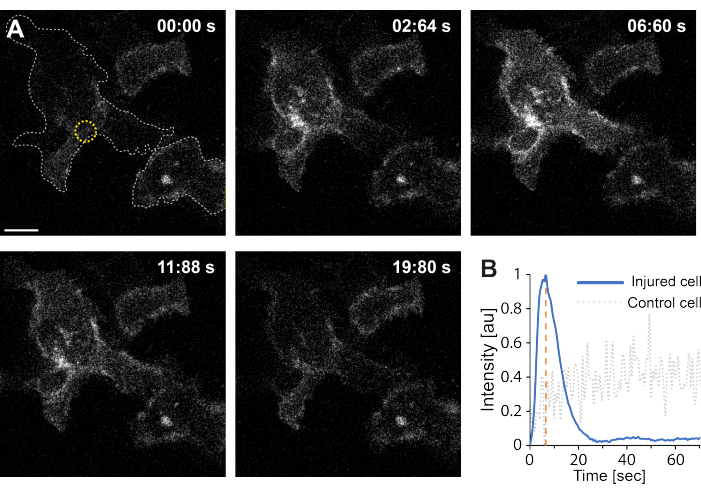
图 4:当HEK293T细胞的质膜被热等离子体破裂时,就会发生钙内流。 一系列共聚焦图像显示两个细胞(感兴趣的细胞和用作阳性对照的未损伤细胞)表达膜结合钙探针 GCaMP6s-CAAX。比例尺尺寸为 10 μm。(A)辐照前,在00:00 s,两个细胞的足迹由灰色虚线可视化,辐照部位用黄色圆圈表示。在激光照射下,观察到 Ca2+ 的快速流入,在 ~ 6.6 秒处达到最大强度,用橙色虚线表示,该时间点假定对应于伤口闭合的时间64。(B) 将损伤细胞(蓝线)中 GCaMP6s-CAAX 探针获得的钙强度曲线与相邻未损伤细胞(灰色虚线)中的 Ca2+ 强度进行比较,仅在 PM 破坏时显示明显的 Ca2+ 流入。 请点击这里查看此图的较大版本.
讨论
该研究强调了热等离子体方法是一种很有前途的技术,用于探索活细胞中的蛋白质反应和膜破坏后的模型膜。该方法不仅提供了有关蛋白质募集的广泛信息,还提供了有关蛋白质-膜动力学中涉及的蛋白质的生物物理功能的信息。因此,它有助于识别负责表面修复的分子成分,并促进对质膜修复复杂而重要的机制的理解。尽管存在各种诱导膜破坏的方法,例如机械、化学和光学技术,但这些方法存在局限性,例如对细胞非特异性,对细胞膜产生多次损伤,或对膜造成重大损伤,并在使用高功率脉冲激光时沿激光路径烧蚀内部细胞材料。虽然共聚焦显微镜和光镊的集成提供了最全面的信息,但也可以使用替代成像方式。例如,由于等离子体纳米颗粒的成像是使用反射显微镜实现的,徕卡共聚焦显微镜中的内置成像模式,因此可以使用其他成像技术,例如暗场显微镜65,66,其他散射方法,如iSCAT67,68或纳米颗粒的荧光标记,尽管这可能会限制该方法的适用性。
所提出的方法还能够在模型膜中诱导纳米孔,从而能够研究不同膜联蛋白之间的协同作用。这是通过封装不同标记的重组膜联蛋白(例如分别是 RFP 和 GFP)然后进行热等离子体穿刺来实现的。如 图2D所示,该模型系统提供了膜联蛋白如何与自由边缘附近的膜相互作用的见解。然而,与细胞不同的是,施加在GUV上的孔继续扩大,随后是囊泡的不稳定。由于孔直径的快速膨胀,使用共聚焦显微镜对孔的演变进行成像可能具有挑战性,但可以通过随着时间的推移捕获多个 z 堆栈来实现。另一种方法是使用旋转盘共聚焦来加快成像速度。此外,当应用于单细胞或GUV实验时,热等离子体方法通常每小时产生有限数量的最佳结果,通常为20°C至30°C之间的样品温度。 为了获得最准确的蛋白质-膜动力学观察结果,建议将细胞保存在含有HEPES的缓冲液中,并每小时更换一次样品。或者,可以通过在细胞培养室中进行实验来延长实验窗口,即在37°C的恒定温度下使用5%CO2。此外,将这种方法与其他成像技术相结合,如随机光学重建显微镜(STORM),可以在单分子水平上更深入地了解参与膜修复的关键蛋白质的生物物理功能和相互作用。这可以提供有关损伤部位的详细信息,包括伤口几何形状和膜联蛋白的位置,并确定参与修复膜表面的其他关键参与者。
为了在诱导膜损伤方面达到最大的有效性和精度,必须在每次实验之前验证激光焦点的位置,并确保激光焦点的轴向位置与共聚焦焦点重合。这种对准优化了AuNP成像过程中的强度,从而导致局部温度的最大升高,并在较低的激光功率下导致膜损伤。该过程是手动执行的,因此容易受到膜破裂效率变化的影响,因为焦点被手动转换为与颗粒位置重合的位置。在缺乏反射模式的显微镜中,如在一些商业系统中,激光焦点和粒子的共定位可能具有挑战性。在这种情况下,可以采用替代成像模式(例如,明场),并且可以在预期的粒子位置周围进行慢速光栅扫描。应该注意的是,低激光功率可能只会引起膜透化,而高激光功率会在NP周围产生超过水沸点的温度,即使玻璃表面具有冷却作用。据估计,NP周围的纳米气泡的形成发生在200°C和300°C之间25,48,其中爆炸热可能导致粒子从激光焦点位移或粒子碎裂。此外,在加热过程中纳米或微气泡的形成对这种方法提出了挑战。由于空气界面会使膜变湿并可能导致蛋白质不稳定,这是不可取的,因此在研究膜修复时必须限制加热。值得注意的是,金纳米壳不能耐受高温,并且在这些条件下会降解,如高分辨率显微镜58所示。
本文提供了使用热等离子体在膜中进行高度局部穿刺的详细方案,适用于细胞和模型膜。为了进一步降低加热程度,可以利用与近红外光共振的较小纳米颗粒,从而在内体、内质网和核膜中实现细胞内穿刺。这种纳米颗粒,包括棒状物和纳米套娃48,可用于通过靶向内吞金纳米颗粒来研究核膜修复,这些金纳米颗粒很容易在细胞表面被吸收并运输到细胞核69。总体而言,该技术能够识别和检查参与PMR的关键分子成分,阐明其生物物理功能和作用,同时保持细胞的活力。
披露声明
作者没有什么可透露的。
致谢
我们要感谢 Jesper Nylandsted 为我们提供重组膜联蛋白和编码膜联蛋白的质粒。这项工作得到了丹麦自然科学独立研究委员会(DFF-4181-00196)、诺和诺德基金会2018年跨学科协同计划(NNF18OC0034936)、丹麦癌症学会科学委员会(R90-A5847-14-S2)、灵北基金会(R218-2016-534)和灵北基金会卓越中心(纳米医学生物膜)的资助。
材料
| Name | Company | Catalog Number | Comments |
| 1064 nm trapping laser | Spectra Physics | N/A | Spectra Physics J201-BL-106C, Nd: YVO4 NIR laser |
| 160 nm Gold Nanoshells | NanoComposix | NCXGSIR150 | |
| 200 nm Gold Nanoparticles | BBI Solutions | EM.GC200/7 | |
| 35 mm glass surface MatTex microwell | MATTEK | P35G-1.5-14-C | |
| Amber-glass vials | Supelco Sigma Aldrich | 243438 | |
| Annexin A2 plasmids | N/A | N/A | Received from our collaborator at the Danish Cancer Research Center |
| Annexin A4 recombinant-protein | N/A | N/A | N-terminal GFP tagged ANXA4 received from our collaborator at the Danish Cancer Research Center |
| Annexin A5 recombinant-protein | N/A | N/A | N-terminal GFP tagged ANXA5 received from our collaborator at the Danish Cancer Research Center |
| beta-casein | Sigma Life Science | C6905-1G | |
| CaCl2 | Suprlco (sigma Aldrich) | 10035-04-8 | |
| Centrifuge 5702 | Eppendorf | 5702 | |
| Chloroform | VWR Chemicals | 67-66-3 | |
| Culture dish (Nunclon Delta Surface) | Thermo scientific | 150460 | |
| DID cell-labelling Solution | Invitrogen | 7757 | |
| Distilled water | Gibco | 15230-089 | |
| DOPC | Avanti Polar Lipids | 850375C | Dissolved in chloroform |
| DOPS | Avanti Polar Lipids | 840035C | Dissolved in chloroform |
| Dulbecco's Modified Eage's Medium | Thermo Fisher Scientific | 11995065 | |
| FIJI ImageJ distribution | ImageJ2 | N/A | |
| GCaMP6s-CAAX | N/A | Received from our collaborator at the Danish Cancer Research Center | |
| Gibco Fetal Bovine Serum | Fisher Scientific | 11573397 | 10% of the culture medium |
| Glucose | PROLABO | 24 374.297 | |
| Hamilton syringes | Hamilton Company | N/A | 50 and 500 microliters |
| Harrick Plasma Cleaner PDG-002 | Harrick Plasma | N/A | |
| HEK293T cells | N/A | Received from our collaborator at the Danish Cancer Research Center | |
| Leica Acousto-Optical Beam Splitter (AOBS) | Leica | N/A | |
| Leica PL APO 63x water immersion objective, NA = 1.2 | Leica | N/A | |
| Leica SP5 confocal scanning microscope | Leica | N/A | |
| Lipofectamine | Fisher Scientific | 15338030 | |
| MatLab | The Mathworks, Inc., Natick, Massachusetts, United States | N/A | |
| NaCl | VWR Chemicals | 7647-14-5 | |
| Opti-MEM Reduced-Serum Medium | Thermo Fisher Scientific | 11058021 | |
| Parafilm | Bemis | PM-992 | |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | 1% of the culture medium |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | 10010023 | |
| Piezoelectric stage (PI 731.20) | Physik Instrumente (Germany) | N/A | |
| Poly-L-Lysine | Sigma-Aldrich | P8920-100ML | 0.01-0.1% for coating |
| Polyvinyl alcohol | Sigma-Aldrich | 363065-25G | |
| round glass slide 25 mm Ø | VWR | 631-1584 | |
| Sonicator Brandson 2800 | Brandson | N/A | |
| sucrose | Sigma Life Science | 57-50-1 | |
| T25 tissue culture flask | Falcon | 353108 | Blue Vented cap |
| Tris-HCl | Invitrogen | 15567-027 | |
| TrypLE | Thermo Fisher Scientific | A1285901 | |
| Trypsin-EDTA | Fisher Scientific | 11590626 | |
| VWR Mixer mini vortex 230V EU | VWR | 12620-84 | ECN: 444-2790, SN: 150713022 |
参考文献
- Bendix, P. M., et al. Interdisciplinary synergy to reveal mechanisms of annexin-mediated plasma membrane shaping and repair. Cells. 9 (4), 1029 (2020).
- Gajic, O., Lee, J., Doerr, C. H., Berrios, J. C., Myers, J. L., Hubmayr, R. D. Ventilator-induced Cell Wounding and Repair in the Intact Lung. American Journal of Respiratory and Critical Care Medicine. 167, 1057-1063 (2003).
- McNeil, P. L., Khakee, R. Disruptions of muscle fiber plasma membranes. Role in exercise-induced damage. The American Journal of Pathology. 140 (5), 1097-1109 (1992).
- Yu, Q. C., McNeil, P. L. Transient disruptions of aortic endothelial cell plasma membranes. The American Journal of Pathology. 141 (6), 1349-1360 (1992).
- Boye, T. L., et al. Annexin A4 and A6 induce membrane curvature and constriction during cell membrane repair. Nature Communications. 8, 1623 (2017).
- Bischofberger, M., Gonzalez, M. R., van der Goot, F. G. Membrane injury by pore-forming proteins. Current Opinion in Cell Biology. 21, 589-595 (2009).
- Tang, S. K. Y., Marshall, W. F. Self-repairing cells. Science (New York, N.Y.). 356, 1022-1025 (2017).
- Abreu-Blanco, M. T., Verboon, J. M., Parkhurst, S. M. Single cell wound repair: Dealing with life's little traumas. Bioarchitecture. 1, 114-121 (2011).
- Sønder, S. L., et al. Annexin A7 is required for ESCRT III-mediated plasma membrane repair. Scientific Reports. 9, 6726 (2019).
- Andrews, N. W., Almeida, P. E., Corrotte, M. Damage control: cellular mechanisms of plasma membrane repair. Trends in Cell Biology. 24 (12), 734-742 (2014).
- Idone, V., Tam, C., Goss, J. W., Toomre, D., Pypaert, M., Andrews, N. W. Repair of injured plasma membrane by rapid Ca2+-dependent endocytosis. The Journal of Cell Biology. 180 (5), 905-914 (2008).
- Lauritzen, S. P., Boye, T. L., Nylandsted, J. Annexins are instrumental for efficient plasma membrane repair in cancer cells. Seminars in Cell & Developmental Biology. 45, 32-38 (2015).
- Häger, S. C., Nylandsted, J. Annexins: players of single cell wound healing and regeneration. Communicative & Integrative Biology. 12 (1), 162-165 (2019).
- Jaiswal, J. K., et al. S100A11 is required for efficient plasma membrane repair and survival of invasive cancer cells. Nature Communications. 5, 3795 (2014).
- Draeger, A., Monastyrskaya, K., Babiychuk, E. B. Plasma membrane repair and cellular damage control: The annexin survival kit. Biochemical Pharmacology. 81 (6), 703-712 (2011).
- Moreno-Pescador, G. S., et al. Thermoplasmonic nano-rupture of cells reveals annexin V function in plasma membrane repair. Nanoscale. 14 (21), 7778-7787 (2022).
- Zhivotovsky, B., Orrenius, S. Calcium and cell death mechanisms: A perspective from the cell death community. Cell Calcium. 50 (3), 211-221 (2011).
- Gerke, V., Moss, S. E. Annexins: From structure to function. Physiological Reviews. 82 (2), 331-371 (2002).
- Idone, V., Tam, C., Andrews, N. W. Two-way traffic on the road to plasma membrane repair. Trends in Cell Biology. 18 (11), 552-559 (2008).
- Boye, T. L., et al. Annexins induce curvature on free-edge membranes displaying distinct morphologies. Scientific Reports. 8, 10309 (2018).
- Bouter, A., et al. Annexin-A5 assembled into two-dimensional arrays promotes cell membrane repair. Nature Communications. 2, 270 (2011).
- Boye, T. L., Nylandsted, J. Annexins in plasma membrane repair. Biological Chemistry. 397 (10), 961-969 (2016).
- Weinberger, A., et al. Gel-assisted formation of giant unilamellar vesicles. Biophysical Journal. 105 (1), 154-164 (2013).
- Numata, T., Tatsuta, H., Morita, Y., Otani, Y., Umeda, N. Localized thermal processing with a laser-trapped and heated metal nanoparticle. IEEJ Transactions on Electrical and Electronic Engineering. 2, 398-401 (2007).
- Bendix, P. M., Reihani, S. N. S., Oddershede, L. B. Direct measurements of heating by electromagnetically trapped gold nanoparticles on supported lipid bilayers. ACS Nano. 4 (4), 2256-2262 (2010).
- Kyrsting, A., Bendix, P. M., Stamou, D. G., Oddershede, L. B. Heat profiling of three-dimensionally optically trapped gold nanoparticles using vesicle cargo release. Nano Letters. 11 (2), 888-892 (2011).
- Andersen, T., Kyrsting, A., Bendix, P. M. Local and transient permeation events are associated with local melting of giant liposomes. Soft Matter. 10 (24), 4268-4274 (2014).
- Bahadori, A., Oddershede, L. B., Bendix, P. M. Hot-nanoparticle-mediated fusion of selected cells. Nano Research. 10, 2034-2045 (2017).
- Rørvig-Lund, A., Bahadori, A., Semsey, S., Bendix, P. M., Oddershede, L. B. Vesicle fusion triggered by optically heated gold nanoparticles. Nano Letters. 15 (6), 4183-4188 (2015).
- Moreno-Pescador, G., Arastoo, M. R., Ruhoff, V. T., Chiantia, S., Daniels, R., Bendix, P. M. Thermoplasmonic vesicle fusion reveals membrane phase segregation of influenza spike proteins. Nano Letters. 23 (8), 3377-3384 (2023).
- Bahadori, A., Lund, A. R., Semsey, S., Oddershede, L. B., Bendix, P. M. Controlled cellular fusion using optically trapped plasmonic nano-heaters. SPIE Proceedings. SPIE 9922, Optical Trapping and Optical Micromanipulation XIII. 992211, (2016).
- Bahadori, A., Moreno-Pescador, G., Oddershede, L. B., Bendix, P. M. Remotely controlled fusion of selected vesicles and living cells: a key issue review. Reports on Progress in Physics. 81 (3), 32602 (2018).
- Moreno-Pescador, G., Arastoo, M. R., Chiantia, S., Daniels, R., Bendix, P. M. Thermoplasmonic induced vesicle fusion for investigating membrane protein phase affinity. bioRxiv. , (2022).
- Pescador, G. S. M., et al. Investigating plasma-membrane repair employing thermoplasmonics. Biophysical Journal. 120 (3), 45A (2021).
- Moreno-Pescador, G. S., Qoqaj, I., Thusgaard Ruhoff, V., Iversen, J., Nylandsted, J., Bendix, P. M. Effect of local thermoplasmonic heating on biological membranes. SPIE 11083, Optical Trapping and Optical Micromanipulation XVI. 110830M, (2019).
- Bement, W. M., Mandato, C. A., Kirsch, M. N. Wound-induced assembly and closure of an actomyosin purse string in Xenopus oocytes. Current Biology. 9 (11), 579-587 (1999).
- Weisleder, N., et al. Recombinant MG53 protein modulates therapeutic cell membrane repair in treatment of muscular dystrophy. Science Translational Medicine. 4 (139), 139ra85 (2012).
- Sudji, I. R., Subburaj, Y., Frenkel, N., García-Sáez, A. J., Wink, M. Membrane disintegration caused by the steroid saponin digitonin is related to the presence of cholesterol. Molecules. 20 (11), 20146-20160 (2015).
- Babiychuk, E. B., Monastyrskaya, K., Potez, S., Draeger, A. Intracellular Ca2+ operates a switch between repair and lysis of streptolysin O-perforated cells. Cell Death & Differentiation. 16, 1126-1134 (2009).
- Nygård Skalman, L., Holst, M. R., Larsson, E., Lundmark, R. Plasma membrane damage caused by listeriolysin O is not repaired through endocytosis of the membrane pore. Biology Open. 7 (10), bio035287 (2018).
- Swaggart, K. A., et al. Annexin A6 modifies muscular dystrophy by mediating sarcolemmal repair. Proceedings of the National Academy of Sciences of the United States of America. 111, 6004-6009 (2014).
- Yeheskely-Hayon, D., Minai, L., Golan, L., Dann, E. J., Yelin, D. Optically induced cell fusion using bispecific nanoparticles. Small. 9 (22), 3771-3777 (2013).
- Minai, L., Yeheskely-Hayon, D., Golan, L., Bisker, G., Dann, E. J., Yelin, D. Optical nanomanipulations of malignant cells: Controlled cell damage and fusion. Small. 8 (11), 1732-1739 (2012).
- Lukianova-Hleb, E., et al. Plasmonic nanobubbles as transient vapor nanobubbles generated around plasmonic nanoparticles. ACS Nano. 4 (4), 2109-2123 (2010).
- Vogel, A., Noack, J., Hüttman, G., Paltauf, G. Mechanisms of femtosecond laser nanosurgery of cells and tissues. Applied Physics B. 81, 1015-1047 (2005).
- Baffou, G., Polleux, J., Rigneault, H., Monneret, S. Super-heating and micro-bubble generation around plasmonic nanoparticles under cw illumination. Journal of Physical Chemistry C. 118 (9), 4890-4898 (2014).
- Sasikumar, K., Liang, Z., Cahill, D. G., Keblinski, P. Curvature induced phase stability of an intensely heated liquid. Journal of Chemical Physics. 140 (23), 234506 (2014).
- Jauffred, L., Samadi, A., Klingberg, H., Bendix, P. M., Oddershede, L. B. Plasmonic heating of nanostructures. Chemical Reviews. 119 (13), 8087-8130 (2019).
- Neuman, K. C., Nagy, A. Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nature Methods. 5 (6), 491-505 (2008).
- Bendix, P. M., Jauffred, L., Norregaard, K., Oddershede, L. B. Optical trapping of nanoparticles and quantum dots. IEEE Journal of Selected Topics in Quantum Electronics. 20, 15-26 (2014).
- Samadi, A., Bendix, P. M., Oddershede, L. B. Optical manipulation of individual strongly absorbing platinum nanoparticles. Nanoscale. 46, 18449-18455 (2017).
- Jørgensen, J. T., Norregaard, K., Tian, P., Bendix, P. M., Kjaer, A., Oddershede, L. B. Single particle and PET-based platform for identifying optimal plasmonic nano-heaters for photothermal cancer therapy. Scientific Reports. 6, 30076 (2016).
- Goldenberg, H., Tranter, C. J. Heat flow in an infinite medium heated by a sphere. British Journal of Applied Physics. 3 (9), 296-298 (1952).
- Eustis, S., El-Sayed, M. A. Why gold nanoparticles are more precious than pretty gold: Noble metal surface plasmon resonance and its enhancement of the radiative and nonradiative properties of nanocrystals of different shapes. Chemical Society Reviews. 35, 209-217 (2006).
- Landau, L. D., Lifshitz, E. M. . Fluid Mechanics: Landau and Lifshitz: Course of Theoretical Physics. 6, (2013).
- Niederauer, C., Seynen, M., Zomerdijk, J., Kamp, M., Ganzinger, K. A. The K2: Open-source simultaneous triple-color TIRF microscope for live-cell and single-molecule imaging. HardwareX. 13, e00404 (2023).
- Richardson, A. C., Reihani, N., Oddershede, L. B. Combining confocal microscopy with precise force-scope optical tweezers. SPIE Proceedings:SPIE 6326, Optical Trapping and Optical Micromanipulation III. 632628, (2006).
- Samadi, A., Klingberg, H., Jauffred, L., Kjær, A., Bendix, P. M., Oddershede, L. B. Platinum nanoparticles: a non-toxic, effective and thermally stable alternative plasmonic material for cancer therapy and bioengineering. Nanoscale. 10 (19), 9097-9107 (2018).
- . Available from: https://www.thermofisher.com/order/catalog/product/A7816 (2023)
- Kreibig, U., Vollmer, M. Theoretical considerations. In: Optical Properties of Metal Clusters. 25, (1995).
- Mie, G. Beiträge zur Optik trüber Medien, speziell kolloidaler Metallösungen. Annalen der Physik. 330 (3), 377-445 (1908).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529 (2017).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Klenow, M. B., Heitmann, A. S. B., Nylandsted, J., Simonsen, A. C. Timescale of hole closure during plasma membrane repair estimated by calcium imaging and numerical modeling. Scientific Reports. 11, 4226 (2021).
- Li, T., Wu, X., Liu, F., Li, N. Analytical methods based on the light-scattering of plasmonic nanoparticles at the single particle level with dark-field microscopy imaging. Analyst. 142 (2), 248-256 (2017).
- Gibbs-Flournoy, E. A., Bromberg, P. A., Hofer, T. P. J., Samet, J. M., Zucker, R. M. Darkfield-Confocal Microscopy detection of nanoscale particle internalization by human lung cells. Particle and Fibre Toxicology. 8 (1), 2 (2011).
- Taylor, R. W., Sandoghdar, V. Interferometric scattering microscopy: Seeing single nanoparticles and molecules via Rayleigh scattering. Nano Letters. 19 (8), 4827-4835 (2019).
- Wu, Y., Ali, M. R. K., Chen, K., Fang, N., El-Sayed, M. A. Gold nanoparticles in biological optical imaging. Nano Today. 24, 120-140 (2019).
- Klingberg, H., Oddershede, L. B., Loeschner, K., Larsen, E. H., Loft, S., Møller, P. Uptake of gold nanoparticles in primary human endothelial cells. Toxicology Research. 4 (3), 566-666 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。