Method Article
Термоплазмонный подход к исследованию репарации плазматических мембран в живых клетках и модельных мембранах
В этой статье
Резюме
Метод термоплазмотонной пункции объединяет конфокальную микроскопию, оптический пинцет и наночастицы золота для изучения белковых реакций при восстановлении плазматической мембраны в клетках и гигантских одноламеллярных везикулах. Этот метод позволяет проводить быструю и локализованную пункцию мембраны, что позволяет идентифицировать ключевые белки и их функциональные роли в сложном механизме восстановления плазматической мембраны.
Аннотация
Клеточная мембрана имеет решающее значение для выживания клетки, и обеспечение ее целостности имеет важное значение, поскольку клетка испытывает повреждения на протяжении всего своего жизненного цикла. Чтобы предотвратить повреждение мембраны, клетки разработали эффективные механизмы восстановления плазматической мембраны. Эти механизмы репарации могут быть изучены путем объединения конфокальной микроскопии и наноразмерной термоплазмоники для выявления и исследования роли ключевых белков, таких как аннексины, участвующих в репарации поверхности в живых клетках и мембранных модельных системах.
Метод прокола использует лазер для индуцирования высоколокализованного нагрева при облучении наночастицами. Использование ближнего инфракрасного света сводит к минимуму фототоксичность в биологическом образце, в то время как большая часть поглощения происходит в резонансной плазмонной наночастице ближнего инфракрасного диапазона. Этот термоплазмонный метод был использован для потенциальных фототермических и биофизических исследований, чтобы улучшить понимание внутриклеточных механизмов и клеточных реакций с помощью исследований везикул и слияния клеток. Этот подход показал себя дополняющим существующие методы разрушения мембран, такими как механические, химические или оптические травмы, и обеспечивает высокий уровень контроля за счет нанесения чрезвычайно локализованных повреждений. Степень повреждения ограничена окрестностями сферической наночастицы, и на траектории пучка не происходит никаких вредных повреждений, в отличие от импульсных лазеров, использующих разные длины волн. Несмотря на определенные ограничения, такие как образование нанопузырьков, термоплазмонный метод предлагает уникальный инструмент для исследования клеточных реакций при восстановлении плазматической мембраны в почти естественной среде без ущерба для жизнеспособности клеток.
В сочетании с конфокальной микроскопией метод пункции может обеспечить механистическое понимание динамики мембран в модельных мембранных системах, а также количественную информацию о реакциях белков на повреждение мембран, включая рекрутирование белков и их биофизическую функцию. В целом, применение этого метода к редуцированным модельным системам может улучшить наше понимание сложного механизма восстановления плазматических мембран в живых клетках.
Введение
Клеточная мембрана, служащая как физическим барьером, так и сигнальной платформой, жизненно важна для выживанияклеток. На протяжении всего своего клеточного цикла плазматическая мембрана (ТМ) подвергается повреждениям, таким как механические 2,3,4,5 и химические 6 стресс-индуцированные повреждения. Для поддержания целостности мембраны и обеспечения выживания клетки в клетке разработаны надежные механизмы репарации плазматической мембраны (PMR). Эти механизмы зависят от различных стратегий, таких как реорганизация цитоскелета, слияние мембран и стратегии замены мембран 7,8,9,10,11, все из которых основаны на рекрутировании специфических белков. Примечательно, что представители семейства белков аннексина были идентифицированы как ключевые белки, связанные с процессами PMR 1,9,12,13,14,15,16. После повреждения PM клетка испытывает приток ионов кальция (Ca2+), что представляет непосредственную угрозу выживанию клетки17. В ответ на притокCa2+ белки аннексинов, которые преимущественно расположены в цитозоле, связываются с внутренней створкой поврежденной плазматической мембраны в рамках стратегий PMR18. Аннексин А2 (ANXA2) был одним из первых представителей семейства аннексинов, который ассоциировался с ПМР при мышечной дистрофии с дефицитом дисферлина, и было предложено опосредовать репарацию путем слияния внутриклеточных везикул с ТЧ вблизи места повреждения 5,19,20,21. Впоследствии аннексинам22 был приписан ряд функций, и за последние 20 лет их роль в ПМР привлекла к себе повышенное внимание. Однако точная роль аннексинов в ПМР остается до конца не изученной 15,18,21,22.
В данной статье предложен метод исследования белок-мембранного взаимодействия и мембранной динамики контролируемым и высоко локализованным образом с использованием комбинации конфокальной микроскопии, оптического пинцета и наночастиц золота (AuNPs). Этот метод позволяет количественно изучать взаимодействия белков, липидов и малых молекул в ответ на повреждение мембран и притокCa2+ . Несмотря на сложность и множественность компонентов, участвующих в процессе репарации мембраны, для получения более глубокого механистического понимания динамики мембраны и реакции белков аннексина на разрушение мембраныбыли использованы упрощенные мембранные системы, имитирующие плазматическую мембрану. В качестве модельной мембранной системы с заданным липидным составом были выбраны гигантские одноламеллярные липидные везикулы (ГУВ). GUV были получены с использованием метода гелевой гидратации, в частности, гидратации гелем поливиниловым спиртом, как описано Weinberger et al.23, что позволило эффективно инкапсулировать аннексины в GUV.
Использование лазерного излучения ближнего инфракрасного диапазона (NIR) на металлических наночастицах (НЧ) индуцирует значительный нагрев НЧ, что делает его эффективным методом создания локального источника тепла, используемого в биомедицинских приложениях24. Первоначально метод использовался для непосредственного измерения температуры вокруг одного AuNP как в 2D, так и в 3D биомиметическом анализе. В этих анализах25,26 плазмонные наночастицы облучали на липидном бислое или оптически захватывали вблизи ГУВ, подвергаясь локальному термическому фазовому переходу при локальном нагревании, что позволяло количественно определять и контролировать точный температурный профиль вокруг частицы. Этот эталонный температурный профиль используется при исследовании или манипулировании биологическими образцами. Дальнейшие усовершенствования в этом методе способствовали индукции наноскопических пор в мембранах27, что позволило слить везикулы и клетки28,29. В других исследованиях изучалось поведение белков периферических мембран в GUVs29 и трансмембранных белках30 путем создания новых гибридных везикул, в то время как клеточно-специфическая доставка лекарств также изучалась для контроля и изучения клеточных ответов или экспрессии генов 28,29,31,32,33. В последнее время метод используется для исследования белковых реакций на повреждение мембран 32,34,35.
Существует несколько методов разрушения плазматической мембраны для изучения клеточных реакций и восстановления мембран. К ним относятся проколы микроиглами, встряхивание микрошариков и соскабливание клеток, все из которых могут механически нарушить клеточную мембрану 14,36,37. Химически индуцированное повреждение может быть достигнуто путем добавления детергентов 5,38 или бактериальных токсинов39,40, которые дестабилизируют липидный бислой и создают мембранные поры на плазматической мембране. Кроме того, оптически индуцированные повреждения непрерывными волнами и импульсными лазерами были использованы для изучения компонентов PMR, таких как белки аннексина 5,14,21,41, в сочетании с плазмонными наночастицами 42,43,44,45. Несмотря на эффективность мощных импульсных лазеров, они могут нанести значительные травмы и повреждения внутренней части клетки по пути луча. Кроме того, детальные изменения, происходящие в биологическом веществе при импульсном лазерном облучении, и то, создает ли оно четко очерченную пору, еще предстоит изучить. В данной статье представлен альтернативный метод, использующий термоплазмонику для контролируемого индуцирования наноскопических отверстий в ФМ34,35 без причинения существенного вреда внутренним структурам. Это достигается путем воздействия плазмонных НЧ высокосфокусированным лазером ближнего ИК-диапазона, что приводит к чрезвычайно локализованному повышению температуры, которое может легко достигать температур, превышающих 200 °C, что может привести к небольшим наноскопическим взрывам 25,46,47. Этот процесс можно контролировать, регулируя интенсивность лазера, а также размер, форму и состав NPs48. Используя этот метод, исследователи могут изучить роль белков в репарации PM в живых клетках, что может помочь ответить на некоторые из оставшихся без ответа вопросов, касающихся участия белков аннексина в репарации мембран без ущерба для жизнеспособности клеток.
Оптический захват плазмонных наночастиц был хорошо установлен предыдущими исследованиями 25,49,50,51,52; тем не менее, дополнительная информация о термоплазмонных свойствах наночастиц 53,54,55 может быть получена в дополнительных материалах (Дополнительный файл 1). Термоплазмонный метод может быть использован для создания наноскопических отверстий в ТЧ с целью изучения механизмов клеточного ответа и репарации. Точнее, прокол может быть достигнут за счет оптического нагрева AuNPs в непосредственной близости от мембраны, как показано на рисунках 1А и Б. Этот локализованный прокол обеспечивает приток Ca2+, что было проверено кальциевым датчиком, таким образом, активируя механизм PMR. Для экспериментов с живыми клетками AuNP диаметром 200 нм иммобилизовали на поверхности под клеткой для мониторинга роли ANXA2 в PMR с помощью конфокальной микроскопии. Лазер NIR (рис. 1A, B) с длиной волны 1064 нм облучает AuNP, используя его плазмонные свойства (рис. 1C), что приводит к значительному локальному нагреву (рис. 1D) в окне биологической прозрачности49, нанося при этом минимальное повреждение самой клетке. Высокотемпературная область, окружающая AuNP, быстро уменьшается на 30-40% на расстоянии, соответствующем радиусу NP, как показано на рисунке 1E, что позволяет получить чрезвычайно ограниченное повреждение во всех трех измерениях.
Дополнительный файл 1. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
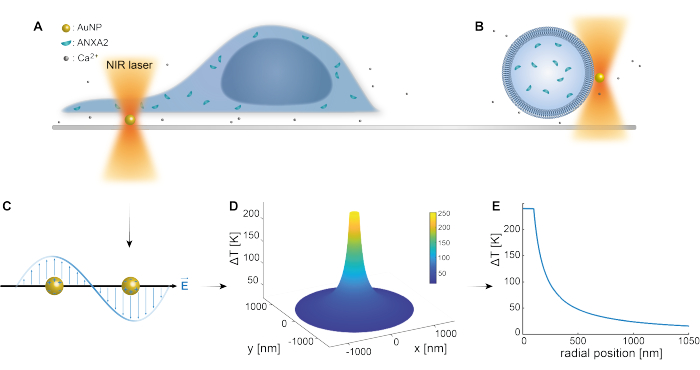
Рисунок 1: Схематическая схема экспериментального метода. (А) Клетки, трансфицированные ANXA, расположены поверх иммобилизованных наночастиц золота (AuNP) на поверхности, или (B) гигантские одноламеллярные везикулы (GUV) с инкапсулированными ANXA суспендированы в среде, содержащей AuNPs. (C) Один AuNP облучается оптической ловушкой NIR, где взаимодействие между входящим электромагнитным полем и электронами проводимости приводит к коллективным колебаниям электронов внутри БИК. (D) Этот процесс приводит к очень ограниченному, но значительному повышению температуры. Для оценки температуры на поверхности НЧ используется теория Ми и рассчитывается температурный профиль (E) для AuNP диаметром 200 нм и интенсивностью лазера I = 6,36 x 108 Вт/см2. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Чтобы свести к минимуму тепловое воздействие на клеточную мембрану, AuNPs облучаются только в течение ~1 секунды. Это вызывает кратковременный и локальный всплеск нагрева, что уменьшает повреждение белков, которым обычно требуется больше времени для раскрытия. При пункции мембраны белки аннексина рекрутируются за доли секунды, и в течение нескольких секунд вокруг места повреждения образуется кольцевидный каркас аннексина (рис. 2). Этот подход также был применен для изучения участия ANXA5 как в живых клетках, так и в модельных мембранах16 в попытке пролить свет на полную схему процессов репарации. В то время как основное внимание уделялось коррелированному набору различных белков аннексинов, биофизические аспекты механизма репарации еще предстоит выяснить.
Для полноценной реализации предложенного метода необходимы три ключевых компонента: конфокальная микроскопия, оптический пинцет и металлические наночастицы. Оптический пинцет используется для улавливания AuNP, и его конструкция может быть достигнута путем следования процедуре, описанной Neuman et al.49. Однако, если создание оптического пинцета окажется слишком сложной задачей, можно использовать плотно сфокусированный лазер ближнего ИК-диапазона для облучения AuNP, иммобилизованных под клетками. Несмотря на то, что для этого протокола были выбраны сферические AuNP, различные плазмонные частицы с перестраиваемыми спектрами поглощения также могут быть использованы для достижения высоко локализованного температурного градиента в областиNIR 48.
Флуоресцентная визуализация необходима для наблюдения за ролью флуоресцентно меченных белков, и поэтому микроскопия полного внутреннего отражения (TIRF)56 может рассматриваться как альтернатива конфокальной визуализации. Однако этот метод позволяет получать изображения только поверхности и не совместим с модельными экспериментами с мембранными везикулами. Следовательно, оптический пинцет и конфокальный микроскоп необходимы для точной локализации наночастицы и детального исследования локальной области, окружающей повреждение клетки. Для эффективного облучения наночастицы дифракционно-ограниченным лазерным фокусом необходимо визуализировать наночастицу. Оптимально это может быть достигнуто с помощью отражательной микроскопии, которая является стандартной функцией визуализации конфокальных микроскопов Leica. Однако, если изображение отражения или рассеяния недоступно, можно рассмотреть альтернативные методы, такие как менее эффективное флуоресцентное мечение AuNP.
Таким образом, высококонтролируемый и локализованный термоплазмонный метод, представленный в этом исследовании, может служить отличной платформой для изучения молекулярных компонентов, участвующих в клеточных реакциях и механизмах репарации PM в живых клетках. В дополнение к изучению реакции белка при повреждении PM, этот подход также может быть использован для локального прокола везикул, что позволяет исследовать белковый ответ как в белок-белковой, так и в белково-мембранной динамике. Кроме того, этот метод позволяет проводить количественный анализ взаимодействий между белками, липидами и малыми молекулами при разрушении мембран. В совокупности эти достижения могут пролить свет на некоторые нерешенные вопросы, касающиеся сложного и сложного механизма ремонта плазматических мембран.
протокол
1. Подготовка к пункции клеточной мембраны
- Посев клеток (День 1)
- Культивировать клетки эмбриональной почки человека (HEK293T) в питательной среде при 37 °C в инкубаторе-увлажнителе 5%CO2 до тех пор, пока они не достигнут 70% слияния.
- Отделяют клетки от поверхности с помощью 500 мкл трипсина, подсчитывают 200 000 HEK293T клеток и высевают их в культуральную чашку общим объемом 3 мл питательной среды. Инкубируют клетки при температуре 37 °C в инкубаторе-увлажнителе 5%CO2 в течение 24 ч.
ПРИМЕЧАНИЕ: Чтобы предотвратить скопление клеток в центре чашки, равномерно распределите клетки и избегайте вращения чашки, так как это может снизить эффективность трансфекции.
- Трансфекция клеток (день 2)
ПРИМЕЧАНИЕ: Трансфицированные клетки можно использовать в течение 48 часов после трансфекции.- Перед применением пипетируют интересующую плазмиду и реагент для трансфекции в течение 5 с.
- В стерильной пробирке объемом 2 мл смешайте в определенном порядке: 500 мкл восстановленной сывороточной среды, 5 мкл реагента для трансфекции (в 4 раза больше, чем плазмида) и 1,25 мкл плазмиды (1 мкг/мкл).
ПРИМЕЧАНИЕ: Для исследования притока кальция при разрыве мембраны выполните ту же процедуру, но используйте связанный с мембраной датчик кальция GCaMP6-CAAX (1 мкг/мкл). - Осторожно, но тщательно пропитывайте смесь для трансфекции и инкубируйте ее при комнатной температуре (RT) в течение 30 минут, прежде чем добавлять ее по каплям в клетки.
- Перед добавлением смеси для трансфекции выньте среду из чашки для культивирования, осторожно промойте клетки 2 мл фосфатно-солевого буфера и добавьте в чашку 2000 мкл восстановленной сывороточной среды.
- Инкубируют клетки вместе со смесью для трансфекции при 37 °C в инкубаторе с 5%СО2 в течение 2 ч 45 мин перед сменой среды на 3 мл питательной среды.
- Приготовление раствора наночастиц золота (AuNP) (день 2)
- Вихрь 200 нм исходного раствора AuNP в течение 10 с на уровне 10 (см. Таблицу материалов для дальнейшего описания аппарата), ультразвуковой ток в течение 5 мин (максимальная амплитуда) и снова вихрь в течение 10 с.
- Смешайте 150 мкл AuNPs с 850 мкл дистиллированной воды до общего объема 1 мл.
ПРИМЕЧАНИЕ: Разбавленный раствор AuNP можно хранить в холодильнике и повторно использовать до 1 месяца.
- Приготовление экспериментального блюда (День 2)
- Покройте чашку с микролунками 150 мкл 0,01%-0,1% раствора для прикрепления клеток и инкубируйте в течение 15 мин при RT.
- Дважды промойте стеклянную поверхность 500 мкл дистиллированной воды и дайте ей высохнуть на воздухе в течение ~10 минут.
- Добавьте 80 мкл раствора AuNP по каплям на сухую поверхность.
ПРИМЕЧАНИЕ: Вихрь (10 с), ультразвуковое (5 мин) и вихрь (10 с) разбавленный раствор AuNP перед добавлением его на поверхность стекла с покрытием, чтобы свести к минимуму агрегаты AuNP. - Подождите ~10 мин, прежде чем вводить 1,5 мл питательной среды. Дайте блюду инкубироваться при температуре 37 °C в течение ночи.
- Подготовка экспериментальной камеры (День 3)
ПРИМЕЧАНИЕ: Экспериментальная камера может быть подготовлена как на 3-й, так и на 4-й день; Тем не менее, убедитесь, что следующие приготовления были выполнены в тот же день, что и эксперимент.- Удалите среду из клеток в чашке для культивирования и промойте клетки 2 мл фосфатно-солевого буфера.
ПРИМЕЧАНИЕ: Этот шаг необходим для удаления любой остаточной среды и мусора, которые могут помешать последующим этапам. - Добавьте в лунку 500 мкл раствора для отделения клеток на основе ферментов и инкубируйте в течение 1-3 мин до тех пор, пока клетки не отделятся от чашки для культивирования.
- Добавьте 1,5 мл свежей питательной среды и пипеткой откормите клеточный раствор, чтобы получить однородный клеточный раствор, чтобы свести к минимуму вероятность образования клеточных кластеров.
- Осторожно удалите среду из AuNPs в экспериментальной микролунке.
- Добавьте клеточный раствор (2 мл) в микролунку и дайте ему инкубироваться не менее 5 ч перед проведением эксперимента.
ПРИМЕЧАНИЕ: Для оптимальных условий эксперимента избегайте закручивания камеры, так как это может привести к скоплению клеток в середине камеры.
- Удалите среду из клеток в чашке для культивирования и промойте клетки 2 мл фосфатно-солевого буфера.
2. Эксперимент с пункцией клеточной мембраны
- Оптические настройки эксперимента
- Проводите эксперименты с использованием конфокального сканирующего микроскопа в сочетании с улавливающим лазером57 с длиной волны 1064 нм.
- Выполняйте оптический захват в фокальной плоскости с помощью 63-кратного иммерсионного объектива с числовой апертурой (NA) 1,2.
- Предположим, что фокус имеет размер диска Эйри и что ширина фокусного луча облучающего лазера составляет ~540 нм в радиусе.
- Преобразуйте мощность лазера (P) в соответствующую интенсивность лазера (I), рассчитав мощность лазера на площадь (Вт/см2).
- Используйте акустооптический светоделитель (AOBS) для визуализации нескольких флуоресцентных сигналов, обнаруженных с помощью фотоумножителей, и одновременного обнаружения металлических НЧ по сигналу их рассеяния.
ПРИМЕЧАНИЕ: Не все конфокальные системы оснащены AOBS, который позволяет получать отраженные изображения металлических НЧ. В этом случае должны быть реализованы другие формы обнаружения, или может быть предпринята попытка последовательного сканирования лазера NIR в области под клеткой. - Во время экспериментальных сессий установите на микроскоп открытую камеру со стеклянным дном, содержащую клетки, молекулярные флуоресцентные зонды и наночастицы золота.
- Перемещают ловушку относительно ячеек путем перемещения образца, установленного на пьезоэлектрическом столике, обеспечивая боковые перемещения с нанометровой точностью16.
ПРИМЕЧАНИЕ: Оптическая ловушка остается неподвижной.
- Экспериментальные установки для пункции клеточной мембраны
- Поместите HEK293T клетки, трансфицированные плазмидами аннексина в сочетании с флуоресцентным белком, поверх изолированных AuNP, которые иммобилизованы на поверхности стекла (рис. 1A).
- Используйте аргоновый лазер с длиной волны 488 нм для визуализации флуоресцентного сигнала GFP и гелий-неоновый лазер с длиной волны 633 нм для наблюдения отражения AuNP в сканирующем конфокальном микроскопе.
- Используйте оптический пинцет, который работает с лазером ближнего ИК-диапазона с длиной волны 1064 нм, чтобы облучать один AuNP в течение ~1 с, вызывая значительное локальное повышение температуры, которое разрушает плазматическую мембрану.
- Примените облучение в диапазоне от 200 до 295 мВт к сфокусированной частице, что приведет к значительному повышению температуры.
ПРИМЕЧАНИЕ: В оптике происходит существенная потеря мощности, при этом мощность лазера в фокусной точке достигает около 20% от заявленного милливатта, в зависимости от конкретной настройки. Удельная интенсивность (измеряется в Вт/см2) зависит от точного выравнивания системы, в частности, от фокусного размера. Кроме того, теплопроводность стекла выше, чем у клетки и воды, и, следовательно, уменьшение количества тепла, выделяемого на плазматическую мембрану, немного уменьшается48,58. - Добейтесь эффективного и локализованного повреждения PM и последующей реакции репарации белка путем правильной калибровки локализации пятна фокусировки лазера NIR. Это достигается за счет захвата одного AuNP, взвешенного в одной и той же среде изображения, и обеспечения того, чтобы выбранный AuNP находился в фокусе перед облучением.
ПРИМЕЧАНИЕ: Наночастица считается находящейся в фокусе, когда ее сигнал рассеяния кажется наиболее резким, т.е. демонстрирует четкие края и отсутствие ореола вокруг частицы при наблюдении за ней в конфокальной микроскопии (рис. 2C (ii)).
- Условия плотности ячеек и AuNP
- Выбирайте одиночные клетки, а не клеточные кластеры, чтобы предотвратить перекрытие плазматических мембран.
ПРИМЕЧАНИЕ: Клетки должны быть приклеены к поверхности, демонстрируя уплощенную морфологию (дополнительный рисунок 1), что позволяет прокалывать периферию клетки, предотвращая повреждение ядерной мембраны (дополнительный рисунок 2). - Инкубируйте клетки в соответствии с протоколом или до тех пор, пока они не осядут и не сплющутся, чтобы предотвратить клеточный захват AuNP. Избегайте чрезмерного инкубационного времени и снижайте вероятность эндоцитоза AuNP с помощью ПЭГилированных AuNP.
- Убедитесь, что иммобилизованные AuNP присутствуют в виде отдельных частиц, расположенных на достаточном расстоянии друг от друга для предотвращения образования агрегатов. Агрегаты могут привести к значительному увеличению теплового градиента, что приводит к повышению температуры, которая может нарушить существенную часть ячейки.
- Заменяйте образец каждые 1-2 часа для поддержания здоровья клеток.
ПРИМЕЧАНИЕ: Длительное воздействие может привести к ухудшению здоровья клеток, ставя под угрозу их способность точно реагировать на повреждение с точки зрения восстановления мембран. Это ухудшение здоровья клеток обычно наблюдается изменением формы клеток, поскольку клетки кажутся более сферическими и более жесткими, что в конечном итоге приводит к их гибели.
- Выбирайте одиночные клетки, а не клеточные кластеры, чтобы предотвратить перекрытие плазматических мембран.
Дополнительная информация. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
3. Препарирование гигантских одноламеллярных везикул (ГУВ)
- Приготовление липидной смеси
- Получают липидную композицию GUV, комбинируя 1,2-диолеоил-sn-глицеро-3-фосфохолин (ДОФХ) и 1,2-диолеоил-sn-глицеро-3-фосфо-L-серин (ДОПС) липидов в молярном соотношении 4:1 (см. табл. 1). Разлить липидную массу в стеклянные флаконы по 1,5 мл в соответствии с экспериментальными потребностями и хранить при температуре -20 °C.
ПРИМЕЧАНИЕ: Для длительного сохранения липидов и предотвращения окисления ненасыщенных липидов замените воздух аргоном в аликвотированных флаконах. - Перед смешиванием липидов тщательно промойте стеклянный или металлический шприц объемом 50 мкл и 500 мкл хлороформом пять раз, чтобы убедиться, что они не содержат загрязняющих веществ для растворенных хлороформом липидов.
ВНИМАНИЕ: Обращайтесь с хлороформом в вытяжном шкафу из-за его токсичности.- Рассчитанный объем хлороформа переносят в чистый янтарно-стеклянный флакон с последующим указанным количеством каждого липида (см. табл. 1).
ПРИМЕЧАНИЕ: Во избежание перекрестного загрязнения запасов липидов убедитесь, что шприцы очищены хлороформом. - Наконец, добавьте мембранный краситель и тщательно перемешайте липиды пипетированием. Приготовленную липидную смесь хранить при температуре -20 °C для дальнейшего использования; Смесь сохраняет жизнеспособность в течение 2-3 недель без какого-либо значительного повреждения липидов.
ПРИМЕЧАНИЕ: Смешивание должно производиться металлическим или стеклянным шприцем. Всегда держите липиды на льду, когда они находятся вне морозильной камеры.
- Рассчитанный объем хлороформа переносят в чистый янтарно-стеклянный флакон с последующим указанным количеством каждого липида (см. табл. 1).
- Получают липидную композицию GUV, комбинируя 1,2-диолеоил-sn-глицеро-3-фосфохолин (ДОФХ) и 1,2-диолеоил-sn-глицеро-3-фосфо-L-серин (ДОПС) липидов в молярном соотношении 4:1 (см. табл. 1). Разлить липидную массу в стеклянные флаконы по 1,5 мл в соответствии с экспериментальными потребностями и хранить при температуре -20 °C.
- Приготовление геля на поливиниловом спирте (ПВА)
- Готовят GUV с помощью метода гелевой гидратации, описанного Weinberger et al.23с незначительными изменениями.
- Гель ПВА готовят, растворяя 5 г ПВА в 100 мл буфера, содержащего 50 мМ сахарозы, 25 мМ NaCl и 25 мМ Tris (рН 7,4).
- Нагрейте раствор ПВА до 85 °C и перемешайте, пока он не станет прозрачным. Дайте ему остыть до RT и храните в холодильнике для дальнейшего использования.
ПРИМЕЧАНИЕ: ПВА не растворяется должным образом в буфере, поэтому необходим нагрев до 85 °C.
- Готовят GUV с помощью метода гелевой гидратации, описанного Weinberger et al.23с незначительными изменениями.
- Подготовка предметных стекол
- Очистите предметные стекла этанолом и дайте им высохнуть на воздухе. Затем обработайте предметные стекла воздушно-плазменным очистителем, чтобы удалить остаточные загрязнения с поверхности стекла.
- Подготовка предметных стекол с ПВА-покрытием
- Нагрейте гель ПВА (5%) до 60 °C в течение 30 мин для повышения его текучести. Нанесите 90 мкл теплого ПВА на предметное стекло, равномерно распределите и дайте высохнуть в нагревательном шкафу при температуре 50 °C в течение 50 минут.
- Как только предметное стекло ПВА будет готово, добавьте 30 мкл приготовленной липидной смеси с помощью стеклянного или металлического шприца и распределите ее в тонкую пленку, используя край иглы.
- Высушите липидную смесь, выпарив содержащийся в ней хлороформ под умеренным давлением азота. Далее просушите предметные стекла под вакуумом в течение 1,5-2 ч.
- Выращивание GUV в камере
- Соберите внутреннюю камеру, аналогичную по конструкции ранее опубликованному отчету59, используя подготовленное предметное стекло.
- В отдельной пробирке объемом 2 мл разбавьте интересующий рекомбинантный белок (в данном случае ANXA5 или ANXA4) до конечной концентрации 500 нМ с растущим буфером (GB), состоящим из 80 мМ сахарозы, 70 мМ NaCl и 25 мМ Tris-HCl (pH 7,4).
- Добавьте в камеру 400 мкл разбавленного раствора рекомбинантного белка. Инкубируйте камеру в RT в течение 1 ч, чтобы позволить GUV вырасти из осажденной липидной оболочки. Используйте тот же буфер, исключая белок, в качестве отрицательного контроля.
ПРИМЕЧАНИЕ: Оберните камеру полиолефиновой пленкой, чтобы предотвратить испарение буфера. - Соберите GUV, перенеся 400 мкл содержимого камеры в пробирку объемом 2 мл.
- Удаляют неинкапсулированные белки за пределами GUV, добавляя к собранному раствору 1 мл наблюдательного буфера (OB), содержащего 55 мМ глюкозы, 70 мМ NaCl и 50 мМ Tris-HCl (рН 7,4). Затем центрифугируют раствор при 600 х г в течение 10 мин при 13 °C.
- После центрифугирования заменяют 1 мл надосадочной жидкости равным объемом наблюдательного буфера. Распыляйте GUV с помощью осторожного пипетирования и храните их в холодильнике до тех пор, пока они не будут использованы в экспериментах с GUV.
4. Эксперимент с пункцией ГУВ
- Подготовка камеры
- Используйте для эксперимента посуду со стеклянным дном диаметром 35 мм. Чтобы предотвратить прилипание GUV к поверхности и разрыв, покройте поверхность β-казеином (5 мг/мл) в течение 15-30 минут.
- Для получения β-казеинового раствора растворяют 0,1 г белка в 20-миллилитровом буфере из 20 мМ Tris (рН 7,5) и 100 мМ NaCl. Белковый раствор отфильтровать, разлить по небольшим флаконам и заморозить для дальнейшего использования.
- Дважды промойте камеру наблюдательным буфером, чтобы удалить излишки свободных β-казеинов с поверхности, и дайте высохнуть при RT.
- В отдельной пробирке объемом 2 мл смешайте собранные GUV с OB. Добавьте CaCl2 в смесь для получения желаемой конечной концентрации (в данном случае 200 мкМ).
- Введите в смесь нанооболочки золота (AuNS) с длиной волны 150 нм в соотношении 1:100. Конечная смесь состоит из 250 мкл GUV, 225 мкл OB, 20 мкл CaCl2 (5 мМ) и 5 мкл указанных AuNS.
- Используйте для эксперимента посуду со стеклянным дном диаметром 35 мм. Чтобы предотвратить прилипание GUV к поверхности и разрыв, покройте поверхность β-казеином (5 мг/мл) в течение 15-30 минут.
- Экспериментальная установка
- Перенесите смесь в камеру и установите ее на столик микроскопа. В зависимости от размера камеры добавьте либо всю смесь, либо ее часть.
ПРИМЕЧАНИЕ: Время имеет решающее значение, так как ионы кальция могут проходить через мембрану и опосредуть связывание аннексинов с внутренней створкой мембраны. - Используйте ту же оптическую установку, которая использовалась для экспериментов по прокалыванию клеток.
- Используйте оптический пинцет, чтобы захватить отдельный AuNS в непосредственной близости от или на поверхности GUV, применяя мощность лазера ~ 125 мВт.
- Впоследствии увеличьте мощность лазера до ~300 мВт. Это приводит к высоколокализованному повышению температуры, которое разрушает и прокалывает мембрану в целевом месте.
ПРИМЕЧАНИЕ: AuNS предпочтительны для экспериментов GUV из-за их способности генерировать более высокое переходное повышение температуры при сохранении меньшего размера по сравнению с твердыми AuNP.
- Перенесите смесь в камеру и установите ее на столик микроскопа. В зависимости от размера камеры добавьте либо всю смесь, либо ее часть.
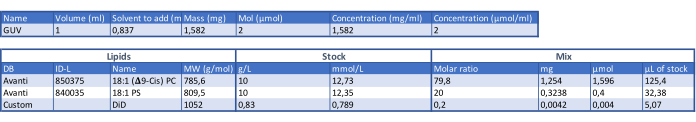
Таблица 1: Таблица для определения состава ГУВ. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
5. Измерения и анализ данных ответа ANXA в экспериментах по пункции клеток
- Используйте MATLAB для анализа изображений, а также для расчета и построения температурного профиля AuNP (рис. 1D, E) на основе уравнений Ми60,61.
- Кроме того, обработайте все конфокальные изображения, используя распределение FIJI ImageJ62,63.
- Расчет радиуса кольца ANXA
- Обрежьте интересующую область, содержащую проколотую область, из исходных данных перед анализом повреждения мембраны.
- Используйте собственный рабочий процесс MATLAB для обработки каждого изображения, вручную отмечая центр кольца ANXA и его внешний периметр.
- Используйте эти метки для установки пределов обработки для интересующей области.
ПРИМЕЧАНИЕ: Область затем обрабатывается радиально в заданных пределах, и интенсивность флуоресценции на определенном расстоянии от центра является средней по полному кругу с тем же межосевым расстоянием. Это число сохраняется для каждого шага радиуса. - Используйте рабочий процесс для подгонки усредненных интенсивностей по всему диапазону сканирования к одномерной гауссовской кривой для определения максимумов (Rp) и полной ширины при половинном максимуме (FWHM), соответствующих Rext и Rint соответственно, как показано на рисунке 3A.
- Используйте эти метки для установки пределов обработки для интересующей области.
- Наконец, определите радиус кольца ANXA по расстоянию от центра кольца до Rext , заданному графиком, сгенерированным рабочим процессом MATLAB.
- Трехмерный расчет радиуса кольца ANXA
- Отслеживайте изменение радиуса кольца ANXA в направлении z, используя тот же рабочий процесс анализа MATLAB, что и на шаге 5.1. Примените рабочий процесс к нескольким конфокальным z-сечениям по всей мембранной намотке, как показано на рисунке 3C, E.
- Рассчитайте уклон для каждой раны на основе изменения радиусов по z-сечениям, как показано на рисунке 3F.
- Эволюция радиуса кольца ANXA во времени
- Аналогичным образом, проследите эволюцию кольца ANXA после пункции термоплазмонной мембраны с помощью рабочего процесса анализа MATLAB, начиная с шага 5.1. Анализируйте последовательные моменты времени для отслеживания изменений с течением времени, как показано на рисунке 3D, G, H.
Результаты
В настоящем исследовании термоплазмонный метод используется для изучения реакции белка аннексина на разрушение плазматической мембраны; Тем не менее, любой белок, который может быть рекрутирован при повреждении мембраны, может быть исследован с помощью этого анализа, учитывая, что соответствующий белок флуоресцентно мечен. Рекрутирование и функция белка контролируются с помощью конфокальной визуализации как в клетках эмбриональной почки человека (HEK293T), так и в гигантских одноламеллярных везикулах (GUV). На рисунке 2 показаны экспериментальные условия, в которых сфокусированный лазерный луч ближнего ИК-диапазона с длиной волны 1064 нм используется для облучения одного AuNP (рис. 2A), что приводит к повреждению мембраны и притокуCa2+ в клетку, активируя механизм PMR. Затем аннексины быстро рекрутируются в место повреждения, где они связываются с отрицательно заряженными фосфолипидами по периметру раны, образуя кольцеобразную структуру в течение нескольких секунд (рис. 2B, i-iv). Модельные мембранные эксперименты с использованием GUV показали, что проколы мембраны быстро запечатывались в отсутствие ANXA, как показано на рисунке 2C. Однако в присутствии ANXA наблюдалось быстрое накопление ANXA в месте повреждения после пункции мембраны (рис. 2D). Примечательно, что ANXA продолжала закручивать открытые края, что в конечном итоге привело к разрыву GUV. Считается, что этот механизм качения возникает из-за способности ANXA вызывать искривление и изгибать липидные мембраны20.
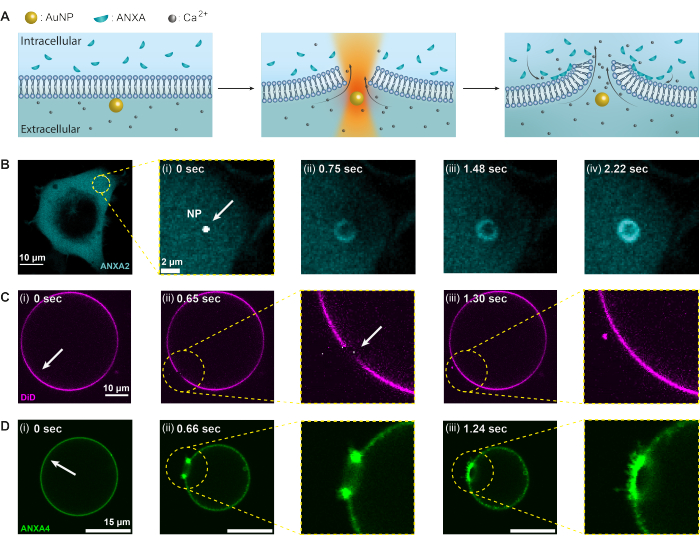
Рисунок 2: Реакция аннексинов (ANXA) на термоплазмонное разрушение мембран. Первоначально (А) плазматическая мембрана действует как барьер между внеклеточной средой, содержащей высокие уровни ионовCa2+, и внутриклеточной средой с инкапсулированными ANXA. При облучении лазером ближнего инфракрасного диапазона (NIR) AuNP выделяет значительное тепло, что приводит к разрыву мембраны и притоку ионов Ca2+. Следовательно, активируется механизм репарации плазматической мембраны (PMR), который включает в себя рекрутирование ANXA к месту повреждения, где они связываются с отрицательно заряженными фосфолипидами. (Б-Д) Конфокальные микроскопические изображения клетки, содержащей ANXA2, и GUV, содержащей ANXA4, демонстрируют этот процесс. (i) До облучения на изображениях видна интактная ячейка, или GUV, с местами облучения, обозначенными белыми стрелками. (ii) При облучении наночастицами (B) ANXA быстро рекрутируются в месте повреждения, образуя кольцеобразную структуру вокруг мембранной раны (B [ii-iv]). На рисунке (C) показан окрашенный мембраной GUV без ANXA, который после прокола быстро запечатывается без видимого ремоделирования мембраны. С другой стороны, на панели (D) показан GUV, содержащий рекомбинантный ANXA4, который уже связан с мембраной до (i) облучения из-за утечки Ca2+ через мембрану. (ii) При проколе ANXA4 связывается со свободными краями, вызывая схлопывание GUV по мере того, как мембрана откатывается от края. Размеры масштабных линеек составляют 10 мкм для рисунка (B), 2 мкм для рисунка B (i), 10 мкм для (C) и 15 мкм для (D). Эта цифра воспроизведена из Moreno-Pescador et. 16 с разрешения Королевского химического общества. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Анализ полных кольцевидных структур ANXA (Рисунок 2B и Дополнительный рисунок 1) дает полезную информацию о размере и морфологии раны. Радиус кольцевой структуры ANXA может быть определен во времени и пространстве, как описано в разделе 5. Moreno et al.16 проанализировали более 135 повреждений плазматической мембраны в живых клетках, где анализ кольцевых структур ANXA5 представлен на рисунке 3. Радиус определяли путем измерения расстояния от центра кольца до внешнего радиуса кривой на основе полумаксимума по всей ширине профиля интенсивности коллапса (рис. 3A). Полученные данные продемонстрировали неоднородное распределение размеров колец ANXA5 (рис. 3B), которые оставались постоянными во времени (рис. 3D,G,H) и пространстве (рис. 3C,E,F). Эти результаты свидетельствуют о накоплении ANXA5 вокруг мест повреждения, что указывает на альтернативную ANXA5-опосредованную стратегию PMR в живых клетках по сравнению с гипотетическим воронкообразным почкованием поврежденной мембраны5.
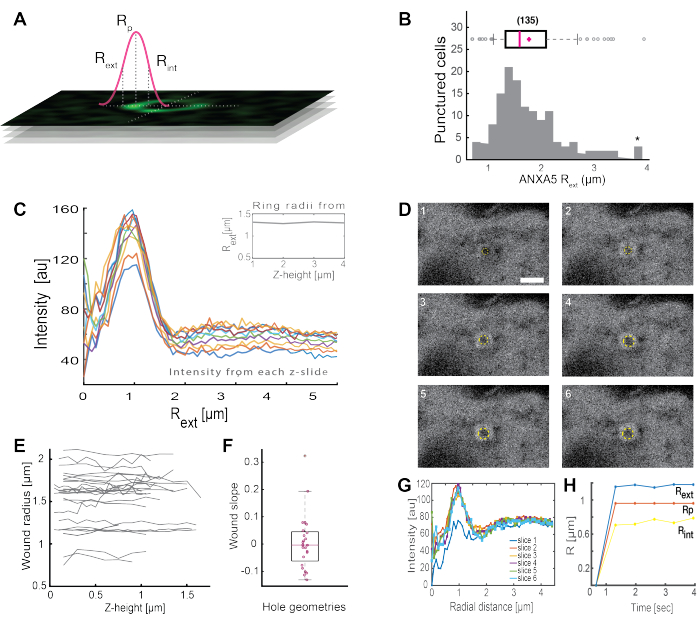
Рисунок 3: Анализ кольцевых структур ANXA5, окружающих место повреждения в живых клетках. (A) Схематическое изображение иллюстрирует аналитический подход, который основан на максимуме линии интенсивности ANXA во всю ширину. (B) Гистограмма иллюстрирует 135 измеренных радиусов колец ANXA5. (C) Профили линий интенсивности флуоресценции через кольцо ANXA5-GFP для каждого z-сечения z-стека. (D) Конфокальные изображения иллюстрируют эволюцию раны во времени, при которой ANXA5-GFP накапливается по периметру раны сразу после травмы с последующей стабилизацией раны. Таймфреймы, помеченные 1-6, были записаны с интервалом 0,66 с на кадр. Масштабная линейка составляет 2 мкм. (E) Радиусы ран были определены в зависимости от глубины раны на основе метода, представленного на панели A. (F) Наклон раны был проанализирован как радиус кольца ANXA5 в зависимости от высоты z на основе данных, извлеченных из панели E. (G) Профили линий интенсивности флуоресценции были измерены по кольцу ANXA5-GFP из панели D, где каждый временной интервал 1-6 обозначается как срез 1-6. Наконец, (H) временная эволюция кольцевых радиусов ANXA5-GFP представлена как функция времени, вычисленного по данным на панели G. Эта цифра воспроизведена из Moreno-Pescador et. 16 с разрешения Королевского химического общества. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
По сравнению с кольцевидными структурами, образующимися при разрушении только ТЧ (дополнительный рисунок 1), повреждения в непосредственной близости от ядра (дополнительный рисунок 2А) могут влиять на эволюцию и геометрию раны. Иногда была видна только часть колец ANXA (дополнительный рисунок 2B,C), которые также могут быть проанализированы с помощью собственного рабочего процесса анализа MATLAB (см. раздел 5), хотя дополнительные данные могут быть утеряны. Как правило, кольцевые образования ANXA, наблюдаемые в неадгезивных клетках (дополнительный рисунок 2C), расположены близко как к ядру, так и к периферии клетки. Как следствие, может наблюдаться более вытянутая кольцевая структура, что является неоптимальным для представленного анализа данных. Кроме того, неадгезивные клетки оказались более восприимчивыми к клеточной гибели после повреждения PM. Кроме того, при рассмотрении травм, возникающих в результате облучения агрегатов AuNP, важно отметить, что эти повреждения могут быть более серьезными и менее контролируемыми. Это происходит из-за значительного увеличения плазмонного нагрева, который может повредить большую часть клетки. В результате, такие травмы не были включены в анализ кольца ANXA5.
Более того, предварительные результаты указывают на то, что разрушение плазматической мембраны с помощью термоплазмоники приводит к повышению внутриклеточного уровняCa2+ . Это наблюдалось даже при низкоинтенсивном облучении одиночных AuNP, что позволяет предположить пермеабилизацию PM35, как показано на рисунке 4. ПритокCa2+ наблюдался в клетках, экспрессирующих связанный с мембраной кальциевый зонд GCaMP6s-CAAX, который претерпевает конформационные изменения при притокеCa2+ , и, таким образом, можно наблюдать увеличение его интенсивности64. Интенсивность кальция была количественно определена для всего следа клетки с течением времени. Для устранения фонового шума был вычтен фоновый уровень Ca2+ до разрушения мембраны и после восстановления мембраны. Максимальная интенсивность была определена путем нормализации средней интенсивности Ca2+ в клетке, в результате чего кривая интенсивности показала быстрое начальное увеличение интенсивности Ca2+ с последующим более медленным снижением, как показано на рисунке 4B.
Клетка достигла максимальной интенсивности кальция при ~ 6,6 с, что согласуется с выводами Klenow et al.64, которые предположили, что время пика интенсивности кальция (t = tc) соответствует времени, необходимому для закрытия раны. Тем не менее, несмотря на то, что необходимы дальнейшие исследования для установления основного механизма восстановления мембран и заживления ран, предварительные результаты показали, что этот процесс Ca2+ наблюдался исключительно в поврежденной клетке, а не в неповрежденной клетке, используемой в качестве положительного контроля. Это подтверждает, что клетка испытала притокСа2+ при разрушении термоплазмонной мембраны, где избыток внутриклеточного кальция активно откачивается после успешного ПМР, поскольку внутриклеточный уровень кальция больше не конкурирует с притокомСа2+ , в конечном итоге достигая клеточного гомеостаза64.
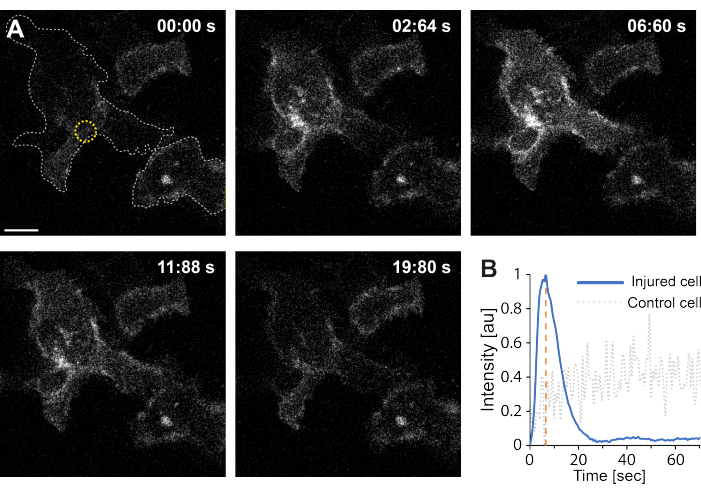
Рисунок 4: Приток кальция происходит при разрыве плазматической мембраны HEK293T клетки термоплазмоникой. Серия конфокальных изображений показывает две клетки (интересующую клетку и неповрежденную клетку, используемую в качестве положительного контроля), экспрессирующие связанный с мембраной кальциевый зонд GCaMP6s-CAAX. Масштабная линейка имеет размер 10 мкм. (А) Перед облучением, в 00:00 с, след двух клеток визуализируется серой пунктирной линией, а место облучения обозначается желтым кружком. При лазерном облучении наблюдается быстрый притокСа2+ , достигающий максимальной интенсивности при ~ 6,6 с, обозначенный оранжевой пунктирной линией, точка времени, которая, как предполагается, соответствует времени закрытия раны64. (B) Профиль интенсивности кальция, полученный с помощью зонда GCaMP6s-CAAX в поврежденной клетке (синяя линия), сравнивали с интенсивностьюCa2+ в соседней неповрежденной клетке (серая пунктирная линия), показывая явный приток Ca2+ исключительно при разрушении PM. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Обсуждение
В исследовании подчеркивается, что термоплазмонный подход является многообещающим методом для изучения белковых реакций в живых клетках и моделирования мембран после разрушения мембраны. Этот метод дает обширную информацию не только о рекрутировании белка, но и о биофизической функции белков, участвующих в белково-мембранной динамике. Следовательно, это облегчает идентификацию молекулярных компонентов, ответственных за восстановление поверхности, и способствует пониманию сложного, но жизненно важного механизма восстановления плазматической мембраны. Несмотря на то, что существуют различные методы индуцирования разрушения мембраны, такие как механические, химические и оптические методы, эти методы страдают от ограничений, таких как неспецифичность для клеток, множественные повреждения клеточной мембраны или значительное повреждение мембраны и удаление внутреннего клеточного материала вдоль пути лазера при использовании мощных импульсных лазеров. Несмотря на то, что интеграция конфокальной микроскопии и оптического пинцета дает наиболее полную информацию, можно использовать и альтернативные методы визуализации. Например, поскольку визуализация плазмонной наночастицы достигается с помощью отражательной микроскопии, встроенного режима визуализации в конфокальных микроскопах Leica, для визуализации AuNP могут быть использованы дополнительные методы визуализации, такие как темнопольная микроскопия65,66, другие методы рассеяния, такие как iSCAT67,68 или флуоресцентное мечение наночастицы, хотя это может ограничить применимость метода.
Кроме того, представленный метод способен индуцировать наноскопические отверстия в модельных мембранах, что позволяет исследовать эффекты синергии между различными аннексинами. Это достигается путем инкапсуляции по-разному меченых рекомбинантных аннексинов, например, RFP и GFP соответственно, с последующей термоплазмонной пункцией. Эта модельная система дает представление о том, как аннексины взаимодействуют с мембранами в непосредственной близости от свободных краев, как показано на рисунке 2D. Однако, в отличие от клеток, отверстия, нанесенные GUV, продолжают расширяться, что приводит к дестабилизации везикулы. Визуализация эволюции отверстий с помощью конфокальной микроскопии может быть сложной задачей из-за быстрого увеличения диаметра отверстия, но может быть достигнута путем захвата нескольких z-стеков с течением времени. Альтернативным методом может быть использование вращающегося диска конфокального для более быстрой визуализации. Кроме того, термоплазмонный подход, как правило, дает ограниченное количество оптимальных результатов в час при применении к одиночным клеткам или экспериментам с УФ-излучением, обычно к двум-трем, при температуре образца от 20 °C до 30 °C. Для получения наиболее точного наблюдения за белково-мембранной динамикой рекомендуется держать клетки в HEPES-содержащем буфере и заменять образец каждый час. В качестве альтернативы экспериментальное окно можно было бы расширить, проведя эксперименты в камере инкубации клеток, т.е. при постоянной температуре 37 °C с 5%CO2. Кроме того, сочетание этого подхода с другими методами визуализации, такими как стохастическая оптическая реконструктивная микроскопия (STORM), может обеспечить более глубокое понимание биофизических функций и взаимодействия ключевых белков, участвующих в репарации мембран на уровне одной молекулы. Это может предоставить подробную информацию о месте повреждения, включая геометрию раны и расположение белков аннексинов, а также определить других ключевых игроков, участвующих в восстановлении поверхности мембраны.
Для достижения максимальной эффективности и точности в индуцировании повреждения мембраны необходимо проверять местоположение лазерного фокуса перед каждым экспериментом и следить за тем, чтобы осевое положение лазерного фокуса совпадало с конфокальным фокусом. Такое выравнивание оптимизирует интенсивность во время визуализации AuNP, что приводит к максимальному локальному повышению температуры и, как следствие, повреждению мембраны при более низкой мощности лазера. Этот процесс выполняется вручную и, следовательно, подвержен изменениям в эффективности разрыва мембраны, поскольку фокус вручную перемещается в положение, совпадающее с местоположением частицы. В микроскопах, в которых отсутствует режим отражения, как в некоторых коммерческих системах, совместная локализация лазерного фокуса и частицы может быть сложной задачей. В таких случаях могут быть использованы альтернативные режимы визуализации (например, яркое поле), и медленное растровое сканирование может быть выполнено вокруг ожидаемого положения частицы. Следует отметить, что низкая мощность лазера, скорее всего, вызовет только проницаемость мембраны, в то время как высокая мощность лазера может генерировать температуры вокруг НЧ, превышающие температуру кипения воды, даже если поверхность стекла имеет охлаждающий эффект. Подсчитано, что образование нанопузырьков, окружающих НЧ, происходит между 200 °C и 300 °C25,48, где взрывное тепло может привести либо к смещению частиц из лазерного фокуса, либо к фрагментации частиц. Кроме того, образование нано- или микропузырьков во время нагрева представляет собой проблему для этого метода. Поскольку воздух увлажняет мембраны и может вызвать дестабилизацию белка, что нежелательно, необходимо ограничить нагрев при исследовании восстановления мембраны. Примечательно, что золотые нанооболочки не переносят высоких температур и разрушаются в этих условиях, что было продемонстрировано микроскопией высокого разрешения58.
В данной статье представлен подробный протокол использования термоплазмоники для выполнения высоколокализованных пункций в мембранах, который применим как к клеткам, так и к модельным мембранам. Для дальнейшего уменьшения степени нагрева можно использовать более мелкие наночастицы, резонирующие со светом ближнего ИК-диапазона, что позволяет проводить внутриклеточные пункции в эндосомах, эндоплазматическом ретикулуме и ядерной оболочке. Такие наночастицы, в том числе палочки и наноматрёшки48, могут быть использованы для исследования репарации ядерной оболочки путем нацеливания на эндоцитозированные наночастицы золота, которые легко захватываются на поверхности клетки и направляются к ядру69. В целом, этот метод позволяет идентифицировать и исследовать ключевые молекулярные компоненты, участвующие в PMR, выясняя их биофизические функции и роль, сохраняя при этом жизнеспособность клеток.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы хотели бы поблагодарить Йеспера Нюландстеда за предоставление нам рекомбинантных белков аннексина и плазмид, кодирующих аннексины. Эта работа была финансово поддержана Датским советом по независимым исследованиям в области естественных наук (DFF-4181-00196), Междисциплинарной программой синергии Фонда «Ново Нордиск» 2018 (NNF18OC0034936), Научным комитетом Датского онкологического общества (R90-A5847-14-S2), Фондом Лундбека (R218-2016-534) и Центром передового опыта Фонда Лундбека (биомембраны в наномедицине).
Материалы
| Name | Company | Catalog Number | Comments |
| 1064 nm trapping laser | Spectra Physics | N/A | Spectra Physics J201-BL-106C, Nd: YVO4 NIR laser |
| 160 nm Gold Nanoshells | NanoComposix | NCXGSIR150 | |
| 200 nm Gold Nanoparticles | BBI Solutions | EM.GC200/7 | |
| 35 mm glass surface MatTex microwell | MATTEK | P35G-1.5-14-C | |
| Amber-glass vials | Supelco Sigma Aldrich | 243438 | |
| Annexin A2 plasmids | N/A | N/A | Received from our collaborator at the Danish Cancer Research Center |
| Annexin A4 recombinant-protein | N/A | N/A | N-terminal GFP tagged ANXA4 received from our collaborator at the Danish Cancer Research Center |
| Annexin A5 recombinant-protein | N/A | N/A | N-terminal GFP tagged ANXA5 received from our collaborator at the Danish Cancer Research Center |
| beta-casein | Sigma Life Science | C6905-1G | |
| CaCl2 | Suprlco (sigma Aldrich) | 10035-04-8 | |
| Centrifuge 5702 | Eppendorf | 5702 | |
| Chloroform | VWR Chemicals | 67-66-3 | |
| Culture dish (Nunclon Delta Surface) | Thermo scientific | 150460 | |
| DID cell-labelling Solution | Invitrogen | 7757 | |
| Distilled water | Gibco | 15230-089 | |
| DOPC | Avanti Polar Lipids | 850375C | Dissolved in chloroform |
| DOPS | Avanti Polar Lipids | 840035C | Dissolved in chloroform |
| Dulbecco's Modified Eage's Medium | Thermo Fisher Scientific | 11995065 | |
| FIJI ImageJ distribution | ImageJ2 | N/A | |
| GCaMP6s-CAAX | N/A | Received from our collaborator at the Danish Cancer Research Center | |
| Gibco Fetal Bovine Serum | Fisher Scientific | 11573397 | 10% of the culture medium |
| Glucose | PROLABO | 24 374.297 | |
| Hamilton syringes | Hamilton Company | N/A | 50 and 500 microliters |
| Harrick Plasma Cleaner PDG-002 | Harrick Plasma | N/A | |
| HEK293T cells | N/A | Received from our collaborator at the Danish Cancer Research Center | |
| Leica Acousto-Optical Beam Splitter (AOBS) | Leica | N/A | |
| Leica PL APO 63x water immersion objective, NA = 1.2 | Leica | N/A | |
| Leica SP5 confocal scanning microscope | Leica | N/A | |
| Lipofectamine | Fisher Scientific | 15338030 | |
| MatLab | The Mathworks, Inc., Natick, Massachusetts, United States | N/A | |
| NaCl | VWR Chemicals | 7647-14-5 | |
| Opti-MEM Reduced-Serum Medium | Thermo Fisher Scientific | 11058021 | |
| Parafilm | Bemis | PM-992 | |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | 1% of the culture medium |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | 10010023 | |
| Piezoelectric stage (PI 731.20) | Physik Instrumente (Germany) | N/A | |
| Poly-L-Lysine | Sigma-Aldrich | P8920-100ML | 0.01-0.1% for coating |
| Polyvinyl alcohol | Sigma-Aldrich | 363065-25G | |
| round glass slide 25 mm Ø | VWR | 631-1584 | |
| Sonicator Brandson 2800 | Brandson | N/A | |
| sucrose | Sigma Life Science | 57-50-1 | |
| T25 tissue culture flask | Falcon | 353108 | Blue Vented cap |
| Tris-HCl | Invitrogen | 15567-027 | |
| TrypLE | Thermo Fisher Scientific | A1285901 | |
| Trypsin-EDTA | Fisher Scientific | 11590626 | |
| VWR Mixer mini vortex 230V EU | VWR | 12620-84 | ECN: 444-2790, SN: 150713022 |
Ссылки
- Bendix, P. M., et al. Interdisciplinary synergy to reveal mechanisms of annexin-mediated plasma membrane shaping and repair. Cells. 9 (4), 1029 (2020).
- Gajic, O., Lee, J., Doerr, C. H., Berrios, J. C., Myers, J. L., Hubmayr, R. D. Ventilator-induced Cell Wounding and Repair in the Intact Lung. American Journal of Respiratory and Critical Care Medicine. 167, 1057-1063 (2003).
- McNeil, P. L., Khakee, R. Disruptions of muscle fiber plasma membranes. Role in exercise-induced damage. The American Journal of Pathology. 140 (5), 1097-1109 (1992).
- Yu, Q. C., McNeil, P. L. Transient disruptions of aortic endothelial cell plasma membranes. The American Journal of Pathology. 141 (6), 1349-1360 (1992).
- Boye, T. L., et al. Annexin A4 and A6 induce membrane curvature and constriction during cell membrane repair. Nature Communications. 8, 1623 (2017).
- Bischofberger, M., Gonzalez, M. R., van der Goot, F. G. Membrane injury by pore-forming proteins. Current Opinion in Cell Biology. 21, 589-595 (2009).
- Tang, S. K. Y., Marshall, W. F. Self-repairing cells. Science (New York, N.Y.). 356, 1022-1025 (2017).
- Abreu-Blanco, M. T., Verboon, J. M., Parkhurst, S. M. Single cell wound repair: Dealing with life's little traumas. Bioarchitecture. 1, 114-121 (2011).
- Sønder, S. L., et al. Annexin A7 is required for ESCRT III-mediated plasma membrane repair. Scientific Reports. 9, 6726 (2019).
- Andrews, N. W., Almeida, P. E., Corrotte, M. Damage control: cellular mechanisms of plasma membrane repair. Trends in Cell Biology. 24 (12), 734-742 (2014).
- Idone, V., Tam, C., Goss, J. W., Toomre, D., Pypaert, M., Andrews, N. W. Repair of injured plasma membrane by rapid Ca2+-dependent endocytosis. The Journal of Cell Biology. 180 (5), 905-914 (2008).
- Lauritzen, S. P., Boye, T. L., Nylandsted, J. Annexins are instrumental for efficient plasma membrane repair in cancer cells. Seminars in Cell & Developmental Biology. 45, 32-38 (2015).
- Häger, S. C., Nylandsted, J. Annexins: players of single cell wound healing and regeneration. Communicative & Integrative Biology. 12 (1), 162-165 (2019).
- Jaiswal, J. K., et al. S100A11 is required for efficient plasma membrane repair and survival of invasive cancer cells. Nature Communications. 5, 3795 (2014).
- Draeger, A., Monastyrskaya, K., Babiychuk, E. B. Plasma membrane repair and cellular damage control: The annexin survival kit. Biochemical Pharmacology. 81 (6), 703-712 (2011).
- Moreno-Pescador, G. S., et al. Thermoplasmonic nano-rupture of cells reveals annexin V function in plasma membrane repair. Nanoscale. 14 (21), 7778-7787 (2022).
- Zhivotovsky, B., Orrenius, S. Calcium and cell death mechanisms: A perspective from the cell death community. Cell Calcium. 50 (3), 211-221 (2011).
- Gerke, V., Moss, S. E. Annexins: From structure to function. Physiological Reviews. 82 (2), 331-371 (2002).
- Idone, V., Tam, C., Andrews, N. W. Two-way traffic on the road to plasma membrane repair. Trends in Cell Biology. 18 (11), 552-559 (2008).
- Boye, T. L., et al. Annexins induce curvature on free-edge membranes displaying distinct morphologies. Scientific Reports. 8, 10309 (2018).
- Bouter, A., et al. Annexin-A5 assembled into two-dimensional arrays promotes cell membrane repair. Nature Communications. 2, 270 (2011).
- Boye, T. L., Nylandsted, J. Annexins in plasma membrane repair. Biological Chemistry. 397 (10), 961-969 (2016).
- Weinberger, A., et al. Gel-assisted formation of giant unilamellar vesicles. Biophysical Journal. 105 (1), 154-164 (2013).
- Numata, T., Tatsuta, H., Morita, Y., Otani, Y., Umeda, N. Localized thermal processing with a laser-trapped and heated metal nanoparticle. IEEJ Transactions on Electrical and Electronic Engineering. 2, 398-401 (2007).
- Bendix, P. M., Reihani, S. N. S., Oddershede, L. B. Direct measurements of heating by electromagnetically trapped gold nanoparticles on supported lipid bilayers. ACS Nano. 4 (4), 2256-2262 (2010).
- Kyrsting, A., Bendix, P. M., Stamou, D. G., Oddershede, L. B. Heat profiling of three-dimensionally optically trapped gold nanoparticles using vesicle cargo release. Nano Letters. 11 (2), 888-892 (2011).
- Andersen, T., Kyrsting, A., Bendix, P. M. Local and transient permeation events are associated with local melting of giant liposomes. Soft Matter. 10 (24), 4268-4274 (2014).
- Bahadori, A., Oddershede, L. B., Bendix, P. M. Hot-nanoparticle-mediated fusion of selected cells. Nano Research. 10, 2034-2045 (2017).
- Rørvig-Lund, A., Bahadori, A., Semsey, S., Bendix, P. M., Oddershede, L. B. Vesicle fusion triggered by optically heated gold nanoparticles. Nano Letters. 15 (6), 4183-4188 (2015).
- Moreno-Pescador, G., Arastoo, M. R., Ruhoff, V. T., Chiantia, S., Daniels, R., Bendix, P. M. Thermoplasmonic vesicle fusion reveals membrane phase segregation of influenza spike proteins. Nano Letters. 23 (8), 3377-3384 (2023).
- Bahadori, A., Lund, A. R., Semsey, S., Oddershede, L. B., Bendix, P. M. Controlled cellular fusion using optically trapped plasmonic nano-heaters. SPIE Proceedings. SPIE 9922, Optical Trapping and Optical Micromanipulation XIII. 992211, (2016).
- Bahadori, A., Moreno-Pescador, G., Oddershede, L. B., Bendix, P. M. Remotely controlled fusion of selected vesicles and living cells: a key issue review. Reports on Progress in Physics. 81 (3), 32602 (2018).
- Moreno-Pescador, G., Arastoo, M. R., Chiantia, S., Daniels, R., Bendix, P. M. Thermoplasmonic induced vesicle fusion for investigating membrane protein phase affinity. bioRxiv. , (2022).
- Pescador, G. S. M., et al. Investigating plasma-membrane repair employing thermoplasmonics. Biophysical Journal. 120 (3), 45A (2021).
- Moreno-Pescador, G. S., Qoqaj, I., Thusgaard Ruhoff, V., Iversen, J., Nylandsted, J., Bendix, P. M. Effect of local thermoplasmonic heating on biological membranes. SPIE 11083, Optical Trapping and Optical Micromanipulation XVI. 110830M, (2019).
- Bement, W. M., Mandato, C. A., Kirsch, M. N. Wound-induced assembly and closure of an actomyosin purse string in Xenopus oocytes. Current Biology. 9 (11), 579-587 (1999).
- Weisleder, N., et al. Recombinant MG53 protein modulates therapeutic cell membrane repair in treatment of muscular dystrophy. Science Translational Medicine. 4 (139), 139ra85 (2012).
- Sudji, I. R., Subburaj, Y., Frenkel, N., García-Sáez, A. J., Wink, M. Membrane disintegration caused by the steroid saponin digitonin is related to the presence of cholesterol. Molecules. 20 (11), 20146-20160 (2015).
- Babiychuk, E. B., Monastyrskaya, K., Potez, S., Draeger, A. Intracellular Ca2+ operates a switch between repair and lysis of streptolysin O-perforated cells. Cell Death & Differentiation. 16, 1126-1134 (2009).
- Nygård Skalman, L., Holst, M. R., Larsson, E., Lundmark, R. Plasma membrane damage caused by listeriolysin O is not repaired through endocytosis of the membrane pore. Biology Open. 7 (10), bio035287 (2018).
- Swaggart, K. A., et al. Annexin A6 modifies muscular dystrophy by mediating sarcolemmal repair. Proceedings of the National Academy of Sciences of the United States of America. 111, 6004-6009 (2014).
- Yeheskely-Hayon, D., Minai, L., Golan, L., Dann, E. J., Yelin, D. Optically induced cell fusion using bispecific nanoparticles. Small. 9 (22), 3771-3777 (2013).
- Minai, L., Yeheskely-Hayon, D., Golan, L., Bisker, G., Dann, E. J., Yelin, D. Optical nanomanipulations of malignant cells: Controlled cell damage and fusion. Small. 8 (11), 1732-1739 (2012).
- Lukianova-Hleb, E., et al. Plasmonic nanobubbles as transient vapor nanobubbles generated around plasmonic nanoparticles. ACS Nano. 4 (4), 2109-2123 (2010).
- Vogel, A., Noack, J., Hüttman, G., Paltauf, G. Mechanisms of femtosecond laser nanosurgery of cells and tissues. Applied Physics B. 81, 1015-1047 (2005).
- Baffou, G., Polleux, J., Rigneault, H., Monneret, S. Super-heating and micro-bubble generation around plasmonic nanoparticles under cw illumination. Journal of Physical Chemistry C. 118 (9), 4890-4898 (2014).
- Sasikumar, K., Liang, Z., Cahill, D. G., Keblinski, P. Curvature induced phase stability of an intensely heated liquid. Journal of Chemical Physics. 140 (23), 234506 (2014).
- Jauffred, L., Samadi, A., Klingberg, H., Bendix, P. M., Oddershede, L. B. Plasmonic heating of nanostructures. Chemical Reviews. 119 (13), 8087-8130 (2019).
- Neuman, K. C., Nagy, A. Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nature Methods. 5 (6), 491-505 (2008).
- Bendix, P. M., Jauffred, L., Norregaard, K., Oddershede, L. B. Optical trapping of nanoparticles and quantum dots. IEEE Journal of Selected Topics in Quantum Electronics. 20, 15-26 (2014).
- Samadi, A., Bendix, P. M., Oddershede, L. B. Optical manipulation of individual strongly absorbing platinum nanoparticles. Nanoscale. 46, 18449-18455 (2017).
- Jørgensen, J. T., Norregaard, K., Tian, P., Bendix, P. M., Kjaer, A., Oddershede, L. B. Single particle and PET-based platform for identifying optimal plasmonic nano-heaters for photothermal cancer therapy. Scientific Reports. 6, 30076 (2016).
- Goldenberg, H., Tranter, C. J. Heat flow in an infinite medium heated by a sphere. British Journal of Applied Physics. 3 (9), 296-298 (1952).
- Eustis, S., El-Sayed, M. A. Why gold nanoparticles are more precious than pretty gold: Noble metal surface plasmon resonance and its enhancement of the radiative and nonradiative properties of nanocrystals of different shapes. Chemical Society Reviews. 35, 209-217 (2006).
- Landau, L. D., Lifshitz, E. M. . Fluid Mechanics: Landau and Lifshitz: Course of Theoretical Physics. 6, (2013).
- Niederauer, C., Seynen, M., Zomerdijk, J., Kamp, M., Ganzinger, K. A. The K2: Open-source simultaneous triple-color TIRF microscope for live-cell and single-molecule imaging. HardwareX. 13, e00404 (2023).
- Richardson, A. C., Reihani, N., Oddershede, L. B. Combining confocal microscopy with precise force-scope optical tweezers. SPIE Proceedings:SPIE 6326, Optical Trapping and Optical Micromanipulation III. 632628, (2006).
- Samadi, A., Klingberg, H., Jauffred, L., Kjær, A., Bendix, P. M., Oddershede, L. B. Platinum nanoparticles: a non-toxic, effective and thermally stable alternative plasmonic material for cancer therapy and bioengineering. Nanoscale. 10 (19), 9097-9107 (2018).
- . Available from: https://www.thermofisher.com/order/catalog/product/A7816 (2023)
- Kreibig, U., Vollmer, M. Theoretical considerations. In: Optical Properties of Metal Clusters. 25, (1995).
- Mie, G. Beiträge zur Optik trüber Medien, speziell kolloidaler Metallösungen. Annalen der Physik. 330 (3), 377-445 (1908).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529 (2017).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Klenow, M. B., Heitmann, A. S. B., Nylandsted, J., Simonsen, A. C. Timescale of hole closure during plasma membrane repair estimated by calcium imaging and numerical modeling. Scientific Reports. 11, 4226 (2021).
- Li, T., Wu, X., Liu, F., Li, N. Analytical methods based on the light-scattering of plasmonic nanoparticles at the single particle level with dark-field microscopy imaging. Analyst. 142 (2), 248-256 (2017).
- Gibbs-Flournoy, E. A., Bromberg, P. A., Hofer, T. P. J., Samet, J. M., Zucker, R. M. Darkfield-Confocal Microscopy detection of nanoscale particle internalization by human lung cells. Particle and Fibre Toxicology. 8 (1), 2 (2011).
- Taylor, R. W., Sandoghdar, V. Interferometric scattering microscopy: Seeing single nanoparticles and molecules via Rayleigh scattering. Nano Letters. 19 (8), 4827-4835 (2019).
- Wu, Y., Ali, M. R. K., Chen, K., Fang, N., El-Sayed, M. A. Gold nanoparticles in biological optical imaging. Nano Today. 24, 120-140 (2019).
- Klingberg, H., Oddershede, L. B., Loeschner, K., Larsen, E. H., Loft, S., Møller, P. Uptake of gold nanoparticles in primary human endothelial cells. Toxicology Research. 4 (3), 566-666 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены