需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用单次呼吸法测量人体运动期间的双重测试气体肺弥散能力
摘要
该方案提出了一种评估肺泡毛细血管储备的方法,该方法通过联合单次呼吸测量运动期间对一氧化碳(DL,CO)和一氧化氮(DL,NO)的扩散能力进行测量。在锻炼过程中使用该技术的假设和建议构成了本文的基础。
摘要
一氧化碳 (DL,CO) 和一氧化氮 (DL,NO) 的扩散能力的联合单次呼吸测量是测量健康和患者人群肺泡毛细血管储备的有用技术。该测量值提供了参与者募集和扩张肺毛细血管的能力的估计。最近有报道称,该方法在健康志愿者中表现出高重测可靠性,用于轻度至中等强度的运动。值得注意的是,这种技术最多允许 12 次重复操作,并且只需要一次呼吸,屏气时间相对较短,为 5 秒。提供了代表性数据,显示了 DL,NO 和 DL,CO 从休息到运动的逐渐变化,强度高达最大工作量的 60%。弥散能力的测量和肺泡毛细血管储备的评估是评估健康人群和患者群体(如慢性肺病患者)肺部对运动的反应能力的有用工具。
引言
与静息状态相比,运动导致能量需求显着增加。心脏和肺的反应是增加心输出量和通气量,导致肺泡-毛细血管床扩张,主要是肺毛细血管的募集和扩张1.这确保了足够的肺气体交换,这可以通过肺弥散能力(DL)的增加来衡量2,3,4。在运动过程中测量 DL 的第一次尝试可以追溯到一个多世纪前 5,6,7。从静息状态增加 DL 的能力通常被称为肺泡毛细血管储备 8,9。
在实验上,肺泡-毛细血管膜弥散能力 (DM) 和肺毛细血管血容量 (VC) 对肺泡-毛细血管储备的相对贡献可以通过不同的方法进行评估,包括经典的吸入氧多重组分 (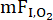 )方法 10。在这种情况下可能有用的另一种技术是双重测试气体方法,其中同时测量 DL 到一氧化碳 (CO) 和一氧化氮 (NO) (DL,CO/NO)11。该技术是在 1980 年代开发的,它利用了 NO 与血红蛋白 (Hb) 的反应速率大大大于 CO 的反应速率这一事实,因此 CO 的肺扩散比 NO 更依赖于 VC 。 因此,对 CO 扩散的抵抗主要部位 (~75%) 位于红细胞内, 而对 NO 扩散的主要阻力 (~60%) 在肺泡毛细血管膜和肺血浆12。因此,同时测量 DL,CO 和 DL,NO 可以评估 DM 和 VC 对 DL12 的相对贡献,其中在运动过程中观察到的 DL,NO 的变化在很大程度上反映了肺泡-毛细血管膜的扩张。在运动期间获得测量值时,这种方法的另一个优点是,与经典技术相比,它涉及相对较短的屏气时间(~5 s)和更少的操作,在经典
)方法 10。在这种情况下可能有用的另一种技术是双重测试气体方法,其中同时测量 DL 到一氧化碳 (CO) 和一氧化氮 (NO) (DL,CO/NO)11。该技术是在 1980 年代开发的,它利用了 NO 与血红蛋白 (Hb) 的反应速率大大大于 CO 的反应速率这一事实,因此 CO 的肺扩散比 NO 更依赖于 VC 。 因此,对 CO 扩散的抵抗主要部位 (~75%) 位于红细胞内, 而对 NO 扩散的主要阻力 (~60%) 在肺泡毛细血管膜和肺血浆12。因此,同时测量 DL,CO 和 DL,NO 可以评估 DM 和 VC 对 DL12 的相对贡献,其中在运动过程中观察到的 DL,NO 的变化在很大程度上反映了肺泡-毛细血管膜的扩张。在运动期间获得测量值时,这种方法的另一个优点是,与经典技术相比,它涉及相对较短的屏气时间(~5 s)和更少的操作,在经典 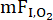 技术中,在不同的氧气水平下进行多次重复操作,标准化的 10 秒屏气。虽然
技术中,在不同的氧气水平下进行多次重复操作,标准化的 10 秒屏气。虽然 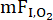 最近应用了更短的屏气时间和更少的动作,但每种强度13.然而,
最近应用了更短的屏气时间和更少的动作,但每种强度13.然而, 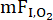 每次会话总共只允许 6 次 DL,CO 操作,而最多可以执行 12 次重复的 DL,CO/NO 操作,而不会对结果估计值产生任何可测量的影响14。在运动期间进行测量时,这些都是重要的考虑因素,因为在非常高的强度下或在出现呼吸困难的患者群体中,长时间屏气和多次操作都可能难以进行。
每次会话总共只允许 6 次 DL,CO 操作,而最多可以执行 12 次重复的 DL,CO/NO 操作,而不会对结果估计值产生任何可测量的影响14。在运动期间进行测量时,这些都是重要的考虑因素,因为在非常高的强度下或在出现呼吸困难的患者群体中,长时间屏气和多次操作都可能难以进行。
本文提供了一个详细的方案,包括关于运动期间测量 DL、CO/NO 及其用作肺泡-毛细血管储备指标的理论考虑和实践建议。这种方法很容易应用于实验环境,并允许评估肺部的扩散限制如何影响不同人群的摄氧量。
理论和测量原理
DL,CO/NO 方法涉及单次呼吸气体混合物,假设气体在吸入后均匀分布在通风的肺泡空间中。气体混合物由几种气体组成,包括惰性示踪气体。通风肺泡腔中示踪气体的稀释度,基于其在呼气末空气中的分数,可用于计算肺泡容积 (VA)15。气体混合物还包括测试气体 CO 和 NO,它们都在通风的肺泡空间中稀释并扩散到肺泡毛细血管膜上。根据它们的肺泡分数,可以计算出它们从肺泡空间中消失的个体速率 (k),也称为弥散常数。按照惯例,在单次呼吸操作期间测量的测试气体的 DL 由以下公式16 推导:
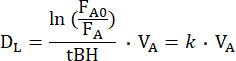
其中 FA0 是单个 DL 动作屏气开始时测试气体(CO 或 NO)的肺泡分数,而 FA 是屏气结束时测试气体的肺泡分数,tBH 是屏气时间。DL 在机械上相当于测试气体穿过肺泡毛细血管膜,通过血浆和红细胞内部到达血红蛋白的电导。因此,它既取决于 DM 的电导率,也取决于所谓的肺毛细血管血 (θ) 的比电导率,后者既取决于测试气体在血液中的电导率,也取决于其与血红蛋白10 的反应速率。鉴于电导的倒数是电阻,则测试气体转移的总电阻取决于串联 10 中的以下电阻:
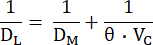
这些分量可以通过同时测量 DL 到 CO 和 NO 来区分,因为它们具有不同的 θ 值,因此它们各自的 DL 值对 VC 的依赖程度不同。与 NO 相比,CO 的肺扩散更依赖于 VC,对 CO 扩散的主要抵抗部位 (~75%) 位于红细胞内 12。相反,NO扩散的主要阻力(~60%)在肺泡毛细血管膜和肺血浆,因为NO与血红蛋白的反应速率明显大于CO。 而后者对 VC 的依赖要小得多,因此可以对决定 DL 的因素进行综合评估。
DL、CO/NO 指标的报告可以使用不同的单位完成。因此,欧洲呼吸学会 (ERS) 使用 mmol/min/kPa,而美国胸科学会 (ATS) 使用 mL/min/mmHg。单位之间的转换系数为 2.987 mmol/min/kPa = mL/min/mmHg。
研究方案
丹麦首都地区科学伦理委员会此前已批准在我们机构的健康志愿者和慢性阻塞性肺病 (COPD) 患者中测量休息、运动期间和仰卧位的 DL、CO/NO (协议 H-20052659、H-21021723 和 H-21060230)。
注意:在运动期间测量 DL、CO/NO 之前,必须进行动态肺活量测定和心肺运动测试 (CPET)。动态肺活量测定法用于单个 DL,CO/NO 动作的质量控制,而 CPET 用于确定在运动期间测量 DL,CO/NO 的工作量。对于气流受限的患者,特别是由于阻塞性肺疾病,在动态肺活量测定法的基础上补充全身体积描记法以获得有效的肺活量测量值可能是有利的。建议在开始 CPET 之前进行医学健康检查以排除任何已知的禁忌证17.重要的是,CPET 应在运动期间获得 DL,CO/NO 测量值前至少 48 小时进行,因为先前的剧烈运动可能会影响 DL 至少 24 小时18,19。
1. 动态肺活量测定法
注意:动态肺活量测定应根据 ERS 和 ATS20 的当前临床指南进行。
- 测量重量(最接近的 100 克)和高度(最接近的 1 毫米)。
- 让参与者坐在直立的椅子上。
- 在强制呼气操作期间进行动态肺活量测定,以确定参与者的 1 秒内用力呼气体积 (FEV1) 和用力肺活量 (FVC),如其他地方所述20.
2. 心肺运动试验(CPET)
注:CPET 应按照当前的临床建议进行 21.
- 根据参与者的身高调整自行车测力计,并将心率 (HR) 监测器放在胸部。
- 将参与者放在自行车测力计上。为参与者配备连接到代谢测量系统的面罩,以测量整个测试过程中的通气和肺气体交换。
- 指导参与者以自我选择的速度开始骑自行车≥每分钟 60 轮 (RPM),并根据自我报告的活动水平、每日健身和疾病状态(例如,15-150 W)以次最大工作量进行 5 分钟的热身期。
- 每分钟增加 5-20 W 的工作量,直到参与者达到自愿疲惫。增量应基于参与者当前的健康水平,因此测试预计在增量阶段开始后 8-12 分钟终止。
- 指导参与者在接下来的 48 小时内避免其他剧烈运动。
3.单次呼吸扩散能力设备的校准
注意:有必要校准流量传感器和气体分析仪,以确保测量有效且可靠。具体程序因制造商和设备而异。校准程序,包括生物控制,应在每个研究日完成,如果每周执行的研究日少于一个,则应进行额外的每周校准。实验设置如 图1所示。
- 打开计算机上的软件程序,将启动50分钟的自动预热期,以确保气动管的温度足够。
- 确保装有测试气体的容器已打开(见 图 1D)。
- 首先将采样管线从气动管连接到称为 CAL 的 MS-PFT 分析仪单元插件(见 图 1B),从而执行气体校准。
- 通过在主页上选择 校准 (参见 图 2A)并选择 气体校准来启动气体校准。按 Start 或 F1 开始校准(参见 图 2B)。
- 当气体校准完成并被接受时,将采样管连接到气动管上。
- 使用有效的 3 L 注射器进行体积校准。通过选择主页上的 校准 (参见 图 2A)并选择 体积校准来启动体积校准。按 F1 开始校准,并按照软件提供的说明进行操作(参见 图 2C)。
- 确保吸气袋连接到MS-PFT分析仪装置(见 图1C)。
- 通过在坐姿下静息进行生物控制测量来完成校准程序。这应该由健康的非吸烟者进行,以确保方法的可靠性。如果给定受试者的 DL,CO 或 DL,NO 的每周变化分别超过 1.6 和 6.5 mmol/min/kPa(5 和 20 mL/min/mmHg),则该变化可能是由于机器错误造成的,应进一步研究12, 22。
4. 参与者的准备
- 根据先前的 CPET 结果计算所选强度(最大工作量的百分比 (Wmax))所需的工作量,以测量 DL、CO/NO 。
- 在参与者执行 CPET 后至少 48 小时,要求参与者返回实验室在运动期间获得 DL、CO/NO 测量值。
- 测量患者的身高(以厘米为单位到最接近的毫米)、体重(以公斤为单位到最接近的 100 克)和毛细血管血的 Hb(以 mmol/L 为单位到最接近的 0.1 mmol/L)。
- 在程序的主页上,选择 "患者>新患者 "(见 图2A)并填写所需数据:参与者的身份、姓氏、名字、出生日期、性别、身高和体重。继续选择 "确定 "或 "F1 "(参见 图 2D)。
5. 直立休息时的DL,CO/NO 测量
注意:DL、CO/NO 测量是根据 ERS工作组 12 的当前临床建议进行的。
- 在主页上,选择 测量>无膜扩散 (见 图2E)。
- 启动软件的自动复位,将所有测试气体的气体分析仪归零,并开始在连接的吸气袋中混合测试气体。按 F1 启动自动重置(参见 图 2F)。
- 自动复位需要 140-210 秒。遵守软件提供的说明,以识别何时开始测量。当软件指示 连接患者时,立即开始测量非常重要。
- 将参与者放在配有鼻夹的直立椅子上。指导参与者如何执行如下所述的动作。
- 要求参与者使用鼻夹并通过连接到气肿的吹嘴开始正常的潮汐呼吸。为确保测量系统封闭,请确保参与者的嘴唇在吹嘴周围保持闭合。
- 在三次正常呼吸后,指示参与者进行快速最大呼气以达到残余容积 (RV)。
- 当达到 RV 时,立即指示参与者进行快速最大吸气至总肺活量 (TLC),目标是吸气时间为 < 4 秒。在最大吸气期间,阀门打开,允许参与者在吸气前吸入吸气袋中与已知浓度的 NO (800 ppm NO/N 2) 混合的气体混合物。
- 要求参与者在 TLC 进行 5 (4-8) 秒的屏气。在吸气期间,以 4-8 秒屏气时间的 FVC(或基于体积描记法的肺活量)的 ≥90% 23 为目标的吸气体积 (VI)23(表 1)。
- 屏气后,指示参与者在不中断的情况下进行强烈稳定的最大呼气。
- 在最大呼气期后,要求参与者放开吹嘴和鼻夹。然后,软件将在没有任何命令的情况下计算 DL,NO 和 DL,CO 。
- 在整个操作过程中使用口头鼓励,以确保参与者达到 RV 和 TLC。根据 表 1 评估机动的可接受性。
- 在至少 4 分钟的洗脱期后再次执行该操作,直到两个操作满足可接受性标准(表 1)或直到在同一会话中总共执行了 12 个操作(见下文)。
- DL,NO 和 DL,CO 根据 表 2 中概述的标准进行报告。我们还建议按报告的屏气时间、吸气容积和肺泡容积。此外,应报告可接受和可重复的动作的数量,并应谨慎解释基于不符合可接受性或可重复性标准的动作的结果。
6. 运动期间的DL,CO/NO 测量
注意:图 3 提供了运动期间 DL、CO/NO 测量的时间表。
- 将自行车测力计放置在一定距离处,使参与者能够通过吹嘴呼吸,而无需改变自行车位置。增加设备的高度,以便可以在自行车上以正确的工作位置进行测量(见 图 2)。
- 将参与者放在自行车测力计上,并将心率监测器放在胸部。指导参与者按照步骤 5.3 中概述的每个动作执行。
- 指导参与者以次最大工作量开始循环 5 分钟,作为测量前的热身。
- 将工作负载增加到目标强度,同时按 F1 启动设备的自动重置(请参阅步骤 5.2)。自动复位需要 140-210 秒,足以确保参与者已达到稳定状态。
- 自动复位完成后,将吹嘴转向参与者并执行如下所述的动作,同时参与者继续以目标强度骑行。
- 按照步骤 5.4 到 5.5 中的步骤操作。评估每个工作负载的可接受性和可重复性标准(表1),并报告休息期间的测量值(参见步骤5.6和 表2)。
- 完成操作后,取下吹嘴并将工作量降低到15-40 W.执行主动恢复阶段2分钟,然后重复步骤6.4和6.5。2 分钟的主动恢复和自动复位期间的 140-210 秒提供了 4-5 分钟的足够洗脱期。
结果
该协议于 2021 年实施,在撰写本文时,在运动期间共进行了 124 次测量(即健康志愿者 51 次,不同严重程度的 COPD 患者 73 次)。 表 3中提供了操作,以及有关满足可接受性和可重复性标准的数据,以及故障率。
计算
例如,这里根据健康组中以 20% Wmax 进行第一次操作的数据提供单个 DL、CO/NO 操作的计算,作为下面描述?...
讨论
该协议提供了一种使用双测试气体单次呼吸技术在运动期间测量 DL、CO/NO 的标准化方法。由于获得的 DL、CO/NO 指标因肺毛细血管复张和扩张而增加,因此该方法提供了具有生理意义的肺泡-毛细血管储备测量。
协议中的关键步骤
该方法需要呼气至残余容积,然后吸气至总肺活量,此时进行 5 秒屏气并终止至 RV。这是一个关键的步骤,因为在运动...
披露声明
文章中介绍的设备和软件不是免费的。任何作者都与提供软件许可的任何公司无关。所有作者均声明没有相互竞争的经济利益。
致谢
该研究得到了斯文德·安徒生基金会的财政支持。体育活动研究中心由 TrygFonden 资助 ID 101390、ID 20045 和 ID 125132 提供支持。JPH 由 HelseFonden 和哥本哈根大学医院 Rigshospitalet 资助,而 HLH 由 Beckett 基金会资助。
材料
| Name | Company | Catalog Number | Comments |
| HemoCue Hb 201+ | HemoCue, Brønshøj, Denmark | Unkown | For measurements of hemoglobin |
| Jaeger MasterScreen PFT pro (Lung Function Equipment) | CareFusion, Höchberg, Germany | Unkown | For measurements of DLCO/NO |
| Mouthpiece | SpiroBac, Henrotech, Aartselaar, Belgium | Unkown | Used together with the Lung Fuction Equipment. (dead space 56 ml, resistance to flow at 12 L s−1 0.9 cmH2O) |
| Nose-clip | IntraMedic, Gentofte, Denmark | JAE-892895 | |
| Phenumotach | IntraMedic, Gentofte, Denmark | JAE-705048 | Used together with the Lung Fuction Equipment |
| SentrySuite Software Solution | Vyaire's Medical GmbH, Leibnizstr. 7, D-97204 Hoechberg Germany | Unkown | |
| Test gasses | IntraMedic, Gentofte, Denmark | Unkown | Concentrations: 0.28% CO, 20.9% O2, 69.52% N2 and 9.3% He |
参考文献
- Johnson Jr, R. L., Heigenhauser, G. J. F., Hsia, C. C., Jones, N. L., Wagner, P. D. Determinants of gas exchange and acid-base balance during exercise. Compr Physiol. , 515-584 (2011).
- Rampulla, C., Marconi, C., Beulcke, G., Amaducci, S. Correlations between lung-transfer factor, ventilation, and cardiac output during exercise. Respiration. 33 (6), 405-415 (1976).
- Tedjasaputra, V., Bouwsema, M. M., Stickland, M. K. Effect of aerobic fitness on capillary blood volume and diffusing membrane capacity responses to exercise. J Physiol. 594 (15), 4359-4370 (2016).
- Tamhane, R. M., Johnson, R. L., Hsia, C. C. W. Pulmonary membrane diffusing capacity and capillary blood volume measured during exercise from nitric oxide uptake. Chest. 120 (6), 1850-1856 (2001).
- Bohr, C. On the determination of gas diffusion through the lungs and its size during rest and work. Zentralblatt für Physiologie. 23 (12), 374-379 (1909).
- Krogh, A., Krogh, M. On the rate of diffusion of carbonic oxide into the lungs of man. Skandinavisches Archiv Für Physiologie. 23 (1), 236-247 (1910).
- Krogh, M. The diffusion of gases through the lungs of man. J Physiol. 49 (4), 271-300 (1915).
- Hsia, C. C., Herazo, L. F., Ramanathan, M., Johnson, R. L. Cardiopulmonary adaptations to pneumonectomy in dogs IV. Membrane diffusing capacity and capillary blood volume. J Appl Physiol. 77 (2), 998-1005 (1994).
- Behnia, M., Wheatley, C. M., Avolio, A., Johnson, B. D. Alveolar-capillary reserve during exercise in patients with chronic obstructive pulmonary disease. Int J Chron Obstruct Pulmon Dis. 12, 3115-3122 (2017).
- Roughton, F. J., Forster, R. E. Relative importance of diffusion and chemical reaction rates in determining rate of exchange of gases in the human lung, with special reference to true diffusing capacity of pulmonary membrane and volume of blood in the lung capillaries. J Appl Physiol. 11 (2), 290-302 (1957).
- Borland, C., Higenbottam, T. A simultaneous single breath measurement of pulmonary diffusing capacity with nitric oxide and carbon monoxide. Eur Respir J. 2 (1), 56-63 (1989).
- Zavorsky, G. S., et al. Standardisation and application of the single-breath determination of nitric oxide uptake in the lung. Eur Respir J. 49 (2), 1600962 (2017).
- Tedjasaputra, V., Van Diepen, S., Collins, S., Michaelchuk, W. M., Stickland, M. K. Assessment of pulmonary capillary blood volume, membrane diffusing capacity, and intrapulmonary arteriovenous anastomoses during exercise. J Vis Exp. (120), e54949 (2017).
- Zavorsky, G. S. The rise in carboxyhemoglobin from repeated pulmonary diffusing capacity tests. Respir Physiol Neurobiol. 186 (1), 103-108 (2013).
- Graham, B. L., et al. ERS/ATS standards for single-breath carbon monoxide uptake in the lung. Eur Respir J. 49 (1), 1600016 (2017).
- Hughes, J. M., Pride, N. B. Examination of the carbon monoxide diffusing capacity (DLCO) in relation to its KCO and VA components. Am J Respir Crit Care Med. 186 (2), 132-139 (2012).
- Balady, G. J., et al. Clinician's guide to cardiopulmonary exercise testing in adults: a scientific statement from the American heart association. Circulation. 122 (2), 191-225 (2010).
- Hanel, B., Clifford, P. S., Secher, N. H. Restricted postexercise pulmonary diffusion capacity does not impair maximal transport for O2. J Appl Physiol. 77 (5), 2408-2412 (1994).
- Sheel, A. W., Coutts, K. D., Potts, J. E., McKenzie, D. C. The time course of pulmonary diffusing capacity for carbon monoxide following short duration high intensity exercise. Respir Physiol. 111 (3), 271-281 (1998).
- Graham, B. L., et al. Standardization of spirometry 2019 update an official American Thoracic Society and European Respiratory Society technical statement. Am J Respir Crit Care Med. 200 (8), e70-e88 (2019).
- Glaab, T., Taube, C. Practical guide to cardiopulmonary exercise testing in adults. Respir Res. 23 (1), 9 (2022).
- Munkholm, M., et al. Reference equations for pulmonary diffusing capacity of carbon monoxide and nitric oxide in adult Caucasians. Eur Respir J. 52 (1), 1500677 (2018).
- Dressel, H., et al. Lung diffusing capacity for nitric oxide and carbon monoxide: dependence on breath-hold time. Chest. 133 (5), 1149-1154 (2008).
- Madsen, A. C., et al. Pulmonary diffusing capacity to nitric oxide and carbon monoxide during exercise and in the supine position: a test-retest reliability study. Exp Physiol. 108 (2), 307-317 (2023).
- Ross, B. A., et al. The supine position improves but does not normalize the blunted pulmonary capillary blood volume response to exercise in mild COPD. J Appl Physiol. 128 (4), 925-933 (2020).
- Zavorsky, G. S., Lands, L. C. Lung diffusion capacity for nitric oxide and carbon monoxide is impaired similarly following short-term graded exercise. Nitric Oxide. 12 (1), 31-38 (2005).
- Alves, M. M., Dressel, H., Radtke, T. Test-retest reliability of lung diffusing capacity for nitric oxide during light to moderate intensity cycling exercise. Respir Physiol Neurobiol. 304, 103940 (2022).
- Jorgenson, C. C., Coffman, K. E., Johnson, B. D. Effects of intrathoracic pressure, inhalation time, and breath hold time on lung diffusing capacity. Respir Physiol Neurobiol. 258, 69-75 (2018).
- Zavorsky, G. S., Quiron, K. B., Massarelli, P. S., Lands, L. C. The relationship between single-breath diffusion capacity of the lung for nitric oxide and carbon monoxide during various exercise intensities. Chest. 125 (3), 1019-1027 (2004).
- Coffman, K. E., Boeker, M. G., Carlson, A. R., Johnson, B. D. Age-dependent effects of thoracic and capillary blood volume distribution on pulmonary artery pressure and lung diffusing capacity. Physiol Rep. 6 (17), e13834 (2018).
- Borland, C. D. R., Hughes, J. M. B. Lung diffusing capacities (DL) for nitric oxide (NO) and carbon monoxide (CO): The evolving story. Compr Physiol. 11 (1), 1371 (2021).
- Tedjasaputra, V., Van Diepen, S., Collins, S. &. #. 2. 0. 1. ;., Michaelchuk, W. M., Stickland, M. K. Assessment of pulmonary capillary blood volume, membrane diffusing capacity, and intrapulmonary arteriovenoua anastomoses during exercise. J. Vis. Exp. (120), e54949 (2017).
- Thomas, A., et al. The single-breath diffusing capacity of CO and NO in healthy children of European descent. PLoS One. 12 (6), e0179097 (2017).
- Blakemore, W. S., Forster, R. E., Morton, J. W., Ogilvie, C. M. A standardized breath holding technique for the clinical measurement of the diffusing capacity of the lung for carbon monoxide. J Clin Invest. 36 (1), 1-17 (1957).
- Cotes, J. E., et al. Iron-deficiency anaemia: its effect on transfer factor for the lung (diffusiong capacity) and ventilation and cardiac frequency during sub-maximal exercise. Clin Sci. 42 (3), 325-335 (1972).
- Mann, T., Lamberts, R. P., Lambert, M. I. Methods of prescribing relative exercise intensity: Physiological and practical considerations. Sports Med. 43 (7), 613-625 (2013).
- Forster, R. E. Exchange of gases between alveolar air and pulmonary capillary blood: pulmonary diffusing capacity. Physiol Rev. 37 (4), 391-452 (1957).
- Tedjasaputra, V., et al. Pulmonary capillary blood volume response to exercise is diminished in mild chronic obstructive pulmonary disease. Respir Med. 145, 57-65 (2018).
- Nymand, S. B., et al. Exercise adaptations in COPD: the pulmonary perspective. Am J Physiol Lung Cell Mol Physiol. 323 (6), L659-L666 (2022).
- Rodríguez-Roisin, R., et al. Ventilation-perfusion imbalance and chronic obstructive pulmonary disease staging severity. J Appl Physiol. 106 (6), 1902-1908 (2009).
- Hsia, C. C., Johnson, R. L., Shah, D. Red cell distribution and the recruitment of pulmonary diffusing capacity. J Appl Physiol. 86 (5), 1460-1467 (1999).
- Wilhelm, E., Battino, R., Wilcock, R. J. Low-pressure solubility of gases in liquid water. Chem Rev. 77 (2), 219-262 (1977).
- Forster, R. E. . Diffusion of gases across the alveolar membrane. , (1987).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。