Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Messung der Lungendiffusionskapazität mit zwei Prüfgasen während des Trainings am Menschen mit der Single-Breath-Methode
In diesem Artikel
Zusammenfassung
Dieses Protokoll stellt eine Methode zur Bewertung der pulmonalen alveolar-kapillaren Reserve vor, die durch kombinierte Einzelatemmessung der Diffusionskapazität zu Kohlenmonoxid (DL, CO) und Stickstoffmonoxid (DL, NO) während des Trainings gemessen wird. Annahmen und Empfehlungen für die Anwendung der Technik während des Trainings bilden die Grundlage dieses Artikels.
Zusammenfassung
Die kombinierte Messung der Diffusionskapazität von Kohlenmonoxid (D L, CO) und Stickstoffmonoxid (DL, NO) ist eine nützliche Technik zur Messung der pulmonalen alveolar-kapillaren Reserve sowohl in gesunden als auch in Patientenpopulationen. Die Messung liefert eine Schätzung der Fähigkeit des Teilnehmers, Lungenkapillaren zu rekrutieren und zu dehnen. Kürzlich wurde berichtet, dass die Methode bei gesunden Probanden während des Trainings mit leichter bis mittlerer Intensität eine hohe Test-Retest-Reliabilität aufweist. Bemerkenswert ist, dass diese Technik bis zu 12 wiederholte Manöver ermöglicht und nur einen einzigen Atemzug mit einer relativ kurzen Atemhaltezeit von 5 s erfordert. Es werden repräsentative Daten vorgelegt, die die allmählichen Veränderungen von DL, NO undD L, CO von Ruhe zu Bewegung bei zunehmenden Intensitäten von bis zu 60 % der maximalen Arbeitsbelastung zeigen. Die Messung der Diffusionskapazität und die Bewertung der alveolar-kapillaren Reserve ist ein nützliches Instrument, um die Fähigkeit der Lunge zu bewerten, auf Bewegung zu reagieren, sowohl in der gesunden Bevölkerung als auch in Patientenpopulationen wie Patienten mit chronischen Lungenerkrankungen.
Einleitung
Bewegung führt zu einem erheblichen Anstieg des Energiebedarfs im Vergleich zum Ruhezustand. Herz und Lunge reagieren mit einer Erhöhung des Herzzeitvolumens und der Beatmung, was zu einer Erweiterung des Alveolarkapillarbetts führt, hauptsächlich der Rekrutierung und Dehnung von Lungenkapillaren1. Dies gewährleistet einen ausreichenden pulmonalen Gasaustausch, der durch eine Erhöhung der pulmonalen Diffusionskapazität (DL) gemessen werden kann2,3,4. Die ersten Versuche, DL während des Trainings zu messen, liegen mehr als ein Jahrhundert zurück 5,6,7. Die Fähigkeit, DL aus dem Ruhezustand heraus zu erhöhen, wird oft als alveolar-kapillare Reserve bezeichnet 8,9.
Experimentell können die relativen Beiträge der Alveolar-Kapillarmembran-Diffusionskapazität (DM) und des pulmonalen kapillaren Blutvolumens (VC) zur alveolar-kapillaren Reserve mit verschiedenen Methoden bewertet werden, einschließlich der klassischen Mehrfachfraktionen des eingeatmeten Sauerstoffs (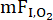 ) Methode10. Eine alternative Technik, die in diesem Zusammenhang nützlich sein kann, ist die Dual-Testgas-Methode, bei der DL zu Kohlenmonoxid (CO) und Stickstoffmonoxid (NO) (DL, CO/NO) gleichzeitig gemessen werden11. Diese Technik wurde in den 1980er Jahren entwickelt und macht sich die Tatsache zunutze, dass die Reaktionsgeschwindigkeit von NO mit Hämoglobin (Hb) wesentlich größer ist als die von CO, so dass die pulmonale Diffusion von CO stärker von VC als von NO abhängt. Daher befindet sich der Hauptort des Widerstands (~75%) gegen CO-Diffusion innerhalb der roten Blutkörperchen. während der Hauptwiderstand (~60%) gegen NO-Diffusion an der Alveolarkapillarmembran und im Lungenplasmaliegt 12. Die gleichzeitige Messung von DL,CO undD L,NO ermöglicht somit die Bewertung der relativen Beiträge von DM und VC zu DL12, wobei die während der Belastung beobachtete Änderung vonD L,NO somit weitgehend die Ausdehnung der Alveolar-Kapillarmembran widerspiegelt. Ein zusätzlicher Vorteil dieser Methode bei der Erfassung von Messungen während des Trainings besteht darin, dass sie eine relativ kurze Atemhaltezeit (~5 s) und weniger Manöver im Vergleich zur klassischen
) Methode10. Eine alternative Technik, die in diesem Zusammenhang nützlich sein kann, ist die Dual-Testgas-Methode, bei der DL zu Kohlenmonoxid (CO) und Stickstoffmonoxid (NO) (DL, CO/NO) gleichzeitig gemessen werden11. Diese Technik wurde in den 1980er Jahren entwickelt und macht sich die Tatsache zunutze, dass die Reaktionsgeschwindigkeit von NO mit Hämoglobin (Hb) wesentlich größer ist als die von CO, so dass die pulmonale Diffusion von CO stärker von VC als von NO abhängt. Daher befindet sich der Hauptort des Widerstands (~75%) gegen CO-Diffusion innerhalb der roten Blutkörperchen. während der Hauptwiderstand (~60%) gegen NO-Diffusion an der Alveolarkapillarmembran und im Lungenplasmaliegt 12. Die gleichzeitige Messung von DL,CO undD L,NO ermöglicht somit die Bewertung der relativen Beiträge von DM und VC zu DL12, wobei die während der Belastung beobachtete Änderung vonD L,NO somit weitgehend die Ausdehnung der Alveolar-Kapillarmembran widerspiegelt. Ein zusätzlicher Vorteil dieser Methode bei der Erfassung von Messungen während des Trainings besteht darin, dass sie eine relativ kurze Atemhaltezeit (~5 s) und weniger Manöver im Vergleich zur klassischen 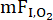 Technik beinhaltet, bei der mehrere wiederholte Manöver mit einem standardisierten Atemanhalten von 10 s bei unterschiedlichen Sauerstoffgehalten durchgeführt werden. Obwohl
Technik beinhaltet, bei der mehrere wiederholte Manöver mit einem standardisierten Atemanhalten von 10 s bei unterschiedlichen Sauerstoffgehalten durchgeführt werden. Obwohl 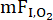 kürzlich mit einer kürzeren Atemanhaltezeit und weniger Manövern bei jeder Intensität13 angewendet wurde. Trotzdem erlaubt es nur insgesamt sechs DL,CO-Manöver pro Sitzung, während bis zu 12 wiederholte DL,CO/NO-Manöver ohne messbare Auswirkungen auf die resultierenden Schätzungen durchgeführt werdenkönnen 14.
kürzlich mit einer kürzeren Atemanhaltezeit und weniger Manövern bei jeder Intensität13 angewendet wurde. Trotzdem erlaubt es nur insgesamt sechs DL,CO-Manöver pro Sitzung, während bis zu 12 wiederholte DL,CO/NO-Manöver ohne messbare Auswirkungen auf die resultierenden Schätzungen durchgeführt werdenkönnen 14. 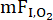 Dies sind wichtige Überlegungen bei der Durchführung von Messungen während des Trainings, da sowohl ein langes Atemanhalten als auch mehrere Manöver bei sehr hohen Intensitäten oder bei Patientenpopulationen mit Dyspnoe schwierig durchzuführen sein können.
Dies sind wichtige Überlegungen bei der Durchführung von Messungen während des Trainings, da sowohl ein langes Atemanhalten als auch mehrere Manöver bei sehr hohen Intensitäten oder bei Patientenpopulationen mit Dyspnoe schwierig durchzuführen sein können.
Die vorliegende Arbeit enthält ein detailliertes Protokoll, einschließlich theoretischer Überlegungen und praktischer Empfehlungen zur Messung vonD L, CO/NO während des Trainings und seiner Verwendung als Index der Alveolar-Kapillar-Reserve. Diese Methode ist im experimentellen Umfeld leicht anwendbar und ermöglicht die Beurteilung, wie sich die Diffusionsbegrenzung in der Lunge auf die Sauerstoffaufnahme in verschiedenen Populationen auswirken kann.
Theorie und Messprinzipien
Die DL,CO/NO-Methode beinhaltet einen einzigen Atemzug eines Gasgemisches mit der Annahme, dass sich die Gase nach der Inhalation gleichmäßig im belüfteten Alveolarraum verteilen. Das Gasgemisch besteht aus mehreren Gasen, darunter ein inertes Prüfgas. Die Verdünnung des Tracergases im belüfteten Alveolarraum, basierend auf seinem Anteil in der endexspiratorischen Luft, kann zur Berechnung des Alveolarvolumens (VA) verwendet werden15. Das Gasgemisch enthält auch die Prüfgase CO und NO, die beide im belüfteten Alveolarraum verdünnt sind und über die Alveolar-Kapillarmembran diffundieren. Anhand ihrer Alveolarfraktionen können ihre individuellen Verschwindensraten (k), auch Diffusionskonstante genannt, aus dem Alveolarraum berechnet werden. Gemäß der Konvention wird derD L für ein Prüfgas, das während eines Einatemmanövers gemessen wird, aus der folgenden Gleichung16 abgeleitet:
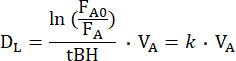
wobei FA0 der alveoläre Anteil des Testgases (CO oder NO) zu Beginn des Atemanhaltens deseinzelnen DL-Manövers ist, während FA der alveoläre Anteil des Testgases am Ende des Atemanhaltens und tBH die Atemanhaltezeit ist. DL entspricht mechanisch der Leitfähigkeit des Testgases durch die Alveolarkapillarmembran, durch Plasma und das Innere der roten Blutkörperchen zu Hämoglobin. Sie hängt also sowohl von der Leitfähigkeit von DM als auch von der sogenannten spezifischen Leitfähigkeit des Lungenkapillarblutes (θ) ab, wobei letztere sowohl von der Leitfähigkeit des Prüfgases im Blut als auch von seiner Reaktionsgeschwindigkeit mit Hämoglobin10 abhängt. Da der Kehrwert des Leitwerts der Widerstand ist, hängt der Gesamtwiderstand gegen die Übertragung eines Prüfgases von den folgenden Widerständen der Reihe10 ab:
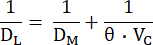
Diese Komponenten können durch gleichzeitige Messung von DL zu CO und NO unterschieden werden, da diese unterschiedliche θ-Werte haben und ihrejeweiligen DL-Werte daher unterschiedlich von VC abhängen. Die pulmonale Diffusion von CO hängt stärker von VC ab als von NO, wobei sich der Hauptwiderstandsort (~75%) gegen CO-Diffusion innerhalb der roten Blutkörperchenbefindet 12. Im Gegensatz dazu liegt der Hauptwiderstand (~60%) gegen NO-Diffusion an der Alveolarkapillarmembran und im Lungenplasma, da die Reaktionsgeschwindigkeit von NO mit Hämoglobin wesentlich größer ist als die von CO. Daher wirken sich bei gleichzeitiger Messung von DL, CO und DL,NO Änderungen sowohl von DM als auch von VC deutlich auf erstere aus. während letzteres viel weniger von VC abhängt und somit eine integrative Bewertung der Faktoren ermöglicht, die DL bestimmen.
Die Meldung von DL, CO/NO-Metriken kann mit unterschiedlichen Einheiten erfolgen. Daher verwendet die European Respiratory Society (ERS) mmol/min/kPa, während die American Thoracic Society (ATS) mL/min/mmHg verwendet. Der Umrechnungsfaktor zwischen den Einheiten beträgt 2,987 mmol/min/kPa = ml/min/mmHg.
Protokoll
Das Wissenschaftliche Ethikkomitee für die Hauptstadtregion Dänemarks hat zuvor die Messung von DL, CO/NO in Ruhe, während des Trainings und in Rückenlage sowohl bei gesunden Freiwilligen als auch bei Patienten mit chronisch obstruktiver Lungenerkrankung (COPD) in unserer Einrichtung genehmigt (Protokolle H-20052659, H-21021723 und H-21060230).
HINWEIS: Bevor DL, CO/NO während des Trainings gemessen wird, müssen eine dynamische Spirometrie und ein kardiopulmonaler Belastungstest (CPET) durchgeführt werden. Die dynamische Spirometrie dient der Qualitätskontrolle der einzelnen DL,CO/NO-Manöver, während die CPET zur Bestimmung der Arbeitsbelastung verwendet wird, bei der DL,CO/NO während des Trainings gemessen werden soll. Bei Patienten mit eingeschränktem Luftstrom, insbesondere aufgrund einer obstruktiven Lungenerkrankung, kann es vorteilhaft sein, die dynamische Spirometrie durch eine Ganzkörperplethysmographie zu ergänzen, um ein valides Maß für die Vitalkapazität zu erhalten. Ein ärztlicher Gesundheitscheck zum Ausschluss bekannter Kontraindikationen vor Beginn der CPET wird empfohlen17. Wichtig ist, dass die CPET mindestens 48 Stunden vor der während des Trainings durchgeführten DL,CO/NO-Messung durchgeführt werden sollte, da eine vorherige intensive Betätigung dieD L bis zu mindestens 24 h beeinflussen kann18,19.
1. Dynamische Spirometrie
HINWEIS: Die dynamische Spirometrie sollte in Übereinstimmung mit den aktuellen klinischen Richtlinien des ERS und ATS20 durchgeführt werden.
- Gewicht (auf 100 g genau) und Höhe (auf 1 mm genau) messen.
- Bitten Sie den Teilnehmer, sich auf einen aufrechten Stuhl zu setzen.
- Eine dynamische Spirometrie während eines erzwungenen Auslaufmanövers wird durchgeführt, um das forcierte Exspirometrievolumen in 1 s (FEV1) und die forcierte Vitalkapazität (FVC) des Teilnehmers zu identifizieren, wie an anderer Stellebeschrieben 20.
2. Herz-Lungen-Belastungstest (CPET)
HINWEIS: CPET sollte in Übereinstimmung mit den aktuellen klinischen Empfehlungendurchgeführt werden 21.
- Stellen Sie das Fahrradergometer entsprechend der Körpergröße des Teilnehmers ein und legen Sie einen Herzfrequenzmesser (HF) auf die Brust.
- Stellen Sie den Teilnehmer auf das Fahrradergometer. Statten Sie den Teilnehmer mit einer Maske aus, die an ein Stoffwechselmesssystem angeschlossen ist, um die Belüftung und den Lungengasaustausch während des gesamten Tests zu messen.
- Weisen Sie den Teilnehmer an, mit einem selbst gewählten Tempo ≥60 Umdrehungen pro Minute (RPM) mit dem Radfahren zu beginnen und eine 5-minütige Aufwärmphase bei einer submaximalen Arbeitsbelastung durchzuführen, die auf dem selbst berichteten Aktivitätsniveau, der täglichen Fitness und dem Krankheitsstatus (z. B. 15-150 W) basiert.
- Erhöhen Sie die Arbeitsbelastung jede Minute um 5-20 W, bis der Teilnehmer die freiwillige Erschöpfung erreicht. Die Inkremente sollten auf dem aktuellen Fitnessniveau des Teilnehmers basieren, so dass der Test voraussichtlich 8-12 Minuten nach Beginn der inkrementellen Phase endet.
- Weisen Sie den Teilnehmer an, in den nächsten 48 Stunden andere kräftige Übungen zu vermeiden.
3. Kalibrierung von Geräten mit Einzelatem-Diffusionskapazität
HINWEIS: Es ist notwendig, Durchflusssensoren und Gasanalysatoren zu kalibrieren, um sicherzustellen, dass die Messungen sowohl gültig als auch zuverlässig sind. Das genaue Vorgehen ist hersteller- und gerätespezifisch. Das Kalibrierungsverfahren, einschließlich der biologischen Kontrolle, sollte an jedem Studientag abgeschlossen werden, und wenn weniger als ein Studientag pro Woche durchgeführt wird, sollten zusätzliche wöchentliche Kalibrierungen durchgeführt werden. Der Versuchsaufbau ist in Abbildung 1 dargestellt.
- Öffnen Sie das Softwareprogramm auf dem Computer, und es wird eine automatische Aufwärmphase von 50 Minuten eingeleitet, um eine ausreichende Temperatur des Pneumotachs sicherzustellen.
- Stellen Sie sicher, dass die Behälter mit den Prüfgasen geöffnet sind (siehe Abbildung 1D).
- Führen Sie eine Gaskalibrierung durch, indem Sie zuerst die Probenahmeleitung vom Pneumotach an das MS-PFT-Analyzer-Unit-Plug-in anschließen, das als CAL bezeichnet wird (siehe Abbildung 1B).
- Starten Sie die Gaskalibrierung, indem Sie auf der Startseite Kalibrierung auswählen (siehe Abbildung 2A) und dann Gaskalibrierung auswählen. Starten Sie die Kalibrierung durch Drücken von Start oder F1 (siehe Abbildung 2B).
- Befestigen Sie die Probenahmeleitung am Pneumotach, wenn die Gaskalibrierung erfüllt und akzeptiert ist.
- Führen Sie eine Volumenkalibrierung mit einer gültigen 3-Liter-Spritze durch. Starten Sie die Volumenkalibrierung, indem Sie auf der Startseite Kalibrierung auswählen (siehe Abbildung 2A) und dann Volumenkalibrierung auswählen. Starten Sie die Kalibrierung, indem Sie F1 drücken, und befolgen Sie die Anweisungen der Software (siehe Abbildung 2C).
- Stellen Sie sicher, dass der Inspirationsbeutel an die MS-PFT-Analyseeinheit angeschlossen ist (siehe Abbildung 1C).
- Schließen Sie den Kalibrierungsvorgang ab, indem Sie eine biologische Kontrollmessung in Ruhe in sitzender Position durchführen. Dies sollte von einem gesunden Nichtraucher durchgeführt werden, um die Zuverlässigkeit der Methode zu gewährleisten. Wenn die wöchentliche Variation des jeweiligen Probanden in DL, CO oderD L, NO mehr als 1,6 bzw. 6,5 mmol/min/kPa (5 und 20 ml/min/mmHg) variiert, kann die Variation auf einen Maschinenfehler zurückzuführen sein und sollte weiter untersucht werden12, 22.
4. Vorbereitung des Teilnehmers
- Berechnen Sie die gewünschte Arbeitsbelastung aus den vorherigen CPET-Ergebnissen für die gewählte Intensität (% der maximalen Arbeitsbelastung (Wmax)), bei der die DL, CO/NO gemessen wird.
- Bitten Sie den Teilnehmer mindestens 48 Stunden, nachdem er die CPET durchgeführt hat, ins Labor zurückzukehren, um die D,L, CO/NO-Messung während des Trainings durchzuführen.
- Messen Sie die Körpergröße (in cm auf den nächsten mm), das Gewicht (in kg auf die nächsten 100 g) und den Hb aus dem Kapillarblut (in mmol/l auf die nächsten 0,1 mmol/l) des Patienten.
- Wählen Sie auf der Startseite des Programms Patient > Neuer Patient (siehe Abbildung 2A) und geben Sie die erforderlichen Daten ein: Identifikation, Nachname, Vorname, Geburtsdatum, Geschlecht, Größe und Gewicht des Teilnehmers. Fahren Sie fort, indem Sie OK oder F1 auswählen (siehe Abbildung 2D).
5. DL, CO / NO-Messung während der aufrechten Ruhe
Hinweis: DL,CO/NO-Messungen werden in Übereinstimmung mit den aktuellen klinischen Empfehlungen der ERS Task Force12 durchgeführt.
- Wählen Sie auf der Startseite Messung > NO-Membrandiffusion (siehe Abbildung 2E).
- Starten Sie das automatische Zurücksetzen der Software, um den Gasanalysator für alle Testgase auf Null zu stellen und das Mischen der Testgase im angeschlossenen Inspirationsbeutel zu initiieren. Starten Sie das automatische Zurücksetzen durch Drücken von F1 (siehe Abbildung 2F).
- Das automatische Zurücksetzen dauert 140-210 s. Beachten Sie die Anweisungen der Software, um zu erkennen, wann die Messung eingeleitet werden muss. Es ist wichtig, die Messung sofort zu starten, wenn die Software anweist, den Patienten zu verbinden.
- Setzen Sie den Teilnehmer in einen aufrechten Stuhl, der mit einer Nasenklammer ausgestattet ist. Weisen Sie den Teilnehmer an, wie das Manöver wie unten beschrieben durchzuführen ist.
- Bitten Sie den Teilnehmer, den Nasenclip zu verwenden und die normale Gezeitenatmung durch ein Mundstück zu beginnen, das mit dem Pneumotach verbunden ist. Um ein geschlossenes System für die Messungen zu gewährleisten, stellen Sie sicher, dass die Lippen des Teilnehmers um das Mundstück geschlossen bleiben.
- Weisen Sie den Teilnehmer nach drei normalen Atmungen an, eine schnelle maximale Exspiration durchzuführen, um das Restvolumen (RV) zu erreichen.
- Wenn RV erreicht ist, weisen Sie den Teilnehmer sofort an, eine schnelle maximale Inspiration zur Gesamtlungenkapazität (TLC) durchzuführen, wobei eine Inspirationszeit von < 4 s angestrebt wird. Während der maximalen Inspiration öffnet sich ein Ventil, das es dem Teilnehmer ermöglicht, das Gasgemisch mit einer bekannten Konzentration von NO (800 ppm NO/N 2) in einem Inspirationsbeutel kurz vor der Inhalation einzuatmen.
- Bitten Sie den Teilnehmer, bei TLC 5 (4-8) Sekunden lang den Atem anzuhalten. Während der Inspiration wird ein inspiriertes Volumen (VI) ≥90% der FVC (oder plethysmographie-basierte Vitalkapazität) mit einer Atemanhaltezeit von 4-8 s angestrebt23 (Tabelle 1).
- Weisen Sie den Teilnehmer nach dem Anhalten des Atems an, eine starke, gleichmäßige maximale Ausatmung ohne Unterbrechungen durchzuführen.
- Bitten Sie den Teilnehmer nach dem maximalen Ausatmen, das Mundstück und den Nasenbügel loszulassen. Die Software berechnet dann DL, NO und DL, CO ohne Befehl.
- Verwenden Sie während des gesamten Manövers verbale Ermutigung, um sicherzustellen, dass der Teilnehmer RV und TLC erreicht. Beurteilen Sie die Akzeptanz des Manövers gemäß Tabelle 1.
- Führen Sie das Manöver nach mindestens 4 Minuten Auswaschzeit erneut durch, bis zwei Manöver die Akzeptanzkriterien erfüllen (Tabelle 1) oder bis insgesamt 12 Manöver (siehe unten) in derselben Sitzung durchgeführt wurden.
- Die DL, NO undD L, CO werden nach den in Tabelle 2 aufgeführten Kriterien gemeldet. Wir empfehlen auch, dass die Atemanhaltezeit, das inspirierte Volumen und das Alveolarvolumen wie berichtet werden. Darüber hinaus sollte die Anzahl der akzeptablen und wiederholbaren Manöver gemeldet werden, und Ergebnisse, die auf Manövern basieren, die entweder die Akzeptanz- oder Wiederholbarkeitskriterien nicht erfüllen, sollten mit Vorsicht interpretiert werden.
6. DL, CO / NO-Messung während des Trainings
HINWEIS: Eine Zeitleiste der DL, CO/NO-Messungen während des Trainings ist in Abbildung 3 dargestellt.
- Stellen Sie das Fahrradergometer in einem Abstand auf, der es dem Teilnehmer ermöglicht, durch das Mundstück zu atmen, ohne die Radposition ändern zu müssen. Erhöhen Sie die Höhe des Geräts, damit die Messungen mit einer korrekten Arbeitsposition auf dem Fahrrad durchgeführt werden können (siehe Abbildung 2).
- Legen Sie den Teilnehmer auf das Fahrradergometer und legen Sie einen HR-Monitor auf die Brust. Weisen Sie den Teilnehmer an, jedes Manöver wie in Schritt 5.3 beschrieben auszuführen.
- Weisen Sie den Teilnehmer an, 5 Minuten lang mit einer submaximalen Arbeitsbelastung zu fahren, um sich vor der Messung aufzuwärmen.
- Erhöhen Sie die Arbeitslast auf die Zielintensität und starten Sie gleichzeitig das automatische Zurücksetzen des Geräts durch Drücken von F1 (siehe Schritt 5.2). Das automatische Zurücksetzen dauert 140-210 s, was ausreicht, um sicherzustellen, dass der Teilnehmer einen stabilen Zustand erreicht hat.
- Wenn das automatische Zurücksetzen beendet ist, drehen Sie das Mundstück zum Teilnehmer und führen Sie ein Manöver wie unten beschrieben durch, während der Teilnehmer mit der Zielintensität weiterfährt.
- Führen Sie die Schritte in den Schritten 5.4 bis 5.5 aus. Bewerten Sie die Akzeptanz- und Wiederholbarkeitskriterien (Tabelle 1) bei jeder Arbeitsbelastung und melden Sie die Messungen während der Ruhezeit (siehe Schritt 5.6 und Tabelle 2).
- Entfernen Sie nach Abschluss des Manövers das Mundstück und verringern Sie die Arbeitsbelastung auf 15-40 W. Führen Sie die aktive Erholungsphase für 2 Minuten durch, danach wiederholen Sie die Schritte 6.4 und 6.5. Die 2 min aktive Erholung und die 140-210 s während des automatischen Zurücksetzens sorgen für eine ausreichende Auswaschzeit von 4-5 min.
Ergebnisse
Das Protokoll wurde im Jahr 2021 implementiert und zum Zeitpunkt der Erstellung dieses Artikels wurden insgesamt 124 Messungen während des Trainings (d. h. 51 bei gesunden Freiwilligen und 73 bei Patienten mit COPD unterschiedlicher Schweregrade) durchgeführt. Die Manöver sowie Daten zu erfüllten Akzeptanz- und Wiederholbarkeitskriterien und der Ausfallrate sind in Tabelle 3 aufgeführt.
Berechnungen
Als Beispiel werden hier Berechnunge...
Diskussion
Das Protokoll bietet einen standardisierten Ansatz für die Messung von DL, CO/NO während des Trainings mit der Dual-Testgas-Single-Breath-Technik. Da die erhaltenen DL,CO/NO-Metriken aufgrund der Rekrutierung und Dehnung der Lungenkapillaren ansteigen, liefert die Methode ein physiologisch aussagekräftiges Maß für die alveolar-kapillare Reserve.
Kritische Schritte im Protokoll
Die Methode erfordert eine Ausatmung auf das Restvolumen, gefolgt von e...
Offenlegungen
Die im Artikel vorgestellten Geräte und Software sind nicht kostenlos. Keiner der Autoren ist mit einem Unternehmen verbunden, das die Lizenz für die Software bereitstellt. Alle Autoren erklären, dass keine konkurrierenden finanziellen Interessen bestehen.
Danksagungen
Die Studie wurde von der Svend Andersen Stiftung finanziell unterstützt. Das Zentrum für Bewegungsforschung wird durch die TrygFonden-Zuschüsse ID 101390, ID 20045 und ID 125132 unterstützt. JPH wird von HelseFonden und dem Universitätskrankenhaus Kopenhagen, Rigshospitalet, finanziert, während HLH von der Beckett-Stiftung finanziert wird.
Materialien
| Name | Company | Catalog Number | Comments |
| HemoCue Hb 201+ | HemoCue, Brønshøj, Denmark | Unkown | For measurements of hemoglobin |
| Jaeger MasterScreen PFT pro (Lung Function Equipment) | CareFusion, Höchberg, Germany | Unkown | For measurements of DLCO/NO |
| Mouthpiece | SpiroBac, Henrotech, Aartselaar, Belgium | Unkown | Used together with the Lung Fuction Equipment. (dead space 56 ml, resistance to flow at 12 L s−1 0.9 cmH2O) |
| Nose-clip | IntraMedic, Gentofte, Denmark | JAE-892895 | |
| Phenumotach | IntraMedic, Gentofte, Denmark | JAE-705048 | Used together with the Lung Fuction Equipment |
| SentrySuite Software Solution | Vyaire's Medical GmbH, Leibnizstr. 7, D-97204 Hoechberg Germany | Unkown | |
| Test gasses | IntraMedic, Gentofte, Denmark | Unkown | Concentrations: 0.28% CO, 20.9% O2, 69.52% N2 and 9.3% He |
Referenzen
- Johnson Jr, R. L., Heigenhauser, G. J. F., Hsia, C. C., Jones, N. L., Wagner, P. D. Determinants of gas exchange and acid-base balance during exercise. Compr Physiol. , 515-584 (2011).
- Rampulla, C., Marconi, C., Beulcke, G., Amaducci, S. Correlations between lung-transfer factor, ventilation, and cardiac output during exercise. Respiration. 33 (6), 405-415 (1976).
- Tedjasaputra, V., Bouwsema, M. M., Stickland, M. K. Effect of aerobic fitness on capillary blood volume and diffusing membrane capacity responses to exercise. J Physiol. 594 (15), 4359-4370 (2016).
- Tamhane, R. M., Johnson, R. L., Hsia, C. C. W. Pulmonary membrane diffusing capacity and capillary blood volume measured during exercise from nitric oxide uptake. Chest. 120 (6), 1850-1856 (2001).
- Bohr, C. On the determination of gas diffusion through the lungs and its size during rest and work. Zentralblatt für Physiologie. 23 (12), 374-379 (1909).
- Krogh, A., Krogh, M. On the rate of diffusion of carbonic oxide into the lungs of man. Skandinavisches Archiv Für Physiologie. 23 (1), 236-247 (1910).
- Krogh, M. The diffusion of gases through the lungs of man. J Physiol. 49 (4), 271-300 (1915).
- Hsia, C. C., Herazo, L. F., Ramanathan, M., Johnson, R. L. Cardiopulmonary adaptations to pneumonectomy in dogs IV. Membrane diffusing capacity and capillary blood volume. J Appl Physiol. 77 (2), 998-1005 (1994).
- Behnia, M., Wheatley, C. M., Avolio, A., Johnson, B. D. Alveolar-capillary reserve during exercise in patients with chronic obstructive pulmonary disease. Int J Chron Obstruct Pulmon Dis. 12, 3115-3122 (2017).
- Roughton, F. J., Forster, R. E. Relative importance of diffusion and chemical reaction rates in determining rate of exchange of gases in the human lung, with special reference to true diffusing capacity of pulmonary membrane and volume of blood in the lung capillaries. J Appl Physiol. 11 (2), 290-302 (1957).
- Borland, C., Higenbottam, T. A simultaneous single breath measurement of pulmonary diffusing capacity with nitric oxide and carbon monoxide. Eur Respir J. 2 (1), 56-63 (1989).
- Zavorsky, G. S., et al. Standardisation and application of the single-breath determination of nitric oxide uptake in the lung. Eur Respir J. 49 (2), 1600962 (2017).
- Tedjasaputra, V., Van Diepen, S., Collins, S., Michaelchuk, W. M., Stickland, M. K. Assessment of pulmonary capillary blood volume, membrane diffusing capacity, and intrapulmonary arteriovenous anastomoses during exercise. J Vis Exp. (120), e54949 (2017).
- Zavorsky, G. S. The rise in carboxyhemoglobin from repeated pulmonary diffusing capacity tests. Respir Physiol Neurobiol. 186 (1), 103-108 (2013).
- Graham, B. L., et al. ERS/ATS standards for single-breath carbon monoxide uptake in the lung. Eur Respir J. 49 (1), 1600016 (2017).
- Hughes, J. M., Pride, N. B. Examination of the carbon monoxide diffusing capacity (DLCO) in relation to its KCO and VA components. Am J Respir Crit Care Med. 186 (2), 132-139 (2012).
- Balady, G. J., et al. Clinician's guide to cardiopulmonary exercise testing in adults: a scientific statement from the American heart association. Circulation. 122 (2), 191-225 (2010).
- Hanel, B., Clifford, P. S., Secher, N. H. Restricted postexercise pulmonary diffusion capacity does not impair maximal transport for O2. J Appl Physiol. 77 (5), 2408-2412 (1994).
- Sheel, A. W., Coutts, K. D., Potts, J. E., McKenzie, D. C. The time course of pulmonary diffusing capacity for carbon monoxide following short duration high intensity exercise. Respir Physiol. 111 (3), 271-281 (1998).
- Graham, B. L., et al. Standardization of spirometry 2019 update an official American Thoracic Society and European Respiratory Society technical statement. Am J Respir Crit Care Med. 200 (8), e70-e88 (2019).
- Glaab, T., Taube, C. Practical guide to cardiopulmonary exercise testing in adults. Respir Res. 23 (1), 9 (2022).
- Munkholm, M., et al. Reference equations for pulmonary diffusing capacity of carbon monoxide and nitric oxide in adult Caucasians. Eur Respir J. 52 (1), 1500677 (2018).
- Dressel, H., et al. Lung diffusing capacity for nitric oxide and carbon monoxide: dependence on breath-hold time. Chest. 133 (5), 1149-1154 (2008).
- Madsen, A. C., et al. Pulmonary diffusing capacity to nitric oxide and carbon monoxide during exercise and in the supine position: a test-retest reliability study. Exp Physiol. 108 (2), 307-317 (2023).
- Ross, B. A., et al. The supine position improves but does not normalize the blunted pulmonary capillary blood volume response to exercise in mild COPD. J Appl Physiol. 128 (4), 925-933 (2020).
- Zavorsky, G. S., Lands, L. C. Lung diffusion capacity for nitric oxide and carbon monoxide is impaired similarly following short-term graded exercise. Nitric Oxide. 12 (1), 31-38 (2005).
- Alves, M. M., Dressel, H., Radtke, T. Test-retest reliability of lung diffusing capacity for nitric oxide during light to moderate intensity cycling exercise. Respir Physiol Neurobiol. 304, 103940 (2022).
- Jorgenson, C. C., Coffman, K. E., Johnson, B. D. Effects of intrathoracic pressure, inhalation time, and breath hold time on lung diffusing capacity. Respir Physiol Neurobiol. 258, 69-75 (2018).
- Zavorsky, G. S., Quiron, K. B., Massarelli, P. S., Lands, L. C. The relationship between single-breath diffusion capacity of the lung for nitric oxide and carbon monoxide during various exercise intensities. Chest. 125 (3), 1019-1027 (2004).
- Coffman, K. E., Boeker, M. G., Carlson, A. R., Johnson, B. D. Age-dependent effects of thoracic and capillary blood volume distribution on pulmonary artery pressure and lung diffusing capacity. Physiol Rep. 6 (17), e13834 (2018).
- Borland, C. D. R., Hughes, J. M. B. Lung diffusing capacities (DL) for nitric oxide (NO) and carbon monoxide (CO): The evolving story. Compr Physiol. 11 (1), 1371 (2021).
- Tedjasaputra, V., Van Diepen, S., Collins, S. &. #. 2. 0. 1. ;., Michaelchuk, W. M., Stickland, M. K. Assessment of pulmonary capillary blood volume, membrane diffusing capacity, and intrapulmonary arteriovenoua anastomoses during exercise. J. Vis. Exp. (120), e54949 (2017).
- Thomas, A., et al. The single-breath diffusing capacity of CO and NO in healthy children of European descent. PLoS One. 12 (6), e0179097 (2017).
- Blakemore, W. S., Forster, R. E., Morton, J. W., Ogilvie, C. M. A standardized breath holding technique for the clinical measurement of the diffusing capacity of the lung for carbon monoxide. J Clin Invest. 36 (1), 1-17 (1957).
- Cotes, J. E., et al. Iron-deficiency anaemia: its effect on transfer factor for the lung (diffusiong capacity) and ventilation and cardiac frequency during sub-maximal exercise. Clin Sci. 42 (3), 325-335 (1972).
- Mann, T., Lamberts, R. P., Lambert, M. I. Methods of prescribing relative exercise intensity: Physiological and practical considerations. Sports Med. 43 (7), 613-625 (2013).
- Forster, R. E. Exchange of gases between alveolar air and pulmonary capillary blood: pulmonary diffusing capacity. Physiol Rev. 37 (4), 391-452 (1957).
- Tedjasaputra, V., et al. Pulmonary capillary blood volume response to exercise is diminished in mild chronic obstructive pulmonary disease. Respir Med. 145, 57-65 (2018).
- Nymand, S. B., et al. Exercise adaptations in COPD: the pulmonary perspective. Am J Physiol Lung Cell Mol Physiol. 323 (6), L659-L666 (2022).
- Rodríguez-Roisin, R., et al. Ventilation-perfusion imbalance and chronic obstructive pulmonary disease staging severity. J Appl Physiol. 106 (6), 1902-1908 (2009).
- Hsia, C. C., Johnson, R. L., Shah, D. Red cell distribution and the recruitment of pulmonary diffusing capacity. J Appl Physiol. 86 (5), 1460-1467 (1999).
- Wilhelm, E., Battino, R., Wilcock, R. J. Low-pressure solubility of gases in liquid water. Chem Rev. 77 (2), 219-262 (1977).
- Forster, R. E. . Diffusion of gases across the alveolar membrane. , (1987).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten