Method Article
使用组织切碎器培养离体患者来源的神经胶质瘤类器官
摘要
本研究介绍了一种利用组织切碎器生成患者来源的胶质母细胞瘤 3 维类器官的自动化方法。该方法提供了一种合适且有效的方法,以获得用于治疗测试的此类类器官。
摘要
胶质母细胞瘤,IDH-野生型,CNS WHO 4 级 (GBM) 是一种原发性脑肿瘤,尽管进行了积极治疗,但患者生存率低下。开发逼真的离体模型仍然具有挑战性。患者来源的三维类器官 (PDO) 模型提供了创新的平台,可以捕获 GBM 的表型和分子异质性,同时保留原始肿瘤的关键特征。然而,手动解剖生成 PDO 既费时又昂贵,并且可能导致许多不规则和大小不均匀的 PDO。本研究提出了一种使用自动组织切碎机生产 PDO 的创新方法。来自 4 名 GBM 和 1 名星形细胞瘤、IDH 突变、CNS WHO 2 级患者的肿瘤样本被手动处理以及使用组织切碎器处理。在手动方法中,在显微镜控制下使用手术刀解剖肿瘤材料,同时使用组织切碎器在三个不同的角度进行解剖。在37°C的轨道振荡器上培养后,使用明场显微镜评估形态学变化,同时在6周后通过免疫荧光评估增殖(Ki67)和细胞凋亡(CC3)。从第二周开始,与手动处理的组织相比,组织切碎器方法减少了近 70% 的制造时间,并导致 PDO 平均计数显着更高(第 2 周:801 对 601,P = 0.018;第 3 周:1105 对 771,P = 0.032;第 4 周 :1195 对 784,P < 0.01)。 质量评估显示,两种制造方法的肿瘤细胞凋亡和增殖率相似。因此,自动组织切碎器方法在时间和PDO产量方面提供了更有效的方法。这种方法有望对GBM患者进行药物或免疫治疗筛查。
引言
低级别胶质瘤 (LGG) 是一组相对罕见的脑肿瘤,与胶质母细胞瘤等高级别胶质瘤相比,通常表现为生长缓慢且侵袭性较低。它们可发生于成人和儿童,成人患病率略高。确切的患病率因地区和人群而异,但 LGG 约占所有原发性脑肿瘤的 15%-20%1。LGG 的治疗策略通常涉及手术、放疗和化疗的组合,旨在最大限度地切除肿瘤,同时保留神经功能。LGGs的治疗可能很复杂,治疗的选择可能取决于肿瘤位置和分子特征等因素2。对LGGs的遗传和分子基础的理解取得了进展,导致了更有针对性的治疗,正在进行的研究继续完善治疗方法。
另一方面,胶质母细胞瘤,IDH-野生型,CNS WHO 4 级 (GBM),是成人中发现的最普遍的原发性脑肿瘤,发病率在每 100,000 人年 3.19-4.17 例之间3.GBM 会引起头痛、癫痫发作、局灶性神经功能缺损、性格改变和颅内压升高等症状。GBM 的标准治疗包括肿瘤减瘤(如果可行),然后放疗联合替莫唑胺4。此外,替莫唑胺和洛莫司汀联合使用可提高 O6-甲基鸟嘌呤-甲基转移酶 (MGMT) 启动子甲基化患者的中位总生存率5。然而,尽管有这些最近的治疗方法,GBM 仍然是一种预后不良的不治之症,其特征是患者的中位总生存率为 16 个月至 20.9 个月(当添加肿瘤治疗场 (TTFields)时 3,6。已经在GBM中研究了几种免疫治疗方法,但在体内显示出有限的疗效。此外,临床和临床前的局限性阻碍了治疗的突破7。由于 GBM 的 8 间和 9 瘤内9 的异质性,建立合适且现实的离体模型一直具有挑战性。
传统的二维 (2D) 患者细胞系代表同质细胞群,适用于高通量药物筛选。然而,由于生长条件的差异以及多次传代后基因型和表型特征的偏差,患者来源的和永生化的细胞系无法充分模拟 GBM 10,11,12。
另一方面,3D 类器官模型最近已成为有前途的系统,可以复制器官和各种癌症类型的表型和分子异质性13、14、15、16、17、18。在GBM的背景下,大脑类器官已被基因修饰以模拟肿瘤样特征16,17或与GSC或球状体共培养以诱导肿瘤细胞浸润18,19。虽然用 Matrigel 和 EGF/bFGF 培养的患者来源的 GBM 类器官表现出 GBM 特征,例如干细胞异质性和缺氧20,但仍不确定该模型在多大程度上可以代表患者肿瘤的关键分子特性。
患者来源的 GBM 类器官 (PDO) 是一种很有前途的模型,可以保持其类似亲本肿瘤的主要特征,包括组织学特征、细胞多样性、基因表达和突变谱。此外,它们在植入成年啮齿动物大脑后会迅速渗透,为药物测试和个性化治疗提供现实模型21。然而,手动解剖肿瘤组织以生成 PDO 既耗时又昂贵。因此,迫切需要一种能够产生大量 PDO 的快速方法,从而能够全面评估不同的治疗方法,从而有望进行个体化药物测试。本研究描述了一种使用自动组织切碎机直接从新鲜解剖的肿瘤组织中制造 PDO 的新方法。此外,在PDO计数、形态学特征、肿瘤细胞凋亡和增殖方面,将该方法产生的PDO与手动解剖的PDO进行了比较。
研究方案
所有患者均在德国维尔茨堡大学医院神经外科接受治疗,并根据赫尔辛基宣言并经维尔茨堡大学机构审查委员会批准(#22/20-me)给予书面知情同意书。从手术中获得来自 4 名 GBM 患者和 1 名星形细胞瘤、IDH 突变、CNS WHO 2 级患者(低级别胶质瘤,LGG)(表 1)的肿瘤组织材料,并使用以下方案进行处理。使用组织切碎器生成 PDO 的自动化过程称为切碎器 (C),在显微控制下用两把手术刀手动切割组织的过程称为手动 (M)。从肿瘤样本中解剖出六个大小相等的切片(1-2 cm3),然后将每个切成两半并使用两种方法均匀处理。由于上述肿瘤内异质性,每种方法从每位患者生成一个 6 孔板,每个孔代表来自原始肿瘤内不同部位的 PDO。这两种程序都在层流柜下进行,所有使用的器械在使用前都经过消毒。该方法的概述如 图 1 所示。
1. 制备琼脂糖嵌段(仅适用于C方法,可选)
- 将 50 mL 磷酸盐缓冲盐水 (PBS) 填充到烧杯中,加入一片琼脂糖(参见 材料表),充分混合直至悬浮。
- 在微波炉中加热混合物 30-40 秒,同时避免沸腾。然后将混合物冷却至47°C。
- 将琼脂糖混合物倒入密封的圆柱形铸造模具中,避免形成任何气泡。立即使用冷冻(-20°C)夹子冷却铸件,或将其放在干冰上30分钟。
2.肿瘤材料的加工
- 准备一盒冰块,以保持肿瘤材料在从手术室到实验室的途中冷却。
- 将肿瘤组织(4-5cm³)转移到含有25mLHibernate A(参见 材料表)覆盖肿瘤的无菌50mL管中,并将管放入冰盒中。
- 在层流柜下,将肿瘤材料与Hibernate A一起转移到灭菌的玻璃培养皿中。
- 消除坏死组织,并在显微镜下使用手术刀和组织镊子仔细解剖血管。通过出血导致的褐色出血区域或相对于邻近活组织表现出更苍白或更白的组织来识别坏死组织。注意不要挤压或破坏组织。
- 将肿瘤材料切成六块,大小约为1-2厘米3。将碎片分配到预装有 3 mL H-GPSA 培养基(表 2)的塑料培养皿 (n = 6) 中,每个22.将培养皿放在冰上。
3. 设置纸巾切碎机
- 按照制造商手册23 中的说明放置刀片。
- 将切片厚度调整为 0.45-0.50 毫米。将刀片力设置为中等。将桌子释放旋钮固定为“启动”模式。
4. 处理肿瘤组织碎片
- 用斩波器处理肿瘤组织(C法)
- 将琼脂糖块切成2厘米长的圆柱体,并使用组丙烯醇胶将其中一个圆柱体粘在切碎器圆形塑料皿上(参见 材料表)。
- 使用手术刀在琼脂糖圆柱体中加深,然后将第一个孔(步骤2.5)的肿瘤组织安装到该凹坑内。
注意:应小心处理肿瘤材料,不要挤压或推入缝隙。间隙应足够大,以便轻松贴合肿瘤,但又要足够小,以便在切割过程中保持肿瘤材料稳定。步骤 4.1.1.和 4.1.2.是可选的。 - 将塑料圆盘放在切割台的安装圆盘上(请参阅 材料表)。
- 打开斩波器并按下重置按钮。斩波器现在开始切割(第一轮)。当工作台到达终点并将琼脂糖和肿瘤组织切割成所需的直径后,机器会自动停止。
- 将安装盘旋转 90°,然后将释放台旋钮调整到启动模式。
- 按 下复位 按钮,让机器再次切割组织,形成矩形组织(第二轮)。
- 取出装有处理过的材料的塑料盘,并使用组织刮刀小心地仅将肿瘤组织旋转 90°。
- 将塑料圆盘放在切割台上,然后将释放台旋钮调整到启动模式并按 下复位 按钮进行最后一轮切割(第三轮)。
- 关闭斩波器并取下塑料盘。清洁斩波器和刀片。
- 使用 5 mL 单通道移液器,将处理后的材料与培养基一起吸入移液器中,然后将悬浮液冲洗回培养皿中。
- 重复上一步 2-3 次以正确分离组织。
- 将培养皿放回冰上,并用每个肿瘤的其他 5 个培养皿重复步骤 (4.1.1-4.1.12.)。
- 手动处理肿瘤组织(M方法)
- 将肿瘤组织从第一个塑料培养皿(步骤2.5)与3mL H-GPSA培养基(表2)一起转移到玻璃培养皿中。使用两把手术刀在显微镜下手动将该片段解剖成0.5mm的切片。
- 使用 2 mL 移液管将解剖的组织转移回其塑料培养皿。
- 对其他五个培养皿中的肿瘤切片重复步骤(4.2.1.-4.2.3.)(步骤2.5)。
5.清洗肿瘤组织
- 将每个培养皿向上倾斜至45°,等待30秒,直到肿瘤块沉入培养皿底部。
- 使用 1 mL 移液管小心吸出 2.5 mL H-GPSA 培养基(表 2),注意不要占用任何肿瘤组织。
- 向每个样品中加入 2 mL 红细胞裂解缓冲液(参见 材料表)。处理后的肿瘤片段必须完全被裂解缓冲液覆盖。
- 将6个培养皿放在实验室轨道振荡机上慢速10分钟。
- 小心吸出 2 mL 裂解缓冲液,以免占用任何肿瘤组织。
- 每次使用2mL H-GPSA培养基(表2)代替裂解缓冲液重复上述洗涤步骤(步骤5.1-5.5)两次。
6. 培养肿瘤组织
- 从每个培养皿中吸出 H-GPSA 培养基(表 2),并用 4 mL PDO 培养基(表 2)代替。
- 将每个培养皿的组织块转移到超低附着 6 孔板的一个相应孔中(参见 材料表)。
- 将板放在培养箱内的轨道振荡器上,并在37°C,5%CO2 和150rpm下孵育2-4周。
- 每两天更换一次半培养基,从每个孔中吸出 2 mL 培养基,并用预热至 37 °C 的 2 mL 新鲜 PDO 培养基(表 2)代替。
- 在显微镜下观察组织(形态、生长、中等颜色)并切割生长的 PDO (>0.7 mm) 或粘附组织以防止组织缺氧。
- 为此,将 PDO 从超低附着孔转移到灭菌的玻璃培养皿中,并使用手术刀进行切割。或者,可以通过用 1 mL 移液管吸出粘性 PDO 来解析。注意不要挤压 PDO 并轻拿轻放。
- 通过每两天计数一次PDO来评估PDO的形成,并彻底检查所需的圆形形态(图2)。
7. 固定和嵌入 PDO
- 培养 6 周后,用 4% 福尔马林固定每个患者每个孔的两个 PDO 24 小时。
- 将固定的PDO浸入中性缓冲(磷酸钠)福尔马林中,直至包埋。
- 将每个PDO放入盒中(参见 材料表)进行进一步处理。
- 通过将暗盒浸入以下溶液中来启动脱水过程,如下注所述:
注意:50%乙醇20分钟,70%乙醇20分钟,80%乙醇20分钟,96%乙醇20分钟,100%乙醇20分钟,100%乙醇30分钟,100%乙醇+氯仿(1:1比例)30分钟,100%乙醇+氯仿(1:1比例)30分钟,无水氯仿30分钟,无水氯仿30分钟, 石蜡 30 分钟,使用 STP 120 石蜡 30 分钟。 - 将脱水的PDO包埋在58-60°C的石蜡中。
- 将嵌入的PDO切片为2.5μm厚度,并将它们安装在载玻片上进行染色。
8. 免疫荧光染色
- 培养 6 周后挂载 PDO。
- 随后,对神经胶质纤维酸性蛋白(GFAP,稀释度:1:100)和增殖标志物Ki67(稀释度:1:1000)进行双重染色(参见 材料表),如先前报道的22。
- 同样,通过对GFAP和抗caspase-3(CC3,稀释度:1:400)的PDO进行双重染色来评估细胞凋亡(参见 材料表)。
- 使用荧光显微镜以 40 倍放大倍率捕获 PDO 的图像。
- 分析 GFAP、Ki67 和 CC3 阳性细胞以及 GFAP/Ki67 和 GFAP/CC3 双阳性细胞的图像。
- 利用开源程序Fiji(ImageJ-win 32)进行图像分析。
9. 评估和数据分析
- 在标准设置和 5 倍放大倍率下在培养的第一周捕获每日显微明场图片。
- 观察形态变化,并跟踪手动和自动加工方法的成熟过程。
- 在标准明场模式设置下使用显微镜进行形态学分析。
- 评估所有 5 名患者在 PDO 培养的前 4 周内的 PDO 数量和形态。
- 从每位患者那里获得每个 PDO 计数的三个读数,以计算平均值和标准误差 (SEM)。
- 研究三名患者的 PDO 增殖和细胞凋亡。
- 使用市售的统计软件包分析数据(见 材料表)。
- 应用 Students-T 和 Mann-Whitney U 检验来确定手动和自动 PDO 生成在 PDO 计数、增殖和细胞凋亡方面的差异。
结果
经经验丰富的神经病理学家 (CMM) 进行病理确认后,纳入了 4 例 GBM 患者和 1 例 LGG 患者。大多数患者具有未甲基化的MGMT启动子,所有GBM患者均为IDH1和IDH2野生型(表1)。平均而言,C方法的制造过程持续了88.8分钟(+/- 6.3分钟),M方法的制造过程持续了322分钟(+/- 17.2分钟)。培养 4 周后,手册组的总体成功率为 87%,斩波器组的总成功率为 93% (n = 5)。此外,来自C组的PDO在1周内达到所需的圆形,并且足够成熟,可用于 体外 实验,而M组的PDO大多保持锋利的边缘和未定义(图2)。在培养第一周后,用 C 方法处理的肿瘤组织总共产生了 281 个 PDO(每个患者的平均值 = 56 +/- 43),而使用 M 方法产生了 250 个 PDO(每个患者的平均值 = 50 +/- 41)。在培养的第二周,所有 5 名患者的组织在使用 C 方法生成时都产生了更高的 PDO 数 (801;每位患者的平均值 = 130 +/- 38),与 M 方法 (601;每位患者的平均值 = 76 +/- 44; P = 0.018)。在培养的第三周,C 方法从所有患者中累积了 1105 个 PDO(每位患者的平均值 = 221 +/- 32),而 M 方法为 771 个 PDO(每位患者的平均值 = 155 +/- 34)(P = 0.032)。此外,使用 C 方法生成 4 周培养后共形成 1195 个 PDO(每位患者的平均值 = 239 +/- 50),而使用 M 方法的 PDO 为 784 个(每位患者的平均值 = 157 +/- 36)(P < 0.01)。因此,从第二周开始,C方法显示出显著更高的PDO计数(图3)。此外,还评估了PDO计数的相对波动,以探索连续几周之间的动态趋势。分析显示,在C方法从第一周到第二周的初始过渡期间,PDO计数激增(265%)令人印象深刻,这表明取得了快速进展。随后,第三周的计数增幅较低(75%),反映了暂时的调整。相比之下,M 方法显示 PDO 计数持续稳定增加(第二周为 92%,第三周分别为 67%),这有助于第四周计数的显着稳定。PDO计数的持续上升趋势强调了C方法在整个观察期间的可靠性和弹性。
纳入 2 名 GBM 患者和 1 名 LGG 患者,用于分析 PDO 内的星形胶质细胞数量 (GFAP)、PDO 细胞增殖 (Ki67) 和细胞凋亡 (CC3)。测定的星形胶质细胞计数显示两种处理方法之间没有显着差异,C方法平均为43%,M方法平均为45%(图4 和 图5, 补充图1 和 补充图2)。同样,PDOs的扩散率在C方法(3%)和M方法(1%)之间具有可比性。只有患者 5 使用 C 方法生成的 PDO 显示出 26% 的增殖率,而 M 方法的增殖率为 1% (P = 0.001; 图4C)。在所有患者中,用C方法处理的PDO中检测到总体较低的细胞凋亡率(3%),而M方法的细胞凋亡率为2%,两者没有显着差异(图5C)。此外,两种方法在发生细胞凋亡的星形胶质细胞数量方面没有显着差异(图5D)。
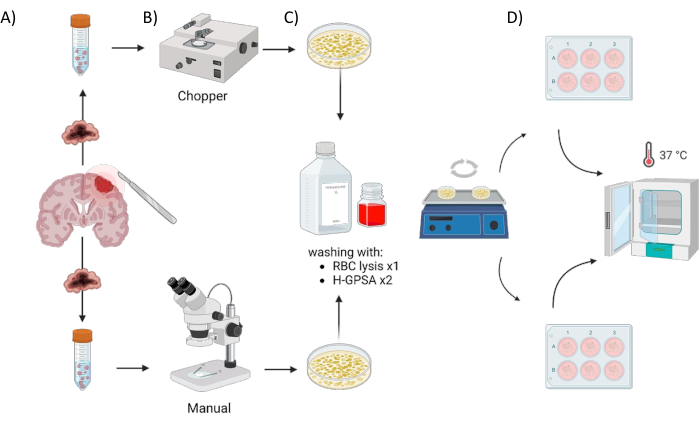
图 1:使用自动斩波器与手动方法的患者来源类器官 (PDO) 制造过程的图形概述。 该图描述了所涉及的各个步骤,包括 (A) 样本采集、(B) 肿瘤材料解剖、(C) 洗涤和 (D) 孵育。 请点击这里查看此图的较大版本.
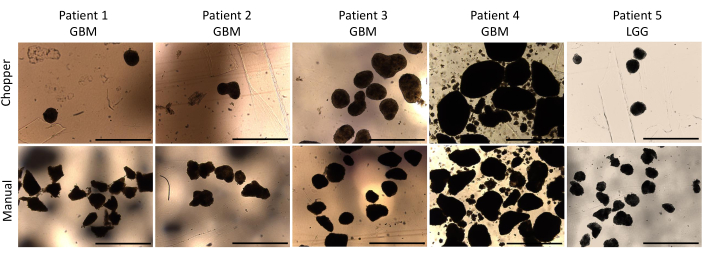
图 2:培养第一周的 PDO 形态。 使用自动斩波器和手动方法进行解剖后 PDO 形成的比较。比例尺 = 1000 μm. 请点击这里查看此图的较大版本.
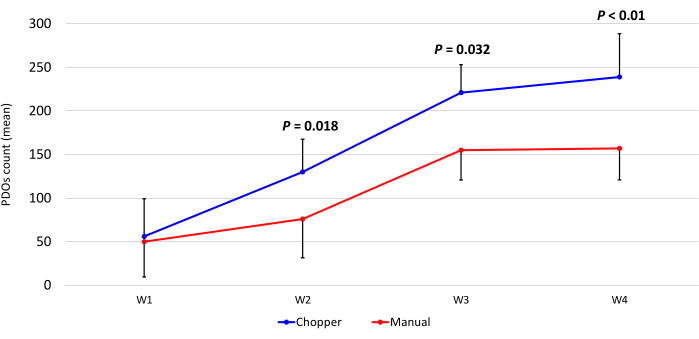
图 3:培养前 4 周的 PDO 计数。 x 轴显示以周 (W) 为单位的时间,y 轴显示 C(蓝色)和 M(红色)方法的 PDO 数量 (n = 5)。每个数据点表示平均计数,误差线表示平均值的标准误差。 请点击这里查看此图的较大版本.
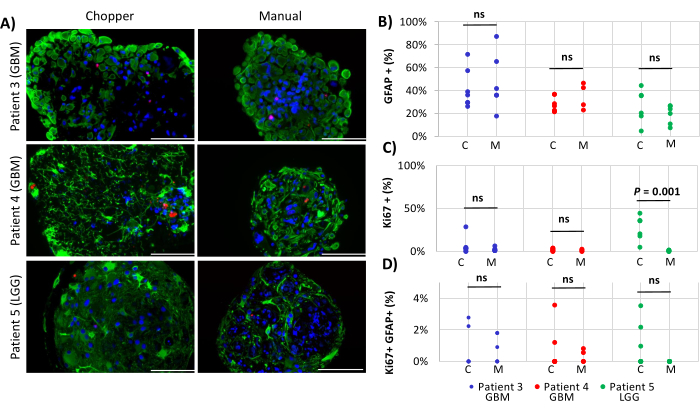
图 4:PDO 内的细胞增殖速率。 (A) 来自患者 3、4 和 5 的 PDO 中 GFAP 阳性细胞(绿色)、Ki67 阳性细胞(红色)和 DAPI(蓝色)的代表性免疫荧光图像 (n = 3)(表 1)。所有 PDO 均使用斩波器 (C) 和手动 (M) 方法进行处理。比例尺 = 100 μm。 (B) 两种方法关于 GFAP 阳性细胞、(C) Ki67 阳性细胞和 (D) Ki67/GFAP 双阳性细胞相对数量的比较。“ns”表示不显著的结果。 请点击这里查看此图的较大版本.
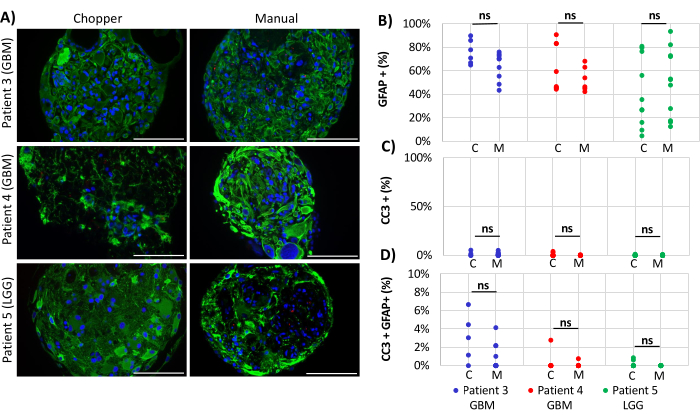
图 5:PDO 内的细胞凋亡率。 (A) 来自患者 3、4 和 5 的 PDO 中 GFAP 阳性细胞(绿色)、CC3 阳性细胞(红色)和 DAPI(蓝色)的代表性免疫荧光图像 (n = 3)(表 1)。所有 PDO 均使用斩波器 (C) 和手动 (M) 方法进行处理。比例尺 = 100 μm。 (B) 两种方法关于GFAP阳性细胞、(C)CC3阳性细胞和(D)CC3/GFAP双阳性细胞相对数量的比较。“ns”表示不显著的结果。 请点击这里查看此图的较大版本.
表1:患者特征和临床参数。 GBM = 胶质母细胞瘤,IDH 野生型,CNS WHO 4 级;LGG = 低级别胶质瘤;KPS = Karnofsky 性能得分;MGMT =O 6-甲基鸟嘌呤-DNA 甲基转移酶;IDH1 = 异柠檬酸脱氢酶 1,IDH2 = 异柠檬酸脱氢酶 2,ATRX = α-地中海贫血/智力低下,X 连锁基因;M = 形态;CC = 细胞计数;p = 增殖;A = 细胞凋亡。 请按此下载此表格。
表2:中等成分。 H-GPSA = 冬眠 A-谷氨酸铅笔素 链霉素 两性霉素 B. PDO = 患者来源的类器官 DMEM:Dulbecco 改良的 Eagle 培养基。NEAA:非必需氨基酸。笔链球菌:青霉素/链霉素 请点击此处下载此表。
表 3:用于生成细胞培养模型的技术概述。请按此下载此表格。
补充图1:PDO增殖染色的单个通道。 (A) DAPI(蓝色)、(B) GFAP 阳性细胞(绿色)、(C) Ki67 阳性细胞(红色)和 (D) 患者 3、4 和 5 的 PDO 中的叠加通道。比例尺 = 100 μm。 请点击此处下载此文件。
补充图2:PDO细胞凋亡染色的各个通道。 (A) DAPI(蓝色)、(B) GFAP 阳性细胞(绿色)、(C) CC3 阳性细胞(红色)和 (D) 患者 3、4 和 5 的 PDO 中的叠加通道。比例尺 = 100 μm。 请点击此处下载此文件。
讨论
本研究提出了一种快速有效的PDO生成方法。GBM 仍然是一种难以治疗的肿瘤,通常以复发和高疾病负担为特征 3,6。迫切需要创新的治疗方法,因为在I期试验中,在体外观察到的有希望的结果往往无法证明体内疗效。造成这种差异的原因之一可能是在单层培养物中生长的患者来源的永生化细胞系反映亲本肿瘤的复杂细胞间相互作用和遗传特性的能力有限。鉴于 GBM 8,9 的肿瘤间和肿瘤内异质性很高,个性化靶向治疗是首选,并可能在未来的应用中带来希望。与2D贴壁细胞系相比,类器官具有保留亲本组织特性的能力21,但肿瘤与正常大脑之间的复杂细胞间相互作用至关重要,并且可能被该模型忽略。然而,手动生成 PDO 是一个耗时的过程,并且在切割过程中用手术刀挤压造成的组织损伤会阻碍 PDO 的成功生长。因此,使用组织切碎机优化了一种自动化方法,以更少的时间和精力生成更多的 PDO。此外,我们证明两种方法之间的总体增殖和细胞凋亡率没有差异。
C 方法简单明了,易于实现,并且能够生成更多的 PDO(图 3)。在第二轮和第三轮切碎之间旋转组织被确定为方案中的关键步骤。在这个阶段,组织已经失去了完整性,很容易分崩离析,导致较大的碎片需要在显微镜下进行额外的切割或手动解剖。虽然自动斩波器方法允许以更高的精度预设切割尺寸,但手动方法在确定 PDO 的尺寸方面缺乏精确度,导致 PDO 的形状和尺寸不均匀,这对于比较药物筛选来说是一个缺点(图 2)。尽管如此,使用所提出的方法,无法实现每个PDO细胞数的标准化,这可能会给标准化的药物筛选方案带来缺陷。不同类器官生成技术的优缺点 18,19,20,24,25,26,27,28,29,30,31,32,33,34,35,36,
表3总结了37、38、39、40、41、42及其应用。
GBM 组织的稠度各不相同,从坚硬(浸润区)到柔软(坏死核心),这可能给自动斩波器方法带来挑战。如果组织太硬,切碎器可能会挤压并损坏它,而太软的组织可能会被压扁。所选组织表现出独特的属性,包括中等强度,偶尔呈现粉灰色,而不是表现出棕色或黄色变色。具有海绵状和易碎质地的组织在琼脂糖块内表现出优越的保存,而采样过程中省略了极其脆弱和液化的肿瘤组织。然而,与手动方法相比,斩波器方法能够成功生成更多数量的 PDO,即使组织一致性不理想。关键的解决方案是与进行肿瘤切除的外科医生保持密切互动,以处理来自肿瘤不同区域的组织。在组织稠度欠佳的情况下,在显微镜下手动返工组织是切碎后的有用补充。为了解释异质性,肿瘤组织最初被分成六个部分,随后每个部分减半以进行C或M方法。在这六个不同的部分中,预计会有很大程度的异质性。此外,即使在来自同一剖面或油井的PDO中,存在不同的亚群也是合理的。
作为概念验证,报告了 2 名 GBM 患者和 1 名 LGG 患者的增殖和细胞凋亡数据,显示两种方法之间没有显着差异。PDO的产生不仅限于高度恶性脑肿瘤,也可以应用于LGG。这项研究强调,LGG很少在2D培养物中表现出生长,因此为他们的研究开发一个准确的模型非常有价值。该协议旨在证明这种方法在快速有效地从 GBM 和 LGG 生成 PDO 方面的多功能性。
总体而言,PDO在未来可用于恶性脑肿瘤靶向治疗的以患者为导向的治疗前测试。提供一种快速有效的个体化药物筛选方法至关重要,因为肿瘤进展迅速,迫切需要挽救性治疗方案。下一步,可以使用各种免疫治疗方法评估PDO模型,以更好地模拟真实的治疗反应。未来,PDO可用于得出关于在临床环境中进一步探索和评估疗法的必要性的复杂结论。
披露声明
作者没有什么可透露的。
致谢
这项研究由维尔茨堡跨学科临床研究中心(IZKF,B-450)资助,巴伐利亚癌症研究中心(BZKF)和维尔茨堡大学开放获取出版基金支持的出版物。我们要感谢维尔茨堡大学医院神经外科实验神经外科的 Dagmar Hemmerich 和 Siglinde Kühnel 提供技术支持。图 1 是使用 www.biorender.com 创建的。
材料
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol (1000x) | Gibco | 21985023 | |
| 30% formaldehyde methanol-free | Carl Roth | 4235.1 | Used in 4% concentration |
| 70% ethanol solution | For sterilisation | ||
| Agarose tablets 0.5 g | Carl Roth | HP67.7 | |
| Amphotericin B 250 µg/mL | Gibco | 15290018 | |
| Anatomical forceps | Hartstein | N/A | |
| Anatomical spatula | Hartstein | N/A | |
| B-27 Supplement without vitamin A (50x) | Gibco | 12587010 | |
| Biopsy cassette with cover | Resolab | 37001-b | |
| Blades for McIlwain Tissue Chopper | Campden instruments | Model TC752-1 | |
| CC3 antibody (Asp 175) | Cells signaling technology | 9661 | |
| Disposable scalpel | Feather | 0200130015 | |
| Distilled water | Gibco | 15230089 | To dilute the formaldehyd |
| Dulbecco's Modified Eagle Serum Nutrient Mixture (DMEM) F-12 (1:1) (1x) | Gibco | 11330032 | Includes L-Glutamine and 15 mM HEPES |
| Dulbecco's Phosphate Buffered Saline (PBS) | Sigma Life Sciences | D8537-500ML | Modified, without calcium, chloride and magnesium chloride, liquid, sterile-filtered, suitable for cell culture |
| eBioscience 1x RBC Lysis Buffer | Invitrogen | 433357 | |
| Falcon tube 50 ml Cellstar | Greiner Bio-One | 227261 | |
| GFAP antibody | Santa Cruz Biotechnology | sc33673 | |
| Glass beaker | N/A | N/A | |
| Glass petri dish | N/A | N/A | |
| GlutaMAX (100x) | Gibco | 35050061 | |
| Heracell 240i CO2 Incubator | Thermo scientific | 51032875 | |
| Herasafe 2025 Biological Safety Cabinet | Thermo scientific | 5016643 | |
| Hibernate-A | Gibco | A1247501 | |
| Histoacryl glue | B. Braun surgical | 1050052 | |
| Human Insulin, Solution | Santa Cruz Biotechnology | sc-360248 | |
| Ice box | N/A | N/A | |
| Ki67 antibody | Abcam | ab16667 | |
| McIlwain Tissue Chopper | Cavey Laboratory Engineering | 51350V | |
| Microscope Leica DMI 3000B, DMI 4000B, DMI 6000B | Leica | DMI6000B | For brightfield and immunofluorescence pictures |
| Microscope stereozoom S9D | Leica | W841832 | For manual cutting and to organoids monitoring |
| Microwave | Bosch | N/A | To heat the agarose solution |
| Mounting plastic discs | Cavey Laboratory Engineering | 51354 | |
| N-2 Supplement (100x) | Gibco | 17502048 | |
| NEM Non-Essential Amino Acids (NEAA) (100x) | Gibco | 11140050 | |
| Neurobasal (1x) | Gibco | 21103049 | |
| Orbital shaking machine Rotamax120 | Heidolph | 10304491 | |
| Penicilin Streptomycin | Gibco | 15140122 | |
| Plastic petri dishes Cellstar | greiner bio-one | 628160 | n = 12 |
| Single channel pipette 1000 µm | Eppendorf | 4924000010 | |
| Single channel pipette 5000 µm | Eppendorf | EP3123000276 | |
| Statistical Package for the Social Sciences (SPSS) version 23.0 | IBM | ||
| Surgipath Paraplast | Leica | 39601006 | Embedding medium |
| Ultra-low attachment Nucleon Sphera 6-well plate | Thermo Scientific | 174932 |
参考文献
- Gatto, L., et al. IDH inhibitors and beyond: the cornerstone targeted glioma treatment. Mol Diagn Ther. 25 (4), 457-473 (2021).
- Buckner, J. C., et al. Radiation plus Procarbazine, CCNU, and Vincristine in low-grade glioma. N Engl J Med. 374 (14), 1344-1355 (2016).
- Grochans, S., et al. Epidemiology of glioblastoma multiforme-literature review. Cancers (Basel). 14 (10), 2412 (2022).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma). N Engl J Med. 352 (10), 987-996 (2005).
- Herrlinger, U., et al. Lomustine-temozolomide combination therapy versus standard temozolomide therapy in patients with newly diagnosed glioblastoma with methylated MGMT promoter (CeTeG/NOA-09): a randomised, open-label, phase 3 trial. Lancet. 393 (10172), 678-688 (2019).
- Stupp, R., et al. Effect of tumor-treating fields plus maintenance temozolomide vs maintenance temozolomide alone on survival in patients with glioblastoma: a randomized clinical trial. Jama. 318 (23), 2306-2316 (2017).
- Desbaillets, N., Hottinger, A. F. Immunotherapy in glioblastoma: a clinical perspective. Cancers (Basel). 13 (15), 3721 (2021).
- Gularyan, S. K., et al. Investigation of inter- and intratumoral heterogeneity of glioblastoma using TOF-SIMS). Mol Cell Proteomics. 19 (6), 960-970 (2020).
- Brennan, C. W., et al. The somatic genomic landscape of glioblastoma. Cell. 155 (2), 462-477 (2013).
- Lathia, J. D., Mack, S. C., Mulkearns-Hubert, E. E., Valentim, C. L., Rich, J. N. Cancer stem cells in glioblastoma. Genes Dev. 29 (12), 1203-1217 (2015).
- Pollard, S. M., et al. Glioma stem cell lines expanded in adherent culture have tumor-specific phenotypes and are suitable for chemical and genetic screens. Cell Stem Cell. 4 (6), 568-580 (2009).
- Timerman, D., Yeung, C. M. Identity confusion of glioma cell lines. Gene. 536 (1), 221-222 (2014).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Kopper, O., et al. An organoid platform for ovarian cancer captures intra- and interpatient heterogeneity. Nat Med. 25 (5), 838-849 (2019).
- Lee, S. H., et al. Tumor evolution and drug response in patient-derived organoid models of bladder cancer. Cell. 173 (2), 515-528 (2018).
- Bian, S., et al. Genetically engineered cerebral organoids model brain tumor formation. Nat Methods. 15 (8), 631-639 (2018).
- Ogawa, J., Pao, G. M., Shokhirev, M. N., Verma, I. M. Glioblastoma model using human cerebral organoids. Cell Rep. 23 (4), 1220-1229 (2018).
- Linkous, A., et al. Modeling patient-derived glioblastoma with cerebral organoids. Cell Rep. 26 (12), 3203-3211 (2019).
- da Silva, B., Mathew, R. K., Polson, E. S., Williams, J., Wurdak, H. Spontaneous glioblastoma spheroid infiltration of early-stage cerebral organoids models brain tumor invasion. SLAS Discov. 23 (8), 862-868 (2018).
- Hubert, C. G., et al. A three-dimensional organoid culture system derived from human glioblastomas recapitulates the hypoxic gradients and cancer stem cell heterogeneity of tumors found in vivo. Cancer Res. 76 (8), 2465-2477 (2016).
- Jacob, F., et al. A patient-derived glioblastoma organoid model and biobank recapitulates inter- and intra-tumoral heterogeneity. Cell. 180 (1), 188-204 (2020).
- Nickl, V., et al. Glioblastoma-derived three-dimensional ex vivo models to evaluate effects and efficacy of tumor treating fields (TTFields). Cancers (Basel). 14 (21), 5177 (2022).
- Klein, E., Hau, A. C., Oudin, A., Golebiewska, A., Niclou, S. P. Glioblastoma organoids: pre-clinical applications and challenges in the context of immunotherapy. Front Oncol. 10, 604121 (2020).
- Golebiewska, A., et al. Patient-derived organoids and orthotopic xenografts of primary and recurrent gliomas represent relevant patient avatars for precision oncology. Acta Neuropathol. 140 (6), 919-949 (2020).
- Bougnaud, S., et al. Molecular crosstalk between tumour and brain parenchyma instructs histopathological features in glioblastoma. Oncotarget. 7 (22), 31955-31971 (2016).
- Chua, C. W., et al. Single luminal epithelial progenitors can generate prostate organoids in culture. Nat Cell Biol. 16 (10), 951-954 (2014).
- Collingridge, G. L. The brain slice preparation: a tribute to the pioneer Henry McIlwain. J Neurosci Methods. 59 (1), 5-9 (1995).
- Kato, H., Ogawa, T. A technique for preparing in vitro slices of cat's visual cortex for electrophysiological experiments. J Neurosci Methods. 4 (1), 33-38 (1981).
- Teyler, T. J. Brain slice preparation: hippocampus. Brain Res Bull. 5 (4), 391-403 (1980).
- Schulz, E., et al. Preparation and culture of organotypic hippocampal slices for the analysis of brain metastasis and primary brain tumor growth. Methods Mol Biol. 2294, 59-77 (2021).
- Driehuis, E., Gracanin, A., Vries, R. G. J., Clevers, H., Boj, S. F. Establishment of pancreatic organoids from normal tissue and tumors. STAR Protoc. 1 (3), 100192 (2020).
- Driehuis, E., et al. Pancreatic cancer organoids recapitulate disease and allow personalized drug screening. Proc Natl Acad Sci U S A. 116 (52), 26580-26590 (2019).
- Neal, J. T., et al. Organoid modeling of the tumor immune microenvironment. Cell. 175 (7), 1972-1988 (2018).
- Li, X., et al. Oncogenic transformation of diverse gastrointestinal tissues in primary organoid culture. Nat Med. 20 (7), 769-777 (2014).
- Ootani, A., et al. Sustained in vitro intestinal epithelial culture within a Wnt-dependent stem cell niche. Nat Med. 15 (6), 701-706 (2009).
- Zhao, Z., et al. Organoids. Nat Rev Methods Primers. 2, 94 (2022).
- Toh, Y. C., et al. A novel 3D mammalian cell perfusion-culture system in microfluidic channels. Lab Chip. 7 (3), 302-309 (2007).
- Zhang, C., Zhao, Z., Abdul Rahim, N. A., van Noort, D., Yu, H. Towards a human-on-chip: culturing multiple cell types on a chip with compartmentalized microenvironments. Lab Chip. 9 (22), 3185-3192 (2009).
- Homan, K. A., et al. Flow-enhanced vascularization and maturation of kidney organoids in vitro. Nat Methods. 16 (3), 255-262 (2019).
- Huh, D., et al. Reconstituting organ-level lung functions on a chip. Science. 328 (5986), 1662-1668 (2010).
- Kengla, C., Atala, A., Sang Jin, L. Bioprinting of organoids. Essentials of 3D Biofabrication and Translation. , 271-282 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。