Method Article
移植到小鼠眼前房的肝球体的体内成像
* 这些作者具有相同的贡献
摘要
在这里,我们描述了一个平台,该平台允许对植入小鼠眼前房的肝球体进行非侵入 性体内 成像。工作流程涵盖从原代肝细胞生成球状体到移植到小鼠眼中,以及通过共聚焦显微镜以细胞分辨率进行 体内 成像。
摘要
哺乳动物肝脏的生物医学研究受到缺乏细胞分辨率的 体内 无创纵向成像方法的阻碍。到目前为止,肝脏的 原位 光学成像可以通过活体成像实现,该成像在细胞水平上提供高分辨率成像,但不能多次进行,因此不能在同一只动物中纵向进行。非侵入性成像方法,如生物发光,允许对同一只动物进行重复成像,但不能达到细胞分辨率。为了解决这一方法学上的差距,我们开发了一个平台,用于对移植到小鼠眼前房的肝球体进行无创 体内 成像。在这项研究中描述的工作流程中,原代小鼠肝球体 在体外 产生并移植到受体小鼠的眼睛前房,在那里它们植入虹膜上。角膜充当一个自然的身体窗口,通过它,我们可以通过传统的共聚焦显微镜对移植的球体进行成像。球状体在眼睛中存活数月,在此期间,可以在健康和疾病的背景下研究细胞,并使用适当的荧光探针在重复成像过程中监测对不同刺激的反应。在该协议中,我们提供了实施该成像系统所需步骤的细分,并解释了如何最好地利用其潜力。
引言
由于缺乏高分辨率、无创 的体内 成像技术,哺乳动物在健康和疾病期间的肝功能监测受到限制。该器官的可视化因其难以接近的位置而受到阻碍,并且为了将细胞过程拼凑在一起, 体内 研究依赖于动物在不同时间点的牺牲。为了规避这种成像限制,许多工作依赖于 体外 模型,其中肝脏样微组织在受控环境中可视化和研究。
近年来,肝球体等三维培养系统的发展帮助和推进了肝脏研究。肝球体是多细胞聚集体,在一定程度上模仿肝组织的微环境和复杂的细胞间相互作用1,与传统的单层培养物相比具有明显的优势 2,3。肝球体也被用作不同肝脏疾病的模型4,5,6,并且有助于理解疾病机制。尽管如此,目前体外肝脏模型的主要局限性是缺乏生理体内环境和有限的培养利用时间(约 20 天)3。肝球体先前已被移植到体内的不同部位,例如肾囊7 下或腹膜内8,这些部位无法进行光学成像。活体肝脏成像是一种最先进的技术,可提供细胞分辨率的实时成像。目前,这种原位肝脏成像只能在外部器官上进行,该器官具有高度侵入性,通常是终末9。虽然安装腹窗可以允许重复进行肝脏成像,但它需要复杂的手术和术后护理。
为了在细胞分辨率下进行纵向监测,我们探索了将肝球体移植到小鼠的眼睛前房 (ACE) 中,其中肝样组织被移植到生理环境中,连接到身体刺激,并可用于光学成像。角膜是一种透明组织,充当一个窗口,通过该窗口,植入虹膜上的微组织可以通过共聚焦显微镜进行非侵入性和纵向成像。在这里,我们介绍了这个新开发的肝球 体活体 成像平台的工作流程10。该协议是其实施的分步指南,分为(1)原代小鼠肝细胞的提取和肝球体的 体外 形成,(2)将肝球体移植到受体小鼠的ACE中,以及(3)麻醉小鼠中移植肝球体的 体内 成像。此外,我们将展示该成像平台的一些可能性和应用。
研究方案
在动物身上进行的所有程序都得到了卡罗林斯卡医学院动物实验伦理委员会的批准。
1.原代小鼠肝细胞的提取和体外肝球体的生成
- 制备
- 对于插管、肝切除和原代肝细胞的分离,除血清移液管和离心管外,还准备以下无菌或一次性使用材料(图1A):蠕动泵、水平桶离心机、吸收垫、解剖垫、两个弯尖镊子、手术剪刀、一个 27 G 蝶针、一个 70 μm 细胞过滤器、一个细胞提升器、一个 100 mm 培养皿, 细胞计数室和 96 孔 U 形底部微孔板。
- 如 表1所示,制备用于肝脏灌注,初级肝细胞分离和肝球体生成的溶液。
注意:消化缓冲液和梯度溶液应新鲜制备。 - 设置由蠕动泵组成的灌注系统,蠕动泵将溶液从42°C水浴传导到肝脏(图1A)。水浴的较高温度确保了缓冲液在37°C的最佳温度下到达肝脏。 根据管子长度和室温 (RT) 进行自定义。
- 对于插管,将 27 G 蝶针安装到管子的末端。将最终分离步骤中使用的电镀介质保持在4°C。
- 程序
- 在50mL离心管中的42°C水浴中预热以下溶液:40mL PBS,20mL灌注缓冲液和12mL消化缓冲液。
- 要清洁和加热泵管,请循环约 20 mL 预热的 PBS。
- 将管路换成灌注缓冲液,灌注管子和蝶针,并将流速设置为 4 mL/min。确保在整个方案中更换缓冲液期间管路中没有气泡。
- 通过颈椎脱位对小鼠实施安乐死,并使用针头将肢体固定在解剖板上。
- 用70%乙醇润湿腹部皮毛,并将其解剖以进入消化器官。
- 将肠道向右移动,露出门静脉和下腔静脉(图1B)。
- 将针头置于水平位置,将腔静脉插管在其长度的大约一半处,确保其稳定,然后启动泵。
- 当肝脏开始膨胀,或在较近的肺叶中出现白点时,切开门静脉,让血液和灌注缓冲液排出。
- 肝脏应立即开始变白。鼓励使用弯曲的镊子以 5 秒的间隔夹住门静脉进行清理。
- 重复步骤 1.2.9,直到肝脏变黄并清除血液(约 15-20 mL 灌注缓冲液)。
- 停止蠕动泵,将管道更换到消解缓冲液,然后重新启动泵。当消化缓冲液到达肝脏时,将流速降低至 2.5 mL/min。
注意:消化缓冲液中的酚红可以区分其到达肝脏,并允许在处理过程中调整泵参数。 - 为了促进缓冲液到达所有肝叶并确保适当的消化,请重复步骤1.2.9几次。
- 当消化缓冲液耗尽或肝脏看起来充分消化时,停止蠕动泵的流动。
注意:可以通过用镊子轻轻捏住肝叶并检查组织上是否出现小痕迹来目视监测消化程度。肝脏也会变得脆弱。 - 为了提取肝脏,切断腹腔内的肝韧带和连接,旨在将其完全切除,并将其放入含有10mL冷板培养基的培养皿中(表1)。
- 取出胆囊后,用镊子在肺叶上捏一小捏,轻轻撕开肝囊。通过在培养皿中摇晃肝脏,观察细胞倒入培养基中。
- 用镊子保持肝脏稳定,沿着裂片轻轻拖动细胞提升器以释放细胞。
注意:正确的小叶间消化将导致培养基中的细胞悬浮,而不是组织碎片。 - 使用血清移液管,从培养皿中收集细胞悬浮液,并通过放置在50mL离心管上的70μm细胞过滤器过滤。使用新鲜的电镀介质清洗消化的肝细胞培养皿,并将它们转移到过滤器中。
- 在4°C下以50× g 离心5分钟以沉淀细胞。
- 取出上清液,留下约 1 mL 以覆盖细胞沉淀,旋转试管以重悬细胞,然后逐渐加入 10 mL 冷板培养基。
- 将 10 mL 梯度溶液加入细胞悬液中,轻轻倒置试管 10 次。
- 在4°C下以200× g 离心10分钟。
- 沉淀中含有富含肝细胞的活肝细胞,而上清液则含有死细胞和碎片。使用血清移液管弃去上清液,留下约 1 mL,并通过轻轻旋转重悬沉淀。
- 向细胞悬液中加入20mL冷镀培养基,并在4°C下以50× g 离心5分钟以洗去梯度溶液。
- 除去上清液,在沉淀上方留下约 1 mL,并将细胞重悬于 20 mL 冷板培养基中。
注意:在这里,细胞沉淀可以压实,因此如果需要,请使用 10 mL 血清移液管轻轻解离细胞。 - 使用细胞计数室和台盼蓝手动确定细胞数量和活力。
注意:肝细胞会在试管中迅速沉淀;要重新悬浮它们,请轻轻地将管子倒置几次。 - 将肝细胞以 1200 个细胞/孔接种在 200 μL/孔的平板培养基中,放入 96 孔超低粘附板中。
注:每孔培养基的最佳体积为 200 μL;但是,可以在 100 μL/孔中接种细胞。 - 将板以 200 x g 旋转 3 分钟,以将细胞聚集在孔的中心。
- 孵育(37°C,5%CO2)细胞,并让它们自然形成球状体5天(图1C)。
- 在第 5 天,小心地取出孔中的一半培养基,并用无血清维持培养基替换(表 1)。每48小时重复此步骤,直到第10天,当肝球体准备好移植时。
注:在培养的肝球体中形成胶囊状结构显示出良好的聚集和活力。
2.肝球体移植到眼前房(ACE)
- 制备
- 对于肝球体移植到ACE中,请确保安排以下资源(图2A):体视显微镜,异氟烷麻醉装置,诱导室,异氟烷,加热垫,定制的金属底板,小鼠头架和防毒面具,连接到固体万向节的镊子,汉密尔顿500μL螺纹柱塞注射器,硅胶,聚乙烯和泵管,定制的钝玻璃套管或24G导管, 乙醇 70%、无菌生理盐水、无菌 23 G 针头、眼膏(液体石蜡和凡士林,比例为 1:1)、一次性 1 mL 注射器和细胞悬浮皿 35 mm。
- 通过 70% 乙醇和生理盐水清洁 Hamilton 注射器、管道和套管。
- 用生理盐水填充汉密尔顿注射器,管子和玻璃套管,并用胶带将汉密尔顿注射器固定在水平位置的工作台上(图2A)。
- 使用定制的钝玻璃套管。
- 使用双级微量移液器拉长硼硅酸盐玻璃毛细管至内径为 >300 μm,以允许球状体抽吸。
- 使用微电极斜面刀斜面和钝化尖端,并将套管尖端暴露在火焰中几秒钟以软化边缘。
注意: 微电极坡口机由一个手动操作的旋转砂石组成;因此,特定设置不适用。
- 或者,使用24G导管的塑料部分构建套管(图2B)。
- 准备麻醉异氟烷单元并将加热垫加热至37°C。
- 用一根聚乙烯管盖住连接到固体万向节的镊子的尖端,形成一个环,这有助于稳定眼睛。
- 使用移液管和 200 μL 吸头将肝球体从 96 孔板转移到装有维持培养基的 35 mm 细胞悬浮培养皿中。
- 程序
- 使用2.5%异氟醚和280mL / min空气的剂量在诱导室中麻醉小鼠。
- 当小鼠失去知觉时,将麻醉降至 1.8% 异氟烷和 280 mL/min 空气,将麻醉管连接到头部支架,并迅速将动物转移到加热垫上,将鼻子定位在头部支架内。
- 用螺丝固定头部,轻轻地将眼睛从眼窝中弹出,用镊子固定,然后在双眼上滴一滴生理盐水以防止干燥。
- 在立体镜下,使用汉密尔顿注射器将肝球体吸出并收集到套管尖端,然后让它们水平放置在干净的表面上。
注意:抽吸培养基和肝球体有助于防止它们粘附在套管壁上。 - 用23G针小心地刺破角膜,并用组织干燥渗出的房水。如果需要,要使切口更宽,请小心地将针头向一侧滑动以切开角膜。
注意:使用一次性无菌针头进行角膜穿刺,因此在切口前不会对角膜进行消毒。 - 将生理盐水滴入眼睛以避免干燥。
- 取含有肝球体的套管并垂直握住,让球体向套管尖端吸引。
- 轻轻地将套管插入孔中,并将斜面朝向瞳孔,使用汉密尔顿注射器将肝球体缓慢排出到ACE中(图2C)。
注意: 在取出套管之前,建议等待几秒钟,让眼睛内外的液体压力重新调整并避免球体从眼睛中逸出。 - 从角膜外,用套管的尖端轻轻刺激角膜,将肝球体放置在瞳孔周围并远离切口(图2C)。
- 等待~5-10分钟,使肝球体落在虹膜上,然后再将眼睛从镊子中释放出来。
- 将凡士林眼膏涂抹在手术过的眼睛上,这有助于润滑和愈合角膜。
- 如果需要,可以按照相同的方法对第二只眼睛进行手术。
- 在唤醒小鼠之前,给予镇痛剂以避免术后不适,例如,在无菌盐水中给予0.1mg / kg丁丙诺啡,皮下给药。
注意:只给小鼠注射了一剂镇痛药,因为它们从这个小手术中恢复得很快,并且没有表现出任何疼痛或行为改变的迹象。由于该过程非常快速(不到10分钟)并且只引起轻微的不适,因此小鼠不需要术后护理,除了在唤醒动物之前进行术后镇痛。
3. ACE 中移植肝球体的 体内 成像
- 制备
- 准备以下材料和仪器用于植入ACE的肝球体的无创 活体 成像(图3A):直立共聚焦显微镜,长工作距离水浸物镜,异氟烷麻醉装置,诱导室,异氟烷,加热垫,定制的金属底板,小鼠头架和防毒面具,连接到固体万向节的镊子,人工泪液凝胶,眼膏(液体石蜡和凡士林,比例为1:1)。
- 可选材料包括可注射荧光探针、一次性注射器和用于尾部静脉注射的 27 G 针头。
- 程序
- 使用2.5%异氟醚和280mL / min空气的剂量在诱导室中麻醉小鼠。
- 当小鼠失去知觉时,将麻醉降至 1.8% 异氟烷和 280 mL/min 空气,将麻醉管连接到头部支架,并迅速将动物转移到加热垫上,将鼻子定位在头部支架内。
- 使用螺钉将头部固定在头部支架中。
- 在双眼上滴一滴人工泪液,以防止干燥。
- 此时,通过尾静脉静脉注射荧光探针,然后立即成像。
- 倾斜头部,轻轻地将眼睛从眼眶中弹出,然后用镊子将其固定并固定在物镜下方。
- 使用大量的人工泪液凝胶填充角膜和物镜之间的空间,并通过目镜聚焦在肝球体上。
注意: 如果可能,请取下其中一个目镜的目镜以获得非放大视力,并更容易在虹膜上定位球体。 - 为了在动物的呼吸运动下获得高分辨率成像,请使用 25 倍物镜和以下成像设置:格式为 512 x 512 像素,扫描速度为 600 Hz,Z 堆栈厚度为 3 μm。请参阅 表 2 中的详细成像设置。
注意:在整个成像过程中,麻醉浓度在 1.6-2.2 mL/h 异氟醚之间调节,以实现浅层、受控的呼吸节律,从而最大限度地减少动物的运动。 - 在成像过程结束时,用凡士林眼膏治疗成像的眼睛,然后去除异氟烷并唤醒动物。
结果
通过两步胶原酶灌注从小鼠肝脏中分离出富含肝细胞的原代肝细胞,使用蠕动泵在肝脏中循环温暖的缓冲液,利用器官的脉管系统将解离酶输送到所有细胞(图1A)。为此,对下腔静脉进行插管,并剪断门静脉以允许缓冲液流过(图1B)。首先,将基于 HBSS 的缓冲液冲洗肝脏以清除血液。如果插管成功并且没有血凝块,肝脏会在几秒钟内变白并变黄。其次,将含有Liberase酶混合物的消化缓冲液在肝脏中循环,以将组织解离成单细胞悬浮液。这些细胞被手动计数并接种到 96 孔超低粘附 (ULA) 板中,这使得细胞能够在几天内自组装成球状体。在第 5 天,球状体形成,与球状体接壤的薄胶囊表明成功聚集(图 1C)。我们等到第 10 天进行移植,此时球状体紧凑并已形成强大的细胞间连接。每孔接种的细胞数决定了肝球体的大小,1000、1200 和 1500 个细胞/孔产生的球体分别为 238 μm ± 10 μm、248 μm ± 17 μm 和 298 μm ± 19 μm(平均 ± SD)直径(图 1C,D)。对于移植,我们选择直径约为 250 μm 的球状体,原因如下:(1) 球状体尺寸不应太大以避免缺氧和坏死核心,但应包含足够的细胞以支持细胞间通讯并允许移植物在眼睛中重塑,(2) 这种尺寸的球体的重量使它们能够被吸引到虹膜并改善其植入, (3) 该尺寸适用于每只小鼠眼移植 5-10 个球状体。
移植手术需要一个连接到玻璃套管的手动螺纹注射器(图2A)。玻璃套管由硼硅酸盐玻璃毛细管组成,该毛细管经过内部修改,使用微量移液器拉拔器和斜面器具有细钝尖端。可以使用连接到注射器管并在移液器吸头中稳定的市售塑料导管来创建更简单的替代套管(图2B)。该手术包括通过角膜上的切口将肝球体接种到ACE中(图2C)。球体被放置在瞳孔的边缘,使它们更容易成像,并避免它们移动到眼角。白化小鼠用于移植,因为它们的非色素虹膜允许对移植的肝球体进行 体内 成像。将受体小鼠以 7-10 个球状体/眼睛移植到双眼中,并在移植后 3 天(Tx 后)以及 Tx 后 1 周和 1 个月拍摄立体图像,以记录角膜愈合和球状体植入成功(图 2D)。值得注意的是,在新鲜移植和完全移植之间,ACE 中肝球体的外观变化是由于移植物沉降到虹膜上,以及单层虹膜细胞在球体上的生长。ACE中肝球体的植入成功率为70%(雄性和雌性小鼠中的n = 9只眼睛)(图2E)。Tx 后的头几天对于生存和植入最为关键,可能是由于受体动物在角膜愈合之前摩擦眼睛并使球状体移位。Tx后肝球体的大小没有显着差异,形状的变化归因于移植物重塑和植入(图2F)。在 Tx 后 1 个月,虹膜上存在的所有移植球体都被血管化和神经支配,如免疫荧光染色所示(图 2G)。
使用直立共聚焦显微镜和长距离浸渍物镜对麻醉的受体小鼠进行非侵入 性体内 成像(图3A,表2)。ACE中的荧光成像可以通过不同的方法实现, 如图3B所示。将荧光探针注射到受体小鼠的循环中,可以观察球状体内的不同细胞类型和结构。我们使用凝集素标记血管(图3C),CMFDA观察胆小管网络(图3D)和pHrodo-LDL,这证实了活性LDL摄取到球状细胞(图3E)。也可以使用由报告小鼠模型生成的肝球体。Albumin-Cre:tdTomato 球状体允许标记和追踪肝细胞(图3F),表达荧光泛素细胞周期指示剂 (FUCCI) 生物传感器的球状体用于在单细胞分辨率下可视化细胞周期动力学(图 3G)。最后,肝球体可以在 移植前在体外 进行基因修饰,并且在腺相关病毒(AAV)-GFP转导的情况下, 在体内 观察表达超过6个月(图3H)。
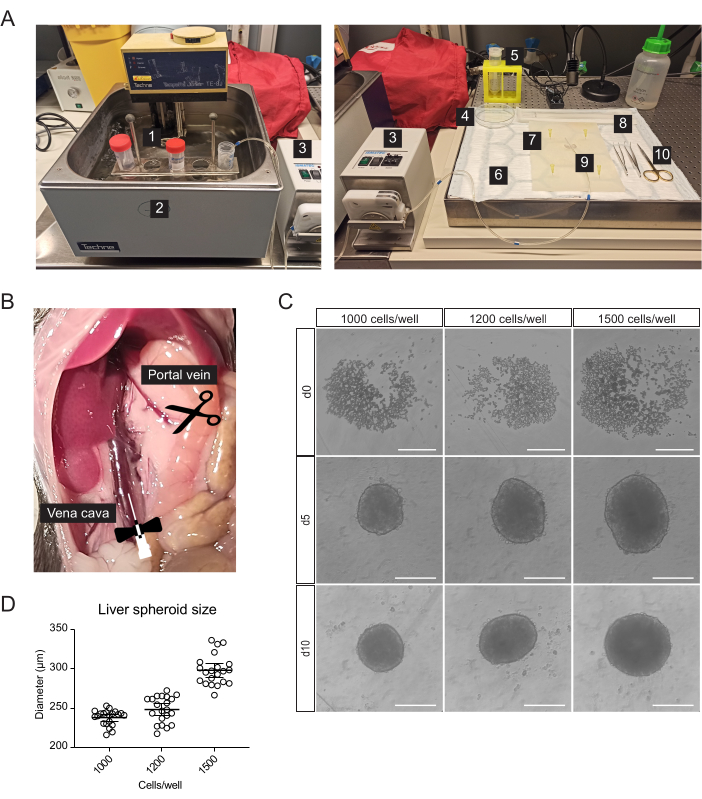
图1:原代小鼠肝细胞的分离和肝球体的生成。 (一)原代小鼠肝细胞分离所用的材料及设备: 1.分离缓冲液;2.水浴;3、蠕动泵;4.培养皿;5.细胞过滤器;6.吸水垫;7.解剖垫;8.细胞升降器;9.蝴蝶针27克;10. 解剖工具。(B) 手术过程中的腹腔:腔静脉管和灌注,门静脉被剪断以允许缓冲液流过。(C) 接种后 0 (d0)、5 (d5) 和 10 (d10) 天体 外 肝球体形成的明场图像,比例尺 = 200 μm。 (D) 不同细胞接种浓度下的肝球体大小,n = 21 个球状体。 请点击这里查看此图的较大版本.
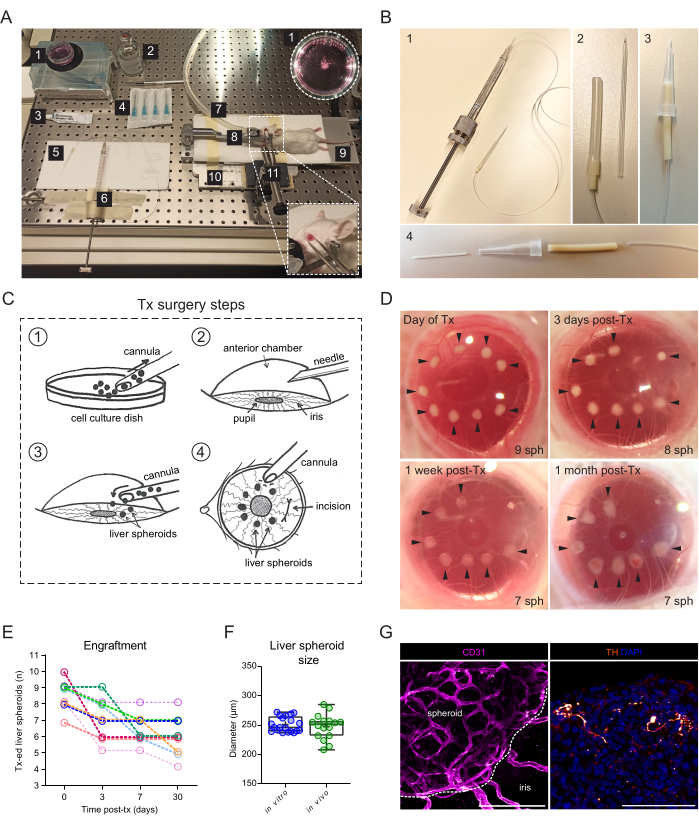
图 2:肝球体移植和植入小鼠的 ACE。 (A) 用于将肝球体移植(Tx)到ACE的材料和设备: 1.培养皿中的肝球体;2.无菌生理盐水;3.眼膏;4.针23克;5.套管;6.汉密尔顿注射器;7.麻醉气管;8.头架和防毒面具;9.加热垫;10.定制金属底板;11.镊子和实心万向节。(B) 套管和 Hamilton 注射器设置:1. 玻璃套管通过 Portex 管和 27G 针头连接到 Hamilton 注射器;2. 玻璃套管通过硅胶管和 PharMed 管的附加段连接到 Portex 管;3.替代组装的塑料套管;4. 形成塑料套管的部件:24G BD Insyte 塑料导管通过 PharMed 管连接,并包裹在截止的 10 μl 移液器吸头中,以实现稳定性和抓地力。(C) Tx手术步骤示意图:1.将球状体收集到套管中;2.角膜用针刺破;3.将套管插入切口中,球状体释放到ACE中;4. 从眼睛的外部看,球体靠近瞳孔并远离切口。(D) 手术当天以及 Tx 后 3、7 和 30 天小鼠眼中肝球体 (sph) 的立体图像。箭头表示可行的椭球体。(E) Xx 后肝球状体(1200 个细胞/孔的大小)植入率,6 只受体小鼠的 n= 9 只眼睛。(F) 培养物中肝球体的大小,移植前(体外, n = 20 个球体来自单一制剂)和 ACE 中 Tx 后 1 个月(体内, n = 3 只受体小鼠中的 16 个球体),通过平均垂直和水平直径计算。(G) Tx 后 2 个月移植肝球体的免疫荧光染色,显示血管形成(CD31,粉红色,虚线描绘球状体肿块)和交感神经支配(酪氨酸羟化酶 (TH),橙色),比例尺 = 100 μm。图F的数据经Lazzeri-Barcelo等人许可改编10。 请点击这里查看此图的较大版本.
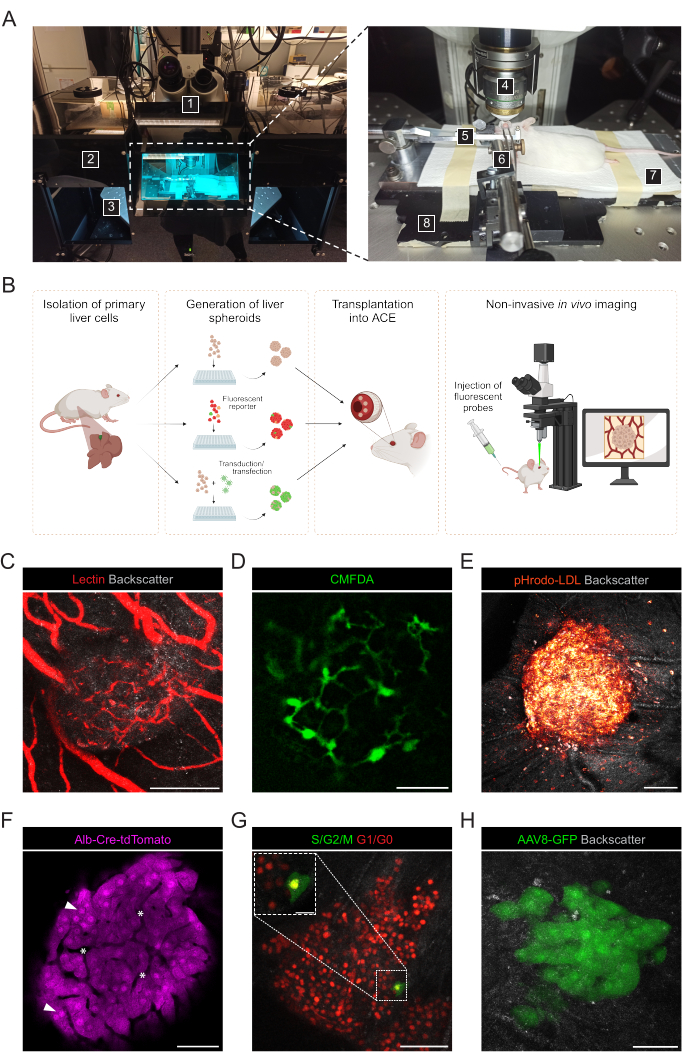
图 3:移植肝球体的无创眼 内活体 成像。 (一) 用于活体 ACE成像的材料和设备: 1.正置激光扫描共聚焦显微镜;2.暗匣子;3.电动XYZ载物台;4.浸渍物镜;5、头架和防毒面具;6.镊子和实心万向节;7.加热垫;8.定制金属底板。(B) 描绘了用于植入眼睛的肝球状体中荧光读数的 活体 成像的不同方法的图表。(C-H)通过共聚焦显微镜 进行体内 成像期间 ACE-肝球体的代表性图像。反向散射信号用于观察球体的体积和结构;(C) 静脉注射荧光凝集素标记的血管,比例尺 = 100 μm;(D) 通过注射荧光CMFDA标记的胆小管网络,比例尺= 50μm;(E) 通过注射荧光 pHrodo-LDL 探针摄取 LDL,比例尺 = 100 μm;(F) 表达Td-番茄的肝细胞,箭头表示细胞核,星号表示球状体内脉管系统,比例尺 = 50 μm;(G) 监测表达 FUCCI 的肝球体中的细胞周期动力学,比例尺 = 50 μm(主图像)和 20 μm(膨胀)。(H) 在 Tx 之前用 AAV8-GFP 在体外 转导的肝球体,并在 Tx 后 6 个月在眼睛中成像,比例尺 = 50 μm。图G中的图像经Lazzeri-Barcelo等人许可改编10。 请点击这里查看此图的较大版本.
表1:用于分离原代小鼠肝细胞的溶液。 小鼠肝细胞分离所需的溶液和缓冲液的组成。酶解缓冲液和梯度溶液组分应在分离当天新鲜混合。 请按此下载此表格。
表 2.共聚焦徕卡 SP5 显微镜设置,用于肝球体的眼内活体成像。 该表经 Lazzeri 等人许可改编自 10。 请按此下载此表格。
讨论
该协议描述了一种用于植入ACE的肝球体的眼内活体成像的新平台。ACE 以前曾被用作其他器官衍生微组织(如胰岛11,12)的移植部位,因为它具有独特的植入微环境,富含血管、神经和氧气,并且可以通过角膜进行成像。虽然活体肝脏成像可以原位观察细胞和过程,但无法进行纵向监测。通过腹窗进行肝脏成像需要复杂的手术,并且器官在体内的运动使得随着时间的推移进行单细胞追踪变得困难。因此,这种新颖的成像方法能够以单细胞分辨率对肝细胞进行无创的纵向监测。
该协议分为三个部分。首先是通过两步胶原酶灌注分离原代肝细胞,该法改编自 Charni-Natan 等人 13,不同之处在于我们对死小鼠而不是麻醉的活体动物进行肝脏灌注。这种变化带来了某些优点,例如较少的伦理考虑和避免生物体中的麻醉残留物。在这项工作中,我们从分离的肝细胞富集部分产生肝球状体,但这并不排除使用其他专门方案分离其他非实质细胞群以制作不同成分的共培养球状体的潜力14,15。
该协议的第二部分涉及将肝球体移植到受体小鼠的ACE中。这是一种在麻醉小鼠中进行的快速(不到 10 分钟)和简单的手术,不需要任何术后治疗。角膜穿刺自我封闭并在 3-5 天内愈合。偶尔,在愈合过程中,切口周围会观察到一些雾化,但这种情况会在几天内消失。我们还没有经历过手术动物眼前粘连的病例。我们在干净但露天的实验室中进行移植手术,手术眼部没有感染问题。球状体在眼睛中的接种和植入不会损害视力或改变受体动物的行为。在该方案中,我们使用异氟烷麻醉进行移植手术和 体内 成像,这在小鼠中具有良好的耐受性。由于其剂量依赖性效应,它可以在整个过程中轻松调整,并带来减少睡眠和觉醒时间的优势。但是,可以使用替代注射麻醉剂。移植后,我们通常允许 1 个月的时间让球状体完全植入、血管化和神经支配,然后再进行治疗干预和 体内 成像。我们还表明,使用人肝球体和免疫功能低下的受体小鼠10 进行移植和植入是可能的。
该方法的第三部分是 ACE 中移植肝球体的 体内 成像。该协议描述了 体内 成像设置,其使用研究成像设施中常见的显微镜设备。此外,专用材料,如鼠标头架和塑料套管,现在已经商业化了。通过这种成像设置,我们能够捕获 z 截面并获得球体结构的三维重建,具体取决于激光穿透和荧光检测的深度。监测移植肝球体中的细胞功能依赖于荧光蛋白的可视化,荧光蛋白报告细胞类型、细胞功能和动力学。因此,该成像平台可以单独或组合使用不同的模式进行利用:(1)荧光探针可以静脉内给药,例如,用于标记和追踪细胞的抗体以及功能性染料;(2)肝球体可以从表达肝脏特异性荧光蛋白的报告小鼠模型中分离的细胞中产生,例如,报告细胞周期动力学的FUCCI肝球体;(3)肝球体 外 的形成可以与转染或转导相结合,使球体配备荧光蛋白和生物传感器。例如,腺相关病毒。在我们的实验设置中,通过使用单个光子进行激发,可能达到的成像深度约为 60-100 μm。然而,这取决于激光功率和多光子成像的可用性、荧光探针发射特性和检测器的灵敏度,以及球状体移植的眼睛角度。成像采集后,可以使用 Image J 和 Imaris 等流行程序进行下游图像分析。例如,在FUCCI报告基因的情况下,可以对绿色的细胞周期活性细胞进行计数,并将其与总红细胞的数量进行比较,以评估移植球状体内的细胞周期活性。此外,ACE成像平台允许将物质施加到眼睛上(以滴眼液的形式)或直接注射到ACE中,以治疗移植物并监测其反应。尸检后,移植的球状体可以很容易地通过手动显微切割取回,并可以通过 离体 技术提供有价值的信息,如免疫荧光染色、转录组学分析等10。
这种技术有一定的局限性。首先,根据我们的经验,受体小鼠必须是白化病小鼠,即具有非色素沉着的虹膜。植入后,肝球体被单层虹膜细胞覆盖,这不会影响球体的活力或功能,但虹膜细胞中的色素会阻止成像。第二个考虑因素是麻醉小鼠眼内成像期间的稳定性。在 体内 成像过程中,必须密切监测动物的麻醉浓度和呼吸,以尽量减少运动。尽管如此,使用此处指示的成像设置,我们能够在单细胞水平上实现高分辨率成像。
总而言之,该协议描述了植入小鼠眼睛的肝样组织的非侵入 性体内 成像平台的实现。我们使用简单的程序、通用的设备和负担得起的材料,使其成为许多研究人员可以实现的方法。该模型将 体外 3D肝球体的优点与ACE提供的 体内 环境和光学可及性相结合,为在基础研究和临床前环境中研究肝脏生理学和病理学创造了一个有价值的平台。
披露声明
P-OB 是 Biocrine AB 的联合创始人兼首席执行官,IBL 和 BL 是 Biocrine AB 的顾问。
致谢
这项工作得到了瑞典糖尿病协会,卡罗林斯卡学院基金,瑞典研究委员会,诺和诺德基金会,家庭Erling-Persson基金会,卡罗林斯卡医学院糖尿病战略研究计划,家庭Knut和Alice Wallenberg基金会,Jonas&Christina af Jochnick基金会,瑞典糖尿病学协会和ERC-2018-AdG 834860-EYELETS的支持。图形图纸由 FL-B 使用 BioRender.com 创建。
材料
| Name | Company | Catalog Number | Comments |
| 27 G butterfly needle | Venofix | 4056388 | |
| AAV8-CAG-GFP | Charles River | CV17169-AV9 | Incubated with isolated hepatocytes at 1 µL/mL during liver spheroid formation |
| Absolute and 70% ethanol | N/A | N/A | |
| Absorbent pad | Attends | 203903 | |
| Albumin-Cre;RCL-tdTomato (B6.Cg-Speer6-ps1Tg(Alb-cre)21Mgn/J ; B6.Cg-Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J) | Jackson | #003574 and #007914 | Mice obtained from in-house breeding |
| B6 albino mice (B6(Cg)-Tyrc-2J/J) | Jackson | #000058 | Mice obtained from in-house breeding |
| B6;129P2-Gt(ROSA)26Sor[tm1(CAG-Venus/GMNN,-Cherry/CDT1)Jkn]/JknH | INFRAFRONTIER/EMMA | EM:08395 | Mice obtained from in-house breeding |
| BD Insyte IV Catheter 24 G x 0.75 in | BD Medical | 381212 | |
| Borosillicate standard glass cappilaries | World Precision Instruments | 1B150-4 | |
| Cell lifter | Corning | 3008 | |
| Cell strainer, 70 µm | Falcon | 352350 | |
| Custom-made metal plate | Hardware store | N/A | |
| Dexamethasone | Sigma-Aldrich | D4902 | |
| Dual-Stage Glass Micropipette Puller | Narshige | Model PC-100 | |
| EDTA | Sigma-Aldrich | E9884 | |
| Electric heating pad | Hardware store | N/A | |
| FBS | Gibco | N/A | |
| GlutaMAX | Gibco | 35050061 | |
| Green CMFDA | Abcam | ab145459 | Reconstituted in DMSO, administered at 100 µg/mouse in PBS 10% FBS |
| Hamilton syringe | Hamilton | 81242 | Model 1750 Luer Tip Threaded Plunger Syringe, 500 µL |
| HBSS; no calcium, no magnesium and no phenol red | Gibco | 14175095 | |
| HCX IRAPO L 25x/0.95 W objective | Leica | N/A | |
| HEPES | Gibco | 15630080 | |
| Induction chamber 0.8 L | Univentor | 8329001 | |
| Insulin-Transferrin-Selenium (ITS-G) | Gibco | 41400045 | |
| Isoflurane | Baxter | N/A | |
| Lectin DyLight-649 | Invitrogen | L32472 | Administered at 1 mg/mL and 100 µL/mouse |
| Liberase TM Research Grade | Sigma-Aldrich | 5401127001 | |
| Microelectrode beveler | World Precision Instruments | Model BV-10 | |
| Mouse head-holder and gas mask | Narshige | Model SGM-4 | |
| Nunclon Sphera 96-Well, U-Shaped-Bottom Microplate | Thermo Fisher | 174929 | |
| Oculentum simplex | APL | N/A | |
| PBS 10x | Gibco | 14080055 | |
| PBS 1x; no calcium, no magnesium | Gibco | 14190144 | |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Percoll | Sigma-Aldrich | P1644 | |
| Peristaltic pump | Ismatec | Model ISM795 | |
| PharMed BPT Pump Tubing | VWR | VERN070540-07 | Inner diameter 0.76 mm, outer diameter 2.46 mm |
| pHrodo Red-LDL | Invitrogen | L34356 | Administered at 1 mg/mL and 100 µL/mouse |
| Portex Fine Bore Polyethylene Tubing | Smiths Medical | 800/100/140 | Inner diameter 0.4 mm, outer diameter 0.8 mm |
| Silicone dissection mat | Hardware store | N/A | |
| Sodium chloride 0.9% | Braun | N/A | |
| Solid Universal Joint | Narshige | Model UST-2 | |
| Stereomicroscope | Leica | Model M80 | |
| Suspension culture dish 35 mm | Sarstedt | 833900500 | |
| Temgesic | Indivor | N/A | Administered s.c. at 0.05 mg/mL and 2 µL/g mouse |
| Translucent Silicone Tubing | VWR | 228-1450 | Inner diameter 1.5 mm, outer diameter 3 mm |
| Trypan Blue | Sigma-Aldrich | T8154 | |
| Univentor 400 Anesthesia unit | Univentor | 8323001 | |
| Upright laser scanning confocal microscope | Leica | Model TCS SP5 II | |
| Viscotears | Novartis | N/A | |
| William's E Medium; no glutamine, phenol red | Gibco | 22551089 |
参考文献
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Sci Rep. 6, 25187(2016).
- Lauschke, V. M., et al. Massive rearrangements of cellular MicroRNA signatures are key drivers of hepatocyte dedifferentiation. Hepatology. 64 (5), 1743-1756 (2016).
- Oliva-Vilarnau, N., Vorrink, S. U., Ingelman-Sundberg, M., Lauschke, V. M. A 3D cell culture model identifies Wnt/beta-catenin mediated inhibition of p53 as a critical step during human hepatocyte regeneration. Adv Sci (Weinh). 7 (15), 2000248(2020).
- Hurrell, T., et al. Human liver spheroids as a model to study aetiology and treatment of hepatic fibrosis. Cells. 9 (4), 964(2020).
- Kozyra, M., et al. Human hepatic 3D spheroids as a model for steatosis and insulin resistance. Sci Rep. 8 (1), 14297(2018).
- Lauschke, V. M., Shafagh, R. Z., Hendriks, D. F. G., Ingelman-Sundberg, M. 3D primary hepatocyte culture systems for analyses of liver diseases, drug metabolism, and toxicity: Emerging culture paradigms and applications. Biotechnol J. 14 (7), e1800347(2019).
- Shibuya, K., et al. The efficacy of the hepatocyte spheroids for hepatocyte transplantation. Cell Transplant. 30, 9636897211000014(2021).
- Hamazaki, K., Doi, Y., Koide, N. Microencapsulated multicellular spheroid of rat hepatocytes transplanted intraperitoneally after 90% hepatectomy. Hepatogastroenterology. 49 (48), 1514-1516 (2002).
- Marques, P. E., et al. Imaging liver biology in vivo using conventional confocal microscopy. Nat Protoc. 10 (2), 258-268 (2015).
- Lazzeri-Barcelo, F., et al. Intraocular liver spheroids for noninvasive high-resolution in vivo monitoring of liver cell function. Nat Commun. 15 (1), 767(2024).
- Speier, S., et al. Noninvasive in vivo imaging of pancreatic islet cell biology. Nat Med. 14 (5), 574-578 (2008).
- Leibiger, I. B., Berggren, P. O. Intraocular in vivo imaging of pancreatic islet cell physiology/pathology. Mol Metab. 6 (9), 1002-1009 (2017).
- Charni-Natan, M., Goldstein, I. Protocol for Primary Mouse Hepatocyte Isolation. STAR protocols. 1 (2), 100086(2020).
- Baze, A., et al. Three-dimensional spheroid primary human hepatocytes in monoculture and coculture with nonparenchymal cells. Tissue Eng Part C Methods. 24 (9), 534-545 (2018).
- Mohar, I., Brempelis, K. J., Murray, S. A., Ebrahimkhani, M. R., Crispe, I. N. Isolation of nonparenchymal cells from the mouse liver. Methods Mol Biol. 1325, 3-17 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。