Methods Article
Imagerie in vivo de sphéroïdes hépatiques greffés dans la chambre antérieure de l’œil de souris
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous décrivons ici une plateforme qui permet une imagerie in vivo non invasive de sphéroïdes hépatiques greffés dans la chambre antérieure de l’œil de souris. Le flux de travail s’étend de la génération de sphéroïdes à partir de cellules hépatiques primaires à la transplantation dans l’œil de la souris et à l’imagerie in vivo à résolution cellulaire par microscopie confocale.
Résumé
Les études biomédicales du foie chez les mammifères sont entravées par le manque de méthodes d’imagerie longitudinale non invasive in vivo à résolution cellulaire. Jusqu’à présent, l’imagerie optique du foie in situ était possible par l’imagerie intravitale, qui offre une imagerie à haute résolution au niveau cellulaire mais ne peut pas être réalisée plusieurs fois et, donc, longitudinalement chez le même animal. Les méthodes d’imagerie non invasives, telles que la bioluminescence, permettent des séances d’imagerie répétées sur le même animal mais n’atteignent pas la résolution cellulaire. Pour combler cette lacune méthodologique, nous avons développé une plateforme d’imagerie in vivo non invasive de sphéroïdes hépatiques greffés dans la chambre antérieure de l’œil de souris. Dans le flux de travail décrit dans cette étude, des sphéroïdes primaires du foie de souris sont générés in vitro et transplantés dans la chambre antérieure de l’œil des souris receveuses, où ils se greffent sur l’iris. La cornée agit comme une fenêtre corporelle naturelle à travers laquelle nous pouvons imager les sphéroïdes greffés par la microscopie confocale conventionnelle. Les sphéroïdes survivent pendant des mois dans l’œil, au cours desquels les cellules peuvent être étudiées dans des contextes de santé et de maladie, ainsi que d’être surveillées en réponse à différents stimuli au cours de séances d’imagerie répétées à l’aide de sondes fluorescentes appropriées. Dans ce protocole, nous détaillons les étapes nécessaires à la mise en œuvre de ce système d’imagerie et expliquons comment exploiter au mieux son potentiel.
Introduction
La surveillance de la fonction hépatique chez les mammifères pendant la santé et la maladie est limitée par le manque de techniques d’imagerie in vivo non invasives à haute résolution. La visualisation de cet organe est entravée par son emplacement inaccessible, et afin de reconstituer les processus cellulaires, les études in vivo reposent sur le sacrifice d’animaux à différents moments temporels. Pour contourner cette limitation de l’imagerie, une grande partie des travaux s’appuie sur des modèles in vitro , dans lesquels des microtissus semblables à ceux du foie sont visualisés et étudiés dans un environnement contrôlé.
Au cours des dernières années, le développement de systèmes de culture tridimensionnels, tels que les sphéroïdes hépatiques, a contribué et fait progresser la recherche sur le foie. Les sphéroïdes hépatiques sont des agrégats multicellulaires qui imitent le microenvironnement et les interactions cellule-cellule complexes du tissu hépatique dans une certaine mesure1 et offrent des avantages évidents par rapport aux cultures monocouches traditionnelles 2,3. Les sphéroïdes hépatiques sont également utilisés comme modèles pour différentes maladies du foie 4,5,6 et ont joué un rôle déterminant dans la compréhension des mécanismes de la maladie. Pourtant, les principales limites des modèles hépatiques in vitro actuels sont l’absence d’un milieu physiologique in vivo et le temps d’utilisation limité en culture (environ 20 jours)3. Des sphéroïdes hépatiques ont déjà été transplantés à différents sites in vivo, comme sous la capsule rénale7 ou l’intrapéritonéale8, qui ne sont pas accessibles pour l’imagerie optique. L’imagerie intravitale du foie est une technique de pointe offrant une imagerie en temps réel à résolution cellulaire. Actuellement, cette imagerie hépatique in situ n’est possible que sur l’organe extériorisé, très invasif et souvent terminal9. Bien que la mise en place d’une fenêtre abdominale permette des séances répétées d’imagerie hépatique, elle implique une intervention chirurgicale et un suivi complexes.
Pour effectuer un suivi longitudinal à résolution cellulaire, nous avons exploré la transplantation de sphéroïdes hépatiques dans la chambre antérieure de l’œil (ECA) de souris, où le tissu hépatique est greffé dans un milieu physiologique, connecté aux stimuli corporels et accessible pour l’imagerie optique. La cornée est un tissu transparent et agit comme une fenêtre à travers laquelle les microtissus greffés sur l’iris peuvent être imagés de manière non invasive et longitudinale par microscopie confocale. Nous présentons ici un flux de travail de cette nouvelle plateforme développée pour l’imagerie in vivo des sphéroïdes hépatiques10. Ce protocole est un guide étape par étape pour sa mise en œuvre, divisé en (1) l’extraction de cellules hépatiques primaires de souris et la formation in vitro de sphéroïdes hépatiques, (2) la transplantation de sphéroïdes hépatiques dans l’ECA de souris receveuses, et (3) l’imagerie in vivo de sphéroïdes hépatiques greffés chez des souris anesthésiées. De plus, nous présenterons certaines des possibilités et des applications de cette plate-forme d’imagerie.
Protocole
Toutes les procédures effectuées sur des animaux ont été approuvées par le comité d’éthique de l’expérimentation animale du Karolinska Institutet.
1. Extraction de cellules hépatiques primaires de souris et génération de sphéroïdes hépatiques in vitro
- Préparation
- Pour la canulation, la résection hépatique et l’isolement des cellules hépatiques primaires, préparez les matériaux stériles ou à usage unique suivants, en plus des pipettes sérologiques et des tubes à centrifuger (figure 1A) : pompe péristaltique, centrifugeuse à godet oscillant, tampon absorbant, tapis de dissection, deux pinces à pointe incurvée, ciseaux chirurgicaux, une aiguille papillon de 27 G, une passoire à cellules de 70 μm, un élévateur de cellules, une boîte de Pétri de 100 mm, chambre de comptage cellulaire et microplaques à fond en U de 96 puits.
- Préparer les solutions utilisées pour la perfusion hépatique, l’isolement des cellules hépatiques primaires et la génération de sphéroïdes hépatiques, comme indiqué dans le tableau 1.
REMARQUE : Le tampon de digestion et la solution Gradient doivent être préparés frais. - Mettre en place le système de perfusion composé d’une pompe péristaltique, qui conduit les solutions du bain d’eau à 42 °C vers le foie (figure 1A). La température plus élevée du bain-marie garantit que les tampons atteignent le foie à la température optimale de 37 °C. Personnalisez-le en fonction de la longueur du tube et de la température ambiante (RT).
- Pour la canulation, placez une aiguille papillon de 27 G à l’extrémité du tube. Maintenez le support de placage utilisé dans les étapes finales d’isolation à 4 °C.
- Procédure
- Préchauffer les solutions suivantes dans le bain-marie à 42 °C dans des tubes à centrifuger de 50 mL : 40 mL de PBS, 20 mL de tampon de perfusion et 12 mL de tampon de digestion.
- Pour nettoyer et réchauffer les tubes de la pompe, faites circuler environ 20 ml de PBS préchauffé.
- Remplacez la tubulure par le tampon de perfusion, amorcez le tube et l’aiguille papillon, puis réglez le débit à 4 mL/min. Assurez-vous qu’il n’y a pas de bulles dans la tubulure lors des changements de tampon tout au long du protocole.
- Euthanasiez la souris par luxation cervicale et utilisez des aiguilles pour fixer les membres à la planche de dissection.
- Mouillez la fourrure de l’abdomen avec de l’éthanol à 70% et disséquez-la pour accéder aux organes digestifs.
- Déplacez les intestins vers la droite pour exposer la veine porte et la veine cave inférieure (Figure 1B).
- Canulez la veine cave à peu près à mi-chemin de sa longueur avec l’aiguille en position horizontale, assurez-vous qu’elle est stable et démarrez la pompe.
- Lorsque le foie commence à gonfler ou que des points blancs apparaissent dans les lobes les plus proches, coupez la veine porte pour permettre au sang et au tampon de perfusion de s’écouler.
- Le foie doit commencer à blanchir immédiatement. Encouragez le dégagement à l’aide d’une pince incurvée pour clamper la veine porte à des intervalles de 5 secondes.
- Répétez l’étape 1.2.9 jusqu’à ce que le foie soit jaune et débarrassé du sang (environ 15 à 20 ml de tampon de perfusion).
- Arrêtez la pompe péristaltique pour remplacer le tube par le tampon de digestion et redémarrez la pompe. Lorsque le tampon de digestion atteint le foie, réduisez le débit à 2,5 mL/min.
REMARQUE : Le rouge de phénol présent dans le tampon de digestion permet de discriminer son arrivée dans le foie et permet d’ajuster les paramètres de la pompe pendant le traitement. - Pour encourager le tampon à atteindre tous les lobes hépatiques et assurer une bonne digestion, répétez l’étape 1.2.9 plusieurs fois.
- Arrêtez le débit de la pompe péristaltique lorsque le tampon de digestion est épuisé ou que le foie semble suffisamment digéré.
REMARQUE : Le degré de digestion peut être surveillé visuellement en pinçant doucement les lobes du foie avec des pinces et en vérifiant si de petites marques apparaissent sur le tissu. Le foie deviendra également fragile. - Pour extraire le foie, coupez les ligaments hépatiques et les connexions à l’intérieur de la cavité abdominale, en visant à l’enlever complètement, et placez-le dans la boîte de Pétri contenant 10 ml de produit de placage à froid (tableau 1).
- Après avoir retiré la vésicule biliaire, faites de petits pincements sur les lobes à l’aide d’une pince, en déchirant légèrement la capsule hépatique. En secouant le foie dans la boîte, observez les cellules se déverser dans le milieu.
- En maintenant le foie stable avec une pince, faites glisser doucement le lève-cellules le long des lobes pour libérer les cellules.
REMARQUE : Une digestion interlobulaire correcte conduira à une suspension cellulaire dans le milieu, et non à des fragments de tissu. - À l’aide d’une pipette sérologique, prélever la suspension cellulaire de la boîte de Pétri et filtrer à travers la passoire cellulaire de 70 μm placée sur un tube à centrifuger de 50 mL. Utilisez un support de placage frais pour laver la boîte des cellules hépatiques digérées et transférez-les dans le filtre.
- Centrifuger à 50 x g pendant 5 min à 4 °C pour granuler les cellules.
- Retirez le surnageant en laissant environ 1 ml pour couvrir la pastille de cellule, faites tourner le tube pour remettre les cellules en suspension, puis ajoutez progressivement 10 ml de produit de placage à froid.
- Ajoutez les 10 mL de solution de gradient à la suspension cellulaire et retournez doucement le tube 10 fois.
- Centrifugeuse à 200 x g pendant 10 min à 4 °C.
- La pastille contient des cellules hépatiques viables enrichies en hépatocytes, tandis que le surnageant contient des cellules mortes et des débris. Jeter le surnageant à l’aide d’une pipette sérologique, en laissant environ 1 mL, et remettre la pastille en suspension en l’agitant doucement.
- Ajouter 20 mL de produit de placage à froid dans la suspension cellulaire et centrifuger à 50 x g pendant 5 min à 4 °C pour éliminer la solution à gradient.
- Retirer le surnageant, en laissant environ 1 mL au-dessus de la pastille, et remettre les cellules en suspension dans 20 mL de milieu de placage à froid.
REMARQUE : Ici, la pastille cellulaire peut être compactée, donc si nécessaire, utilisez une pipette sérologique de 10 ml pour dissocier doucement les cellules. - Déterminez manuellement le nombre de cellules et la viabilité à l’aide d’une chambre de comptage cellulaire et de Trypan Blue.
REMARQUE : Les cellules hépatocytaires précipiteront rapidement dans le tube ; Pour les remettre en suspension, retournez doucement le tube plusieurs fois. - Ensemencer les cellules hépatiques dans 200 μL/puits de milieu de placage à 1200 cellules/puits dans des plaques à très faible adhérence de 96 puits.
REMARQUE : Le volume optimal de média par puits est de 200 μL ; cependant, il est possible d’ensemencer des cellules dans 100 μL/puits. - Faites tourner les plaques à 200 x g pendant 3 min pour rassembler les cellules au centre des puits.
- Incuber (37 °C, 5 % CO2) les cellules et les laisser former des sphéroïdes pendant 5 jours (Figure 1C) naturellement.
- Le 5e jour, retirez soigneusement la moitié du milieu dans le puits et remplacez-le par un milieu d’entretien sans sérum (tableau 1). Répétez cette étape toutes les 48 h jusqu’au 10e jour, lorsque les sphéroïdes hépatiques sont prêts à être transplantés.
REMARQUE : La formation d’une structure en forme de capsule chez les sphéroïdes hépatiques en culture montre une bonne agrégation et une bonne viabilité.
2. Transplantation de sphéroïdes hépatiques dans la chambre antérieure de l’œil (ECA)
- Préparation
- Pour la transplantation de sphéroïdes hépatiques dans l’ACE, assurez-vous de prévoir les ressources suivantes (Figure 2A) : stéréomicroscope, unité d’anesthésie à l’isoflurane, chambre d’induction, isoflurane, coussin chauffant, plaque de base métallique sur mesure, support de tête de souris et masque à gaz, pinces fixées à l’articulation universelle solide, seringue à piston filetée Hamilton 500 μL, tube en silicone, en polyéthylène et à pompe, canule en verre émoussé sur mesure ou cathéter 24 G, éthanol 70 %, solution saline stérile, aiguilles stériles de 23 G, pommade pour les yeux (paraffine liquide et vaseline au rapport de 1:1), seringue jetable de 1 ml et boîte de suspension cellulaire de 35 mm.
- Nettoyez la seringue, le tube et la canule Hamilton en passant de l’éthanol à 70 % et du sérum physiologique.
- Remplissez la seringue, le tube et la canule en verre de solution saline et fixez la seringue Hamilton à la paillasse en position horizontale avec du ruban adhésif (Figure 2A).
- Utilisez une canule en verre émoussé sur mesure.
- Allongez un capillaire en verre borosilicaté à l’aide d’un extracteur de micropipette à deux étages jusqu’à un diamètre intérieur de >300 μm pour permettre l’aspiration des sphéroïdes.
- Biseautez et émoussez la pointe à l’aide d’un chanfreineur à microélectrodes et exposez la pointe de la canule à une flamme pendant quelques secondes pour adoucir les bords.
REMARQUE : Le chanfreineur à microélectrodes se compose d’une pierre abrasive rotative qui est actionnée manuellement ; Par conséquent, des paramètres spécifiques ne sont pas applicables.
- Vous pouvez également construire une canule à l’aide de la partie en plastique d’un cathéter de 24 G (figure 2B).
- Préparez l’appareil d’anesthésie isoflurane et réchauffez le coussin chauffant à 37 °C.
- Couvrez les extrémités de la pince fixée au joint universel solide avec un morceau de tube en polyéthylène pour former une boucle, ce qui aide à stabiliser l’œil.
- Transférez les sphéroïdes hépatiques de la plaque à 96 puits dans une boîte de suspension cellulaire de 35 mm avec un produit d’entretien à l’aide d’une pipette et d’une pointe de 200 μL.
- Procédure
- Anesthésier la souris dans la chambre d’induction à l’aide d’une dose de 2,5 % d’isoflurane et de 280 mL/min d’air.
- Lorsque la souris est inconsciente, abaissez l’anesthésie à 1,8 % d’isoflurane et à 280 ml/min d’air, connectez le tube d’anesthésie au support de tête et transférez rapidement l’animal sur le coussin chauffant, en positionnant le nez à l’intérieur du support de tête.
- Immobilisez la tête avec les vis, sortez doucement l’œil de l’orbite et fixez-le avec la pince et placez une goutte de solution saline sur les deux yeux pour éviter le dessèchement.
- Sous le stéréoscope, utilisez la seringue Hamilton pour aspirer et recueillir les sphéroïdes du foie dans l’extrémité de la canule et laissez-les reposer horizontalement sur une surface propre.
REMARQUE : L’aspiration du milieu avec les sphéroïdes du foie aide à les empêcher de coller aux parois de la canule. - Percez soigneusement la cornée à l’aide d’une aiguille de 23 G et séchez l’humeur aqueuse suintante avec un mouchoir. Si nécessaire, pour élargir l’incision, glissez soigneusement l’aiguille sur le côté pour trancher la cornée.
REMARQUE : Une aiguille stérile à usage unique est utilisée pour effectuer la ponction cornéenne, de sorte que la cornée n’est pas désinfectée avant l’incision. - Ajoutez des gouttes salines dans l’œil pour éviter le dessèchement.
- Prenez la canule contenant les sphéroïdes du foie et tenez-la verticalement pour permettre aux sphéroïdes de graviter vers l’extrémité de la canule.
- Insérez doucement la canule dans le trou et, avec le biseau dirigé vers la pupille, utilisez la seringue Hamilton pour expulser lentement les sphéroïdes hépatiques dans l’ECA (Figure 2C).
REMARQUE : Avant de retirer la canule, il est recommandé d’attendre quelques secondes que les pressions du liquide à l’intérieur et à l’extérieur de l’œil se réajustent et évitent que les sphéroïdes ne s’échappent de l’œil. - De l’extérieur de la cornée, positionnez les sphéroïdes hépatiques autour de la pupille et loin de l’incision en poussant doucement la cornée avec l’extrémité de la canule (figure 2C).
- Attendez ~5-10 min pour que les sphéroïdes du foie se déposent sur l’iris avant de libérer l’œil de la pince.
- Appliquez une pommade oculaire à la vaseline sur l’œil opéré, ce qui aide à lubrifier et à guérir la cornée.
- Si vous le souhaitez, opérez le deuxième œil en suivant la même méthode.
- Avant de réveiller la souris, administrez un analgésique pour éviter les inconforts postopératoires, par exemple, 0,1 mg/kg de buprénorphine dans une solution saline stérile, administrée par voie sous-cutanée.
REMARQUE : Une seule dose d’analgésiques a été administrée aux souris car elles se sont rapidement rétablies de cette petite procédure et n’ont montré aucun signe de douleur ou de comportement altéré. Comme cette procédure est très rapide (moins de 10 min) et ne cause qu’une gêne mineure, les souris ne nécessitent aucun soin postopératoire, autre que l’analgésie postopératoire administrée avant de réveiller l’animal.
3. Imagerie in vivo de sphéroïdes hépatiques greffés dans l’ACE
- Préparation
- Préparer les matériaux et instruments suivants pour l’imagerie in vivo non invasive des sphéroïdes hépatiques greffés dans l’ACE (figure 3A) : microscope confocal vertical, objectif d’immersion dans l’eau à longue distance de travail, unité d’anesthésie à l’isoflurane, chambre d’induction, isoflurane, coussin chauffant, plaque de base métallique sur mesure, support de tête de souris et masque à gaz, pince fixée à l’articulation universelle solide, gel lacrymal artificiel, pommade oculaire (paraffine liquide et vaseline au rapport 1:1).
- Les matériaux optionnels comprennent des sondes fluorescentes injectables, des seringues jetables et des aiguilles 27 G pour l’injection intraveineuse par queue.
- Procédure
- Anesthésier la souris dans la chambre d’induction à l’aide d’une dose de 2,5 % d’isoflurane et de 280 mL/min d’air.
- Lorsque la souris est inconsciente, abaissez l’anesthésie à 1,8 % d’isoflurane et à 280 ml/min d’air, connectez le tube d’anesthésie au support de tête et transférez rapidement l’animal sur le coussin chauffant, en positionnant le nez à l’intérieur du support de tête.
- Immobilisez la tête dans le porte-tête à l’aide des vis.
- Placez une goutte de gel lacrymal artificiel sur les deux yeux pour éviter le dessèchement.
- À ce stade, injectez par voie intraveineuse des sondes fluorescentes à travers la veine de la queue et imagez immédiatement après.
- Inclinez la tête, sortez doucement l’œil de l’orbite et fixez-le à l’aide d’une pince et en position sous l’objectif.
- Appliquez une quantité généreuse de gel lacrymal artificiel pour remplir l’espace entre la cornée et l’objectif et concentrez-vous sur les sphéroïdes du foie à travers l’oculaire.
REMARQUE : Si possible, retirez l’oculaire de l’un des oculaires pour obtenir une vision non agrandie et localiser plus facilement les sphéroïdes sur l’iris. - Afin d’obtenir une imagerie haute résolution malgré les mouvements respiratoires de l’animal, utilisez des objectifs 25x et les paramètres d’imagerie suivants : format 512 x 512 pixels, vitesse de balayage de 600 Hz et une épaisseur de pile Z de 3 μm. Voir les paramètres d’imagerie détaillés dans le Tableau 2.
REMARQUE : Tout au long de l’imagerie, la concentration de l’anesthésie est ajustée de 1,6 à 2,2 mL/h pour obtenir un rythme respiratoire peu profond et contrôlé et ainsi minimiser les mouvements de l’animal. - À la fin de la séance d’imagerie, traitez les yeux imagés avec une pommade oculaire à la vaseline avant de retirer l’isoflurane et de réveiller l’animal.
Résultats
Les cellules hépatiques primaires, enrichies en hépatocytes, ont été isolées du foie de souris par perfusion de collagénase en deux étapes, à l’aide d’une pompe péristaltique pour faire circuler des tampons chauds dans le foie, en profitant de la vascularisation de l’organe pour délivrer des enzymes de dissociation à toutes les cellules (Figure 1A). Pour cela, la veine cave inférieure a été canulée et la veine porte a été coupée pour permettre l’écoulement des tampons (Figure 1B). Tout d’abord, un tampon à base de HBSS a été évacué dans le foie pour éliminer le sang. Si la canulation réussit et qu’il n’y a pas de caillots sanguins, le foie blanchit et jaunit en quelques secondes. Deuxièmement, un tampon de digestion contenant le mélange d’enzymes Liberase a circulé dans le foie pour dissocier le tissu en une suspension unicellulaire. Les cellules ont été comptées manuellement et ensemencées dans des plaques à très faible adhérence (ULA) à 96 puits, qui permettent l’auto-assemblage en sphéroïdes en quelques jours. Au jour 5, les sphéroïdes se forment et la fine capsule bordant les sphéroïdes indique une agrégation réussie (figure 1C). Nous attendons le 10e jour pour transplanter, moment où les sphéroïdes sont compacts et ont développé de solides connexions cellule-cellule. Le nombre de cellules ensemencées par puits a déterminé la taille du sphéroïde hépatique, avec 1000, 1200 et 1500 cellules/puits produisant des sphéroïdes de 238 μm ± 10 μm, 248 μm ± 17 μm et 298 μm ± 19 μm (± écart-type moyens), respectivement (figures 1C et D). Pour la transplantation, nous sélectionnons des sphéroïdes d’environ 250 μm de diamètre pour les raisons suivantes : (1) la taille des sphéroïdes ne doit pas être trop grande pour éviter l’hypoxie et le noyau nécrotique, mais doit contenir suffisamment de cellules pour soutenir les communications cellule-cellule et permettre le remodelage du greffon dans l’œil, (2) le poids des sphéroïdes de cette taille leur permet de graviter vers l’iris et d’améliorer leur greffe, (3) Cette taille est appropriée par rapport à la transplantation de 5 à 10 sphéroïdes par œil de souris.
La chirurgie de transplantation nécessite une seringue à filetage manuel reliée à une canule en verre (Figure 2A). La canule en verre est constituée d’un capillaire en verre borosilicaté modifié en interne pour avoir une pointe fine et émoussée à l’aide d’un extracteur de micropipette et d’un biseauteur. Une autre canule plus simple peut être créée à l’aide d’un cathéter en plastique disponible dans le commerce, relié au tube de la seringue et stabilisé dans une pointe de pipette (figure 2B). La chirurgie consiste à inoculer des sphéroïdes hépatiques dans l’ECA par une incision dans la cornée (Figure 2C). Les sphéroïdes ont été positionnés sur les bords de la pupille pour les rendre plus accessibles pour l’imagerie et éviter qu’ils ne se déplacent dans l’angle oculaire. Des souris albinos ont été utilisées pour la transplantation, car leur iris non pigmenté permet l’imagerie in vivo des sphéroïdes hépatiques greffés. Les souris receveuses ont été transplantées dans les deux yeux avec 7 à 10 sphéroïdes/œil, et des images stéréoscopiques ont été prises 3 jours après la transplantation (post-Tx) ainsi qu’à 1 semaine et 1 mois après Tx pour documenter la cicatrisation de la cornée et le succès de la greffe de sphéroïde (Figure 2D). Il est à noter que le changement d’apparence des sphéroïdes hépatiques dans l’ECA entre le moment où ils sont fraîchement transplantés et celui où ils sont entièrement greffés est dû à l’installation du greffon sur l’iris, ainsi qu’à la croissance d’une monocouche de cellules de l’iris sur le sphéroïde. Le taux de réussite de la greffe des sphéroïdes hépatiques dans l’ECA est de 70 % (n = 9 yeux chez les souris mâles et femelles) (figure 2E). Les premiers jours post-Tx sont les plus critiques pour la survie et la greffe, probablement en raison du fait que l’animal receveur se frotte les yeux et déloge les sphéroïdes avant que la cornée ne soit guérie. La taille des sphéroïdes hépatiques ne diffère pas significativement après l’émission et les changements de forme sont attribués au remodelage et à la greffe du greffon (Figure 2F). A 1 mois post-Tx, tous les sphéroïdes greffés présents sur l’iris étaient vascularisés et innervés, comme le montre la coloration par immunofluorescence (Figure 2G).
L’imagerie in vivo non invasive est réalisée sur des souris receveuses anesthésiées à l’aide d’un microscope confocal droit et d’un objectif de trempage à longue distance (figure 3A, tableau 2). L’imagerie de fluorescence dans l’ACE peut être réalisée par différentes approches, comme le montre la figure 3B. L’injection de sondes fluorescentes dans la circulation de la souris réceptrice permet de visualiser différents types de cellules et de structures au sein des sphéroïdes. Nous avons utilisé la lectine pour marquer les vaisseaux sanguins (Figure 3C), le CMFDA pour observer le réseau des canalicules biliaires (Figure 3D) et le pHrodo-LDL, qui a confirmé l’absorption active du LDL dans les cellules sphéroïdes (Figure 3E). Des sphéroïdes hépatiques générés à partir de modèles de souris rapporteures peuvent également être utilisés. Les sphéroïdes de Tomato ont permis le marquage et le suivi des hépatocytes (Figure 3F), et les sphéroïdes exprimant le biocapteur FUCCI (Fluorescent Ubiquitin Cell Cycle Indicator) ont été utilisés pour visualiser la dynamique du cycle cellulaire à une résolution de cellule unique (Figure 3G). Enfin, les sphéroïdes hépatiques peuvent être génétiquement modifiés in vitro avant la transplantation, et, dans le cas de la transduction du virus adéno-associé (AAV)-GFP, l’expression a été observée in vivo pendant plus de 6 mois (Figure 3H).
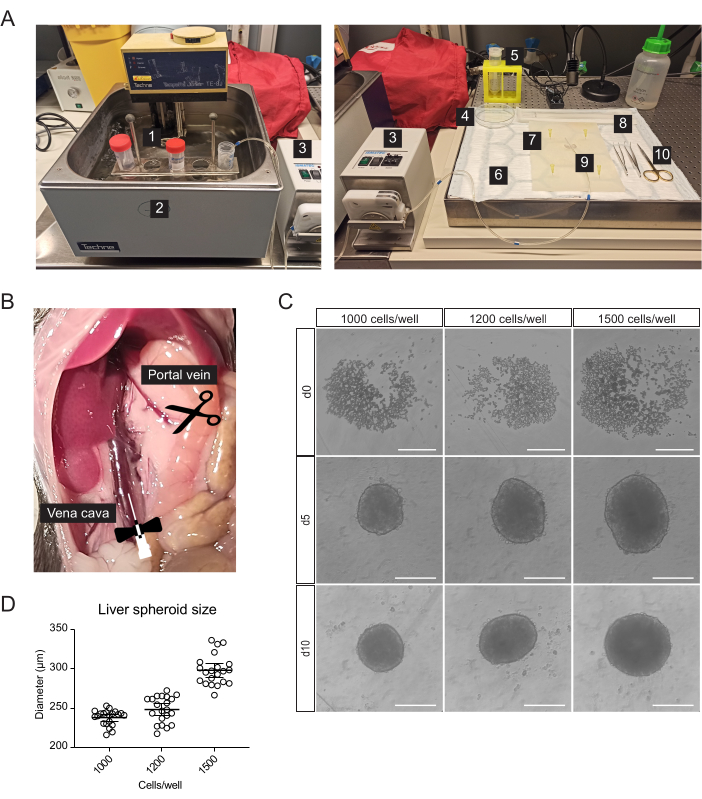
Figure 1 : Isolement des hépatocytes primaires de souris et génération de sphéroïdes hépatiques. (A) Matériel et équipement utilisés pour l’isolement des hépatocytes primaires de souris : 1. Tampons d’isolement ; 2. Bain-marie ; 3. Pompe péristaltique ; 4. Boîte de Pétri ; 5. Passoire cellulaire ; 6. Tampon absorbant ; 7. Tapis de dissection ; 8. Lève-cellule ; 9. Aiguille papillon 27 G ; 10. Outils de dissection. (B) Cavité abdominale pendant l’intervention chirurgicale : la veine cave est canulée et perfusée, et la veine porte est coupée pour permettre l’écoulement des tampons. (C) Images en fond clair de la formation des sphéroïdes hépatiques in vitro à 0 (j0), 5 (j5) et 10 (j10) jours après l’ensemencement, barres d’échelle = 200 μm. (D) Taille des sphéroïdes hépatiques à différentes concentrations d’ensemencement cellulaire, n = 21 sphéroïdes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
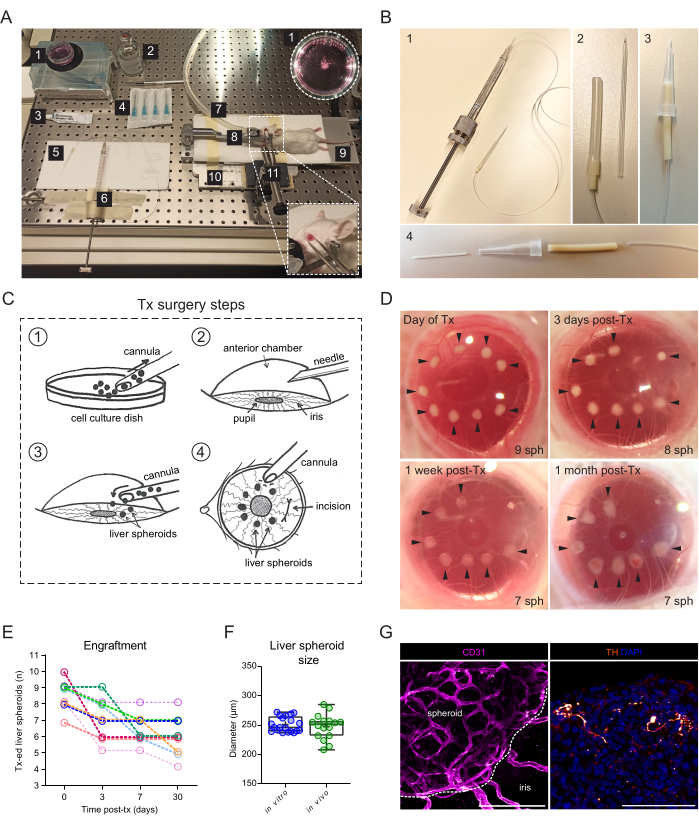
Figure 2 : Transplantation et greffe de sphéroïdes hépatiques dans l’ECA de souris. (A) Matériaux et équipements utilisés pour la transplantation (Tx) de sphéroïdes hépatiques dans l’ECA : 1. Sphéroïdes hépatiques dans la boîte de culture ; 2. Solution saline stérile ; 3. Pommade pour les yeux ; 4. Aiguilles 23 g ; 5. Canule ; 6. Seringue Hamilton ; 7. Tube de gaz d’anesthésie ; 8. Support de tête et masque à gaz ; 9. Coussin chauffant ; 10. Plaque de base en métal sur mesure ; 11. Pinces et joint universel solide. (B) Configuration de la canule et de la seringue Hamilton : 1. Canule en verre reliée à la seringue Hamilton par un tube Portex et une aiguille 27G ; 2. La canule en verre est reliée au tube Portex via des segments supplémentaires de tube en silicone et de tube PharMed ; 3. Canule en plastique assemblée alternativement ; 4. Pièces formant la canule en plastique : cathéter en plastique 24G BD Insyte connecté via un tube PharMed et gainé d’une pointe de pipette de 10 μl pour plus de stabilité et d’adhérence. (C) Illustration des étapes de la chirurgie Tx : 1. Les sphéroïdes sont rassemblés dans la canule ; 2. La cornée est perforée avec une aiguille ; 3. La canule est insérée dans l’incision et les sphéroïdes sont libérés dans l’ACE ; 4. De l’extérieur de l’œil, les sphéroïdes sont positionnés près de la pupille et loin de l’incision. (D) Images stéréoscopiques de sphéroïdes hépatiques (sph) dans l’œil de la souris le jour de la chirurgie et à 3, 7 et 30 jours après l’opération. Les flèches indiquent des sphéroïdes viables. (E) Taux de greffe de sphéroïdes hépatiques (taille de 1200 cellules/puits) après Tx, n = 9 yeux chez 6 souris receveuses. (F) Taille des sphéroïdes hépatiques en culture, avant la transplantation (in vitro, n = 20 sphéroïdes issus d’une préparation unique) et à 1 mois après l’émission dans l’ECA (in vivo, n = 16 sphéroïdes chez 3 souris receveuses), calculée en faisant la moyenne des diamètres verticaux et horizontaux. (G) Coloration par immunofluorescence de sphéroïdes hépatiques greffés à 2 mois post-Tx, montrant une vascularisation (CD31, rose, la ligne pointillée délimite la masse sphéroïde) et une innervation sympathique (tyrosine hydroxylase (TH), orange), barre d’échelle = 100 μm. Les données du panneau F ont été adaptées avec la permission de Lazzeri-Barcelo et al.10. Veuillez cliquer ici pour voir une version agrandie de cette figure.
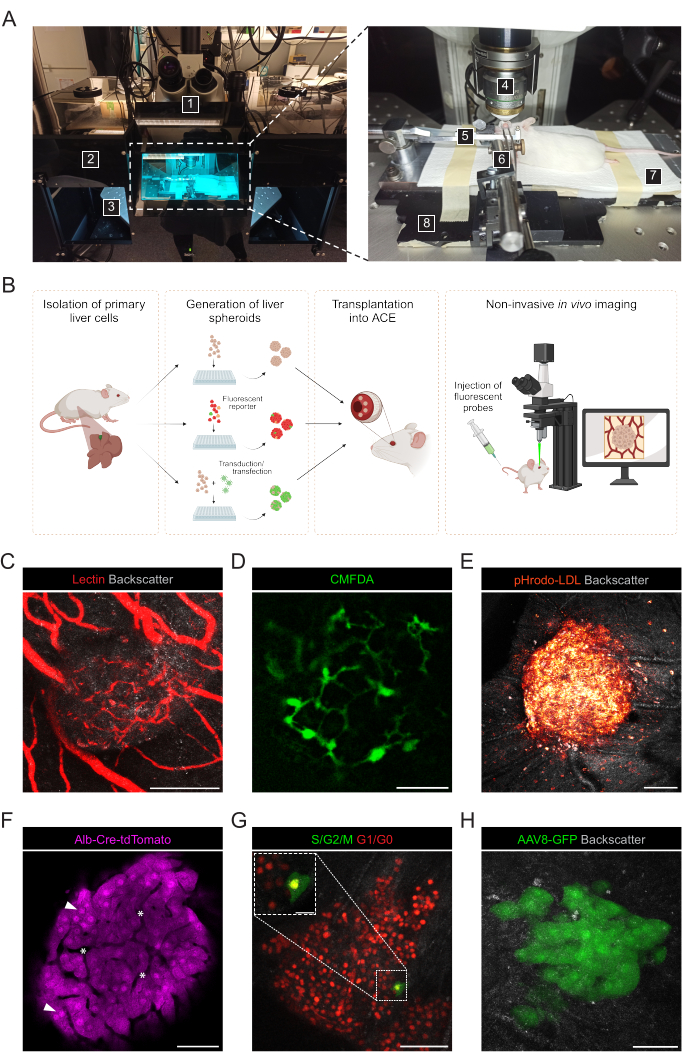
Figure 3 : Imagerie intraoculaire in vivo non invasive de sphéroïdes hépatiques greffés. (A) Matériel et équipement utilisés pour l’imagerie ACE in vivo : 1. Microscope confocal à balayage laser droit ; 2. Boîte sombre ; 3. Scène XYZ motorisée ; 4. Objectif de trempage ; 5. Support de tête et masque à gaz ; 6. Pinces et joint universel solide ; 7. Coussin chauffant ; 8. Plaque de base en métal sur mesure. (B) Schéma illustrant différentes approches utilisées pour l’imagerie in vivo des lectures fluorescentes dans des sphéroïdes hépatiques greffés dans l’œil. (C-H) Images représentatives des sphéroïdes hépatiques ECA lors de l’imagerie in vivo par microscopie confocale. Le signal de rétrodiffusion est utilisé pour observer le volume et la structure du sphéroïde ; (C) Vaisseaux sanguins marqués par injection intraveineuse de lectine fluorescente, barre d’échelle = 100 μm ; (D) Réseau de canalicules biliaires marqués par injection de CMFDA fluorescent, barre d’échelle = 50 μm ; (E) absorption de LDL par injection d’une sonde fluorescente pHrodo-LDL, barre d’échelle = 100 μm ; (F) les hépatocytes exprimant la tomate, les pointes de flèches indiquent les noyaux et les astérisques indiquent le système vasculaire intra-sphéroïde, barre d’échelle = 50 μm ; (G) Surveillance de la dynamique du cycle cellulaire chez les sphéroïdes hépatiques exprimant FUCCI, barres d’échelle = 50 μm (image principale) et 20 μm (gonflement). (H) sphéroïdes hépatiques transduits in vitro avec AAV8-GFP avant Tx et imagés dans l’œil 6 mois après Tx, barre d’échelle = 50 μm. L’image du panneau G a été adaptée avec la permission de Lazzeri-Barcelo et al.10. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Solutions utilisées pour l’isolement des hépatocytes primaires de souris. Composition des solutions et des tampons nécessaires à l’isolement des hépatocytes de souris. Le tampon de digestion et les composants de la solution Gradient doivent être mélangés frais le jour de l’isolement. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2. Réglages du microscope confocal Leica SP5 utilisés pour l’imagerie intraoculaire in vivo des sphéroïdes hépatiques. Le tableau a été adapté avec la permission de Lazzeri et al.10. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Ce protocole décrit une nouvelle plateforme pour l’imagerie intraoculaire in vivo de sphéroïdes hépatiques greffés dans l’ACE. L’ACE a déjà été utilisé comme site de transplantation d’autres microtissus dérivés d’organes, tels que les îlots pancréatiques11,12, en raison de son microenvironnement de greffe unique, riche en vaisseaux, en nerfs et en oxygène, et de l’accès à l’imagerie par la cornée. Alors que l’imagerie hépatique intravitale permet de visualiser les cellules et les processus in situ, la surveillance longitudinale n’est pas possible. L’imagerie hépatique à travers une fenêtre abdominale implique une intervention chirurgicale complexe, et le mouvement de l’organe dans le corps rend difficile le suivi d’une cellule unique au fil du temps. Par conséquent, cette nouvelle méthode d’imagerie permet une surveillance longitudinale non invasive des cellules hépatiques à une résolution unicellulaire.
Ce protocole est divisé en trois parties. La première est l’isolement des hépatocytes primaires par perfusion de collagénase en deux étapes, adaptée de Charni-Natan et al.13, à la différence que nous effectuons la perfusion hépatique sur la souris morte au lieu des animaux vivants anesthésiés. Cette variation apporte certains avantages, tels que moins de considérations éthiques et l’évitement des résidus d’anesthésie dans l’organisme. Dans ce travail, nous générons des sphéroïdes hépatiques à partir de la fraction enrichie en hépatocytes de l’isolement, mais cela n’exclut pas le potentiel d’isoler d’autres populations de cellules non parenchymateuses en utilisant d’autres protocoles spécialisés pour fabriquer des sphéroïdes de coculture de composition diverse14,15.
La deuxième partie de ce protocole implique la transplantation des sphéroïdes hépatiques dans l’ECA de souris receveuses. Il s’agit d’une chirurgie rapide (moins de 10 min) et simple réalisée chez des souris anesthésiées et ne nécessitant aucun traitement postopératoire. La ponction de la cornée s’auto-scelle et guérit en 3 à 5 jours. Parfois, au cours du processus de guérison, un peu de bizutage est observé autour de l’incision, mais cela disparaît en quelques jours. Nous n’avons pas connu de cas de synéchie antérieure dans les yeux d’animaux opérés. Nous effectuons les procédures de transplantation dans un laboratoire propre mais en plein air et sans problèmes d’infections des yeux opérés. L’inoculation et la greffe de sphéroïdes dans l’œil ne compromettent pas la vision ni n’altèrent le comportement de l’animal receveur. Dans ce protocole, nous utilisons l’anesthésie à l’isoflurane à la fois pour la chirurgie de transplantation et l’imagerie in vivo , qui est bien tolérée chez la souris. En raison de son effet dose-dépendant, il peut être facilement ajusté tout au long des procédures et présente l’avantage de réduire les temps de sommeil et de réveil. Cependant, d’autres anesthésiques injectables peuvent être utilisés. Après la transplantation, on laisse généralement 1 mois aux sphéroïdes pour se greffer complètement, se vasculariser et s’innerver, avant d’effectuer des interventions de traitement et d’imagerie in vivo . Nous avons également montré que la transplantation et la greffe sont possibles en utilisant des sphéroïdes hépatiques humains et des souris receveuses immunodéprimées10.
La troisième partie de cette méthode est l’imagerie in vivo des sphéroïdes hépatiques greffés dans l’ACE. Ce protocole décrit l’installation d’imagerie in vivo, qui utilise des équipements de microscopie que l’on trouve couramment dans les installations d’imagerie de recherche. De plus, les matériaux spécialisés, tels que le support de tête de souris et la canule en plastique, sont maintenant disponibles dans le commerce. Avec cette configuration d’imagerie, nous sommes en mesure de capturer des sections z et d’obtenir une reconstruction tridimensionnelle de l’architecture du sphéroïde, en fonction de la profondeur de pénétration du laser et de la détection de fluorescence. La surveillance de la fonction cellulaire dans les sphéroïdes hépatiques greffés repose sur la visualisation de protéines fluorescentes qui rendent compte des types de cellules, des fonctions cellulaires et de la dynamique. Ainsi, cette plateforme d’imagerie peut être exploitée à l’aide de différentes modalités, seules ou en combinaison : (1) des sondes fluorescentes peuvent être administrées par voie intraveineuse, par exemple, des anticorps pour marquer et suivre les cellules ainsi que des colorants fonctionnels ; (2) Les sphéroïdes hépatiques peuvent être générés à partir de cellules isolées à partir de modèles de souris rapporteures qui expriment des protéines fluorescentes spécifiques du foie, par exemple, les sphéroïdes hépatiques FUCCI qui rendent compte de la dynamique du cycle cellulaire ; (3) La formation de sphéroïdes hépatiques in vitro peut être combinée à la transfection ou à la transduction, pour équiper les sphéroïdes de protéines fluorescentes et de biocapteurs. par exemple, les virus adéno-associés. Dans nos contextes expérimentaux et en utilisant un seul photon pour l’excitation, la profondeur d’imagerie qu’il est possible d’atteindre est d’environ 60-100 μm. Cependant, cela dépend de la puissance du laser et de la disponibilité de l’imagerie multiphotonique, des caractéristiques d’émission de la sonde de fluorescence et de la sensibilité des détecteurs, ainsi que de l’angle de l’œil dans lequel le sphéroïde est greffé. Après l’acquisition de l’imagerie, l’analyse d’image en aval peut être effectuée à l’aide de programmes populaires tels que Image J et Imaris. Par exemple, dans le cas du rapporteur FUCCI, les cellules actives du cycle cellulaire en vert peuvent être comptées et comparées au nombre total de globules rouges pour évaluer l’activité du cycle cellulaire dans le sphéroïde greffé. De plus, la plateforme d’imagerie ACE permet d’appliquer des substances sur l’œil (sous forme de gouttes ophtalmiques) ou de les injecter directement dans l’ACE pour traiter le greffon et surveiller sa réaction. Post-mortem, les sphéroïdes transplantés peuvent facilement être récupérés par microdissection manuelle et peuvent fournir des informations précieuses par des techniques ex vivo, telles que la coloration par immunofluorescence, l’analyse transcriptomique, etc.10.
Cette technique présente certaines limites. La première est que, d’après notre expérience, les souris receveuses doivent être albinos, c’est-à-dire avoir un iris non pigmenté. Lors de la greffe, les sphéroïdes du foie sont recouverts d’une monocouche de cellules de l’iris, ce qui n’affecte pas la viabilité ou la fonction des sphéroïdes, mais le pigment des cellules de l’iris empêche l’imagerie. Une deuxième considération est la stabilité lors de l’imagerie intraoculaire chez les souris anesthésiées. Lors des séances d’imagerie in vivo , la concentration anesthésique et la respiration de l’animal doivent être surveillées de près afin de minimiser les mouvements. Néanmoins, en utilisant les paramètres d’imagerie indiqués ici, nous sommes en mesure d’obtenir une imagerie à haute résolution au niveau de la cellule unique.
Pour résumer, ce protocole décrit la mise en œuvre d’une plateforme d’imagerie in vivo non invasive de tissus hépatiques greffés dans les yeux de souris. Nous utilisons des procédures simples, un équipement commun et des matériaux abordables, ce qui en fait une approche réalisable pour de nombreux enquêteurs. Ce modèle combine les avantages des sphéroïdes hépatiques 3D in vitro avec le milieu in vivo et l’accessibilité optique fournis par l’ACE pour créer une plate-forme précieuse pour l’étude de la physiologie et de la pathologie hépatiques dans la recherche fondamentale et les contextes précliniques.
Déclarations de divulgation
P-OB est le cofondateur et PDG de Biocrine AB, IBL et BL sont consultants pour Biocrine AB.
Remerciements
Ce travail a été soutenu par l’Association suédoise du diabète, les fonds du Karolinska Institutet, le Conseil suédois de la recherche, la Fondation Novo Nordisk, la Fondation de la famille Erling-Persson, le programme de recherche stratégique sur le diabète du Karolinska Institutet, la Fondation de la famille Knut et Alice Wallenberg, la Fondation Jonas et Christina af Jochnick, l’Association suédoise de diabétologie et ERC-2018-AdG 834860-EYELETS. Les dessins de figures ont été créés par FL-B à l’aide de BioRender.com.
matériels
| Name | Company | Catalog Number | Comments |
| 27 G butterfly needle | Venofix | 4056388 | |
| AAV8-CAG-GFP | Charles River | CV17169-AV9 | Incubated with isolated hepatocytes at 1 µL/mL during liver spheroid formation |
| Absolute and 70% ethanol | N/A | N/A | |
| Absorbent pad | Attends | 203903 | |
| Albumin-Cre;RCL-tdTomato (B6.Cg-Speer6-ps1Tg(Alb-cre)21Mgn/J ; B6.Cg-Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J) | Jackson | #003574 and #007914 | Mice obtained from in-house breeding |
| B6 albino mice (B6(Cg)-Tyrc-2J/J) | Jackson | #000058 | Mice obtained from in-house breeding |
| B6;129P2-Gt(ROSA)26Sor[tm1(CAG-Venus/GMNN,-Cherry/CDT1)Jkn]/JknH | INFRAFRONTIER/EMMA | EM:08395 | Mice obtained from in-house breeding |
| BD Insyte IV Catheter 24 G x 0.75 in | BD Medical | 381212 | |
| Borosillicate standard glass cappilaries | World Precision Instruments | 1B150-4 | |
| Cell lifter | Corning | 3008 | |
| Cell strainer, 70 µm | Falcon | 352350 | |
| Custom-made metal plate | Hardware store | N/A | |
| Dexamethasone | Sigma-Aldrich | D4902 | |
| Dual-Stage Glass Micropipette Puller | Narshige | Model PC-100 | |
| EDTA | Sigma-Aldrich | E9884 | |
| Electric heating pad | Hardware store | N/A | |
| FBS | Gibco | N/A | |
| GlutaMAX | Gibco | 35050061 | |
| Green CMFDA | Abcam | ab145459 | Reconstituted in DMSO, administered at 100 µg/mouse in PBS 10% FBS |
| Hamilton syringe | Hamilton | 81242 | Model 1750 Luer Tip Threaded Plunger Syringe, 500 µL |
| HBSS; no calcium, no magnesium and no phenol red | Gibco | 14175095 | |
| HCX IRAPO L 25x/0.95 W objective | Leica | N/A | |
| HEPES | Gibco | 15630080 | |
| Induction chamber 0.8 L | Univentor | 8329001 | |
| Insulin-Transferrin-Selenium (ITS-G) | Gibco | 41400045 | |
| Isoflurane | Baxter | N/A | |
| Lectin DyLight-649 | Invitrogen | L32472 | Administered at 1 mg/mL and 100 µL/mouse |
| Liberase TM Research Grade | Sigma-Aldrich | 5401127001 | |
| Microelectrode beveler | World Precision Instruments | Model BV-10 | |
| Mouse head-holder and gas mask | Narshige | Model SGM-4 | |
| Nunclon Sphera 96-Well, U-Shaped-Bottom Microplate | Thermo Fisher | 174929 | |
| Oculentum simplex | APL | N/A | |
| PBS 10x | Gibco | 14080055 | |
| PBS 1x; no calcium, no magnesium | Gibco | 14190144 | |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Percoll | Sigma-Aldrich | P1644 | |
| Peristaltic pump | Ismatec | Model ISM795 | |
| PharMed BPT Pump Tubing | VWR | VERN070540-07 | Inner diameter 0.76 mm, outer diameter 2.46 mm |
| pHrodo Red-LDL | Invitrogen | L34356 | Administered at 1 mg/mL and 100 µL/mouse |
| Portex Fine Bore Polyethylene Tubing | Smiths Medical | 800/100/140 | Inner diameter 0.4 mm, outer diameter 0.8 mm |
| Silicone dissection mat | Hardware store | N/A | |
| Sodium chloride 0.9% | Braun | N/A | |
| Solid Universal Joint | Narshige | Model UST-2 | |
| Stereomicroscope | Leica | Model M80 | |
| Suspension culture dish 35 mm | Sarstedt | 833900500 | |
| Temgesic | Indivor | N/A | Administered s.c. at 0.05 mg/mL and 2 µL/g mouse |
| Translucent Silicone Tubing | VWR | 228-1450 | Inner diameter 1.5 mm, outer diameter 3 mm |
| Trypan Blue | Sigma-Aldrich | T8154 | |
| Univentor 400 Anesthesia unit | Univentor | 8323001 | |
| Upright laser scanning confocal microscope | Leica | Model TCS SP5 II | |
| Viscotears | Novartis | N/A | |
| William's E Medium; no glutamine, phenol red | Gibco | 22551089 |
Références
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Sci Rep. 6, 25187 (2016).
- Lauschke, V. M., et al. Massive rearrangements of cellular MicroRNA signatures are key drivers of hepatocyte dedifferentiation. Hepatology. 64 (5), 1743-1756 (2016).
- Oliva-Vilarnau, N., Vorrink, S. U., Ingelman-Sundberg, M., Lauschke, V. M. A 3D cell culture model identifies Wnt/beta-catenin mediated inhibition of p53 as a critical step during human hepatocyte regeneration. Adv Sci (Weinh). 7 (15), 2000248 (2020).
- Hurrell, T., et al. Human liver spheroids as a model to study aetiology and treatment of hepatic fibrosis. Cells. 9 (4), 964 (2020).
- Kozyra, M., et al. Human hepatic 3D spheroids as a model for steatosis and insulin resistance. Sci Rep. 8 (1), 14297 (2018).
- Lauschke, V. M., Shafagh, R. Z., Hendriks, D. F. G., Ingelman-Sundberg, M. 3D primary hepatocyte culture systems for analyses of liver diseases, drug metabolism, and toxicity: Emerging culture paradigms and applications. Biotechnol J. 14 (7), e1800347 (2019).
- Shibuya, K., et al. The efficacy of the hepatocyte spheroids for hepatocyte transplantation. Cell Transplant. 30, 9636897211000014 (2021).
- Hamazaki, K., Doi, Y., Koide, N. Microencapsulated multicellular spheroid of rat hepatocytes transplanted intraperitoneally after 90% hepatectomy. Hepatogastroenterology. 49 (48), 1514-1516 (2002).
- Marques, P. E., et al. Imaging liver biology in vivo using conventional confocal microscopy. Nat Protoc. 10 (2), 258-268 (2015).
- Lazzeri-Barcelo, F., et al. Intraocular liver spheroids for noninvasive high-resolution in vivo monitoring of liver cell function. Nat Commun. 15 (1), 767 (2024).
- Speier, S., et al. Noninvasive in vivo imaging of pancreatic islet cell biology. Nat Med. 14 (5), 574-578 (2008).
- Leibiger, I. B., Berggren, P. O. Intraocular in vivo imaging of pancreatic islet cell physiology/pathology. Mol Metab. 6 (9), 1002-1009 (2017).
- Charni-Natan, M., Goldstein, I. Protocol for Primary Mouse Hepatocyte Isolation. STAR protocols. 1 (2), 100086 (2020).
- Baze, A., et al. Three-dimensional spheroid primary human hepatocytes in monoculture and coculture with nonparenchymal cells. Tissue Eng Part C Methods. 24 (9), 534-545 (2018).
- Mohar, I., Brempelis, K. J., Murray, S. A., Ebrahimkhani, M. R., Crispe, I. N. Isolation of nonparenchymal cells from the mouse liver. Methods Mol Biol. 1325, 3-17 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon