Method Article
Визуализация in vivo сфероидов печени, привитых в передней камере глаза мыши
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы описываем платформу, которая позволяет неинвазивно визуализировать in vivo сфероиды печени, привитые в передней камере глаза мыши. Рабочий процесс охватывает от получения сфероидов из первичных клеток печени до трансплантации в глаз мыши и визуализации in vivo с клеточным разрешением с помощью конфокальной микроскопии.
Аннотация
Биомедицинские исследования печени у млекопитающих затруднены отсутствием методов неинвазивной продольной визуализации in vivo с клеточным разрешением. До сих пор оптическая визуализация печени in situ возможна с помощью прижизненной визуализации, которая обеспечивает визуализацию с высоким разрешением на клеточном уровне, но не может быть выполнена несколько раз и, следовательно, продольно у одного и того же животного. Неинвазивные методы визуализации, такие как биолюминесценция, позволяют проводить повторные сеансы визуализации на одном и том же животном, но не достигают клеточного разрешения. Чтобы восполнить этот пробел в методологии, мы разработали платформу для неинвазивной визуализации in vivo сфероидов печени, привитых в передней камере глаза мыши. В рабочем процессе, описанном в этом исследовании, первичные сфероиды печени мыши генерируются in vitro и трансплантируются в переднюю камеру глаза мышей-реципиентов, где они приживаются на радужной оболочке. Роговица действует как естественное окно тела, через которое мы можем визуализировать привитые сфероиды с помощью обычной конфокальной микроскопии. Сфероиды выживают в глазу в течение нескольких месяцев, в течение которых клетки можно изучать в контексте здоровья и болезни, а также контролировать в ответ на различные стимулы в течение повторных сеансов визуализации с использованием соответствующих флуоресцентных зондов. В этом протоколе мы приводим разбивку необходимых шагов для внедрения этой системы визуализации и объясняем, как наилучшим образом использовать ее потенциал.
Введение
Мониторинг функции печени у млекопитающих во время здоровья и болезни ограничен отсутствием неинвазивных методов визуализации in vivo с высоким разрешением. Визуализация этого органа затруднена его недоступным местоположением, и для того, чтобы собрать воедино клеточные процессы, исследования in vivo полагаются на жертвоприношение животных в разные моменты времени. Чтобы обойти это ограничение визуализации, большая часть работы полагается на модели in vitro , в которых микроткани, похожие на печень, визуализируются и изучаются в контролируемой среде.
В последние годы развитие трехмерных систем культивирования, таких как сфероиды печени, помогло и продвинуло исследования печени. Сфероиды печени представляют собой многоклеточные агрегаты, которые в определенной степени имитируют микроокружение и сложные межклеточные взаимодействия ткани печени1 и имеют явные преимущества по сравнению с традиционными монослойными культурами 2,3. Сфероиды печени также используются в качестве моделей для различных заболеваний печени 4,5,6 и играют важную роль в понимании механизмов заболевания. Тем не менее, ключевыми ограничениями существующих моделей печени in vitro являются отсутствие физиологической среды in vivo и ограниченное время использования в культуре (около 20 дней)3. Сфероиды печени ранее трансплантировались в различные места in vivo, например, под капсулу почки7 или внутрибрюшинно8, которые недоступны для оптической визуализации. Прижизненная визуализация печени — это современный метод, предлагающий визуализацию с клеточным разрешением в режиме реального времени. В настоящее время визуализация печени in situ возможна только на внешнем органе, который является высокоинвазивным и часто терминальным9. Хотя установка брюшного окна позволила бы проводить повторные сеансы визуализации печени, она влечет за собой сложную операцию и последующий уход.
Для проведения лонгитюдного мониторинга с клеточным разрешением мы исследовали трансплантацию сфероидов печени в переднюю камеру глаза (АПФ) мышей, где печеноподобная ткань приживается в физиологической среде, соединена со стимулами тела и доступна для оптической визуализации. Роговица представляет собой прозрачную ткань и действует как окно, через которое микроткани, привитые на радужной оболочке, могут быть визуализированы неинвазивно и продольно с помощью конфокальной микроскопии. Здесь мы представляем рабочий процесс этой недавно разработанной платформы для визуализации сфероидов печени in vivo 10. Этот протокол представляет собой пошаговое руководство по его реализации, разделенное на (1) экстракцию первичных клеток печени мыши и образование сфероидов печени in vitro , (2) трансплантацию сфероидов печени в АПФ мышей-реципиентов и (3) визуализацию in vivo привитых сфероидов печени у мышей, находящихся под наркозом. Кроме того, мы продемонстрируем некоторые возможности и области применения этой платформы визуализации.
протокол
Все процедуры, выполняемые на животных, были одобрены Комитетом по этике экспериментов на животных Каролинского института.
1. Экстракция первичных клеток печени мыши и генерация сфероидов печени in vitro
- Подготовка
- Для канюляции, резекции печени и выделения первичных клеток печени приготовьте следующие стерильные или одноразовые материалы в дополнение к серологическим пипеткам и центрифужным пробиркам (рис. 1A): перистальтический насос, центрифуга с качающимся ведром, абсорбирующая прокладка, коврик для препарирования, два щипца с изогнутым наконечником, хирургические ножницы, одна игла-бабочка 27 G, один клеточный фильтр 70 мкм, один клеточный подъемник, одна чашка Петри 100 мм, камера для подсчета клеток и 96-луночные микропланшеты с U-образным дном.
- Приготовьте растворы, используемые для перфузии печени, выделения первичных клеток печени и получения сфероидов печени, как указано в таблице 1.
ПРИМЕЧАНИЕ: Буфер для разложения и раствор для градиента следует готовить свежими. - Настройте перфузионную систему, состоящую из перистальтического насоса, который проводит растворы от водяной бани 42 °C к печени (рис. 1A). Более высокая температура водяной бани гарантирует, что буферы достигают печени при оптимальной температуре 37 °C. Настройте его в зависимости от длины трубки и температуры в помещении (RT).
- Для канюляции установите иглу-бабочку 27 G на конец трубки. Держите металлический материал, используемый на заключительных этапах изоляции, при температуре 4 °C.
- Процедура
- Предварительно нагрейте следующие растворы на водяной бане при температуре 42 °C в центрифужных пробирках объемом 50 мл: 40 мл PBS, 20 мл буфера для перфузии и 12 мл буфера для разложения.
- Для очистки и нагрева трубок насоса циркулируйте около 20 мл предварительно нагретого PBS.
- Замените трубку на перфузионный буфер, загрунтуйте трубку и иглу-бабочку и установите скорость потока на 4 мл/мин. Убедитесь, что в трубке нет пузырьков во время замены буфера на протяжении всего протокола.
- Усыпьте мышь при вывихе шейки матки и с помощью игл прикрепите конечности к препарирующей доске.
- Намочите мех живота 70% этанолом и рассеките его, чтобы получить доступ к органам пищеварения.
- Сдвиньте кишечник вправо, чтобы обнажить воротную вену и нижнюю полую вену (рисунок 1B).
- Канюлируйте полую вену примерно на полпути ее длины с иглой в горизонтальном положении, убедитесь, что она устойчива, и запустите насос.
- Когда печень начинает раздуваться или появляются белые точки в более близких долях, перережьте воротную вену, чтобы позволить крови и перфузионному буферу вытечь.
- Печень должна немедленно начать бледнеть. Поощряйте очищение с помощью изогнутых щипцов для зажима воротной вены с интервалом в 5 с.
- Повторяйте шаг 1.2.9 до тех пор, пока печень не станет желтой и не очистится от крови (около 15-20 мл перфузионного буфера).
- Остановите перистальтический насос, чтобы заменить трубку на буфер для разложения, и перезапустите насос. Когда буфер для разложения достигнет печени, уменьшите скорость потока до 2,5 мл/мин.
ПРИМЕЧАНИЕ: Феноловый красный в буфере для пищеварения позволяет различать его поступление в печень и позволяет регулировать параметры насоса во время лечения. - Чтобы стимулировать попадание буфера во все доли печени и обеспечить правильное пищеварение, повторите шаг 1.2.9 несколько раз.
- Остановите поток перистальтического насоса, когда буфер для пищеварения истощен или печень выглядит достаточно переваренной.
ПРИМЕЧАНИЕ: Степень пищеварения можно визуально контролировать, аккуратно зажимая доли печени щипцами и проверяя, не появляются ли на тканях небольшие отметины. Печень также станет хлипкой. - Чтобы извлечь печень, разрежьте печеночные связки и соединения в брюшной полости, стремясь удалить ее полностью, и поместите ее в чашку Петри, содержащую 10 мл среды для холодного покрытия (табл. 1).
- После удаления желчного пузыря сделайте небольшие пощипки на мочках с помощью щипцов, слегка разрывая печеночную капсулу. Встряхивая печень в чашке, наблюдайте, как клетки выливаются в среду.
- Удерживая печень устойчиво щипцами, осторожно проведите клеточный подъемник по долям, чтобы освободить клетки.
ПРИМЕЧАНИЕ: Правильное междольковое пищеварение приведет к суспензии клеток в среде, а не фрагментов тканей. - С помощью серологической пипетки соберите клеточную суспензию из чашки Петри и профильтруйте через клеточный сетчатый фильтр 70 мкм, помещенный в центрифужную пробирку объемом 50 мл. Используйте свежий гальванический материал, чтобы вымыть чашку от переваренных клеток печени и перенести их на фильтр.
- Центрифугируйте при 50 x g в течение 5 мин при 4 °C для гранулирования клеток.
- Удалите надосадочную жидкость, оставив примерно 1 мл для покрытия клеточной гранулы, закрутите трубку, чтобы повторно суспендировать клетки, а затем постепенно добавьте 10 мл среды для холодного покрытия.
- Добавьте 10 мл градиентного раствора в клеточную суспензию и аккуратно переверните пробирку 10 раз.
- Центрифуга при 200 x g в течение 10 мин при 4 °C.
- Гранула содержит жизнеспособные клетки печени, обогащенные гепатоцитами, в то время как надосадочная жидкость содержит мертвые клетки и мусор. Выбросьте надосадочную жидкость с помощью серологической пипетки, оставив примерно 1 мл, и повторно суспендируйте гранулу, осторожно поворачивая.
- Добавьте 20 мл среды для холодного покрытия в суспензию клеток и центрифугируйте при 50 x g в течение 5 мин при 4 °C, чтобы смыть градиентный раствор.
- Удалите надосадочную жидкость, оставив примерно 1 мл над гранулой, и повторно суспендируйте клетки в 20 мл среды для холодного покрытия.
ПРИМЕЧАНИЕ: Здесь клеточную гранулу можно уплотнить, поэтому при необходимости используйте серологическую пипетку объемом 10 мл, чтобы аккуратно диссоциировать клетки. - Вручную определите количество клеток и жизнеспособность с помощью камеры для подсчета клеток и Trypan Blue.
ПРИМЕЧАНИЕ: Клетки гепатоцитов быстро выпадают в осадок в трубе; Чтобы снова подвесить их, осторожно переверните трубку несколько раз. - Засейте клетки печени в 200 мкл/лунку гальванической среды из расчета 1200 клеток/лунку в 96-луночные планшеты со сверхнизкой адгезией.
ПРИМЕЧАНИЕ: Оптимальный объем среды на лунку составляет 200 μл; однако можно засеять клетки в 100 мкл/лунку. - Вращайте пластины при 200 x g в течение 3 минут, чтобы собрать ячейки в центре лунок.
- Инкубируйте (37 °C, 5%CO2) клетки и оставьте их для образования сфероидов на 5 дней естественным путем (рисунок 1C).
- На 5-й день осторожно удалите половину среды из лунки и замените ее бессывороточными питательными средами (Таблица 1). Повторяйте этот шаг каждые 48 ч до 10-го дня, когда сфероиды печени будут готовы к пересадке.
ПРИМЕЧАНИЕ: Формирование капсулообразной структуры у культивируемых сфероидов печени показывает хорошую агрегацию и жизнеспособность.
2. Трансплантация сфероидов печени в переднюю камеру глаза (АПФ)
- Подготовка
- Для пересадки сфероидов печени в АПФ необходимо обеспечить наличие следующих ресурсов (рис. 2A): стереомикроскоп, узел для анестезии изофлурана, индукционная камера, изофлуран, грелка, изготовленная на заказ металлическая опорная пластина, держатель головки мыши и противогаз, щипцы, прикрепленные к твердому универсальному шарниру, шприц с резьбовым плунжером Hamilton 500 μL, силикон, полиэтилен и трубка для помпы, изготовленная на заказ канюля из тупого стекла или катетер 24 G, этанол 70%, стерильный физиологический раствор, стерильные иглы 23 г, глазная мазь (жидкий парафин и вазелин в соотношении 1:1), одноразовый шприц 1 мл и чашка для клеточной суспензии 35 мм.
- Очистите шприц, трубку и канюлю Hamilton, пропустив 70% этанол и физиологический раствор.
- Наполните шприц, трубку и стеклянную канюлю Гамильтона физиологическим раствором и закрепите шприц Гамильтона на скамье в горизонтальном положении лентой (рисунок 2А).
- Используйте изготовленную на заказ канюлю из тупого стекла.
- Удлинить капилляр боросиликатного стекла с помощью двухступенчатого съемника микропипеток до внутреннего диаметра >300 мкм, чтобы обеспечить аспирацию сфероидов.
- Скосите и затупите наконечник с помощью микроэлектродного скоса и подвергните наконечник канюли воздействию пламени на несколько секунд, чтобы смягчить края.
ПРИМЕЧАНИЕ: Станок для снятия фаски с микроэлектродами состоит из вращающегося шлифовального камня, который управляется вручную; поэтому определенные настройки неприменимы.
- В качестве альтернативы можно сконструировать канюлю с помощью пластиковой части катетера 24 G (рисунок 2B).
- Подготовьте анестезиологический изофлуран и разогрейте грелку до 37 °C.
- Накройте кончики щипцов, прикрепленных к твердому универсальному шарниру, куском полиэтиленовой трубки, чтобы образовалась петля, которая помогает стабилизировать глаз.
- Перенесите сфероиды печени из 96-луночного планшета в 35-миллиметровую чашку для клеточной суспензии с поддерживающей средой с помощью пипетки и наконечника объемом 200 мкл.
- Процедура
- Обезболить мышь в индукционной камере, используя дозу 2,5% изофлурана и 280 мл/мин воздуха.
- Когда мышь находится без сознания, снизьте анестезию до 1,8% изофлурана и 280 мл/мин воздуха, подсоедините анестезиологическую трубку к держателю головы и быстро переложите животное на грелку, расположив нос внутри держателя головы.
- Иммобилизуйте головку винтами, аккуратно вытащите глаз из глазницы, зафиксируйте его щипцами и капните каплю физраствора на оба глаза, чтобы предотвратить высыхание.
- Под стереоскопом используйте шприц Гамильтона для аспирации и сбора сфероидов печени на кончике канюли и оставьте их горизонтально лежать на чистой поверхности.
ПРИМЕЧАНИЕ: Аспирационная среда вместе со сфероидами печени помогает предотвратить их прилипание к стенкам канюли. - Осторожно проколите роговицу иглой 23 G и высушите сочащуюся водянистую влагу салфеткой. При необходимости, чтобы сделать разрез шире, осторожно сдвиньте иглу в сторону, чтобы разрезать роговицу.
ПРИМЕЧАНИЕ: Для выполнения пункции роговицы используется одноразовая стерильная игла, поэтому роговица не дезинфицируется перед разрезом. - Добавьте в глаза капли солевого раствора, чтобы избежать высыхания.
- Возьмите канюлю, содержащую сфероиды печени, и держите ее вертикально, чтобы сфероиды могли тяготеть к кончику канюли.
- Осторожно вставьте канюлю в отверстие и, направив скос к зрачку, с помощью шприца Гамильтона медленно вытолкните сфероиды печени в АПФ (рисунок 2C).
ПРИМЕЧАНИЕ: Перед удалением канюли рекомендуется подождать несколько секунд, пока давление жидкости внутри и снаружи глаза не отрегулируется, и избежать выхода сфероидов обратно из глаза. - Снаружи роговицы расположите сфероиды печени вокруг зрачка и подальше от разреза, осторожно проталкивая роговицу кончиком канюли (рис. 2C).
- Подождите ~5-10 минут, пока сфероиды печени осядут на радужную оболочку, прежде чем освободить глаз от щипцов.
- Нанесите на прооперированный глаз вазелиновую глазную мазь, которая помогает смазать и заживить роговицу.
- При желании приступайте к операции на втором глазу, следуя тому же методу.
- Перед пробуждением мыши введите обезболивающее средство, чтобы избежать послеоперационного дискомфорта, например, 0,1 мг/кг бупренорфина в стерильном физрастворе, вводимом подкожно.
ПРИМЕЧАНИЕ: Мышам была введена только одна доза анальгетиков, так как они быстро восстановились после этой небольшой процедуры и не показали никаких признаков боли или изменения поведения. Поскольку эта процедура очень быстрая (занимает менее 10 минут) и вызывает лишь незначительный дискомфорт, мыши не нуждаются в послеоперационном уходе, кроме послеоперационной анальгезии, проводимой перед пробуждением животного.
3. Визуализация in vivo привитых сфероидов печени в АПФ
- Подготовка
- Подготовить следующие материалы и инструменты для неинвазивной визуализации in vivo сфероидов печени, привитых в АПФ (рис. 3А): вертикальный конфокальный микроскоп, объектив для погружения в воду на большом рабочем расстоянии, узел для анестезии изофлураном, индукционная камера, изофлуран, грелка, изготовленная на заказ металлическая опорная пластина, держатель головы мыши и противогаз, щипцы, прикрепленные к твердому универсальному шарниру, гель искусственной слезы, глазная мазь (жидкий парафин и вазелин в соотношении 1:1).
- Дополнительные материалы включают инъекционные флуоресцентные зонды, одноразовые шприцы и иглы 27 G для внутривенной инъекции хвоста.
- Процедура
- Обезболить мышь в индукционной камере, используя дозу 2,5% изофлурана и 280 мл/мин воздуха.
- Когда мышь находится без сознания, снизьте анестезию до 1,8% изофлурана и 280 мл/мин воздуха, подсоедините анестезиологическую трубку к держателю головы и быстро переложите животное на грелку, расположив нос внутри держателя головы.
- Иммобилизуйте головку в держателе головы с помощью винтов.
- Нанесите каплю искусственного слезного геля на оба глаза, чтобы предотвратить высыхание.
- На этом этапе внутривенно введите флуоресцентные зонды через хвостовую вену и сразу после этого сделайте снимок.
- Наклоните голову, аккуратно вытащите глаз из глазницы и закрепите его щипцами в положение под объективом.
- Нанесите большое количество искусственного слезного геля, чтобы заполнить пространство между роговицей и объективом, и сосредоточьтесь на сфероидах печени через окуляр.
ПРИМЕЧАНИЕ: Если возможно, снимите окуляр одного из окуляров, чтобы получить неувеличенное зрение и легче найти сфероиды на радужной оболочке. - Чтобы получить изображение с высоким разрешением, несмотря на дыхательные движения животного, используйте объективы с 25-кратным увеличением и следующие настройки изображения: формат 512 x 512 пикселей, скорость сканирования 600 Гц и толщина Z-стека 3 мкм. Подробные настройки изображения см. в таблице 2.
ПРИМЕЧАНИЕ: На протяжении всей визуализации концентрация анестезии регулируется от 1,6-2,2 мл/ч изофлурана для достижения неглубокого, контролируемого ритма дыхания и, таким образом, минимизации движений животного. - В конце сеанса визуализации обработайте изображенные глаза вазелиновой глазной мазью, прежде чем удалить изофлуран и разбудить животное.
Результаты
Первичные клетки печени, обогащенные гепатоцитами, были выделены из печени мыши с помощью двухступенчатой перфузии коллагеназы с использованием перистальтического насоса для циркуляции теплых буферов через печень, используя сосудистую сеть органа для доставки ферментов диссоциации ко всем клеткам (рис. 1A). Для этого нижняя полая вена была канюлирована, а воротная вена была разрезана, чтобы обеспечить протекание буферов (рис. 1B). Сначала буфер на основе HBSS промывался через печень, чтобы очистить кровь. Если канюляция прошла успешно и тромбов нет, печень бледнеет и становится желтой в течение нескольких секунд. Во-вторых, буфер для пищеварения, содержащий смесь ферментов либеразы, циркулировал через печень для диссоциации ткани в одноклеточную суспензию. Клетки были подсчитаны вручную и помещены в 96-луночные планшеты со сверхнизкой адгезией (ULA), которые позволяют самособираться в сфероиды в течение нескольких дней. На 5-й день формируются сфероиды, а тонкая капсула, окаймляющая сфероиды, свидетельствует об успешной агрегации (рис. 1В). Мы ждем до 10-го дня трансплантации, после чего сфероиды компактны и развивают прочные межклеточные связи. Количество засеянных клеток на лунку определяло размер сфероида печени с диаметром 1000, 1200 и 1500 клеток на хорошо дающий сфероид 238 мкм ± 10 мкм, 248 мкм ± 17 мкм и диаметром 298 мкм ± 19 мкм (среднее значение ± SD) соответственно (рис. 1C, D). Для трансплантации мы отбираем сфероиды диаметром около 250 мкм по следующим причинам: (1) размер сфероидов не должен быть слишком большим, чтобы избежать гипоксии и некротического ядра, но должен содержать достаточно клеток для поддержания межклеточных коммуникаций и ремоделирования трансплантата в глазу, (2) вес сфероидов такого размера позволяет им тяготеть к радужной оболочке и улучшать их приживление, (3) Этот размер подходит для пересадки 5-10 сфероидов на глаз мыши.
Для операции по трансплантации требуется шприц с ручной резьбой, соединенный со стеклянной канюлей (рисунок 2A). Стеклянная канюля состоит из боросиликатного стеклянного капилляра, модифицированного на собственном производстве для получения тонкого тупого наконечника с помощью съемника микропипетки и скоса. Более простая альтернативная канюля может быть создана с использованием имеющегося в продаже пластикового катетера, подключенного к трубке шприца и стабилизированного в наконечнике пипетки (рисунок 2B). Операция заключается в инокуляции сфероидов печени в АПФ через разрез в роговице (Рисунок 2C). Сфероиды располагались по краям зрачка, чтобы сделать их более доступными для визуализации и избежать их смещения в глазной угол. Мышей-альбиносов использовали для трансплантации, так как их непигментированная радужная оболочка позволяет in vivo визуализировать привитые сфероиды печени. Мышам-реципиентам трансплантировали в оба глаза с 7-10 сфероидами на глаз, а стереоскопические изображения были сделаны через 3 дня после трансплантации (после пересадки), а также через 1 неделю и 1 месяц после пересадки, чтобы задокументировать заживление роговицы и успешное приживление сфероидов (рисунок 2D). Следует отметить, что изменение внешнего вида сфероидов печени в АПФ между свежей трансплантацией и полным приживлением связано с оседанием трансплантата на радужной оболочке, а также с ростом монослоя клеток радужки над сфероидом. Успешность приживления сфероидов печени в АПФ составляет 70% (n = 9 глаз как у самцов, так и у самок мышей) (рис. 2E). Первые дни после пересадки являются наиболее важными для выживания и приживления, вероятно, из-за того, что животное-реципиент трет глаза и смещает сфероиды до того, как роговица заживет. Размеры сфероидов печени существенно не различаются после пересадки, а изменения формы объясняются ремоделированием и приживлением трансплантата (рис. 2F). Через 1 месяц после передатчика все привитые сфероиды, присутствующие на радужной оболочке, были васкуляризированы и иннервированы, как показано иммунофлуоресцентным окрашиванием (рис. 2G).
Неинвазивная визуализация in vivo выполняется на мышах-реципиентах, находящихся под наркозом, с использованием вертикального конфокального микроскопа и объектива для погружения на большое расстояние (рис. 3A, таблица 2). Флуоресцентная визуализация в АПФ может быть получена с помощью различных подходов, как показано на рисунке 3B. Введение флуоресцентных зондов в кровообращение мыши-реципиента позволяет визуализировать различные типы клеток и структуры внутри сфероидов. Мы использовали лектин для маркировки кровеносных сосудов (рис. 3C), CMFDA для наблюдения сети желчных каналов (рис. 3D) и pHrodo-LDL, что подтвердило активное поглощение ЛПНП сфероидными клетками (рис. 3E). Также можно использовать сфероиды печени, полученные из моделей мышей-репортеров. Сфероиды Albumin-Cre:tdTomato позволяли мечить и отслеживать гепатоциты (рис. 3F), а сфероиды, экспрессирующие биосенсор флуоресцентного убиквитинового индикатора клеточного цикла (FUCCI), использовали для визуализации динамики клеточного цикла с разрешением одной клетки (рис. 3G). Наконец, сфероиды печени могут быть генетически модифицированы in vitro до трансплантации, а в случае трансдукции аденоассоциированного вируса (AAV)-GFP экспрессия наблюдалась in vivo в течение более 6 месяцев (рисунок 3H).
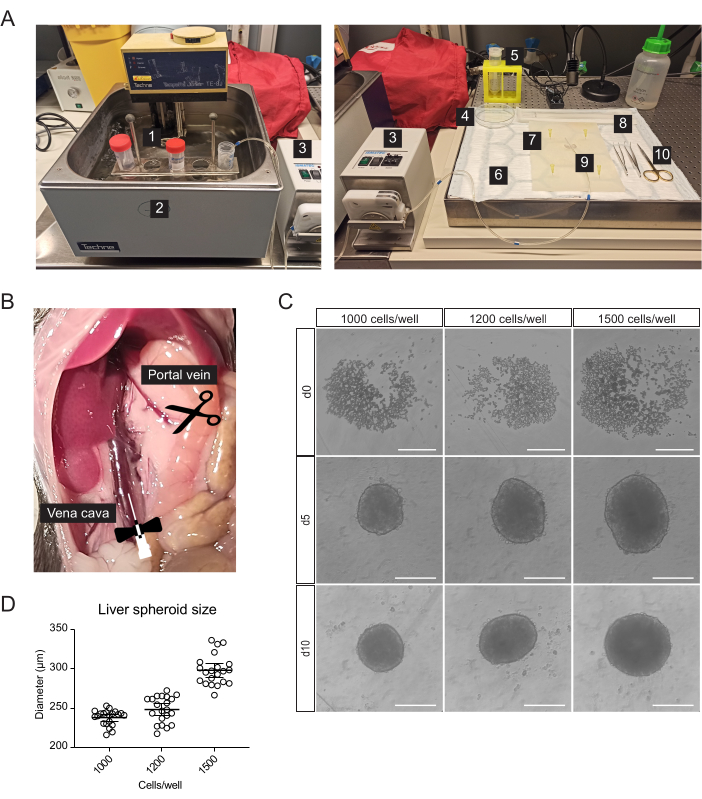
Рисунок 1: Выделение первичных гепатоцитов мыши и генерация сфероидов печени. (A) Материал и оборудование, используемые для выделения первичных гепатоцитов мыши: 1. Изоляционные буферы; 2. Водяная баня; 3. Перистальтический насос; 4. Чашка Петри; 5. Сетчатый фильтр; 6. Впитывающая прокладка; 7. Коврик для вскрытия; 8. Клеточный лифтер; 9. Игла бабочка 27 г; 10. Инструменты для препарирования. (B) Брюшная полость во время операции: полая вена канюлируется и перфузируется, а воротная вена разрезается, чтобы обеспечить протекание буферов. (C) Светлопольные изображения формирования сфероидов печени in vitro через 0 (d0), 5 (d5) и 10 (d10) дней после посева, масштабные линейки = 200 мкм. (D) Размер сфероида печени при различных концентрациях при посеве клеток, n = 21 сфероид. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
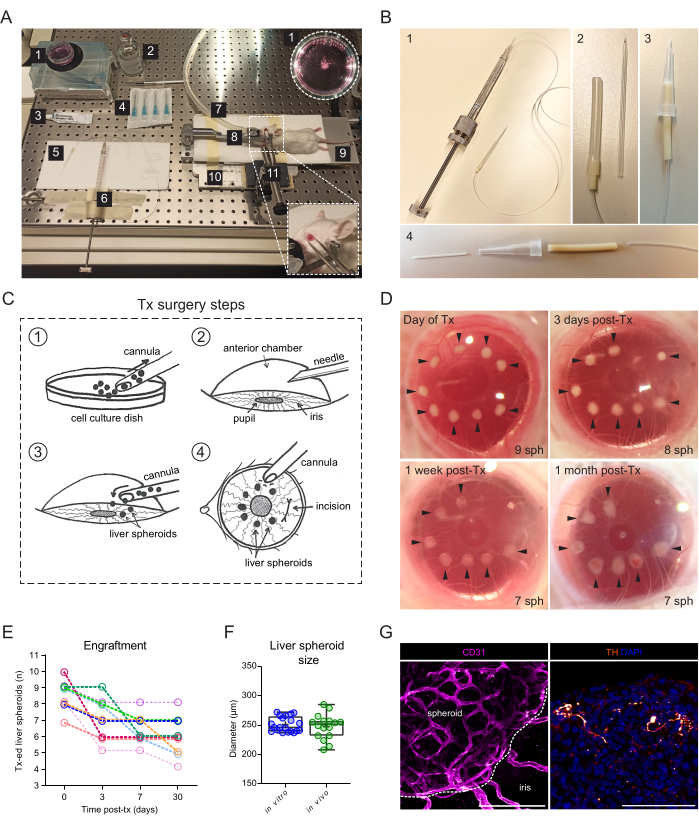
Рисунок 2: Трансплантация и приживление сфероидов печени в АПФ мышей. (A) Материалы и оборудование, используемые для трансплантации (Tx) сфероидов печени в АПФ: 1. Сфероиды печени в чашке для культивирования; 2. Стерильный физиологический раствор; 3. Глазная мазь; 4. Иглы 23 г; 5. Канюля; 6. Шприц Гамильтона; 7. Газовая трубка для анестезии; 8. Подголовник и противогаз; 9. Грелка; 10. Изготовленная на заказ металлическая опорная плита; 11. Щипцы и прочный карданный шарнир. (B) Установка канюли и шприца Гамильтона: 1. Стеклянная канюля, соединенная со шприцем Гамильтона с помощью трубки Portex и иглы 27G; 2. Стеклянная канюля соединена с трубкой Portex через дополнительные сегменты силиконовой трубки и трубки PharMed; 3. Пластиковая канюля в альтернативной сборке; 4. Детали, образующие пластиковую канюлю: пластиковый катетер BD Insyte 24 г, подключенный через трубку PharMed и заключенный в обрезной наконечник пипетки объемом 10 мкл для стабильности и захвата. (C) Иллюстрация этапов операции Tx: 1. Сфероиды собираются в канюлю; 2. Роговица прокалывается иглой; 3. Канюля вводится в разрез, а сфероиды высвобождаются в АПФ; 4. Снаружи глаза сфероиды расположены близко к зрачку и вдали от разреза. (D) Стереоскопические изображения сфероидов печени (sph) в глазу мыши в день операции и через 3, 7 и 30 дней после Tx. Стрелки указывают на жизнеспособные сфероиды. (E) Скорость приживления сфероида печени (размер 1200 клеток/лунка) после Tx, n = 9 глаз у 6 мышей-реципиентов. (F) Размер сфероидов печени в культуре до трансплантации (in vitro, n = 20 сфероидов из одного препарата) и через 1 месяц после приема в АПФ (in vivo, n = 16 сфероидов у 3 мышей-реципиентов), рассчитанный путем усреднения вертикального и горизонтального диаметров. (G) Иммунофлуоресцентное окрашивание привитых сфероидов печени через 2 месяца после передатчика, показывающее васкуляризацию (CD31, розовый, пунктирная линия очерчивает сфероидную массу) и симпатическую иннервацию (тирозингидроксилаза (TH), оранжевый), масштабная линейка = 100 мкм. Данные для панели F были адаптированы с разрешения Lazzeri-Barcelo et al.10. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
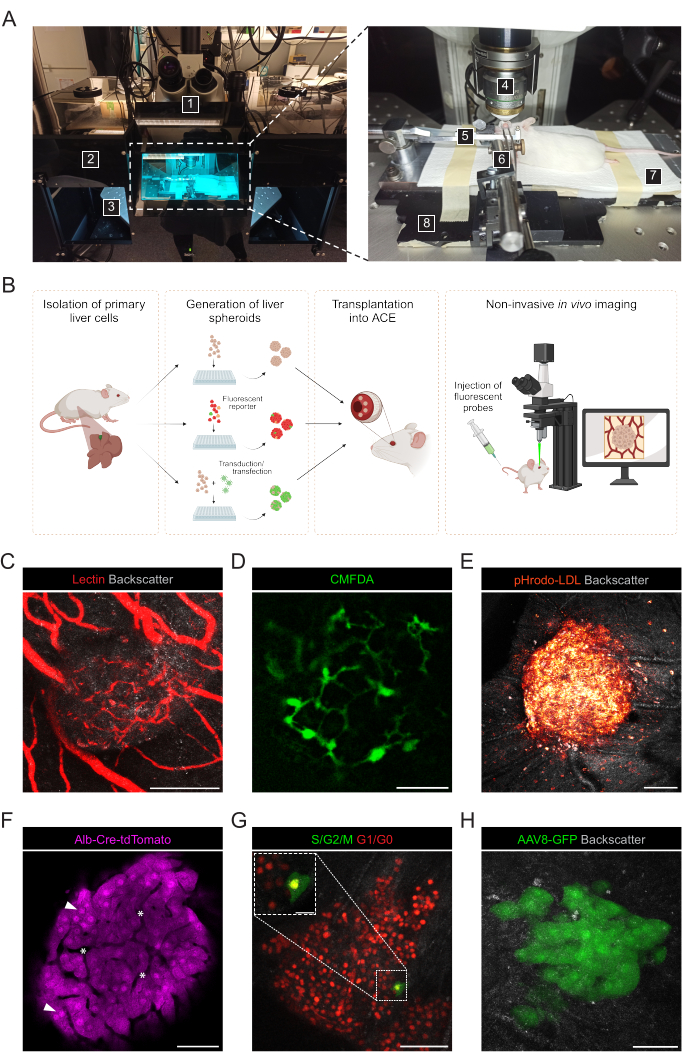
Рисунок 3: Неинвазивная интраокулярная визуализация in vivo привитых сфероидов печени. (A) Материал и оборудование, используемые для визуализации АПФ in vivo : 1. Вертикальный лазерный сканирующий конфокальный микроскоп; 2. Темный ящик; 3. Моторизованная ступень XYZ; 4. Цель погружения; 5. Подголовник и противогаз; 6. Щипцы и прочный карданный шарнир; 7. Грелка; 8. Изготовленная на заказ металлическая опорная плита. (B) Диаграмма, изображающая различные подходы, используемые для визуализации in vivo флуоресцентных показаний в сфероидах печени, привитых в глазу. (К-Н) Репрезентативные изображения сфероидов печени АПФ во время визуализации in vivo с помощью конфокальной микроскопии. Сигнал обратного рассеяния используется для наблюдения за объемом и структурой сфероида; (C) Кровеносные сосуды, помеченные внутривенной инъекцией флуоресцентного лектина, масштабная линейка = 100 мкм; (D) Желчно-канальная сеть, меченная инъекцией флуоресцентного CMFDA, масштабная линейка = 50 μм; (E) Поглощение ЛПНП путем инъекции флуоресцентного пХродо-ЛПНП-зонда, масштабная линейка = 100 мкм; (F) Td-томатоэкспрессирующие гепатоциты, стрелки обозначают ядра, звездочки указывают на внутрисфероидную сосудистую сеть, масштабная линейка = 50 мкм; (G) Мониторинг динамики клеточного цикла в сфероидах печени, экспрессирующих FUCCI, масштабные линейки = 50 мкм (основное изображение) и 20 мкм (увеличение). (H) сфероиды печени, трансдуцированные in vitro с помощью AAV8-GFP до Tx и визуализированные в глазу через 6 месяцев после Tx, масштабная линейка = 50 μm. Изображение на панели G было адаптировано с разрешения Lazzeri-Barcelo et al.10. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Растворы, используемые для выделения первичных гепатоцитов мыши. Состав растворов и буферов, необходимых для выделения гепатоцитов мыши. Компоненты буфера для разложения и раствора градиента следует смешивать свежими в день изоляции. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 2. Настройки конфокального микроскопа Leica SP5 используются для интраокулярной визуализации сфероидов печени in vivo. Таблица была адаптирована с разрешения Lazzeri et al.10. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
Этот протокол описывает новую платформу для интраокулярной визуализации in vivo сфероидов печени, привитых в АПФ. АПФ ранее использовался в качестве места трансплантации других микротканей, полученных из органов, таких как островки поджелудочной железы11,12, из-за его уникального микроокружения приживления, богатого сосудами, нервами и кислородом, а также доступа к визуализации через роговицу. В то время как прижизненная визуализация печени позволяет визуализировать клетки и процессы in situ, лонгитюдный мониторинг невозможен. Визуализация печени через брюшное окно влечет за собой сложную операцию, а движение органа в организме затрудняет отслеживание отдельных клеток с течением времени. Таким образом, этот новый метод визуализации позволяет проводить неинвазивный продольный мониторинг клеток печени с одноклеточным разрешением.
Этот протокол разделен на три части. Во-первых, это выделение первичных гепатоцитов с помощью двухступенчатой перфузии коллагеназы, адаптированной из Charni-Natan et al.13, с той разницей, что мы выполняем перфузию печени на мертвых мышах, а не на живых животных, находящихся под наркозом. Этот вариант дает определенные преимущества, такие как меньшее количество этических соображений и отсутствие остатков анестезии в организме. В этой работе мы получаем сфероиды печени из обогащенной гепатоцитами фракции выделения, но это не исключает возможности выделения других непаренхиматозных клеточных популяций с использованием других специализированных протоколов для создания сфероидов кокультуры разнообразного состава14,15.
Вторая часть этого протокола включает трансплантацию сфероидов печени в АПФ мышей-реципиентов. Это быстрая (менее 10 минут) и простая операция, выполняемая на мышах под наркозом и не требующая послеоперационного лечения. Прокол роговицы самозаживает и заживает в течение 3-5 дней. Иногда, в процессе заживления, вокруг разреза наблюдается некоторая дедовщина, но она проходит в течение нескольких дней. Мы не сталкивались со случаями передней синехии в глазах прооперированных животных. Мы проводим процедуры трансплантации в чистой, но открытой лаборатории и без проблем с инфекциями в прооперированных глазах. Инокуляция и приживление сфероидов в глазу не ставят под угрозу зрение и не изменяют поведение животного-реципиента. В этом протоколе мы используем изофлурановую анестезию как для трансплантационной операции, так и для визуализации in vivo , которая хорошо переносится мышами. Благодаря дозозависимому эффекту его можно легко регулировать на протяжении всей процедуры, что дает преимущество сокращения времени сна и пробуждения. Однако можно использовать альтернативные инъекционные анестетики. После трансплантации мы обычно даем 1 месяц, чтобы сфероиды полностью прижились, васкуляризировались и иннервировались, прежде чем проводить лечебные вмешательства и визуализацию in vivo . Мы также показали, что трансплантация и приживление возможны с использованием сфероидов печени человека и мышей-реципиентов с ослабленным иммунитетом10.
Третьей частью этого метода является визуализация in vivo привитых сфероидов печени в АПФ. Этот протокол описывает установку визуализации in vivo, в которой используется оборудование для микроскопии, обычно используемое в исследовательских центрах визуализации. Кроме того, специализированные материалы, такие как держатель головы мыши и пластиковая канюля, теперь коммерчески доступны. С помощью этой установки визуализации мы можем захватывать z-срезы и получать трехмерную реконструкцию архитектуры сфероида в зависимости от глубины проникновения лазера и обнаружения флуоресценции. Мониторинг клеточной функции в привитых сфероидах печени основан на визуализации флуоресцентных белков, которые сообщают о типах клеток, клеточных функциях и динамике. Таким образом, эта платформа визуализации может быть использована с использованием различных модальностей, по отдельности или в комбинации: (1) флуоресцентные зонды могут вводиться внутривенно, например, антитела для маркировки и отслеживания клеток, а также функциональные красители; (2) сфероиды печени могут быть получены из клеток, выделенных из моделей мышей-репортеров, которые экспрессируют специфичные для печени флуоресцентные белки, например, сфероиды печени FUCCI, которые сообщают о динамике клеточного цикла; (3) Образование сфероидов печени in vitro может сочетаться с трансфекцией или трансдукцией, чтобы оснастить сфероиды флуоресцентными белками и биосенсорами. Например, аденоассоциированные вирусы. В наших экспериментальных условиях и при использовании одного фотона для возбуждения глубина изображения, которую можно достичь, составляет примерно 60-100 мкм. Однако это зависит от мощности лазера и доступности многофотонной визуализации, характеристик излучения флуоресцентного зонда и чувствительности детекторов, а также угла глаза, в который привит сфероид. После получения изображений последующий анализ изображений может быть выполнен с помощью популярных программ, таких как Image J и Imaris. Например, в случае с репортером FUCCI активные клетки клеточного цикла, выделенные зеленым цветом, могут быть подсчитаны и сопоставлены с количеством общих эритроцитов для оценки активности клеточного цикла в привитом сфероиде. Кроме того, платформа ACE-imaging позволяет наносить вещества в глаз (в виде глазных капель) или вводить непосредственно в АПФ для обработки трансплантата и мониторинга его реакции. После вскрытия трансплантированные сфероиды могут быть легко извлечены с помощью ручной микродиссекции и могут предоставить ценную информацию с помощью методов ex vivo, таких как иммунофлуоресцентное окрашивание, транскриптомный анализ и т.д.10.
Эта методика имеет определенные ограничения. Во-первых, по нашему опыту, мыши-реципиенты должны быть альбиносами, т.е. иметь непигментированную радужную оболочку. При приживлении сфероиды печени покрываются монослоем клеток радужной оболочки, что не влияет на жизнеспособность или функцию сфероидов, но пигмент в клетках радужки препятствует визуализации. Вторым соображением является стабильность во время внутриглазной визуализации у мышей под наркозом. Во время сеансов визуализации in vivo необходимо тщательно контролировать концентрацию анестезии и дыхание животного, чтобы свести к минимуму движения. Тем не менее, используя указанные здесь настройки визуализации, мы можем получить изображение с высоким разрешением на уровне отдельных клеток.
Подводя итог, можно сказать, что этот протокол описывает реализацию неинвазивной платформы визуализации in vivo печеноподобной ткани, привитой в глаза мышей. Мы используем простые процедуры, обычное оборудование и доступные материалы, что делает этот подход доступным для многих исследователей. Эта модель сочетает в себе преимущества 3D-сфероидов печени in vitro с средой in vivo и оптической доступностью, обеспечиваемой ACE, чтобы создать ценную платформу для изучения физиологии и патологии печени в фундаментальных исследованиях и доклинических условиях.
Раскрытие информации
P-OB является соучредителем и генеральным директором Biocrine AB, IBL и BL являются консультантами Biocrine AB.
Благодарности
Эта работа была поддержана Шведской диабетической ассоциацией, фондами Каролинского института, Шведским исследовательским советом, Фондом Novo Nordisk, Фондом семьи Эрлинг-Перссон, Программой стратегических исследований диабета в Каролинском институте, Фондом семьи Кнут и Алисы Валленберг, Фондом Йонаса и Кристины аф Йохник, Шведской ассоциацией диабетологии и ERC-2018-AdG 834860-EYELETS. Рисунки фигур были созданы FL-B с использованием BioRender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| 27 G butterfly needle | Venofix | 4056388 | |
| AAV8-CAG-GFP | Charles River | CV17169-AV9 | Incubated with isolated hepatocytes at 1 µL/mL during liver spheroid formation |
| Absolute and 70% ethanol | N/A | N/A | |
| Absorbent pad | Attends | 203903 | |
| Albumin-Cre;RCL-tdTomato (B6.Cg-Speer6-ps1Tg(Alb-cre)21Mgn/J ; B6.Cg-Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J) | Jackson | #003574 and #007914 | Mice obtained from in-house breeding |
| B6 albino mice (B6(Cg)-Tyrc-2J/J) | Jackson | #000058 | Mice obtained from in-house breeding |
| B6;129P2-Gt(ROSA)26Sor[tm1(CAG-Venus/GMNN,-Cherry/CDT1)Jkn]/JknH | INFRAFRONTIER/EMMA | EM:08395 | Mice obtained from in-house breeding |
| BD Insyte IV Catheter 24 G x 0.75 in | BD Medical | 381212 | |
| Borosillicate standard glass cappilaries | World Precision Instruments | 1B150-4 | |
| Cell lifter | Corning | 3008 | |
| Cell strainer, 70 µm | Falcon | 352350 | |
| Custom-made metal plate | Hardware store | N/A | |
| Dexamethasone | Sigma-Aldrich | D4902 | |
| Dual-Stage Glass Micropipette Puller | Narshige | Model PC-100 | |
| EDTA | Sigma-Aldrich | E9884 | |
| Electric heating pad | Hardware store | N/A | |
| FBS | Gibco | N/A | |
| GlutaMAX | Gibco | 35050061 | |
| Green CMFDA | Abcam | ab145459 | Reconstituted in DMSO, administered at 100 µg/mouse in PBS 10% FBS |
| Hamilton syringe | Hamilton | 81242 | Model 1750 Luer Tip Threaded Plunger Syringe, 500 µL |
| HBSS; no calcium, no magnesium and no phenol red | Gibco | 14175095 | |
| HCX IRAPO L 25x/0.95 W objective | Leica | N/A | |
| HEPES | Gibco | 15630080 | |
| Induction chamber 0.8 L | Univentor | 8329001 | |
| Insulin-Transferrin-Selenium (ITS-G) | Gibco | 41400045 | |
| Isoflurane | Baxter | N/A | |
| Lectin DyLight-649 | Invitrogen | L32472 | Administered at 1 mg/mL and 100 µL/mouse |
| Liberase TM Research Grade | Sigma-Aldrich | 5401127001 | |
| Microelectrode beveler | World Precision Instruments | Model BV-10 | |
| Mouse head-holder and gas mask | Narshige | Model SGM-4 | |
| Nunclon Sphera 96-Well, U-Shaped-Bottom Microplate | Thermo Fisher | 174929 | |
| Oculentum simplex | APL | N/A | |
| PBS 10x | Gibco | 14080055 | |
| PBS 1x; no calcium, no magnesium | Gibco | 14190144 | |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Percoll | Sigma-Aldrich | P1644 | |
| Peristaltic pump | Ismatec | Model ISM795 | |
| PharMed BPT Pump Tubing | VWR | VERN070540-07 | Inner diameter 0.76 mm, outer diameter 2.46 mm |
| pHrodo Red-LDL | Invitrogen | L34356 | Administered at 1 mg/mL and 100 µL/mouse |
| Portex Fine Bore Polyethylene Tubing | Smiths Medical | 800/100/140 | Inner diameter 0.4 mm, outer diameter 0.8 mm |
| Silicone dissection mat | Hardware store | N/A | |
| Sodium chloride 0.9% | Braun | N/A | |
| Solid Universal Joint | Narshige | Model UST-2 | |
| Stereomicroscope | Leica | Model M80 | |
| Suspension culture dish 35 mm | Sarstedt | 833900500 | |
| Temgesic | Indivor | N/A | Administered s.c. at 0.05 mg/mL and 2 µL/g mouse |
| Translucent Silicone Tubing | VWR | 228-1450 | Inner diameter 1.5 mm, outer diameter 3 mm |
| Trypan Blue | Sigma-Aldrich | T8154 | |
| Univentor 400 Anesthesia unit | Univentor | 8323001 | |
| Upright laser scanning confocal microscope | Leica | Model TCS SP5 II | |
| Viscotears | Novartis | N/A | |
| William's E Medium; no glutamine, phenol red | Gibco | 22551089 |
Ссылки
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Sci Rep. 6, 25187(2016).
- Lauschke, V. M., et al. Massive rearrangements of cellular MicroRNA signatures are key drivers of hepatocyte dedifferentiation. Hepatology. 64 (5), 1743-1756 (2016).
- Oliva-Vilarnau, N., Vorrink, S. U., Ingelman-Sundberg, M., Lauschke, V. M. A 3D cell culture model identifies Wnt/beta-catenin mediated inhibition of p53 as a critical step during human hepatocyte regeneration. Adv Sci (Weinh). 7 (15), 2000248(2020).
- Hurrell, T., et al. Human liver spheroids as a model to study aetiology and treatment of hepatic fibrosis. Cells. 9 (4), 964(2020).
- Kozyra, M., et al. Human hepatic 3D spheroids as a model for steatosis and insulin resistance. Sci Rep. 8 (1), 14297(2018).
- Lauschke, V. M., Shafagh, R. Z., Hendriks, D. F. G., Ingelman-Sundberg, M. 3D primary hepatocyte culture systems for analyses of liver diseases, drug metabolism, and toxicity: Emerging culture paradigms and applications. Biotechnol J. 14 (7), e1800347(2019).
- Shibuya, K., et al. The efficacy of the hepatocyte spheroids for hepatocyte transplantation. Cell Transplant. 30, 9636897211000014(2021).
- Hamazaki, K., Doi, Y., Koide, N. Microencapsulated multicellular spheroid of rat hepatocytes transplanted intraperitoneally after 90% hepatectomy. Hepatogastroenterology. 49 (48), 1514-1516 (2002).
- Marques, P. E., et al. Imaging liver biology in vivo using conventional confocal microscopy. Nat Protoc. 10 (2), 258-268 (2015).
- Lazzeri-Barcelo, F., et al. Intraocular liver spheroids for noninvasive high-resolution in vivo monitoring of liver cell function. Nat Commun. 15 (1), 767(2024).
- Speier, S., et al. Noninvasive in vivo imaging of pancreatic islet cell biology. Nat Med. 14 (5), 574-578 (2008).
- Leibiger, I. B., Berggren, P. O. Intraocular in vivo imaging of pancreatic islet cell physiology/pathology. Mol Metab. 6 (9), 1002-1009 (2017).
- Charni-Natan, M., Goldstein, I. Protocol for Primary Mouse Hepatocyte Isolation. STAR protocols. 1 (2), 100086(2020).
- Baze, A., et al. Three-dimensional spheroid primary human hepatocytes in monoculture and coculture with nonparenchymal cells. Tissue Eng Part C Methods. 24 (9), 534-545 (2018).
- Mohar, I., Brempelis, K. J., Murray, S. A., Ebrahimkhani, M. R., Crispe, I. N. Isolation of nonparenchymal cells from the mouse liver. Methods Mol Biol. 1325, 3-17 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены