Method Article
Fare gözünün ön kamarasına aşılanmış karaciğer sferoidlerinin in vivo görüntülenmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, fare gözünün ön kamarasına aşılanmış karaciğer sferoidlerinin noninvaziv in vivo görüntülemesine izin veren bir platformu tarif ediyoruz. İş akışı, birincil karaciğer hücrelerinden sferoidlerin üretilmesinden fare gözüne transplantasyona ve konfokal mikroskopi ile hücresel çözünürlükte in vivo görüntülemeye kadar uzanır.
Özet
Memelilerde karaciğer ile ilgili biyomedikal çalışmalar, hücresel çözünürlükte in vivo noninvaziv uzunlamasına görüntüleme yöntemlerinin eksikliği nedeniyle engellenmektedir. Şimdiye kadar, karaciğerin yerinde optik görüntülemesi, hücresel düzeyde yüksek çözünürlüklü görüntüleme sunan ancak birden çok kez ve dolayısıyla aynı hayvanda uzunlamasına gerçekleştirilemeyen intravital görüntüleme ile mümkündü. Biyolüminesans gibi invaziv olmayan görüntüleme yöntemleri, aynı hayvan üzerinde tekrarlanan görüntüleme seanslarına izin verir, ancak hücre çözünürlüğü elde etmez. Bu metodoloji boşluğunu gidermek için, fare gözünün ön kamarasına aşılanmış karaciğer sferoidlerinin noninvaziv in vivo görüntülemesi için bir platform geliştirdik. Bu çalışmada açıklanan iş akışında, birincil fare karaciğer sferoidleri in vitro olarak üretilir ve alıcı farelerin gözünün ön odasına nakledilir ve burada iris üzerine aşılanırlar. Kornea, konvansiyonel konfokal mikroskopi ile aşılanmış sferoidleri görüntüleyebileceğimiz doğal bir vücut penceresi görevi görür. Sferoidler gözde aylarca hayatta kalır, bu süre zarfında hücreler sağlık ve hastalık bağlamlarında incelenebilir ve uygun floresan problar kullanılarak tekrarlanan görüntüleme seansları boyunca farklı uyaranlara yanıt olarak izlenebilir. Bu protokolde, bu görüntüleme sistemini uygulamak için gerekli adımların bir dökümünü sunuyor ve potansiyelinden en iyi şekilde nasıl yararlanılacağını açıklıyoruz.
Giriş
Memelilerde sağlık ve hastalık sırasında karaciğer fonksiyonunun izlenmesi, yüksek çözünürlüklü, noninvaziv in vivo görüntüleme tekniklerinin eksikliği nedeniyle sınırlıdır. Bu organın görselleştirilmesi, erişilemeyen konumu tarafından engellenir ve hücresel süreçleri bir araya getirmek için, in vivo çalışmalar, farklı zaman noktalarında hayvanların kurban edilmesine dayanır. Bu görüntüleme sınırlamasını aşmak için, birçok çalışma, karaciğer benzeri mikro dokuların kontrollü bir ortamda görselleştirildiği ve incelendiği in vitro modellere dayanır.
Son yıllarda, karaciğer sferoidleri gibi üç boyutlu kültür sistemlerinin geliştirilmesi, karaciğer araştırmalarına yardımcı olmuş ve ilerletmiştir. Karaciğer sferoidleri, karaciğer dokusunun mikro çevresini ve karmaşık hücre-hücre etkileşimlerini bir dereceye kadar taklit eden çok hücreli agregatlardır1 ve geleneksel tek katmanlı kültürlere göre açık avantajlar sunar 2,3. Karaciğer sferoidleri ayrıca farklı karaciğer hastalıkları için model olarak kullanılmaktadır 4,5,6 ve hastalık mekanizmalarını anlamada etkili olmuştur. Yine de, mevcut in vitro karaciğer modellerinin temel sınırlamaları, fizyolojik bir in vivo ortamın olmaması ve kültürde sınırlı kullanım süresidir (yaklaşık 20 gün)3. Karaciğer sferoidleri daha önce in vivo olarak, optik görüntüleme için erişilemeyen böbrek kapsülü7 veya intraperitoneal8 gibi farklı bölgelere nakledilmiştir. İntravital karaciğer görüntüleme, hücre çözünürlüğünde gerçek zamanlı görüntüleme sunan son teknoloji bir tekniktir. Şu anda, bu in situ karaciğer görüntülemesi yalnızca oldukça invaziv ve sıklıkla terminal9 olan dış organda mümkündür. Abdominal bir pencerenin takılması, tekrarlanan karaciğer görüntüleme seanslarına izin verse de, karmaşık cerrahi ve bakım sonrası bakım gerektirir.
Hücresel çözünürlükte uzunlamasına izleme yapmak için, karaciğer sferoidlerinin, karaciğer benzeri dokunun fizyolojik bir ortamda aşılandığı, vücut uyaranlarına bağlı olduğu ve optik görüntüleme için erişilebilir olduğu farelerin gözün ön odasına (ACE) naklini araştırdık. Kornea şeffaf bir dokudur ve iris üzerine aşılanan mikro dokuların konfokal mikroskopi ile non-invaziv ve uzunlamasına görüntülenebildiği bir pencere görevi görür. Burada, karaciğer sferoidlerinin 10 in vivo görüntülenmesi için bu yeni geliştirilen platformun bir iş akışını sunuyoruz. Bu protokol, (1) birincil fare karaciğer hücrelerinin ekstraksiyonu ve karaciğer sferoidlerinin in vitro oluşumu, (2) karaciğer sferoidlerinin alıcı farelerin ACE'sine nakli ve (3) anestezi uygulanmış farelerde aşılanmış karaciğer sferoidlerinin in vivo görüntülenmesi. Ayrıca, bu görüntüleme platformunun bazı olanaklarını ve uygulamalarını sergileyeceğiz.
Protokol
Hayvanlar üzerinde yapılan tüm işlemler Karolinska Enstitüsü'ndeki Hayvan Deneyleri Etik Kurulu tarafından onaylandı.
1. Birincil fare karaciğer hücrelerinin ekstraksiyonu ve in vitro karaciğer sferoidlerinin üretilmesi
- Hazırlık
- Kanülasyon, karaciğer rezeksiyonu ve birincil karaciğer hücrelerinin izolasyonu için, serolojik pipetlere ve santrifüj tüplerine ek olarak aşağıdaki steril veya tek kullanımlık malzemeleri hazırlayın (Şekil 1A): peristaltik pompa, döner kovalı santrifüj, emici ped, diseksiyon matı, iki kavisli uçlu forseps, cerrahi makas, bir adet 27 G kelebek iğne, bir adet 70 μm hücre süzgeci, bir adet hücre kaldırıcı, bir adet 100 mm Petri kabı, hücre sayma odası ve 96 Kuyulu, U şeklinde tabanlı mikroplakalar.
- Karaciğer perfüzyonunda, primer karaciğer hücrelerinin izolasyonunda ve karaciğer sferoidlerinin oluşturulmasında kullanılan solüsyonları Tablo 1'de listelendiği gibi hazırlayın.
NOT: Sindirim tamponu ve Gradyan çözeltisi taze olarak hazırlanmalıdır. - 42 °C su banyosundan karaciğere solüsyon ileten peristaltik bir pompadan oluşan perfüzyon sistemini kurun (Şekil 1A). Su banyosunun daha yüksek sıcaklığı, tamponların karaciğere 37 ° C'lik optimum sıcaklıkta ulaşmasını sağlar. Bunu tüp uzunluğuna ve oda sıcaklığına (RT) bağlı olarak özelleştirin.
- Kanülasyon için tüpün ucuna 27 G'lık bir kelebek iğne takın. Son izolasyon adımlarında kullanılan kaplama ortamını 4 °C'de tutun.
- Prosedür
- Aşağıdaki çözeltileri 42 ° C'lik su banyosunda 50 mL santrifüj tüplerinde önceden ısıtın: 40 mL PBS, 20 mL perfüzyon tamponu ve 12 mL sindirim tamponu.
- Pompa borularını temizlemek ve ısıtmak için, önceden ısıtılmış PBS'den yaklaşık 20 mL dolaştırın.
- Tüpü perfüzyon tamponuna değiştirin, tüpü ve kelebek iğneyi astarlayın ve akış hızını 4 mL / dk'ya ayarlayın. Protokol boyunca tampon değişiklikleri sırasında boruda kabarcık olmadığından emin olun.
- Fareyi servikal çıkık ile ötenazi yapın ve uzuvları diseksiyon tahtasına sabitlemek için iğneler kullanın.
- Karın kürkünü% 70 etanol ile ıslatın ve sindirim organlarına erişmek için inceleyin.
- Portal ven ve inferior vena kava'yı ortaya çıkarmak için bağırsakları sağa hareket ettirin (Şekil 1B).
- İğne yatay konumdayken vena kava'yı uzunluğunun yaklaşık yarısında kanüle edin, sabit olduğundan emin olun ve pompayı çalıştırın.
- Karaciğer şişmeye başladığında veya daha yakın loblarda beyaz noktalar göründüğünde, kanın ve perfüzyon tamponunun dışarı akmasını sağlamak için portal veni kesin.
- Karaciğer hemen ağartmaya başlamalıdır. Portal veni 5 s aralıklarla klemplemek için kavisli forseps kullanarak temizlemeyi teşvik edin.
- Karaciğer sarı olana ve kandan temizlenene kadar (yaklaşık 15-20 mL perfüzyon tamponu) adım 1.2.9'u tekrarlayın.
- Hortumu sindirim tamponuna değiştirmek için peristaltik pompayı durdurun ve pompayı yeniden başlatın. Sindirim tamponu karaciğere ulaştığında, akış hızını 2,5 mL / dk'ya düşürün.
NOT: Sindirim tamponundaki fenol kırmızısı, karaciğere gelişini ayırt etmeye izin verir ve tedavi sırasında pompa parametrelerinin ayarlanmasını sağlar. - Tamponun tüm karaciğer loblarına ulaşmasını teşvik etmek ve uygun sindirimi sağlamak için adım 1.2.9'u birkaç kez tekrarlayın.
- Sindirim tamponu tükendiğinde veya karaciğer yeterince sindirilmiş göründüğünde peristaltik pompanın akışını durdurun.
NOT: Sindirim derecesi, karaciğer loblarını forseps ile nazikçe sıkıştırarak ve doku üzerinde küçük izler olup olmadığını kontrol ederek görsel olarak izlenebilir. Karaciğer de dayanıksız hale gelecektir. - Karaciğeri çıkarmak için, karın boşluğu içindeki karaciğer bağlarını ve bağlantılarını kesin, tamamen çıkarmayı hedefleyin ve 10 mL soğuk kaplama ortamı içeren Petri kabına yerleştirin (Tablo 1).
- Safra kesesini çıkardıktan sonra, hepatik kapsülü hafifçe yırtarak forseps kullanarak loblar üzerinde küçük tutamlar yapın. Karaciğeri tabakta sallayarak, hücrelerin ortama döküldüğünü gözlemleyin.
- Karaciğeri forseps ile sabit tutarak, hücreleri serbest bırakmak için hücre kaldırıcıyı loblar boyunca yavaşça sürükleyin.
NOT: Doğru interlobüler sindirim, doku parçalarında değil, ortamda hücre süspansiyonuna yol açacaktır. - Serolojik bir pipet kullanarak, hücre süspansiyonunu Petri kabından toplayın ve 50 mL'lik bir santrifüj tüpüne yerleştirilmiş 70 μm hücre süzgecinden süzün. Sindirilmiş karaciğer hücrelerinin kabını yıkamak ve bunları filtreye aktarmak için taze kaplama ortamı kullanın.
- Hücreleri peletlemek için 50 ° C'de 5 dakika boyunca 4 x g'da santrifüjleyin.
- Hücre peletini kaplamak için yaklaşık 1 mL bırakarak süpernatanı çıkarın, hücreleri yeniden süspanse etmek için tüpü döndürün ve ardından yavaş yavaş 10 mL soğuk kaplama ortamı ekleyin.
- 10 mL gradyan çözeltisini hücre süspansiyonuna ekleyin ve tüpü 10 kez hafifçe ters çevirin.
- 4 ° C'de 10 dakika boyunca 200 x g'da santrifüjleyin.
- Pelet, hepatositler için zenginleştirilmiş canlı karaciğer hücreleri içerirken, süpernatant ölü hücreler ve döküntüler içerir. Süpernatanı serolojik bir pipet kullanarak, yaklaşık 1 mL bırakarak atın ve peleti hafifçe döndürerek yeniden süspanse edin.
- Hücre süspansiyonuna 20 mL soğuk kaplama ortamı ekleyin ve gradyan çözeltisini yıkamak için 4 ° C'de 5 dakika boyunca 50 x g'da santrifüjleyin.
- Peletin üzerinde yaklaşık 1 mL bırakarak süpernatanı çıkarın ve hücreleri 20 mL soğuk kaplama ortamında yeniden süspanse edin.
NOT: Burada, hücre peleti sıkıştırılabilir, bu nedenle gerekirse, hücreleri nazikçe ayırmak için 10 mL'lik bir serolojik pipet kullanın. - Bir hücre sayma odası ve Tripan Blue kullanarak hücre sayısını ve canlılığını manuel olarak belirleyin.
NOT: Hepatosit hücreleri tüpte hızla çökelir; Bunları yeniden askıya almak için tüpü birkaç kez hafifçe ters çevirin. - Karaciğer hücrelerini 200 μL / kuyu kaplama ortamında 1200 hücre / kuyuda 96 oyuklu ultra düşük yapışma plakalarına tohumlayın.
NOT: Oyuk başına en uygun ortam hacmi 200 μL'dir; bununla birlikte, hücreleri 100 μL / kuyuda tohumlamak mümkündür. - Hücreleri kuyucukların merkezinde toplamak için plakaları 200 x g'da 3 dakika döndürün.
- Hücreleri inkübe edin (37 °C, %5 CO2) ve 5 gün boyunca doğal olarak sferoid oluşturmaya bırakın (Şekil 1C).
- 5. günde, kuyudaki ortamın yarısını dikkatlice çıkarın ve serumsuz bakım ortamıyla değiştirin (Tablo 1). Karaciğer sferoidlerinin nakledilmeye hazır olduğu 10. güne kadar her 48 saatte bir bu adımı tekrarlayın.
NOT: Kültürlenmiş karaciğer sferoidlerinde kapsül benzeri bir yapının oluşumu, iyi bir agregasyon ve canlılık gösterir.
2. Karaciğer sferoidlerinin gözün ön kamarasına nakli (ACE)
- Hazırlık
- Karaciğer sferoidlerinin ACE'ye nakli için aşağıdaki kaynakları düzenlediğinizden emin olun (Şekil 2A): stereomikroskop, izofluran anestezi ünitesi, indüksiyon odası, izofluran, ısıtma yastığı, ısmarlama metal taban plakası, fare kafası tutucusu ve gaz maskesi, katı üniversal mafsala bağlı forseps, Hamilton 500 μL dişli dalgıç şırınga, silikon, polietilen ve pompa boruları, ısmarlama künt cam kanül veya 24 G kateter, etanol %70, steril tuzlu su, steril 23 G iğneler, göz merhemi (1:1 oranında sıvı parafin ve vazelin), tek kullanımlık 1 mL şırınga ve hücre süspansiyon kabı 35 mm.
- Hamilton şırıngasını, hortumunu ve kanülünü %70 etanol ve tuzlu su geçirerek temizleyin.
- Hamilton şırıngasını, hortumunu ve cam kanülünü tuzlu su ile doldurun ve Hamilton şırıngasını bantla yatay konumda tezgaha sabitleyin (Şekil 2A).
- Özel yapım künt bir cam kanül kullanın.
- Kürelerin aspirasyonuna izin vermek için çift kademeli bir mikropipet çektirme kullanarak bir borosilikat cam kılcal damarı >300 μm'lik bir iç çapa kadar uzatın.
- Bir mikroelektrot çevirici kullanarak ucu eğin ve köreltin ve kenarları yumuşatmak için kanül ucunu birkaç saniye aleve maruz bırakın.
NOT: Mikroelektrot düzenleyici, manuel olarak çalıştırılan dönen bir zımpara taşından oluşur; bu nedenle, belirli ayarlar geçerli değildir.
- Alternatif olarak, 24 G'lik bir kateterin plastik kısmını kullanarak bir kanül oluşturun (Şekil 2B).
- Anestezi izofluran ünitesini hazırlayın ve ısıtma yastığını 37 °C'ye ısıtın.
- Katı üniversal bağlantıya tutturulmuş forsepslerin uçlarını, gözü stabilize etmeye yardımcı olan bir halka oluşturmak için bir parça polietilen boru ile örtün.
- Karaciğer sferoidlerini 96 oyuklu plakadan bir pipet ve 200 μL uç kullanarak bakım ortamıyla birlikte 35 mm'lik bir hücre süspansiyon kabına aktarın.
- Prosedür
- % 2.5 izofluran ve 280 mL / dak hava dozu kullanarak fareyi indüksiyon odasında uyuşturun.
- Fare bilinçsiz olduğunda, anesteziyi% 1.8 izofluran ve 280 mL / dak havaya düşürün, anestezi tüpünü baş tutucuya bağlayın ve burnu baş tutucunun içine yerleştirerek hayvanı hızlı bir şekilde ısıtma yastığına aktarın.
- Kafayı vidalarla hareketsiz hale getirin, gözü yavaşça soketten çıkarın ve forseps ile sabitleyin ve kurumasını önlemek için her iki göze bir damla tuzlu su damlatın.
- Stereoskopun altında, karaciğer sferoidlerini kanülün ucuna aspire etmek ve toplamak için Hamilton şırıngasını kullanın ve temiz bir yüzeyde yatay olarak dinlenmeye bırakın.
NOT: Karaciğer sferoidleri ile birlikte aspire edilmesi, kanül duvarlarına yapışmalarını önlemeye yardımcı olur. - 23 G'lik bir iğne kullanarak korneayı dikkatlice delin ve sızan sulu mizahı bir mendille kurulayın. Gerekirse, kesiği daha geniş hale getirmek için, korneayı dilimlemek için iğneyi dikkatlice yana doğru kaydırın.
NOT: Kornea ponksiyonunu gerçekleştirmek için tek kullanımlık steril bir iğne kullanılır, bu nedenle kornea insizyondan önce dezenfekte edilmez. - Kurumasını önlemek için göze tuzlu su damlaları ekleyin.
- Karaciğer sferoidlerini içeren kanülü alın ve sferoidlerin kanülün ucuna doğru çekilmesini sağlamak için dikey olarak tutun.
- Kanülü yavaşça deliğe yerleştirin ve eğim göz bebeğine doğru yönlendirilmiş durumdayken, karaciğer sferoidlerini yavaşça ACE'ye atmak için Hamilton şırıngasını kullanın (Şekil 2C).
NOT: Kanülü çıkarmadan önce, gözün içindeki ve dışındaki sıvı basınçlarının yeniden ayarlanması için birkaç saniye beklenmesi ve sferoidlerin gözden geri kaçmasını önlemeniz önerilir. - Korneanın dışından, kanülün ucuyla korneayı nazikçe iterek karaciğer sferoidlerini göz bebeğinin etrafına ve insizyondan uzağa yerleştirin (Şekil 2C).
- Gözü forsepsten serbest bırakmadan önce karaciğer sferoidlerinin iris üzerine yerleşmesi için ~ 5-10 dakika bekleyin.
- Ameliyat edilen göze vazelin göz merhemi sürün, bu da korneanın kayganlaşmasına ve iyileşmesine yardımcı olur.
- İstenirse, aynı yöntemi izleyerek ikinci gözü de çalıştırmaya devam edin.
- Fareyi uyandırmadan önce, ameliyat sonrası rahatsızlığı önlemek için bir analjezik uygulayın, örneğin, deri altından uygulanan steril salin içinde 0.1 mg / kg buprenorfin.
NOT: Farelere sadece bir doz analjezik uygulandı, çünkü bu küçük prosedürden hızlı bir şekilde iyileştiler ve herhangi bir ağrı veya davranış değişikliği belirtisi göstermediler. Bu prosedür çok hızlı olduğundan (10 dakikadan az sürer) ve sadece küçük bir rahatsızlığa neden olduğundan, fareler, hayvanı uyandırmadan önce uygulanan ameliyat sonrası analjezi dışında ameliyat sonrası bakıma ihtiyaç duymaz.
3. ACE'de aşılanmış karaciğer sferoidlerinin in vivo görüntülenmesi
- Hazırlık
- ACE'de aşılanmış karaciğer sferoidlerinin noninvaziv in vivo görüntülemesi için aşağıdaki malzemeleri ve aletleri hazırlayın (Şekil 3A): dik konfokal mikroskop, uzun çalışma mesafeli su daldırma objektifi, izofluran anestezi ünitesi, indüksiyon odası, izofluran, ısıtma yastığı, ısmarlama metal taban plakası, fare kafası tutucusu ve gaz maskesi, katı üniversal ekleme bağlı forseps, yapay gözyaşı jeli, göz merhemi (1:1 oranında sıvı parafin ve vazelin).
- İsteğe bağlı malzemeler arasında enjekte edilebilir floresan problar, tek kullanımlık şırıngalar ve kuyruk intravenöz enjeksiyonu için 27 G iğneler bulunur.
- Prosedür
- % 2.5 izofluran ve 280 mL / dak hava dozu kullanarak fareyi indüksiyon odasında uyuşturun.
- Fare bilinçsiz olduğunda, anesteziyi% 1.8 izofluran ve 280 mL / dak havaya düşürün, anestezi tüpünü baş tutucuya bağlayın ve burnu baş tutucunun içine yerleştirerek hayvanı hızlı bir şekilde ısıtma yastığına aktarın.
- Vidaları kullanarak kafayı kafa tutucuda hareketsiz hale getirin.
- Kurumasını önlemek için her iki gözünüze bir damla suni gözyaşı jeli damlatın.
- Bu noktada, kuyruk damarından intravenöz olarak floresan problar enjekte edin ve hemen ardından görüntü alın.
- Başı eğin, gözü yavaşça yuvadan çıkarın ve forseps ile sabitleyin ve hedefin altındaki yerine yerleştirin.
- Kornea ile objektif arasındaki boşluğu doldurmak için bol miktarda suni gözyaşı jeli uygulayın ve göz merceği aracılığıyla karaciğer sferoidlerine odaklanın.
NOT: Mümkünse, büyütülmemiş görüş elde etmek ve iris üzerindeki sferoidleri daha kolay bulmak için oküler çubuklardan birinin göz merceğini çıkarın. - Hayvanın solunum hareketlerine rağmen yüksek çözünürlüklü görüntüleme elde etmek için 25x objektif ve aşağıdaki görüntüleme ayarlarını kullanın: 512 x 512 piksel format, 600 Hz tarama hızı ve 3 μm Z yığını kalınlığı. Tablo 2'deki ayrıntılı görüntüleme ayarlarına bakın.
NOT: Görüntüleme boyunca, sığ, kontrollü bir solunum ritmi elde etmek ve böylece hayvanın hareketini en aza indirmek için anestezi konsantrasyonu 1.6-2.2 mL / s izofluran arasında ayarlanır. - Görüntüleme seansının sonunda, izofluranı çıkarmadan ve hayvanı uyandırmadan önce görüntülenen gözleri vazelin göz merhemi ile tedavi edin.
Sonuçlar
Hepatositler için zenginleştirilmiş primer karaciğer hücreleri, tüm hücrelere ayrışma enzimleri iletmek için organın damar sisteminden yararlanarak, karaciğer boyunca sıcak tamponları dolaştırmak için peristaltik bir pompa kullanılarak iki aşamalı kollajenaz perfüzyonu ile fare karaciğerinden izole edildi (Şekil 1A). Bunun için inferior vena kava kanüle edildi ve portal ven kesilerek tamponların geçişine izin verildi (Şekil 1B). İlk olarak, kanı temizlemek için HBSS bazlı bir tampon karaciğerden akıtıldı. Kanülasyon başarılı olursa ve kan pıhtılaşması yoksa, karaciğer birkaç saniye içinde beyazlar ve sararır. İkinci olarak, Liberaz enzim karışımını içeren bir Sindirim tamponu, dokuyu tek hücreli bir süspansiyona ayırmak için karaciğer boyunca dolaştırıldı. Hücreler manuel olarak sayıldı ve 96 oyuklu ultra düşük yapışmalı (ULA) plakalara tohumlandı, bu da birkaç gün içinde sferoidlere kendi kendine montajı mümkün kıldı. 5. günde, sferoidler oluşur ve sferoidleri çevreleyen ince kapsül, başarılı agregasyonu gösterir (Şekil 1C). Nakil için 10. güne kadar bekliyoruz, bu noktada sferoidler kompakttır ve güçlü hücre-hücre bağlantıları geliştirmiştir. Kuyu başına tohumlanan hücre sayısı, karaciğer sferoidinin boyutunu belirlemiş olup, 1000, 1200 ve 1500 hücre/kuyu sırasıyla 238 μm ± 10 μm, 248 μm ± 17 μm ve 298 μm ± 19 μm (ortalama ± SD) çaplarında sferoidler vermiştir (Şekil 1C,D). Transplantasyon için, aşağıdaki nedenlerden dolayı yaklaşık 250 μm çapında sferoidleri seçiyoruz: (1) sferoidlerin boyutu hipoksi ve nekrotik çekirdekten kaçınmak için çok büyük olmamalı, ancak hücre-hücre iletişimini desteklemek ve gözde greft yeniden şekillenmesine izin vermek için yeterli hücre içermelidir, (2) bu boyuttaki sferoidlerin ağırlığı, irise doğru çekilmelerine ve aşılanmalarını iyileştirmelerine izin verir, (3) Bu boyut, fare gözü başına 5-10 sferoidin nakli ile ilgili olarak uygundur.
Transplantasyon ameliyatı, bir cam kanüle bağlı manuel dişli bir şırınga gerektirir (Şekil 2A). Cam kanül, bir mikropipet çektirme ve beveler kullanılarak ince bir künt uca sahip olacak şekilde şirket içinde modifiye edilmiş bir borosilikat cam kılcaldan oluşur. Şırınga hortumuna bağlı ve bir pipet ucunda stabilize edilmiş, ticari olarak temin edilebilen bir plastik kateter kullanılarak daha basit bir alternatif kanül oluşturulabilir (Şekil 2B). Cerrahi, korneadaki bir kesi yoluyla karaciğer sferoidlerinin ACE'ye aşılanmasından oluşur (Şekil 2C). Sferoidler, görüntüleme için daha erişilebilir hale getirmek ve oküler açıya hareket etmelerini önlemek için göz bebeğinin sınırlarına yerleştirildi. Albino fareler, pigmentli olmayan irisleri, aşılanmış karaciğer sferoidlerinin in vivo görüntülenmesine izin verdiği için transplantasyon için kullanıldı. Alıcı fareler her iki göze 7-10 sferoid/göz ile nakledildi ve kornea iyileşmesini ve sferoid engraftman başarısını belgelemek için transplantasyondan 3 gün sonra (Tx sonrası) ve Tx'ten 1 hafta ve 1 ay sonra stereoskopik görüntüler alındı (Şekil 2D). Dikkat çekici bir şekilde, ACE'deki karaciğer sferoidlerinin görünümündeki değişiklik, taze nakledildiği ve tamamen aşılandığı zaman arasında, greftin iris üzerine yerleşmesinin yanı sıra, sferoid üzerinde tek bir iris hücresi tabakasının büyümesinden kaynaklanmaktadır. ACE'deki karaciğer sferoidlerinin aşılama başarı oranı %70'tir (hem erkek hem de dişi farelerde n = 9 göz) (Şekil 2E). Tx'ten sonraki ilk günler, muhtemelen alıcı hayvanın gözlerini ovuşturması ve kornea iyileşmeden önce sferoidleri yerinden çıkarması nedeniyle hayatta kalma ve aşılama için en kritik olanlardır. Karaciğer sferoidlerinin boyutu Tx sonrası önemli ölçüde farklılık göstermez ve şekil değişiklikleri greft yeniden şekillenmesi ve aşılamaya bağlanır (Şekil 2F). Tx'ten 1 ay sonra, iris üzerinde bulunan tüm aşılanmış sferoidler, immünofloresan boyama ile gösterildiği gibi vaskülarize edildi ve innerve edildi (Şekil 2G).
Noninvaziv in vivo görüntüleme, anestezi uygulanmış alıcı farelerde dik konfokal mikroskop ve uzun mesafeli daldırma objektifi kullanılarak gerçekleştirilir (Şekil 3A, Tablo 2). ACE'deki floresan görüntüleme, Şekil 3B'de gösterildiği gibi farklı yaklaşımlarla elde edilebilir. Floresan probların alıcı farenin dolaşımına enjekte edilmesi, sferoidler içindeki farklı hücre tiplerinin ve yapılarının görselleştirilmesini sağlar. Kan damarlarını işaretlemek için lektin (Şekil 3C), safra kanalikülleri ağını gözlemlemek için CMFDA (Şekil 3D) ve sferoid hücrelere aktif LDL alımını doğrulayan pHrodo-LDL (Şekil 3E) kullandık. Raportör fare modellerinden üretilen karaciğer sferoidleri de kullanılabilir. Albümin-Cre:tdDomates sferoidleri, hepatositlerin etiketlenmesine ve izlenmesine izin verdi (Şekil 3F) ve Floresan Ubikitin Hücre Döngüsü Göstergesi (FUCCI) biyosensörünü ifade eden sferoidler, hücre döngüsü dinamiklerini tek hücre çözünürlüğünde görselleştirmek için kullanıldı (Şekil 3G). Son olarak, karaciğer sferoidleri transplantasyondan önce in vitro olarak genetik olarak modifiye edilebilir ve adeno-ilişkili virüs (AAV)-GFP transdüksiyonu durumunda, ekspresyon 6 aydan fazla bir süre boyunca in vivo olarak gözlenmiştir (Şekil 3H).
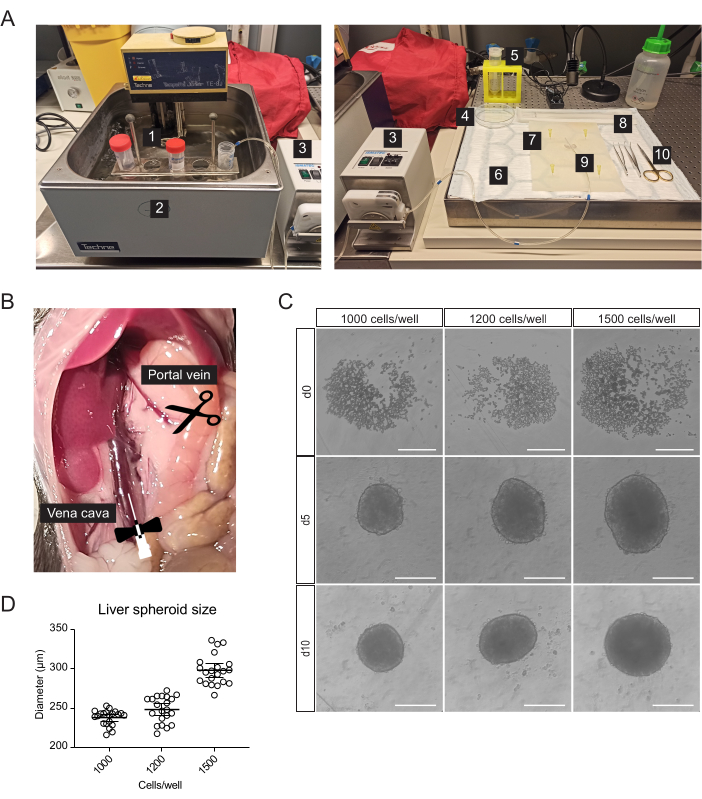
Şekil 1: Birincil fare hepatositlerinin izolasyonu ve karaciğer sferoidlerinin oluşumu. (A) Birincil fare hepatositlerinin izolasyonu için kullanılan malzeme ve ekipman: 1. İzolasyon tamponları; 2. Su banyosu; 3. Peristaltik pompa; 4. Petri kabı; 5. Hücre süzgeci; 6. Emici ped; 7. Diseksiyon matı; 8. Hücre Kaldırıcı; 9. Kelebek iğne 27 G; 10. Diseksiyon aletleri. (B) Ameliyat sırasında karın boşluğu: vena kava kanüle edilir ve perfüze edilir ve tamponların akışına izin vermek için portal ven kesilir. (C) Tohumlamadan 0 (d0), 5 (d5) ve 10 (d10) gün sonra in vitro olarak hepatik sferoidlerin oluşumunun parlak alan görüntüleri, ölçek çubukları = 200 μm. (D) Farklı hücre tohumlama konsantrasyonlarında karaciğer sferoid boyutu, n = 21 sferoid. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
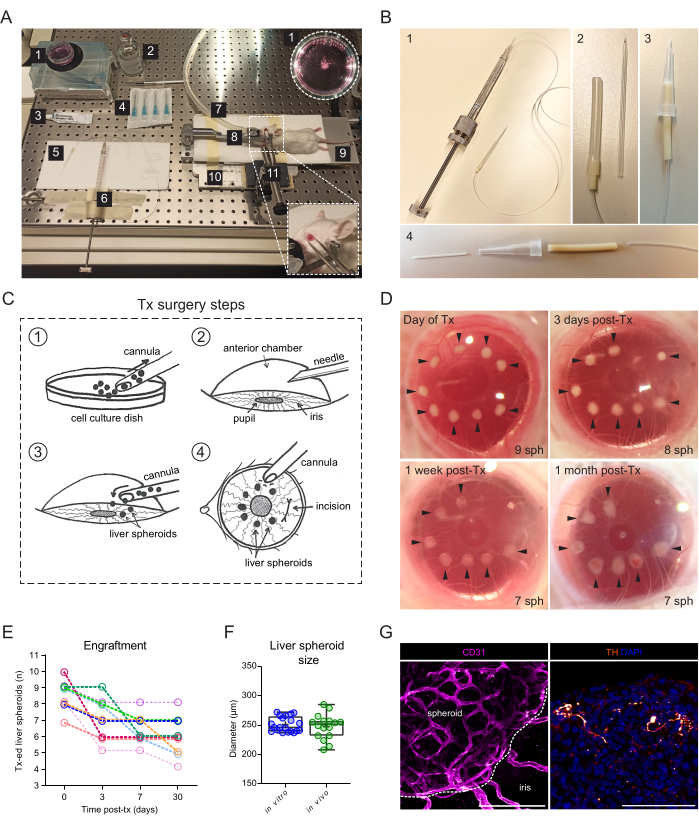
Şekil 2: Karaciğer sferoidlerinin farelerin ACE'sine nakli ve aşılanması. (A) Karaciğer sferoidlerinin ACE'ye nakli (Tx) için kullanılan malzeme ve ekipman: 1. Kültür kabındaki karaciğer sferoidleri; 2. Steril tuzlu su; 3. Göz merhemi; 4. İğneler 23 g; 5. Kanül; 6. Hamilton şırıngası; 7. Anestezi gaz tüpü; 8. Baş tutucu ve gaz maskesi; 9. Isıtma yastığı; 10. Ismarlama metal taban plakası; 11. Forseps ve katı üniversal eklem. (B) Kanül ve Hamilton şırınga kurulumu: 1. Portex boru ve 27G iğne ile Hamilton şırıngaya bağlanan cam kanül; 2. Cam kanül, Silikon boru ve PharMed borularının ek segmentleri aracılığıyla Portex borusuna bağlanır; 3. Alternatif montajlı plastik kanül; 4. Plastik kanülü oluşturan parçalar: 24G BD Insyte plastik kateter, PharMed hortumu ile bağlanır ve stabilite ve kavrama için 10 μl'lik bir kesik pipet ucuyla kaplanır. (C) Tx cerrahi adımlarının gösterimi: 1. Sferoidler kanül içine toplanır; 2. Kornea bir iğne ile delinir; 3. Kanül insizyona yerleştirilir ve sferoidler ACE'ye salınır; 4. Gözün dışından, sferoidler göz bebeğine yakın ve kesiden uzağa yerleştirilir. (D) Ameliyat günü ve Tx'ten 3, 7 ve 30 gün sonra fare gözünde karaciğer sferoidlerinin (sph) stereoskopik görüntüleri. Oklar canlı sferoidleri gösterir. (E) Karaciğer sferoidi (1200 hücre / kuyu boyutu) Tx sonrası aşılama oranı, 6 alıcı farede n = 9 göz. (F) Kültürdeki karaciğer sferoidlerinin boyutu, transplantasyondan önce (in vitro, tek preparattan n = 20 sferoid) ve ACE'de Tx'ten 1 ay sonra (in vivo, 3 alıcı farede n = 16 sferoid), dikey ve yatay çapların ortalaması alınarak hesaplanır. (G) Tx'ten 2 ay sonra aşılanmış karaciğer sferoidlerinin immünofloresan boyanması, vaskülarizasyon (CD31, pembe, kesikli çizgi sferoid kütleyi tanımlar) ve sempatik innervasyon (tirozin hidroksilaz (TH), turuncu), ölçek çubuğu = 100 μm. Panel F için veriler Lazzeri-Barcelo ve ark.10'un izniyle uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
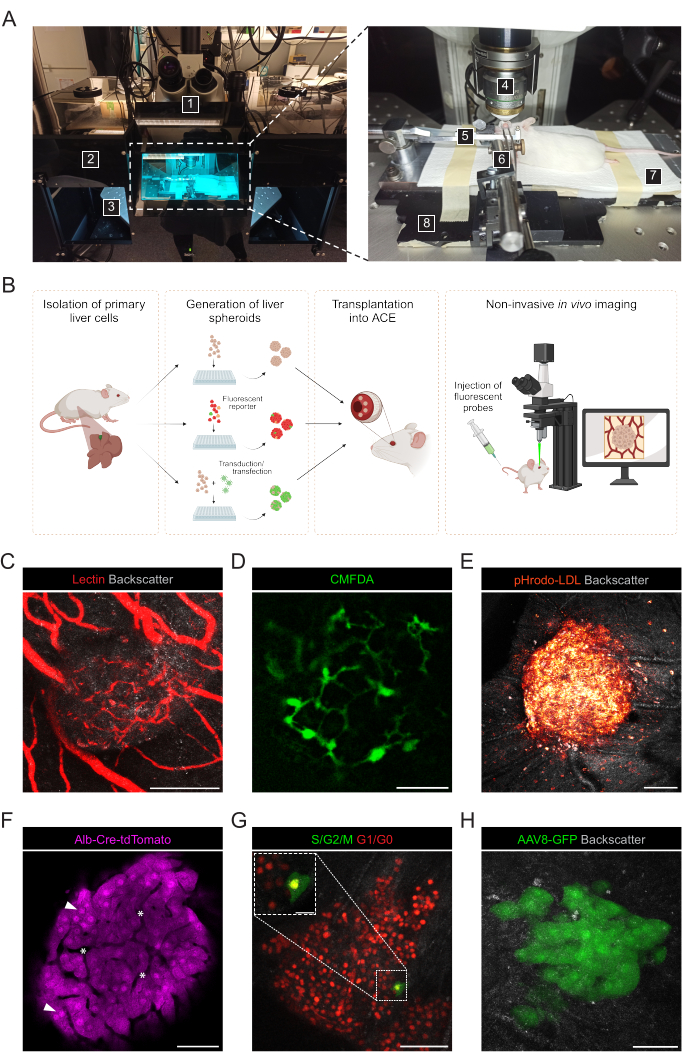
Şekil 3: Aşılanmış karaciğer sferoidlerinin noninvaziv intraoküler in vivo görüntülemesi. (A) İn vivo ACE görüntüleme için kullanılan malzeme ve ekipman: 1. Dik lazer taramalı konfokal mikroskop; 2. Karanlık kutu; 3. Motorlu XYZ aşaması; 4. Daldırma hedefi; 5. Baş tutucu ve gaz maskesi; 6. Forseps ve katı üniversal eklem; 7. Isıtma yastığı; 8. Ismarlama metal taban plakası. (B) Göze aşılanmış karaciğer sferoidlerinde floresan okumalarının in vivo görüntülenmesi için kullanılan farklı yaklaşımları gösteren diyagram. (C-H) Konfokal mikroskopi ile in vivo görüntüleme sırasında ACE-karaciğer sferoidlerinin temsili görüntüleri. Geri saçılma sinyali, küresel hacmi ve yapıyı gözlemlemek için kullanılır; (C) Floresan lektin enjeksiyonu ile etiketlenmiş kan damarları, ölçek çubuğu = 100 μm; (D) Floresan CMFDA enjeksiyonu ile etiketlenmiş safra kanalikülleri ağı, ölçek çubuğu = 50 μm; (E) Floresan pHrodo-LDL probu enjeksiyonu ile LDL alımı, ölçek çubuğu = 100 μm; (F) Td-Domates eksprese eden hepatositler, ok uçları çekirdekleri ve yıldız işaretleri intra-sferoid vaskülatürü gösterir, ölçek çubuğu = 50 μm; (G) FUCCI eksprese eden karaciğer sferoidlerinde hücre döngüsü dinamiklerinin izlenmesi, ölçek çubukları = 50 μm (ana görüntü) ve 20 μm (şişirme). (H) karaciğer sferoidleri, Tx'ten önce AAV8-GFP ile in vitro olarak transdüksiyona tabi tutuldu ve Tx'ten 6 ay sonra gözde görüntülendi, ölçek çubuğu = 50 μm. Panel G'deki görüntü, Lazzeri-Barcelo ve ark.10'un izniyle uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: Birincil fare hepatositlerinin izolasyonu için kullanılan çözeltiler. Fare hepatosit izolasyonu için gerekli çözeltilerin ve tamponların bileşimi. Çürütme tamponu ve Gradyan çözeltisi bileşenleri, izolasyon gününde taze olarak karıştırılmalıdır. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 2. Karaciğer sferoidlerinin intraoküler in vivo görüntülemesi için kullanılan konfokal Leica SP5 mikroskop ayarları. Tablo, Lazzeri ve ark.10'un izniyle uyarlanmıştır. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, ACE içine aşılanmış karaciğer sferoidlerinin intraoküler in vivo görüntülenmesi için yeni bir platformu tanımlamaktadır. ACE daha önce pankreas adacıkları11,12 gibi diğer organ kaynaklı mikro dokuların nakil bölgesi olarak kullanılmıştır, çünkü benzersiz aşılama mikro çevresi, damarlar, sinirler ve oksijen açısından zengin olması ve kornea yoluyla görüntülemeye erişimi vardır. İntravital karaciğer görüntüleme, hücrelerin ve süreçlerin yerinde görüntülenmesini sağlarken, uzunlamasına izleme mümkün değildir. Karın penceresinden karaciğer görüntülemesi karmaşık cerrahi gerektirir ve organın vücut içindeki hareketi zaman içinde tek hücreli izlemeyi zorlaştırır. Bu nedenle, bu yeni görüntüleme yöntemi, karaciğer hücrelerinin tek hücre çözünürlüğünde invaziv olmayan, uzunlamasına izlenmesini sağlar.
Bu protokol üç bölüme ayrılmıştır. Birincisi, Charni-Natan ve ark.13'ten uyarlanan iki aşamalı kollajenaz perfüzyonu yoluyla primer hepatositlerin izolasyonudur, tek fark, karaciğer perfüzyonunu anestezi uygulanmış canlı hayvanlar yerine ölü fare üzerinde gerçekleştirmemizdir. Bu varyasyon, daha az etik husus ve organizmada anestezi kalıntısından kaçınma gibi bazı avantajlar getirir. Bu çalışmada, izolasyonun hepatositle zenginleştirilmiş fraksiyonundan karaciğer sferoidleri üretiyoruz, ancak bu, çeşitli bileşimlere sahip kokültür sferoidleri yapmak için diğer özel protokolleri kullanarak diğer parankimal olmayan hücre popülasyonlarını izole etme potansiyelini dışlamaz14,15.
Bu protokolün ikinci kısmı, karaciğer sferoidlerinin alıcı farelerin ACE'sine nakledilmesini içerir. Bu, anestezi uygulanmış farelerde yapılan hızlı (10 dakikadan az) ve basit bir ameliyattır ve ameliyat sonrası herhangi bir tedavi gerektirmez. Kornea delinmesi kendi kendine kapanır ve 3-5 gün içinde iyileşir. Bazen, iyileşme sürecinde, kesi çevresinde bir miktar kirlenme gözlenir, ancak bu birkaç gün içinde düzelir. Ameliyat edilen hayvanların gözlerinde anterior sineşi vakası yaşamadık. Nakil işlemlerini temiz ama açık bir laboratuvarda ve ameliyat edilen gözlerde enfeksiyon sorunu olmadan gerçekleştiriyoruz. Sferoidlerin göze aşılanması ve aşılanması, alıcı hayvanın görüşünü tehlikeye atmaz veya davranışını değiştirmez. Bu protokolde hem transplantasyon cerrahisi hem de in vivo görüntüleme için farelerde iyi tolere edilen izofluran anestezisi kullanıyoruz. Doza bağımlı etkisi nedeniyle, prosedürler boyunca kolayca ayarlanabilir ve uyku ve uyanma sürelerini azaltma avantajını beraberinde getirir. Bununla birlikte, alternatif enjekte edilebilir anestezikler kullanılabilir. Transplantasyondan sonra, tedavi müdahaleleri ve in vivo görüntüleme yapmadan önce sferoidlerin tamamen aşılanması, vaskülarize olması ve innerve olması için genellikle 1 ay izin veriyoruz. Ayrıca insan karaciğer sferoidleri ve immün sistemi baskılanmış alıcı fareler kullanılarak transplantasyon ve aşılamanın mümkün olduğunu gösterdik10.
Bu yöntemin üçüncü kısmı, ACE'deki aşılanmış karaciğer sferoidlerinin in vivo görüntülemesidir. Bu protokol, araştırma görüntüleme tesislerinde yaygın olarak bulunan mikroskopi ekipmanını kullanan in vivo görüntüleme kurulumunu açıklar. Ayrıca, fare kafası tutucusu ve plastik kanül gibi özel malzemeler artık ticari olarak temin edilebilir. Bu görüntüleme kurulumuyla, lazer penetrasyon derinliğine ve floresan algılamaya bağlı olarak z-kesitlerini yakalayabiliyor ve küresel mimarinin üç boyutlu bir rekonstrüksiyonunu elde edebiliyoruz. Aşılanmış karaciğer sferoidlerinde hücresel fonksiyonun izlenmesi, hücre tipleri, hücresel fonksiyonlar ve dinamikler hakkında rapor veren floresan proteinlerin görselleştirilmesine dayanır. Bu nedenle, bu görüntüleme platformu, tek başına veya kombinasyon halinde farklı modaliteler kullanılarak kullanılabilir: (1) Floresan problar intravenöz olarak uygulanabilir, örneğin hücreleri etiketlemek ve izlemek için antikorlar ve ayrıca fonksiyonel boyalar; (2) Karaciğer sferoidleri, karaciğere özgü floresan proteinleri eksprese eden muhabir fare modellerinden izole edilen hücrelerden, örneğin hücre döngüsü dinamiklerini rapor eden FUCCI karaciğer sferoidlerinden üretilebilir; (3) Karaciğer sferoidlerinin oluşumu in vitro olarak, sferoidleri floresan proteinler ve biyosensörler ile donatmak için transfeksiyon veya transdüksiyon ile birleştirilebilir. örneğin, adeno ile ilişkili virüsler. Deneysel ortamlarımızda ve uyarma için tek bir foton kullanarak, elde edilmesi mümkün olan görüntüleme derinliği kabaca 60-100 μm'dir. Bununla birlikte, bu, lazer gücüne ve çoklu foton görüntüleme kullanılabilirliğine, floresan probu emisyon özelliklerine ve dedektörlerin hassasiyetine ve ayrıca sferoidin aşılandığı gözün açısına bağlıdır. Görüntüleme elde edildikten sonra, aşağı akış görüntü analizi, Image J ve Imis gibi popüler programlar kullanılarak gerçekleştirilebilir. Örneğin, FUCCI raportörü söz konusu olduğunda, yeşil renkli hücre döngüsü aktif hücreleri sayılabilir ve aşılanmış sferoid içindeki hücre döngüsü aktivitesini değerlendirmek için toplam kırmızı hücrelerin sayısıyla karşılaştırılabilir. Ek olarak, ACE görüntüleme platformu, grefti tedavi etmek ve reaksiyonunu izlemek için maddelerin göze uygulanmasına (göz damlası şeklinde) veya doğrudan ACE'ye enjekte edilmesine izin verir. Ölüm sonrası, nakledilen sferoidler manuel mikrodiseksiyon ile kolayca alınabilir ve immünofloresan boyama, transkriptomik analiz vb. gibi ex vivo tekniklerle değerli bilgiler sağlayabilir.10.
Bu tekniğin belirli sınırlamaları vardır. Birincisi, deneyimlerimize göre, alıcı farelerin albino olması, yani pigmentli olmayan irise sahip olması gerektiğidir. Aşılama üzerine, karaciğer sferoidleri, sferoidlerin canlılığını veya işlevini etkilemeyen, ancak iris hücrelerindeki pigment görüntülemeyi önleyen tek bir iris hücresi tabakası ile kaplanır. İkinci bir husus, anestezi uygulanmış farelerde göz içi görüntüleme sırasındaki stabilitedir. İn vivo görüntüleme seansları sırasında, hareketi en aza indirmek için hayvanın anestezi konsantrasyonu ve solunumu yakından izlenmelidir. Bununla birlikte, burada belirtilen görüntüleme ayarlarını kullanarak, tek hücre düzeyinde yüksek çözünürlüklü görüntüleme elde edebiliyoruz.
Özetlemek gerekirse, bu protokol, farelerin gözlerine aşılanmış karaciğer benzeri dokunun noninvaziv bir in vivo görüntüleme platformunun uygulanmasını açıklar. Kolay prosedürler, ortak ekipman ve uygun fiyatlı malzemeler kullanıyoruz, bu da onu birçok araştırmacı için ulaşılabilir bir yaklaşım haline getiriyor. Bu model, temel araştırma ve klinik öncesi ortamlarda karaciğer fizyolojisi ve patolojisini incelemek için değerli bir platform oluşturmak için in vitro 3D karaciğer sferoidlerinin avantajlarını ACE tarafından sağlanan in vivo ortam ve optik erişilebilirlik ile birleştirir.
Açıklamalar
P-OB, Biocrine AB'nin kurucu ortağı ve CEO'sudur, IBL ve BL, Biocrine AB'nin danışmanlarıdır.
Teşekkürler
Bu çalışma İsveç Diyabet Derneği, Karolinska Enstitüsü Fonları, İsveç Araştırma Konseyi, Novo Nordisk Vakfı, Aile Erling-Persson Vakfı, Karolinska Enstitüsü Diyabette Stratejik Araştırma Programı, The Family Knut ve Alice Wallenberg Vakfı, Jonas & Christina af Jochnick Vakfı, İsveç Diyabetoloji Derneği ve ERC-2018-AdG 834860-EYELETS tarafından desteklenmiştir. Figür çizimleri FL-B tarafından BioRender.com kullanılarak oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 27 G butterfly needle | Venofix | 4056388 | |
| AAV8-CAG-GFP | Charles River | CV17169-AV9 | Incubated with isolated hepatocytes at 1 µL/mL during liver spheroid formation |
| Absolute and 70% ethanol | N/A | N/A | |
| Absorbent pad | Attends | 203903 | |
| Albumin-Cre;RCL-tdTomato (B6.Cg-Speer6-ps1Tg(Alb-cre)21Mgn/J ; B6.Cg-Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J) | Jackson | #003574 and #007914 | Mice obtained from in-house breeding |
| B6 albino mice (B6(Cg)-Tyrc-2J/J) | Jackson | #000058 | Mice obtained from in-house breeding |
| B6;129P2-Gt(ROSA)26Sor[tm1(CAG-Venus/GMNN,-Cherry/CDT1)Jkn]/JknH | INFRAFRONTIER/EMMA | EM:08395 | Mice obtained from in-house breeding |
| BD Insyte IV Catheter 24 G x 0.75 in | BD Medical | 381212 | |
| Borosillicate standard glass cappilaries | World Precision Instruments | 1B150-4 | |
| Cell lifter | Corning | 3008 | |
| Cell strainer, 70 µm | Falcon | 352350 | |
| Custom-made metal plate | Hardware store | N/A | |
| Dexamethasone | Sigma-Aldrich | D4902 | |
| Dual-Stage Glass Micropipette Puller | Narshige | Model PC-100 | |
| EDTA | Sigma-Aldrich | E9884 | |
| Electric heating pad | Hardware store | N/A | |
| FBS | Gibco | N/A | |
| GlutaMAX | Gibco | 35050061 | |
| Green CMFDA | Abcam | ab145459 | Reconstituted in DMSO, administered at 100 µg/mouse in PBS 10% FBS |
| Hamilton syringe | Hamilton | 81242 | Model 1750 Luer Tip Threaded Plunger Syringe, 500 µL |
| HBSS; no calcium, no magnesium and no phenol red | Gibco | 14175095 | |
| HCX IRAPO L 25x/0.95 W objective | Leica | N/A | |
| HEPES | Gibco | 15630080 | |
| Induction chamber 0.8 L | Univentor | 8329001 | |
| Insulin-Transferrin-Selenium (ITS-G) | Gibco | 41400045 | |
| Isoflurane | Baxter | N/A | |
| Lectin DyLight-649 | Invitrogen | L32472 | Administered at 1 mg/mL and 100 µL/mouse |
| Liberase TM Research Grade | Sigma-Aldrich | 5401127001 | |
| Microelectrode beveler | World Precision Instruments | Model BV-10 | |
| Mouse head-holder and gas mask | Narshige | Model SGM-4 | |
| Nunclon Sphera 96-Well, U-Shaped-Bottom Microplate | Thermo Fisher | 174929 | |
| Oculentum simplex | APL | N/A | |
| PBS 10x | Gibco | 14080055 | |
| PBS 1x; no calcium, no magnesium | Gibco | 14190144 | |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Percoll | Sigma-Aldrich | P1644 | |
| Peristaltic pump | Ismatec | Model ISM795 | |
| PharMed BPT Pump Tubing | VWR | VERN070540-07 | Inner diameter 0.76 mm, outer diameter 2.46 mm |
| pHrodo Red-LDL | Invitrogen | L34356 | Administered at 1 mg/mL and 100 µL/mouse |
| Portex Fine Bore Polyethylene Tubing | Smiths Medical | 800/100/140 | Inner diameter 0.4 mm, outer diameter 0.8 mm |
| Silicone dissection mat | Hardware store | N/A | |
| Sodium chloride 0.9% | Braun | N/A | |
| Solid Universal Joint | Narshige | Model UST-2 | |
| Stereomicroscope | Leica | Model M80 | |
| Suspension culture dish 35 mm | Sarstedt | 833900500 | |
| Temgesic | Indivor | N/A | Administered s.c. at 0.05 mg/mL and 2 µL/g mouse |
| Translucent Silicone Tubing | VWR | 228-1450 | Inner diameter 1.5 mm, outer diameter 3 mm |
| Trypan Blue | Sigma-Aldrich | T8154 | |
| Univentor 400 Anesthesia unit | Univentor | 8323001 | |
| Upright laser scanning confocal microscope | Leica | Model TCS SP5 II | |
| Viscotears | Novartis | N/A | |
| William's E Medium; no glutamine, phenol red | Gibco | 22551089 |
Referanslar
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Sci Rep. 6, 25187(2016).
- Lauschke, V. M., et al. Massive rearrangements of cellular MicroRNA signatures are key drivers of hepatocyte dedifferentiation. Hepatology. 64 (5), 1743-1756 (2016).
- Oliva-Vilarnau, N., Vorrink, S. U., Ingelman-Sundberg, M., Lauschke, V. M. A 3D cell culture model identifies Wnt/beta-catenin mediated inhibition of p53 as a critical step during human hepatocyte regeneration. Adv Sci (Weinh). 7 (15), 2000248(2020).
- Hurrell, T., et al. Human liver spheroids as a model to study aetiology and treatment of hepatic fibrosis. Cells. 9 (4), 964(2020).
- Kozyra, M., et al. Human hepatic 3D spheroids as a model for steatosis and insulin resistance. Sci Rep. 8 (1), 14297(2018).
- Lauschke, V. M., Shafagh, R. Z., Hendriks, D. F. G., Ingelman-Sundberg, M. 3D primary hepatocyte culture systems for analyses of liver diseases, drug metabolism, and toxicity: Emerging culture paradigms and applications. Biotechnol J. 14 (7), e1800347(2019).
- Shibuya, K., et al. The efficacy of the hepatocyte spheroids for hepatocyte transplantation. Cell Transplant. 30, 9636897211000014(2021).
- Hamazaki, K., Doi, Y., Koide, N. Microencapsulated multicellular spheroid of rat hepatocytes transplanted intraperitoneally after 90% hepatectomy. Hepatogastroenterology. 49 (48), 1514-1516 (2002).
- Marques, P. E., et al. Imaging liver biology in vivo using conventional confocal microscopy. Nat Protoc. 10 (2), 258-268 (2015).
- Lazzeri-Barcelo, F., et al. Intraocular liver spheroids for noninvasive high-resolution in vivo monitoring of liver cell function. Nat Commun. 15 (1), 767(2024).
- Speier, S., et al. Noninvasive in vivo imaging of pancreatic islet cell biology. Nat Med. 14 (5), 574-578 (2008).
- Leibiger, I. B., Berggren, P. O. Intraocular in vivo imaging of pancreatic islet cell physiology/pathology. Mol Metab. 6 (9), 1002-1009 (2017).
- Charni-Natan, M., Goldstein, I. Protocol for Primary Mouse Hepatocyte Isolation. STAR protocols. 1 (2), 100086(2020).
- Baze, A., et al. Three-dimensional spheroid primary human hepatocytes in monoculture and coculture with nonparenchymal cells. Tissue Eng Part C Methods. 24 (9), 534-545 (2018).
- Mohar, I., Brempelis, K. J., Murray, S. A., Ebrahimkhani, M. R., Crispe, I. N. Isolation of nonparenchymal cells from the mouse liver. Methods Mol Biol. 1325, 3-17 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır