Method Article
マウス眼の前房に移植された肝スフェロイドのin vivoイメージング
* これらの著者は同等に貢献しました
要約
ここでは、マウスの眼の前房に生着した肝スフェロイドの非侵襲的な in vivo イメージングを可能にするプラットフォームについて説明します。ワークフローは、初代肝細胞からのスフェロイドの生成から、マウスの眼への移植、共焦点顕微鏡による細胞分解能での in vivo イメージングまで多岐にわたります。
要約
哺乳類における肝臓の生物医学的研究は、細胞分解能での in vivo 非侵襲的縦断イメージングの方法の欠如によって妨げられています。これまで、肝臓のin situ 光学イメージングは、細胞レベルで高解像度のイメージングを提供する生体内イメージングによって可能でしたが、同じ動物で複数回、したがって縦断的に実行することはできません。生物発光などの非侵襲的なイメージング法では、同じ動物で繰り返しイメージングセッションを行うことができますが、細胞の解像度は得られません。この方法論のギャップに対処するために、マウスの眼の前房に生着した肝スフェロイドの非侵襲的な in vivo イメージングのためのプラットフォームを開発しました。この研究で説明したワークフローでは、初代マウス肝スフェロイドを in vitro で生成し、レシピエントマウスの眼の前房に移植し、そこで虹彩に生着させます。角膜は、従来の共焦点顕微鏡で生着したスフェロイドを画像化できる自然な体の窓として機能します。スフェロイドは眼の中で数ヶ月間生存し、その間、細胞は健康や病気の状況で研究できるだけでなく、適切な蛍光プローブを使用して繰り返しイメージングセッションを行い、さまざまな刺激に応答して監視することができます。このプロトコルでは、このイメージングシステムを実装するために必要な手順の内訳を提供し、その可能性を最大限に活用する方法を説明します。
概要
健康および疾患中の哺乳類の肝機能のモニタリングは、高解像度で非侵襲的な in vivo イメージング技術の欠如によって制限されています。この器官の視覚化は、そのアクセスできない場所によって妨げられており、細胞プロセスをつなぎ合わせるために、 in vivo 研究は異なる時点での動物の犠牲に依存しています。このイメージングの限界を回避するために、多くの研究は、肝臓のような微小組織を視覚化し、制御された環境で研究する in vitro モデルに依存しています。
近年、肝臓スフェロイドなどの3次元培養システムの開発が肝臓研究を後押しし、進歩させています。肝スフェロイドは、肝臓組織の微小環境や複雑な細胞間相互作用をある程度模倣した多細胞凝集体であり1、従来の単層培養に比べて明らかな利点を提供します2,3。肝スフェロイドは、さまざまな肝疾患のモデルとしても使用され、4,5,6、疾患のメカニズムを理解するのに役立ちました。それでも、現在のin vitro肝臓モデルの主な制限は、生理学的なin vivo環境の欠如と、培養での利用時間が限られていること(約20日)です3。肝スフェロイドは、腎臓嚢の下7や腹腔内8など、光学イメージングではアクセスできないin vivoのさまざまな部位に以前に移植されています。生体内肝臓イメージングは、細胞分解能のリアルタイムイメージングを提供する最先端の技術です。現在、このin situ肝臓イメージングは、侵襲性が高く、多くの場合末端9である外在臓器でのみ可能です。腹部窓を装着することで、肝臓の画像診断セッションを繰り返すことができますが、複雑な手術とアフターケアが必要です。
細胞分解能で縦断的モニタリングを行うために、肝臓様組織が生理学的環境に生着し、身体刺激に接続され、光学イメージングにアクセス可能なマウスの前房(ACE)への肝スフェロイドの移植を検討しました。角膜は透明な組織であり、虹彩に生着した微小組織を共焦点顕微鏡で非侵襲的かつ縦方向に画像化するための窓として機能します。ここでは、肝スフェロイド10のin vivoイメージングのために新たに開発されたプラットフォームのワークフローを紹介します。このプロトコルは、(1)初代マウス肝細胞の抽出および肝スフェロイドのin vitro形成、(2)レシピエントマウスのACEへの肝スフェロイドの移植、および(3)麻酔マウスにおける生着肝スフェロイドのin vivoイメージングに分けられる、その実施のためのステップバイステップガイドである。さらに、このイメージングプラットフォームの可能性と応用例をいくつか紹介します。
プロトコル
動物に対して行われたすべての手順は、カロリンスカ研究所の動物実験倫理委員会によって承認されました。
1. in vitroでのマウス初代肝細胞の抽出と肝スフェロイドの作製
- 準備
- カニューレ挿入、肝臓切除、および初代肝細胞の単離のために、血清学的ピペットおよび遠心分離チューブ(図1A)に加えて、以下の滅菌または単回使用の材料を準備します:蠕動ポンプ、スイングバケット遠心分離機、吸収パッド、解剖マット、2つの湾曲した先端鉗子、手術用ハサミ、1つの27Gバタフライニードル、1つの70μmセルストレーナー、1つのセルリフター、1つの100mmペトリ皿、 細胞計数室、96ウェルのU字型底マイクロプレート。
- 表1に示すように、肝灌流、初代肝細胞の単離、および肝スフェロイドの生成に使用する溶液を調製します。
注:消化バッファーとグラジエント溶液は新鮮に調製する必要があります。 - 42°Cの水浴から肝臓に溶液を導く蠕動ポンプからなる灌流システムをセットアップします(図1A)。水浴の温度が高いほど、バッファーは最適な温度である37°Cで肝臓に到達します。 チューブの長さと室温(RT)に応じてカスタマイズします。
- カニューレ挿入には、27Gのバタフライニードルをチューブの端に取り付けます。最終絶縁工程で使用するめっき媒体は4°Cに保ちます。
- プロシージャ
- 42°Cの水浴中で、50 mLの遠心チューブに、40 mLのPBS、20 mLの灌流バッファー、および12 mLの消化バッファー溶液を予熱します。
- ポンプチューブを洗浄して温めるには、予熱したPBSを約20mL循環させます。
- チューブを灌流バッファーに交換し、チューブとバタフライニードルをプライミングし、流速を4 mL/minに設定します。プロトコル全体を通して、バッファー交換中にチューブ内に気泡が入らないようにしてください。
- 子宮頸部脱臼によってマウスを安楽死させ、針を使用して手足を解剖板に固定します。
- 腹部の毛皮を70%エタノールで濡らし、消化器官にアクセスするために解剖します。
- 腸を右に動かして、門脈と下大静脈を露出させます(図1B)。
- 針を水平にして大静脈を長さの約半分にカニューレし、安定していることを確認してから、ポンプを始動します。
- 肝臓が膨らみ始めたら、または近くの葉に白い点が現れたら、門脈を切って血液と灌流バッファーを排出させます。
- 肝臓はすぐにブランチングを開始するはずです。湾曲した鉗子を使用して、門脈を5秒間隔でクランプするクリアを奨励します。
- 肝臓が黄色くなり、血液がなくなるまで手順1.2.9を繰り返します(約15〜20 mLの灌流バッファー)。
- チューブを消化バッファーに交換するために蠕動ポンプを停止し、ポンプを再起動します。消化バッファーが肝臓に到達したら、流速を2.5 mL/minに下げます。
注:消化バッファー中のフェノールレッドは、肝臓への到着を識別し、治療中のポンプパラメータの調整を可能にします。 - バッファーがすべての肝葉に到達し、適切な消化を確実にするために、手順1.2.9を数回繰り返します。
- 消化バッファーが枯渇した場合、または肝臓が十分に消化されたように見える場合は、蠕動ポンプの流れを停止します。
注:消化の程度は、鉗子で肝葉をそっとつまみ、組織に小さな跡が現れるかどうかを確認することで視覚的に監視できます。肝臓も薄っぺらになります。 - 肝臓を摘出するには、腹腔内の肝靭帯と接続部を切断し、完全に除去することを目指し、10mLの冷めっき培地を入れたペトリ皿に入れます(表1)。
- 胆嚢を取り除いた後、鉗子を使用して葉に小さなつまみを作り、肝嚢を軽く引き裂きます。皿の中で肝臓を振って、細胞が培地に注がれるのを観察します。
- 鉗子で肝臓を安定させ、細胞リフターを葉に沿ってそっと引きずり、細胞を解放します。
注:正しい小葉間消化は、組織片ではなく、培地中の細胞懸濁液につながります。 - 血清学的ピペットを使用して、ペトリ皿から細胞懸濁液を回収し、50mLの遠心分離チューブに置いた70μmの細胞ストレーナーでろ過します。新鮮なめっき培地を使用して、消化された肝細胞の皿を洗い、フィルターに移します。
- 50 x g で4°Cで5分間遠心分離し、細胞をペレット化します。
- 上清を取り除き、細胞ペレットを覆うために約1 mLを残し、チューブを旋回させて細胞を再懸濁し、10 mLの冷めっき培地を徐々に加えます。
- 10 mLのグラジエント溶液を細胞懸濁液に加え、チューブを10回静かに反転させます。
- 200 x g で4°Cで10分間遠心分離します。
- ペレットには肝細胞が豊富な生存可能な肝細胞が含まれ、上清には死んだ細胞と破片が含まれています。血清学的ピペットを使用して上清を捨て、約1 mLを残し、穏やかに旋回してペレットを再懸濁します。
- 20 mLのコールドプレーティング培地を細胞懸濁液に加え、50 x g で4°Cで5分間遠心分離して、グラジエント溶液を洗い流します。
- ペレットの上に約1 mLを残して上清を取り除き、細胞を20 mLの冷間めっき培地に再懸濁します。
注:ここでは、細胞ペレットを圧縮できるため、必要に応じて、10mLの血清ピペットを使用して細胞を穏やかに解離します。 - 細胞数と生存率を、細胞計数チャンバーとトリパンブルーを用いて手動で測定します。
注:肝細胞はチューブ内で急速に沈殿します。それらを再懸濁するには、チューブを数回静かに反転させます。 - 1200細胞/ウェルのめっき培地200μL/ウェル中の肝細胞を96ウェルの超低接着プレートに播種します。
注:ウェルあたりの最適な培地容量は200μLです。ただし、100μL /ウェルで細胞を播種することは可能です。 - プレートを200 x g で3分間回転させて、ウェルの中央に細胞を集めます。
- 細胞をインキュベート(37°C、5%CO2)し、スフェロイドを形成するために5日間自然に置いておきます(図1C)。
- 5日目に、ウェル内の培地の半分を慎重に除去し、無血清のメンテナンス培地と交換します(表1)。肝スフェロイドを移植する準備が整う10日目まで、48時間ごとにこの手順を繰り返します。
注:培養肝スフェロイドにおけるカプセル様構造の形成は、良好な凝集および生存率を示す。
2. 眼の前房への肝スフェロイド移植(ACE)
- 準備
- ACEへの肝スフェロイドの移植については、実体顕微鏡、イソフルラン麻酔ユニット、誘導室、イソフルラン、加熱パッド、カスタムメイドの金属ベースプレート、マウスヘッドホルダーとガスマスク、固体ユニバーサルジョイントに取り付けられた鉗子、ハミルトン500μLネジ付きプランジャーシリンジ、シリコーン、ポリエチレン、ポンプチューブ、カスタムメイドの鈍いガラスカニューレまたは24Gカテーテル、 エタノール70%、滅菌生理食塩水、滅菌23 G針、眼軟膏(流動パラフィンとワセリンの比率1:1)、使い捨て1 mLシリンジ、および細胞懸濁皿35 mm。
- ハミルトンのシリンジ、チューブ、カニューレを70%エタノールと生理食塩水を通して洗浄します。
- ハミルトンシリンジ、チューブ、ガラスカニューレに生理食塩水を入れ、ハミルトンシリンジをテープでベンチの水平位置に固定します(図2A)。
- カスタムメイドの鈍いガラスカニューレを使用してください。
- 2段式マイクロピペットプラーを使用してホウケイ酸ガラスキャピラリーを内径>300μmに伸ばし、スフェロイドを吸引できるようにします。
- 微小電極ベベラーを使用して先端を面取りして鈍くし、カニューレの先端を数秒間炎にさらしてエッジを柔らかくします。
注:微小電極ベベラーは、手動で操作される回転サンディングストーンで構成されています。したがって、特定の設定は適用されません。
- または、24 Gカテーテルのプラスチック部分を使用してカニューレを構築します(図2B)。
- 麻酔イソフルランユニットを準備し、加熱パッドを37°Cに温めます。
- 固体のユニバーサルジョイントに取り付けられた鉗子の先端をポリエチレンチューブで覆ってループを形成し、目を安定させるのに役立ちます。
- ピペットと200 μLチップを使用して、肝臓スフェロイドを96ウェルプレートからメンテナンス培地を入れた35 mm細胞懸濁皿に移します。
- プロシージャ
- 2.5%イソフルランと280mL / minの空気の用量を使用して、誘導チャンバーでマウスを麻酔します。
- マウスが意識を失ったら、麻酔を1.8%イソフルランと280mL / minの空気に下げ、麻酔チューブをヘッドホルダーに接続し、動物を加熱パッドにすばやく移し、鼻をヘッドホルダーの内側に配置します。
- 頭をネジで固定し、眼球をソケットからそっと飛び出して鉗子で固定し、乾燥を防ぐために両目に生理食塩水を滴下します。
- ステレオスコープの下で、ハミルトンシリンジを使用して肝臓スフェロイドを吸引してカニューレの先端に集め、きれいな表面に水平に置きます。
注:肝臓スフェロイドと一緒に培地を吸引すると、カニューレ壁に付着するのを防ぐのに役立ちます。 - 23Gの針を使用して角膜に注意深く穴を開け、浸透した房水を組織で乾かします。必要に応じて、切開部を広くするために、針を慎重に横にスライドさせて角膜をスライスします。
注:角膜穿刺には使い捨ての滅菌針が使用されるため、切開前に角膜を消毒することはありません。 - 乾燥を避けるために生理食塩水を目に加えます。
- 肝臓のスフェロイドが入ったカニューレを取り、垂直に保持して、スフェロイドがカニューレの先端に引き寄せられるようにします。
- カニューレを穴にそっと挿入し、ベベルを瞳孔に向けて、ハミルトンシリンジを使用して肝臓スフェロイドをACEにゆっくりと排出します(図2C)。
注意: カニューレを取り外す前に、目の内外の液体圧力が再調整され、スフェロイドが目から逃げ出さないように数秒待つことをお勧めします。 - 角膜の外側から、カニューレの先端で角膜をそっと突いて、肝スフェロイドを瞳孔の周りに置き、切開部から遠ざけます(図2C)。
- 肝臓のスフェロイドが虹彩に落ち着くまで5~10分待ってから、鉗子から眼球を解放します。
- ワセリン眼軟膏を手術眼に塗布し、角膜を滑らかにし、治癒させるのを助けます。
- 必要に応じて、同じ方法に従って2番目の目の手術に進みます。
- マウスを目覚めさせる前に、術後の不快感を避けるために鎮痛剤を投与します(たとえば、滅菌生理食塩水中の0.1 mg / kgブプレノルフィンを皮下投与します。.
注:マウスはこの小さな手順からすぐに回復し、痛みや行動の変化の兆候を示さなかったため、鎮痛薬は1回だけ投与されました。この手順は非常に迅速(10分未満)で、わずかな不快感しか引き起こさないため、マウスは動物を目覚めさせる前に投与される術後鎮痛以外の術後のケアを必要としません。
3. ACEにおける生着肝スフェロイドの in vivo イメージング
- 準備
- ACEに生着した肝スフェロイドの非侵襲的 in vivo イメージングのために、次の材料と器具を準備します(図3A):正立共焦点顕微鏡、長作動距離水浸対物レンズ、イソフルラン麻酔ユニット、誘導チャンバー、イソフルラン、加熱パッド、カスタムメイドの金属ベースプレート、マウスヘッドホルダーとガスマスク、固体ユニバーサルジョイントに取り付けられた鉗子、人工涙液ジェル、眼軟膏(流動パラフィンとワセリンの比率は1:1)。
- オプションの材料には、注射可能な蛍光プローブ、使い捨て注射器、尾部静脈注射用の27G針が含まれます。
- プロシージャ
- 2.5%イソフルランと280mL / minの空気の用量を使用して、誘導チャンバーでマウスを麻酔します。
- マウスが意識を失ったら、麻酔を1.8%イソフルランと280mL / minの空気に下げ、麻酔チューブをヘッドホルダーに接続し、動物を加熱パッドにすばやく移し、鼻をヘッドホルダーの内側に配置します。
- ネジを使用して、ヘッドホルダーにヘッドを固定します。
- 乾燥を防ぐために、両目に人工涙液ジェルを一滴垂らします。
- この時点で、尾静脈から蛍光プローブを静脈内注入し、直後に画像化します。
- 頭を傾け、眼窩から目をそっと外し、鉗子で対物レンズの下の位置に固定します。
- 角膜と対物レンズの間のスペースを埋めるために人工涙液ジェルをたっぷりと塗布し、接眼レンズを通して肝臓スフェロイドに焦点を合わせます。
注:可能であれば、接眼レンズの1つの接眼レンズを取り外して、拡大されていない視力を獲得し、虹彩上のスフェロイドをより簡単に見つけます。 - 動物の呼吸の動きにもかかわらず高解像度のイメージングを取得するには、25倍の対物レンズと次のイメージング設定を使用します:フォーマット512 x 512ピクセル、スキャン速度600 Hz、Zスタックの厚さ3 μm。詳細な画像設定については 、表2を参照してください。
注:イメージング全体を通して、麻酔濃度は1.6〜2.2 mL / hのイソフルランに調整され、浅く制御された呼吸リズムを達成し、それによって動物の動きを最小限に抑えます。 - イメージングセッションの最後に、イソフルランを除去して動物を目覚めさせる前に、画像化された目をワセリン眼軟膏で治療します。
結果
肝細胞が豊富な初代肝細胞を、蠕動ポンプを使用して肝臓に温かい緩衝液を循環させ、臓器の血管系を利用して解離酵素をすべての細胞に送達する2段階のコラゲナーゼ灌流によってマウス肝臓から単離しました(図1A)。このために、下大静脈をカニューレ挿入し、門脈を切り取ってバッファーのフロースルーを可能にしました(図1B)。まず、HBSSベースのバッファーを肝臓に流して血液を透明化しました。カニューレ挿入が成功し、血栓がない場合、肝臓は白くなり、数秒以内に黄色になります。次に、リベラーゼ酵素ブレンドを含む消化バッファーを肝臓に循環させて、組織を単細胞懸濁液に解離させました。細胞を手作業でカウントし、96ウェルの超低接着(ULA)プレートに播種することで、数日以内にスフェロイドへの自己組織化を可能にしました。5日目にスフェロイドが形成され、スフェロイドに隣接する薄いカプセルが凝集に成功したことを示します(図1C)。移植は10日目まで待ちますが、その時点でスフェロイドはコンパクトになり、細胞間結合が強くなっています。ウェルあたりの播種細胞数によって肝スフェロイドのサイズが決定され、1000、1200、および1500個の細胞/ウェルが、それぞれ238μm±10μm、248μm±17μm、および298μm±19μm(平均±19μm)のスフェロイドを産出しました(図1C、D)。移植には、(1)スフェロイドのサイズは、低酸素症や壊死性コアを避けるために大きすぎず、細胞間コミュニケーションをサポートし、眼の移植片のリモデリングを可能にするのに十分な細胞を含む必要がある、(2)このサイズのスフェロイドの重量により、虹彩に引き寄せられ、生着を改善することができる、 (3)このサイズは、マウスの眼あたり5〜10個のスフェロイドを移植する場合に適しています。
移植手術には、ガラスカニューレに接続された手動ネジ式シリンジが必要です(図2A)。ガラスカニューレは、マイクロピペットの引き手とベベラーを使用して、細い鈍い先端を持つように社内で改造されたホウケイ酸ガラスキャピラリーで構成されています。より簡単な代替カニューレは、シリンジチューブに接続し、ピペットチップで安定化された市販のプラスチックカテーテルを使用して作成できます(図2B)。手術は、角膜の切開を通してACEに肝スフェロイドを接種することからなる(図2C)。スフェロイドは、イメージングのためによりアクセスしやすくし、眼角に移動するのを防ぐために、瞳孔の境界に配置されました。アルビノマウスは、非色素沈着虹彩が生着肝スフェロイドの in vivo イメージングを可能にするため、移植に使用されました。レシピエントマウスを7〜10個のスフェロイド/眼で両眼に移植し、移植後3日(Tx後)およびTx後1週間および1か月で立体画像を撮影して、角膜の治癒とスフェロイド生着の成功を記録しました(図2D)。注目すべきは、移植したばかりと完全に生着したときの間のACEの肝スフェロイドの外観の変化は、虹彩への移植片の沈降と、スフェロイド上の虹彩細胞の単層の成長によるものです。ACEにおける肝スフェロイドの生着成功率は70%です(n=雌マウスともに9眼)(図2E)。Tx後の最初の日は、生存と生着にとって最も重要であり、角膜が治癒する前にレシピエント動物が目をこすり、スフェロイドを脱落させる可能性があります。肝スフェロイドのサイズはTx後も有意に変わらず、形状の変化は移植片のリモデリングと生着に起因します(図2F)。Txの1か月後、虹彩に存在するすべての生着スフェロイドは、免疫蛍光染色によって示されるように血管新生され、神経支配されました(図2G)。
非侵襲的な in vivo イメージングは、正立共焦点顕微鏡および長距離浸漬対物レンズを使用して、麻酔をかけたレシピエントマウスで実施されます(図3A、表2)。ACEの蛍光イメージングは、 図3Bに示すように、さまざまなアプローチで実現できます。レシピエントマウスの循環に蛍光プローブを注入することで、スフェロイド内のさまざまな細胞タイプや構造を可視化することができます。レクチンを使用して血管をマーキングし(図3C)、CMFDAを使用して胆管ネットワークを観察し(図3D)、pHrodo-LDLを使用して、スフェロイド細胞へのLDLの活発な取り込みを確認しました(図3E)。レポーターマウスモデルから作製した肝スフェロイドも使用できます。Albumin-Cre:tdTomatoスフェロイドは肝細胞の標識と追跡を可能にし(図3F)、蛍光ユビキチン細胞周期インジケーター(FUCCI)バイオセンサーを発現するスフェロイドを使用して、単一細胞の分解能で細胞周期の動態を可視化しました(図3G)。最後に、肝スフェロイドは移植前に in vitro で遺伝子組み換えを行うことができ、アデノ随伴ウイルス(AAV)-GFP形質導入の場合、発現はin vivo で6ヶ月以上観察されました(図3H)。
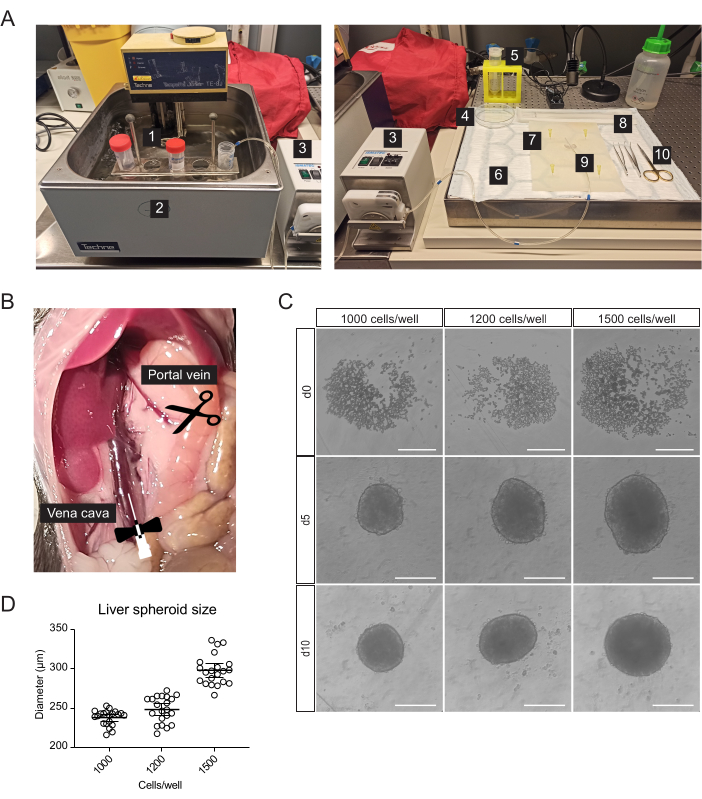
図1:マウス初代肝細胞の単離および肝スフェロイドの作製(A)初代マウス肝細胞の単離に用いる材料および装置: 1. 単離バッファー;2.ウォーターバス;3.蠕動ポンプ;4.ペトリ皿;5.セルストレーナー;6.吸収性パッド;7.解剖マット;8.セルリフター;9.バタフライニードル27 G;10.解剖ツール。(B)手術中の腹腔:大静脈をカニューレで灌流し、門脈を切り取って緩衝液を流します。(C)播種後0(d0)、5(d5)、および10(d10)日におけるin vitroでの肝スフェロイド形成の明視野画像、スケールバー= 200μm。この図の拡大版を見るには、ここをクリックしてください。
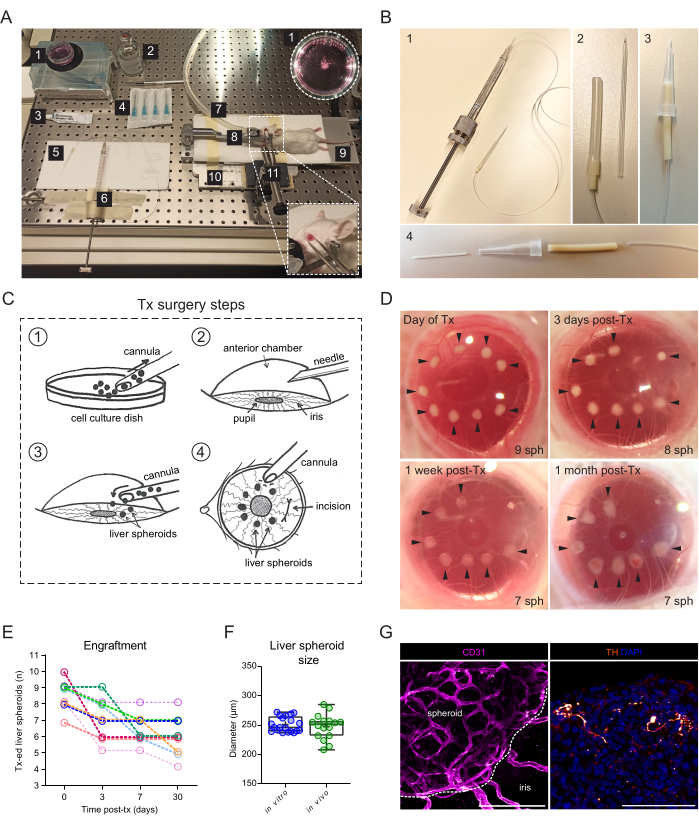
図2:マウスのACEへの肝スフェロイドの移植と生着 (A)ACEへの肝スフェロイドの移植(Tx)に使用される材料と装置: 1.培養皿中の肝スフェロイド;2.滅菌生理食塩水;3.目の軟膏;4.針23g;5.カニューレ;6.ハミルトン注射器;7.麻酔ガス管;8.ヘッドホルダーとガスマスク。9.加熱パッド;10.カスタムメイドの金属製ベースプレート。11.鉗子と固体のユニバーサルジョイント。(B)カニューレとハミルトンシリンジのセットアップ:1.ポルテックスチューブと27Gニードルを介してハミルトンシリンジに接続されたガラスカニューレ。2.ガラスカニューレは、シリコンチューブとPharMedチューブの追加セグメントを介してPortexチューブに接続されています。3.代替の組み立てられたプラスチックカニューレ。4.プラスチックカニューレを形成する部品:24G BD InsyteプラスチックカテーテルをPharMedチューブで接続し、安定性とグリップのためにカットオフ10μlピペットチップで被覆します。(C)Tx手術手順の図:1.スフェロイドはカニューレに集められます。2.角膜に針を刺します。3.カニューレが切開部に挿入され、スフェロイドがACEに放出されます。4.目の外側から、回転楕円体は瞳孔の近くに配置され、切開部から離れます。(D)手術日およびTx後3、7、および30日後のマウス眼の肝スフェロイド(sph)の立体画像。矢印は生存可能なスフェロイドを示します。(E)Tx後の肝スフェロイド(1200細胞/ウェルのサイズ)生着率、6人のレシピエントマウスにおけるn = 9眼。(F)移植前(in vitro、 n=1回調製物からの20スフェロイド)およびACEにおけるTx後1ヶ月(in vivo、 3匹のレシピエントマウスにおけるn=16スフェロイド)の培養中の肝スフェロイドのサイズ、垂直方向と水平方向の直径を平均して計算した。(G)Tx後2ヶ月の生着肝スフェロイドの免疫蛍光染色、血管新生(CD31、ピンク、破線はスフェロイド塊を描写)および交感神経支配(チロシンヒドロキシラーゼ(TH)、オレンジ)、スケールバー= 100μm。パネルFのデータは、Lazzeri-Barcelo et al.10の許可を得て改変された。 この図の拡大版を見るには、ここをクリックしてください。
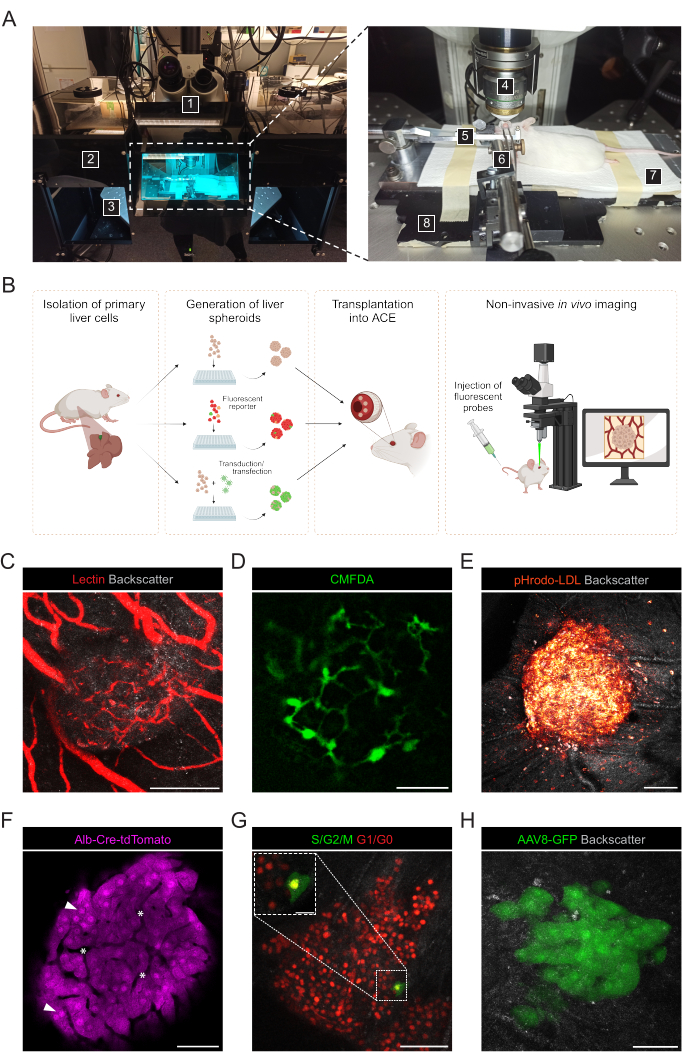
図3:生着肝スフェロイドの非侵襲的眼内in vivo イメージング (A) in vivo ACEイメージングに使用される材料と機器: 1.正立レーザー走査型共焦点顕微鏡;2.ダークボックス;3.電動XYZステージ。4.浸漬目的;5.ヘッドホルダーとガスマスク。6.鉗子と固体のユニバーサルジョイント。7.加熱パッド;8.カスタムメイドの金属製ベースプレート。(B)眼に生着した肝スフェロイドの蛍光測定値の in vivo イメージングに使用されるさまざまなアプローチを示す図。(C-H)共焦点顕微鏡による in vivo イメージング中のACE肝スフェロイドの代表的な画像。後方散乱信号は、回転楕円体の体積と構造を観察するために使用されます。(C)静脈内標識血管 蛍光レクチンの注入、スケールバー= 100μm;(D)蛍光CMFDAの注射によって標識された胆管ネットワーク、スケールバー= 50μm;(E)蛍光pHrodo-LDLプローブの注入によるLDL取り込み、スケールバー= 100μm;(F)Td-トマト発現肝細胞、矢印は核を示し、アスタリスクはスフェロイド内血管系を示し、スケールバー= 50μm;(G)FUCCI発現肝スフェロイドの細胞周期動態のモニタリング、スケールバー=50μm(メイン画像)および20μm(ブローアップ)。(H)Txの前にAAV8-GFPで in vitro で形質導入し、Tx後6ヶ月で眼で画像化された肝スフェロイド、スケールバー= 50μm。パネルGの画像は、Lazzeri-Barcelo et al.10の許可を得て翻案したものである。 この図の拡大版を見るには、ここをクリックしてください。
表1:初代マウス肝細胞の単離に用いた溶液。 マウス肝細胞の単離に必要な溶液および緩衝液の組成。消化バッファーとグラジエント溶液の成分は、単離当日に新鮮に混合する必要があります。 この表をダウンロードするには、ここをクリックしてください。
表2。肝スフェロイドの眼内in vivoイメージングに使用される共焦点ライカSP5顕微鏡設定。 この表は、Lazzeri et al.10の許可を得て改作したものである。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
このプロトコルは、ACEに生着した肝スフェロイドの眼内in vivoイメージングのための新しいプラットフォームを記述しています。ACEは、その独特の生着微小環境、血管、神経、酸素が豊富で、角膜を介したイメージングへのアクセスにより、膵島11,12などの他の臓器由来微小組織の移植部位として以前に使用されてきました。生体内肝臓イメージングは、細胞やプロセスをその場で可視化することができますが、縦断的なモニタリングは不可能です。腹部窓からの肝臓のイメージングは複雑な手術を伴い、体内の臓器の動きにより、時間の経過に伴う単一細胞の追跡が困難になります。したがって、この新しいイメージング法により、単一細胞の解像度で肝細胞の非侵襲的な縦断的モニタリングが可能になります。
このプロトコルは3つの部分に分かれています。1つ目は、Charni-Natanら13から採用された2段階コラゲナーゼ灌流による初代肝細胞の単離ですが、麻酔をかけた生きた動物ではなく、死んだマウスで肝灌流を行うという違いがあります。このバリエーションは、倫理的考慮事項が少なく、生体内の麻酔残留物の回避など、特定の利点をもたらします。この研究では、単離の肝細胞が豊富な画分から肝スフェロイドを作製するが、これは、他の特殊なプロトコルを使用して他の非実質細胞集団を単離し、多様な組成の共培養スフェロイドを作製する可能性を排除するものではない14,15。
このプロトコルの第2部は、レシピエントマウスのACEへの肝スフェロイドの移植を含む。麻酔をかけたマウスに行う迅速(10分以内)で簡単な手術で、術後治療は必要ありません。角膜穿刺は自己密閉し、3〜5日で治癒します。時折、治癒過程で切開部の周囲にかすみが見られることがありますが、これは数日以内に解消します。手術を受けた動物の眼に前癒着症の症例は経験していません。移植手術は、清潔で野外の実験室で、手術した眼の感染症の問題はありません。眼へのスフェロイドの接種と生着は、視力を損なったり、レシピエント動物の行動を変えたりすることはありません。このプロトコルでは、移植手術と in vivo イメージングの両方にイソフルラン麻酔を使用しますが、これはマウスで十分に許容されます。用量依存的な効果があるため、処置全体を通して簡単に調整でき、睡眠時間と覚醒時間を短縮するという利点があります。ただし、代替の注射用麻酔薬を使用できます。移植後、スフェロイドが完全に生着し、血管新生し、神経支配されるまで通常1か月待ってから、治療介入と in vivo イメージングを行います。また、ヒト肝スフェロイドや免疫不全のレシピエントマウスを用いて移植や生着が可能であることも示した10。
この方法の第3部は、ACEにおける生着肝スフェロイドの in vivo イメージングである。このプロトコルは、研究イメージング施設で一般的に見られる顕微鏡装置を使用する in vivo イメージングセットアップについて説明します。さらに、マウスヘッドホルダーやプラスチックカニューレなどの特殊材料も市販されています。このイメージング設定により、レーザー透過の深さと蛍光検出に応じて、z切片をキャプチャし、スフェロイド構造の3次元再構成を得ることができます。生着肝スフェロイドの細胞機能のモニタリングは、細胞の種類、細胞機能、およびダイナミクスを報告する蛍光タンパク質の可視化に依存しています。したがって、このイメージングプラットフォームは、単独で、または組み合わせて、異なるモダリティを使用して利用することができます:(1)蛍光プローブは、静脈内投与することができ、例えば、細胞を標識および追跡するための抗体、ならびに機能性色素;(2)肝スフェロイドは、肝臓特異的蛍光タンパク質を発現するレポーターマウスモデルから単離された細胞、例えば、細胞周期動態を報告するFUCCI肝スフェロイドから作製することができる。(3) in vitro での肝スフェロイドの形成は、トランスフェクションまたは形質導入と組み合わせて、スフェロイドに蛍光タンパク質とバイオセンサーを装備することができます。例えば、アデノ随伴ウイルス。私たちの実験環境では、単一の光子を励起に使用することで、達成可能なイメージング深度は約60〜100μmです。ただし、これは、レーザー出力と多光子イメージングの可用性、蛍光プローブの発光特性と検出器の感度、およびスフェロイドが生着する目の角度に依存します。画像取得後、Image JやImarisなどの一般的なプログラムを使用して、ダウンストリームの画像解析を実行できます。例えば、FUCCIレポーターの場合、緑色の細胞周期活性細胞をカウントし、赤血球の総数と対比して、生着したスフェロイド内の細胞周期活性を評価することができます。さらに、ACEイメージングプラットフォームにより、物質を眼に塗布(点眼剤の形で)したり、ACEに直接注入して移植片を治療し、その反応をモニターすることができます。死後、移植されたスフェロイドは手動の顕微鏡解剖によって容易に回収でき、免疫蛍光染色、トランスクリプトーム分析などの ex vivo 技術によって貴重な情報を提供できます10。
この手法には一定の制限があります。1つ目は、私たちの経験から、レシピエントマウスはアルビノ、つまり色素沈着していない虹彩を持っている必要があるということです。生着すると、肝スフェロイドは虹彩細胞の単層で覆われるようになり、スフェロイドの生存率や機能には影響しませんが、虹彩細胞の色素がイメージングを妨げます。2番目の考慮事項は、麻酔をかけたマウスの眼内イメージング中の安定性です。 in vivo イメージングセッション中は、動物の麻酔濃度と呼吸を注意深く監視して、動きを最小限に抑える必要があります。しかし、ここで示したイメージング設定を用いることで、シングルセルレベルでの高分解能イメージングを実現することができます。
要約すると、このプロトコルは、マウスの眼に生着した肝臓様組織の非侵襲的な in vivo イメージングプラットフォームの実装を記述します。私たちは、簡単な手順、一般的な機器、手頃な価格の材料を使用しているため、多くの研究者にとって達成可能なアプローチとなっています。このモデルは、 in vitro 3D肝スフェロイドの利点と、ACEが提供する in vivo 環境および光学的アクセス可能性を組み合わせて、基礎研究および前臨床環境で肝臓生理学および病理学を研究するための貴重なプラットフォームを作成します。
開示事項
P-OBはBiocrine ABの共同設立者兼CEOであり、IBLとBLはBiocrine ABのコンサルタントです。
謝辞
この研究は、スウェーデン糖尿病協会、カロリンスカ研究所の基金、スウェーデン研究評議会、ノボノルディスク財団、ファミリーアーリングペルソン財団、カロリンスカ研究所の糖尿病の戦略的研究プログラム、ファミリークヌートアンドアリスワレンバーグ財団、ジョナス&クリスティーナアフヨクニック財団、スウェーデン糖尿病学会、ERC-2018-AdG 834860-EYELETSの支援を受けました。図形図はFL-Bが BioRender.com を用いて作成しました。
資料
| Name | Company | Catalog Number | Comments |
| 27 G butterfly needle | Venofix | 4056388 | |
| AAV8-CAG-GFP | Charles River | CV17169-AV9 | Incubated with isolated hepatocytes at 1 µL/mL during liver spheroid formation |
| Absolute and 70% ethanol | N/A | N/A | |
| Absorbent pad | Attends | 203903 | |
| Albumin-Cre;RCL-tdTomato (B6.Cg-Speer6-ps1Tg(Alb-cre)21Mgn/J ; B6.Cg-Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J) | Jackson | #003574 and #007914 | Mice obtained from in-house breeding |
| B6 albino mice (B6(Cg)-Tyrc-2J/J) | Jackson | #000058 | Mice obtained from in-house breeding |
| B6;129P2-Gt(ROSA)26Sor[tm1(CAG-Venus/GMNN,-Cherry/CDT1)Jkn]/JknH | INFRAFRONTIER/EMMA | EM:08395 | Mice obtained from in-house breeding |
| BD Insyte IV Catheter 24 G x 0.75 in | BD Medical | 381212 | |
| Borosillicate standard glass cappilaries | World Precision Instruments | 1B150-4 | |
| Cell lifter | Corning | 3008 | |
| Cell strainer, 70 µm | Falcon | 352350 | |
| Custom-made metal plate | Hardware store | N/A | |
| Dexamethasone | Sigma-Aldrich | D4902 | |
| Dual-Stage Glass Micropipette Puller | Narshige | Model PC-100 | |
| EDTA | Sigma-Aldrich | E9884 | |
| Electric heating pad | Hardware store | N/A | |
| FBS | Gibco | N/A | |
| GlutaMAX | Gibco | 35050061 | |
| Green CMFDA | Abcam | ab145459 | Reconstituted in DMSO, administered at 100 µg/mouse in PBS 10% FBS |
| Hamilton syringe | Hamilton | 81242 | Model 1750 Luer Tip Threaded Plunger Syringe, 500 µL |
| HBSS; no calcium, no magnesium and no phenol red | Gibco | 14175095 | |
| HCX IRAPO L 25x/0.95 W objective | Leica | N/A | |
| HEPES | Gibco | 15630080 | |
| Induction chamber 0.8 L | Univentor | 8329001 | |
| Insulin-Transferrin-Selenium (ITS-G) | Gibco | 41400045 | |
| Isoflurane | Baxter | N/A | |
| Lectin DyLight-649 | Invitrogen | L32472 | Administered at 1 mg/mL and 100 µL/mouse |
| Liberase TM Research Grade | Sigma-Aldrich | 5401127001 | |
| Microelectrode beveler | World Precision Instruments | Model BV-10 | |
| Mouse head-holder and gas mask | Narshige | Model SGM-4 | |
| Nunclon Sphera 96-Well, U-Shaped-Bottom Microplate | Thermo Fisher | 174929 | |
| Oculentum simplex | APL | N/A | |
| PBS 10x | Gibco | 14080055 | |
| PBS 1x; no calcium, no magnesium | Gibco | 14190144 | |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Percoll | Sigma-Aldrich | P1644 | |
| Peristaltic pump | Ismatec | Model ISM795 | |
| PharMed BPT Pump Tubing | VWR | VERN070540-07 | Inner diameter 0.76 mm, outer diameter 2.46 mm |
| pHrodo Red-LDL | Invitrogen | L34356 | Administered at 1 mg/mL and 100 µL/mouse |
| Portex Fine Bore Polyethylene Tubing | Smiths Medical | 800/100/140 | Inner diameter 0.4 mm, outer diameter 0.8 mm |
| Silicone dissection mat | Hardware store | N/A | |
| Sodium chloride 0.9% | Braun | N/A | |
| Solid Universal Joint | Narshige | Model UST-2 | |
| Stereomicroscope | Leica | Model M80 | |
| Suspension culture dish 35 mm | Sarstedt | 833900500 | |
| Temgesic | Indivor | N/A | Administered s.c. at 0.05 mg/mL and 2 µL/g mouse |
| Translucent Silicone Tubing | VWR | 228-1450 | Inner diameter 1.5 mm, outer diameter 3 mm |
| Trypan Blue | Sigma-Aldrich | T8154 | |
| Univentor 400 Anesthesia unit | Univentor | 8323001 | |
| Upright laser scanning confocal microscope | Leica | Model TCS SP5 II | |
| Viscotears | Novartis | N/A | |
| William's E Medium; no glutamine, phenol red | Gibco | 22551089 |
参考文献
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Sci Rep. 6, 25187(2016).
- Lauschke, V. M., et al. Massive rearrangements of cellular MicroRNA signatures are key drivers of hepatocyte dedifferentiation. Hepatology. 64 (5), 1743-1756 (2016).
- Oliva-Vilarnau, N., Vorrink, S. U., Ingelman-Sundberg, M., Lauschke, V. M. A 3D cell culture model identifies Wnt/beta-catenin mediated inhibition of p53 as a critical step during human hepatocyte regeneration. Adv Sci (Weinh). 7 (15), 2000248(2020).
- Hurrell, T., et al. Human liver spheroids as a model to study aetiology and treatment of hepatic fibrosis. Cells. 9 (4), 964(2020).
- Kozyra, M., et al. Human hepatic 3D spheroids as a model for steatosis and insulin resistance. Sci Rep. 8 (1), 14297(2018).
- Lauschke, V. M., Shafagh, R. Z., Hendriks, D. F. G., Ingelman-Sundberg, M. 3D primary hepatocyte culture systems for analyses of liver diseases, drug metabolism, and toxicity: Emerging culture paradigms and applications. Biotechnol J. 14 (7), e1800347(2019).
- Shibuya, K., et al. The efficacy of the hepatocyte spheroids for hepatocyte transplantation. Cell Transplant. 30, 9636897211000014(2021).
- Hamazaki, K., Doi, Y., Koide, N. Microencapsulated multicellular spheroid of rat hepatocytes transplanted intraperitoneally after 90% hepatectomy. Hepatogastroenterology. 49 (48), 1514-1516 (2002).
- Marques, P. E., et al. Imaging liver biology in vivo using conventional confocal microscopy. Nat Protoc. 10 (2), 258-268 (2015).
- Lazzeri-Barcelo, F., et al. Intraocular liver spheroids for noninvasive high-resolution in vivo monitoring of liver cell function. Nat Commun. 15 (1), 767(2024).
- Speier, S., et al. Noninvasive in vivo imaging of pancreatic islet cell biology. Nat Med. 14 (5), 574-578 (2008).
- Leibiger, I. B., Berggren, P. O. Intraocular in vivo imaging of pancreatic islet cell physiology/pathology. Mol Metab. 6 (9), 1002-1009 (2017).
- Charni-Natan, M., Goldstein, I. Protocol for Primary Mouse Hepatocyte Isolation. STAR protocols. 1 (2), 100086(2020).
- Baze, A., et al. Three-dimensional spheroid primary human hepatocytes in monoculture and coculture with nonparenchymal cells. Tissue Eng Part C Methods. 24 (9), 534-545 (2018).
- Mohar, I., Brempelis, K. J., Murray, S. A., Ebrahimkhani, M. R., Crispe, I. N. Isolation of nonparenchymal cells from the mouse liver. Methods Mol Biol. 1325, 3-17 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved