Method Article
쥐 눈의 전방에 생착된 간 회전 타원체의 In vivo 이미징
* 이 저자들은 동등하게 기여했습니다
요약
여기에서는 쥐 눈의 전방에 생착된 간 스페로이드의 비침습적 in vivo 이미징을 허용하는 플랫폼에 대해 설명합니다. 워크플로우는 일차 간 세포에서 스페로이드를 생성하는 것부터 마우스 눈에 이식하고 컨포칼 현미경을 통해 세포 해상도로 생체 내 이미징을 수행하는 것까지 다양합니다.
초록
포유류의 간에 대한 생물의학 연구는 세포 해상도에서 생체 내 비침습적 종단 이미징을 위한 방법의 부족으로 인해 방해를 받고 있습니다. 지금까지는 세포 수준에서 고해상도 이미징을 제공하는 생체 내 이미징을 통해 간의 현장 광학 이미징이 가능했지만 여러 번 수행할 수 없으므로 동일한 동물에서 종방향으로 수행할 수 없었습니다. 생물 발광(bioluminescence)과 같은 비침습적 이미징 방법은 동일한 동물에 대한 반복적인 이미징 세션을 허용하지만 세포 해상도를 달성하지는 못합니다. 이러한 방법론의 차이를 해결하기 위해 우리는 쥐 눈의 전방에 생착된 간 스페로이드의 비침습적 in vivo 이미징을 위한 플랫폼을 개발했습니다. 이 연구에서 설명된 워크플로우에서 1차 마우스 간 스페로이드는 시험관에서 생성되어 수혜자 마우스의 눈 전방에 이식되어 홍채에 생착됩니다. 각막은 기존의 컨포칼 현미경으로 생착된 스페로이드를 이미지화할 수 있는 자연스러운 신체 창 역할을 합니다. 스페로이드는 눈에서 수개월 동안 생존하며, 이 기간 동안 세포는 건강 및 질병의 맥락에서 연구될 수 있을 뿐만 아니라 적절한 형광 프로브를 사용하여 반복적인 이미징 세션을 통해 다양한 자극에 대한 반응으로 모니터링될 수 있습니다. 이 프로토콜에서는 이 이미징 시스템을 구현하는 데 필요한 단계를 분석하고 그 잠재력을 가장 잘 활용하는 방법을 설명합니다.
서문
건강 및 질병 중 포유류의 간 기능 모니터링은 고해상도, 비침습적 생체 내 이미징 기술의 부족으로 인해 제한됩니다. 이 장기의 시각화는 접근할 수 없는 위치로 인해 방해를 받고 있으며, 세포 과정을 결합하기 위해 생체 내 연구는 서로 다른 시점에서 동물의 희생에 의존합니다. 이러한 이미징 제한을 피하기 위해 많은 작업이 통제된 환경에서 간과 같은 미세 조직을 시각화하고 연구하는 체외 모델에 의존하고 있습니다.
최근 몇 년 동안 간 스페로이드와 같은 3차원 배양 시스템의 개발은 간 연구를 지원하고 발전시켰습니다. 간 스페로이드는 간 조직의 미세환경과 복잡한 세포-세포 상호작용을어느 정도 모방하는 다세포 응집체이며1 기존의 단층 배양에 비해 분명한 이점을 제공합니다 2,3. 간 스페로이드는 또한 다양한 간 질환 4,5,6에 대한 모델로 사용되며 질병 메커니즘을 이해하는 데 중요한 역할을 합니다. 그럼에도 불구하고 현재 in vitro liver 모델의 주요 한계는 생리학적 in vivo 환경이 부족하고 배양에서의 활용 시간이 제한적(약 20일)이라는 것입니다3. 간 스페로이드는 이전에 생체 내 다른 부위, 예를 들어 신장 캡슐(kidney capsule)7 아래 또는 복강 내(intraperitoneally)8와 같은 다른 부위에 이식되었는데, 이는 광학 이미징을 위해 접근할 수 없다. 생체 내 간 이미징은 세포 해상도 실시간 이미징을 제공하는 최첨단 기술입니다. 현재 이러한 상피내 간 영상은 외부 장기에서만 가능하며, 이는 매우 침습적이며 종종말기 9입니다. 복부 창문을 삽입하면 반복적인 간 영상 촬영이 가능하지만 복잡한 수술과 사후 관리가 수반됩니다.
세포 해상도에서 종단 모니터링을 수행하기 위해 간 스페로이드를 생쥐의 안구 전방(ACE)에 이식하는 방법을 조사했으며, 여기서 간과 유사한 조직이 생리학적 환경에 생착되고 신체 자극에 연결되어 광학 이미징에 접근할 수 있습니다. 각막은 투명한 조직이며 홍채에 생착된 미세조직을 컨포칼 현미경으로 비침습적 및 종방향으로 이미징할 수 있는 창 역할을 합니다. 여기에서는 간 스페로이드10의 in vivo 이미징을 위해 새로 개발된 이 플랫폼의 워크플로우를 제시합니다. 이 프로토콜은 (1) 1차 마우스 간 세포 추출 및 간 스페로이드의 시험관 내 형성, (2) 간 스페로이드를 수혜 마우스의 ACE에 이식, (3) 마취된 마우스에서 생착된 간 스페로이드의 in vivo 이미징으로 나뉘며 구현을 위한 단계별 가이드입니다. 또한 이 이미징 플랫폼의 몇 가지 가능성과 응용 분야를 선보일 것입니다.
프로토콜
동물에게 행해진 모든 시술은 카롤린스카 연구소의 동물실험윤리위원회(Animal Experiment Ethics Committee)의 승인을 받았다.
1. in vitro에서 1차 마우스 간세포 추출 및 간 스페로이드 생성
- 준비
- 캐뉼레이션, 간 절제 및 일차 간 세포의 분리를 위해 혈청학적 피펫 및 원심분리기 튜브(그림 1A) 외에도 다음과 같은 멸균 또는 일회용 재료를 준비합니다: 연동 펌프, 스윙 버킷 원심분리기, 흡수 패드, 해부 매트, 곡선 팁 겸자 2개, 수술용 가위, 27G 버터플라이 바늘 1개, 70μm 세포 여과기 1개, 세포 리프터 1개, 100mm 페트리 접시 1개, 세포 계수 챔버 및 96-Well, U-shaped-bottom microplates.
- 표 1에 나열된 간 관류, 일차 간 세포의 분리 및 간 스페로이드 생성에 사용되는 용액을 준비합니다.
참고: Digestion buffer와 Gradient 용액은 신선하게 준비해야 합니다. - 42°C 수조에서 간으로 용액을 전도하는 연동 펌프로 구성된 관류 시스템을 설정합니다(그림 1A). 수조의 온도가 높을수록 완충액이 최적의 온도인 37°C에서 간에 도달합니다. 튜브 길이와 실내 온도(RT)에 따라 이를 사용자 정의하십시오.
- 캐뉼레이션의 경우 27G 버터플라이 바늘을 튜브 끝에 맞춥니다. 최종 분리 단계에서 사용되는 도금 매체를 4°C로 유지합니다.
- 절차
- 50mL 원심분리기 튜브의 42°C 수조에서 PBS 40mL, 관류 완충액 20mL, 분해 완충액 12mL를 사전 가열합니다.
- 펌프 튜브를 청소하고 따뜻하게 하려면 예열된 PBS 약 20mL를 순환시킵니다.
- 튜브를 관류 완충액으로 변경하고 튜브와 버터플라이 바늘을 프라이밍한 다음 유속을 4mL/분으로 설정합니다. 프로토콜 전체에서 버퍼를 변경하는 동안 튜브에 기포가 없는지 확인하십시오.
- 자궁 경부 탈구로 쥐를 안락사시키고 바늘을 사용하여 팔다리를 해부판에 고정합니다.
- 복부 털을 70% 에탄올로 적시고 해부하여 소화 기관에 접근합니다.
- 장을 오른쪽으로 움직여 문맥과 하대정맥을 노출시킵니다(그림 1B).
- 바늘을 수평 위치에 놓고 대정맥을 길이의 약 절반으로 캐뉼레이팅하고 안정적인지 확인한 다음 펌프를 시작합니다.
- 간이 팽창하기 시작하거나 간엽에 흰 점이 나타나면 문맥을 절단하여 혈액과 관류 완충액이 배출될 수 있도록 합니다.
- 간은 즉시 데치기 시작해야 합니다. 구부러진 집게를 사용하여 5초 간격으로 문맥을 고정하도록 권장합니다.
- 간이 노랗게 변하고 피가 없어질 때까지 1.2.9단계를 반복합니다(약 15-20mL의 관류 완충액).
- 연동 펌프를 중지하여 튜브를 분해 완충액으로 변경하고 펌프를 다시 시작합니다. 분해 완충액이 간에 도달하면 유속을 2.5mL/분으로 줄입니다.
참고: 소화 완충액의 페놀 레드는 간으로의 도착을 구별하고 치료 중 펌프 매개변수를 조정할 수 있도록 합니다. - 완충액이 모든 간엽에 도달하고 적절한 소화를 보장하도록 하려면 1.2.9단계를 여러 번 반복하십시오.
- 소화 완충액이 고갈되거나 간이 충분히 소화된 것처럼 보일 때 연동 펌프의 흐름을 멈춥니다.
참고: 소화 정도는 집게로 간엽을 부드럽게 꼬집고 조직에 작은 자국이 나타나는지 확인하여 육안으로 모니터링할 수 있습니다. 간도 약해진다. - 간을 적출하려면 복강 내의 간 인대와 연결부를 절단하여 완전히 제거하는 것을 목표로 하고 10mL의 냉간 도금 배지가 들어 있는 페트리 접시에 넣습니다(표 1).
- 담낭을 제거한 후 겸자를 사용하여 엽을 약간 꼬집어 간낭을 가볍게 찢습니다. 접시에서 간을 흔들어 세포가 배지로 쏟아져 나오는 것을 관찰하십시오.
- 집게로 간을 안정되게 잡고 세포 리프터를 엽을 따라 부드럽게 당겨 세포를 방출합니다.
참고: 올바른 소엽 간 소화는 조직 조각이 아닌 매체에서 세포 현탁으로 이어집니다. - 혈청학적 피펫을 사용하여 페트리 접시에서 세포 현탁액을 수집하고 50mL 원심분리기 튜브에 놓인 70μm 세포 여과기를 통해 여과합니다. 신선한 도금 매체를 사용하여 소화 된 간 세포의 접시를 씻고 필터로 옮깁니다.
- 4 °C에서 5분 동안 50 x g 으로 원심분리하여 세포를 펠릿화합니다.
- 상층액을 제거하고 약 1mL를 남겨 세포 펠릿을 덮고 튜브를 소용돌이쳐 세포를 재현 탁한 다음 점차적으로 10mL의 냉간 도금 매체를 추가합니다.
- 10mL의 그래디언트 용액을 세포 현탁액에 넣고 튜브를 10회 부드럽게 뒤집습니다.
- 200 x g 에서 4 °C에서 10분 동안 원심분리합니다.
- 펠릿에는 간세포가 풍부해진 생존 가능한 간세포가 포함되어 있는 반면, 상층액에는 죽은 세포와 파편이 포함되어 있습니다. 혈청학적 피펫을 사용하여 상층액을 버리고 약 1mL를 남기고 부드럽게 휘젓습니다.
- 셀 현탁액에 20mL의 냉간 도금 매체를 추가하고 4°C에서 5분 동안 50 x g 으로 원심분리하여 그래디언트 용액을 씻어냅니다.
- 펠릿 위로 약 1mL를 남겨두고 상층액을 제거하고 20mL의 냉간 도금 매체에 세포를 재현탁시킵니다.
참고: 여기에서 세포 펠릿을 압축할 수 있으므로 필요한 경우 10mL 혈청학적 피펫을 사용하여 세포를 부드럽게 해리합니다. - 세포 계수 챔버와 Trypan Blue를 사용하여 세포 수와 생존율을 수동으로 측정합니다.
참고: 간세포 세포는 튜브에서 빠르게 침전됩니다. 그것들을 다시 매달기 위해 튜브를 몇 번 부드럽게 뒤집습니다. - 1200 cells/well의 도금 매체 200 μL/well에 간 세포를 96-well 초저 접착 플레이트에 파종합니다.
참고: 웰당 최적의 매체 부피는 200μL입니다. 그러나 100 μL/well에 세포를 파종할 수 있습니다. - 플레이트를 200 x g 에서 3분 동안 돌려 웰 중앙에 세포를 모읍니다.
- 세포를 배양(37 °C, 5% CO2)하고 자연적으로 5일 동안 스페로이드를 형성하도록 둡니다(그림 1C).
- 5일째에 웰에서 배지의 절반을 조심스럽게 제거하고 무혈청 유지 관리 배지로 교체합니다(표 1). 간 스페로이드를 이식할 준비가 된 10일까지 48시간마다 이 단계를 반복합니다.
참고: 배양된 간 스페로이드에서 캡슐과 같은 구조의 형성은 우수한 응집과 생존력을 보여줍니다.
2. 간 스페로이드를 안구 전방(ACE)에 이식
- 준비
- 간 스페로이드를 ACE에 이식하려면 다음 자원을 준비해야 합니다(그림 2A): 실체현미경, 이소플루란 마취 장치, 유도 챔버, 이소플루란, 가열 패드, 맞춤형 금속 베이스 플레이트, 마우스 헤드 홀더 및 방독면, 고체 유니버설 조인트에 부착된 겸자, Hamilton 500 μL 나사산 플런저 주사기, 실리콘, 폴리에틸렌 및 펌프 튜브, 맞춤형 무딘 유리 캐뉼라 또는 24G 카테터, 에탄올 70%, 멸균 식염수, 멸균 23G 바늘, 눈 연고(액상 파라핀과 바셀린을 1:1 비율로 사용), 일회용 1mL 주사기 및 세포 현탁액 접시 35mm.
- Hamilton 주사기, 튜브 및 캐뉼러를 70% 에탄올과 식염수를 통과시켜 청소합니다.
- Hamilton 주사기, 튜브 및 유리 캐뉼러에 식염수를 채우고 테이프로 Hamilton 주사기를 수평으로 벤치에 고정합니다(그림 2A).
- 맞춤형 뭉툭한 유리 캐뉼라를 사용하십시오.
- 2단계 마이크로피펫 풀러를 사용하여 붕규산 유리 모세관을 >300μm의 내경으로 늘려 스페로이드를 흡인할 수 있도록 합니다.
- 미세 전극 베벨러를 사용하여 팁을 경사지고 무디게 하고 캐뉼라 팁을 몇 초 동안 화염에 노출시켜 가장자리를 부드럽게 합니다.
알림: 미세 전극 베벨러는 수동으로 작동되는 회전 샌딩 스톤으로 구성됩니다. 따라서 특정 설정은 적용할 수 없습니다.
- 또는 24G 카테터의 플라스틱 부분을 사용하여 캐뉼라를 구성합니다(그림 2B).
- 마취 이소플루란 장치를 준비하고 가열 패드를 37°C로 예열합니다.
- 단단한 유니버설 조인트에 부착된 집게의 끝부분을 폴리에틸렌 튜브 조각으로 덮어 고리를 형성하면 눈을 안정시키는 데 도움이 됩니다.
- 피펫과 200 μL 팁을 사용하여 유지 배지가 있는 96-well plate의 간 스페로이드를 35 mm cell suspension dish에 옮깁니다.
- 절차
- 2.5% 이소플루란과 280mL/분 공기를 사용하여 유도 챔버에서 마우스를 마취합니다.
- 쥐가 의식을 잃었을 때 마취를 1.8% 이소플루란과 280mL/min 공기로 낮추고 마취 튜브를 헤드 홀더에 연결한 다음 동물을 가열 패드로 빠르게 옮겨 코를 헤드 홀더 내부에 위치시킵니다.
- 나사로 머리를 고정하고 소켓에서 눈을 부드럽게 빼낸 다음 집게로 고정하고 양쪽 눈에 식염수를 한 방울 떨어뜨려 건조를 방지합니다.
- 스테레오스코프 아래에서 Hamilton 주사기를 사용하여 간 스페로이드를 흡입하고 캐뉼라 끝으로 모으고 깨끗한 표면에 수평으로 놓습니다.
참고: 간 스페로이드와 함께 매체를 흡입하면 캐뉼라 벽에 달라붙는 것을 방지하는 데 도움이 됩니다. - 23G의 바늘을 사용하여 각막을 조심스럽게 뚫고 스며드는 수액을 티슈로 말리십시오. 필요한 경우 절개 부위를 더 넓히기 위해 바늘을 조심스럽게 옆으로 밀어 각막을 자릅니다.
참고: 일회용 멸균 바늘을 사용하여 각막 천자를 수행하므로 절개 전에 각막을 소독하지 않습니다. - 눈이 건조해지지 않도록 눈에 식염수를 넣으십시오.
- 간 스페로이드가 들어있는 캐뉼라를 잡고 수직으로 잡아 스페로이드가 캐뉼라 끝 쪽으로 끌릴 수 있도록 합니다.
- 캐뉼라를 구멍에 부드럽게 삽입하고 베벨이 동공을 향하게 하여 Hamilton 주사기를 사용하여 간 스페로이드를 ACE로 천천히 배출합니다(그림 2C).
알림: 캐뉼라를 제거하기 전에 눈 안팎의 액체 압력이 재조정되고 스페로이드가 눈 밖으로 다시 빠져나가지 않도록 몇 초 동안 기다리는 것이 좋습니다. - 각막 바깥쪽에서 캐뉼라 끝으로 각막을 부드럽게 찔러 간 회전 타원체를 동공 주위로 배치하고 절개 부위에서 멀리 떨어뜨립니다(그림 2C).
- 간 회전 타원체가 홍채에 정착할 때까지 5~10분 동안 기다렸다가 집게에서 눈을 떼십시오.
- 수술한 눈에 바셀린 눈 연고를 바르면 각막을 윤활하고 치유하는 데 도움이 됩니다.
- 원하는 경우 동일한 방법에 따라 두 번째 눈 수술을 진행하십시오.
- 쥐를 깨우기 전에 수술 후 불편함을 피하기 위해 진통제를 투여하십시오(예: 멸균 식염수에 0.1mg/kg 부프레노르핀을 넣고 피하 투여).
참고: 이 작은 절차에서 빠르게 회복하고 통증이나 변화된 행동의 징후를 보이지 않았기 때문에 생쥐에게 진통제의 단 한 가지 용량만 투여되었습니다. 이 절차는 매우 빠르고(10분 미만 소요) 경미한 불편함만 유발하기 때문에 생쥐는 동물을 깨우기 전에 투여된 수술 후 진통제 외에는 수술 후 관리가 필요하지 않습니다.
3. ACE에서 생착된 간 스페로이드의 In vivo 이미징
- 준비
- ACE에 생착된 간 스페로이드의 비침습적 in vivo 이미징을 위해 정립 컨포칼 현미경, 장거리 침지 대물렌즈, 이소플루란 마취 장치, 유도 챔버, 이소플루란, 가열 패드, 맞춤형 금속 베이스 플레이트, 마우스 헤드 홀더 및 방독면, 고형 유니버설 조인트에 부착된 겸자, 인공 눈물 젤, 눈 연고(액체 파라핀과 바셀린을 1:1 비율로 사용).
- 옵션 재료에는 주사 가능한 형광 프로브, 일회용 주사기 및 꼬리 정맥 주입을 위한 27G 바늘이 포함됩니다.
- 절차
- 2.5% 이소플루란과 280mL/분 공기를 사용하여 유도 챔버에서 마우스를 마취합니다.
- 쥐가 의식을 잃었을 때 마취를 1.8% 이소플루란과 280mL/min 공기로 낮추고 마취 튜브를 헤드 홀더에 연결한 다음 동물을 가열 패드로 빠르게 옮겨 코를 헤드 홀더 내부에 위치시킵니다.
- 나사를 사용하여 헤드 홀더의 헤드를 고정합니다.
- 인공 눈물 젤을 양쪽 눈에 한 방울 떨어뜨려 건조를 방지합니다.
- 이 시점에서 꼬리 정맥을 통해 형광 프로브를 정맥 주사하고 직후에 이미지를 촬영합니다.
- 머리를 기울이고 소켓에서 눈을 부드럽게 빼낸 다음 집게로 고정하고 대물렌즈 아래 위치에 고정합니다.
- 인공 눈물 젤을 넉넉하게 바르고 각막과 대물렌즈 사이의 공간을 채우고 접안렌즈를 통해 간 회전 타원체에 초점을 맞춥니다.
알림: 가능하면 접안렌즈 중 하나의 접안렌즈를 제거하여 비확대 시야를 확보하고 홍채의 스페로이드를 더 쉽게 찾을 수 있습니다. - 동물의 호흡 움직임에도 불구하고 고해상도 이미징을 얻으려면 25x 대물렌즈와 512 x 512 픽셀 형식, 600Hz의 스캔 속도 및 3μm의 Z 스택 두께와 같은 이미징 설정을 사용하십시오. 자세한 이미징 설정은 표 2를 참조하십시오.
참고: 이미징 전반에 걸쳐 마취 농도는 1.6-2.2mL/h 이소플루란으로 조정되어 얕고 제어된 호흡 리듬을 달성하여 동물의 움직임을 최소화합니다. - 이미징 세션이 끝나면 이소플루란을 제거하고 동물을 깨우기 전에 이미징된 눈을 바셀린 눈 연고로 치료합니다.
결과
간세포를 위해 농축된 일차 간세포는 2단계 콜라겐분해효소 관류를 통해 쥐의 간에서 분리되었으며, 연동 펌프를 사용하여 장기의 혈관 구조를 활용하여 모든 세포에 해리 효소를 전달하는 따뜻한 완충액을 간을 순환시켰습니다(그림 1A). 이를 위해 하대정맥(inferior vena cava)을 캐뉼러(cannurately)하고, 문맥(portal vein)을 잘라내어 완충액의 흐름을 허용했습니다(그림 1B). 먼저, HBSS 기반 완충액을 간을 통해 세척하여 혈액을 맑게 했습니다. 캐뉼레이션이 성공적이고 혈전이 없으면 간이 희어지고 몇 초 내에 노랗게 변합니다. 둘째로, Liberase 효소 혼합물을 포함하는 소화 완충액은 간을 통해서 단 하나 세포 현탁액으로 조직을 해리하기 위하여 회람되었습니다. 세포를 수동으로 계수하고 96웰 ULA(ultra-low-adherence) 플레이트에 파종하여 며칠 내에 스페로이드로 자체 조립할 수 있습니다. 5일째에 스페로이드가 형성되고 스페로이드와 경계를 이루는 얇은 캡슐은 성공적인 응집을 나타냅니다(그림 1C). 우리는 이식하기 위해 10일까지 기다렸고, 그 시점에서 스페로이드는 조밀하고 강력한 세포-세포 연결을 발달시켰습니다. 웰당 파종된 세포의 수는 각각 238μm ± 10μm, 248μm ± 17μm, 298μm ± 19μm(평균 ± SD) 직경의 1000, 1200 및 1500개 세포/잘 수율 스페로이드로 간 스페로이드의 크기를 결정했습니다(그림 1C, D). 이식을 위해 다음과 같은 이유로 약 250μm 직경의 스페로이드를 선택합니다: (1) 스페로이드 크기는 저산소증 및 괴사 코어를 피하기 위해 너무 크지 않아야 하지만 세포 간 통신을 지원하고 눈의 이식편 리모델링을 허용하기에 충분한 세포를 포함해야 합니다. (2) 이 크기의 스페로이드의 무게는 홍채 쪽으로 끌리고 생착을 개선할 수 있도록 합니다. (3) 이 크기는 마우스 눈 당 5-10 개의 스페로이드를 이식하는 것과 관련하여 적합합니다.
이식 수술에는 유리 캐뉼라에 연결된 수동 나사산 주사기가 필요합니다(그림 2A). 유리 캐뉼라는 마이크로피펫 풀러와 베벨러를 사용하여 미세하고 뭉툭한 팁을 갖도록 사내에서 개조한 붕규산 유리 모세관으로 구성됩니다. 더 간단한 대체 캐뉼러는 시판되는 플라스틱 카테터를 주사기 튜브에 연결하고 피펫 팁에 안정화하여 만들 수 있습니다(그림 2B). 수술은 각막 절개를 통해 간 스페로이드를 ACE에 접종하는 것으로 구성됩니다(그림 2C). 스페로이드는 이미징에 더 쉽게 접근할 수 있도록 동공의 경계에 배치되었으며 안구 각도로 이동하는 것을 방지했습니다. 알비노 마우스는 색소가 없는 홍채가 생착된 간 스페로이드의 생체 내 이미징을 가능하게 하기 때문에 이식에 사용되었습니다. 수혜자 마우스를 7-10개의 스페로이드/눈으로 양쪽 눈에 이식하고, 이식 후 3일(Tx 후)과 Tx 후 1주 및 1개월에 입체 이미지를 촬영하여 각막 치유 및 스페로이드 생착 성공을 문서화했습니다(그림 2D). 주목할 점은, 갓 이식했을 때와 완전히 생착했을 때 사이에 ACE에서 간 스페로이드의 모양이 변하는 것은 이식편이 홍채에 정착하고 스페로이드 위에 홍채 세포의 단층이 성장하기 때문입니다. ACE에서 간 스페로이드의 생착 성공률은 70%입니다(수컷 및 암컷 마우스 모두에서 n = 9개의 눈)(그림 2E). Tx 발병 후 첫 며칠은 생존과 생착에 가장 중요한데, 이는 수혜 동물이 각막이 치유되기 전에 눈을 비비고 스페로이드를 제거하기 때문일 수 있습니다. 간 스페로이드의 크기는 Tx 후에도 크게 다르지 않으며 모양의 변화는 이식편 리모델링 및 생착에 기인합니다(그림 2F). Tx 후 1개월에 홍채에 존재하는 모든 생착 스페로이드는 면역형광 염색에서 볼 수 있듯이 혈관화되고 신경 분포가 이루어졌습니다(그림 2G).
비침습적 in vivo 이미징은 정립 컨포칼 현미경과 장거리 침지 대물렌즈를 사용하여 마취된 수용 마우스에서 수행됩니다(그림 3A, 표 2). ACE의 형광 이미징은 그림 3B와 같이 다양한 접근 방식을 통해 달성할 수 있습니다. 형광 프로브를 수용 마우스의 순환에 주입하면 스페로이드 내의 다양한 세포 유형과 구조를 시각화할 수 있습니다. 혈관을 표시하기 위해 렉틴을 사용했고(그림 3C), 담관 네트워크를 관찰하기 위해 CMFDA를 사용했으며(그림 3D), 스페로이드 세포로의 활성 LDL 흡수를 확인한 pHrodo-LDL(그림 3E)을 사용했습니다. 리포터 마우스 모델에서 생성된 간 스페로이드도 사용할 수 있습니다. Albumin-Cre:tdTomato 스페로이드는 간세포의 라벨링 및 추적을 가능하게 했으며(그림 3F), FUCCI(Fluorescent Ubiquitin Cell Cycle Indicator) 바이오센서를 발현하는 스페로이드를 사용하여 단일 세포 해상도에서 세포주기 역학을 시각화했습니다(그림 3G). 마지막으로, 간 스페로이드는 이식 전에 시험관에서 유전자 변형이 가능하며, 아데노 관련 바이러스(AAV)-GFP 형질도입의 경우 6개월 이상 생체 내에서 발현이 관찰되었습니다(그림 3H).
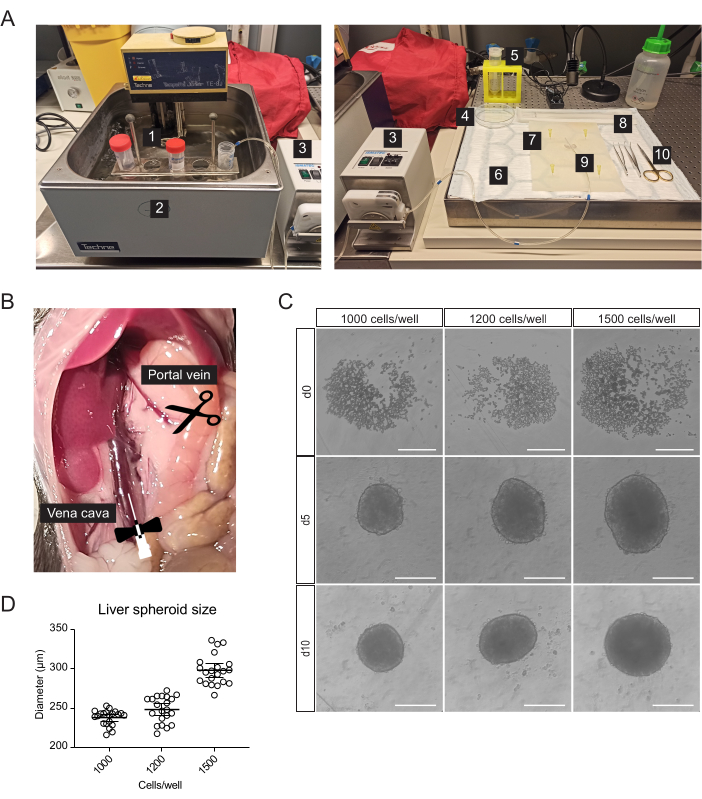
그림 1: 1차 마우스 간세포의 분리 및 간 스페로이드 생성. (A) 1차 마우스 간세포의 분리에 사용되는 재료 및 장비: 1. 격리 완충액; 2. 수조; 3. 연동 펌프; 4. 페트리 접시; 5. 세포 스트레이너; 6. 흡수성 패드; 7. 해부 매트; 8. 세포 기중기; 9. 나비 바늘 27 G; 10. 해부 도구. (B) 수술 중 복강: 대정맥을 캐뉼러(cannulat) 모양으로 관류하고 문맥을 잘라 완충액이 통과할 수 있도록 합니다. (C) 파종 후 0일(d0), 5(d5) 및 10(d10)일 후 시험관 내 간 스페로이드 형성에 대한 명시야 이미지, 스케일 바 = 200μm. (D) 다양한 세포 파종 농도에서의 간 스페로이드 크기, n = 21 스페로이드. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
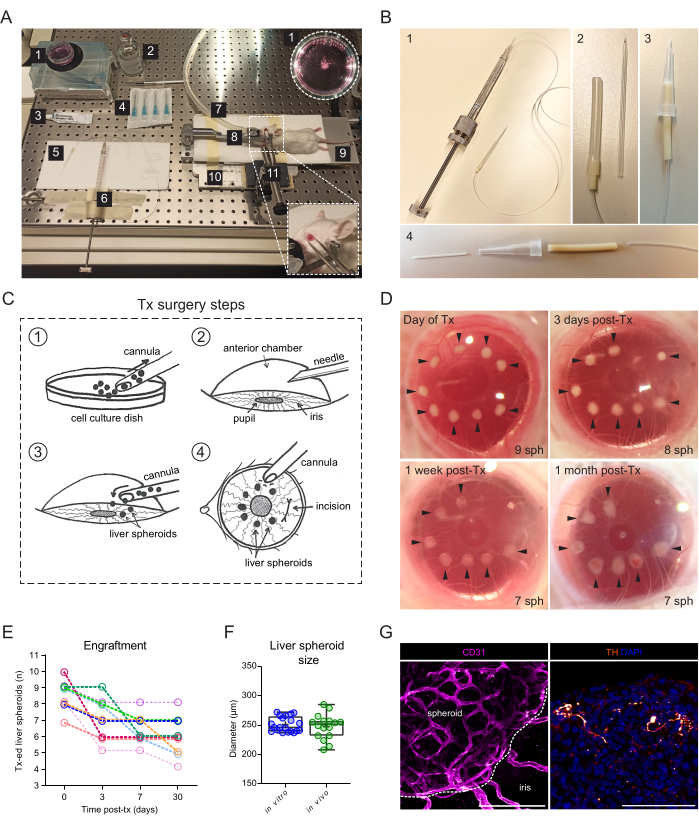
그림 2: 간 스페로이드를 마우스의 ACE에 이식 및 생착. (A) 간 스페로이드를 ACE에 이식(Tx)하는 데 사용되는 재료 및 장비: 1. 배양 접시의 간 스페로이드; 2. 메마른 식염수; 3. 눈 연고; 4. 바늘 23g; 5. 캐뉼라; 6. 해밀턴 주사기; 7. 마취 가스관; 8. 맨 위 홀더와 방독면; 9. 가열 패드; 10. 주문품 금속 기본 판; 11. 집게와 단단한 보편적인 합동. (B) 캐뉼라 및 Hamilton 주사기 설정: 1. Portex 튜브와 27G 바늘을 통해 Hamilton 주사기에 연결된 유리 캐뉼라; 2. 유리 캐뉼러는 실리콘 튜빙 및 PharMed 튜빙의 추가 세그먼트를 통해 Portex 튜빙에 연결됩니다. 3. 양자택일 조립된 플라스틱 캐뉼러; 4. 플라스틱 캐뉼라를 형성하는 부품: 24G BD Insyte 플라스틱 카테터는 PharMed 튜브를 통해 연결되고 안정성과 그립을 위해 절단된 10μl 피펫 팁에 끼워져 있습니다. (C) Tx 수술 단계의 그림: 1. 스페로이드는 캐뉼라에 수집됩니다. 2. 각막에 바늘로 구멍을 뚫었다. 3. 캐뉼라가 절개 부위에 삽입되고 스페로이드가 ACE로 방출됩니다. 4. 눈 바깥쪽에서 스페로이드는 동공에 가깝게 위치하고 절개 부위에서 멀리 떨어져 있습니다. (D) 수술 당일과 Tx 후 3일, 7일, 30일에 쥐 눈에 있는 간 회전 타원체(sph)의 입체 이미지. 화살표는 생존 가능한 스페로이드를 나타냅니다. (E) 간 스페로이드(1200개 세포/웰 크기) Tx 후 생착률, n= 6마리의 수혜 마우스에서 9개의 눈. (F) 이식 전(시험관외, 단일 제제에서 n= 20개의 스페로이드) 및 ACE에서 Tx 1개월 후 배양 중인 간 스페로이드의 크기(생체 내, 3마리의 수혜 마우스에서 n= 16개의 스페로이드), 수직 및 수평 직경의 평균으로 계산. (G) Tx 후 2개월에 생착된 간 스페로이드의 면역형광 염색, 혈관화(CD31, 분홍색, 점선은 스페로이드 종괴를 나타냄) 및 교감신경 분포(티로신 하이드록실라아제(TH), 주황색), 눈금 막대 = 100μm. 패널 F에 대한 데이터는 Lazzeri-Barcelo et al.10의 허가를 받아 조정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
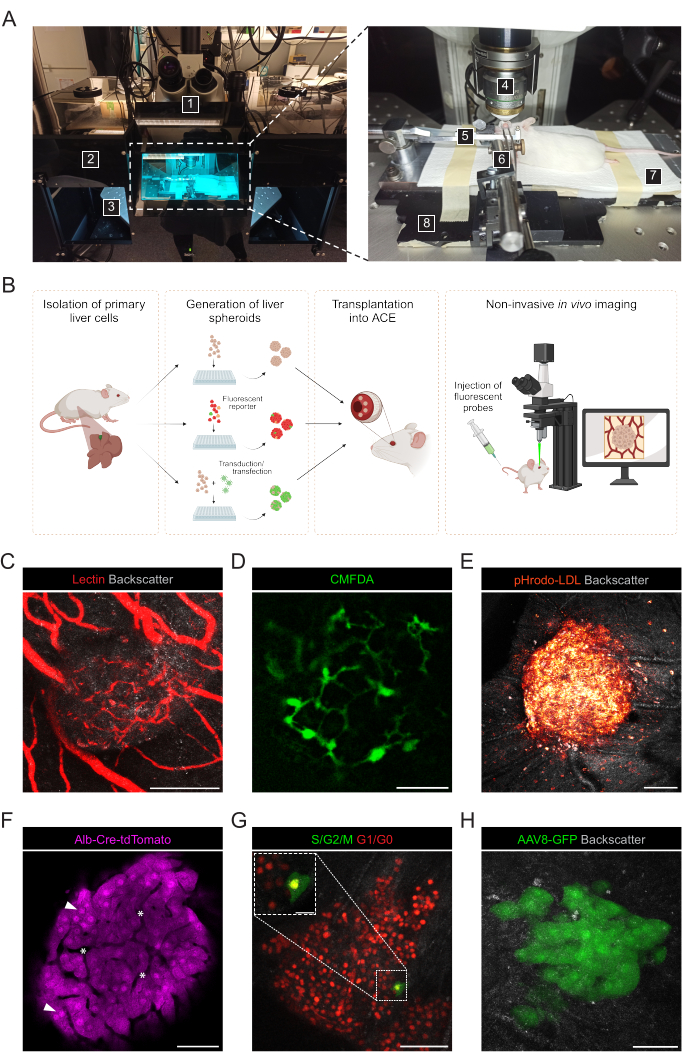
그림 3: 생착된 간 스페로이드의 비침습적 인 공내 생체 내 이미징. (A) in vivo ACE 이미징에 사용되는 재료 및 장비: 1. 직립 레이저 스캐닝 컨포칼 현미경; 2. 어두운 상자; 3. 자동화된 XYZ 단계; 4. 담그는 목표; 5. 맨 위 홀더와 방독면; 6. 집게와 단단한 보편적인 합동; 7. 가열 패드; 8. 주문품 금속 기본적인 판. (B) 눈에 생착된 간 스페로이드의 형광 판독값의 in vivo 이미징에 사용되는 다양한 접근 방식을 보여주는 다이어그램. (C-H) 컨포칼 현미경에 의한 in vivo 이미징 중 ACE-liver spheroids의 대표 이미지. 후방 산란 신호는 스페로이드 부피와 구조를 관찰하는 데 사용됩니다. (C) 형광 렉틴의 i.v. 주입으로 표지된 혈관, 스케일 바 = 100 μm; (D) 형광 CMFDA의 주입으로 표지된 담즙 카날리큘리 네트워크, 스케일 바 = 50 μm; (E) 형광 pHrodo-LDL 프로브 주입에 의한 LDL 흡수, 스케일 바 = 100 μm; (F) Td-토마토 발현 간세포, 화살촉은 핵을 나타내고 별표는 스페로이드 내 혈관을 나타내며 눈금 막대 = 50μm; (G) FUCCI 발현 간 스페로이드의 세포 주기 역학 모니터링, 스케일 바 = 50μm(기본 이미지) 및 20μm(팽창). (H) Tx 전에 AAV8-GFP로 시험관에서 transduction하고 Tx 후 6개월에 눈에서 이미지화한 간 스페로이드, 눈금 막대 = 50μm. 패널 G의 이미지는 Lazzeri-Barcelo et al.10의 허가를 받아 각색되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: primary mouse hepatocyte의 분리에 사용되는 용액. 마우스 간세포 분리에 필요한 용액 및 완충액의 구성. Digestion buffer 및 Gradient 용액 성분은 분리 당일에 신선하게 혼합해야 합니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2. 간 스페로이드의 인공압 in vivo 이미징에 사용되는 컨포칼 Leica SP5 현미경 설정. 이 표는 Lazzeri et al.10의 허가를 받아 조정되었습니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
이 프로토콜은 ACE에 생착된 간 스페로이드의 안구 내 이미징을 위한 새로운 플랫폼을 설명합니다. ACE는 혈관, 신경 및 산소가 풍부한 독특한 생착 미세환경과 각막을 통한 이미징에 대한 접근성으로 인해 이전에 췌장 섬11,12과 같은 다른 장기 유래 미세조직의 이식 장소로 사용되었습니다. 생체 내 간 이미징을 통해 세포와 과정을 현장에서 시각화할 수 있지만 종단 모니터링은 불가능합니다. 복부 창문을 통한 간 영상 촬영은 복잡한 수술을 수반하며, 신체 내 장기의 움직임으로 인해 시간 경과에 따른 단세포 추적이 어렵습니다. 따라서 이 새로운 이미징 방법은 단일 세포 해상도에서 간 세포의 비침습적 종단 모니터링을 가능하게 합니다.
이 프로토콜은 세 부분으로 나뉩니다. 첫 번째는 Charni-Natan et al.13에서 채택한 2단계 콜라겐분해효소 관류를 통한 원발성 간세포의 분리로, 마취된 살아있는 동물 대신 죽은 쥐에 대해 간 관류를 수행한다는 차이점이 있습니다. 이러한 변화는 윤리적 고려 사항이 적고 유기체에서 마취 잔류물을 피하는 것과 같은 특정 이점을 제공합니다. 이 연구에서는 분리물의 간세포가 풍부한 부분에서 간 스페로이드를 생성하지만, 이는 다양한 조성의 공동 배양 스페로이드를 만들기 위해 다른 특수 프로토콜을 사용하여 다른 비실질 세포 집단을 분리할 가능성을 배제하지 않습니다14,15.
이 프로토콜의 두 번째 부분은 간 스페로이드를 수용 마우스의 ACE에 이식하는 것입니다. 이것은 마취된 마우스에서 수행되는 빠르고 간단한 수술(10분 미만)이며 수술 후 치료가 필요하지 않습니다. 각막 천자는 자가 밀봉되고 3-5일에 걸쳐 치유됩니다. 간혹 치유 과정에서 절개 부위 주변에 약간의 흐릿함이 관찰되지만 며칠 내에 사라집니다. 우리는 수술받은 동물의 눈에 전방 활막증이 나타난 사례를 경험하지 못했습니다. 우리는 깨끗하지만 개방된 실험실에서 이식 절차를 수행하며 수술한 눈의 감염 문제 없이 수행합니다. 눈에 스페로이드를 접종하고 생착하는 것은 시력을 손상시키거나 수용 동물의 행동을 변화시키지 않습니다. 이 프로토콜에서는 이식 수술과 생체 내 이미징 모두에 이소플루란 마취를 사용하며, 이는 마우스에서 잘 견디는 것입니다. 용량 의존적 효과로 인해 절차 전반에 걸쳐 쉽게 조정할 수 있으며 수면 및 기상 시간을 줄이는 이점을 제공합니다. 그러나 대체 주사 가능한 마취제를 사용할 수 있습니다. 이식 후, 일반적으로 스페로이드가 완전히 생착되고, 혈관화되고, 신경 분포가 형성될 때까지 1개월을 허용한 후 치료 중재 및 생체 내 이미징을 수행합니다. 또한 인간 간 스페로이드와 면역력이 저하된 수용 마우스를 사용하여 이식 및 생착이 가능하다는 것을 보여주었다10.
이 방법의 세 번째 부분은 ACE에서 생착된 간 스페로이드의 in vivo 이미징입니다. 이 프로토콜은 연구 이미징 시설에서 흔히 볼 수 있는 현미경 장비를 사용하는 in vivo 이미징 설정을 설명합니다. 더욱이, 마우스 헤드 홀더 및 플라스틱 캐뉼라와 같은 특수 재료는 현재 상업적으로 이용 가능합니다. 이 이미징 설정을 통해 z 절편을 캡처하고 레이저 침투 깊이와 형광 검출 깊이에 따라 스페로이드 구조의 3차원 재구성을 얻을 수 있습니다. 생착된 간 스페로이드에서 세포 기능을 모니터링하려면 세포 유형, 세포 기능 및 역학을 보고하는 형광 단백질의 시각화에 의존합니다. 따라서, 이 이미징 플랫폼은 단독으로 또는 조합하여 다양한 양식을 사용하여 활용될 수 있습니다: (1) 형광 프로브는 정맥 주사로 투여될 수 있습니다(예: 기능성 염료뿐만 아니라 세포를 라벨링하고 추적하기 위한 항체); (2) 간 스페로이드는 간 특이적 형광 단백질을 발현하는 리포터 마우스 모델로부터 분리된 세포로부터 생성될 수 있습니다(예: 세포주기 역학에 대해 보고하는 FUCCI 간 스페로이드; (3) 시험관 내에서 간 스페로이드의 형성은 transfection 또는 transduction과 결합하여 스페로이드에 형광 단백질 및 바이오센서를 장착할 수 있습니다. 예: 아데노 관련 바이러스. 실험 설정에서 excitation을 위해 단일 광자를 사용하여 달성할 수 있는 이미징 깊이는 대략 60-100 μm입니다. 그러나 이는 레이저 출력 및 다광자 이미징 가용성, 형광 프로브 방출 특성 및 검출기의 감도, 스페로이드가 생착되는 눈의 각도에 따라 달라집니다. 이미징 획득 후 Image J 및 Imaris와 같은 인기 있는 프로그램을 사용하여 다운스트림 이미지 분석을 수행할 수 있습니다. 예를 들어, FUCCI 리포터의 경우, 녹색으로 표시된 세포주기 활성 세포를 계수하고 총 적색 세포의 수와 대조하여 생착된 스페로이드 내의 세포 주기 활성을 평가할 수 있습니다. 또한 ACE 이미징 플랫폼을 사용하면 물질을 눈에 적용하거나(점안액 형태) ACE에 직접 주입하여 이식편을 치료하고 반응을 모니터링할 수 있습니다. 사후 이식된 스페로이드는 수동 미세해부로 쉽게 회수할 수 있으며 면역형광 염색, 전사체 분석 등과 같은 생체 외 기술을 통해 귀중한 정보를 제공할 수 있습니다.10.
이 기술에는 몇 가지 제한 사항이 있습니다. 첫 번째는 우리의 경험에 비추어 볼 때, 수혜 마우스는 알비노, 즉 색소가 없는 홍채를 가져야 한다는 것입니다. 생착 시 간 스페로이드는 홍채 세포의 단층으로 덮여 스페로이드의 생존력이나 기능에 영향을 미치지 않지만 홍채 세포의 색소는 이미징을 방해합니다. 두 번째 고려 사항은 마취된 마우스에서 안구 내 이미징 중 안정성입니다. in vivo 이미징 세션 중에는 동물의 마취 농도와 호흡을 면밀히 모니터링하여 움직임을 최소화해야 합니다. 그럼에도 불구하고 여기에 표시된 이미징 설정을 사용하여 단일 셀 수준에서 고해상도 이미징을 얻을 수 있습니다.
요약하자면, 이 프로토콜은 생쥐의 눈에 생착된 간 유사 조직의 비침습적 in vivo 이미징 플랫폼의 구현을 설명합니다. 우리는 쉬운 절차, 공통 장비 및 저렴한 재료를 사용하여 많은 조사관이 달성할 수 있는 접근 방식을 만듭니다. 이 모델은 in vitro 3D 간 스페로이드의 장점과 ACE가 제공하는 in vivo 환경 및 광학 접근성을 결합하여 기초 연구 및 전임상 환경에서 간 생리학 및 병리학을 연구하기 위한 귀중한 플랫폼을 만듭니다.
공개
P-OB는 Biocrine AB의 공동 창립자이자 CEO이며, IBL은 Biocrine AB의 컨설턴트입니다.
감사의 말
이 연구는 스웨덴 당뇨병 협회(Swedish Diabetes Association), 카롤린스카 연구소(Karolinska Institutet) 기금, 스웨덴 연구 위원회(Swedish Research Council), 노보 노디스크 재단(Novo Nordisk Foundation), 패밀리 얼링-페르손 재단(Family Erling-Persson Foundation), 카롤린스카 연구소(Karolinska Institutet)의 당뇨병 전략 연구 프로그램(Strategic Research Program in Diabetes at Karolinska Institutet), 패밀리 크누트 & 앨리스 발렌베리 재단(The Family Knut and Alice Wallenberg Foundation), 요나스 & 크리스티나 아프 요흐닉 재단(Jonas & Christina af Jochnick Foundation), 스웨덴 당뇨병 협회(Swedish Association for Diabetology) 및 ERC-2018-AdG 834860-EYELETS의 지원을 받았습니다. 그림 도면은 FL-B가 BioRender.com 를 사용하여 만들었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 27 G butterfly needle | Venofix | 4056388 | |
| AAV8-CAG-GFP | Charles River | CV17169-AV9 | Incubated with isolated hepatocytes at 1 µL/mL during liver spheroid formation |
| Absolute and 70% ethanol | N/A | N/A | |
| Absorbent pad | Attends | 203903 | |
| Albumin-Cre;RCL-tdTomato (B6.Cg-Speer6-ps1Tg(Alb-cre)21Mgn/J ; B6.Cg-Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J) | Jackson | #003574 and #007914 | Mice obtained from in-house breeding |
| B6 albino mice (B6(Cg)-Tyrc-2J/J) | Jackson | #000058 | Mice obtained from in-house breeding |
| B6;129P2-Gt(ROSA)26Sor[tm1(CAG-Venus/GMNN,-Cherry/CDT1)Jkn]/JknH | INFRAFRONTIER/EMMA | EM:08395 | Mice obtained from in-house breeding |
| BD Insyte IV Catheter 24 G x 0.75 in | BD Medical | 381212 | |
| Borosillicate standard glass cappilaries | World Precision Instruments | 1B150-4 | |
| Cell lifter | Corning | 3008 | |
| Cell strainer, 70 µm | Falcon | 352350 | |
| Custom-made metal plate | Hardware store | N/A | |
| Dexamethasone | Sigma-Aldrich | D4902 | |
| Dual-Stage Glass Micropipette Puller | Narshige | Model PC-100 | |
| EDTA | Sigma-Aldrich | E9884 | |
| Electric heating pad | Hardware store | N/A | |
| FBS | Gibco | N/A | |
| GlutaMAX | Gibco | 35050061 | |
| Green CMFDA | Abcam | ab145459 | Reconstituted in DMSO, administered at 100 µg/mouse in PBS 10% FBS |
| Hamilton syringe | Hamilton | 81242 | Model 1750 Luer Tip Threaded Plunger Syringe, 500 µL |
| HBSS; no calcium, no magnesium and no phenol red | Gibco | 14175095 | |
| HCX IRAPO L 25x/0.95 W objective | Leica | N/A | |
| HEPES | Gibco | 15630080 | |
| Induction chamber 0.8 L | Univentor | 8329001 | |
| Insulin-Transferrin-Selenium (ITS-G) | Gibco | 41400045 | |
| Isoflurane | Baxter | N/A | |
| Lectin DyLight-649 | Invitrogen | L32472 | Administered at 1 mg/mL and 100 µL/mouse |
| Liberase TM Research Grade | Sigma-Aldrich | 5401127001 | |
| Microelectrode beveler | World Precision Instruments | Model BV-10 | |
| Mouse head-holder and gas mask | Narshige | Model SGM-4 | |
| Nunclon Sphera 96-Well, U-Shaped-Bottom Microplate | Thermo Fisher | 174929 | |
| Oculentum simplex | APL | N/A | |
| PBS 10x | Gibco | 14080055 | |
| PBS 1x; no calcium, no magnesium | Gibco | 14190144 | |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Percoll | Sigma-Aldrich | P1644 | |
| Peristaltic pump | Ismatec | Model ISM795 | |
| PharMed BPT Pump Tubing | VWR | VERN070540-07 | Inner diameter 0.76 mm, outer diameter 2.46 mm |
| pHrodo Red-LDL | Invitrogen | L34356 | Administered at 1 mg/mL and 100 µL/mouse |
| Portex Fine Bore Polyethylene Tubing | Smiths Medical | 800/100/140 | Inner diameter 0.4 mm, outer diameter 0.8 mm |
| Silicone dissection mat | Hardware store | N/A | |
| Sodium chloride 0.9% | Braun | N/A | |
| Solid Universal Joint | Narshige | Model UST-2 | |
| Stereomicroscope | Leica | Model M80 | |
| Suspension culture dish 35 mm | Sarstedt | 833900500 | |
| Temgesic | Indivor | N/A | Administered s.c. at 0.05 mg/mL and 2 µL/g mouse |
| Translucent Silicone Tubing | VWR | 228-1450 | Inner diameter 1.5 mm, outer diameter 3 mm |
| Trypan Blue | Sigma-Aldrich | T8154 | |
| Univentor 400 Anesthesia unit | Univentor | 8323001 | |
| Upright laser scanning confocal microscope | Leica | Model TCS SP5 II | |
| Viscotears | Novartis | N/A | |
| William's E Medium; no glutamine, phenol red | Gibco | 22551089 |
참고문헌
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Sci Rep. 6, 25187 (2016).
- Lauschke, V. M., et al. Massive rearrangements of cellular MicroRNA signatures are key drivers of hepatocyte dedifferentiation. Hepatology. 64 (5), 1743-1756 (2016).
- Oliva-Vilarnau, N., Vorrink, S. U., Ingelman-Sundberg, M., Lauschke, V. M. A 3D cell culture model identifies Wnt/beta-catenin mediated inhibition of p53 as a critical step during human hepatocyte regeneration. Adv Sci (Weinh). 7 (15), 2000248 (2020).
- Hurrell, T., et al. Human liver spheroids as a model to study aetiology and treatment of hepatic fibrosis. Cells. 9 (4), 964 (2020).
- Kozyra, M., et al. Human hepatic 3D spheroids as a model for steatosis and insulin resistance. Sci Rep. 8 (1), 14297 (2018).
- Lauschke, V. M., Shafagh, R. Z., Hendriks, D. F. G., Ingelman-Sundberg, M. 3D primary hepatocyte culture systems for analyses of liver diseases, drug metabolism, and toxicity: Emerging culture paradigms and applications. Biotechnol J. 14 (7), e1800347 (2019).
- Shibuya, K., et al. The efficacy of the hepatocyte spheroids for hepatocyte transplantation. Cell Transplant. 30, 9636897211000014 (2021).
- Hamazaki, K., Doi, Y., Koide, N. Microencapsulated multicellular spheroid of rat hepatocytes transplanted intraperitoneally after 90% hepatectomy. Hepatogastroenterology. 49 (48), 1514-1516 (2002).
- Marques, P. E., et al. Imaging liver biology in vivo using conventional confocal microscopy. Nat Protoc. 10 (2), 258-268 (2015).
- Lazzeri-Barcelo, F., et al. Intraocular liver spheroids for noninvasive high-resolution in vivo monitoring of liver cell function. Nat Commun. 15 (1), 767 (2024).
- Speier, S., et al. Noninvasive in vivo imaging of pancreatic islet cell biology. Nat Med. 14 (5), 574-578 (2008).
- Leibiger, I. B., Berggren, P. O. Intraocular in vivo imaging of pancreatic islet cell physiology/pathology. Mol Metab. 6 (9), 1002-1009 (2017).
- Charni-Natan, M., Goldstein, I. Protocol for Primary Mouse Hepatocyte Isolation. STAR protocols. 1 (2), 100086 (2020).
- Baze, A., et al. Three-dimensional spheroid primary human hepatocytes in monoculture and coculture with nonparenchymal cells. Tissue Eng Part C Methods. 24 (9), 534-545 (2018).
- Mohar, I., Brempelis, K. J., Murray, S. A., Ebrahimkhani, M. R., Crispe, I. N. Isolation of nonparenchymal cells from the mouse liver. Methods Mol Biol. 1325, 3-17 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유