需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
啮齿动物口腔疾病模型中牙齿和牙槽骨的显微硬度测量
摘要
显微硬度是一种机械特性,也是评估硬组织病理生理学的信息参数。在这里,我们展示了一种标准化方案(样品制备、抛光、平坦表面和压痕位点),用于在啮齿动物口腔疾病模型中牙齿和牙槽骨的微硬度分析,即氟斑牙和结扎诱导的牙周骨吸收。
摘要
在口腔疾病模型(包括氟斑牙和牙周炎)中,在牙釉质、牙本质和骨骼中评估机械性能,即显微硬度。Micro-CT (μCT) 提供 3D 成像信息(体积和矿物质密度),扫描电子显微镜 (SEM) 产生微观结构图像(牙釉质棱柱体和骨腔隙-小管)。作为对μCT和SEM结构分析的补充,显微硬度是评估结构变化如何改变机械性能的信息参数之一。尽管这是一个有用的参数,但对口腔疾病中牙槽骨微硬度的研究是有限的。迄今为止,已经报道了不同的显微硬度测量方法。由于显微硬度值根据样品制备(抛光和平坦表面)和压痕位点的不同而变化,因此不同的方案可能会导致研究之间存在差异。显微硬度协议的标准化对于口腔疾病模型的一致和准确评估至关重要。在本研究中,我们展示了牙齿和牙槽骨中显微硬度分析的标准化协议。使用的标本如下:对于氟斑牙模型,从用/没有含氟水处理 6 周的小鼠中收集切牙;对于结扎诱导的牙周骨吸收(L-PBR)模型,从上颌第2磨牙 结扎的小鼠中收集具有牙周骨吸收的牙槽骨。结扎后 2 周,收集上颌骨。根据标准化方案分析这些样品中的维氏硬度。该协议为切牙和牙槽的树脂包埋、连续抛光和压痕位点提供了详细的材料和方法。据我们所知,这是第一个标准化的微硬度协议,用于评估啮齿动物口腔疾病模型中牙齿和牙槽骨的机械性能。
引言
硬度是机械性能(例如弹性、硬度、粘弹性和断裂行为)之一,通常用于表征材料局部区域抵抗压缩变形和断裂的能力。静态压痕硬度测试是最常用的方法,包括维氏硬度和努氏硬度1。维氏硬度测试是通过在固定的测试载荷下将金刚石压头压入表面来实现的。压头呈金字塔形,底部为方形,相对面之间的夹角为 136°。测量在测试表面上形成的两条对角线的长度,并使用平均值来计算硬度,硬度由 F/A 比率确定(其中 F 是力,A 是压痕的表面积)。维氏显微硬度数(HV=F/A)通常以千克力(kgf)每mm2 压痕表示,1HV≈0.1891F/d2 (N/mm2)。努氏硬度也由两个不相等的相对角形成的菱形方形金字塔压头组成。努氏硬度数 (HK) 等于施加的负载与投影接触面积的比率。硬度测试分为微压痕(显微硬度)测试和宏观压痕测试,具体取决于施加在测试材料上的力。微压痕测试通常使用0.01-2 N(约1-203 gf)范围内的负载;同时,宏观压痕测试使用超过 10 N (10119 gf)1。
为了评估口腔疾病中牙齿硬组织的特征,包括牙齿和牙槽骨,使用显微CT(μCT)和扫描电子显微镜(SEM)进行结构分析。μCT 提供 3D 成像信息(体积和矿物质密度)2,SEM 产生微观结构图像(牙釉质棱镜和骨腔隙-小管)3。作为对μCT和SEM结构分析的补充,显微硬度是评估结构变化如何改变口腔疾病(例如牙釉质畸形和牙周骨吸收)中牙齿和牙槽骨机械性能的信息参数之一。人牙釉质的维氏显微硬度值(HV=283-374)约为牙本质(HV=53-63)的4-5倍4,5。在啮齿动物氟斑牙模型中,与对照牙釉质 (HV = 334) 相比,用氟化物处理的小鼠切牙 (HV = 334) 的牙釉质微硬度显着降低 6,7。这表明氟化牙釉质比非氟化牙釉质更柔软、更弱,矿物质含量更低,蛋白质含量更高。显微硬度用于评估骨骼的机械性能。之前的几项研究已经检查了来自不同解剖部位的人体骨骼的机械行为,包括长骨显微硬度 8,9,10。与非氟化股骨(HV = 294.4)相比,人氟化股骨的平均显微硬度显着降低(HV = 222.4)11。尽管这是一个有用的参数,但描述口腔疾病中牙槽骨微硬度(Vickers12 或 Knoop 13,14)的文献很少。
迄今为止,已经报道了不同的显微硬度测量方法。由于显微硬度值因样品制备(抛光和平坦表面)和压痕部位的不同而变化15 ,因此不同的方案可能会导致研究之间存在差异。显微硬度测试协议的标准化对于口腔疾病模型的一致和准确评估至关重要。在本研究中,我们展示了小鼠氟斑牙模型和牙周骨吸收模型中牙齿和牙槽骨显微硬度分析的标准化方案。
研究方案
本协议中描述的所有程序均按照奥古斯塔大学机构动物护理使用委员会 (IACUC) 批准的脊椎动物使用指南和规定执行,该大学获得国际实验动物护理协会 (AAALAC) 的认可。请注意,Suzuki博士受雇于奥古斯塔大学,在那里完成了小鼠氟斑牙实验。
1. 小鼠氟斑牙模型中下颌切牙的拔除
- 从氟化物前1周开始向C57BL / 6小鼠(5周龄,雄性)喂食无氟饲料,直至氟化物治疗终止。
- 通过在蒸馏水中加入NaF来制备氟化物水,然后使用0.2μm过滤器进行真空过滤。给动物以NaF(0ppm和125ppm;N=5/组) 随意6 周。每 2 天用新鲜制备的一批氟化物水替换氟化物水。
- 经过 6 周的氟化物水处理后,用 CO2 对动物实施安乐死,然后斩首。
- 用门牙从每只小鼠中提取半下颌骨。要用门牙收集半下颌骨,请在不用力的情况下切开下颌周围的肌肉。
- 将半下颌放入PBS中,并将其保持在4°C,直到μ-CT分析(可选)。使用手术刀 (#15) 和剪刀将门牙与下颌骨分开,而不会损坏或破坏标本。
- 用PBS清洗分离的切牙,并通过将其浸入增加强度的酒精(70%和100%乙醇)中进行脱水2-3小时。
注意:如果组织(例如,牙髓)没有充分脱水,树脂浸渍可能会受到抑制,并且后续评估可能不充分。 - 用乙醇脱水后,将门牙水平嵌入树脂中。继续执行步骤 3。
2. 小鼠结扎诱导牙周骨吸收 (L-PBR) 模型中上颌牙槽骨的提取
- 将 0.8 mL 氯胺酮 (100 mg/mL) + 0.1 mL 甲苯噻嗪 (100 mg/mL) + 9.1 mL PBS 腹膜内 (ip) 给予小鼠(C57BL/6,8-12 周龄,雄性)作为麻醉剂。用量为0.01mL/g(重量)。在麻醉下将眼药膏涂抹在双眼上,以防止干燥。
- 将麻醉的小鼠放在加热垫上5-10分钟。评估对尾部/脚趾捏合的反应和眼反射的完整性。确认小鼠对有害刺激没有反应并且反射不存在。
- 将鼠标放在治疗台上,并通过结扎5-0丝线将缝合线绑在治疗台上的磁柱上,保持嘴巴张开。
- 在手术显微镜下,使用微针架将结扎线(编织丝缝合线 6-0)缠绕在上颌第二磨牙(单层)的一侧。通过使用一侧作为治疗侧,另一侧作为对照,最大限度地减少分析中的个体差异。
- 系上结扎线,在上颚侧打一个结。打结后,将剩余的结扎线剪得尽可能短,以免过多的结扎线干扰咀嚼或进食。这对于确保结扎线在随后的观察期间不会因咀嚼而松动非常重要。
注意:在动物恢复足够的意识以保持胸骨卧位之前,不要让动物无人看管。在完全康复之前,不要将接受过手术的动物送回其他动物的陪伴下。在存活期间保持无菌条件。 - 随意给小鼠喂食饮食和水 2 周。结扎2周后,用CO2对小鼠实施安乐死,然后斩首。
- 从每只小鼠中取出两侧上颌骨(结扎侧和对照侧),并用臼齿。要用臼齿收集上颌骨,请使用剪刀切开上颌周围的肌肉和骨头,不要用力过大。将每个上颌骨置于PBS中,并将其保持在4°C,直到μCT分析(可选)。
- 使用手术刀(#15)和剪刀将带有臼齿(1至3rd)的牙槽骨与上颌骨分开,而不会损坏或破坏标本。
- 用PBS洗涤分离的肺泡骨,然后通过浸入增加强度的酒精(70%和100%乙醇)中脱水和脱脂2-3小时。
注意:如果组织(例如,牙髓和骨骼)没有充分脱水,树脂浸渍可能会受到抑制,并且随后的评估可能不充分。 - 用乙醇脱水后,将牙槽骨水平嵌入树脂中。继续执行步骤 3。
- 可选:在显微硬度测试之前执行 μCT 评估。
- 在进行显微硬度测试之前,使用相同的样品进行微硬度测试的无损结构分析(例如,μCT)作为补充评估(图1)。μCT的结构信息(3D图像、矿物密度、体积)可以支持评估可能影响显微硬度结果的样品机械性能和质量。
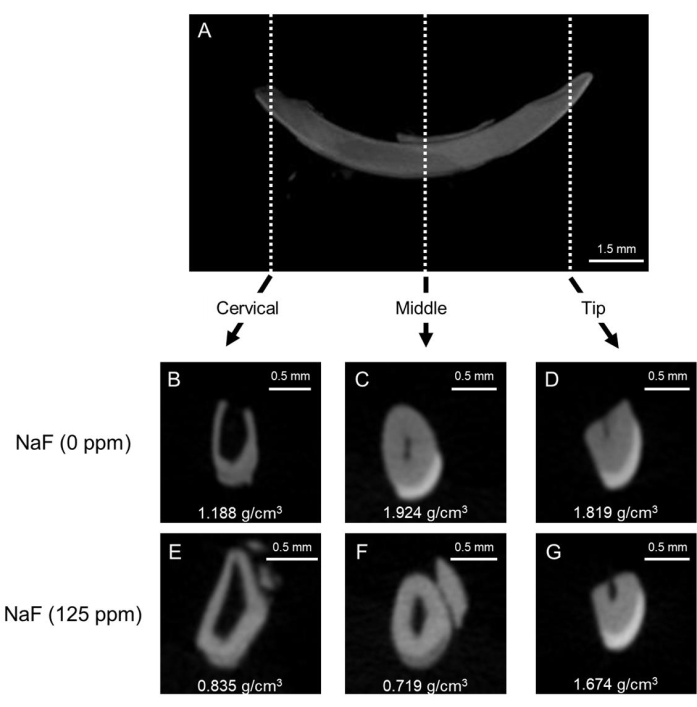
图 1:对照组和氟化物处理小鼠切牙中牙釉质的代表性 μCT 图像。 (A) 下颌切牙的代表性 μCT 矢状面图像。(BD) 对照切牙的 μCT 冠状图像 (NaF 0 ppm)。(EG) 用 NaF (125 ppm) 处理的切牙的 μCT 冠状动脉图像。代表性牙釉质矿物密度 (EMD) 如图 (g/cm3) 所示。 请点击这里查看此图的较大版本.
3. 将样品包埋在树脂中
- 从步骤 1.7(氟斑牙模型)或步骤 2.10(L-PBR 模型)继续。
- 在安装杯(1 英寸)的内表面涂上一层薄薄的凡士林。根据说明混合树脂(冷定型包埋树脂)。将树脂和硬化剂以 15:2 的体积比倒入提供的塑料杯中,然后用木刮刀小心混合至少 2 分钟。避免气泡。
- 将脱水和脱脂的切牙(图2A)或带有臼齿的牙槽骨(图2B)水平方向并平行于安装杯的底部(每个杯1个标本)。
- 将混合树脂(刚好足够的树脂,约 1.5 mL)倒入安装杯中,以完全覆盖样品。避免添加过多的树脂,因为过多的树脂会阻碍抛光过程(图2C,D)。将含有样品的安装杯放在50°C的热板上至少8小时,以促进树脂聚合。该过程有助于将试样保持在稳定位置。
注意:根据样品量,调整树脂量以完全覆盖样品。不要填充过多的树脂,否则将需要更多时间来去除多余的树脂。 - 固化后,从安装杯中取出含有试样的树脂。在水驱下,使用先进的研磨抛光机和粗糙的防水砂纸(砂砾 60/P60 和 120/P120)去除毛刺并将试样的平面和对侧平面平行和平坦。对于门牙和牙槽骨,将标本的高度保持在约3mm(图2E,F)。
注意:在显微硬度测量后通过 SEM 分析样品时,样品的厚度应约为 3 mm,以免影响后续的 SEM 观察。较小的样品更难用研磨机操作。对于仅用于显微硬度的样品,试样高度可以增加到约 10-20 mm。 - 修剪外部形状以制作矩形固体树脂块和圆角(大约,门牙宽30 mm,长10 mm(图2G)和宽10 mm,长5 mm,牙槽骨(图2H))使用精密切片锯。
- 粗略形状校正完成后,使用超声波清洗器(约 1 分钟)从树脂块中清除碎屑和颗粒。继续执行步骤 4。

图 2:树脂包埋和抛光程序的流程。 (A) 脱水和脱脂的门牙。(B) L-PBR 中脱水和脱脂的牙槽骨。(C、D)将切牙和牙槽骨浸入树脂中。(英、法)通过切断树脂,更容易抛光目标组织表面。(克,水平)树脂角是圆形的,用于抛光过程。缩写:L-PBR = 结扎诱导的牙周骨吸收。请点击这里查看此图的较大版本.
4. 试样的抛光
注意: 试样的抛光是在水驱下使用防水砂纸(从粗糙到细)在高级研磨抛光机上手动完成的。
- 将粗糙的防水砂纸 (Grit 600/P1200) 放在研磨机上。将修剪和清洁的树脂块(来自步骤 3.7)放在粗糙的防水砂纸上。
- 倒水时,握住树脂块并在研磨抛光机上抛光试样的评估表面(速度 1-10 x g)。此时,请小心握住树脂块,使评估表面与地面平行。为保持评估表面完好无损,请用肉眼或在显微镜下检查表面。
注意: 请注意,研磨机是顺时针旋转的,均匀的压力会导致表面不平行。要获得平行表面,请保持滑翔机旋转速度恒定并小心地按压试样几秒钟,然后将试样旋转 180° 以按压相同的时间。粗糙的砂纸不仅可以去除树脂,还可以去除试样。 - 将砂纸更换为 Grit 800/P2400,然后将树脂块放在上面。重复步骤 4.2。
- 使用超声波清洗器(约 1 分钟)从树脂块中清除碎屑和颗粒。
注意: 在继续之前,建议使用超声波清洁器清除任何表面碎屑以防止堵塞。 - 接下来,使用更细的砂纸进行连续抛光;抛光顺序为 12 μm、9 μm、3 μm、1 μm 和 0.3 μm。
- 在不旋转的情况下将研磨膜(12μm)放在研磨机 - 抛光机台上,并将树脂块放在研磨膜上。
注意:在本实验中,研磨台适合在水驱下获得平坦的表面条件。或者,也可以使用提供平行度的大平面镜(或类似的平面镜)。 - 在水冷下,用手在研磨膜上仔细抛光试样的评估表面。在水注入下,以 2 至 3 厘米(1 英寸)的行程垂直、水平和对角线移动样品相同的秒数。当抛光程序正确完成时,树脂试样将粘在研磨膜上。
- 按照步骤 4.4 清除碎屑和颗粒。根据连续抛光顺序(从 12 μm 到 0.3 μm)将砂纸更改为下一个尺寸,并将树脂块放在上面。
- 倒水时,握住树脂块,用手小心地在研磨膜上抛光试样的表面。按照步骤 4.4 清除碎屑和颗粒。
- 重复步骤 4.5 - 4.8 完成最终抛光 (0.3 μm)。完成最终抛光(0.3μm)后,试样应具有镜面光洁度表面(图3A)。
- 用乙醇(100%)清洁试样表面以脱脂和脱水,并将树脂块在室温下储存,直到进行显微硬度测试。储存过程中,避免过多的湿气和灰尘。继续执行步骤 5。
5.维氏显微硬度试验
注意:镜面表面试样的压痕是使用显微硬度计完成的。使用维氏尖端在 25 g 的负载下进行测试 10 秒。
- 切牙维氏显微硬度试验(氟斑牙模型)
注意:牙釉质从外部(口腔侧)到内部(牙髓侧)可分为三层;即浅层、中间层和深层(牙本质-牙釉质交界处,DEJ)(图3B)16。在该协议中,测试了三个牙釉质层。- 将加载力设置为 25 g,将加载持续时间设置为 10 秒。将树脂块放在载物台上。
- 在每个牙釉质层(浅表、中部和 DEJ)和每个区域(颈部、中部和尖端)的牙本质中缩进 6 个点; 图3B)。
- 测量两条对角线的长度(d1 和 d2; 图3B)计算维氏显微硬度值(HV; 图4)。
- 牙槽骨维氏显微硬度试验(L-PBR模型)
- 将加载力设置为 25 g,将加载持续时间设置为 10 秒。将树脂块放在载物台上。
- 在牙槽骨的中侧和远端侧距牙槽嵴凹进 3-6 个点。凹陷第 1和 第 2磨 牙(白色方块)以及第 2和 第 3磨牙之间的 牙槽骨。
注意:在本协议中,对照(完整)骨评估了对照(完整)骨的近中侧和远端每侧 6 个点(共 12 分),每侧 3 个点(总共 6 分)评估了 L-PBR。压痕点的数量取决于病变的条件(例如,过多的骨质流失限制了压痕区域)。
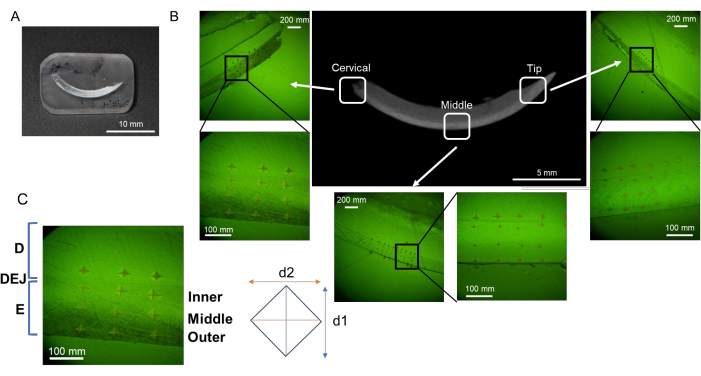
图 3:下颌切牙中显微硬度的评估区域。 (A) 含有下颌切牙的镜面表面样品。(B) 每个区域的缩进;颈部、中部和尖端 (NaF 0 ppm)。(C) 三层珐琅;来自 DEJ、内珐琅、中珐琅和外珐琅。缩写: D = 牙本质, E = 牙釉质, DEJ = 牙本质牙釉质交界处 请点击这里查看此图的较大版本.
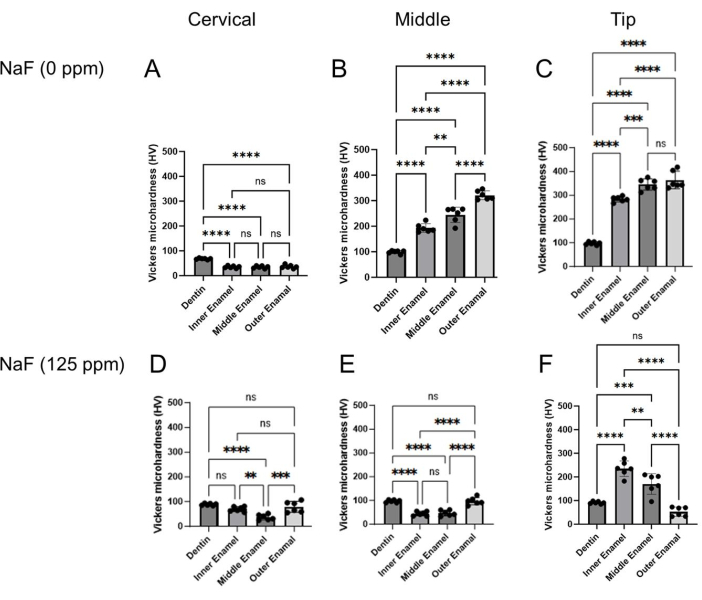
图4:经NaF或不经NaF处理的牙釉质的维氏显微硬度。 评估牙本质和三个牙釉质层在每个区域、颈部、中部和尖端区域的显微硬度。(A-C)对照和 (D-F) NaF (125 ppm) 处理。数据以平均值± SD 表示,通过单因素方差分析和 Tukey 事后检验评估显着差异。 P 值< 0.05 被认为具有统计学意义。< 0.005, < 0.0005, < 0.0001 请点击这里查看此图的较大版本.
结果
氟斑牙模型:图1显示了对照组和氟化物处理小鼠中切牙的代表性μCT图像。在对照组(图1B-D)中,与中部(1.924 g/cm3)和尖端(1.819 g/cm3)相比,颈部区域的牙釉质矿物质密度(EMD)较低,为1.188 g / cm3(图1B);图1C,D)。在氟化物处理的牙釉质(
讨论
进行显微硬度测定是为了评估牙齿和骨骼等硬组织的机械性能。迄今为止,已经报道了不同的显微硬度测量方法。大多数测量信息,尤其是样品制备和压痕位点可能不足。本研究的重点是氟斑牙和牙周病模型中牙釉质和牙槽骨的显微硬度方案。为了获得一致和准确的结果,该协议中的关键步骤是样品在树脂包埋中的方向,保持评估表面与地面平行,对评估表面进行连续抛光以获得镜面光洁度,以?...
披露声明
作者声明没有利益冲突。
致谢
本出版物中报告的研究得到了 JSPS KAKENHI JP21K09915 (MO) 和国家普通医学科学研究所的支持;T34GM145509 (MM) 和国家牙科和颅面研究所;R01DE025255和R21DE032156(XH);R01DE029709、R21DE028715和R15DE027851(TK);R01DE027648 和 K02DE029531 (MS)。
材料
| Name | Company | Catalog Number | Comments |
| Braided Silk Suture 6-0 | Teleflex | ||
| Canica Small Animal Surgery System | Kent Scientific Corporation | SURGI 5001 | |
| CarbiMet PSA 120/P120 | Buehler | 30080120 | |
| CarbiMet PSA 60/P60 | Buehler | 36080060 | |
| CarbiMet PSA 600/P1200 | Buehler | 36080600 | |
| Castroviejo Micro Needle hilder | F.S.T | 12060-01 | |
| Epofix cold setting embeding Resin | Electron Microscopey Science | CAT-1237 | |
| Fisherbrand 112xx Series Advanced Ultrasonic Cleaner | Fisher Brand | FB11201 | |
| Fluoride-free Rodent diet | Bio Serv | F1515 | AIN-76A, 1/2" Pellets |
| in-vivo microCT Skyscan 1176 | Bruker | ||
| Isomet 1000 Precison saw | Buehler | MA112180 | |
| Lapping film 0.3µm | Maruto instrument co, LTD. Japan | 26-4203 | Alternative A3-0.3 SHT, 3M USA |
| Lapping film 1µm | Maruto instrument co, LTD. Japan | 26-4206 | Alternative A3-1 SHT, 3M USA |
| Lapping film 12µm | Maruto instrument co, LTD. Japan | 26-4211 | Alternative A3-12 SHT, 3M USA |
| Lapping film 3µm | Maruto instrument co, LTD. Japan | 26-4204 | Alternative A3-3 SHT, 3M USA |
| Lapping film 9µm | Maruto instrument co, LTD. Japan | 26-4201 | Alternative A3-9 SHT, 3M USA |
| Leica wild microscope | Leica | LEIC M690 | |
| Metaserv 2000 Variable speed Grinder polisher | Buehler | No: 557-MG1-1160 | |
| MicroCut PSA 1200/P2500 | Buehler | 36081200 | |
| MicroCut PSA P4000 | Buehler | 36084000 | |
| Microhardness tester, ALPHA-MHT-1000Z | PACE Technologies | ||
| SamplKups 1 inch | Buehler | No: 209178 | |
| Sodium Fluoride | Fisher Scientific | S299-100 | |
| West cott Stitch Scissor | JEDMED | Cat. #25-1180 | |
| ZooMed Repti Thern Undertank heater (U.T.H) | Zoo Med Laboratories, Inc. | RH-4 |
参考文献
- Broitman, E. Indentation hardness measurements at macro-, micro-, and nanoscale: A critical overview. Tribol Lett. 65 (1), 23 (2017).
- Lee, M. J., et al. Sirt6 activation ameliorates inflammatory bone loss in ligature-induced periodontitis in mice. Int J Mol Sci. 24 (13), 10714 (2023).
- Min, J., et al. Investigation on the gradient nanomechanical behavior of dental fluorosis enamel. Nanoscale Res Lett. 13 (1), 347 (2018).
- Craig, R. G., Peyton, F. A. The micro-hardness of enamel and dentin. J Dent Res. 37 (4), 661-668 (1958).
- Chun, K., Choi, H., Lee, J. Comparison of mechanical property and role between enamel and dentin in the human teeth. J Dent Biomech. 5, (2014).
- Suzuki, M., Everett, E. T., Whitford, G. M., Bartlett, J. D. 4-phenylbutyrate mitigates fluoride-induced cytotoxicity in alc cells. Front Physiol. 8, 302 (2017).
- Sharma, R., et al. Assessment of dental fluorosis in mmp20 +/- mice. J Dent Res. 90 (6), 788-792 (2011).
- Wu, W. W., et al. Bone hardness of different anatomical regions of human radius and its impact on the pullout strength of screws. Orthop Surg. 11 (2), 270-276 (2019).
- Li, S., et al. Atlas of human skeleton hardness obtained using the micro-indentation technique. Orthop Surg. 13 (4), 1417-1422 (2021).
- Ibrahim, A., et al. Hardness an important indicator of bone quality, and the role of collagen in bone hardness. J Funct Biomater. 11 (4), 85 (2020).
- Vandana, K. L., Srishti Raj, B., Desai, R. Dental fluorosis and periodontium: An original research report of in vitro and in vivo institutional studies. Biol Trace Elem Res. 199 (10), 3579-3592 (2021).
- Xia, P. F., et al. Microcarriers containing "hypoxia-engine" for simultaneous enhanced osteogenesis and angiogenesis. Chemical Engineering Journal. 456, 141014 (2023).
- Chiu, R., et al. Effects of biglycan on physico-chemical properties of ligament-mineralized tissue attachment sites. Arch Oral Biol. 57 (2), 177-187 (2012).
- Leong, N. L., et al. Age-related adaptation of bone-pdl-tooth complex: Rattus-norvegicus as a model system. PLoS One. 7 (4), e35980 (2012).
- Johnson, W. M., Rapoff, A. J. Microindentation in bone: Hardness variation with five independent variables. J Mater Sci Mater Med. 18 (4), 591-597 (2007).
- Kweon, Y. S., et al. Effects of fam83h overexpression on enamel and dentine formation. Arch Oral Biol. 58 (9), 1148-1154 (2013).
- Boivin, G., et al. The role of mineralization and organic matrix in the microhardness of bone tissue from controls and osteoporotic patients. Bone. 43 (3), 532-538 (2008).
- Okamoto, M., et al. Microstructural evaluation of the mineralized apical barrier induced by a calcium hydroxide paste containing iodoform: A case report. J Endod. 2 (2), 243-251 (2024).
- Wang, Y., et al. B10 cells alleviate periodontal bone loss in experimental periodontitis. Infect Immun. 85 (9), e00335 (2017).
- Chen, Y., et al. Nlrp3 regulates alveolar bone loss in ligature-induced periodontitis by promoting osteoclastic differentiation. Cell Prolif. 54 (2), e12973 (2021).
- Robinson, J. W., et al. Male mice with elevated c-type natriuretic peptide-dependent guanylyl cyclase-b activity have increased osteoblasts, bone mass and bone strength. Bone. 135, 115320 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。