Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kemirgen Ağız Hastalığı Modellerinde Diş ve Alveol Kemiği Üzerinde Mikrosertlik Ölçümleri
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Mikrosertlik, mekanik bir özelliktir ve sert doku patofizyolojisini değerlendirmek için bilgilendirici bir parametredir. Burada, kemirgen ağız hastalığı modellerinde diş ve alveol kemiğinde mikrosertlik analizi, yani dental florozis ve ligatür kaynaklı periodontal kemik rezorpsiyonu için standart bir protokol (numune hazırlama, parlatma, düz yüzey ve girinti bölgeleri) gösteriyoruz.
Özet
Mekanik özellik olan mikro sertlik, dental florozis ve periodontitis dahil olmak üzere ağız hastalığı modellerinde diş minesi, dentin ve kemikte değerlendirilir. Mikro-BT (μCT) 3D görüntüleme bilgisi (hacim ve mineral yoğunluğu) sağlar ve taramalı elektron mikroskobu (SEM) mikroyapı görüntüleri (mine prizması ve kemik lakuna-kanaliküler) üretir. μCT ve SEM ile yapısal analize ek olarak, mikro sertlik, yapısal değişikliklerin mekanik özellikleri nasıl değiştirdiğini değerlendirmek için bilgilendirici parametrelerden biridir. Yararlı bir parametre olmasına rağmen, ağız hastalıklarında alveol kemiğinin mikro sertliği ile ilgili çalışmalar sınırlıdır. Bugüne kadar, farklı mikrosertlik ölçüm yöntemleri rapor edilmiştir. Mikro sertlik değerleri, numune hazırlamaya (parlatma ve düz yüzey) ve girinti bölgelerine bağlı olarak değiştiğinden, çeşitli protokoller çalışmalar arasında tutarsızlıklara neden olabilir. Oral hastalık modellerinde tutarlı ve doğru değerlendirme için mikrosertlik protokolünün standardizasyonu esastır. Bu çalışmada, diş ve alveol kemiğinde mikrosertlik analizi için standart bir protokol gösterilmiştir. Kullanılan örnekler aşağıdaki gibidir: dental florozis modeli için, kesici dişler 6 hafta boyunca florür içeren su ile / florür içermeyen su ile tedavi edilen farelerden toplandı; ligatür ile indüklenen periodontal kemik rezorpsiyonu (L-PBR) modeli için, periodontal kemik rezorpsiyonu olan alveolar kemikler, maksiller 2. azı dişine bağlanan farelerden toplandı. Ligasyondan 2 hafta sonra maksilla toplandı. Vickers sertliği bu örneklerde standartlaştırılmış protokole göre analiz edildi. Protokol, kesici dişler ve alveolar için reçine gömme, seri parlatma ve girinti bölgeleri için ayrıntılı malzemeler ve yöntemler sağlar. Bildiğimiz kadarıyla, bu, kemirgen ağız hastalığı modellerinde diş ve alveol kemiğinin mekanik özelliklerini değerlendirmek için ilk standartlaştırılmış mikrosertlik protokolüdür.
Giriş
Sertlik, mekanik özelliklerden biridir (örneğin, elastikiyet, sertlik, viskoelastisite ve kırılma davranışı) ve yaygın olarak, bir malzemenin yerel bir alanının sıkıştırma deformasyonuna ve kırılmasına direnme yeteneğini karakterize etmek için kullanılır. Statik girinti sertliği testi, Vickers sertliği ve Knoop sertliği1 dahil olmak üzere en çok kullanılan yöntemdir. Vickers sertlik testi, sabit bir test yükü altında yüzeye bir elmas girintinin bastırılmasıyla gerçekleştirilir. Girinti piramit şeklindedir, kare bir tabana ve zıt yüzler arasında 136°'lik bir açıya sahiptir. Test yüzeyinde oluşturulan her iki köşegenin uzunluğu ölçülür ve ortalama, F/A oranı ile belirlenen sertliği hesaplamak için kullanılır (burada F kuvvet ve A, girintinin yüzey alanıdır). Vickers mikro sertlik sayısı (HV = F / A) genellikle mm2 girinti başına kilogram-kuvvet (kgf) cinsinden ifade edilir ve 1 HV ≈ 0.1891 F / d2 (N / mm2) ile. Knoop sertliği ayrıca iki eşit olmayan zıt açıdan oluşan bir elmas kare piramit girintiden oluşur. Knoop sertlik sayısı (HK), uygulanan yükün öngörülen temas alanına oranına eşittir. Sertlik testleri, test malzemesine uygulanan kuvvete bağlı olarak mikro indentasyon (mikro sertlik) testleri ve makro indentasyon testleri olarak sınıflandırılır. Mikro girinti testleri tipik olarak 0.01-2 N (yaklaşık 1-203 gf) aralığındaki yükleri kullanır; bu arada, makro girinti testleri 10 N'nin (10119 gf) üzerinde kullanır1.
Diş ve alveol kemiği dahil olmak üzere ağız hastalıklarında diş sert dokularının özelliklerini değerlendirmek için yapısal analiz için mikro-BT (μCT) ve taramalı elektron mikroskobu (SEM) kullanılır. μCT, 3D görüntüleme bilgisi (hacim ve mineral yoğunluğu) sağlar2 ve SEM, mikroyapı görüntüleri (mine prizması ve kemik lakuna-kanaliküler) üretir3. μCT ve SEM ile yapılan yapısal analize ek olarak, mikro sertlik, yapısal değişikliklerin diş ve alveol kemiğinin mekanik özelliklerini nasıl değiştirdiğini değerlendirmek için bilgilendirici parametrelerden biridir, örneğin mine malformasyonu ve periodontal kemik rezorpsiyonu. İnsan minesinin Vickers mikrosertlik değeri (HV = 283-374), dentininkinden (HV = 53-63) yaklaşık 4 ila 5 kat daha yüksektir4,5. Kemirgen dental florozis modellerinde, florür ile tedavi edilen fare kesici dişlerinde (HV = 136) mine mikro sertliği, kontrol minesine (HV = 334) kıyasla önemli ölçüde azalır6,7. Bu, florlu minenin, florozlu olmayan minede bulunandan daha düşük mineral içeriği ve daha yüksek protein içeriği ile daha yumuşak ve daha zayıf olduğunu göstermektedir. Mikrosertlik, kemiğin mekanik özelliklerini değerlendirmek için kullanılır. Önceki birkaç çalışma, uzun kemik mikrosertliği 8,9,10 dahil olmak üzere farklı anatomik bölgelerden insan kemiğinin mekanik davranışını incelemiştir. İnsan florlu uyluk kemiğinin ortalama mikro sertliği, florsuz uyluk kemiğine (HV = 294.4) kıyasla önemli bir azalma (HV = 222.4) göstermiştir11. Yararlı bir parametre olmasına rağmen, ağız hastalıklarında alveol kemiğinin mikrosertliğini (Vickers12 veya Knoop 13,14) tanımlayan literatür azdır.
Bugüne kadar, farklı mikrosertlik ölçüm yöntemleri rapor edilmiştir. Mikrosertlik değerleri, numune hazırlamaya (parlatma ve düz yüzey) ve girinti yerine bağlı olarak15 derece değiştiğinden, çeşitli protokoller çalışmalar arasında tutarsızlıklara neden olabilir. Oral hastalık modellerinde tutarlı ve doğru değerlendirme için mikrosertlik test protokolünün standardizasyonu esastır. Bu çalışmada, fare dental florozis modeli ve periodontal kemik rezorbsiyon modelinde diş ve alveol kemiğinde mikrosertlik analizi için standart bir protokol gösterilmiştir.
Protokol
Bu protokolde açıklanan tüm prosedürler, Augusta Üniversitesi'ndeki Kurumsal Hayvan Bakımı Kullanım Komitesi (IACUC) ve Uluslararası Laboratuvar Hayvanları Bakımı Değerlendirme ve Akreditasyon Derneği (AAALAC) tarafından akredite edilmiş Nova Southeastern Üniversitesi'ndeki Kurumsal Hayvan Bakımı Kullanım Komitesi (IACUC) tarafından onaylanan omurgalı hayvanların kullanımına ilişkin kılavuz ve yönetmeliklere uygun olarak gerçekleştirilmiştir. Dr. Suzuki'nin, fare diş florozu deneylerinin tamamlandığı Augusta Üniversitesi tarafından istihdam edildiğini unutmayın.
1. Bir fare dental florozis modelinde mandibular kesici dişlerin çıkarılması
- Florürden 1 hafta öncesinden florür tedavisinin sonlandırılmasına kadar C57BL / 6 farelere (5 haftalık, erkek) florür içermeyen diyetler verin.
- Damıtılmış suya NaF ekleyerek ve ardından 0,2 μm'lik bir filtre kullanarak vakumlu filtrasyon yaparak florürlü su hazırlayın. Hayvanlara florürlü suyu NaF (0 ppm ve 125 ppm; N = 5 / grup) 6 hafta boyunca ad libitum . Florürlü suyu her 2 günde bir taze hazırlanmış bir parti ile değiştirin.
- 6 haftalık florürlü su tedavisinden sonra, hayvanları CO2 ile ötenazi yapın ve ardından dekapitasyon yapın.
- Her fareden kesici diş ile hemi mandibular çıkarın. Hemi mandibuları kesici diş ile toplamak için, mandibular çene etrafındaki kasları aşırı kuvvet uygulamadan kesin.
- Hemi mandibuları PBS'ye yerleştirin ve μ-CT analizine kadar (isteğe bağlı) 4 ° C'de tutun. Numuneye zarar vermeden veya kırmadan bir neşter (# 15) ve makas kullanarak kesici dişi mandibulardan ayırın.
- İzole edilmiş kesici dişi PBS ile yıkayın ve 2-3 saat boyunca artan alkol gücüne (% 70 ve% 100 etanol) batırarak dehidrasyon yapın.
NOT: Doku (örn. pulpa) yeterince susuz değilse, reçine emdirme işleminin inhibe edilmesi muhtemeldir ve sonraki değerlendirme muhtemelen yetersiz olacaktır. - Etanol ile dehidrasyondan sonra, kesici dişi reçineye yatay olarak gömün. 3. adıma geçin.
2. Fare ligatürüne bağlı periodontal kemik rezorpsiyonu (L-PBR) modelinde maksiller alveolar kemiklerin ekstraksiyonu
- 0.8 mL ketamin (100 mg / mL) + 0.1 mL Ksilazin (100 mg / mL) + 9.1 mL PBS intraperitoneal olarak (ip) fareye (C57BL / 6, 8-12 haftalık, erkek) anestezik olarak uygulayın. Dozaj 0.01 mL / g'dır (ağırlık). Anestezi altında kuruluğu önlemek için her iki göze de oftalmik merhem sürün.
- Anestezi uygulanmış fareyi 5-10 dakika boyunca bir ısıtma yastığının üzerine yerleştirin. Kuyruk / ayak parmağı tutamlarına verilen yanıtları ve oküler refleksin sağlamlığını değerlendirin. Farenin zararlı uyaranlara yanıt vermediğini ve refleksin olmadığını onaylayın.
- Fareyi tedavi masasına yerleştirin ve tedavi masasındaki manyetik bir direğe bağlı bir ligatür 5-0 ipek sütür vasıtasıyla ağzı açık tutun.
- Cerrahi mikroskop altında, mikro iğne tutucular kullanarak ligatürü (Örgülü ipek sütür 6-0) maksiller ikinci azı dişinin (tek katman) bir tarafına sarın. Bir tarafı tedavi tarafı ve diğer tarafı kontrol tarafı olarak kullanarak analizdeki bireysel farklılıkları en aza indirin.
- Bağı bağlayın ve damak tarafında bir düğüm yapın. Bir düğüm attıktan sonra, kalan bağı mümkün olduğunca kısa kesin, böylece aşırı bağ çiğneme veya yemek yemeyi engellemez. Bu, sonraki gözlem süresi boyunca bağın çiğneme ile gevşememesini sağlamak için önemlidir.
NOT: Sternal yaslanmayı sürdürmek için yeterli bilinci yeniden kazanana kadar hayvanı gözetimsiz bırakmayın. Ameliyat geçiren hayvanı, tamamen iyileşene kadar diğer hayvanların şirketine iade etmeyin. Hayatta kalma sırasında steril koşulları koruyun. - 2 hafta boyunca farelere ad libitum diyet ve su verin. 2 haftalık ligasyondan sonra, fareleri CO2 ile ötenazi yapın ve ardından dekapitasyon yapın.
- Her fareden azı dişleri ile her iki yan maksillayı (bağ tarafı ve kontrol tarafı) çıkarın. Azı dişleri olan üst çeneleri toplamak için, aşırı kuvvet uygulamadan makas kullanarak üst çene etrafındaki kasları ve kemiği kesin. Her maksillayı PBS'ye yerleştirin ve μCT analizine kadar (isteğe bağlı) 4 ° C'de tutun.
- Alveolar kemiği azı dişleri (1. ila 3.) ile bir neşter (# 15) ve makas kullanarak numuneye zarar vermeden veya kırmadan maksilladan ayırın.
- İzole edilmiş alveolar kemiği PBS ile yıkayın, daha sonra 2-3 saat boyunca artan alkol gücüne (% 70 ve% 100 etanol) batırarak kurutun ve yağdan arındırın.
NOT: Doku (örneğin, pulpa ve kemik) yeterince susuz değilse, reçine emdirme işleminin inhibe edilmesi muhtemeldir ve sonraki değerlendirme muhtemelen yetersiz olacaktır. - Etanol ile dehidrasyondan sonra, alveolar kemiği reçineye yatay olarak gömün. 3. adıma geçin.
- İsteğe bağlı: Mikro sertlik testinden önce μCT değerlendirmesi yapın.
- Mikro sertlik testinden önce, tamamlayıcı bir değerlendirme olarak mikro sertlik testi için aynı numuneyi kullanarak tahribatsız yapısal analiz (örn. μCT) yapın (Şekil 1). μCT ile elde edilen yapısal bilgiler (3D görüntü, mineral yoğunluğu, hacim), mikro sertlik sonuçlarını etkileyebilecek numune mekanik özelliklerinin ve kalitesinin değerlendirilmesini destekleyebilir.
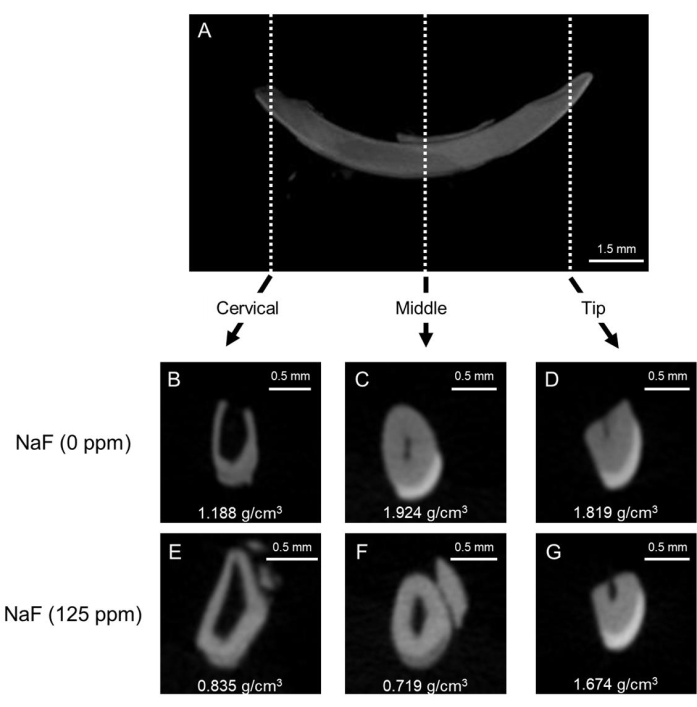
Şekil 1: Kontrol ve florür ile tedavi edilen fare kesici dişlerinde minenin temsili μCT görüntüleri. (A) Mandibular kesici dişin temsili μCT sagital görüntüsü. (B-D) kontrol kesicisinin μCT koronal görüntüleri (NaF 0 ppm). NaF (125 ppm) ile tedavi edilen kesici dişin μCT koronal görüntüleri. Temsili emaye mineral yoğunluğu (EMD) gösterilmiştir (g/cm3). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Numunelerin reçineye gömülmesi
- Adım 1.7'den (dental florozis modeli) veya adım 2.10'dan (L-PBR modeli) devam edin.
- Montaj kabının (1 inç) iç yüzeyini ince bir vazelin tabakası ile kaplayın. Reçineyi (soğuk sertleşen gömme reçinesi) talimatlara göre karıştırın. Reçineyi ve sertleştiriciyi verilen plastik kaba 15:2 hacim oranında dökün ve tahta bir spatula ile en az 2 dakika dikkatlice karıştırın. Hava kabarcıklarından kaçının.
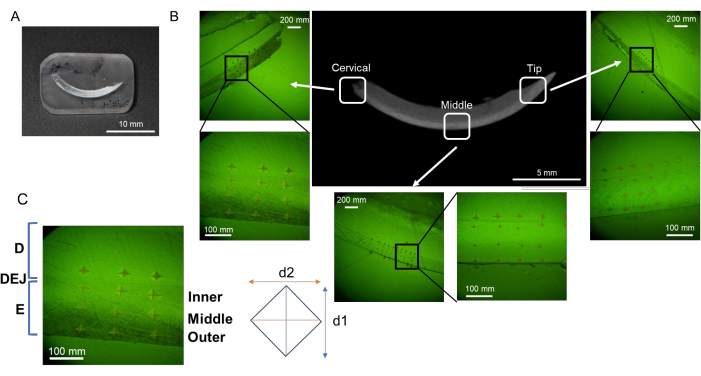
- Susuz kalmış ve yağdan arındırılmış kesici dişi (Şekil 2A) veya alveol kemiğini azı dişleri (Şekil 2B) yatay ve montaj kabının tabanına paralel olarak (fincan başına 1 örnek) yerleştirin.
- Karıştırılmış reçineyi (sadece yeterli miktarda reçine, yaklaşık 1,5 mL) numuneyi tamamen kaplayacak şekilde montaj kabına dökün. Fazla reçine parlatma işlemini engelleyeceğinden, gerekenden daha fazla reçine eklemekten kaçının (Şekil 2C,D). Reçine polimerizasyonunu teşvik etmek için numune içeren montaj kabını en az 8 saat boyunca 50 °C'de sıcak bir plaka üzerine yerleştirin. Bu prosedür, numunenin sabit bir pozisyonda tutulmasına katkıda bulunur.
NOT: Numune boyutuna bağlı olarak, reçine miktarını numuneyi tamamen kaplayacak şekilde ayarlayın. Çok fazla reçine doldurmayın, aksi takdirde gereksiz reçineyi çıkarmak için daha fazla zamana ihtiyaç duyulacaktır. - Sertleştikten sonra, numuneyi içeren reçineyi montaj kabından çıkarın. Su taşması altında pürüzlü, suya dayanıklı zımpara kağıdı (Grit 60/P60 ve 120/P120) içeren gelişmiş bir öğütücü-parlatıcı kullanarak çapakları çıkarın ve numunenin düzlemini ve karşı yan düzlemini paralel ve düz olarak düzenleyin. Kesici diş ve alveol kemiği için numunenin yüksekliğini yaklaşık 3 mm'de tutun (Şekil 2E,F).
NOT: Numune, mikro sertlik ölçümünü takiben SEM ile analiz edildiğinde, numunenin kalınlığı yaklaşık 3 mm olmalıdır, böylece sonraki SEM gözlemi etkilenmez. Daha küçük numunelerin öğütücü ile manipüle edilmesi daha zordur. Sadece mikro sertlik amaçlı numuneler için numune yüksekliği yaklaşık 10-20 mm'ye kadar artabilir. - Dikdörtgen bir katı reçine blok ve yuvarlak köşeler (yaklaşık olarak genişlik 30 mm, kesici diş için uzunluk 10 mm (Şekil 2G) ve genişlik 10 mm, uzunluk 5 mm, alveol kemiği için (Şekil 2H)) yapmak için dış şekli hassas bir kesit testeresi kullanarak kesin.
- Kaba şekil düzeltmesi tamamlandıktan sonra, ultrasonik bir temizleyici (yaklaşık 1 dakika) kullanarak reçine bloğundaki kalıntıları ve parçacıkları temizleyin. 4. adıma geçin.

Şekil 2: Reçine gömme ve parlatma prosedürünün akışı. (A) Susuz kalmış ve yağdan arındırılmış kesici diş. (B) L-PBR'de susuz ve yağdan arındırılmış alveolar kemik. (C, D) Kesici dişler ve alveol kemiği reçineye batırılmış. (E, F) Reçineyi keserek, hedef doku yüzeyini parlatmak daha kolaydır. (G, H) Parlatma işlemi için yuvarlatılmış reçine köşeleri. Kısaltmalar: L-PBR = ligatür kaynaklı periodontal kemik rezorpsiyonu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Numunelerin parlatılması
NOT: Numunelerin parlatılması, su baskını altında gelişmiş bir öğütücü-parlatıcı üzerinde su geçirmez aşındırıcı kağıtlar (pürüzlüden daha inceye) kullanılarak manuel olarak yapılır.
- Öğütücünün üzerine suya dayanıklı sert bir zımpara kağıdı (Grit 600/P1200) yerleştirin. Kesilmiş ve temizlenmiş reçine bloğunu (adım 3.7'den itibaren) pürüzlü suya dayanıklı zımpara kağıdının üzerine yerleştirin.
- Su dökerken, reçine bloğunu tutun ve numunenin değerlendirme yüzeyini öğütücü-parlatıcı üzerinde parlatın (Hız 1-10 x g). Bu sırada, reçine bloğunu, değerlendirme yüzeyi yere paralel olacak şekilde tutmaya dikkat edin. Değerlendirme yüzeyini sağlam tutmak için, yüzeyi çıplak gözle veya mikroskop altında kontrol edin.
NOT: Öğütücünün saat yönünde döndüğünü ve eşit basıncın benzersiz bir yüzeye yol açabileceğini unutmayın. Paralel bir yüzey elde etmek için, planörün dönüş hızını sabit tutun ve numuneyi birkaç saniye dikkatlice bastırın ve ardından aynı süre boyunca bastırmak için numuneyi 180° döndürün. Kaba zımpara kağıdı sadece reçineyi değil, aynı zamanda numuneyi de çıkarabilir. - Zımpara kağıdını Grit 800/P2400 ile değiştirin ve reçine bloğunu üzerine yerleştirin. Adım 4.2'yi tekrarlayın.
- Ultrasonik bir temizleyici kullanarak (yaklaşık 1 dakika) reçine bloğundaki kalıntıları ve parçacıkları temizleyin.
NOT: Devam etmeden önce, tıkanmayı önlemek için yüzeydeki kalıntıları temizlemek için ultrasonik bir temizleyici kullanılması önerilir. - Ardından, daha ince aşındırıcı kağıtlar kullanarak seri cilalama yapın; Parlatma sırası 12 μm, 9 μm, 3 μm, 1 μm ve 0.3 μm'dir.
- Öğütücü-parlatıcı tablasına döndürmeden bir alıştırma filmi (12 μm) yerleştirin ve reçine bloğunu alıştırma filminin üzerine yerleştirin.
NOT: Bu deneyde, öğütücü tabla su taşması altında düz bir yüzey durumu elde etmek için uygundur. Alternatif olarak, paralellik sağlayan büyük bir düzlem ayna (veya benzeri) de kullanılabilir. - Su soğutması altında, numunenin değerlendirme yüzeyini alıştırma filmi üzerinde elle dikkatlice parlatın. Numuneyi 2 ila 3 cm'lik (1 inç) vuruşlarla su enjeksiyonu altında aynı sayıda saniye boyunca dikey, yatay ve çapraz olarak hareket ettirin. Parlatma prosedürü uygun şekilde gerçekleştirildiğinde, reçine numunesi alıştırma filmine yapışacaktır.
- Kalıntıları ve parçacıkları adım 4.4'teki gibi temizleyin. Zımpara kağıdını seri parlatma sırasına göre (12 μm'den 0,3 μm'ye) bir sonraki boyuta değiştirin ve reçine bloğunu üzerine yerleştirin.
- Su dökerken, reçine bloğunu tutun ve numunenin yüzeyini alıştırma filmi üzerinde elle dikkatlice parlatın. Kalıntıları ve parçacıkları adım 4.4'teki gibi temizleyin.
- Son parlatmayı (0,3 μm) tamamlamak için 4,5 - 4,8 arasındaki adımları tekrarlayın. Son parlatma işlemi (0,3 μm) tamamlandıktan sonra, numune bir ayna kaplama yüzeyine sahip olmalıdır (Şekil 3A).
- Yağdan arındırmak ve kurutmak için numunenin yüzeyini etanol (%100) ile temizleyin ve reçine bloklarını mikro sertlik testine kadar oda sıcaklığında saklayın. Depolama sırasında aşırı nem ve tozdan kaçının. 5. adıma geçin.
5. Vickers mikro sertlik testi
NOT: Bir ayna kaplama yüzey numunesinin girintisi, bir mikro sertlik test cihazı kullanılarak yapılır. Test, bir Vickers ucu ile 10 saniye boyunca 25 g'lık bir yük ile gerçekleştirilir.
- Kesici dişler için Vickers mikrosertlik testi (dental florozis modeli)
NOT: Emaye dıştan (ağız boşluğu tarafı) içeriye (pulpa tarafı) üç katmana ayrılabilir; yani yüzeysel tabaka, orta tabaka ve derin tabaka (dentin-mine bileşkesi, DEJ) (Şekil 3B)16. Bu protokolde üç mine tabakası test edilir.- Yükleme kuvvetini 25 g'a ve yükleme süresini 10 saniyeye ayarlayın. Reçine bloğunu sahneye yerleştirin.
- Her mine tabakasında (yüzeysel, orta ve DEJ) 6 nokta girinti ve her bölgede dentin (servikal, orta ve uç; Şekil 3B).
- İki köşegenin uzunluğunu ölçün (d1 ve d2; Şekil 3B) Vickers mikro sertlik değerini (HV; Şekil 4).
- Alveolar kemik için Vickers mikrosertlik testi (L-PBR modeli)
- Yükleme kuvvetini 25 g'a ve yükleme süresini 10 saniyeye ayarlayın. Reçine bloğunu sahneye yerleştirin.
- Alveolar tepeden alveolar kemiğin her bir mesial ve distal tarafında 3-6 nokta girinti. 1. ve 2.azı dişi (beyaz kare) ve 2. ve 3. azı dişi arasındaki girintili alveol kemikleri.
NOT: Bu protokolde kontrol (sağlam) kemik için her bir mezial ve distal tarafta 6 puan (toplam 12 puan), L-PBR için her iki tarafta 3 puan (toplam 6 puan) değerlendirildi. Girinti noktalarının sayısı lezyonun durumuna bağlıdır (örneğin, çok fazla kemik kaybı girinti alanını sınırlar).
Şekil 3: Mandibular kesici dişteki mikro sertlik değerlendirme bölgeleri. (A) Mandibular kesici diş içeren ayna kaplama yüzey numunesi. (B) Her bölgedeki girintiler; servikal, orta ve uç (NaF 0 ppm). (C) Üç emaye tabakası; DEJ, İç, Orta ve Dış emayeden. Kısaltmalar: D = dentin, E = mine, DEJ = dentin mine bağlantısı Bu şeklin daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
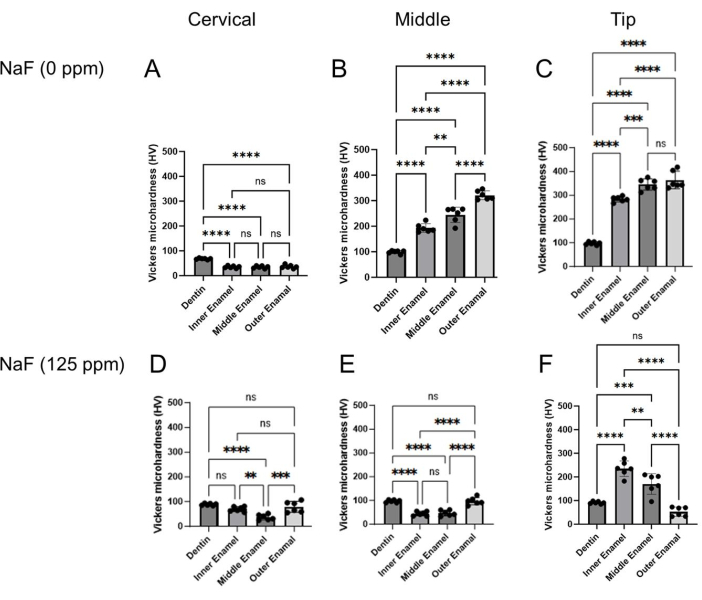
Şekil 4: NaF ile veya NaF olmadan muamele edilmiş emayenin Vickers mikro sertliği. Dentin ve üç mine tabakasının mikro sertliği her bölgede, servikal, orta ve uç bölgede değerlendirildi. (A-C) Kontrol ve (DF) NaF (125 ppm) tedavisi. Veriler ortalama ± SD olarak sunulmuştur. Anlamlı farklılıklar Tukey'in post-hoc testi ile tek yönlü varyans analizi ile değerlendirildi. 0.05< p değerleri istatistiksel olarak anlamlı kabul edildi. **p < 0.005, ***p < 0.0005, ****p < 0.0001 Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Dental florozis modeli: Şekil 1, kontrol ve florür ile tedavi edilen farelerde kesici dişlerin temsili μCT görüntülerini göstermektedir. Kontrolde (Şekil 1B-D), servikal bölge, orta (1.924 g/cm3) ve uca (1.819 g/cm3) kıyasla 1.188 g/cm3 (Şekil 1B) daha düşük mine mineral yoğunluğu (EMD) gösterdi; Şekil 1C,D). Florür i...
Tartışmalar
Mikrosertlik, diş ve kemik gibi sert dokuların mekanik özelliklerini değerlendirmek için yapılır. Bugüne kadar, farklı mikrosertlik ölçüm yöntemleri rapor edilmiştir. Ölçüm bilgilerinin çoğunun, özellikle numune hazırlıklarının ve girinti yerlerinin yetersiz olması muhtemeldir. Bu çalışmada dental florozis ve periodontal hastalıklar modellerinde mine ve alveol kemiği için mikrosertlik protokolü üzerinde durulmuştur. Tutarlı ve doğru sonuçlar elde etmek için, bu protokoldeki kritik ad...
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmezler.
Teşekkürler
Bu yayında bildirilen araştırmalar JSPS KAKENHI JP21K09915 (MO) ve Ulusal Genel Tıp Bilimleri Enstitüsü tarafından desteklenmiştir; T34GM145509 (MM) ve Ulusal Diş ve Kraniyofasiyal Araştırma Enstitüsü; R01DE025255 ve R21DE032156 (XH); R01DE029709, R21DE028715 ve R15DE027851 (TK); R01DE027648 ve K02DE029531 (MS).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Braided Silk Suture 6-0 | Teleflex | ||
| Canica Small Animal Surgery System | Kent Scientific Corporation | SURGI 5001 | |
| CarbiMet PSA 120/P120 | Buehler | 30080120 | |
| CarbiMet PSA 60/P60 | Buehler | 36080060 | |
| CarbiMet PSA 600/P1200 | Buehler | 36080600 | |
| Castroviejo Micro Needle hilder | F.S.T | 12060-01 | |
| Epofix cold setting embeding Resin | Electron Microscopey Science | CAT-1237 | |
| Fisherbrand 112xx Series Advanced Ultrasonic Cleaner | Fisher Brand | FB11201 | |
| Fluoride-free Rodent diet | Bio Serv | F1515 | AIN-76A, 1/2" Pellets |
| in-vivo microCT Skyscan 1176 | Bruker | ||
| Isomet 1000 Precison saw | Buehler | MA112180 | |
| Lapping film 0.3µm | Maruto instrument co, LTD. Japan | 26-4203 | Alternative A3-0.3 SHT, 3M USA |
| Lapping film 1µm | Maruto instrument co, LTD. Japan | 26-4206 | Alternative A3-1 SHT, 3M USA |
| Lapping film 12µm | Maruto instrument co, LTD. Japan | 26-4211 | Alternative A3-12 SHT, 3M USA |
| Lapping film 3µm | Maruto instrument co, LTD. Japan | 26-4204 | Alternative A3-3 SHT, 3M USA |
| Lapping film 9µm | Maruto instrument co, LTD. Japan | 26-4201 | Alternative A3-9 SHT, 3M USA |
| Leica wild microscope | Leica | LEIC M690 | |
| Metaserv 2000 Variable speed Grinder polisher | Buehler | No: 557-MG1-1160 | |
| MicroCut PSA 1200/P2500 | Buehler | 36081200 | |
| MicroCut PSA P4000 | Buehler | 36084000 | |
| Microhardness tester, ALPHA-MHT-1000Z | PACE Technologies | ||
| SamplKups 1 inch | Buehler | No: 209178 | |
| Sodium Fluoride | Fisher Scientific | S299-100 | |
| West cott Stitch Scissor | JEDMED | Cat. #25-1180 | |
| ZooMed Repti Thern Undertank heater (U.T.H) | Zoo Med Laboratories, Inc. | RH-4 |
Referanslar
- Broitman, E. Indentation hardness measurements at macro-, micro-, and nanoscale: A critical overview. Tribol Lett. 65 (1), 23 (2017).
- Lee, M. J., et al. Sirt6 activation ameliorates inflammatory bone loss in ligature-induced periodontitis in mice. Int J Mol Sci. 24 (13), 10714 (2023).
- Min, J., et al. Investigation on the gradient nanomechanical behavior of dental fluorosis enamel. Nanoscale Res Lett. 13 (1), 347 (2018).
- Craig, R. G., Peyton, F. A. The micro-hardness of enamel and dentin. J Dent Res. 37 (4), 661-668 (1958).
- Chun, K., Choi, H., Lee, J. Comparison of mechanical property and role between enamel and dentin in the human teeth. J Dent Biomech. 5, (2014).
- Suzuki, M., Everett, E. T., Whitford, G. M., Bartlett, J. D. 4-phenylbutyrate mitigates fluoride-induced cytotoxicity in alc cells. Front Physiol. 8, 302 (2017).
- Sharma, R., et al. Assessment of dental fluorosis in mmp20 +/- mice. J Dent Res. 90 (6), 788-792 (2011).
- Wu, W. W., et al. Bone hardness of different anatomical regions of human radius and its impact on the pullout strength of screws. Orthop Surg. 11 (2), 270-276 (2019).
- Li, S., et al. Atlas of human skeleton hardness obtained using the micro-indentation technique. Orthop Surg. 13 (4), 1417-1422 (2021).
- Ibrahim, A., et al. Hardness an important indicator of bone quality, and the role of collagen in bone hardness. J Funct Biomater. 11 (4), 85 (2020).
- Vandana, K. L., Srishti Raj, B., Desai, R. Dental fluorosis and periodontium: An original research report of in vitro and in vivo institutional studies. Biol Trace Elem Res. 199 (10), 3579-3592 (2021).
- Xia, P. F., et al. Microcarriers containing "hypoxia-engine" for simultaneous enhanced osteogenesis and angiogenesis. Chemical Engineering Journal. 456, 141014 (2023).
- Chiu, R., et al. Effects of biglycan on physico-chemical properties of ligament-mineralized tissue attachment sites. Arch Oral Biol. 57 (2), 177-187 (2012).
- Leong, N. L., et al. Age-related adaptation of bone-pdl-tooth complex: Rattus-norvegicus as a model system. PLoS One. 7 (4), e35980 (2012).
- Johnson, W. M., Rapoff, A. J. Microindentation in bone: Hardness variation with five independent variables. J Mater Sci Mater Med. 18 (4), 591-597 (2007).
- Kweon, Y. S., et al. Effects of fam83h overexpression on enamel and dentine formation. Arch Oral Biol. 58 (9), 1148-1154 (2013).
- Boivin, G., et al. The role of mineralization and organic matrix in the microhardness of bone tissue from controls and osteoporotic patients. Bone. 43 (3), 532-538 (2008).
- Okamoto, M., et al. Microstructural evaluation of the mineralized apical barrier induced by a calcium hydroxide paste containing iodoform: A case report. J Endod. 2 (2), 243-251 (2024).
- Wang, Y., et al. B10 cells alleviate periodontal bone loss in experimental periodontitis. Infect Immun. 85 (9), e00335 (2017).
- Chen, Y., et al. Nlrp3 regulates alveolar bone loss in ligature-induced periodontitis by promoting osteoclastic differentiation. Cell Prolif. 54 (2), e12973 (2021).
- Robinson, J. W., et al. Male mice with elevated c-type natriuretic peptide-dependent guanylyl cyclase-b activity have increased osteoblasts, bone mass and bone strength. Bone. 135, 115320 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır