È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Misurazioni di microdurezza su dente e osso alveolare in modelli di malattia orale dei roditori
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
La microdurezza è una proprietà meccanica e un parametro informativo per la valutazione della fisiopatologia dei tessuti duri. Qui, dimostriamo un protocollo standardizzato (preparazione del campione, lucidatura, superficie piana e siti di indentazione) per l'analisi della microdurezza nell'osso dentale e alveolare in modelli di malattia orale dei roditori, vale a dire, fluorosi dentale e riassorbimento osseo parodontale indotto dalla legatura.
Abstract
La proprietà meccanica, la microdurezza, viene valutata nello smalto dentale, nella dentina e nell'osso nei modelli di malattie orali, tra cui la fluorosi dentale e la parodontite. La micro-CT (μCT) fornisce informazioni di imaging 3D (volume e densità minerale) e la microscopia elettronica a scansione (SEM) produce immagini di microstruttura (prisma dello smalto e lacuna-canalicolare ossea). A complemento dell'analisi strutturale mediante μCT e SEM, la microdurezza è uno dei parametri informativi per valutare come i cambiamenti strutturali alterano le proprietà meccaniche. Nonostante sia un parametro utile, gli studi sulla microdurezza dell'osso alveolare nelle malattie orali sono limitati. Ad oggi, sono stati segnalati metodi di misurazione della microdurezza divergenti. Poiché i valori di microdurezza variano a seconda della preparazione del campione (lucidatura e superficie piana) e dei siti di indentazione, protocolli diversi possono causare discrepanze tra gli studi. La standardizzazione del protocollo di microdurezza è essenziale per una valutazione coerente e accurata nei modelli di malattia orale. Nel presente studio, dimostriamo un protocollo standardizzato per l'analisi della microdurezza nei denti e nell'osso alveolare. I campioni utilizzati sono i seguenti: per il modello di fluorosi dentale, gli incisivi sono stati raccolti da topi trattati con/senza acqua contenente fluoro per 6 settimane; per il modello di riassorbimento osseo parodontale indotto dalla legatura (L-PBR), le ossa alveolari con riassorbimento osseo parodontale sono state raccolte da topi legati sul 2° molare mascellare. A 2 settimane dalla legatura, la mascella è stata raccolta. La durezza Vickers è stata analizzata in questi campioni secondo il protocollo standardizzato. Il protocollo fornisce materiali e metodi dettagliati per l'inclusione della resina, la lucidatura seriale e i siti di indentazione per incisivi e alveolari. Per quanto ne sappiamo, questo è il primo protocollo standardizzato di microdurezza per valutare le proprietà meccaniche del dente e dell'osso alveolare nei modelli di malattia orale dei roditori.
Introduzione
La durezza è una delle proprietà meccaniche (ad esempio, elasticità, durezza, viscoelasticità e comportamento alla frattura) ed è comunemente usata per caratterizzare la capacità di resistere alla deformazione da compressione e alla frattura di un'area locale di un materiale. Il test di durezza dell'indentazione statica è il metodo più utilizzato, inclusa la durezza Vickers e la durezza Knoop1. Il test di durezza Vickers viene implementato premendo un penetratore di diamante nella superficie sotto un carico di prova fisso. Il penetratore è a forma piramidale, con una base quadrata e un angolo di 136° tra le facce opposte. Viene misurata la lunghezza di entrambe le diagonali formate sulla superficie di prova e la media viene utilizzata per calcolare la durezza, che è determinata dal rapporto F/A (dove F è la forza e A è la superficie dell'impronta). Il numero di microdurezza Vickers (HV=F/A) è solitamente espresso in chilogrammi-forza (kgf) per mm2 indentazione, con 1 HV ≈ 0,1891 F/d2 (N/mm2). La durezza Knoop consiste anche in un penetratore a piramide quadrata diamantata formato da due angoli opposti disuguali. Il numero di durezza Knoop (HK) è uguale al rapporto tra il carico applicato e l'area di contatto proiettata. Le prove di durezza sono classificate in prove di microindentazione (microdurezza) e prove di macroindentazione, a seconda della forza applicata al materiale di prova. I test di microindentazione utilizzano tipicamente carichi nell'intervallo 0,01-2 N (circa 1-203 gf); nel frattempo, i test di macroindentazione utilizzano oltre 10 N (10119 gf)1.
Per valutare le caratteristiche dei tessuti duri dentali nelle malattie orali, inclusi denti e osso alveolare, per l'analisi strutturale vengono utilizzate la micro-TC (μCT) e la microscopia elettronica a scansione (SEM). La μCT fornisce informazioni di imaging 3D (volume e densità minerale)2 e il SEM produce immagini di microstruttura (prisma dello smalto e lacuna-canalicolare ossea)3. Parallelamente all'analisi strutturale mediante μCT e SEM, la microdurezza è uno dei parametri informativi per valutare come i cambiamenti strutturali alterano le proprietà meccaniche del dente e dell'osso alveolare nelle malattie orali, ad esempio la malformazione dello smalto e il riassorbimento osseo parodontale. Il valore di microdurezza Vickers dello smalto umano (HV = 283-374) è da 4 a 5 volte superiore a quello della dentina (HV = 53-63)4,5. Nei modelli di fluorosi dentale dei roditori, la microdurezza dello smalto diminuisce significativamente negli incisivi di topo trattati con fluoro (HV = 136) rispetto allo smalto di controllo (HV = 334)6,7. Ciò suggerisce che lo smalto fluorurato è più morbido e più debole con un contenuto di minerali inferiore e un contenuto proteico più elevato rispetto a quello che si trova nello smalto non fluoro. La microdurezza viene utilizzata per valutare le proprietà meccaniche dell'osso. Diversi studi precedenti hanno esaminato il comportamento meccanico dell'osso umano da diversi siti anatomici, inclusa la microdurezza dell'osso lungo 8,9,10. La microdurezza media dei femori fluorurati umani ha mostrato una diminuzione significativa (HV = 222,4) rispetto ai femori non fluorosati (HV = 294,4)11. Nonostante sia un parametro utile, c'è una scarsità di letteratura che descrive la microdurezza (Vickers12 o Knoop 13,14) dell'osso alveolare nelle malattie orali.
Ad oggi, sono stati segnalati metodi di misurazione della microdurezza divergenti. Poiché i valori di microdurezza varianodi 15 a seconda della preparazione del campione (lucidatura e superficie piana) e del sito di indentazione, protocolli diversi possono causare discrepanze tra gli studi. La standardizzazione del protocollo di test di microdurezza è essenziale per una valutazione coerente e accurata nei modelli di malattie orali. Nel presente studio, dimostriamo un protocollo standardizzato per l'analisi della microdurezza nel dente e nell'osso alveolare nel modello di fluorosi dentale murino e nel modello di riassorbimento osseo parodontale.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutte le procedure descritte in questo protocollo sono state eseguite in conformità con le linee guida e i regolamenti per l'uso di animali vertebrati approvati dall'Institutional Animal Care Use Committee (IACUC) dell'Università di Augusta e della Nova Southeastern University, accreditata dall'Association for Assessment and Accreditation of Laboratory Animal Care International (AAALAC). Si noti che il Dr. Suzuki è stato impiegato presso l'Università di Augusta dove sono stati completati gli esperimenti sulla fluorosi dentale del topo.
1. Estrazione di incisivi mandibolari in un modello murino di fluorosi dentale
- Somministrare diete prive di fluoro a topi C57BL/6 (maschi di 5 settimane) da 1 settimana prima del fluoro fino al termine del trattamento con fluoro.
- Preparare l'acqua fluorurata aggiungendo NaF in acqua distillata seguita dalla filtrazione sottovuoto utilizzando un filtro da 0,2 μm. Somministrare agli animali acqua fluorurata come NaF (0 ppm e 125 ppm; N=5/gruppo) ad libitum per 6 settimane. Sostituire l'acqua al fluoro con un lotto appena preparato ogni 2 giorni.
- Dopo 6 settimane di trattamento dell'acqua al fluoro, sopprimere gli animali con CO2 seguita da decapitazione.
- Estrarre l'emimandibolare con incisivo da ciascun topo. Per raccogliere l'emimandibolare con incisivo, tagliare i muscoli intorno alla mascella mandibolare senza applicare una forza eccessiva.
- Posizionare l'emimandibolare in PBS e mantenerlo a 4 °C fino all'analisi μ-TC (opzionale). Separare l'incisivo dalla mandibolare usando un bisturi (#15) e delle forbici senza danneggiare o rompere il campione.
- Lavare l'incisivo isolato con PBS ed eseguire la disidratazione immergendolo in alcol a forza crescente (etanolo al 70% e al 100%) per 2-3 ore.
NOTA: Se il tessuto (ad es. polpa) non è sufficientemente disidratato, è probabile che l'impregnazione della resina venga inibita e che la successiva valutazione sia probabilmente inadeguata. - Dopo la disidratazione con etanolo, incorporare l'incisivo orizzontalmente nella resina. Continua con il passaggio 3.
2. Estrazione di ossa alveolari mascellari in un modello di riassorbimento osseo parodontale indotto dalla legatura murina (L-PBR)
- Somministrare 0,8 ml di ketamina (100 mg/ml) + 0,1 ml di xilazina (100 mg/ml) + 9,1 ml di PBS per via intraperitoneale (i.p.) al topo (C57BL/6, 8-12 settimane, maschio) come anestetici. Il dosaggio è di 0,01 ml/g (peso). Applicare un unguento oftalmico su entrambi gli occhi per prevenire la secchezza in anestesia.
- Posizionare il mouse anestetizzato su un termoforo per 5-10 minuti. Valutare le risposte ai pizzicamenti della coda/delle dita e l'integrità del riflesso oculare. Verificare che il mouse non risponda agli stimoli nocivi e che il riflesso sia assente.
- Posizionare il mouse sul lettino e tenere la bocca aperta per mezzo di una sutura di seta legatura 5-0 legata a un perno magnetico sul lettino da trattare.
- Sotto un microscopio operatorio, avvolgere la legatura (sutura di seta intrecciata 6-0) attorno a un lato del secondo molare mascellare (strato singolo) utilizzando micro portaaghi. Ridurre al minimo le differenze individuali nell'analisi utilizzando un lato come lato del trattamento e l'altro lato come controllo.
- Legare la legatura e fare un nodo sul lato del palato. Dopo aver fatto un nodo, tagliare la legatura rimanente il più corta possibile in modo che la legatura eccessiva non interferisca con la masticazione o il mangiare. Questo è importante per garantire che la legatura non si allenti masticando durante il successivo periodo di osservazione.
NOTA: Non lasciare l'animale incustodito fino a quando non ha ripreso conoscenza sufficiente per mantenere la decubito sternale. Non restituire l'animale che ha subito un intervento chirurgico alla compagnia di altri animali fino a quando non si è completamente ripreso. Mantenere condizioni sterili durante la sopravvivenza. - Nutrire i topi con dieta e acqua per 2 settimane. Dopo 2 settimane di legatura, sopprimere i topi con CO2 seguita da decapitazione.
- Estrarre entrambe le mascelle laterali (lato legatura e lato controllo) con molari da ciascun topo. Per raccogliere le mascelle con i molari, tagliare i muscoli e l'osso attorno alla mascella mascellare usando le forbici senza applicare una forza eccessiva. Posizionare ogni mascella in PBS e mantenerla a 4 °C fino all'analisi μCT (opzionale).
- Separare l'osso alveolare con molari (da 1° a 3°) dalla mascella usando un bisturi (# 15) e forbici senza danneggiare o rompere il campione.
- Lavare l'osso alveolare isolato con PBS, quindi disidratare e sgrassare per immersione in alcol ad alta intensità (etanolo al 70% e al 100%) per 2-3 ore.
NOTA: Se il tessuto (ad es. polpa e osso) non è sufficientemente disidratato, è probabile che l'impregnazione della resina venga inibita e la successiva valutazione sarà probabilmente inadeguata. - Dopo la disidratazione con etanolo, incorporare l'osso alveolare orizzontalmente nella resina. Continua con il passaggio 3.
- Opzionale: eseguire la valutazione μCT prima del test di microdurezza.
- Prima della prova di microdurezza, eseguire l'analisi strutturale non distruttiva (ad es. μCT) utilizzando lo stesso campione per la prova di microdurezza come valutazione complementare (Figura 1). Le informazioni strutturali (immagine 3D, densità minerale, volume) per μCT potrebbero aiutare a valutare le proprietà meccaniche e la qualità del campione che possono influenzare i risultati della microdurezza.
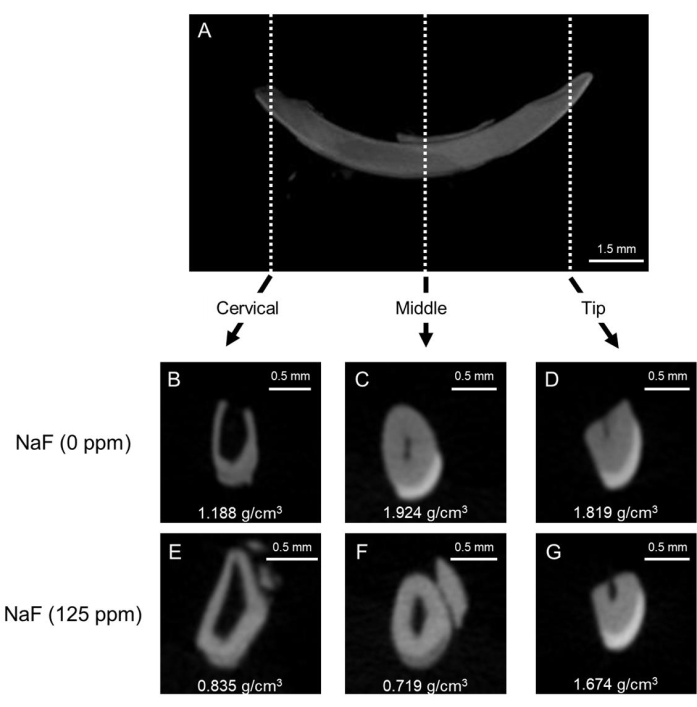
Figura 1: Immagini μCT rappresentative dello smalto negli incisivi di topi di controllo e trattati con fluoro. (A) Immagine sagittale μCT rappresentativa dell'incisivo mandibolare. (BD) μCT immagini coronali dell'incisivo di controllo (NaF 0 ppm). (E-G) μCT immagini coronali di incisivi trattati con NaF (125 ppm). Viene mostrata la densità minerale dello smalto (EMD) rappresentativa (g/cm3). Fare clic qui per visualizzare una versione più grande di questa figura.
3. Inclusione di campioni in resina
- Continuare dal passaggio 1.7 (modello di fluorosi dentale) o dal passaggio 2.10 (modello L-PBR).
- Rivestire la superficie interna della tazza di montaggio (1 pollice) con un sottile strato di vaselina. Miscelare la resina (resina da incasso a freddo) secondo le istruzioni. Versare la resina e l'indurente nel bicchiere di plastica in dotazione in un rapporto volumetrico di 15:2 e mescolare accuratamente con una spatola di legno per almeno 2 minuti. Evitare le bolle d'aria.
- Posizionare l'incisivo disidratato e sgrassato (Figura 2A) o l'osso alveolare con molari (Figura 2B) orientati orizzontalmente e paralleli al fondo della coppa di montaggio (1 campione per coppa).
- Versare la resina mista (resina quanto basta, circa 1,5 ml) nella tazza di montaggio per coprire completamente il campione. Evitare di aggiungere più resina del necessario, poiché la resina in eccesso ostacolerà il processo di lucidatura (Figura 2C, D). Posizionare la tazza di montaggio contenente il campione su una piastra calda a 50 °C per almeno 8 ore per favorire la polimerizzazione della resina. Questa procedura contribuisce a mantenere il campione in una posizione stabile.
NOTA: A seconda delle dimensioni del campione, regolare la quantità di resina per coprire completamente il campione. Non riempire troppa resina, altrimenti sarà necessario più tempo per rimuovere la resina superflua. - Dopo l'indurimento, rimuovere la resina contenente il campione dalla tazza di montaggio. Rimuovere le sbavature e disporre il piano del campione e il piano laterale opposto in modo parallelo e piatto utilizzando una smerigliatrice-lucidatrice avanzata con carta abrasiva ruvida resistente all'acqua (grana 60/P60 e 120/P120) sotto allagamento dell'acqua. Mantenere l'altezza del campione a circa 3 mm per l'incisivo e l'osso alveolare (Figura 2E, F).
NOTA: Quando il campione viene analizzato dal SEM dopo la misurazione della microdurezza, lo spessore del campione deve essere di circa 3 mm in modo che la successiva osservazione del SEM non venga influenzata. I campioni più piccoli sono più difficili da manipolare con il macinino. Per i campioni destinati alla sola microdurezza, l'altezza del campione può aumentare fino a circa 10-20 mm. - Rifilare la forma esterna per ottenere un blocco rettangolare di resina solida e angoli arrotondati (circa, larghezza 30 mm, lunghezza 10 mm per incisivo (Figura 2G) e larghezza 10 mm, lunghezza 5 mm, per osso alveolare (Figura 2H)) utilizzando un sezionatore di precisione.
- Una volta completata la correzione della forma approssimativa, rimuovere detriti e particelle dal blocco di resina utilizzando un pulitore a ultrasuoni (circa 1 min). Continua con il passaggio 4.

Figura 2: Flusso della procedura di inclusione e lucidatura della resina. (A) Incisivo disidratato e sgrassato. (B) Osso alveolare disidratato e sgrassato in L-PBR. (C, D) Incisivi e osso alveolare immersi nella resina. (E, F) Tagliando la resina, è più facile lucidare la superficie del tessuto bersaglio. (G, H) Angoli in resina arrotondati per il processo di lucidatura. Abbreviazioni: L-PBR = riassorbimento osseo parodontale indotto dalla legatura. Fare clic qui per visualizzare una versione più grande di questa figura.
4. Lucidatura dei campioni
NOTA: La lucidatura dei campioni viene eseguita manualmente utilizzando carte abrasive impermeabili (da ruvide a più fini) su una smerigliatrice-lucidatrice avanzata sotto allagamento d'acqua.
- Posizionare una carta abrasiva ruvida resistente all'acqua (grana 600/P1200) sulla smerigliatrice. Posiziona il blocco di resina tagliato e pulito (dal passaggio 3.7) sulla carta abrasiva ruvida resistente all'acqua.
- Mentre si versa l'acqua, tenere il blocco di resina e lucidare la superficie di valutazione del campione sulla smerigliatrice-lucidatrice (velocità 1-10 x g). A questo punto, fare attenzione a tenere il blocco di resina in modo che la superficie di valutazione sia parallela al suolo. Per mantenere intatta la superficie di valutazione, controllare la superficie ad occhio nudo o al microscopio.
NOTA: Si noti che la smerigliatrice ruota in senso orario e una pressione uniforme può portare a una superficie non parallela. Per ottenere una superficie parallela, mantenere costante la velocità di rotazione dell'aliante e premere con cautela il campione per alcuni secondi, quindi ruotare il campione di 180° per premere per lo stesso tempo. La carta abrasiva ruvida può rimuovere non solo la resina ma anche il campione. - Sostituire la carta abrasiva con la grana 800/P2400 e posizionare il blocco di resina su di essa. Ripetere il passaggio 4.2.
- Rimuovere detriti e particelle dal blocco di resina utilizzando un pulitore a ultrasuoni (circa 1 min).
NOTA: Prima di procedere, si consiglia di utilizzare un pulitore a ultrasuoni per rimuovere eventuali detriti superficiali per evitare l'intasamento. - Successivamente, eseguire la lucidatura in serie utilizzando carte abrasive più fini; L'ordine di lucidatura è di 12 μm, 9 μm, 3 μm, 1 μm e 0,3 μm.
- Posizionare una pellicola di lappatura (12 μm) sul tavolo della smerigliatrice-lucidatrice senza rotazione e posizionare il blocco di resina sulla pellicola di lappatura.
NOTA: In questo esperimento, il tavolo della smerigliatrice è adatto per ottenere una condizione di superficie piana in caso di allagamento dell'acqua. In alternativa, è possibile utilizzare anche uno specchio piano di grandi dimensioni (o simile) che fornisce il parallelismo. - Sotto raffreddamento ad acqua, lucidare accuratamente a mano la superficie di valutazione del campione sulla pellicola di lappatura. Spostare il campione verticalmente, orizzontalmente e diagonalmente per lo stesso numero di secondi sotto l'iniezione d'acqua con movimenti da 2 a 3 cm (1 pollice). Quando la procedura di lucidatura è stata eseguita correttamente, il campione di resina si attaccherà alla pellicola di lappatura.
- Rimuovere detriti e particelle come al punto 4.4. Cambiare la carta abrasiva al formato successivo in base all'ordine di lucidatura seriale (da 12 μm a 0,3 μm) e posizionare il blocco di resina su di essa.
- Mentre si versa l'acqua, tenere il blocco di resina e lucidare accuratamente a mano la superficie del campione sulla pellicola di lappatura. Rimuovere detriti e particelle come al punto 4.4.
- Ripetere i passaggi 4.5 - 4.8 per completare la lucidatura finale (0,3 μm). Dopo aver completato la lucidatura finale (0,3 μm), il campione dovrebbe avere una superficie con finitura a specchio (Figura 3A).
- Pulire la superficie del campione con etanolo (100%) per sgrassare e disidratare e conservare i blocchi di resina a temperatura ambiente fino al test di microdurezza. Durante la conservazione, evitare l'umidità e la polvere eccessive. Continua con il passaggio 5.
5. Prova di microdurezza Vickers
NOTA: L'indentazione di un campione superficiale con finitura a specchio viene eseguita utilizzando un tester di microdurezza. Il test viene eseguito con un carico di 25 g per 10 s con una punta Vickers.
- Test di microdurezza Vickers per incisivi (modello di fluorosi dentale)
NOTA: Lo smalto può essere diviso in tre strati dall'esterno (lato del cavo orale) all'interno (lato della polpa); vale a dire, lo strato superficiale, lo strato intermedio e lo strato profondo (giunzione dentina-smalto, DEJ) (Figura 3B)16. In questo protocollo, vengono testati tre strati di smalto.- Impostare la forza di carico a 25 g e la durata del carico a 10 s. Posiziona il blocco di resina sul palco.
- Indentare 6 punti in ogni strato di smalto (superficiale, medio e DEJ) e dentina in ogni regione (cervicale, medio e punta; Figura 3B).
- Misurare la lunghezza delle due diagonali (d1 e d2; Figura 3B) per calcolare il valore di microdurezza Vickers (HV; Figura 4).
- Test di microdurezza Vickers per osso alveolare (modello L-PBR)
- Impostare la forza di carico a 25 g e la durata del carico a 10 s. Posiziona il blocco di resina sul palco.
- Rientrare 3-6 punti in ciascun lato mesiale e distale dell'osso alveolare dalla cresta alveolare. Indentare le ossa alveolari tra il 1° e il 2° molare (quadrato bianco) e il 2° e il 3° molare .
NOTA: In questo protocollo, sono stati valutati 6 punti in ciascun lato mesiale e distale (totale 12 punti) per l'osso di controllo (intatto) e 3 punti in ciascun lato (totale 6 punti) sono stati valutati per L-PBR. Il numero di punti di indentazione dipende dalle condizioni della lesione (ad esempio, troppa perdita ossea limita l'area di indentazione).
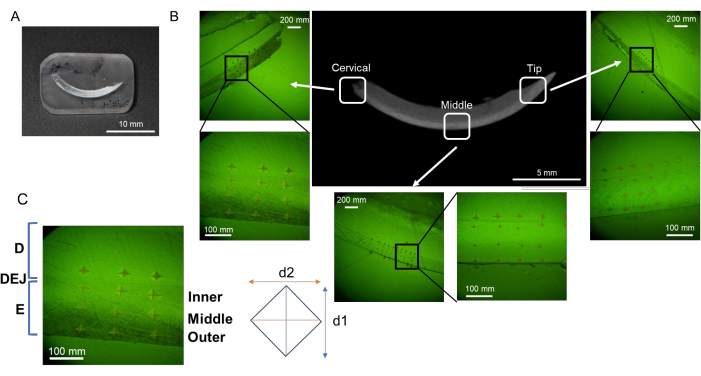
Figura 3: Regioni di valutazione della microdurezza nell'incisivo mandibolare. (A) Campione di superficie con finitura a specchio contenente incisivo mandibolare. (B) Indentazioni in ciascuna regione; cervicale, medio e punta (NaF 0 ppm). (C) Tre strati di smalto; da DEJ, smalto interno, medio ed esterno. Abbreviazioni: D = dentina, E = smalto, DEJ = giunzione smalto dentinale Fare clic qui per visualizzare una versione più grande di questa figura.
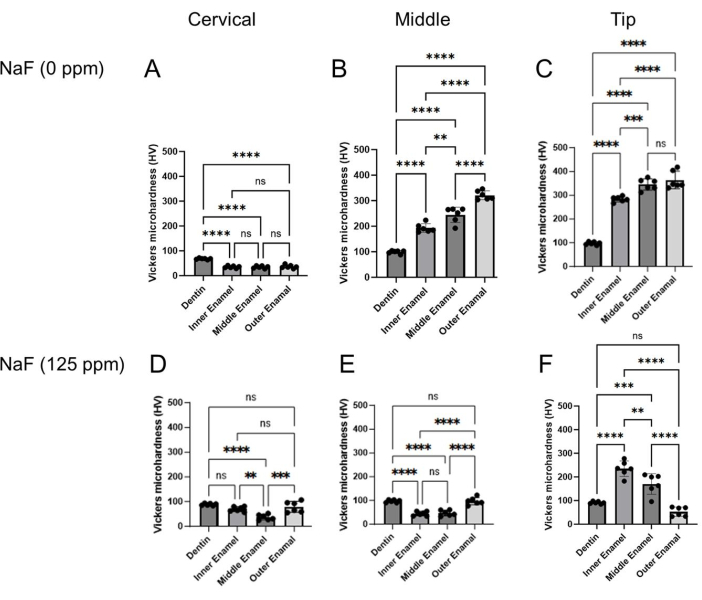
Figura 4: Microdurezza Vickers dello smalto trattato con o senza NaF. La microdurezza della dentina e tre strati di smalto sono stati valutati in ciascuna regione, cervicale, media e della punta. (A-C) Controllo e trattamento (DF) NaF (125 ppm). I dati sono presentati come media ± SD. Le differenze significative sono state valutate mediante ANOVA a una via con il test post-hoc di Tukey. I valori di P < 0,05 sono stati considerati statisticamente significativi. **p < 0,005, ***p < 0,0005, ****p < 0,0001 Fare clic qui per visualizzare una versione più grande di questa figura.
Access restricted. Please log in or start a trial to view this content.
Risultati
Modello di fluorosi dentale: la Figura 1 mostra immagini μCT rappresentative degli incisivi nei topi di controllo e trattati con fluoro. Nel controllo (Figura 1B-D), la regione cervicale ha mostrato una densità minerale dello smalto (EMD) inferiore di 1,188 g/cm3 (Figura 1B) rispetto al centro (1,924 g/cm3) e alla punta (1,819 g/cm3; Figura 1C,...
Access restricted. Please log in or start a trial to view this content.
Discussione
La microdurezza viene eseguita per valutare le proprietà meccaniche dei tessuti duri come denti e ossa. Ad oggi, sono stati segnalati metodi di misurazione della microdurezza divergenti. La maggior parte delle informazioni di misurazione, in particolare le preparazioni dei campioni e i siti di indentazione, sono probabilmente insufficienti. Questo studio si è concentrato sul protocollo di microdurezza per lo smalto e l'osso alveolare nei modelli di fluorosi dentale e malattie parodontali. Per ottenere risultati coerent...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori dichiarano di non avere alcun conflitto di interessi.
Riconoscimenti
La ricerca riportata in questa pubblicazione è stata supportata da JSPS KAKENHI JP21K09915 (MO) e dal National Institute of General Medical Sciences; T34GM145509 (MM) e l'Istituto Nazionale di Ricerca Dentale e Craniofacciale; R01DE025255 e R21DE032156 (XH); R01DE029709, R21DE028715 e R15DE027851 (TK); R01DE027648 e K02DE029531 (MS).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Braided Silk Suture 6-0 | Teleflex | ||
| Canica Small Animal Surgery System | Kent Scientific Corporation | SURGI 5001 | |
| CarbiMet PSA 120/P120 | Buehler | 30080120 | |
| CarbiMet PSA 60/P60 | Buehler | 36080060 | |
| CarbiMet PSA 600/P1200 | Buehler | 36080600 | |
| Castroviejo Micro Needle hilder | F.S.T | 12060-01 | |
| Epofix cold setting embeding Resin | Electron Microscopey Science | CAT-1237 | |
| Fisherbrand 112xx Series Advanced Ultrasonic Cleaner | Fisher Brand | FB11201 | |
| Fluoride-free Rodent diet | Bio Serv | F1515 | AIN-76A, 1/2" Pellets |
| in-vivo microCT Skyscan 1176 | Bruker | ||
| Isomet 1000 Precison saw | Buehler | MA112180 | |
| Lapping film 0.3µm | Maruto instrument co, LTD. Japan | 26-4203 | Alternative A3-0.3 SHT, 3M USA |
| Lapping film 1µm | Maruto instrument co, LTD. Japan | 26-4206 | Alternative A3-1 SHT, 3M USA |
| Lapping film 12µm | Maruto instrument co, LTD. Japan | 26-4211 | Alternative A3-12 SHT, 3M USA |
| Lapping film 3µm | Maruto instrument co, LTD. Japan | 26-4204 | Alternative A3-3 SHT, 3M USA |
| Lapping film 9µm | Maruto instrument co, LTD. Japan | 26-4201 | Alternative A3-9 SHT, 3M USA |
| Leica wild microscope | Leica | LEIC M690 | |
| Metaserv 2000 Variable speed Grinder polisher | Buehler | No: 557-MG1-1160 | |
| MicroCut PSA 1200/P2500 | Buehler | 36081200 | |
| MicroCut PSA P4000 | Buehler | 36084000 | |
| Microhardness tester, ALPHA-MHT-1000Z | PACE Technologies | ||
| SamplKups 1 inch | Buehler | No: 209178 | |
| Sodium Fluoride | Fisher Scientific | S299-100 | |
| West cott Stitch Scissor | JEDMED | Cat. #25-1180 | |
| ZooMed Repti Thern Undertank heater (U.T.H) | Zoo Med Laboratories, Inc. | RH-4 |
Riferimenti
- Broitman, E. Indentation hardness measurements at macro-, micro-, and nanoscale: A critical overview. Tribol Lett. 65 (1), 23(2017).
- Lee, M. J., et al. Sirt6 activation ameliorates inflammatory bone loss in ligature-induced periodontitis in mice. Int J Mol Sci. 24 (13), 10714(2023).
- Min, J., et al. Investigation on the gradient nanomechanical behavior of dental fluorosis enamel. Nanoscale Res Lett. 13 (1), 347(2018).
- Craig, R. G., Peyton, F. A. The micro-hardness of enamel and dentin. J Dent Res. 37 (4), 661-668 (1958).
- Chun, K., Choi, H., Lee, J. Comparison of mechanical property and role between enamel and dentin in the human teeth. J Dent Biomech. 5, (2014).
- Suzuki, M., Everett, E. T., Whitford, G. M., Bartlett, J. D. 4-phenylbutyrate mitigates fluoride-induced cytotoxicity in alc cells. Front Physiol. 8, 302(2017).
- Sharma, R., et al. Assessment of dental fluorosis in mmp20 +/- mice. J Dent Res. 90 (6), 788-792 (2011).
- Wu, W. W., et al. Bone hardness of different anatomical regions of human radius and its impact on the pullout strength of screws. Orthop Surg. 11 (2), 270-276 (2019).
- Li, S., et al. Atlas of human skeleton hardness obtained using the micro-indentation technique. Orthop Surg. 13 (4), 1417-1422 (2021).
- Ibrahim, A., et al. Hardness an important indicator of bone quality, and the role of collagen in bone hardness. J Funct Biomater. 11 (4), 85(2020).
- Vandana, K. L., Srishti Raj, B., Desai, R. Dental fluorosis and periodontium: An original research report of in vitro and in vivo institutional studies. Biol Trace Elem Res. 199 (10), 3579-3592 (2021).
- Xia, P. F., et al. Microcarriers containing "hypoxia-engine" for simultaneous enhanced osteogenesis and angiogenesis. Chemical Engineering Journal. 456, 141014(2023).
- Chiu, R., et al. Effects of biglycan on physico-chemical properties of ligament-mineralized tissue attachment sites. Arch Oral Biol. 57 (2), 177-187 (2012).
- Leong, N. L., et al. Age-related adaptation of bone-pdl-tooth complex: Rattus-norvegicus as a model system. PLoS One. 7 (4), e35980(2012).
- Johnson, W. M., Rapoff, A. J. Microindentation in bone: Hardness variation with five independent variables. J Mater Sci Mater Med. 18 (4), 591-597 (2007).
- Kweon, Y. S., et al. Effects of fam83h overexpression on enamel and dentine formation. Arch Oral Biol. 58 (9), 1148-1154 (2013).
- Boivin, G., et al. The role of mineralization and organic matrix in the microhardness of bone tissue from controls and osteoporotic patients. Bone. 43 (3), 532-538 (2008).
- Okamoto, M., et al. Microstructural evaluation of the mineralized apical barrier induced by a calcium hydroxide paste containing iodoform: A case report. J Endod. 2 (2), 243-251 (2024).
- Wang, Y., et al. B10 cells alleviate periodontal bone loss in experimental periodontitis. Infect Immun. 85 (9), e00335(2017).
- Chen, Y., et al. Nlrp3 regulates alveolar bone loss in ligature-induced periodontitis by promoting osteoclastic differentiation. Cell Prolif. 54 (2), e12973(2021).
- Robinson, J. W., et al. Male mice with elevated c-type natriuretic peptide-dependent guanylyl cyclase-b activity have increased osteoblasts, bone mass and bone strength. Bone. 135, 115320(2020).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon