Method Article
用长期植入的 EMG 电极记录头部固定小鼠的前肢肌肉活动
摘要
该协议描述了在小鼠前肢肌肉中手工制作和手术植入肌电图 (EMG) 电极,以记录头部固定行为实验期间的肌肉活动。
摘要
小鼠系统神经科学研究中强大的遗传和分子工具使研究人员能够以前所未有的精度询问执行各种任务的头部固定小鼠的运动系统功能。小鼠的小尺寸使得运动输出的测量变得困难,因为传统的肌电图 (EMG) 记录肌肉活动的方法是为猫和灵长类动物等大型动物设计的。在市售的小鼠 EMG 电极之前,目前记录小鼠肌肉活动的金标准方法是在内部制作电极组。本文介绍了手工制造电极组、在与头板植入相同的手术中植入电极、将连接器固定在头板上以及术后恢复护理的既定程序的改进。恢复后,可以在头部固定行为期间获得数周的毫秒分辨率 EMG 记录,信号质量没有明显变化。这些记录能够精确测量前肢肌肉活动以及 体内 神经记录和/或扰动,以探测小鼠的运动控制机制。
引言
近几十年来,小鼠已成为研究哺乳动物运动系统的有吸引力的模式生物。常见的实验方法包括头部固定小鼠执行运动任务,同时监测和/或扰动神经活动 1,2,3,4,5。在此类实验中,大型物种(如猫和灵长类动物)的运动系统研究传统上依赖于肌电图 (EMG) 直接测量运动输出 6,7,8。然而,记录小鼠的肌肉活动具有挑战性,因为它们的肌肉组织对于大型哺乳动物实验中使用的市售 EMG 电极来说太小了 9。许多研究人员选择通过视频 4,10,11 和/或行为表现 2,4,12 来跟踪肢体运动学,以间接探测运动输出,但这些方法缺乏检测神经活动及其扰动对肌肉的毫秒级时间尺度影响的分辨率。因此,对于对肌肉的直接神经控制感兴趣的研究人员来说,记录 EMG 是可取的。
肌电图涉及测量两点之间的电压,通常相隔一小段距离,大致平行于被记录的肌肉纤维。肌电图电极有表面(或"贴片")和肌内(或"针")两种。表面电极放置在皮肤上或覆盖在肌肉组织上,并用粘合剂或缝合固定。因此,表面电极的侵入性比肌内电极小,并且由于相对易于使用,因此最受人类、猫和灵长类动物的欢迎。表面电极也已成功用于大鼠和小鼠13,14;然而,它们必须是手工制作并通过手术植入皮肤下的,因为啮齿动物在梳理时往往会试图去除异物。另一方面,肌内肌电图电极通过手术植入肌肉组织内。因为它们被肌肉组织吞没,所以它们提供高空间分辨率并无限期地保持在原位。因此,植入式肌内肌电图电极是表面电极上使用啮齿动物进行长期实验的理想选择。为了可靠地记录小鼠的肌内肌内 EMG,研究人员开发了一种在成年小鼠前臂小的肌肉中手工制造和植入 EMG 电极的方法。这些电极可以在啮齿动物的运动行为中持续数周进行慢性肌肉记录。
此处描述的协议是对已建立方法 15,16,17,18 长达十年的改进的结果,它产生了一种用于手工制造、植入和记录长期植入行为小鼠肘部和手腕的屈肌/伸肌对的线 EMG 电极的程序。第一部分描述了手动制造一个电极组,该电极组具有四个电极对和一个用于头部平台接口的 8 针连接器。下一节详细介绍了在与头板植入相同的手术中将电极肌肉注射到上臂和下臂肌肉中。最后,讨论了执行各种行为的小鼠的代表性录音。总体而言,这种方法是一种经济高效且可定制的方法,可将肌肉活动测量纳入头部固定行为实验,非常适合具有一定电极制造经验的实验室。
研究方案
所有实验和程序均根据 NIH 指南进行,并经西北大学机构动物护理和使用委员会批准。其他国家和/或机构可能有不同的法规要求修改此程序。本研究中包括的动物是 C57BL6/J 成年雄性(见 材料表),年龄为 12-20 周,最低体重为 20 克。
1. 电极组制造
注意:使用放大倍率范围为 10 倍至 40 倍的立体显微镜和干净的裸手在干净的工作台上执行这些步骤。有关详细说明电极线剥线(图 1A)和连接器组件(图 1B)的图表,请参见图 1。
- 剪断电线:对于每个电极对,剪下两根 PFA 涂层编织不锈钢丝(7 股,直径 0.0055 英寸)(参见 材料表)。对于上臂肌肉,将每根线剪成 9.5 厘米长。对于下臂肌肉,将每根线剪成 10.5 厘米长。
- 用一个结将两根线打在一起 - 植入时,这将成为位于插入部位外的结(近端结)。绑好的电线包括一个电极对。
- 使用插入瓦楞纸板的 18 G 针头,将结放在距离插入端 6 cm 的位置,然后将电极线拉到纸板上,以收紧针头周围。插入端会收缩到约 5.5 厘米,剩余的 0.5 厘米会打结。
- 小心地取下针头,徒手拉紧结两次以进一步收紧。
注意:打结不应尽可能紧;以这种方式收紧将导致近端结,该结的大小适合将植入的电极固定在组织中。 - 对于上臂肌肉,请确保连接器末端长 3.5 厘米。对于下臂肌肉,请确保连接器末端长 4.5 厘米。
- 从每根电线上剥去 0.5 毫米的绝缘层:从一根电线上的结处剥去 1-1.5 毫米,从另一根电线上的结处剥去 2-2.5 毫米。 图 1 说明了剥去每根电线的位置。
- 将电极拉紧在一块扁平纸板上,将两根连接器端线放在一起,并将插入端线分开。
- 使用手术刀在绝缘层上划出缺口,标记将要去除绝缘层的末端。
- 在每个缺口处,用手术刀刀片在每个缺口处进行一系列 ~6 次切割:顶部 ~2 次,侧面 ~2 次,电线下方 ~2 次。
注意: 避免过多地切割电线本身至关重要。否则,股线可能会断裂。需要练习以达到适当的压力量,以完全切开绝缘层,同时对电线的损坏有限。 - 将电极对旋转 180 度,并在每个缺口中重复 6 次切割。
- 根据需要进行额外的切割,以将 0.5 mm 的绝缘层与底层电线分开。这里需要的切割次数取决于施加的压力和手术刀刀片的锋利度。
- 调整手术刀刀片的角度,沿松动的绝缘层纵向切割,然后使用镊子将其从电线上取下。
- 检查裸露的电线是否有破损和/或绝缘磨损,这些绝缘层在插入组织时可能会造成损坏。
- 在连接器端将每根电线的末端剥去 1 毫米。
- 在插入端从每根电线的末端剥去 5 毫米。
- 将插入端线段扭在一起,并将 5 mm 裸露端一起压接在 0.5 英寸的轴中。27 G 针。典型的皮下注射针头可以在移除鲁尔锁末端后使用。
- 对每个电极对重复步骤 1.1-1.6。
- 组装连接器。
- 将 12 针连接器的母端(参见 材料表)切成小尺寸:# 电极对 x 2 针槽。
- 用钳子轻轻地从每个连接器端口(这些接头预先连接到 12 针连接器)上取下黄铜配件。保存这些管接头以备下一步使用。
- 将每根电线的每 1 mm 裸露端焊接到黄铜配件的一个刀片的外表面。
注意: 焊接会释放烟雾,引起皮肤、眼睛和呼吸道刺激。戴手套(或事后洗手),使用护目镜,并使用当地的排烟装置来限制接触。- 将黄铜配件固定在无齿鳄鱼夹中,该夹子连接到辅助手动工具上,其中一个刀片的外表面朝上。
- 将接头置于显微镜下,以便在焊接过程中进行高度视觉控制。使用展开的回形针或一根废电线,在刀片表面轻拍少量不锈钢兼容助焊剂。
- 使用狭窄的锥形焊尖,在刀片上涂上足够的焊料,以覆盖黄铜刀片的下部 ~1.5 mm。
注意:此处的焊料过多会干扰连接器组装,而焊料过少可能会导致连接不充分。如有必要,可以使用额外的黄铜配件重新开始。 - 用不锈钢兼容的助焊剂充分涂覆刀片上的焊料表面,但要避免助焊剂滴入两个刀片之间的空间。
- 将 1 mm 的裸露电极丝与刀片上的焊料齐平,然后用烙铁加热焊料以熔合连接。
- 检查连接:大部分裸露的电线应浸入焊料中,并且电线应牢固地连接到黄铜配件上。确保黄铜接头的两个刀片之间没有焊料 - 这可能会使以后难以插入公连接器。最后,确保连接与黄铜刀片齐平,以便在下一步中将接头重新插入连接器。
- 使用直镊子将每个焊接的黄铜接头重新插入连接器,确保每个电极对的导线彼此相邻,不会与其他电极对缠结。参见 图 1B 以可视化连接器中单个电极对的方向。
注意:从左到右的理想方向是:二头肌(连接器端 3.5 毫米)、肱三头肌(连接器端 3.5 毫米)、桡侧腕伸肌(ECR;连接器端 4.5 毫米)和掌长肌(PL;连接器端 4.5 毫米)。用记号笔或白色标记一侧,以跟踪植入过程中连接器的方向。 - 将 12 针公连接器剪成与母端相同的尺寸(# 电极对 x 2),并将其连接到母连接器。如果接头移位,可以在外螺纹连接器就位后用直镊子重新插入。
- 用钳子拆下黄铜配件上的凸耳。
- 用环氧树脂涂覆针槽,确保连接器附近的所有金属或电线与组织绝缘。
注意: 环氧树脂长时间接触会引起皮肤、眼睛和呼吸道刺激。戴上手套、护目镜,并且只能在通风良好的地方或当地的排烟装置下使用环氧树脂。 - 让连接器风干至少 30 分钟。
- 测试每个电极对的电阻,并用热缩的小彩色段标记针头,以便在手术过程中轻松识别。
注意: 电阻应在 18-50 欧姆之间。较低的阻力可能表明空头。较高的电阻可能表明线束损坏过多。然而,高电阻通常源于针轴和导线之间的连接不完美(在步骤 1.6 中完成),这可以通过在该连接处进行额外的压接来解决。 - 植入前确保电极组没有纤维和其他碎屑。喷雾除尘器可用于此。在显微镜下检查可能有助于验证。
2. 电极植入手术
注意:本节描述了将上一节中制造的头板和电极植入肱三头肌、二头肌、桡侧腕伸肌 (ECR) 和掌长肌 (PL) 的单一外科手术。对于后两块肌肉,如果不穿过附近的协同肌,就很难将电极专门植入这些单独的肌肉中。请参阅下面的讨论,了解尝试将录音与单个肌肉隔离的注意事项。头板通常是为特定实验定制设计和制造的。本研究使用 3D 打印的塑料铆钉头板19。许多开源头板设计可通过 Janelia、Allen Institute 和独立研究小组在线获得。此处描述的头板程序已成功用于钛和塑料头板。外科手术必须在立体定位器(见 材料表)上进行,立体显微镜的放大倍率范围为 10-40 倍。
- 使用 1.5% 戊二醛对电极和头板进行冷消毒过夜或 8 小时。在植入前用无菌水短暂冲洗并完全风干。
注意:吞咽戊二醛有害,会对眼睛、皮肤和呼吸道造成刺激。戴手套在通风橱中处理。 - 按照机构批准的方案,在诱导室中用医用级氧气中的 2-4% 异氟醚诱导麻醉,直到失去扶正反射(约 3 分钟)。
- 将动物转移到可移动的鼻锥上以继续接受麻醉。在医用级氧气中加入 2% 异氟醚的麻醉下,手术前剃除动物的头部、颈部和肢体。在麻醉下执行本节中的所有其余步骤。根据需要调整异氟醚的剂量,以保持 1 Hz 的呼吸频率和没有脚趾捏反射。
- 在整个手术过程中涂抹眼部润滑剂并每 1 小时重新涂抹一次。
- 在手术开始时,皮下注射镇痛药(如卡洛芬,5 mg/kg)和抗生素药物(如恩诺沙星,10 mg/kg)(见 材料表)。
- 使用以下步骤或机构批准的替代方法植入头板。
- 将动物的头部固定在立体定位器械上的耳杆中,并通过连接到立体定位器械的鼻锥提供麻醉(2% 异氟醚)。添加无菌覆盖物以维持无菌。
- 用聚维酮碘制备垫和无菌酒精制备垫清洁头部和颈部。
如有必要,请重新涂抹眼部润滑剂。 - 在切口部位皮下注射利多卡因 (4 mg/kg)(参见 材料表)。
- 通过执行脚趾捏确保足够的麻醉诱导。如果没有扶正反射,从眼睛的尾缘到耳朵的尾缘,沿着动物头部的中线做一个切口。
- 用组织夹夹住皮肤:眼睛后面两侧的喙缘各两个,耳朵后面的尾缘两个。
- 用手术刀刀片轻轻刮擦以去除干燥的筋膜,以清洁颅骨表面。
- 在颅骨表面涂上一层薄薄的牙科水泥(见 材料表),并让它干燥 5 分钟。
- 将头板放在动物的头骨上。床头板的植入方式和位置因床头板和研究问题而异。
- 使用牙科粘固剂将头板粘附到颅骨上。确保颅骨被完全覆盖。让牙科粘结剂干燥 10 分钟。
- 将动物转移到可移动的塑料鼻锥上,为手术的其余部分提供麻醉;这将允许在手术期间定期重新定位动物,以在保持麻醉的同时接触不同的肌肉。
- 延长颈部后部的切口(在头板植入期间进行),使其达到耳尾 1 厘米。
- 使用钝骨刮刀,将颈部切口下的皮肤与下面的组织分开,以清理从颈部切口到前肢的路径,在那里植入电极。
- 使用一小块胶带将 EMG 连接器暂时固定到头板上,以便在电极植入过程中将其固定到位。
- 用聚维酮碘制备垫和无菌酒精制备垫清洁动物的前肢。
- 做肱三头肌切口。
- 将动物侧卧,肱三头肌朝上。
- 在计划的切口部位注射利多卡因 (4 mg/kg)。这将缓解局部疼痛并在植入过程中保持肌肉湿润。
注意:在整个手术过程中,肌肉应保持湿润,但不要滴湿。如果肌肉或皮肤看起来干燥,请根据需要局部涂抹无菌盐水。 - 在平行于骨骼的肱三头肌上切 7 毫米。
- 用钝骨刮刀将切口周围的皮肤与下面的组织分开。将刮刀在皮肤下工作,然后回到颈部切口处,为电极清理出一条路径。
- 修剪掉任何遮挡肌肉的筋膜。
- 通过肱三头肌切口插入闭合的剪刀并推出颈孔,在出孔后略微打开,确保从颈部到肱三头肌的路径足够大。
- 将肱三头肌电极带到肱三头肌切口处:将大针头驱动器的尖端穿过肱三头肌切口并从颈部切口中插入。纵向夹住电极针周围的针驱动器,然后拉到肱三头肌切口。
- 肱三头肌插入:按照第 3 步"将电极插入肌肉"进行操作。
- 做手臂远端切口。
- 将动物仰卧。
- 将手臂沿着动物的侧面用胶带固定,手掌朝下。
- 在计划的切口部位注射利多卡因 (4 mg/kg)。
- 从三角肌底部到下臂中部,在二头肌和 ECR 上方做一个 1 厘米的切口,与骨骼平行。切口的远端应高于下臂肌肉末端 ~2 毫米。
- 清理筋膜,露出肱二头肌。
- 从手臂远端切口回到上臂皮肤下(近端)沿大血管上方(近端)的肱三头肌切口清理一条路径。
- 将肱二头肌电极穿过颈部切口穿入皮肤下到肱三头肌切口,然后从肱三头肌切口穿到手臂远端切口。
- 二头肌插入:按照步骤 3 "将电极插入肌肉"。
- 将动物的手臂重新贴在相同的位置,但手掌朝下。
- 插入尽可能靠近暴露的二头肌的近端。
- 要将至少 3 毫米的电极浸入肌肉组织中,请确保根据鼠标的大小略微对角插入肌肉纤维。
- 从肱三头肌切口到上臂皮肤下大血管下方(远端)的手臂远端插入部位清理一条路径,形成一条与肱二头肌电极不同的路径。
- ECR 插入:按照步骤 3"将电极插入肌肉"进行操作。
- 插入 ECR 的最近端部分。
- 从 ECR 及其拮抗剂之间的折痕中退出,并在此折痕中打结。
- 从肱三头肌插入处到肘部下方的 PL 插入部位清理一条路径。
- PL 插入:按照步骤 3"将电极插入肌肉"进行操作。
- 将动物仰卧,将手臂绑在头上,手掌朝上。
- 插入肘部远端。
- 出口离腕筋足够近,这样出口部位的结就会位于肌肉上,而不是腕筋上。
- 将动物重新定位到侧面,并使用 6-0 丝缝合线缝合肱三头肌切口。
- 将动物重新定位在其背部并使用 6-0 丝缝合线缝合手臂远端切口。
- 使用牙科水泥将连接器固定在头板的背面。
- 使用 6-0 丝缝合线缝合颈部切口。
- 在切口部位涂抹局部抗生素乳膏以减少炎症。
- 在动物身上系上伊丽莎白项圈(见 材料表),以防止它在恢复过程中干扰缝合线。
3. 将电极插入肌肉
- 弯曲针头(27 G,步骤 1)略微弯曲。
- 用针头驱动器握住针头(参见 材料表),然后将其压在一对镊子的手柄上,以增加 5-10 度的弯曲。
- 沿针的长度在不同位置添加三个总共弯曲。
- 可视化进入和退出肌肉的位置。
- 用细镊子切割或拉动,去除任何遮挡入口和出口部位的脂肪和筋膜。尽量避免血管损伤以减少出血。
- 目标是 3-5 毫米的浸没钢丝平行于肌肉纤维。这将确保裸露的电极丝部分浸没在肌肉内。
- 使用针头驱动器,将针头插入肌肉的近端,同时用另一只手的钝弯镊子施加反压力。将针头穿过肌肉推至出口部位。
- 针头离开肌肉后,用钝钳抓住尖端并将针头拉过。继续拉动,直到近端结位于插入部位的顶部。
- 打远端结。
- 使用镊子,在出口部位远端打一个松散的结。将结收紧至 1 厘米的环。
- 用镊子推动环并将其放在出口部位。
- 可视化远端结应该闭合的位置,直到它完全收紧之前,距离出口部位约 0.5 毫米。在此位置用细弯曲的镊子轻轻抓住环,然后将环紧紧拉到镊子上。
注意:在此步骤中,不要立即在出口部位上方收紧远端结,否则在下一步中,当结完全收紧时,肌肉会受到挤压。 - 从结上取下细镊子,用细弯曲的镊子将结推向出口部位,然后用手指拉动针端,完成收紧结。确保近端和远端结分别正确定位在插入和出口部位之外,以将插入的电极固定到位。
- 用笔直的细镊子抓住出口结,并将远端金属丝紧紧卷曲在镊子周围,使金属丝弯曲到结周围并朝向肌肉/远离皮肤。
- 剪断远端结 0.5 mm 处的金属丝,在结周围留下一个小块。
上一步确保小块的切割端不会戳入动物的皮肤,这可能会引起刺激。
4. 术后护理
- 手术后,立即执行以下步骤。
- 单独安置动物,这样它的笼子伴侣就不会打扰它的缝合线。
- 将动物放在干净的笼子里,垫子很低。移除佩戴伊丽莎白项圈时可能干扰动物活动能力的任何巢穴和浓缩材料。
- 给动物戴上项圈时可以接触到的水和湿食物。
- 手术后 24 小时和 48 小时执行以下步骤。
- 取下伊丽莎白项圈,让动物梳理自己 20 分钟。
- 如步骤 2.2 和步骤 2.3 中所述,用异氟醚诱导麻醉。
- 注射镇痛药和抗生素药物。
- 检查切口部位是否有缝合缺失、开放性伤口以及感染或刺激的迹象。如果需要,更换缝合线并使用更多的局部抗生素。
- 每 48 小时更换一次湿粮,直到去除 Elizabethan 项圈。
- 手术后 6 天执行以下步骤。
- 检查伤口是否完全愈合。
- 如果伤口闭合,请拆线。如果伤口开放,请再等待两天再拆线。拆线后,取下伊丽莎白时代的项圈。
- 将鼠标放回一个新的、干净的笼子里,笼子里有完整的垫料和丰富的食物。
注意:动物可以在手术后 7 天进行实验或剥水。
结果
图 2、 图 3 和 图 4 显示了从执行不同行为的小鼠前肢肌肉记录的标准化肌肉活动:在没有头部固定的情况下在跑步机上行走(图 2),在头部固定下爬上旋转的轮子(图 3),以及在头部固定下伸手去拿水滴(图 4)。 图 2 显示了 1.5 s 的跑步机运动,根据两次肘屈肌激活之间的时间估计出一个近似的步长周期。 图 3 显示了一只动物的 5 秒 EMG 数据,该动物在植入后 6 周腕伸肌电极衰竭。在 图 3A 中,所有四个电极都产生一个干净的 EMG 信号,该信号与车轮的转动(表示爬升)对齐。 图 3B 显示了故障后来自同一电极的信号:腕伸电极产生不随动物运动而变化的噪声信号。 图 4 显示了在鼠标从静止过渡到伸手去拿水滴的任务期间,四个前肢肌肉群的 1 秒 EMG。
在 图 2、 图 3 和 图 4 中,使用差分放大器放大电压信号并过滤带通 (250-20,000 Hz)。 然后将原始电压子采样为 1 kHz 并进行 z 评分,以便在数据集之间进行比较。再次注意,虽然电极植入方案中指定的四块肌肉(二头肌、肱三头肌、ECR 和 PL)中,但不能保证相邻的协同肌肉不会影响 EMG 信号;因此,为了准确起见,每个录音都被分配到其 Synergy 组(肘屈肌等)。验证来自单个肌肉的孤立记录需要在多个协同体中同时记录,以检测肌肉记录之间的串扰,这可能非常困难,尤其是在小鼠的下臂中。
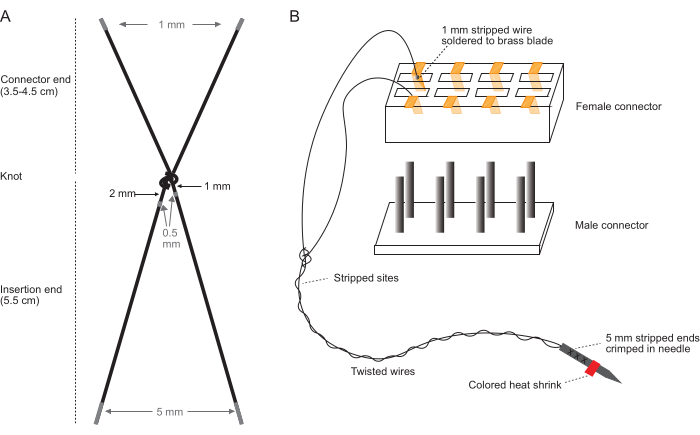
图 1:电极组制造的示意图。 (A) 单个电极对的示意图。灰色区域表示剥离的位置。(B) 将单个完整的电极对插入连接器的连接器组件示意图。(B) 中的图表不是按比例缩放的。 请单击此处查看此图的较大版本。
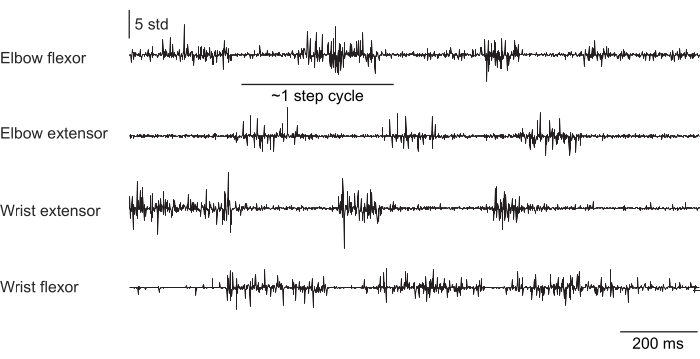
图 2:在跑步机上自由移动(非头部固定)的小鼠的四块肌肉的代表性 EMG 记录。 总持续时间为 1.5 秒。步长周期是根据连续肘伸肌激活之间的时间估计的。 请单击此处查看此图的较大版本。
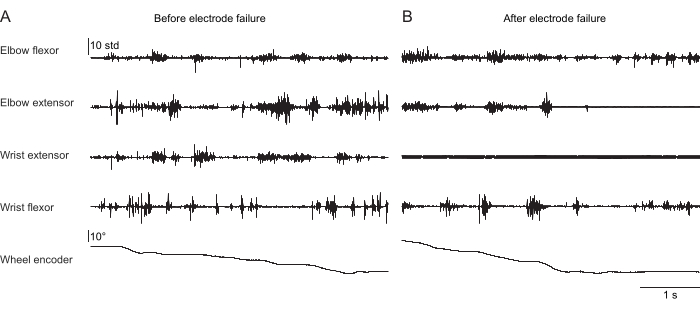
图 3:头部固定小鼠执行自然攀爬行为的四块肌肉的代表性 EMG 记录。第 5 行显示旋转编码器读出的爬升轮的位置;该值的变化表明车轮正在转动,动物正在积极攀爬。总持续时间为 5 秒。(A) 在攀爬期间记录植入后 36 天。(B) 在同一只小鼠中植入腕伸电极失败后 72 天的记录。请单击此处查看此图的较大版本。
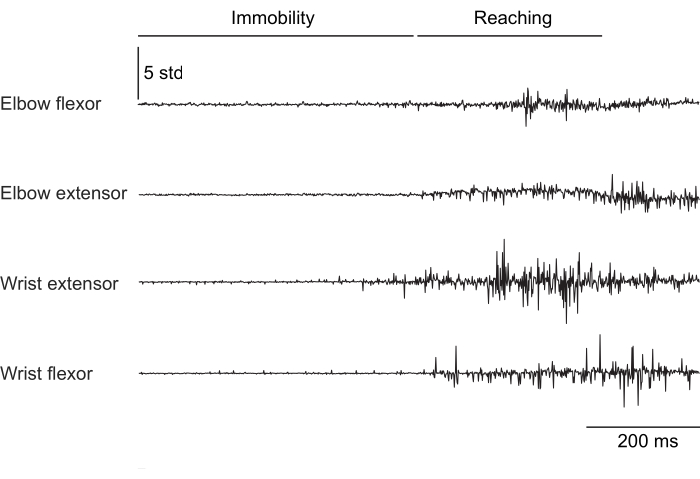
图 4:头部固定小鼠从静止过渡到执行伸手运动的四块肌肉的代表性 EMG 记录。 总持续时间为 1 秒。 请单击此处查看此图的较大版本。
讨论
该协议能够从执行各种行为的头部固定小鼠的稳定肌肉活动记录数周。最近,这种方法已被用于检查跑步机运动18,20、操纵杆拉动任务18 和共收缩任务21 等行为期间肢体肌肉组织的神经控制。虽然此处描述的协议特定于小鼠肘部和腕部肌肉,但通过更改电极对的长度和/或总数,可以很容易地对其进行修改以记录来自不同肌肉或不同数量的肌肉。此处描述的方法改编自以前用于记录没有头枕的小鼠前肢和后肢肌肉活动的方法 15,16,17。
电极制造需要大量的实践才能掌握。建议在学习时每天练习 1-2 小时。剥去电极是最具挑战性的步骤,因为在不损坏底层电线的情况下切割绝缘层所需的力非常精确。这种程度的力取决于刀片的锋利度,因此经常更换手术刀刀片有助于确保学习过程中的可重复性。将电线焊接到连接器的黄铜刀片上也可能很困难,因为不锈钢不容易焊接。涂抹大量与不锈钢兼容的助焊剂有助于促进连接。
植入手术过程中的主要挑战是在不干扰植入的金属丝或近端结的情况下打结远端结。近端结必须足够大,以防止在插入部位滑入肌肉 - 因此,避免在电极组制造的第 2 步中将结打得太紧。如果近端结在植入后迁移,请使用碳纤维尖头的镊子小心地重新定位。慢慢收紧远端结,同时用镊子牢牢抓住金属丝,以避免将整个电极拉过。此步骤对于确保植入电极的使用寿命至关重要:电极上施加的过多张力会导致它在动物移动时断裂,而松动的电极会在恢复过程中移动,并在组织愈合时失去与相关肌肉的接触。
动物从手术中恢复得非常好,尽管需要注意潜在的并发症。首先,如果有机会,老鼠会咀嚼它们的缝合线和电极。虽然伊丽莎白时代的项圈可以防止这种情况发生,但它也会阻止动物自行梳理毛发。一些小鼠的眼睛周围会出现粘液状堆积物。偶尔的雄性小鼠,尤其是年长的雄性小鼠,会出现尿道阻塞,这可能会让动物感到痛苦。在检查缝合线之前,每天让动物梳理自己 20 分钟,应该给动物足够的时间来防止这些问题。
需要注意此方法的重要限制。首先,这些定制电极通常无法解决单个电机单元的活动。此外,不能保证电信号仅来自特定肌肉(即二头肌),因为很难排除附近协同肌活动的串扰。因此,在出版物中,研究人员通常通过其协同组(即肘屈肌)来引用记录的肌肉。建议在每次实验后进行尸检解剖,以验证每个电极的位置,因为它们在恢复过程中可能会在组织中移动。
对单运动单元活动感兴趣的研究人员应考虑尝试埃默里大学高级运动生物工程研究中心 (CAMBER) 新开发的 EMG 电极。这些电极仍在开发中,但 CAMBER 将提供最新的电极设计。这些电极的主要缺点是使用寿命长:本协议中描述的手工制造电极通常允许记录数周,而 CAMBER 电极最适合短期实验。选择 EMG 记录方法的研究人员可以直接联系 CAMBER,以确定他们的电极是否适合给定的实验。
披露声明
没有。
致谢
作者要感谢 Claire Warriner 博士为该方法的开发做出了贡献。Mark Agrios 和 Sajishnu Savya 协助准备图表。这项研究得到了 Searle 学者奖、斯隆研究奖学金、Simons 全球大脑飞行员合作奖、白厅研究资助奖、芝加哥生物医学联盟在芝加哥社区信托基金 Searle 基金的支持下的支持、NIH 赠款 DP2 NS120847 (AM) 和 NIH 赠款 2T32MH067564 (AK)。
材料
| Name | Company | Catalog Number | Comments |
| #11 Scalpel Blades | World Precision Instruments | 504170 | For EMG electrode fabrication |
| #3 Scalpel Handle | Fine Science Tools | 10003-12 | For EMG electrode fabrication |
| 1 mL Sub-Q Syringe (100 pack) | Becton Dickinson | 309597 | For administering injectable drugs |
| 12-pin connector | Newark | 33AC2371 | 12-pin connector with brass fittings; for EMG electrode fabrication |
| 18 G Needles | Exel International | 26419 | For EMG electrode fabrication |
| 27 G Needles | Exel International | 26426 | For EMG electrode fabrication |
| 3 M Transpore Surgical Tape | 3M | 1527-0 | For taping animal's limbs out during surgery |
| 6-0 silk sutures | Henry Schein | 101-2636 | These sutures work well with delicate skin around the wrists |
| C&B Metabond Complete Kit | Pearson Dental | P16-0126 | Dental cement to affix connector to headplate |
| C57BL6/J Mice | Jackson Laboratories | #000664 | Wild type mice |
| Carbofib 5-CF Tweezers (2) | Aven tools | 18762 | Carbon fiber tipped forceps, used to manipulate delicate parts of electrode (stripped or inserted sections) |
| Carprodyl (Carprofen) 50 mg/mL Injection | Ceva Animal Health, LLC | G43010B | Injectable analgesic for pain management during and after surgery |
| Castroviejo Micro Needle Holder | Fine science tools | 12060-01 | For suturing |
| Castroviejo Needle Holder (large) | Fine science tools | 12565-14 | For inserting needle into muscle |
| Delicate Bone Scraper | Fine science tools | 10075-16 | To separate skin from underlying tissue |
| Dietgel 76A Dietary Supplement | Clear H2O | 72-07-5022 | For post-operative care |
| Dumont #5/45 Forceps | Fine science tools | 11251-35 | To remove fascia overlying muscle |
| Elizabethan collar for mouse | Kent Scientific Corporation | EC201V-10 | For post-operative care |
| Enrofloxacin 2.27% | Covetrus | #074743 | Injectable antibiotic for use during and after surgery |
| Epoxy gel | Devcon | 14265 | For EMG electrode fabrication |
| Hopkins Bulldog Clamp (4) | Stoelting | 10-000-481 | Tissue clamps for headplate implantation |
| Isoflurane Solution | Covetrus | 11695067771 | Inhalable anesthesia |
| Lidocaine Hydrochloride Injectable - 2% | Covetrus | #002468 | Topical analgesic for pain management during surgery |
| Medical Grade Oxygen | Airgas | OX USP200 | For administering isoflurane during surgery |
| MetriCide 1 Gallon | Metrex | 10-1400 | Glutaraldehyde solution for cold-sterilization of headplate and electrodes |
| MetriTest Strips 1.5% | Metrex | 10-303 | Test strips for monitoring glutaraldehyde solution (recommended) |
| Model 900LS Small Animal Stereotaxic Instrument | Kopf Instruments | 900LS | Stereotax with lazy susan feature that allows platform rotation during surgery |
| PFA-coated 0.0055" braided stainless steel wire | A-M systems | 793200 | For EMG electrode fabrication |
| Povidone-iodine prep pads | Dynarex | 1108 | For cleaning skin |
| Puralube Vet Ointment | Dechra | 37327 | Eye ointment for surgery |
| Sterile alcohol prep pads | Dynarex | 1113 | For cleaning skin |
| Straight fine #5 forceps | Fine science tools | 11295-10 | For curling wire after insertion |
| Straight fine scissors | Fine science tools | 14060-11 | For cutting wire |
| Student Vannas Spring Scissors | Fine science tools | 91500-09 | For making incisions, trimming fat and fascia, and suturing |
| Technik Tweezers 7B-SA (2) | Aven tools | 18074USA | Curved blunt forceps, for general use during surgery |
| Triple Antibiotic Ointment | Walgreens | 975863 | Topical antibiotic for surgery |
| V-1 Tabletop Laboratory Animal Anesthesia System | VetEquip | 901806 | Contains all necessary equipment for anesthesia induction and scavenging including vaporizer, induction chamber, moveable plastic nose cone, and tubing |
参考文献
- Dombeck, D. A., Khabbaz, A. N., Collman, F., Adelman, T. L., Tank, D. W. Imaging large scale neural activity with cellular resolution in awake mobile mice. Neuron. 56 (1), 43-57 (2007).
- Guo, Z. V., et al. Flow of cortical activity underlying a tactile decision in mice. Neuron. 81 (1), 179-194 (2014).
- Guo, J. Z., et al. Cortex commands the performance of skilled movement. eLife. 4, e10774 (2015).
- Morandell, K., Huber, D. The role of forelimb motor cortex areas in goal directed action in mice. Sci Rep. 7 (1), 15759 (2017).
- Galiñanes, G. L., Bonardi, C., Huber, D. Directional reaching for water as a cortex-dependent behavioral framework for mice. Cell Rep. 22 (10), 2767-2783 (2018).
- Evarts, E. V., Tanji, J. Reflex and intended responses in motor cortex pyramidal tract neurons of monkey. J Neurophysiol. 39 (5), 1069-1080 (1976).
- Hounsgaard, J., Hultborn, H., Jespersen, B., Kiehn, O. Bistability of alpha-motoneurones in the decerebrate cat and in the acute spinal cat after intravenous 5-hydroxytryptophan. J Physiol. 405, 345-367 (1988).
- Murphy, P. R., Hammond, G. R. The role of cutaneous afferents in the control of gamma-motoneurones during locomotion in the decerebrate cat. J Physiol. 434, 529-547 (1991).
- Manuel, M., Chardon, M., Tysseling, V., Heckman, C. J. Scaling of motor output, from mouse to humans. Physiol Bethesda Md. 34 (1), 5-13 (2019).
- Sauerbrei, B. A., et al. Cortical pattern generation during dexterous movement is input-driven. Nature. 577 (7790), 386-391 (2020).
- Barrett, J. M., Raineri Tapies, M. G., Shepherd, G. M. G. Manual dexterity of mice during food-handling involves the thumb and a set of fast basic movements. PLoS One. 15 (1), e0226774 (2020).
- Serradj, N., et al. Task-specific modulation of corticospinal neuron activity during motor learning in mice. Nat Commun. 14, 2708 (2023).
- Scholle, H. C., et al. Spatiotemporal surface EMG characteristics from rat triceps brachii muscle during treadmill locomotion indicate selective recruitment of functionally distinct muscle regions. Exp Brain Res. 138 (1), 26-36 (2001).
- Scholle, H. C., et al. Kinematic and electromyographic tools for characterizing movement disorders in mice. Mov Disord off J Mov Disord Soc. 25 (3), 265-274 (2010).
- Pearson, K. G., Acharya, H., Fouad, K. A new electrode configuration for recording electromyographic activity in behaving mice. J Neurosci Methods. 148 (1), 36-42 (2005).
- Akay, T., Acharya, H. J., Fouad, K., Pearson, K. G. Behavioral and electromyographic characterization of mice lacking EphA4 receptors. J Neurophysiol. 96 (2), 642-651 (2006).
- Akay, T., Tourtellotte, W. G., Arber, S., Jessell, T. M. Degradation of mouse locomotor pattern in the absence of proprioceptive sensory feedback. Proc Natl Acad Sci USA. 111 (47), 16877-16882 (2014).
- Miri, A., et al. Behaviorally selective engagement of short-latency effector pathways by motor cortex. Neuron. 95 (3), 683-696 (2017).
- Osborne, J., Dudman, J. RIVETS: A mechanical system for in vivo and in vitro electrophysiology and imaging. PloS One. 9 (2), e89007 (2014).
- Santuz, A., Laflamme, O. D., Akay, T. The brain integrates proprioceptive information to ensure robust locomotion. J Physiol. 600 (24), 5267-5294 (2022).
- Warriner, C. L., Fageiry, S., Saxena, S., Costa, R. M., Miri, A. Motor cortical influence relies on task-specific activity covariation. Cell Rep. 40, 111427 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。