Method Article
만성적으로 이식된 EMG 전극을 사용하여 머리 고정 마우스의 앞다리 근육 활동 기록
요약
이 프로토콜은 머리 고정 행동 실험 중 근육 활동을 기록하기 위해 쥐의 앞다리 근육에 근전도(EMG) 전극을 손으로 제작하고 외과적으로 이식하는 방법을 설명합니다.
초록
생쥐 시스템 신경 과학 연구에서 사용할 수 있는 강력한 유전 및 분자 도구를 통해 연구원들은 다양한 작업을 수행하는 머리에 고정된 생쥐에서 전례 없는 정밀도로 운동 시스템 기능을 조사할 수 있습니다. 근육 활동을 근전도(EMG)로 기록하는 기존의 방법은 고양이와 영장류와 같은 큰 동물을 위해 설계되었기 때문에 마우스의 크기가 작기 때문에 운동 출력 측정이 어렵습니다. 생쥐용 근전도 전극이 상용화될 예정인 가운데, 생쥐의 근육 활동을 기록하는 현재의 표준 방법은 사내에서 전극 세트를 만드는 것입니다. 이 기사에서는 전극 세트의 수동 제작, 헤드플레이트 삽입과 동일한 수술에서 전극 이식, 헤드플레이트에 커넥터 고정 및 수술 후 회복 관리에 대한 기존 절차의 개선에 대해 설명합니다. 복구 후, 신호 품질의 눈에 띄는 변화 없이 몇 주 동안 헤드 고정 동작 중에 밀리초 해상도의 EMG 기록을 얻을 수 있습니다. 이러한 기록을 통해 생체 내 신경 기록 및/또는 섭동과 함께 앞다리 근육 활동을 정밀하게 측정하여 마우스의 운동 제어 메커니즘을 조사할 수 있습니다.
서문
최근 수십 년 동안 생쥐는 포유류의 운동 시스템을 연구하기 위한 매력적인 모델 유기체가 되었습니다. 일반적인 실험적 접근법은 신경 활동 1,2,3,4,5의 모니터링 및/또는 교란과 함께 운동 작업을 수행하는 머리 고정 마우스를 포함합니다. 더 큰 종(예: 고양이 및 영장류)에 대한 운동 시스템 연구는 전통적으로 이러한 실험 중에 운동 출력을 직접 측정하기 위해 근전도(EMG)에 의존해 왔습니다 6,7,8. 그러나 생쥐의 근육 활동을 기록하는 것은 어려운 일인데, 그 이유는 생쥐의 근육 조직이 대형 포유류 실험에 사용되는 상업적으로 이용 가능한 근전도 전극에 비해 너무 작기 때문이다9. 많은 연구자들이 비디오 4,10,11 및/또는 행동 성능2,4,12를 통해 사지 운동학을 추적하여 운동 출력을 간접적으로 조사하기로 선택하지만, 이러한 방법은 신경 활동과 근육에 대한 섭동이 밀리초 단위의 영향을 감지할 수 있는 해상도가 부족합니다. 따라서 근전도 기록은 근육의 직접적인 신경 제어에 관심이 있는 연구자에게 바람직합니다.
EMG는 일반적으로 기록되는 근육의 섬유와 거의 평행한 짧은 거리로 분리된 두 지점 사이의 전압을 측정하는 것을 포함합니다. EMG 전극은 표면(또는 "패치") 및 근육내(또는 "바늘") 종류가 있습니다. 표면 전극은 피부 위에 배치되거나 근육 조직에 오버레이되고 접착제 또는 봉합으로 고정됩니다. 따라서 표면 전극은 근육 내 전극보다 덜 침습적이며 상대적인 사용 편의성으로 인해 인간, 고양이 및 영장류에서 가장 인기가 있습니다. 표면 전극은 또한 쥐와 생쥐와 함께 성공적으로 사용되었다 13,14; 그러나 설치류가 그루밍하는 동안 이물질을 제거하려고 하는 경향으로 인해 손으로 제작하여 피부 아래에 외과적으로 이식해야 합니다. 반면에 근육 내 EMG 전극은 근육 조직 내에 외과적으로 이식됩니다. 근육 조직에 둘러싸여 있기 때문에 높은 공간 해상도를 제공하고 무기한 제자리에 고정된 상태를 유지합니다. 따라서 이식된 근육 내 EMG 전극은 설치류를 사용한 장기 실험을 위해 표면 전극 위에 이상적입니다. 생쥐의 근육 내 근전도를 안정적으로 기록하기 위해 연구원들은 성인 생쥐의 팔뚝에 있는 근육만큼 작은 근육에 근전도 전극을 수동으로 제작하고 이식하는 방법을 개발했습니다. 이 전극은 몇 주 동안 설치류의 운동 행동 중에 만성 근육 기록을 가능하게 합니다.
여기에 기술된 프로토콜은 확립된 방법15,16,17,18을 10년에 걸쳐 개선한 결과이며, 이는 행동하는 마우스에서 팔꿈치와 손목의 굴곡근/신전근 쌍에 만성적으로 이식된 와이어 EMG 전극에서 손으로 제작, 이식 및 기록하는 절차를 산출했습니다. 첫 번째 섹션에서는 4개의 전극 쌍과 헤드 스테이지 인터페이스용 8핀 커넥터가 있는 전극 세트의 수동 제작에 대해 설명합니다. 다음 섹션에서는 헤드플레이트 삽입과 동일한 수술에서 상완 및 하완 근육에 전극을 근육 내 외과적 이식하는 방법에 대해 자세히 설명합니다. 마지막으로, 다양한 행동을 수행하는 쥐의 대표적인 녹음에 대해 논의합니다. 전반적으로 이 방법은 머리 고정 거동 실험에 근육 활동 측정을 포함할 수 있는 비용 효율적이고 사용자 정의 가능한 방법으로, 전극 제조 경험이 있는 실험실에 이상적입니다.
프로토콜
모든 실험과 절차는 NIH 지침에 따라 수행되었으며 Northwestern University의 Institutional Animal Care and Use Committee의 승인을 받았습니다. 다른 국가 및/또는 기관에는 이 절차를 수정해야 하는 다른 규정이 있을 수 있습니다. 본 연구에 포함된 동물은 최소 체중 20g의 12-20주 된 C57BL6/J 성인 남성( 재료 표 참조)이었습니다.
1. 전극 세트 제작
참고: 배율 범위가 10x-40x인 실체현미경을 사용하여 깨끗한 벤치탑에서 깨끗한 맨손으로 이 단계를 수행합니다. 전극 와이어 스트리핑(그림 1A) 및 커넥터 어셈블리(그림 1B)를 자세히 설명하는 다이어그램은 그림 1을 참조하십시오.
- 와이어 절단: 각 전극 쌍에 대해 PFA 코팅된 편조 스테인리스 강선(7가닥, 0.0055" 직경) 두 조각을 절단합니다( 재료 표 참조). 팔뚝 근육의 경우 각 와이어를 9.5cm 길이로 자릅니다. 팔뚝 근육의 경우 각 와이어를 10.5cm 길이로 자릅니다.
- 두 개의 와이어를 하나의 매듭으로 묶습니다 - 이것은 이식 시 삽입 부위 바로 바깥쪽에 있는 매듭(근위 매듭)이 됩니다. 연결된 와이어는 하나의 전극 쌍을 구성합니다.
- 골판지에 삽입된 18G 바늘을 사용하여 매듭을 삽입 끝에서 6cm 떨어진 곳에 놓고 전극 가닥을 판지에 대고 당겨 바늘 주위를 조입니다. 삽입 끝은 약 5.5cm로 줄어들고 나머지 0.5cm는 매듭에 묶입니다.
- 바늘을 조심스럽게 제거하고 맨손으로 매듭을 두 번 단단히 당겨 더 조입니다.
알림: 매듭은 가능한 한 꽉 조이지 않아야 합니다. 이러한 방식으로 조이면 이식된 전극을 조직에 고정할 수 있는 올바른 크기의 근위 매듭이 생성됩니다. - 상완 근육의 경우 커넥터 끝의 길이가 3.5cm인지 확인하십시오. 팔뚝 근육의 경우 커넥터 끝의 길이가 4.5cm인지 확인하십시오.
- 각 와이어에서 0.5mm의 절연체를 제거합니다: 한 와이어의 매듭에서 1-1.5mm, 다른 와이어의 매듭에서 2-2.5mm. 그림 1 은 각 전선을 벗겨낼 위치를 보여줍니다.
- 두 개의 커넥터 끝 와이어를 함께 놓고 삽입 끝 와이어를 벌리고 평평한 판지 조각에 전극을 팽팽하게 테이프로 붙입니다.
- 메스를 사용하여 단열재에 흠집을 내고 단열재가 제거 될 끝 부분을 표시하십시오.
- 각 흠집에서, 각 흠집에서, 메스 칼날로 일련의 ~ 6 절단을하십시오 : 상단에 ~ 2, 측면에 ~ 2, 와이어 아래에 ~ 2.
알림: 와이어 자체를 너무 많이 절단하지 않는 것이 중요합니다. 그렇지 않으면 가닥이 끊어질 수 있습니다. 와이어의 손상을 제한하면서 절연체를 완전히 절단하기 위해 적절한 양의 압력을 얻으려면 연습이 필요합니다. - 전극 쌍을 180도 회전하고 각 흠집에서 6번의 절단을 반복합니다.
- 필요에 따라 추가 절단을 배치하여 기본 와이어에서 0.5mm의 절연체를 분리합니다. 여기에 필요한 절단 횟수는 가해지는 압력과 메스 칼날의 날카로움에 따라 다릅니다.
- 메스 블레이드의 각도를 조절하여 헐거워진 절연체를 따라 세로로 자르고 집게를 사용하여 와이어에서 제거합니다.
- 노출된 와이어에 조직에 삽입하는 동안 손상을 일으킬 수 있는 파손 및/또는 닳은 절연체가 있는지 검사합니다.
- 커넥터 끝에서 각 와이어의 끝에서 1mm 벗겨냅니다.
- 삽입 끝에서 각 와이어의 끝에서 5mm 벗겨냅니다.
- 삽입 끝 와이어 세그먼트를 함께 꼬고 5mm의 노출된 끝을 0.5인치의 샤프트에서 함께 압착합니다. 27g 바늘. 일반적인 피하 주사 바늘은 루어 잠금 끝을 제거한 후 사용할 수 있습니다.
- 각 전극 쌍에 대해 1.1-1.6단계를 반복합니다.
- 커넥터를 조립합니다.
- 12핀 커넥터의 암 끝( 재료 표 참조)을 크기로 자릅니다: # 전극 쌍 x 2핀 슬롯.
- 각 커넥터 포트에서 황동 피팅(12핀 커넥터에 미리 연결되어 있음)을 플라이어로 부드럽게 제거합니다. 다음 단계를 위해 이러한 피팅을 저장합니다.
- 각 와이어의 각 1mm 노출된 끝을 황동 피팅 블레이드 중 하나의 외부 표면에 납땜합니다.
주의 : 납땜은 피부, 눈 및 호흡기 자극을 유발할 수 있는 연기를 방출합니다. 장갑을 착용하고(또는 나중에 손을 씻으십시오), 보안경을 사용하고 국소 연기 추출 장치를 사용하여 노출을 제한하십시오.- 블레이드 중 하나의 외부 표면이 위를 향하도록 하여 보조 수공구에 부착된 이빨 없는 악어 클립에 황동 피팅을 고정합니다.
- 납땜 중에 높은 시각적 제어를 허용하도록 현미경 아래에 피팅을 배치하십시오. 펼쳐진 종이 클립이나 스크랩 와이어 조각을 사용하여 블레이드 표면에 소량의 스테인리스강 호환 플럭스를 두드립니다.
- 좁은 원뿔형 솔더 팁을 사용하여 황동 블레이드의 하단 ~1.5mm를 덮을 수 있도록 블레이드에 충분한 솔더를 적용합니다.
알림: 여기에 납땜이 너무 많으면 커넥터 조립을 방해하고 납땜이 너무 적으면 연결이 부적절할 수 있습니다. 필요한 경우 다시 시작할 수 있도록 추가 황동 피팅을 준비하십시오. - 블레이드의 땜납 표면을 스테인리스강 호환 플럭스로 넉넉하게 코팅하되 플럭스가 두 블레이드 사이의 공간으로 떨어지지 않도록 합니다.
- 1mm의 노출된 전극 와이어를 블레이드의 땜납과 같은 높이로 잡고 인두로 땜납을 가열하여 연결을 융합합니다.
- 연결 검사: 노출된 와이어의 대부분은 솔더에 담가야 하며 와이어는 황동 피팅에 단단히 부착되어야 합니다. 황동 피팅의 두 날 사이에 땜납이 끼지 않았는지 확인하십시오 - 나중에 수 커넥터를 삽입하기 어렵게 만들 수 있습니다. 마지막으로, 다음 단계에서 피팅을 커넥터에 다시 삽입할 수 있도록 연결이 황동 블레이드와 같은 높이에 있는지 확인합니다.
- 직선 집게를 사용하여 납땜된 각 황동 피팅을 커넥터에 다시 삽입하고 각 전극 쌍의 와이어가 서로 인접하고 다른 전극 쌍과 얽히지 않도록 합니다. 커넥터에서 단일 전극 쌍의 방향을 시각화하려면 그림 1B 를 참조하십시오.
참고: 왼쪽에서 오른쪽으로 이상적인 방향은 이두근(커넥터 끝에서 3.5mm), 삼두근(커넥터 끝에서 3.5mm), 신근 근골 요골(ECR, 커넥터 끝에서 4.5mm) 및 팔마리 장(PL, 커넥터 끝에서 4.5mm)입니다. 주입 중 커넥터의 방향을 추적하기 위해 한쪽을 마커 또는 화이트아웃으로 표시합니다. - 수 12핀 커넥터를 암 끝과 동일한 크기(# 전극 쌍 x 2)로 자르고 암 커넥터에 연결합니다. 피팅이 변위된 경우 수 커넥터가 장착된 후 직선 집게로 다시 삽입할 수 있습니다.
- 펜치로 황동 피팅에서 나오는 탭을 제거합니다.
- 핀 슬롯을 에폭시로 코팅하여 커넥터 근처의 모든 금속 또는 와이어가 조직으로부터 절연되도록 합니다.
주의: 에폭시는 장기간 노출되면 피부, 눈 및 호흡기 자극을 유발할 수 있습니다. 장갑과 보안경을 착용하고 환기가 잘 되는 곳이나 지역 연기 추출 장치 아래에서만 에폭시를 사용하십시오. - 커넥터를 최소 30분 동안 자연 건조시키십시오.
- 각 전극 쌍의 저항을 테스트하고 수술 중에 쉽게 식별할 수 있도록 작은 색상의 열 수축 세그먼트로 바늘에 라벨을 붙입니다.
알림: 저항은 18-50옴 사이여야 합니다. 저항이 낮으면 단락을 나타낼 수 있습니다. 저항이 높으면 와이어 가닥이 너무 많이 손상되었음을 나타낼 수 있습니다. 그러나 높은 저항은 종종 니들 샤프트와 와이어 사이의 불완전한 연결(1.6단계에서 수행)에서 비롯되며, 이는 이 접합부에서 추가 압착으로 해결할 수 있습니다. - 이식하기 전에 전극 세트에 섬유 및 기타 이물질이 없는지 확인하십시오. 이를 위해 스프레이 살포기를 사용할 수 있습니다. 현미경으로 검사하면 확인하는 데 도움이 될 수 있습니다.
2. 전극 이식 수술
참고: 이 섹션에서는 이전 섹션에서 제작된 헤드플레이트와 전극을 삼두근, 이두박근, ECR(Extensor Carpi Radialis) 및 PL(palmaris longus)에 이식하는 단일 수술 절차에 대해 설명합니다. 후자의 두 근육의 경우, 근처의 시너지 근육을 통하지 않고 이러한 개별 근육에만 전극을 이식하는 것은 매우 어렵습니다. 개별 근육에서 녹음을 분리하려고 할 때 주의해야 할 사항에 대한 아래 논의를 참조하십시오. 헤드플레이트는 일반적으로 특정 실험을 위해 맞춤 설계 및 제작됩니다. 본 연구는 3D 프린팅 플라스틱 RIVETS 헤드플레이트19를 사용했습니다. 많은 오픈 소스 헤드플레이트 디자인은 Janelia, Allen Institute 및 독립 연구 그룹을 통해 온라인에서 사용할 수 있습니다. 여기에 설명된 헤드플레이트 절차는 티타늄 및 플라스틱 헤드플레이트에 성공적으로 사용되었습니다. 수술 절차는 10-40x 배율 범위의 입체 현미경이 있는 입체 기구( 재료 표 참조)에서 수행해야 합니다.
- 하룻밤 동안 또는 8시간 동안 1.5% 글루타르알데히드를 사용하여 전극과 헤드플레이트를 냉간 멸균합니다. 멸균된 물로 잠시 헹구고 이식하기 전에 완전히 자연 건조시키십시오.
주의: 글루타르알데히드는 삼키면 유해하며 눈, 피부 및 호흡기에 자극을 유발할 수 있습니다. 통풍이 잘되는 흄 후드에 장갑을 끼고 다루십시오. - 기관에서 승인된 프로토콜에 따라 교정 반사(약 3분)가 손실될 때까지 유도 챔버에서 의료용 산소에 2-4% 이소플루란으로 마취를 유도합니다.
- 마취를 계속하기 위해 동물을 이동식 코콘으로 옮깁니다. 의료용 산소에 2% 이소플루란으로 마취 하에 수술 전에 동물의 머리, 목 및 팔다리를 면도합니다. 이 섹션의 나머지 모든 단계는 마취 상태에서 수행합니다. 1Hz의 호흡 속도를 유지하고 발가락 꼬집기 반사가 없도록 필요에 따라 이소플루란의 복용량을 조정합니다.
- 눈 윤활제를 바르고 수술 내내 1시간마다 다시 바르십시오.
- 수술 시작 시 주사 가능한 진통제(예: 카프로펜, 5mg/kg) 및 항생제(예: 엔로플록사신, 10mg/kg)를 피하로 투여합니다( 자료표 참조).
- 다음 단계 또는 기관에서 승인한 다른 방법을 사용하여 헤드플레이트를 이식합니다.
- 동물의 머리를 입체 기구의 이어 바에 고정하고 입체 기구에 부착된 노즈 콘을 통해 마취(2% 이소플루란)를 제공합니다. 무균을 유지하기 위해 멸균 드레이프를 추가하십시오.
- 포비돈-요오드 준비 패드와 멸균 알코올 준비 패드로 머리와 목을 청소합니다.
필요한 경우 눈 윤활제를 다시 바르십시오. - 절개 부위에 리도카인(4mg/kg)( 재료 표 참조)을 피하로 주사합니다.
- 발가락 꼬집기를 수행하여 적절한 마취 유도를 보장합니다. righting reflex가 없으면 눈의 꼬리 가장자리에서 귀의 꼬리 가장자리까지 동물의 머리 정중선을 절개합니다.
- 티슈 클립으로 피부를 고정합니다: 눈 바로 뒤 양쪽의 가장자리에 2개, 귀 바로 뒤 꼬리 가장자리에 2개.
- 메스 칼날로 부드럽게 긁어 두개골 표면을 청소하여 건조된 근막을 제거합니다.
- 두개골 표면에 치과용 시멘트를 얇게 바르고( 재료 표 참조) 5분 동안 건조시킵니다.
- 헤드플레이트를 동물의 두개골에 놓습니다. 헤드플레이트를 이식하는 방법과 위치는 헤드플레이트와 연구 질문에 따라 다릅니다.
- 치과용 시멘트를 사용하여 헤드플레이트를 두개골에 부착합니다. 두개골이 완전히 덮여 있는지 확인하십시오. 치과용 시멘트를 10분 동안 건조시킵니다.
- 수술을 마칠 수 있도록 동물을 이동식 플라스틱 코콘으로 옮깁니다. 이렇게 하면 수술 중에 동물의 위치를 정기적으로 변경하여 마취를 유지하면서 다른 근육에 접근할 수 있습니다.
- 목 뒤쪽의 절개 부위(헤드플레이트 삽입 시 만듦)를 확장하여 귀에서 꼬리 1cm까지 도달하도록 합니다.
- 뭉툭한 뼈 긁는 도구를 사용하여 목 절개 부위 아래의 피부를 기저 조직에서 분리하여 목 절개 부위에서 전극이 이식될 앞다리까지의 경로를 확보합니다.
- 전극 주입 중에 제자리에 고정하기 위해 작은 테이프를 사용하여 EMG 커넥터를 헤드플레이트에 임시로 고정합니다.
- 포비돈-요오드 준비 패드와 멸균 알코올 준비 패드로 동물의 앞다리를 청소합니다.
- 삼두근을 절개합니다.
- 삼두근이 위를 향하도록 동물을 옆으로 눕힙니다.
- 계획된 절개 부위에 리도카인(4mg/kg)을 주사합니다. 이렇게 하면 이식하는 동안 국소 통증이 완화되고 근육이 촉촉하게 유지됩니다.
참고: 근육은 촉촉한 상태를 유지해야 하지만 수술 내내 젖지 않아야 합니다. 근육이나 피부가 건조해 보이는 경우 필요에 따라 멸균 식염수를 국소적으로 바르십시오. - 뼈와 평행한 삼두근 위로 7mm를 자릅니다.
- 뭉툭한 뼈 스크레이퍼로 절개 부위를 둘러싼 피부를 기저 조직에서 분리합니다. 피부 아래에서 목 절개 부위까지 스크레이퍼를 작업하여 전극이 들어갈 수 있는 경로를 확보합니다.
- 근육을 가리고 있는 근막을 제거합니다.
- 삼두근 절개 부위를 통해 닫힌 가위를 삽입하고 목 구멍을 밀어내고 구멍을 빠져나온 후 약간 열려 목에서 삼두근까지의 경로가 충분히 큰지 확인합니다.
- 삼두근 전극을 삼두근 절개 부위로 가져오기: 큰 바늘 드라이버의 끝을 삼두근 절개 부위를 통해 목 절개 부위 밖으로 삽입합니다. Clamp 니들 드라이버를 전극 바늘 주위에 세로로 끼우고 삼두근 절개 부위까지 당깁니다.
- 삼두근 삽입: 3단계 "근육에 전극 삽입"을 따릅니다.
- 팔 말단부를 절개합니다.
- 동물을 등에 눕힙니다.
- 손바닥이 아래를 향하도록 동물의 옆구리를 따라 팔을 테이프로 붙입니다.
- 계획된 절개 부위에 리도카인(4mg/kg)을 주사합니다.
- 이두박근 위로 1cm를 절개하고 삼각근 하단에서 뼈와 평행하게 팔뚝 중앙까지 ECR을 절개합니다. 절개의 말단 끝은 아래팔 근육 끝에서 ~2mm 위에 있어야 합니다.
- 이두박근을 노출시키기 위해 근막을 제거합니다.
- 팔뚝 말단 절개에서 상완 피부 아래를 따라 흐르는 큰 혈관 위(근위부) 삼두근 절개까지 경로를 비웁니다.
- 이두박근 전극을 목 절개를 통해 삼두근 절개까지 피부 아래에 끼운 다음 삼두근 절개에서 팔 말단 절개까지 끼웁니다.
- 이두박근 삽입: 3단계 "근육에 전극 삽입"을 따릅니다.
- 동물의 팔을 같은 위치에 다시 테이프를 붙이되 손바닥이 아래를 향하도록 합니다.
- 노출된 이두박근의 근위 끝에 가능한 한 가깝게 삽입합니다.
- 근육 조직에서 전극의 최소 3mm를 담그려면 마우스의 크기에 따라 근섬유에 약간 대각선으로 삽입해야 합니다.
- 삼두근 절개 부위에서 상완 피부 아래를 흐르는 큰 혈관 아래(원위)의 말단 팔 삽입 부위까지의 경로를 확보하여 이두박근 전극의 경로와 구별되는 경로를 만듭니다.
- ECR 삽입: 3단계 "근육에 전극 삽입"을 따릅니다.
- ECR의 가장 가까운 부분에 삽입합니다.
- ECR과 길항제 사이의 주름에서 빠져 나오고이 주름에 매듭을 묶습니다.
- 삼두근 삽입에서 팔꿈치 아래의 PL 삽입 부위까지의 경로를 비웁니다.
- PL 삽입: 3단계 "근육에 전극 삽입"을 따릅니다.
- 동물을 등에 눕히고 손바닥이 위를 향하도록 하여 팔을 머리에 테이프로 감습니다.
- 팔꿈치 원위부에 삽입합니다.
- 출구 부위의 매듭이 손목 힘줄이 아닌 근육에 놓이도록 손목 힘줄에 충분히 근접하여 출구를 만듭니다.
- 동물을 옆으로 눕히고 6-0 실크 봉합사를 사용하여 삼두근 절개 부위를 봉합합니다.
- 동물을 등에 눕히고 6-0 실크 봉합사를 사용하여 말단 팔 절개 부위를 봉합합니다.
- 치과용 시멘트를 사용하여 커넥터를 헤드플레이트 뒷면에 부착합니다.
- 6-0 실크 봉합사를 사용하여 절개 부위를 봉합합니다.
- 염증을 줄이기 위해 절개 부위에 국소 항생제 크림을 바르십시오.
- 회복 중 봉합사를 방해하지 않도록 동물에게 엘리자베스 목걸이( 재료 표 참조)를 부착하십시오.
3. 근육에 전극 삽입
- 바늘 (27G, 1 단계)을 구부려 약간 구부립니다.
- 바늘 드라이버로 바늘을 잡고( 재료 표 참조) 한 쌍의 집게 손잡이에 대고 눌러 5-10도 구부리기를 추가합니다.
- 바늘의 길이를 따라 서로 다른 위치에 총 3개의 굽힘을 추가합니다.
- 근육이 들어가고 나갈 위치를 시각화합니다.
- 미세한 집게로 자르거나 잡아당겨 입구와 출구 부위를 가리고 있는 지방과 근막을 제거합니다. 출혈을 제한하기 위해 혈관 손상을 피하십시오.
- 근육 섬유와 평행하게 이어지는 3-5mm의 수중 와이어를 목표로 합니다. 이렇게 하면 노출된 전극 와이어가 근육 내에 잠기게 됩니다.
- 바늘 드라이버를 사용하여 근육의 근위 끝에 바늘을 삽입하고 다른 손에는 뭉툭한 곡선 겸자로 역압을 가합니다. 근육을 통해 바늘을 출구 부위로 밀어 넣습니다.
- 바늘이 근육에서 빠져 나오면 뭉툭한 집게로 끝 부분을 잡고 바늘을 당겨 통과시킵니다. 근위 매듭이 삽입 부위 위에 놓일 때까지 계속 당깁니다.
- 말단 매듭을 만드십시오.
- 집게를 사용하여 출구 부위의 원위부에 느슨한 매듭을 묶습니다. 매듭을 1cm 고리로 조입니다.
- 집게로 루프를 밀어 출구 부위에 놓습니다.
- 말단 매듭을 완전히 조이기 전에 출구 부위에서 약 0.5mm 원위까지 닫아야 하는 위치를 시각화합니다. 이 위치에서 가늘게 구부러진 집게로 고리를 부드럽게 잡고 고리를 집게 위로 단단히 당깁니다.
알림: 이 단계에서 출구 부위 바로 위에 말단 매듭을 조이지 마십시오. 그렇지 않으면 다음 단계에서 매듭이 완전히 조여질 때 근육이 눌립니다. - 매듭에서 가는 집게를 제거하고 세세하게 구부러진 집게로 매듭을 출구 쪽으로 밀어 바늘 끝을 손가락으로 잡아 당겨 매듭을 조이는 마무리합니다. 삽입된 전극을 제자리에 고정하기 위해 근위 매듭과 원위 매듭이 각각 삽입 및 출구 부위 외부에 적절하게 위치하는지 확인합니다.
- 곧고 가는 집게로 출구 매듭을 잡고 집게 주위의 말단 와이어를 단단히 말아 매듭 주위의 와이어를 구부리고 근육 쪽으로/피부에서 멀어집니다.
- 말단 매듭에서 원위 0.5mm 와이어를 잘라 매듭 주위에 작은 덩어리를 말아 둡니다.
이전 단계는 너브의 잘린 끝이 동물의 피부를 찌르지 않도록 하여 자극을 유발할 수 있습니다.
4. 수술 후 관리
- 수술 직후 다음 단계를 수행하십시오.
- 케이지 동료가 봉합사를 방해하지 않도록 동물을 단독으로 수용하십시오.
- 낮은 침구가 있는 깨끗한 케이지에 동물을 넣으십시오. 엘리자베스 칼라를 착용하는 동안 동물의 이동을 방해할 수 있는 둥지와 풍부 물질을 제거하십시오.
- 목걸이를 착용한 동안 접근할 수 있는 물과 습식 사료를 동물에게 주십시오.
- 수술 후 24시간 및 48시간 후에 다음 단계를 수행하십시오.
- 동물이 20분 동안 스스로 그루밍할 수 있도록 엘리자베스 칼라를 제거합니다.
- 2.2단계 및 2.3단계에서 언급한 대로 이소플루란으로 마취를 유도합니다.
- 주사 가능한 진통제와 항생제를 투여합니다.
- 절개 부위에 누락된 봉합사, 열린 상처, 감염 또는 자극의 징후가 있는지 검사합니다. 봉합사를 교체하고 필요한 경우 더 많은 국소 항생제를 바르십시오.
- 엘리자베스 칼라가 제거될 때까지 48시간마다 습식 사료를 교체하십시오.
- 수술 후 6일 후에 다음 단계를 수행하십시오.
- 상처가 완전히 치유되었는지 확인하십시오.
- 상처가 봉합되면 봉합사를 제거하십시오. 상처가 열려 있으면 봉합사를 제거할 때까지 이틀 더 기다립니다. 봉합사를 제거할 때 엘리자베스 칼라를 제거하십시오.
- 마우스를 완전한 침구와 영양 처리 된 새롭고 깨끗한 케이지로 되돌려 놓으십시오.
참고: 동물은 수술 후 7일 후에 실험 또는 수분 박탈을 진행할 수 있습니다.
결과
그림 2, 그림 3 및 그림 4 는 머리를 고정하지 않고 러닝머신 걷기(그림 2), 머리 고정 상태에서 회전하는 바퀴를 오르고(그림 3), 머리 고정 상태에서 물방울에 손을 뻗는 다양한 행동을 수행하는 쥐의 앞다리 근육에서 기록된 정상화된 근육 활동을 보여줍니다(그림 4). 그림 2 는 두 개의 팔꿈치 굴곡근 활성화 사이의 시간에서 추정된 대략적인 걸음 수와 함께 1.5초의 트레드밀 보행을 보여줍니다. 그림 3 은 이식 후 6주 후에 손목 신전근 전극이 고장난 동물의 5초 근전도 데이터를 보여줍니다. 그림 3A에서 4개의 전극은 모두 휠의 회전(등반을 나타냄)과 일치하는 깨끗한 EMG 신호를 생성합니다. 그림 3B 는 고장 후 동일한 전극의 신호를 보여줍니다: 손목 신장 전극은 동물의 움직임에 따라 변하지 않는 잡음이 있는 신호를 생성합니다. 그림 4 는 쥐가 부동자세에서 물방울에 손을 뻗는 것으로 전환하는 작업 동안 4개의 앞다리 근육 그룹에서 1초의 EMG를 보여줍니다.
그림 2, 그림 3 및 그림 4에서 전압 신호는 차동 증폭기를 사용하여 증폭되고 대역 통과 필터링(250-20,000Hz)되었습니다. 그런 다음 원시 전압을 1kHz로 서브샘플링하고 데이터 세트 간 비교를 위해 z-점수를 매겼습니다. 프로토콜에 명시된 4개의 근육(이두근, 삼두근, ECR 및 PL)에 전극이 이식되었지만 인접한 시너지 근육이 EMG 신호에 영향을 미치지 않는다는 보장은 없습니다. 따라서 각 기록은 정확성을 위해 시너지 그룹(팔꿈치 굴곡근 등)에 할당됩니다. 단일 근육에서 분리된 녹음을 확인하려면 근육 녹음 간의 누화를 분석하기 위해 여러 시너지 효과에서 동시에 녹음해야 하며, 이는 특히 마우스의 하완에서 엄청나게 어려울 수 있습니다.
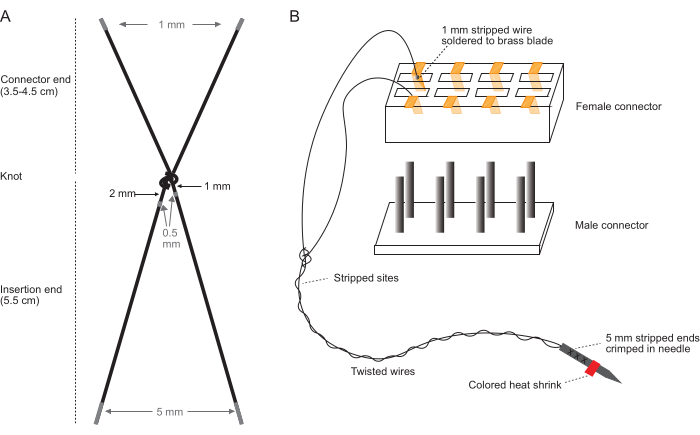
그림 1: 전극 세트 제작의 개략도. (A) 단일 전극 쌍의 다이어그램. 회색 영역은 스트리핑할 위치를 나타냅니다. (B) 커넥터에 삽입된 단일 완성된 전극 쌍이 있는 커넥터 어셈블리의 다이어그램. (B)의 다이어그램은 축척되지 않습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
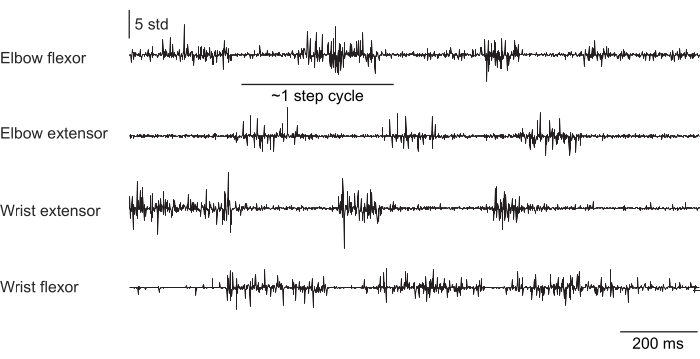
그림 2: 트레드밀 위를 걷는 자유롭게 움직이는(머리가 고정되지 않은) 쥐의 4개 근육에서 기록된 대표적인 EMG. 총 지속 시간은 1.5초입니다. 스텝 주기는 순차적인 엘보우 신전근 활성화 사이의 시간으로부터 추정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
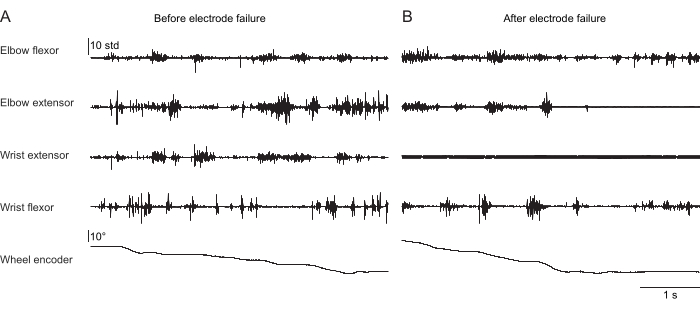
그림 3: 머리를 고정한 쥐의 4개 근육에서 자연주의적인 등반 행동을 수행하는 대표적인 EMG 기록. 5번째 행은 로터리 엔코더에 의해 판독 된 등반 휠의 위치를 보여줍니다. 이 값의 변화는 바퀴가 회전하고 동물이 적극적으로 등반하고 있음을 나타냅니다. 총 지속 시간은 5초입니다. (A) 등반 중 이식 후 36일 기록. (B) 손목 신전근 전극이 고장난 후 동일한 마우스에 이식 후 72일 동안 기록. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
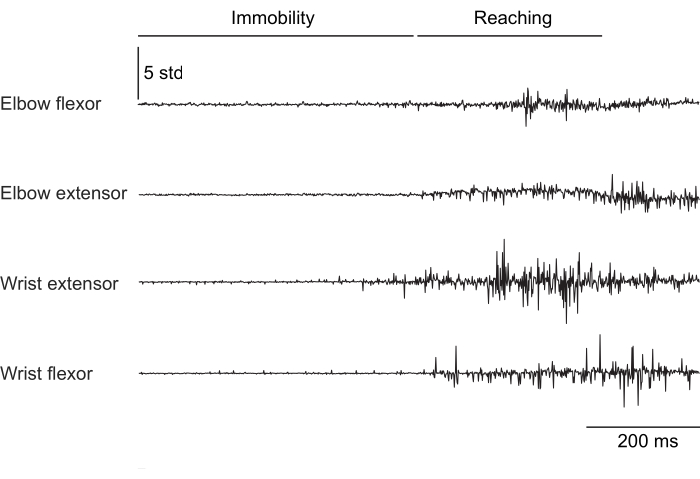
그림 4: 머리에 고정된 쥐의 4개 근육에서 부동자세에서 손을 뻗는 움직임으로 전환하는 대표적인 EMG 기록. 총 지속 시간은 1초입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 프로토콜은 몇 주 동안 다양한 행동을 수행하는 머리 고정 마우스의 안정적인 근육 활동 기록을 가능하게 합니다. 최근에, 이 방법은 트레드밀 운동(treadmill locomotion)18,20, 조이스틱 당기기 작업(18) 및 동반 수축 작업(co-contraction task)21과 같은 행동 동안 사지 근육조직의 신경 제어를 조사하기 위해 사용되고 있다. 여기에 설명된 프로토콜은 마우스 팔꿈치 및 손목 근육에 대해 특정하지만, 길이 및/또는 전극 쌍의 총 수를 변경하여 다른 근육 또는 다른 수의 근육에서 기록하도록 쉽게 수정할 수 있습니다. 본 명세서에 기술된 방법은 헤드리스트가 없는 마우스에서 앞다리 및 뒷다리 근육 활동을 기록하기 위해 이전에 사용된 방법으로부터 변형된 것이다(15,16,17).
전극 제조는 숙달하기 위해 상당한 연습이 필요합니다. 학습하는 동안 매일 1-2시간 동안 연습하는 것이 좋습니다. 전극을 스트리핑하는 것은 기본 와이어를 손상시키지 않고 절연체를 절단하는 데 필요한 정확한 수준의 힘으로 인해 가장 어려운 단계입니다. 이 수준의 힘은 칼날의 날카로움에 따라 달라지므로 메스 칼날을 자주 교체하면 학습 중에 재현성을 보장하는 데 도움이 될 수 있습니다. 커넥터의 황동 블레이드에 와이어를 납땜하는 것도 스테인리스 스틸이 쉽게 납땜되지 않기 때문에 어려울 수 있습니다. 스테인리스강 호환 플럭스를 넉넉하게 적용하면 연결을 촉진하는 데 도움이 됩니다.
이식 수술 중 주요 과제는 이식된 와이어 또는 근위 매듭을 방해하지 않고 원위 매듭을 묶는 것입니다. 근위 매듭은 삽입 부위의 근육으로 미끄러지는 것을 견딜 수 있을 만큼 충분히 커야 하므로 전극 세트 제작의 2단계에서 매듭을 너무 세게 묶지 마십시오. 이식 후 근위 매듭이 이동하는 경우 탄소 섬유 팁이 있는 집게를 사용하여 조심스럽게 위치를 조정하십시오. 전체 전극이 당겨지지 않도록 집게로 와이어를 단단히 잡으면서 말단 매듭을 천천히 조입니다. 이 단계는 이식된 전극의 수명을 보장하는 데 매우 중요합니다: 전극에 너무 많은 장력이 가해지면 동물이 움직일 때 전극이 끊어질 수 있으며, 느슨한 전극은 회복 중에 이동하여 조직이 치유됨에 따라 관련 근육과의 접촉을 잃을 수 있습니다.
동물들은 수술 후 놀라울 정도로 잘 회복되지만, 주의해야 할 잠재적인 합병증이 있습니다. 첫째, 쥐는 기회가 주어지면 봉합사와 전극을 씹을 것입니다. 엘리자베스 칼라는 이것을 방지하지만 동물이 스스로 그루밍하는 것도 방지합니다. 일부 쥐는 눈 주위에 점액과 같은 축적물이 생깁니다. 가끔 수컷 쥐, 특히 나이가 많은 쥐는 동물에게 고통스러울 수 있는 요도 폐색을 경험합니다. 봉합사를 검사하기 전에 동물이 매일 20분 동안 스스로 그루밍을 할 수 있도록 하면 동물이 이러한 문제를 예방할 수 있는 충분한 시간을 제공해야 합니다.
이 방법에는 주목해야 할 중요한 제한 사항이 있습니다. 첫째, 이러한 맞춤형 전극은 일반적으로 단일 모터 장치 활동을 해결할 수 없습니다. 또한, 전기 신호는 특정 근육(즉, 이두박근)에서만 독점적으로 방출된다는 보장되지 않으며, 이는 인근 시너지 근육의 활동으로 인한 누화를 배제하기 어렵기 때문입니다. 따라서 출판물에서 연구자들은 일반적으로 시너지 그룹(즉, 팔꿈치 굴곡근)으로 기록된 근육을 참조합니다. 각 실험 후에는 각 전극의 위치를 확인하기 위해 사후 절개를 수행하는 것이 권장되며, 이는 회복 중에 조직에서 이동할 수 있기 때문입니다.
단일 모터 단위 활동에 관심이 있는 연구원은 에모리 대학의 CAMBER(Center for Advanced Motor Bioengineering Research)에서 새로 개발한 EMG 전극을 사용해 보는 것을 고려해야 합니다. 이 전극은 아직 개발 중이지만 CAMBER는 최신 전극 설계를 제공할 것입니다. 이 전극의 주요 단점은 수명입니다: 이 프로토콜에 설명된 수작업 전극은 일반적으로 몇 주 동안 녹음을 허용하는 반면, CAMBER 전극은 단기 실험에 가장 적합합니다. EMG 기록 방법을 선택하는 연구원은 CAMBER에 직접 연락하여 전극이 주어진 실험에 적합한지 확인할 수 있습니다.
공개
없음.
감사의 말
저자들은 이 방법의 개발에 기여한 Claire Warriner 박사에게 감사를 표하고 싶습니다. 마크 아그리오스(Mark Agrios)와 사지슈누 사비아(Sajishnu Savya)는 피규어 준비를 도왔다. 이 연구는 Searle Scholar Award, Sloan Research Fellowship, Simons Collaboration on the Global Brain Pilot Award, Whitehall Research Grant Award, The Chicago Community Trust의 Searle Funds, NIH Grant DP2 NS120847(A.M.) 및 NIH Grant 2T32MH067564(A.K.)의 지원을 받은 Chicago Biomedical Consortium의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| #11 Scalpel Blades | World Precision Instruments | 504170 | For EMG electrode fabrication |
| #3 Scalpel Handle | Fine Science Tools | 10003-12 | For EMG electrode fabrication |
| 1 mL Sub-Q Syringe (100 pack) | Becton Dickinson | 309597 | For administering injectable drugs |
| 12-pin connector | Newark | 33AC2371 | 12-pin connector with brass fittings; for EMG electrode fabrication |
| 18 G Needles | Exel International | 26419 | For EMG electrode fabrication |
| 27 G Needles | Exel International | 26426 | For EMG electrode fabrication |
| 3 M Transpore Surgical Tape | 3M | 1527-0 | For taping animal's limbs out during surgery |
| 6-0 silk sutures | Henry Schein | 101-2636 | These sutures work well with delicate skin around the wrists |
| C&B Metabond Complete Kit | Pearson Dental | P16-0126 | Dental cement to affix connector to headplate |
| C57BL6/J Mice | Jackson Laboratories | #000664 | Wild type mice |
| Carbofib 5-CF Tweezers (2) | Aven tools | 18762 | Carbon fiber tipped forceps, used to manipulate delicate parts of electrode (stripped or inserted sections) |
| Carprodyl (Carprofen) 50 mg/mL Injection | Ceva Animal Health, LLC | G43010B | Injectable analgesic for pain management during and after surgery |
| Castroviejo Micro Needle Holder | Fine science tools | 12060-01 | For suturing |
| Castroviejo Needle Holder (large) | Fine science tools | 12565-14 | For inserting needle into muscle |
| Delicate Bone Scraper | Fine science tools | 10075-16 | To separate skin from underlying tissue |
| Dietgel 76A Dietary Supplement | Clear H2O | 72-07-5022 | For post-operative care |
| Dumont #5/45 Forceps | Fine science tools | 11251-35 | To remove fascia overlying muscle |
| Elizabethan collar for mouse | Kent Scientific Corporation | EC201V-10 | For post-operative care |
| Enrofloxacin 2.27% | Covetrus | #074743 | Injectable antibiotic for use during and after surgery |
| Epoxy gel | Devcon | 14265 | For EMG electrode fabrication |
| Hopkins Bulldog Clamp (4) | Stoelting | 10-000-481 | Tissue clamps for headplate implantation |
| Isoflurane Solution | Covetrus | 11695067771 | Inhalable anesthesia |
| Lidocaine Hydrochloride Injectable - 2% | Covetrus | #002468 | Topical analgesic for pain management during surgery |
| Medical Grade Oxygen | Airgas | OX USP200 | For administering isoflurane during surgery |
| MetriCide 1 Gallon | Metrex | 10-1400 | Glutaraldehyde solution for cold-sterilization of headplate and electrodes |
| MetriTest Strips 1.5% | Metrex | 10-303 | Test strips for monitoring glutaraldehyde solution (recommended) |
| Model 900LS Small Animal Stereotaxic Instrument | Kopf Instruments | 900LS | Stereotax with lazy susan feature that allows platform rotation during surgery |
| PFA-coated 0.0055" braided stainless steel wire | A-M systems | 793200 | For EMG electrode fabrication |
| Povidone-iodine prep pads | Dynarex | 1108 | For cleaning skin |
| Puralube Vet Ointment | Dechra | 37327 | Eye ointment for surgery |
| Sterile alcohol prep pads | Dynarex | 1113 | For cleaning skin |
| Straight fine #5 forceps | Fine science tools | 11295-10 | For curling wire after insertion |
| Straight fine scissors | Fine science tools | 14060-11 | For cutting wire |
| Student Vannas Spring Scissors | Fine science tools | 91500-09 | For making incisions, trimming fat and fascia, and suturing |
| Technik Tweezers 7B-SA (2) | Aven tools | 18074USA | Curved blunt forceps, for general use during surgery |
| Triple Antibiotic Ointment | Walgreens | 975863 | Topical antibiotic for surgery |
| V-1 Tabletop Laboratory Animal Anesthesia System | VetEquip | 901806 | Contains all necessary equipment for anesthesia induction and scavenging including vaporizer, induction chamber, moveable plastic nose cone, and tubing |
참고문헌
- Dombeck, D. A., Khabbaz, A. N., Collman, F., Adelman, T. L., Tank, D. W. Imaging large scale neural activity with cellular resolution in awake mobile mice. Neuron. 56 (1), 43-57 (2007).
- Guo, Z. V., et al. Flow of cortical activity underlying a tactile decision in mice. Neuron. 81 (1), 179-194 (2014).
- Guo, J. Z., et al. Cortex commands the performance of skilled movement. eLife. 4, e10774 (2015).
- Morandell, K., Huber, D. The role of forelimb motor cortex areas in goal directed action in mice. Sci Rep. 7 (1), 15759 (2017).
- Galiñanes, G. L., Bonardi, C., Huber, D. Directional reaching for water as a cortex-dependent behavioral framework for mice. Cell Rep. 22 (10), 2767-2783 (2018).
- Evarts, E. V., Tanji, J. Reflex and intended responses in motor cortex pyramidal tract neurons of monkey. J Neurophysiol. 39 (5), 1069-1080 (1976).
- Hounsgaard, J., Hultborn, H., Jespersen, B., Kiehn, O. Bistability of alpha-motoneurones in the decerebrate cat and in the acute spinal cat after intravenous 5-hydroxytryptophan. J Physiol. 405, 345-367 (1988).
- Murphy, P. R., Hammond, G. R. The role of cutaneous afferents in the control of gamma-motoneurones during locomotion in the decerebrate cat. J Physiol. 434, 529-547 (1991).
- Manuel, M., Chardon, M., Tysseling, V., Heckman, C. J. Scaling of motor output, from mouse to humans. Physiol Bethesda Md. 34 (1), 5-13 (2019).
- Sauerbrei, B. A., et al. Cortical pattern generation during dexterous movement is input-driven. Nature. 577 (7790), 386-391 (2020).
- Barrett, J. M., Raineri Tapies, M. G., Shepherd, G. M. G. Manual dexterity of mice during food-handling involves the thumb and a set of fast basic movements. PLoS One. 15 (1), e0226774 (2020).
- Serradj, N., et al. Task-specific modulation of corticospinal neuron activity during motor learning in mice. Nat Commun. 14, 2708 (2023).
- Scholle, H. C., et al. Spatiotemporal surface EMG characteristics from rat triceps brachii muscle during treadmill locomotion indicate selective recruitment of functionally distinct muscle regions. Exp Brain Res. 138 (1), 26-36 (2001).
- Scholle, H. C., et al. Kinematic and electromyographic tools for characterizing movement disorders in mice. Mov Disord off J Mov Disord Soc. 25 (3), 265-274 (2010).
- Pearson, K. G., Acharya, H., Fouad, K. A new electrode configuration for recording electromyographic activity in behaving mice. J Neurosci Methods. 148 (1), 36-42 (2005).
- Akay, T., Acharya, H. J., Fouad, K., Pearson, K. G. Behavioral and electromyographic characterization of mice lacking EphA4 receptors. J Neurophysiol. 96 (2), 642-651 (2006).
- Akay, T., Tourtellotte, W. G., Arber, S., Jessell, T. M. Degradation of mouse locomotor pattern in the absence of proprioceptive sensory feedback. Proc Natl Acad Sci USA. 111 (47), 16877-16882 (2014).
- Miri, A., et al. Behaviorally selective engagement of short-latency effector pathways by motor cortex. Neuron. 95 (3), 683-696 (2017).
- Osborne, J., Dudman, J. RIVETS: A mechanical system for in vivo and in vitro electrophysiology and imaging. PloS One. 9 (2), e89007 (2014).
- Santuz, A., Laflamme, O. D., Akay, T. The brain integrates proprioceptive information to ensure robust locomotion. J Physiol. 600 (24), 5267-5294 (2022).
- Warriner, C. L., Fageiry, S., Saxena, S., Costa, R. M., Miri, A. Motor cortical influence relies on task-specific activity covariation. Cell Rep. 40, 111427 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유