Method Article
Registro de la actividad muscular de las extremidades anteriores en ratones con cabeza fija con electrodos EMG implantados crónicamente
En este artículo
Resumen
Este protocolo describe la fabricación manual y la implantación quirúrgica de electrodos electromiográficos (EMG) en los músculos de las extremidades anteriores de ratones para registrar la actividad muscular durante los experimentos de comportamiento con la cabeza fija.
Resumen
Las poderosas herramientas genéticas y moleculares disponibles en la investigación en neurociencia de sistemas de ratón han permitido a los investigadores interrogar la función del sistema motor con una precisión sin precedentes en ratones con cabeza fija que realizan una variedad de tareas. El pequeño tamaño del ratón dificulta la medición de la potencia motora, ya que el método tradicional de registro electromiográfico (EMG) de la actividad muscular se diseñó para animales más grandes como gatos y primates. A la espera de los electrodos EMG disponibles comercialmente para ratones, el método actual de referencia para registrar la actividad muscular en ratones es hacer conjuntos de electrodos internamente. Este artículo describe un refinamiento de los procedimientos establecidos para la fabricación manual de un juego de electrodos, la implantación de electrodos en la misma cirugía que la implantación de la placa de cabeza, la fijación de un conector en la placa de cabeza y el cuidado de la recuperación postoperatoria. Después de la recuperación, se pueden obtener registros EMG con una resolución de milisegundos durante el comportamiento fijo de la cabeza durante varias semanas sin cambios notables en la calidad de la señal. Estas grabaciones permiten una medición precisa de la actividad muscular de las extremidades anteriores junto con el registro neuronal in vivo y/o la perturbación para sondear los mecanismos de control motor en ratones.
Introducción
En las últimas décadas, los ratones se han convertido en un atractivo organismo modelo para estudiar el sistema motor de los mamíferos. Los enfoques experimentales comunes involucran ratones con la cabeza fija que realizan tareas motoras junto con el monitoreo y/o la perturbación de la actividad neuronal 1,2,3,4,5. Los estudios del sistema motor en especies más grandes (como gatos y primates) se han basado tradicionalmente en la electromiografía (EMG) para medir la salida motora directamente durante dichos experimentos 6,7,8. Sin embargo, el registro de la actividad muscular en ratones es un desafío porque su musculatura es demasiado pequeña para los electrodos EMG disponibles comercialmente que se utilizanen experimentos con grandes mamíferos. Muchos investigadores optan por rastrear la cinemática de las extremidades a través de video 4,10,11 y/o rendimiento conductual 2,4,12 para sondear la salida motora indirectamente, pero estos métodos carecen de la resolución para detectar la influencia en la escala de tiempo de milisegundos de la actividad neuronal y la perturbación de la misma en los músculos. Por lo tanto, el registro de EMG es deseable para los investigadores interesados en el control neural directo de los músculos.
La EMG consiste en medir el voltaje entre dos puntos, generalmente separados por una distancia corta aproximadamente paralela a las fibras del músculo que se está registrando. Los electrodos EMG vienen en variedades de superficie (o "parche") e intramusculares (o "aguja"). Los electrodos de superficie se colocan sobre la piel o se superponen sobre el tejido muscular y se aseguran con adhesivo o sutura. Como tal, los electrodos de superficie son menos invasivos que los electrodos intramusculares y son más populares entre humanos, gatos y primates debido a su relativa facilidad de uso. Los electrodos de superficie también se han utilizado con éxito con ratas y ratones 13,14; Sin embargo, deben fabricarse a mano e implantarse quirúrgicamente debajo de la piel debido a la tendencia de los roedores a tratar de eliminar objetos extraños mientras se acicalan. Los electrodos EMG intramusculares, por otro lado, se implantan quirúrgicamente dentro del tejido muscular. Debido a que están engullidos por el tejido muscular, proporcionan una alta resolución espacial y permanecen fijos en su posición indefinidamente. Por lo tanto, los electrodos EMG intramusculares implantados son ideales sobre los electrodos de superficie para experimentos a largo plazo con roedores. Para registrar de forma fiable la EMG intramuscular en ratones, los investigadores han desarrollado un método para fabricar e implantar electrodos de EMG a mano en músculos tan pequeños como los del antebrazo de un ratón adulto. Estos electrodos permiten el registro muscular crónico durante el comportamiento motor en roedores durante varias semanas.
El protocolo descrito aquí es el resultado de un refinamiento de una década de los métodos establecidos 15,16,17,18, que ha producido un procedimiento para la fabricación, implantación y registro manual de electrodos EMG de alambre implantados crónicamente en los pares de músculos flexores/extensores del codo y la muñeca en ratones que se comportan. La primera sección describe la fabricación manual de un conjunto de electrodos con cuatro pares de electrodos y un conector de 8 pines para la interfaz de la etapa principal. En la siguiente sección se detalla la implantación quirúrgica de los electrodos por vía intramuscular en los músculos de la parte superior e inferior del brazo en la misma cirugía que el implante de la placa cefálica. Finalmente, se discuten grabaciones representativas de ratones que realizan una variedad de comportamientos. En general, este método es una forma rentable y personalizable de incluir mediciones de la actividad muscular en experimentos de comportamiento fijo en la cabeza, lo que es ideal para laboratorios con cierta experiencia en la fabricación de electrodos.
Protocolo
Todos los experimentos y procedimientos se realizaron de acuerdo con las directrices de los NIH y fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad Northwestern. Otros países y/o instituciones pueden tener regulaciones diferentes que requieran modificaciones a este procedimiento. Los animales incluidos en el presente estudio fueron machos adultos C57BL6/J (ver Tabla de Materiales) de 12 a 20 semanas de edad con un peso corporal mínimo de 20 g.
1. Fabricación del juego de electrodos
NOTA: Realice estos pasos en una mesa de trabajo limpia utilizando un microscopio estereoscópico con un rango de aumento de 10x-40x y con las manos limpias y desnudas. Consulte la Figura 1 para ver diagramas que detallan el pelado de cables de electrodos (Figura 1A) y el ensamblaje del conector (Figura 1B).
- Alambres cortados: Para cada par de electrodos, corte dos piezas de alambre de acero inoxidable trenzado recubierto de PFA (7 hilos, 0.0055" de diámetro) (consulte la Tabla de materiales). Para los músculos de la parte superior del brazo, corte cada alambre de 9,5 cm de largo. Para los músculos de la parte inferior del brazo, corte cada alambre de 10,5 cm de largo.
- Ate los dos cables con un solo nudo, esto se convertirá en el nudo que se encuentra justo fuera del sitio de inserción (nudo proximal) cuando se implante. Los cables atados comprenden un par de electrodos.
- Con una aguja de 18 G insertada en un trozo de cartón ondulado, coloque el nudo a 6 cm del extremo de inserción y apriételo alrededor de la aguja tirando de las hebras de electrodos contra el cartón. El extremo de inserción se encogerá a unos 5,5 cm, con los 0,5 cm restantes atados en el nudo.
- Retire con cuidado la aguja y apriete el nudo con las manos desnudas dos veces para apretar más.
NOTA: El nudo no debe estar lo más apretado posible; El apriete de esta manera dará como resultado un nudo proximal que tiene el tamaño correcto para anclar los electrodos implantados en el tejido. - Para los músculos de la parte superior del brazo, asegúrese de que los extremos del conector tengan 3,5 cm de largo. Para los músculos de la parte inferior del brazo, asegúrese de que los extremos del conector tengan 4,5 cm de largo.
- Pele 0,5 mm de aislamiento de cada cable: 1-1,5 mm del nudo de un cable y 2-2,5 mm del nudo del otro cable. La Figura 1 ilustra dónde pelar cada cable.
- Tape el electrodo tenso contra un trozo de cartón plano con los dos cables del extremo del conector juntos y los cables del extremo de inserción separados.
- Con un bisturí, haga muescas en el aislamiento, marcando los extremos donde se quitará el aislamiento.
- En cada muesca, haz una serie de ~6 cortes con una hoja de bisturí en cada muesca: ~2 en la parte superior, ~2 en el lateral y ~2 debajo del alambre.
NOTA: Es fundamental evitar cortar demasiado el cable. De lo contrario, las hebras pueden romperse. Se requiere práctica para lograr la cantidad adecuada de presión para cortar el aislamiento por completo con un daño limitado al cable. - Gire el par de electrodos 180 grados y repita los 6 cortes en cada muesca.
- Coloque cortes adicionales según sea necesario para separar los 0,5 mm de aislamiento del cable subyacente. El número de cortes necesarios aquí dependerá de la presión aplicada y del filo de la hoja del bisturí.
- Incline la hoja del bisturí para cortar a lo largo del aislamiento aflojado a lo largo y retírelo del cable con pinzas.
- Inspeccione el cable expuesto en busca de roturas y/o aislamiento deshilachado que pueda causar daños durante la inserción en el tejido.
- Pele 1 mm del extremo de cada cable en el extremo del conector.
- Pele 5 mm del extremo de cada cable en el extremo de inserción.
- Retuerza los segmentos del cable del extremo de inserción y engarce los extremos expuestos de 5 mm juntos en el eje de una tubería de 0,5 pulgadas. Aguja de 27 G. Las agujas hipodérmicas típicas se pueden usar después de quitar el extremo de bloqueo luer.
- Repita los pasos 1.1-1.6 para cada par de electrodos.
- Ensamble el conector.
- Corte el extremo hembra del conector de 12 pines (consulte la Tabla de materiales) al tamaño: # pares de electrodos x ranuras de 2 pines.
- Retire los accesorios de latón de cada puerto del conector (estos vienen preconectados al conector de 12 pines) suavemente con unos alicates. Guarde estos accesorios para el siguiente paso.
- Suelde cada extremo expuesto de 1 mm de cada cable a la superficie exterior de una de las cuchillas de un accesorio de latón.
PRECAUCIÓN: La soldadura libera humos que pueden causar irritación de la piel, los ojos y las vías respiratorias. Use guantes (o lávese las manos después), use protección para los ojos y use un dispositivo local de extracción de humos para limitar la exposición.- Asegure el accesorio de latón en una pinza de cocodrilo sin dientes unida a una herramienta manual de ayuda con la superficie exterior de una de sus hojas hacia arriba.
- Coloque el accesorio debajo del microscopio para permitir un alto control visual durante la soldadura. Con un clip desplegado o un trozo de alambre de desecho, aplique una pequeña cantidad de fundente compatible con acero inoxidable en la superficie de la hoja.
- Aplique suficiente soldadura a la cuchilla para cubrir la parte inferior de ~ 1,5 mm de la hoja de latón con una punta de soldadura cónica estrecha.
NOTA: Demasiada soldadura aquí interferirá con el ensamblaje del conector, mientras que muy poca soldadura podría dejar una conexión inadecuada. Tenga accesorios de latón adicionales disponibles para comenzar de nuevo si es necesario. - Cubra generosamente la superficie de la soldadura en la hoja con fundente compatible con acero inoxidable, pero evite que el fundente gotee en el espacio entre las dos cuchillas.
- Sostenga el cable de electrodo expuesto de 1 mm al ras de la soldadura en la cuchilla y caliente la soldadura con la plancha para fusionar la conexión.
- Inspeccione la conexión: la mayor parte del cable expuesto debe sumergirse en la soldadura y el cable debe estar firmemente unido al accesorio de latón. Asegúrese de que no haya terminado ninguna soldadura entre las dos cuchillas del accesorio de latón, ya que esto podría dificultar la inserción de un conector macho más adelante. Por último, asegúrese de que la conexión quede al ras con la hoja de latón para permitir que el accesorio se vuelva a insertar en el conector en el siguiente paso.
- Con pinzas rectas, vuelva a insertar cada accesorio de latón soldado en el conector, asegurándose de que los cables de cada par de electrodos sean adyacentes entre sí y no se enreden con otros pares de electrodos. Consulte la Figura 1B para visualizar la orientación de un solo par de electrodos en el conector.
NOTA: La orientación ideal de izquierda a derecha es: bíceps (3,5 mm en el extremo del conector), tríceps (3,5 mm en el extremo del conector), extensor radial del carpo (ECR; 4,5 mm en el extremo del conector) y palmar largo (PL; 4,5 mm en el extremo del conector). Marque un lado con un marcador o un blanco para realizar un seguimiento de la orientación del conector durante la implantación. - Corte un conector macho de 12 pines del mismo tamaño (# pares de electrodos x 2) que el extremo hembra y conéctelo al conector hembra. Si los accesorios están desplazados, se pueden volver a insertar con pinzas rectas después de que el conector macho esté asentado.
- Retire las lengüetas que emanan de los accesorios de latón con unos alicates.
- Cubra las ranuras de las clavijas con epoxi, asegurándose de que todo el metal o el cable cerca del conector estén aislados del pañuelo.
PRECAUCIÓN: El epoxi puede causar irritación de la piel, los ojos y las vías respiratorias con una exposición prolongada. Use guantes, protección para los ojos y solo use epoxi en un área bien ventilada o debajo de un dispositivo local de extracción de humos. - Deje que el conector se seque al aire durante al menos 30 minutos.
- Pruebe la resistencia de cada par de electrodos y etiquete las agujas con pequeños segmentos coloreados de termorretráctil para una fácil identificación durante la cirugía.
NOTA: La resistencia debe estar entre 18 y 50 ohmios. Una resistencia más baja puede indicar una posición corta. Una resistencia más alta puede indicar demasiado daño a los hilos de alambre. Sin embargo, la alta resistencia a menudo se deriva de una conexión imperfecta entre el eje de la aguja y el alambre (realizada en el paso 1.6), que se puede resolver mediante un engarzado adicional en esta unión. - Asegúrese de que el juego de electrodos esté libre de fibras y otros residuos antes de la implantación. Para ello se puede utilizar un pulverizador en spray. La inspección bajo el microscopio puede ser útil para verificar.
2. Cirugía de implantación de electrodos
NOTA: Esta sección describe un solo procedimiento quirúrgico para implantar una placa de cabeza y electrodos fabricados en la sección anterior en el tríceps, bíceps, extensor radial del carpo (ECR) y palmar largo (PL). Para los dos últimos músculos, es muy difícil implantar el electrodo exclusivamente en estos músculos individuales sin pasar por los músculos sinérgicos cercanos. Consulte la discusión a continuación sobre las advertencias de intentar aislar las grabaciones de los músculos individuales. Las placas frontales suelen diseñarse y fabricarse a medida para experimentos específicos. En el presente estudio se utilizaron placas de cabeza de remaches de plástico impresas en3D 19. Muchos diseños de diademas de código abierto están disponibles en línea a través de Janelia, el Instituto Allen y grupos de investigación independientes. El procedimiento de la placa de cabeza descrito aquí se ha utilizado con éxito con placas de cabeza de titanio y plástico. El procedimiento quirúrgico debe realizarse en un instrumento estereotáxico (ver Tabla de Materiales) con un microscopio estereoscópico que oscila entre 10 y 40 aumentos.
- Esterilizar en frío los electrodos y la placa frontal con glutaraldehído al 1,5% durante la noche o durante 8 h. Enjuague brevemente con agua estéril y deje que se seque completamente al aire antes de implantar.
PRECAUCIÓN: El glutaraldehído es dañino si se ingiere y puede causar irritación en los ojos, la piel y las vías respiratorias. Mango con guantes en una campana extractora ventilada. - Inducir la anestesia con isoflurano al 2-4% en oxígeno de grado médico en una cámara de inducción hasta la pérdida del reflejo de enderezamiento (aproximadamente 3 min) siguiendo los protocolos aprobados institucionalmente.
- Transfiera al animal al cono móvil de la nariz para continuar recibiendo la anestesia. Bajo anestesia con isoflurano al 2% en oxígeno de grado médico, afeitar la cabeza, el cuello y las extremidades del animal antes de la cirugía. Realice todos los pasos restantes de esta sección bajo anestesia. Ajuste la dosis de isoflurano según sea necesario para mantener una frecuencia respiratoria de 1 Hz y la ausencia de un reflejo de pellizco en los dedos de los pies.
- Aplique lubricante para los ojos y vuelva a aplicar cada 1 h durante toda la cirugía.
- Administrar analgésicos inyectables (por ejemplo, carprofeno, 5 mg/kg) y antibióticos por vía subcutánea (por ejemplo, enrofloxacino, 10 mg/kg) (ver Tabla de materiales) al comienzo de la cirugía.
- Implante la placa de cabeza siguiendo los siguientes pasos o un método alternativo aprobado por la institución.
- Asegure la cabeza del animal en las barras de los oídos del instrumento estereotáxico y administre anestesia (isoflurano al 2%) a través del cono de la nariz conectado al instrumento estereotáxico. Agregue un paño estéril para mantener la asepsia.
- Limpie la cabeza y el cuello con almohadillas de preparación de povidona yodada y almohadillas de preparación estériles con alcohol.
Vuelva a aplicar el lubricante para ojos si es necesario. - Inyecte lidocaína (4 mg/kg) (ver Tabla de Materiales) por vía subcutánea en el sitio de la incisión.
- Asegurar una adecuada inducción anestésica realizando un pinzamiento en el dedo del pie. Si el reflejo de enderezamiento está ausente, haga una incisión en la línea media de la cabeza del animal desde el borde caudal de los ojos hasta el borde caudal de las orejas.
- Sujene la piel con pinzas de tejido: dos en el borde rostral a cada lado, justo detrás de los ojos, y dos en el borde caudal, justo detrás de las orejas.
- Limpie la superficie del cráneo raspando suavemente con una hoja de bisturí para eliminar la fascia seca.
- Aplique una capa delgada de cemento dental (ver Tabla de Materiales) en la superficie del cráneo y deje que se seque durante 5 min.
- Coloque la placa de la cabeza en el cráneo del animal. La forma y el lugar donde se implanta la placa para la cabeza variarán según la placa para la cabeza y la pregunta de investigación.
- Use cemento dental para adherir la placa de la cabeza al cráneo. Asegúrese de que el cráneo esté completamente cubierto. Deje que el cemento dental se seque durante 10 minutos.
- Transfiera al animal a un cono de plástico móvil para la nariz para proporcionar anestesia durante el resto de la cirugía; Esto permitirá el reposicionamiento del animal regularmente durante la cirugía para acceder a diferentes músculos mientras se mantiene la anestesia.
- Extienda la incisión en la parte posterior del cuello (realizada durante la implantación de la placa cefálica) hasta que llegue 1 cm caudal a las orejas.
- Con un raspador de hueso romo, separe la piel debajo de la incisión en el cuello del tejido subyacente para despejar el camino desde la incisión en el cuello hasta la extremidad anterior, donde se implantarán los electrodos.
- Asegure el conector EMG a la placa principal temporalmente con un pequeño trozo de cinta adhesiva para mantenerlo en su lugar durante la implantación del electrodo.
- Limpie la extremidad delantera del animal con almohadillas de preparación de povidona yodada y almohadillas de preparación estériles con alcohol.
- Haz la incisión del tríceps.
- Coloque al animal de lado con los tríceps hacia arriba.
- Inyecte lidocaína (4 mg/kg) en el sitio planeado de la incisión. Esto aliviará el dolor local y mantendrá los músculos húmedos durante la implantación.
NOTA: Los músculos deben permanecer húmedos pero no mojados durante toda la cirugía. Aplique solución salina estéril por vía tópica, según sea necesario, si los músculos o la piel parecen secos. - Corta 7 mm sobre el tríceps paralelo al hueso.
- Separe la piel que rodea la incisión del tejido subyacente con el raspador de hueso romo. Pase el raspador debajo de la piel y de regreso a la incisión en el cuello para despejar el camino para los electrodos.
- Recorta cualquier fascia que oscurezca el músculo.
- Asegúrese de que el camino desde el cuello hasta el tríceps sea lo suficientemente grande insertando unas tijeras cerradas a través de la incisión del tríceps y empujando hacia afuera el orificio del cuello, abriéndose ligeramente después de salir del orificio.
- Lleve el electrodo de tríceps a la incisión del tríceps: Inserte la punta del destornillador de aguja grande a través de la incisión del tríceps y fuera de la incisión del cuello. Sujete el destornillador de la aguja alrededor de la aguja del electrodo a lo largo y tire a través de ella hasta la incisión del tríceps.
- Inserción de tríceps: Siga el paso 3 "inserción de electrodos en los músculos".
- Hacer la incisión distal del brazo.
- Coloque al animal boca arriba.
- Pega el brazo a lo largo del costado del animal con la palma hacia abajo.
- Inyecte lidocaína (4 mg/kg) en el sitio planeado de la incisión.
- Realice una incisión de 1 cm por encima del bíceps y ECR desde la parte inferior del deltoides hasta la mitad de la parte inferior del brazo, paralela al hueso. El extremo distal de la incisión debe estar ~2 mm por encima del extremo de los músculos de la parte inferior del brazo.
- Despeja la fascia para exponer el músculo bíceps.
- Despeje el camino desde la incisión distal del brazo hasta la incisión del tríceps por encima (proximal a) el vaso sanguíneo grande que corre por debajo de la piel de la parte superior del brazo.
- Pase el electrodo de bíceps por debajo de la piel a través de la incisión del cuello hasta la incisión del tríceps, luego desde la incisión del tríceps hasta la incisión distal del brazo.
- Inserción de bíceps: Siga el paso 3 "inserción de electrodos en los músculos".
- Vuelva a pegar el brazo del animal en la misma posición pero con la palma hacia abajo.
- Insértelo lo más cerca posible del extremo proximal del bíceps expuesto.
- Para sumergir al menos 3 mm del electrodo en el tejido muscular, asegúrese de insertarlo ligeramente en diagonal a las fibras musculares según el tamaño del ratón.
- Despeje un camino desde la incisión del tríceps hasta el sitio de inserción del brazo distal por debajo (distal a) el vaso sanguíneo grande que corre debajo de la piel de la parte superior del brazo, creando un camino distinto al del electrodo del bíceps.
- Inserción de ECR: Siga el paso 3 "inserción de electrodos en los músculos".
- Insértelo en la parte más proximal de la ECR.
- Salga en el pliegue entre ECR y su antagonista y haga el nudo en este pliegue.
- Despeje un camino desde la inserción del tríceps hasta el sitio de inserción del PL debajo del codo.
- Inserción de PL: Siga el paso 3 "inserción de electrodos en los músculos".
- Coloque al animal boca arriba y pegue su brazo sobre su cabeza con la palma hacia arriba.
- Insértelo justo distal al codo.
- Salida lo suficientemente proximal a los tendones de la muñeca para que el nudo en el sitio de salida quede en el músculo y no en los tendones de la muñeca.
- Recoloque al animal de costado y sutura la incisión del tríceps con suturas de seda 6-0.
- Recoloque al animal boca arriba y sutura la incisión distal del brazo con suturas de seda 6-0.
- Fije el conector a la parte posterior de la placa principal con cemento dental.
- Suturar la incisión del cuello con suturas de seda 6-0.
- Aplique crema antibiótica tópica en los sitios de incisión para reducir la inflamación.
- Coloque un collar isabelino (ver Tabla de Materiales) en el animal para evitar que altere las suturas durante la recuperación.
3. Inserción de electrodos en los músculos
- Curve ligeramente la aguja (27 G, paso 1) doblándola.
- Sostenga la aguja con el destornillador de agujas (consulte la Tabla de materiales) y presiónela contra el mango de un par de pinzas para agregar una curva de 5 a 10 grados.
- Agregue tres curvas en total en diferentes posiciones a lo largo de la longitud de la aguja.
- Visualiza por dónde entrar y salir del músculo.
- Retire la grasa y la fascia que oscurecen el sitio de entrada y salida cortando o tirando con pinzas finas. Trate de evitar el daño vascular para limitar el sangrado.
- Apunta a 3-5 mm de alambre sumergido que corra paralelo a las fibras musculares. Esto asegurará que los tramos expuestos del alambre del electrodo se sumerjan dentro del músculo.
- Con el destornillador de agujas, inserte la aguja en el extremo proximal del músculo mientras aplica contrapresión con pinzas curvas romas en la otra mano. Empuje la aguja a través del músculo hasta el sitio de salida.
- Una vez que la aguja salga del músculo, agarre la punta con pinzas romas y tire de la aguja a través de ella. Siga tirando hasta que el nudo proximal se asiente sobre el sitio de inserción.
- Haz el nudo distal.
- Con fórceps, haga un nudo suelto distal al sitio de salida. Aprieta el nudo hasta formar un lazo de 1 cm.
- Empuje el asa con pinzas y colóquelo sobre el sitio de salida.
- Visualice dónde se debe cerrar el nudo distal antes de que se apriete por completo, aproximadamente 0,5 mm distal al sitio de salida. Sujete suavemente el lazo con las pinzas dobladas finamente en esta posición y tire del lazo con fuerza sobre las pinzas.
NOTA: No apriete el nudo distal inmediatamente sobre el sitio de salida en este paso, o el músculo se apretará cuando el nudo esté completamente apretado en el siguiente paso. - Retire las pinzas finas del nudo y termine de apretar el nudo empujando el nudo hacia el sitio de salida con las pinzas dobladas finas y tirando del extremo de la aguja con los dedos. Asegúrese de que los nudos proximal y distal estén colocados correctamente fuera de los sitios de inserción y salida, respectivamente, para anclar el electrodo insertado en su lugar.
- Sujete el nudo de salida con pinzas rectas y finas y enrolle firmemente el alambre distal alrededor de las pinzas para doblar el alambre alrededor del nudo y hacia el músculo / lejos de la piel.
- Corta el alambre 0,5 mm distal al nudo distal, dejando una pequeña protuberancia enroscada alrededor del nudo.
El paso anterior asegura que el extremo cortado de la protuberancia no se adentrará en la piel del animal, lo que puede causar irritación.
4. Cuidados postoperatorios
- Inmediatamente después de la cirugía, realice los siguientes pasos.
- Aloje al animal individualmente para que sus compañeros de jaula no alteren sus suturas.
- Coloque al animal en una jaula limpia con ropa de cama baja. Retire cualquier nido y material de enriquecimiento que pueda interferir con la movilidad del animal mientras usa el collar isabelino.
- Dele al animal agua y comida húmeda a la que pueda acceder mientras usa el collar.
- Realice los siguientes pasos 24 h y 48 h después de la cirugía.
- Retire el collar isabelino para permitir que el animal se acicale durante 20 minutos.
- Inducir la anestesia con isoflurano, como se menciona en los pasos 2.2 y 2.3.
- Administrar medicamentos inyectables, analgésicos y antibióticos.
- Inspeccione los sitios de incisión en busca de suturas faltantes, heridas abiertas y signos de infección o irritación. Reemplace las suturas y aplique más antibióticos tópicos si es necesario.
- Reemplace la comida húmeda cada 48 h hasta que se retire el collar isabelino.
- Realice los siguientes pasos 6 días después de la cirugía.
- Revise las heridas para ver si están completamente curadas.
- Si las heridas están cerradas, retire las suturas. Si las heridas están abiertas, espere dos días más para retirar las suturas. Retire el collar isabelino cuando se retiren las suturas.
- Regrese el ratón a una jaula nueva y limpia con ropa de cama completa y enriquecimiento.
NOTA: Los animales pueden proceder a la experimentación o a la privación de agua 7 días después de la cirugía.
Resultados
Las figuras 2, 3 y 4 muestran la actividad muscular normalizada registrada de los músculos de las extremidades anteriores de ratones que realizan diferentes comportamientos: caminar en cinta sin fijación de la cabeza (Figura 2), trepar por una rueda giratoria con fijación de la cabeza (Figura 3) y alcanzar gotas de agua con fijación de la cabeza (Figura 4). La Figura 2 muestra 1,5 s de locomoción en cinta rodante con un ciclo de pasos aproximado estimado a partir del tiempo entre dos activaciones de flexores del codo. La Figura 3 muestra 5 s de datos de EMG de un animal al que el electrodo extensor de la muñeca falló 6 semanas después de la implantación. En la Figura 3A, los cuatro electrodos producen una señal EMG limpia que se alinea con el giro de la rueda (lo que indica escalada). La Figura 3B muestra la señal de los mismos electrodos después de una falla: el electrodo extensor de la muñeca produce una señal ruidosa que no cambia con el movimiento del animal. La Figura 4 muestra 1 s de EMG de los cuatro grupos musculares de las extremidades anteriores durante una tarea en la que el ratón pasó de la inmovilidad a alcanzar una gota de agua.
En la Figura 2, Figura 3 y Figura 4, las señales de voltaje se amplificaron y se filtraron de paso de banda (250-20,000 Hz) utilizando un amplificador diferencial. A continuación, se submuestreó el voltaje bruto a 1 kHz y se puntuó z para compararlo entre los conjuntos de datos. Nótese de nuevo que, aunque se implantaron electrodos en los cuatro músculos especificados en el protocolo (bíceps, tríceps, ECR y PL), no se garantiza que los músculos sinérgicos adyacentes no influyeran en la señal EMG; Por lo tanto, cada grabación se asigna a su grupo de sinergia (flexor del codo, etc.) para mayor precisión. La verificación de registros aislados de músculos individuales requeriría registros simultáneos en múltiples sinergistas para analizar la diafonía entre las grabaciones musculares, lo que puede ser prohibitivamente difícil, especialmente en la parte inferior del brazo de los ratones.
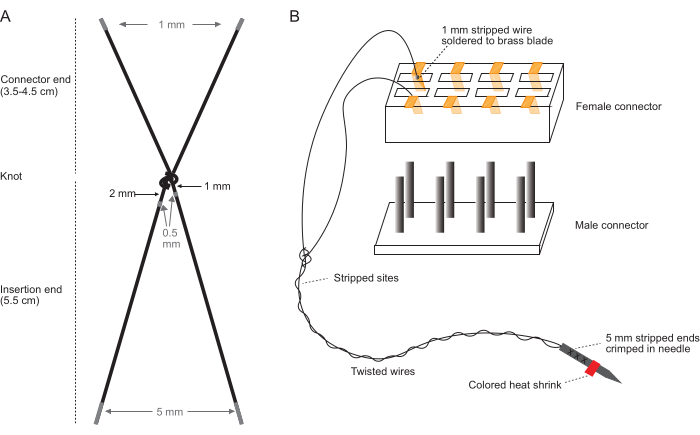
Figura 1: Esquemas de la fabricación del juego de electrodos. (A) Diagrama de un solo par de electrodos. Las áreas grises indican dónde tirar. (B) Diagrama del conjunto del conector con un solo par de electrodos completo insertado en el conector. El diagrama de (B) no está a escala. Haga clic aquí para ver una versión más grande de esta figura.
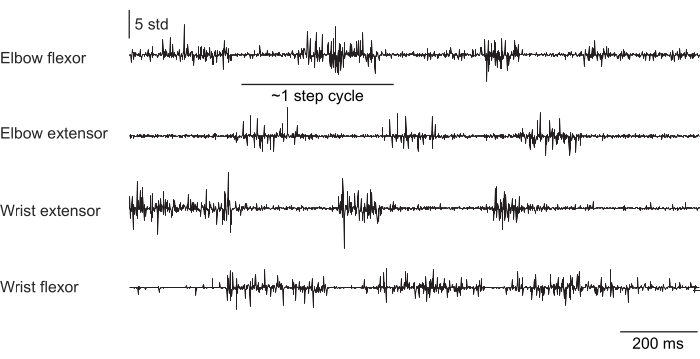
Figura 2: Registro representativo de EMG de cuatro músculos de un ratón que se mueve libremente (no con la cabeza fija) caminando en una cinta de correr. La duración total es de 1,5 s. El ciclo escalonado se estimó a partir del tiempo entre activaciones secuenciales de los extensores del codo. Haga clic aquí para ver una versión más grande de esta figura.
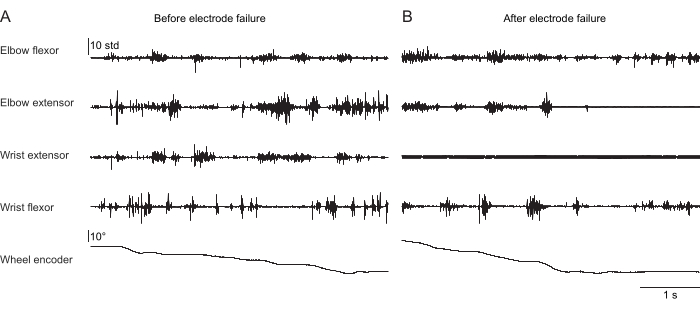
Figura 3: Grabación representativa de EMG de cuatro músculos de un ratón con la cabeza fija realizando un comportamiento de escalada naturalista. La5ª fila muestra la posición de la rueda trepadora leída por un codificador rotativo; Los cambios en este valor indican que la rueda está girando y el animal está trepando activamente. La duración total es de 5 s. (A) Grabación 36 días después de la implantación durante la escalada. (B) Registro 72 días después de la implantación en el mismo ratón después de que falló el electrodo extensor de la muñeca. Haga clic aquí para ver una versión más grande de esta figura.
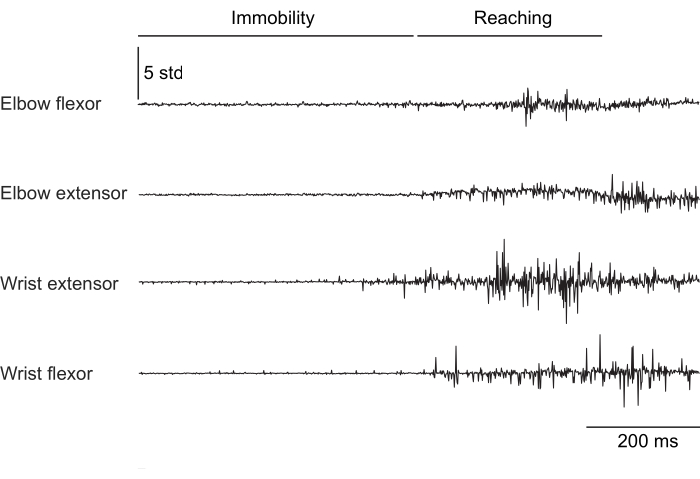
Figura 4: Registro representativo de EMG de cuatro músculos de un ratón con la cabeza fija en la transición de la inmovilidad a la realización de un movimiento de alcance. La duración total es de 1 s. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo permite registros estables de la actividad muscular de ratones con la cabeza fija que realizan una variedad de comportamientos durante varias semanas. Recientemente, este método se ha empleado para examinar el control neural de la musculatura de las extremidades durante comportamientos como la locomoción en la cinta rodante 18,20, una tarea de tracción del joystick18 y una tarea de co-contracción21. Si bien el protocolo descrito aquí es específico para los músculos del codo y la muñeca del ratón, se modifica fácilmente para registrar desde diferentes músculos o un número diferente de músculos cambiando la longitud y / o el número total de pares de electrodos. El método descrito aquí fue adaptado de los utilizados anteriormente para registrar la actividad muscular de las extremidades anteriores y posteriores en ratones sin reposacabezas 15,16,17.
La fabricación de electrodos requiere una práctica significativa para dominarla. Se recomienda la práctica diaria durante 1-2 h mientras se aprende. Pelar los electrodos es el paso más desafiante debido al nivel preciso de fuerza requerido para cortar el aislamiento sin dañar el cable subyacente. Este nivel de fuerza depende del afilado de la hoja, por lo que reemplazar con frecuencia la hoja del bisturí puede ayudar a garantizar la reproducibilidad durante el aprendizaje. Soldar los cables a las cuchillas de latón del conector también puede ser difícil porque el acero inoxidable no se suelda fácilmente. La aplicación de una cantidad generosa de fundente compatible con acero inoxidable ayuda a promover la conexión.
El principal reto durante la cirugía de implantación es atar el nudo distal sin alterar el alambre implantado o el nudo proximal. El nudo proximal debe ser lo suficientemente grande como para resistir el deslizamiento hacia el músculo en el sitio de inserción, por lo tanto, evite atar el nudo demasiado en el paso 2 de la fabricación del juego de electrodos. Si el nudo proximal migra después de la implantación, use pinzas con punta de fibra de carbono para reposicionarlo con cuidado. Apriete el nudo distal lentamente mientras mantiene un agarre firme del alambre con pinzas para evitar tirar de todo el electrodo. Este paso es fundamental para garantizar la longevidad de los electrodos implantados: demasiada tensión colocada sobre el electrodo puede hacer que se rompa cuando el animal se mueve, mientras que un electrodo suelto puede desplazarse durante la recuperación y perder contacto con su músculo asociado a medida que el tejido se cura.
Los animales se recuperan notablemente bien de la cirugía, aunque hay que tener en cuenta las posibles complicaciones. Primero, los ratones masticarán sus suturas y electrodos si se les da la oportunidad. Si bien el collar isabelino lo impide, también evita que el animal se acicale. Algunos ratones desarrollan una acumulación similar a la mucosidad alrededor de los ojos. Ocasionalmente, los ratones macho, particularmente los mayores, experimentan obstrucciones en la uretra que pueden ser angustiantes para el animal. Permitir que el animal se acicale durante 20 minutos cada día antes de inspeccionar las suturas debería darle al animal tiempo suficiente para prevenir estos problemas.
Hay que tener en cuenta las limitaciones importantes de este método. En primer lugar, estos electrodos personalizados generalmente no pueden resolver la actividad de una sola unidad de motor. Además, no se garantiza que la señal eléctrica emane exclusivamente de un músculo específico (es decir, bíceps), ya que es difícil descartar la diafonía de la actividad en los músculos sinérgicos cercanos. Por lo tanto, en las publicaciones, los investigadores comúnmente se refieren a los músculos registrados por su grupo de sinergia (es decir, flexor del codo). Se recomienda realizar disecciones post-mortem después de cada experimento para verificar la posición de cada electrodo, ya que podrían desplazarse en el tejido durante la recuperación.
Los investigadores interesados en la actividad de una sola unidad motora deberían considerar probar los electrodos EMG recientemente desarrollados por el Centro de Investigación Avanzada de Bioingeniería Motora (CAMBER) de la Universidad de Emory. Estos electrodos aún se están desarrollando, pero CAMBER proporcionará el último diseño de electrodos. El principal inconveniente de estos electrodos es la longevidad: los electrodos fabricados a mano descritos en este protocolo generalmente permiten grabaciones durante varias semanas, mientras que los electrodos CAMBER funcionan mejor para experimentos a corto plazo. Los investigadores que seleccionen un método de registro de EMG pueden ponerse en contacto directamente con CAMBER para determinar si sus electrodos serán adecuados para un experimento determinado.
Divulgaciones
Ninguno.
Agradecimientos
Los autores desean agradecer a la Dra. Claire Warriner por contribuir al desarrollo de este método. Mark Agrios y Sajishnu Savya ayudaron a preparar las figuras. Esta investigación fue apoyada por un premio Searle Scholar, una beca de investigación Sloan, una colaboración Simons en el premio Global Brain Pilot, una beca de investigación Whitehall, el Consorcio Biomédico de Chicago con el apoyo de los Fondos Searle en The Chicago Community Trust, la beca DP2 de los NIH NS120847 (A.M.) y la subvención 2T32MH067564 de los NIH (A.K.).
Materiales
| Name | Company | Catalog Number | Comments |
| #11 Scalpel Blades | World Precision Instruments | 504170 | For EMG electrode fabrication |
| #3 Scalpel Handle | Fine Science Tools | 10003-12 | For EMG electrode fabrication |
| 1 mL Sub-Q Syringe (100 pack) | Becton Dickinson | 309597 | For administering injectable drugs |
| 12-pin connector | Newark | 33AC2371 | 12-pin connector with brass fittings; for EMG electrode fabrication |
| 18 G Needles | Exel International | 26419 | For EMG electrode fabrication |
| 27 G Needles | Exel International | 26426 | For EMG electrode fabrication |
| 3 M Transpore Surgical Tape | 3M | 1527-0 | For taping animal's limbs out during surgery |
| 6-0 silk sutures | Henry Schein | 101-2636 | These sutures work well with delicate skin around the wrists |
| C&B Metabond Complete Kit | Pearson Dental | P16-0126 | Dental cement to affix connector to headplate |
| C57BL6/J Mice | Jackson Laboratories | #000664 | Wild type mice |
| Carbofib 5-CF Tweezers (2) | Aven tools | 18762 | Carbon fiber tipped forceps, used to manipulate delicate parts of electrode (stripped or inserted sections) |
| Carprodyl (Carprofen) 50 mg/mL Injection | Ceva Animal Health, LLC | G43010B | Injectable analgesic for pain management during and after surgery |
| Castroviejo Micro Needle Holder | Fine science tools | 12060-01 | For suturing |
| Castroviejo Needle Holder (large) | Fine science tools | 12565-14 | For inserting needle into muscle |
| Delicate Bone Scraper | Fine science tools | 10075-16 | To separate skin from underlying tissue |
| Dietgel 76A Dietary Supplement | Clear H2O | 72-07-5022 | For post-operative care |
| Dumont #5/45 Forceps | Fine science tools | 11251-35 | To remove fascia overlying muscle |
| Elizabethan collar for mouse | Kent Scientific Corporation | EC201V-10 | For post-operative care |
| Enrofloxacin 2.27% | Covetrus | #074743 | Injectable antibiotic for use during and after surgery |
| Epoxy gel | Devcon | 14265 | For EMG electrode fabrication |
| Hopkins Bulldog Clamp (4) | Stoelting | 10-000-481 | Tissue clamps for headplate implantation |
| Isoflurane Solution | Covetrus | 11695067771 | Inhalable anesthesia |
| Lidocaine Hydrochloride Injectable - 2% | Covetrus | #002468 | Topical analgesic for pain management during surgery |
| Medical Grade Oxygen | Airgas | OX USP200 | For administering isoflurane during surgery |
| MetriCide 1 Gallon | Metrex | 10-1400 | Glutaraldehyde solution for cold-sterilization of headplate and electrodes |
| MetriTest Strips 1.5% | Metrex | 10-303 | Test strips for monitoring glutaraldehyde solution (recommended) |
| Model 900LS Small Animal Stereotaxic Instrument | Kopf Instruments | 900LS | Stereotax with lazy susan feature that allows platform rotation during surgery |
| PFA-coated 0.0055" braided stainless steel wire | A-M systems | 793200 | For EMG electrode fabrication |
| Povidone-iodine prep pads | Dynarex | 1108 | For cleaning skin |
| Puralube Vet Ointment | Dechra | 37327 | Eye ointment for surgery |
| Sterile alcohol prep pads | Dynarex | 1113 | For cleaning skin |
| Straight fine #5 forceps | Fine science tools | 11295-10 | For curling wire after insertion |
| Straight fine scissors | Fine science tools | 14060-11 | For cutting wire |
| Student Vannas Spring Scissors | Fine science tools | 91500-09 | For making incisions, trimming fat and fascia, and suturing |
| Technik Tweezers 7B-SA (2) | Aven tools | 18074USA | Curved blunt forceps, for general use during surgery |
| Triple Antibiotic Ointment | Walgreens | 975863 | Topical antibiotic for surgery |
| V-1 Tabletop Laboratory Animal Anesthesia System | VetEquip | 901806 | Contains all necessary equipment for anesthesia induction and scavenging including vaporizer, induction chamber, moveable plastic nose cone, and tubing |
Referencias
- Dombeck, D. A., Khabbaz, A. N., Collman, F., Adelman, T. L., Tank, D. W. Imaging large scale neural activity with cellular resolution in awake mobile mice. Neuron. 56 (1), 43-57 (2007).
- Guo, Z. V., et al. Flow of cortical activity underlying a tactile decision in mice. Neuron. 81 (1), 179-194 (2014).
- Guo, J. Z., et al. Cortex commands the performance of skilled movement. eLife. 4, e10774 (2015).
- Morandell, K., Huber, D. The role of forelimb motor cortex areas in goal directed action in mice. Sci Rep. 7 (1), 15759 (2017).
- Galiñanes, G. L., Bonardi, C., Huber, D. Directional reaching for water as a cortex-dependent behavioral framework for mice. Cell Rep. 22 (10), 2767-2783 (2018).
- Evarts, E. V., Tanji, J. Reflex and intended responses in motor cortex pyramidal tract neurons of monkey. J Neurophysiol. 39 (5), 1069-1080 (1976).
- Hounsgaard, J., Hultborn, H., Jespersen, B., Kiehn, O. Bistability of alpha-motoneurones in the decerebrate cat and in the acute spinal cat after intravenous 5-hydroxytryptophan. J Physiol. 405, 345-367 (1988).
- Murphy, P. R., Hammond, G. R. The role of cutaneous afferents in the control of gamma-motoneurones during locomotion in the decerebrate cat. J Physiol. 434, 529-547 (1991).
- Manuel, M., Chardon, M., Tysseling, V., Heckman, C. J. Scaling of motor output, from mouse to humans. Physiol Bethesda Md. 34 (1), 5-13 (2019).
- Sauerbrei, B. A., et al. Cortical pattern generation during dexterous movement is input-driven. Nature. 577 (7790), 386-391 (2020).
- Barrett, J. M., Raineri Tapies, M. G., Shepherd, G. M. G. Manual dexterity of mice during food-handling involves the thumb and a set of fast basic movements. PLoS One. 15 (1), e0226774 (2020).
- Serradj, N., et al. Task-specific modulation of corticospinal neuron activity during motor learning in mice. Nat Commun. 14, 2708 (2023).
- Scholle, H. C., et al. Spatiotemporal surface EMG characteristics from rat triceps brachii muscle during treadmill locomotion indicate selective recruitment of functionally distinct muscle regions. Exp Brain Res. 138 (1), 26-36 (2001).
- Scholle, H. C., et al. Kinematic and electromyographic tools for characterizing movement disorders in mice. Mov Disord off J Mov Disord Soc. 25 (3), 265-274 (2010).
- Pearson, K. G., Acharya, H., Fouad, K. A new electrode configuration for recording electromyographic activity in behaving mice. J Neurosci Methods. 148 (1), 36-42 (2005).
- Akay, T., Acharya, H. J., Fouad, K., Pearson, K. G. Behavioral and electromyographic characterization of mice lacking EphA4 receptors. J Neurophysiol. 96 (2), 642-651 (2006).
- Akay, T., Tourtellotte, W. G., Arber, S., Jessell, T. M. Degradation of mouse locomotor pattern in the absence of proprioceptive sensory feedback. Proc Natl Acad Sci USA. 111 (47), 16877-16882 (2014).
- Miri, A., et al. Behaviorally selective engagement of short-latency effector pathways by motor cortex. Neuron. 95 (3), 683-696 (2017).
- Osborne, J., Dudman, J. RIVETS: A mechanical system for in vivo and in vitro electrophysiology and imaging. PloS One. 9 (2), e89007 (2014).
- Santuz, A., Laflamme, O. D., Akay, T. The brain integrates proprioceptive information to ensure robust locomotion. J Physiol. 600 (24), 5267-5294 (2022).
- Warriner, C. L., Fageiry, S., Saxena, S., Costa, R. M., Miri, A. Motor cortical influence relies on task-specific activity covariation. Cell Rep. 40, 111427 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados