Method Article
Registrazione dell'attività muscolare degli arti anteriori in topi fissati alla testa con elettrodi EMG impiantati cronicamente
In questo articolo
Riepilogo
Questo protocollo descrive la fabbricazione manuale e l'impianto chirurgico di elettrodi elettromiografici (EMG) nei muscoli degli arti anteriori dei topi per registrare l'attività muscolare durante gli esperimenti di comportamento fissato alla testa.
Abstract
I potenti strumenti genetici e molecolari disponibili nella ricerca neuroscientifica sui sistemi murini hanno permesso ai ricercatori di interrogare la funzione del sistema motorio con una precisione senza precedenti in topi con testa fissa che eseguono una varietà di compiti. Le piccole dimensioni del topo rendono difficile la misurazione della potenza motoria, poiché il metodo tradizionale di registrazione elettromiografica (EMG) dell'attività muscolare è stato progettato per animali più grandi come gatti e primati. In attesa della disponibilità in commercio di elettrodi EMG per topi, l'attuale metodo gold standard per la registrazione dell'attività muscolare nei topi consiste nel realizzare internamente set di elettrodi. Questo articolo descrive un perfezionamento delle procedure consolidate per la fabbricazione manuale di un set di elettrodi, l'impianto di elettrodi nello stesso intervento chirurgico dell'impianto della piastra di testa, il fissaggio di un connettore sulla piastra di testa e l'assistenza di recupero post-operatoria. Dopo il recupero, è possibile ottenere registrazioni EMG con risoluzione al millisecondo durante il comportamento di correzione della testa per diverse settimane senza cambiamenti evidenti nella qualità del segnale. Queste registrazioni consentono una misurazione precisa dell'attività muscolare degli arti anteriori insieme alla registrazione neurale in vivo e/o alla perturbazione per sondare i meccanismi di controllo motorio nei topi.
Introduzione
Negli ultimi decenni, i topi sono diventati un attraente organismo modello per lo studio del sistema motorio dei mammiferi. Gli approcci sperimentali comuni coinvolgono topi con testa fissa che eseguono compiti motori insieme al monitoraggio e/o alla perturbazione dell'attività neurale 1,2,3,4,5. Gli studi sul sistema motorio in specie più grandi (come gatti e primati) si sono tradizionalmente basati sull'elettromiografia (EMG) per misurare direttamente la potenza motoria durante tali esperimenti 6,7,8. Tuttavia, la registrazione dell'attività muscolare nei topi è difficile perché la loro muscolatura è troppo piccola per gli elettrodi EMG disponibili in commercio utilizzati negli esperimenti sui grandi mammiferi9. Molti ricercatori scelgono di tracciare la cinematica degli arti attraverso i video 4,10,11 e/o le prestazioni comportamentali 2,4,12 per sondare indirettamente l'output motorio, ma questi metodi non hanno la risoluzione per rilevare l'influenza su scala temporale dei millisecondi dell'attività neurale e della sua perturbazione sui muscoli. Pertanto, la registrazione dell'EMG è auspicabile per i ricercatori interessati al controllo neurale diretto dei muscoli.
L'EMG comporta la misurazione della tensione tra due punti, tipicamente separati da una breve distanza approssimativamente parallela alle fibre del muscolo da registrare. Gli elettrodi EMG sono disponibili in varietà di superficie (o "cerotto") e intramuscolari (o "ago"). Gli elettrodi di superficie vengono posizionati sulla pelle o sovrapposti al tessuto muscolare e fissati con adesivo o sutura. Pertanto, gli elettrodi di superficie sono meno invasivi degli elettrodi intramuscolari e sono più popolari tra gli esseri umani, i gatti e i primati grazie alla loro relativa facilità d'uso. Gli elettrodi di superficie sono stati utilizzati con successo anche con ratti e topi13,14; Tuttavia, devono essere fabbricati a mano e impiantati chirurgicamente sotto la pelle a causa della tendenza dei roditori a cercare di rimuovere oggetti estranei durante la toelettatura. Gli elettrodi EMG intramuscolari, d'altra parte, vengono impiantati chirurgicamente all'interno del tessuto muscolare. Poiché sono inghiottiti dal tessuto muscolare, forniscono un'elevata risoluzione spaziale e rimangono fissi in posizione a tempo indeterminato. Pertanto, gli elettrodi EMG intramuscolari impiantati sono ideali su elettrodi di superficie per esperimenti a lungo termine con roditori. Per registrare in modo affidabile l'EMG intramuscolare nei topi, i ricercatori hanno sviluppato un metodo per fabbricare e impiantare a mano elettrodi EMG in muscoli piccoli come quelli dell'avambraccio di un topo adulto. Questi elettrodi consentono la registrazione muscolare cronica durante il comportamento motorio nei roditori per diverse settimane.
Il protocollo qui descritto è il risultato di un perfezionamento decennale dei metodi consolidati 15,16,17,18, che ha prodotto una procedura per la fabbricazione, l'impianto e la registrazione a mano da elettrodi EMG a filo impiantati cronicamente in coppie muscolari flessori/estensori del gomito e del polso in topi comportamentali. La prima sezione descrive la fabbricazione manuale di un set di elettrodi con quattro coppie di elettrodi e un connettore a 8 pin per l'interfaccia dello stadio principale. La sezione successiva descrive in dettaglio l'impianto chirurgico degli elettrodi per via intramuscolare nei muscoli della parte superiore e inferiore del braccio nello stesso intervento chirurgico dell'impianto della placca. Infine, vengono discusse registrazioni rappresentative di topi che eseguono una varietà di comportamenti. Nel complesso, questo metodo è un modo economico e personalizzabile per includere le misurazioni dell'attività muscolare in esperimenti di comportamento fissato alla testa, ideale per i laboratori con una certa esperienza nella fabbricazione di elettrodi.
Protocollo
Tutti gli esperimenti e le procedure sono stati eseguiti secondo le linee guida NIH e approvati dal Comitato istituzionale per la cura e l'uso degli animali della Northwestern University. Altri paesi e/o istituzioni possono avere normative diverse che richiedono modifiche a questa procedura. Gli animali inclusi nel presente studio erano maschi adulti C57BL6/J (vedi Tabella dei materiali) di età compresa tra 12 e 20 settimane con un peso corporeo minimo di 20 g.
1. Fabbricazione di set di elettrodi
NOTA: Eseguire questi passaggi su un piano di lavoro pulito utilizzando uno stereomicroscopio con un intervallo di ingrandimento compreso tra 10x e 40x e mani nude pulite. Vedere la Figura 1 per gli schemi che descrivono in dettaglio la spelatura del filo dell'elettrodo (Figura 1A) e l'assemblaggio del connettore (Figura 1B).
- Tagliare i fili: per ogni coppia di elettrodi, tagliare due pezzi di filo intrecciato in acciaio inossidabile rivestito in PFA (7 fili, diametro 0,0055") (vedere la tabella dei materiali). Per i muscoli della parte superiore del braccio, tagliare ogni filo lungo 9,5 cm. Per i muscoli della parte inferiore del braccio, tagliare ogni filo lungo 10,5 cm.
- Legare i due fili insieme con un unico nodo: questo diventerà il nodo che si trova appena fuori dal sito di inserimento (nodo prossimale) quando viene impiantato. I fili legati comprendono una coppia di elettrodi.
- Utilizzando un ago da 18 G inserito in un pezzo di cartone ondulato, posizionare il nodo a 6 cm dall'estremità di inserimento e stringere attorno all'ago tirando i fili dell'elettrodo contro il cartone. L'estremità di inserimento si restringerà a circa 5,5 cm, con i restanti 0,5 cm legati nel nodo.
- Rimuovere con cautela l'ago e stringere il nodo a mani nude due volte per stringere ulteriormente.
NOTA: Il nodo non deve essere il più stretto possibile; Stringendo in questo modo si otterrà un nodo prossimale della dimensione corretta per ancorare gli elettrodi impiantati nel tessuto. - Per i muscoli della parte superiore del braccio, assicurarsi che le estremità del connettore siano lunghe 3,5 cm. Per i muscoli della parte inferiore del braccio, assicurarsi che le estremità del connettore siano lunghe 4,5 cm.
- Spelare 0,5 mm di isolamento da ciascun filo: 1-1,5 mm dal nodo su un filo e 2-2,5 mm dal nodo sull'altro filo. La Figura 1 illustra dove spelare ciascun filo.
- Fissare l'elettrodo con del nastro adesivo contro un pezzo di cartone piatto con i due fili terminali del connettore uniti e i fili terminali di inserimento divaricati.
- Usando un bisturi, fai delle scalfitture nell'isolamento, segnando le estremità in cui verrà rimosso l'isolamento.
- Ad ogni scalfittura, fai una serie di ~6 tagli con una lama di bisturi ad ogni scalfittura: ~2 sopra, ~2 di lato e ~2 sotto il filo.
NOTA: È fondamentale evitare di tagliare troppo il filo stesso. In caso contrario, i fili potrebbero rompersi. È necessaria la pratica per ottenere la quantità di pressione appropriata per tagliare completamente l'isolamento con danni limitati al filo. - Ruotare la coppia di elettrodi di 180 gradi e ripetere i 6 tagli in ogni tacca.
- Effettuare ulteriori tagli secondo necessità per separare gli 0,5 mm di isolamento dal filo sottostante. Il numero di tagli necessari qui dipenderà dalla pressione applicata e dall'affilatura della lama del bisturi.
- Inclinare la lama del bisturi per tagliare longitudinalmente l'isolamento allentato e rimuoverlo dal filo con una pinza.
- Ispezionare il filo esposto per verificare la presenza di rotture e/o sfilacciamenti che potrebbero causare danni durante l'inserimento nel tessuto.
- Spellare 1 mm dall'estremità di ciascun filo all'estremità del connettore.
- Spellare 5 mm dall'estremità di ciascun filo all'estremità di inserimento.
- Attorcigliare insieme i segmenti del filo dell'estremità di inserimento e crimpare insieme le estremità esposte da 5 mm nell'albero di un cavo da 0.5 pollici. Ferri da 27 g. I tipici aghi ipodermici possono essere utilizzati dopo aver rimosso l'estremità del luer lock.
- Ripetere i passaggi 1.1-1.6 per ogni coppia di elettrodi.
- Assemblare il connettore.
- Tagliare l'estremità femmina del connettore a 12 pin (vedere la tabella dei materiali) fino alla dimensione: # coppie di elettrodi x 2 fessure per pin.
- Rimuovere delicatamente i raccordi in ottone da ciascuna porta del connettore (questi sono precollegati al connettore a 12 pin) con una pinza. Conservare questi raccordi per il passaggio successivo.
- Saldare ogni estremità esposta di 1 mm di ciascun filo alla superficie esterna di una delle lame di un raccordo in ottone.
ATTENZIONE: La saldatura rilascia fumi che possono causare irritazione alla pelle, agli occhi e alle vie respiratorie. Indossare guanti (o lavarsi le mani dopo), utilizzare una protezione per gli occhi e utilizzare un dispositivo di estrazione dei fumi locale per limitare l'esposizione.- Fissare il raccordo in ottone con una clip a coccodrillo sdentata fissata a uno strumento manuale di aiuto con la superficie esterna di una delle sue lame rivolta verso l'alto.
- Posizionare il raccordo sotto il microscopio per consentire un elevato controllo visivo durante la saldatura. Utilizzando una graffetta aperta o un pezzo di filo di scarto, tamponare una piccola quantità di fondente compatibile con acciaio inossidabile sulla superficie della lama.
- Applicare una quantità di saldatura sufficiente alla lama per coprire la parte inferiore di ~1,5 mm della lama in ottone utilizzando una punta di saldatura conica stretta.
NOTA: Troppa saldatura qui interferirà con l'assemblaggio del connettore, mentre troppo poca saldatura potrebbe lasciare una connessione inadeguata. Avere a disposizione raccordi in ottone extra per ricominciare da capo, se necessario. - Rivestire abbondantemente la superficie della saldatura sulla lama con un disossidante compatibile con l'acciaio inossidabile, ma evitare che il disossidante goccioli nello spazio tra le due lame.
- Tenere il filo dell'elettrodo esposto da 1 mm a filo contro la saldatura sulla lama e riscaldare la saldatura con il ferro per fondere la connessione.
- Ispezionare la connessione: la maggior parte del filo esposto deve essere immersa nella saldatura e il filo deve essere saldamente fissato al raccordo in ottone. Assicurarsi che nessuna saldatura sia finita tra le due lame del raccordo in ottone: ciò potrebbe rendere difficile l'inserimento di un connettore maschio in un secondo momento. Infine, assicurarsi che il collegamento sia a filo con la lama in ottone per consentire il reinserimento del raccordo nel connettore nel passaggio successivo.
- Utilizzando una pinza diritta, reinserire ciascun raccordo in ottone saldato nel connettore, assicurandosi che i fili di ciascuna coppia di elettrodi siano adiacenti l'uno all'altro e non siano aggrovigliati con altre coppie di elettrodi. Vedere la Figura 1B per visualizzare l'orientamento di una singola coppia di elettrodi nel connettore.
NOTA: L'orientamento ideale da sinistra a destra è: bicipite (3,5 mm all'estremità del connettore), tricipiti (3,5 mm all'estremità del connettore), estensore radiale del carpo (ECR; 4,5 mm all'estremità del connettore) e palmare lungo (PL; 4,5 mm all'estremità del connettore). Contrassegnare un lato con un pennarello o un bianco per tenere traccia dell'orientamento del connettore durante l'impianto. - Tagliare un connettore maschio a 12 pin della stessa dimensione (# coppie di elettrodi x 2) dell'estremità femmina e collegarlo al connettore femmina. Se i raccordi sono spostati, possono essere reinseriti con una pinza diritta dopo aver posizionato il connettore maschio.
- Rimuovere le linguette che fuoriescono dai raccordi in ottone con una pinza.
- Rivestire le fessure dei pin con resina epossidica, assicurandosi che tutto il metallo o il filo vicino al connettore sia isolato dal tessuto.
ATTENZIONE: La resina epossidica può causare irritazione alla pelle, agli occhi e alle vie respiratorie con un'esposizione prolungata. Indossare guanti, proteggere gli occhi e utilizzare la resina epossidica solo in un'area ben ventilata o sotto un dispositivo di aspirazione dei fumi locale. - Lasciare asciugare il connettore all'aria per almeno 30 minuti.
- Testare la resistenza di ciascuna coppia di elettrodi ed etichettare gli aghi con piccoli segmenti colorati di termorestringente per una facile identificazione durante l'intervento chirurgico.
NOTA: La resistenza deve essere compresa tra 18 e 50 ohm. Una resistenza inferiore può indicare un cortocircuito. Una resistenza più elevata può indicare un danno eccessivo ai trefoli del filo. Tuttavia, l'elevata resistenza deriva spesso da una connessione imperfetta tra l'albero dell'ago e il filo (effettuata al punto 1.6), che può essere risolta con una crimpatura aggiuntiva in questa giunzione. - Assicurarsi che il set di elettrodi sia privo di fibre e altri detriti prima dell'impianto. A questo scopo è possibile utilizzare uno spolverino spray. L'ispezione al microscopio può essere utile per verificare.
2. Chirurgia di impianto di elettrodi
NOTA: Questa sezione descrive una singola procedura chirurgica per impiantare una piastra e gli elettrodi fabbricati nella sezione precedente nei tricipiti, nei bicipiti, nell'estensore radiale del carpo (ECR) e nel palmare lungo (PL). Per gli ultimi due muscoli, è molto difficile impiantare l'elettrodo esclusivamente in questi singoli muscoli senza passare attraverso i muscoli sinergici vicini. Si veda la discussione qui sotto per quanto riguarda gli avvertimenti del tentativo di isolare le registrazioni dai singoli muscoli. Le piastre di testa sono in genere progettate su misura e fabbricate per esperimenti specifici. Il presente studio ha utilizzato piastre di testa RIVETS in plastica stampate in3D 19. Molti progetti di piastre di testa open source sono disponibili online tramite Janelia, l'Allen Institute e gruppi di ricerca indipendenti. La procedura della piastra di testa qui descritta è stata utilizzata con successo con piastre di testa in titanio e plastica. La procedura chirurgica deve essere eseguita su uno strumento stereotassico (vedi Tabella dei materiali) con uno stereomicroscopio con ingrandimento compreso tra 10 e 40x.
- Sterilizzare a freddo gli elettrodi e la piastra di testa utilizzando glutaraldeide all'1,5% per una notte o per 8 ore. Sciacquare brevemente in acqua sterile e lasciare asciugare completamente all'aria prima dell'impianto.
ATTENZIONE: La glutaraldeide è dannosa se ingerita e può causare irritazione agli occhi, alla pelle e alle vie respiratorie. Maneggiare con i guanti in una cappa aspirante ventilata. - Indurre l'anestesia con isoflurano al 2-4% in ossigeno di grado medico in una camera di induzione fino alla perdita del riflesso di raddrizzamento (circa 3 minuti) seguendo i protocolli istituzionalmente approvati.
- Trasferisci l'animale sul cono nasale mobile per continuare a ricevere l'anestesia. In anestesia con isoflurano al 2% in ossigeno di grado medico, radere la testa, il collo e l'arto dell'animale prima dell'intervento chirurgico. Eseguire tutti i passaggi rimanenti in questa sezione in anestesia. Regolare il dosaggio dell'isoflurano secondo necessità per mantenere una frequenza respiratoria di 1 Hz e l'assenza di un riflesso di pizzicamento delle dita dei piedi.
- Applicare il lubrificante per gli occhi e riapplicare ogni 1 ora durante l'intervento.
- Somministrare analgesici iniettabili (come carprofene, 5 mg/kg) e farmaci antibiotici per via sottocutanea (come enrofloxacina, 10 mg/kg) (vedi Tabella dei materiali) all'inizio dell'intervento chirurgico.
- Impiantare la piastra di testa utilizzando i seguenti passaggi o un metodo alternativo approvato dall'istituto.
- Fissare la testa dell'animale nelle barre auricolari dello strumento stereotassico e fornire l'anestesia (isoflurano al 2%) attraverso il cono nasale attaccato allo strumento stereotassico. Aggiungere un telo sterile per mantenere l'asepsi.
- Pulisci la testa e il collo con tamponi per la preparazione dello iodio povidone e tamponi sterili per la preparazione dell'alcol.
Se necessario, riapplicare il lubrificante per gli occhi. - Iniettare lidocaina (4 mg/kg) (vedere Tabella dei materiali) per via sottocutanea nel sito di incisione.
- Garantire un'adeguata induzione dell'anestetico eseguendo un pizzicamento delle dita. Se il riflesso di raddrizzamento è assente, praticare un'incisione lungo la linea mediana della testa dell'animale dal bordo caudale degli occhi al bordo caudale delle orecchie.
- Bloccare la pelle con clip di tessuto: due sul bordo rostrale su ciascun lato appena dietro gli occhi e due sul bordo caudale appena dietro le orecchie.
- Pulire la superficie del cranio raschiando delicatamente con una lama di bisturi per rimuovere la fascia secca.
- Applicare uno strato sottile di cemento dentale (vedi Tabella dei materiali) sulla superficie del cranio e lasciarlo asciugare per 5 minuti.
- Posizionare la piastra sulla testa sul cranio dell'animale. Come e dove viene impiantata la piastra varia in base alla piastra e alla domanda di ricerca.
- Usa del cemento dentale per far aderire la piastra al cranio. Assicurarsi che il teschio sia completamente coperto. Lasciare asciugare il cemento dentale per 10 minuti.
- Trasferire l'animale su un cono nasale mobile di plastica per fornire l'anestesia per il resto dell'intervento; Ciò consentirà il riposizionamento regolare dell'animale durante l'intervento chirurgico per accedere a diversi muscoli mantenendo l'anestesia.
- Estendere l'incisione sulla parte posteriore del collo (praticata durante l'impianto della placca) in modo che raggiunga 1 cm caudale alle orecchie.
- Utilizzando un raschietto osseo smussato, separare la pelle sotto l'incisione del collo dal tessuto sottostante per liberare un percorso dall'incisione del collo all'arto anteriore, dove verranno impiantati gli elettrodi.
- Fissare temporaneamente il connettore EMG alla piastra di testa utilizzando un piccolo pezzo di nastro adesivo per tenerlo in posizione durante l'impianto dell'elettrodo.
- Pulisci l'arto anteriore dell'animale con tamponi per la preparazione dello iodio povidone e tamponi per la preparazione dell'alcol sterile.
- Fai l'incisione del tricipite.
- Posiziona l'animale su un fianco con i tricipiti rivolti verso l'alto.
- Iniettare lidocaina (4 mg/kg) nel sito di incisione previsto. Questo allevierà il dolore locale e manterrà i muscoli umidi durante l'impianto.
NOTA: I muscoli devono rimanere umidi ma non gocciolare durante l'intervento chirurgico. Applicare soluzione fisiologica sterile localmente secondo necessità se i muscoli o la pelle sembrano secchi. - Tagliare 7 mm sopra i tricipiti parallelamente all'osso.
- Separare la pelle che circonda l'incisione dal tessuto sottostante con il raschietto per ossa smussato. Lavorare il raschietto sotto la pelle e di nuovo fino all'incisione del collo per liberare un percorso per gli elettrodi.
- Taglia via la fascia che oscura il muscolo.
- Assicurati che il percorso dal collo ai tricipiti sia abbastanza ampio inserendo le forbici chiuse attraverso l'incisione del tricipite e spingendo fuori il foro del collo, aprendolo leggermente dopo essere uscito dal foro.
- Portare l'elettrodo del tricipite all'incisione del tricipite: inserire la punta del trascinatore dell'ago grande attraverso l'incisione del tricipite e fuori dall'incisione del collo. Bloccare il caccia-aghi attorno all'ago dell'elettrodo nel senso della lunghezza e tirare fino all'incisione del tricipite.
- Inserimento del tricipite: Seguire il passaggio 3 "inserimento degli elettrodi nei muscoli".
- Praticare l'incisione del braccio distale.
- Posiziona l'animale sulla schiena.
- Fissa il braccio lungo il fianco dell'animale con il palmo rivolto verso il basso.
- Iniettare lidocaina (4 mg/kg) nel sito di incisione previsto.
- Praticare un'incisione di 1 cm sopra il bicipite e l'ECR dalla parte inferiore del deltoide a metà della parte inferiore del braccio, parallelamente all'osso. L'estremità distale dell'incisione deve trovarsi a ~2 mm sopra l'estremità dei muscoli della parte inferiore del braccio.
- Libera la fascia per esporre il muscolo bicipite.
- Libera un percorso dall'incisione del braccio distale all'incisione del tricipite sopra (prossimale) il grande vaso sanguigno che scorre sotto la pelle della parte superiore del braccio.
- Infilare l'elettrodo del bicipite sotto la pelle attraverso l'incisione del collo fino all'incisione del tricipite, quindi dall'incisione del tricipite all'incisione del braccio distale.
- Inserimento del bicipite: seguire il passaggio 3 "inserimento degli elettrodi nei muscoli".
- Fissa nuovamente il braccio dell'animale nella stessa posizione ma con il palmo rivolto verso il basso.
- Inserire il più vicino possibile all'estremità prossimale del bicipite esposto.
- Per immergere almeno 3 mm dell'elettrodo nel tessuto muscolare, assicurarsi di inserirlo leggermente in diagonale rispetto alle fibre muscolari a seconda delle dimensioni del topo.
- Libera un percorso dall'incisione del tricipite al sito di inserimento del braccio distale sotto (distale al) il grande vaso sanguigno che scorre sotto la pelle della parte superiore del braccio, creando un percorso distinto da quello dell'elettrodo del bicipite.
- Inserimento ECR: Seguire il passaggio 3 "inserimento degli elettrodi nei muscoli".
- Inserire nella parte più prossimale dell'ECR.
- Esci nella piega tra ECR e il suo antagonista e fai il nodo in questa piega.
- Libera un percorso dall'inserimento del tricipite al sito di inserimento del PL sotto il gomito.
- Inserimento PL: Seguire il passaggio 3 "inserimento degli elettrodi nei muscoli".
- Posiziona l'animale sulla schiena e fissa il braccio sopra la testa con il palmo rivolto verso l'alto.
- Inserire appena distalmente al gomito.
- Uscire sufficientemente prossimalmente ai tendini del polso in modo che il nodo nel sito di uscita si trovi sul muscolo e non sui tendini del polso.
- Riposizionare l'animale su un fianco e suturare l'incisione del tricipite utilizzando suture di seta 6-0.
- Riposizionare l'animale sulla schiena e suturare l'incisione del braccio distale utilizzando suture di seta 6-0.
- Fissare il connettore sul retro della piastra di testa utilizzando del cemento dentale.
- Sutura l'incisione del collo utilizzando suture di seta 6-0.
- Applicare una crema antibiotica topica sui siti di incisione per ridurre l'infiammazione.
- Applicare un collare elisabettiano (vedi Tabella dei materiali) sull'animale per evitare che disturbi le suture durante il recupero.
3. Inserimento di elettrodi nei muscoli
- Curvare leggermente l'ago (27 G, passaggio 1) piegandolo.
- Tenere l'ago con il cacciavite (vedi Tabella dei materiali) e premerlo contro l'impugnatura di un paio di pinze per aggiungere una curva di 5-10 gradi.
- Aggiungere tre curve totali in diverse posizioni lungo la lunghezza dell'ago.
- Visualizza dove entrare e uscire dal muscolo.
- Rimuovere il grasso e la fascia che ostruiscono il sito di entrata e di uscita tagliando o tirando con una pinza fine. Cerca di evitare danni vascolari per limitare il sanguinamento.
- Puntare a 3-5 mm di filo sommerso che corre parallelo alle fibre muscolari. Ciò garantirà che i tratti esposti del filo dell'elettrodo siano immersi all'interno del muscolo.
- Usando il cacciatore dell'ago, inserisci l'ago nell'estremità prossimale del muscolo applicando una contropressione con una pinza curva smussata nell'altra mano. Spingere l'ago attraverso il muscolo fino al sito di uscita.
- Una volta che l'ago esce dal muscolo, afferra la punta con una pinza smussata e tira l'ago attraverso. Continua a tirare finché il nodo prossimale non si trova sopra il sito di inserimento.
- Fai il nodo distale.
- Usando una pinza, lega un nodo sciolto distalmente al sito di uscita. Stringere il nodo fino a un anello di 1 cm.
- Spingere l'anello con una pinza e posizionarlo sopra il sito di uscita.
- Visualizza dove dovrebbe essere chiuso il nodo distale prima che sia completamente stretto, a circa 0,5 mm distalmente dal sito di uscita. Afferra delicatamente l'anello con la pinza piegata fine in questa posizione e tira forte l'anello sopra la pinza.
NOTA: Non stringere il nodo distale immediatamente sopra il sito di uscita in questo passaggio, altrimenti il muscolo verrà schiacciato quando il nodo sarà completamente stretto nel passaggio successivo. - Rimuovere la pinza sottile dal nodo e finire di stringere il nodo spingendo il nodo verso il sito di uscita con la pinza piegata fine e tirando l'estremità dell'ago con le dita. Assicurarsi che sia il nodo prossimale che quello distale siano posizionati correttamente al di fuori dei siti di inserimento e di uscita, rispettivamente, per ancorare l'elettrodo inserito in posizione.
- Afferrare il nodo di uscita con una pinza dritta e sottile e arricciare strettamente il filo distale attorno alla pinza per piegare il filo attorno al nodo e verso il muscolo/lontano dalla pelle.
- Tagliare il filo di 0,5 mm distalmente al nodo distale, lasciando una piccola protuberanza arricciata attorno al nodo.
Il passaggio precedente assicura che l'estremità tagliata della protuberanza non colpisca la pelle dell'animale, causando irritazione.
4. Assistenza post-operatoria
- Immediatamente dopo l'intervento chirurgico, eseguire i seguenti passaggi.
- Alloggia l'animale da solo in modo che i suoi compagni di gabbia non disturbino le sue suture.
- Metti l'animale in una gabbia pulita con lettiera bassa. Rimuovere qualsiasi nido e materiale di arricchimento che potrebbe interferire con la mobilità dell'animale mentre indossa il collare elisabettiano.
- Dare all'animale acqua e cibo umido a cui può accedere mentre indossa il collare.
- Eseguire i seguenti passaggi 24 ore e 48 ore dopo l'intervento.
- Rimuovere il collare elisabettiano per consentire all'animale di pulirsi da solo per 20 minuti.
- Indurre l'anestesia con isoflurano, come indicato nei passaggi 2.2 e 2.3.
- Somministrare farmaci analgesici e antibiotici iniettabili.
- Ispezionare i siti di incisione per verificare la presenza di punti di sutura mancanti, ferite aperte e segni di infezione o irritazione. Sostituire i punti di sutura e applicare più antibiotici topici, se necessario.
- Sostituire il cibo umido ogni 48 ore fino a quando il collare elisabettiano non viene rimosso.
- Eseguire i seguenti passaggi 6 giorni dopo l'intervento.
- Controlla le ferite per una guarigione completa.
- Se le ferite sono chiuse, rimuovere i punti di sutura. Se le ferite sono aperte, attendere altri due giorni per rimuovere i punti di sutura. Rimuovere il collare elisabettiano quando le suture vengono rimosse.
- Riporta il topo in una gabbia nuova e pulita con lettiera completa e arricchimento.
NOTA: Gli animali possono procedere alla sperimentazione o alla privazione dell'acqua 7 giorni dopo l'intervento chirurgico.
Risultati
La Figura 2, la Figura 3 e la Figura 4 mostrano l'attività muscolare normalizzata registrata dai muscoli degli arti anteriori di topi che eseguono comportamenti diversi: camminata sul tapis roulant senza fissazione della testa (Figura 2), arrampicandosi su una ruota rotante sotto la fissazione della testa (Figura 3) e raggiungendo goccioline d'acqua sotto la fissazione della testa (Figura 4). La Figura 2 mostra 1,5 s di locomozione su tapis roulant con un ciclo di passo approssimativo stimato dal tempo tra due attivazioni dei flessori del gomito. La Figura 3 mostra 5 s di dati EMG da un animale che ha avuto il guasto dell'elettrodo dell'estensore del polso 6 settimane dopo l'impianto. Nella Figura 3A, tutti e quattro gli elettrodi producono un segnale EMG pulito che si allinea con la rotazione della ruota (che indica l'arrampicata). La Figura 3B mostra il segnale proveniente dagli stessi elettrodi dopo il guasto: l'elettrodo estensore del polso produce un segnale rumoroso che non cambia con il movimento dell'animale. La Figura 4 mostra 1 s di EMG dai quattro gruppi muscolari degli arti anteriori durante un compito in cui il topo è passato dall'immobilità al raggiungimento di una goccia d'acqua.
Nella Figura 2, Figura 3 e Figura 4, i segnali di tensione sono stati amplificati e filtrati in banda passante (250-20.000 Hz) utilizzando un amplificatore differenziale. La tensione grezza è stata quindi sottocampionata a 1 kHz e ha ottenuto un punteggio z per il confronto tra i set di dati. Si noti ancora una volta che mentre gli elettrodi sono stati impiantati nei quattro muscoli specificati nel protocollo (bicipiti, tricipiti, ECR e PL), non è garantito che i muscoli sinergici adiacenti non abbiano influenzato il segnale EMG; Pertanto, ogni registrazione viene assegnata al suo gruppo di sinergia (flessore del gomito, ecc.) per la precisione. La verifica delle registrazioni isolate da singoli muscoli richiederebbe registrazioni simultanee in più sinergizzanti per individuare la diafonia tra le registrazioni muscolari, il che potrebbe essere proibitivo, specialmente nella parte inferiore del braccio dei topi.
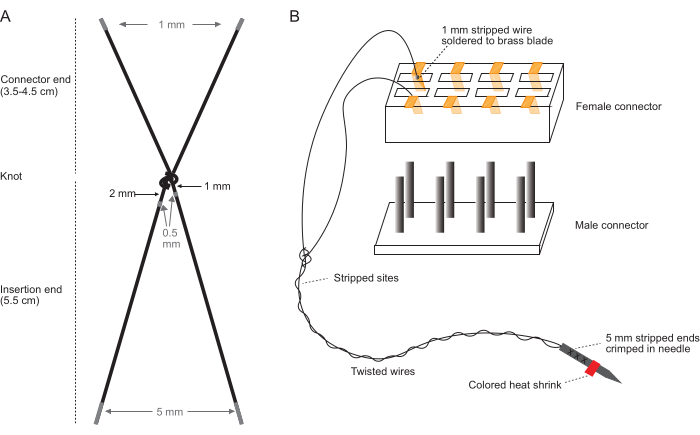
Figura 1: Schemi di fabbricazione del set di elettrodi. (A) Schema di una singola coppia di elettrodi. Le aree grigie indicano dove spogliarsi. (B) Schema del gruppo connettore con una singola coppia di elettrodi completata inserita nel connettore. Il diagramma in (B) non è in scala. Clicca qui per visualizzare una versione più grande di questa figura.
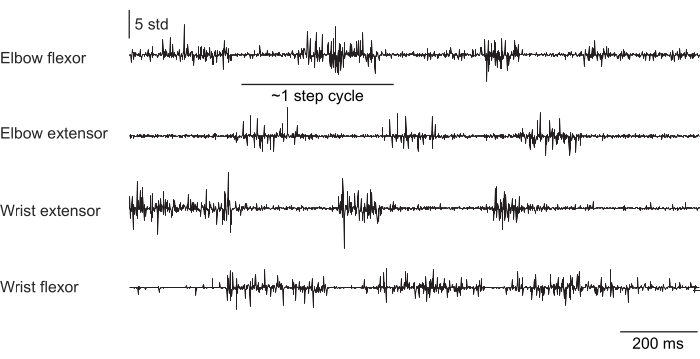
Figura 2: Registrazione EMG rappresentativa da quattro muscoli di un topo che si muove liberamente (non con la testa fissa) che cammina su un tapis roulant. La durata totale è di 1,5 s. Il ciclo di passo è stato stimato dal tempo tra le attivazioni sequenziali dell'estensore del gomito. Clicca qui per visualizzare una versione più grande di questa figura.
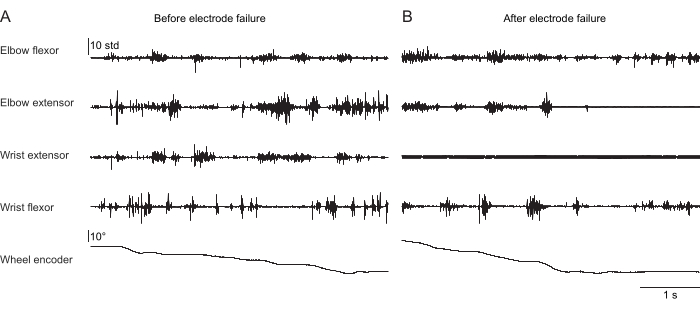
Figura 3: Registrazione EMG rappresentativa da quattro muscoli di un topo con la testa fissa che esegue un comportamento di arrampicata naturalistico. La5a fila mostra la posizione della ruota di arrampicata letta da un encoder rotativo; Le variazioni di questo valore indicano che la ruota sta girando e l'animale si sta arrampicando attivamente. La durata totale è di 5 s. (A) Registrazione 36 giorni dopo l'impianto durante l'arrampicata. (B) Registrazione 72 giorni dopo l'impianto nello stesso topo dopo il guasto dell'elettrodo dell'estensore del polso. Clicca qui per visualizzare una versione più grande di questa figura.
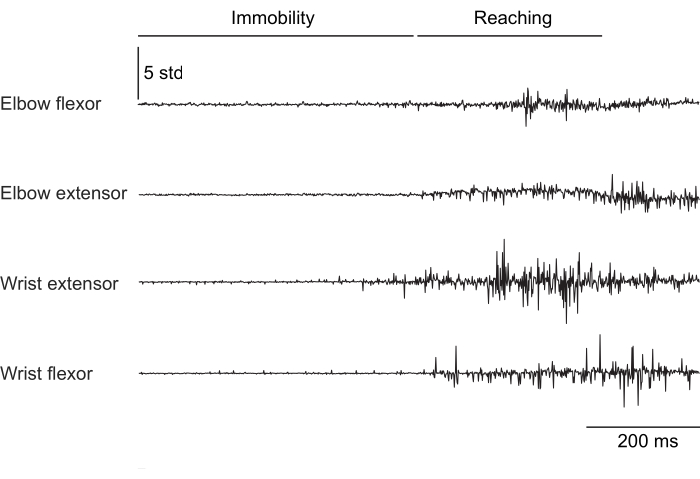
Figura 4: Registrazione EMG rappresentativa da quattro muscoli di un topo con la testa fissa in transizione dall'immobilità all'esecuzione di un movimento di raggiungimento. La durata totale è di 1 s. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questo protocollo consente registrazioni stabili dell'attività muscolare da topi fissati alla testa che eseguono una varietà di comportamenti per diverse settimane. Recentemente, questo metodo è stato impiegato per esaminare il controllo neurale della muscolatura degli arti durante comportamenti come la locomozione su tapis roulant18,20, un'attività di trazione del joystick18 e un'attività di co-contrazione21. Sebbene il protocollo qui descritto sia specifico per i muscoli del gomito e del polso del topo, è facilmente modificabile per registrare da muscoli diversi o da un numero diverso di muscoli modificando la lunghezza e/o il numero totale di coppie di elettrodi. Il metodo qui descritto è stato adattato da quelli utilizzati in precedenza per registrare l'attività muscolare degli arti anteriori e posteriori nei topi senza poggiatesta 15,16,17.
La fabbricazione di elettrodi richiede una notevole pratica per essere padroneggiata. Si consiglia una pratica quotidiana per 1-2 ore durante l'apprendimento. La spelatura degli elettrodi è la fase più impegnativa a causa del preciso livello di forza richiesto per tagliare l'isolamento senza danneggiare il filo sottostante. Questo livello di forza dipende dall'affilatura della lama, quindi la sostituzione frequente della lama del bisturi può aiutare a garantire la riproducibilità durante l'apprendimento. Anche la saldatura dei fili alle lame di ottone del connettore può essere difficile perché l'acciaio inossidabile non salda facilmente. L'applicazione di una quantità generosa di disossidante compatibile con l'acciaio inossidabile aiuta a promuovere la connessione.
La sfida principale durante l'intervento di implantologia è legare il nodo distale senza disturbare il filo impiantato o il nodo prossimale. Il nodo prossimale deve essere abbastanza grande da resistere allo scivolamento nel muscolo nel sito di inserimento, quindi evitare di legare il nodo troppo stretto nella fase 2 della fabbricazione del set di elettrodi. Se il nodo prossimale migra dopo l'impianto, utilizzare una pinza con punta in fibra di carbonio per riposizionarlo con cura. Stringere lentamente il nodo distale mantenendo una presa salda sul filo con una pinza per evitare di tirare l'intero elettrodo. Questo passaggio è fondamentale per garantire la longevità degli elettrodi impiantati: troppa tensione applicata all'elettrodo può causarne la rottura quando l'animale si muove, mentre un elettrodo allentato può spostarsi durante il recupero e perdere il contatto con il muscolo associato durante la guarigione del tessuto.
Gli animali si riprendono molto bene dall'intervento chirurgico, anche se ci sono potenziali complicazioni da notare. In primo luogo, i topi masticano le suture e gli elettrodi se ne hanno la possibilità. Mentre il collare elisabettiano lo impedisce, impedisce anche all'animale di pulirsi da solo. Alcuni topi sviluppano un accumulo di muco intorno agli occhi. Occasionalmente i topi maschi, in particolare quelli più anziani, sperimentano ostruzioni dell'uretra che possono essere angoscianti per l'animale. Lasciare che l'animale si pulisca da solo per 20 minuti al giorno prima di ispezionare i punti di sutura dovrebbe dare all'animale abbastanza tempo per prevenire questi problemi.
Ci sono importanti limitazioni di questo metodo da notare. In primo luogo, questi elettrodi personalizzati generalmente non sono in grado di risolvere l'attività di una singola unità motore. Inoltre, non è garantito che il segnale elettrico provenga esclusivamente da un muscolo specifico (ad esempio, i bicipiti), poiché è difficile escludere la diafonia dall'attività nei muscoli sinergici vicini. Pertanto, nelle pubblicazioni, i ricercatori si riferiscono comunemente ai muscoli registrati in base al loro gruppo di sinergia (ad esempio, flessore del gomito). Si consiglia di eseguire dissezioni post-mortem dopo ogni esperimento per verificare la posizione di ciascun elettrodo, poiché potrebbero spostarsi nel tessuto durante il recupero.
I ricercatori interessati all'attività di una singola unità motoria dovrebbero prendere in considerazione la possibilità di provare elettrodi EMG di nuova concezione sviluppati dal Center for Advanced Motor Bioengineering Research (CAMBER) della Emory University. Questi elettrodi sono ancora in fase di sviluppo, ma CAMBER fornirà l'ultimo design di elettrodi. Lo svantaggio principale di questi elettrodi è la longevità: gli elettrodi fabbricati a mano descritti in questo protocollo consentono generalmente registrazioni per diverse settimane, mentre gli elettrodi CAMBER funzionano meglio per esperimenti a breve termine. I ricercatori che scelgono un metodo di registrazione EMG possono contattare direttamente CAMBER per determinare se i loro elettrodi saranno adatti per un determinato esperimento.
Divulgazioni
Nessuno.
Riconoscimenti
Gli autori desiderano ringraziare la dottoressa Claire Warriner per aver contribuito allo sviluppo di questo metodo. Mark Agrios e Sajishnu Savya hanno assistito alla preparazione delle figure. Questa ricerca è stata supportata da un Searle Scholar Award, una Sloan Research Fellowship, una Simons Collaboration on the Global Brain Pilot Award, un Whitehall Research Grant Award, The Chicago Biomedical Consortium con il supporto dei Searle Funds presso il Chicago Community Trust, NIH grant DP2 NS120847 (A.M.) e NIH grant 2T32MH067564 (A.K.).
Materiali
| Name | Company | Catalog Number | Comments |
| #11 Scalpel Blades | World Precision Instruments | 504170 | For EMG electrode fabrication |
| #3 Scalpel Handle | Fine Science Tools | 10003-12 | For EMG electrode fabrication |
| 1 mL Sub-Q Syringe (100 pack) | Becton Dickinson | 309597 | For administering injectable drugs |
| 12-pin connector | Newark | 33AC2371 | 12-pin connector with brass fittings; for EMG electrode fabrication |
| 18 G Needles | Exel International | 26419 | For EMG electrode fabrication |
| 27 G Needles | Exel International | 26426 | For EMG electrode fabrication |
| 3 M Transpore Surgical Tape | 3M | 1527-0 | For taping animal's limbs out during surgery |
| 6-0 silk sutures | Henry Schein | 101-2636 | These sutures work well with delicate skin around the wrists |
| C&B Metabond Complete Kit | Pearson Dental | P16-0126 | Dental cement to affix connector to headplate |
| C57BL6/J Mice | Jackson Laboratories | #000664 | Wild type mice |
| Carbofib 5-CF Tweezers (2) | Aven tools | 18762 | Carbon fiber tipped forceps, used to manipulate delicate parts of electrode (stripped or inserted sections) |
| Carprodyl (Carprofen) 50 mg/mL Injection | Ceva Animal Health, LLC | G43010B | Injectable analgesic for pain management during and after surgery |
| Castroviejo Micro Needle Holder | Fine science tools | 12060-01 | For suturing |
| Castroviejo Needle Holder (large) | Fine science tools | 12565-14 | For inserting needle into muscle |
| Delicate Bone Scraper | Fine science tools | 10075-16 | To separate skin from underlying tissue |
| Dietgel 76A Dietary Supplement | Clear H2O | 72-07-5022 | For post-operative care |
| Dumont #5/45 Forceps | Fine science tools | 11251-35 | To remove fascia overlying muscle |
| Elizabethan collar for mouse | Kent Scientific Corporation | EC201V-10 | For post-operative care |
| Enrofloxacin 2.27% | Covetrus | #074743 | Injectable antibiotic for use during and after surgery |
| Epoxy gel | Devcon | 14265 | For EMG electrode fabrication |
| Hopkins Bulldog Clamp (4) | Stoelting | 10-000-481 | Tissue clamps for headplate implantation |
| Isoflurane Solution | Covetrus | 11695067771 | Inhalable anesthesia |
| Lidocaine Hydrochloride Injectable - 2% | Covetrus | #002468 | Topical analgesic for pain management during surgery |
| Medical Grade Oxygen | Airgas | OX USP200 | For administering isoflurane during surgery |
| MetriCide 1 Gallon | Metrex | 10-1400 | Glutaraldehyde solution for cold-sterilization of headplate and electrodes |
| MetriTest Strips 1.5% | Metrex | 10-303 | Test strips for monitoring glutaraldehyde solution (recommended) |
| Model 900LS Small Animal Stereotaxic Instrument | Kopf Instruments | 900LS | Stereotax with lazy susan feature that allows platform rotation during surgery |
| PFA-coated 0.0055" braided stainless steel wire | A-M systems | 793200 | For EMG electrode fabrication |
| Povidone-iodine prep pads | Dynarex | 1108 | For cleaning skin |
| Puralube Vet Ointment | Dechra | 37327 | Eye ointment for surgery |
| Sterile alcohol prep pads | Dynarex | 1113 | For cleaning skin |
| Straight fine #5 forceps | Fine science tools | 11295-10 | For curling wire after insertion |
| Straight fine scissors | Fine science tools | 14060-11 | For cutting wire |
| Student Vannas Spring Scissors | Fine science tools | 91500-09 | For making incisions, trimming fat and fascia, and suturing |
| Technik Tweezers 7B-SA (2) | Aven tools | 18074USA | Curved blunt forceps, for general use during surgery |
| Triple Antibiotic Ointment | Walgreens | 975863 | Topical antibiotic for surgery |
| V-1 Tabletop Laboratory Animal Anesthesia System | VetEquip | 901806 | Contains all necessary equipment for anesthesia induction and scavenging including vaporizer, induction chamber, moveable plastic nose cone, and tubing |
Riferimenti
- Dombeck, D. A., Khabbaz, A. N., Collman, F., Adelman, T. L., Tank, D. W. Imaging large scale neural activity with cellular resolution in awake mobile mice. Neuron. 56 (1), 43-57 (2007).
- Guo, Z. V., et al. Flow of cortical activity underlying a tactile decision in mice. Neuron. 81 (1), 179-194 (2014).
- Guo, J. Z., et al. Cortex commands the performance of skilled movement. eLife. 4, e10774 (2015).
- Morandell, K., Huber, D. The role of forelimb motor cortex areas in goal directed action in mice. Sci Rep. 7 (1), 15759 (2017).
- Galiñanes, G. L., Bonardi, C., Huber, D. Directional reaching for water as a cortex-dependent behavioral framework for mice. Cell Rep. 22 (10), 2767-2783 (2018).
- Evarts, E. V., Tanji, J. Reflex and intended responses in motor cortex pyramidal tract neurons of monkey. J Neurophysiol. 39 (5), 1069-1080 (1976).
- Hounsgaard, J., Hultborn, H., Jespersen, B., Kiehn, O. Bistability of alpha-motoneurones in the decerebrate cat and in the acute spinal cat after intravenous 5-hydroxytryptophan. J Physiol. 405, 345-367 (1988).
- Murphy, P. R., Hammond, G. R. The role of cutaneous afferents in the control of gamma-motoneurones during locomotion in the decerebrate cat. J Physiol. 434, 529-547 (1991).
- Manuel, M., Chardon, M., Tysseling, V., Heckman, C. J. Scaling of motor output, from mouse to humans. Physiol Bethesda Md. 34 (1), 5-13 (2019).
- Sauerbrei, B. A., et al. Cortical pattern generation during dexterous movement is input-driven. Nature. 577 (7790), 386-391 (2020).
- Barrett, J. M., Raineri Tapies, M. G., Shepherd, G. M. G. Manual dexterity of mice during food-handling involves the thumb and a set of fast basic movements. PLoS One. 15 (1), e0226774 (2020).
- Serradj, N., et al. Task-specific modulation of corticospinal neuron activity during motor learning in mice. Nat Commun. 14, 2708 (2023).
- Scholle, H. C., et al. Spatiotemporal surface EMG characteristics from rat triceps brachii muscle during treadmill locomotion indicate selective recruitment of functionally distinct muscle regions. Exp Brain Res. 138 (1), 26-36 (2001).
- Scholle, H. C., et al. Kinematic and electromyographic tools for characterizing movement disorders in mice. Mov Disord off J Mov Disord Soc. 25 (3), 265-274 (2010).
- Pearson, K. G., Acharya, H., Fouad, K. A new electrode configuration for recording electromyographic activity in behaving mice. J Neurosci Methods. 148 (1), 36-42 (2005).
- Akay, T., Acharya, H. J., Fouad, K., Pearson, K. G. Behavioral and electromyographic characterization of mice lacking EphA4 receptors. J Neurophysiol. 96 (2), 642-651 (2006).
- Akay, T., Tourtellotte, W. G., Arber, S., Jessell, T. M. Degradation of mouse locomotor pattern in the absence of proprioceptive sensory feedback. Proc Natl Acad Sci USA. 111 (47), 16877-16882 (2014).
- Miri, A., et al. Behaviorally selective engagement of short-latency effector pathways by motor cortex. Neuron. 95 (3), 683-696 (2017).
- Osborne, J., Dudman, J. RIVETS: A mechanical system for in vivo and in vitro electrophysiology and imaging. PloS One. 9 (2), e89007 (2014).
- Santuz, A., Laflamme, O. D., Akay, T. The brain integrates proprioceptive information to ensure robust locomotion. J Physiol. 600 (24), 5267-5294 (2022).
- Warriner, C. L., Fageiry, S., Saxena, S., Costa, R. M., Miri, A. Motor cortical influence relies on task-specific activity covariation. Cell Rep. 40, 111427 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon