Method Article
慢性的にEMG電極を移植した頭部固定マウスにおける前肢筋活動の記録
要約
このプロトコルでは、マウスの前肢筋に筋電図(EMG)電極を手の作製と外科的に移植して、頭固定行動実験中の筋肉活動を記録する方法について説明します。
要約
マウスシステム神経科学研究で利用可能な強力な遺伝的および分子的ツールにより、研究者は、さまざまなタスクを実行する頭部固定マウスで、これまでにない精度で運動系機能を調べることができました。マウスのサイズが小さいため、筋肉活動の筋電図(EMG)記録の従来の方法は、ネコや霊長類などの大型動物向けに設計されていたため、運動出力の測定が困難になります。マウス用のEMG電極の市販が待たれていますが、マウスの筋肉活動を記録するための現在のゴールドスタンダードの方法は、電極セットを社内で作成することです。この記事では、電極セットの手作業による作製、ヘッドプレートの埋め込みと同じ手術での電極の埋め込み、ヘッドプレートへのコネクタの固定、および術後の回復ケアのための確立された手順の改良について説明します。回復後、数週間にわたって頭部固定動作中にミリ秒分解能のEMG記録を取得でき、信号品質に顕著な変化はありません。これらの記録により、前肢の筋肉活動の正確な測定と、マウスの運動制御のメカニズムを調べるための in vivo 神経記録および/または摂動が可能になります。
概要
ここ数十年で、マウスは哺乳類の運動系を研究するための魅力的なモデル生物になりました。一般的な実験的アプローチには、神経活動のモニタリングおよび/または摂動と並行して運動タスクを実行する頭部固定マウスが含まれます1,2,3,4,5。より大きな種(ネコや霊長類など)の運動系研究は、伝統的に、そのような実験中に運動出力を直接測定するために筋電図(EMG)に依存してきた6,7,8。しかし、マウスの筋肉組織は、大型哺乳類の実験で使用される市販のEMG電極には小さすぎるため、マウスの筋肉活動を記録することは困難です9。多くの研究者は、ビデオ4,10,11および/または行動パフォーマンス2,4,12を通じて四肢の運動学を追跡し、運動出力を間接的に調査することを選択しますが、これらの方法では、神経活動とその摂動が筋肉に及ぼすミリ秒の時間スケールの影響を検出する分解能が不足しています。したがって、筋電図の記録は、筋肉の直接的な神経制御に関心のある研究者にとって望ましいものです。
EMGは、通常、記録される筋肉の繊維にほぼ平行な短い距離で隔てられた2点間の電圧を測定することを含みます。EMG電極には、表面電極(または「パッチ」)と筋肉内電極(または「針」)の種類があります。表面電極は、皮膚の上に置くか、筋肉組織に重ねて接着剤または縫合で固定します。そのため、表面電極は筋肉内電極よりも侵襲性が低く、比較的使いやすいため、人間、猫、霊長類に最も人気があります。表面電極は、ラットやマウスでも成功裏に使用されてきた13,14;ただし、げっ歯類がグルーミング中に異物を取り除こうとする傾向があるため、手作業で製造し、皮下に外科的に埋め込む必要があります。一方、筋肉内EMG電極は、筋肉組織内に外科的に埋め込まれます。筋肉組織に飲み込まれているため、高い空間分解能を提供し、無期限に固定されたままになります。したがって、埋め込まれた筋肉内EMG電極は、げっ歯類を使用した長期実験に理想的な表面電極です。マウスの筋肉内筋電図を確実に記録するために、研究者たちは、成体マウスの前腕の筋肉と同じくらい小さな筋肉にEMG電極を手で作製して埋め込む方法を開発しました。これらの電極は、げっ歯類の運動行動中の数週間にわたる慢性的な筋肉記録を可能にします。
ここで説明するプロトコルは、確立された方法15,16,17,18の10年にわたる改良の結果であり、行動するマウスの肘と手首の屈筋/伸筋ペアに慢性的に埋め込まれたワイヤーEMG電極から手を作製、移植、および記録する手順を生み出しました。最初のセクションでは、4つの電極ペアとヘッドステージインターフェース用の8ピンコネクタを備えた電極セットの手作り製作について説明します。次のセクションでは、ヘッドプレートの埋め込みと同じ手術で、上腕と下腕の筋肉に電極を筋肉内に埋め込む手術について詳しく説明します。最後に、さまざまな行動をとるマウスの代表的な記録について説明します。全体として、この方法は、頭部固定動作実験に筋活動測定を含めるための費用対効果が高くカスタマイズ可能な方法であり、電極製造の経験があるラボに最適です。
プロトコル
すべての実験と手順は、NIHのガイドラインに従って実施され、ノースウェスタン大学の動物管理および使用委員会によって承認されました。他の国や機関では、この手順の変更を必要とする異なる規制がある場合があります。本研究に含まれた動物は、12-20週齢のC57BL6/J成人雄( 材料表参照)で、最小体重は20gであった。
1. 電極セットの作製
注意: これらの手順は、10倍から40倍の倍率範囲の実体顕微鏡を使用して、清潔な素手で清潔なベンチトップで実行します。電極ワイヤのストリッピング(図1A)とコネクタアセンブリ(図1B)の詳細を示す図については、図1を参照してください。
- ワイヤーの切断:電極ペアごとに、PFAコーティングされた編組ステンレス鋼ワイヤー(7撚り線、直径0.0055インチ)を2本切断します( 材料の表を参照)。上腕の筋肉は、各ワイヤーを9.5cmの長さでカットします。下腕の筋肉の場合は、各ワイヤーを10.5cmの長さで切断します。
- 2本のワイヤーを1つの結び目で結びます-これは、埋め込まれたときに挿入部位(近位結び目)のすぐ外側にある結び目になります。結束されたワイヤは、1つの電極ペアを構成します。
- 段ボールに18Gの針を差し込んだ状態で、結び目を挿入端から6cmの位置に置き、電極ストランドを段ボールに引っ張って針の周りを締めます。挿入端は約5.5cmに縮み、残りの0.5cmは結び目で結ばれます。
- 針を慎重に外し、結び目を素手で2回しっかりと引っ張ってさらに締めます。
注:結び目はできるだけきつくしないでください。このように締めると、埋め込まれた電極を組織に固定するのに適切なサイズの近位結び目が得られます。 - 上腕の筋肉の場合、コネクタの端の長さが3.5cmであることを確認してください。下腕の筋肉の場合、コネクタの端の長さが4.5cmであることを確認してください。
- 各ワイヤから0.5 mmの絶縁体を剥がします:一方のワイヤの結び目から1〜1.5 mm、もう一方のワイヤのノットから2〜2.5 mm。 図 1 は、各ワイヤを被覆する場所を示しています。
- 2つのコネクタ端線を一緒にし、挿入端線を広げて、電極を平らな段ボールにピンと張ったテープで固定します。
- メスを使用して、断熱材に傷をつけ、断熱材が除去される端に印を付けます。
- 各ニックネームで、各ニックネームにメスの刃で一連の~6カットを行います:上部に~2、側面に~2、ワイヤーの下に~2。
注意: ワイヤー自体を切断しすぎないようにすることが重要です。そうしないと、ストランドが壊れる可能性があります。ワイヤへの損傷を抑えながら絶縁体を完全に切断するための適切な圧力を得るには、練習が必要です。 - 電極ペアを180度回転させ、各ニックで6つのカットを繰り返します。
- 必要に応じて追加のカットを配置して、0.5mmの絶縁体を下にあるワイヤから分離します。ここで必要なカットの数は、加えられる圧力とメスの刃の切れ味によって異なります。
- メスの刃を傾けて、緩んだ絶縁体に沿って縦に切断し、鉗子を使用してワイヤーから取り外します。
- 露出したワイヤーに、組織への挿入中に損傷を引き起こす可能性のある破損や擦り切れた絶縁体がないか検査します。
- コネクタ端の各ワイヤの端から 1 mm をはがします。
- 挿入端の各ワイヤの端から5mm剥がします。
- 挿入端のワイヤセグメントをねじり合わせ、5mmの露出端を0.5インチのシャフトに圧着します。27Gの針。一般的な皮下注射針は、ルアーロックのエンディングを取り外した後に使用できます。
- 電極ペアごとに手順1.1〜1.6を繰り返します。
- コネクタを組み立てます。
- 12ピンコネクタのメス端( 材料の表を参照)をサイズに切り詰めます:#電極ペアx2ピンスロット。
- 各コネクタポートから真ちゅう製のフィッティング(これらは12ピンコネクタにあらかじめ取り付けられています)をペンチでそっと取り外します。これらのフィッティングは、次のステップのために保存します。
- 各ワイヤの露出した1mmの端を、真鍮製フィッティングのブレードの1つの外面にはんだ付けします。
注意: はんだ付けすると、皮膚、目、呼吸器の炎症を引き起こす可能性のある煙が放出されます。手袋を着用し(または後で手を洗い)、目の保護具を使用し、地元の排煙装置を使用して曝露を制限します。- 真ちゅう製の金具を、補助ハンドツールに取り付けられた歯のないワニ口クリップに固定し、ブレードの1つの外面を上にして固定します。
- フィッティングを顕微鏡下に配置して、はんだ付け中に高い視覚制御を可能にします。広げたペーパークリップまたは端線を使用して、ブレードの表面にステンレス鋼の適合フラックスを少量軽くたたきます。
- 幅の狭い円錐形のはんだチップを使用して、真鍮ブレードの下部~1.5mmを覆うのに十分なはんだをブレードに塗布します。
注意: ここにはんだが多すぎるとコネクタの組み立てに干渉しますが、はんだが少なすぎると接続が不十分になる可能性があります。必要に応じて最初からやり直すために、追加の真鍮製フィッティングを用意してください。 - ブレードのはんだの表面には、ステンレス製適合フラックスをたっぷりと塗布しますが、2枚のブレードの隙間にフラックスが垂れ落ちないようにしてください。
- 露出した1mmの電極線をブレードのはんだと同じ高さに保持し、はんだを鉄で加熱して接続を融合します。
- 接続を検査する:露出したワイヤの大部分はんだに沈め、ワイヤを真鍮製のフィッティングにしっかりと取り付ける必要があります。真鍮製フィッティングの2つのブレードの間にはんだが入っていないことを確認してください - これにより、後でオスコネクタを挿入するのが難しくなる可能性があります。最後に、接続が真鍮のブレードと同じ高さにあることを確認して、次のステップでフィッティングをコネクタに再挿入できるようにします。
- まっすぐな鉗子を使用して、はんだ付けされた各真鍮フィッティングをコネクタに再度挿入し、各電極ペアのワイヤが互いに隣接し、他の電極ペアと絡まっていないことを確認します。 図1B を参照して、コネクタ内の1つの電極ペアの向きを視覚化します。
注意: 左から右への理想的な向きは、上腕二頭筋 (コネクタ端で 3.5 mm)、上腕三頭筋 (コネクタ端で 3.5 mm)、橈側手根伸筋 (ECR、コネクタ端で 4.5 mm)、および長手掌筋 (PL、コネクタ端で 4.5 mm) です。片側をマーカーまたはホワイトアウトでマークして、埋め込み中のコネクタの向きを追跡します。 - オス12ピンコネクタをメス端と同じサイズ(#電極ペア×2)に切り詰め、メスコネクタに接続します。継手がずれてしまった場合は、オスコネクタを装着した後、ストレート鉗子で再挿入することができます。
- 真鍮製の金具から発せられているタブをペンチで取り外します。
- ピンスロットをエポキシでコーティングし、コネクタの近くにあるすべての金属またはワイヤが組織から絶縁されるようにします。
注意: エポキシは、長時間の曝露により、皮膚、目、呼吸器の炎症を引き起こす可能性があります。手袋を着用し、目の保護具を着用し、風通しの良い場所または局所的な排煙装置の下でのみエポキシを使用してください。 - コネクタを少なくとも 30 分間風乾させます。
- 各電極ペアの抵抗をテストし、手術中に簡単に識別できるように、熱収縮の小さな色付きのセグメントで針にラベルを付けます。
注:抵抗は18〜50オームである必要があります。抵抗が低い場合は、短絡を示している可能性があります。抵抗値が高い場合は、より線の損傷が大きすぎることを示している可能性があります。ただし、抵抗が高いのは、ニードルシャフトとワイヤ(ステップ1.6で作成)の間の接続が不完全であることに起因していることが多く、この接合部で追加の圧着を行うことで解決できます。 - 埋め込む前に、電極セットに繊維やその他の破片がないことを確認してください。これにはスプレーダスターを使用できます。顕微鏡で検査することは、検証に役立ちます。
2. 電極埋め込み手術
注:このセクションでは、前のセクションで製造したヘッドプレートと電極を上腕三頭筋、上腕二頭筋、橈側手根伸筋(ECR)、および長手掌筋(PL)に埋め込むための単一の外科的手順について説明します。後者の2つの筋肉の場合、近くの相乗筋を経由せずに、これらの個々の筋肉にのみ電極を埋め込むことは非常に困難です。個々の筋肉から記録を分離しようとする際の注意点については、以下の説明を参照してください。ヘッドプレートは通常、特定の実験のためにカスタム設計および製造されています。本研究では、3Dプリントされたプラスチックリベットヘッドプレート19を使用しました。多くのオープンソースのヘッドプレートデザインは、Janelia、Allen Institute、および独立した研究グループを通じてオンラインで入手できます。ここで説明するヘッドプレートの手順は、チタン製およびプラスチック製のヘッドプレートで成功裏に使用されています。外科的処置は、10〜40倍の倍率の実体顕微鏡を備えた脳定位固定装置( 材料の表を参照)で行う必要があります。
- 電極とヘッドプレートを1.5%グルタルアルデヒドを使用して一晩または8時間冷間滅菌します。滅菌水で短時間すすぎ、完全に風乾させてから移植します。
注意: グルタルアルデヒドは飲み込むと有害であり、目、皮膚、気道に刺激を与える可能性があります。換気されたヒュームフードに手袋をはめたハンドル。 - 導入チャンバー内の医療グレードの酸素に 2-4% イソフルランを使用して麻酔を誘発し、施設で承認されたプロトコルに従って立ち直り反射が失われるまで (約 3 分)。
- 動物を可動式ノーズコーンに移し、麻酔を受け続けます。医療グレードの酸素に2%イソフルランを含ませた麻酔下で、手術前に動物の頭、首、手足を剃ります。このセクションの残りのすべての手順を麻酔下で実行します。必要に応じてイソフルランの投与量を調整して、呼吸数を1 Hzに保ち、つま先をつまむ反射がないようにします。.
- アイローションを塗布し、手術中は1時間ごとに再塗布します。
- 手術の開始時に、注射可能な鎮痛剤(カルプロフェン、5 mg / kgなど)と抗生物質薬(エンロフロキサシン、10 mg / kgなど)を皮下投与します( 材料の表を参照)。
- 次の手順または機関が承認した別の方法を使用してヘッドプレートを埋め込みます。
- 動物の頭を定位固定装置のイヤーバーに固定し、固定装置に取り付けられた鼻円錐を通して麻酔(2%イソフルラン)を行います。無菌を維持するために滅菌ドレープを追加します。
- ポビドンヨード調製パッドと滅菌アルコール調製パッドで頭と首を清掃します。
必要に応じて、目の潤滑剤を再度塗布します。 - リドカイン(4 mg / kg)( 材料の表を参照)を切開部位に皮下注射します。.
- つま先をつまむことにより、適切な麻酔薬の導入を確保します。直立反射がない場合は、動物の頭の正中線を目の尾側の端から耳の尾側の端まで切開します。
- ティッシュクリップで皮膚を固定します:目のすぐ後ろの両側の吻側の端に2つ、耳のすぐ後ろの尾側の端に2つ。
- メスの刃でやさしくこすり、乾燥した筋膜を取り除き、頭蓋骨の表面をきれいにします。
- 頭蓋骨の表面に歯科用セメントの薄層( 材料の表を参照)を塗布し、5分間乾燥させます。
- ヘッドプレートを動物の頭蓋骨に置きます。ヘッドプレートを埋め込む方法と場所は、ヘッドプレートと研究課題によって異なります。
- デンタルセメントを使用して、ヘッドプレートを頭蓋骨に接着します。頭蓋骨が完全に覆われていることを確認してください。歯科用セメントを10分間乾燥させます。
- 動物を可動式のプラスチック製ノーズコーンに移して、手術の残りの部分に麻酔を提供します。これにより、手術中に動物を定期的に再配置して、麻酔を維持しながらさまざまな筋肉にアクセスできるようになります。
- 首の後ろの切開部(ヘッドプレートの移植中に行われる)を伸ばして、耳の尾側1cmに達するようにします。
- 鈍骨スクレーパーを使用して、首の切開部の下の皮膚を下の組織から分離し、首の切開部から電極が埋め込まれる前肢までの経路を確保します。
- EMGコネクタを小さなテープを使用してヘッドプレートに一時的に固定し、電極の埋め込み中に所定の位置に保持します。
- ポビドンヨード調製パッドと滅菌アルコール調製パッドで動物の前肢を洗浄します。
- 上腕三頭筋を切開します。
- 上腕三頭筋を上に向けて動物を横向きに置きます。
- リドカイン(4 mg / kg)を予定された切開部位に注入します。.これにより、移植中に局所的な痛みが緩和され、筋肉が湿った状態に保たれます。
注:筋肉は湿ったままで、手術中は濡れないようにする必要があります。筋肉や皮膚が乾燥しているように見える場合は、必要に応じて滅菌生理食塩水を局所的に塗布します。. - 骨と平行な上腕三頭筋の7mmを切ります。
- 切開部の周囲の皮膚を、鈍い骨スクレーパーで下層組織から分離します。スクレーパーを皮膚の下から首の切開部まで動かして、電極の経路をクリアします。
- 筋肉を覆い隠している筋膜を切り取ります。
- 上腕三頭筋の切開部に閉じたハサミを挿入し、穴を出た後に少し開いて首の穴を押し出すことにより、首から上腕三頭筋への経路が十分に大きいことを確認します。
- 上腕三頭筋の電極を上腕三頭筋の切開部に持っていきます:大きなニードルドライバーの先端を上腕三頭筋の切開部から挿入し、首の切開部から取り出します。ニードルドライバーを電極針の周りに縦にクランプし、上腕三頭筋の切開部まで引き抜きます。
- 上腕三頭筋の挿入:ステップ3「筋肉への電極の挿入」に従います。
- 遠位腕を切開します。
- 動物を仰向けにします。
- 手のひらを下に向けて、腕を動物の側面に沿ってテープで固定します。
- リドカイン(4 mg / kg)を予定された切開部位に注入します。.
- 上腕二頭筋とECRの上に1cmの切開を行い、三角筋の下部から下腕の中央まで、骨と平行に切り込みます。切開部の遠位端は、下腕の筋肉の端から~2mm上にある必要があります。
- 筋膜をきれいにして、上腕二頭筋を露出させます。
- 遠位腕の切開部から上腕三頭筋の切開部に戻る経路を、上腕の皮膚の下に沿って走る大きな血管の上(近位)に戻します。
- 上腕二頭筋の電極を皮膚の下に通し、首の切開から上腕三頭筋の切開まで、次に上腕三頭筋の切開から遠位腕の切開まで通します。
- 上腕二頭筋の挿入:ステップ3「筋肉への電極の挿入」に従います。
- 動物の腕を同じ位置にテープを貼り直しますが、手のひらを下に向けています。
- 露出した上腕二頭筋の近位端にできるだけ近づけて挿入します。
- 電極の少なくとも3 mmを筋肉組織に沈めるには、マウスのサイズに応じて、筋線維に対してわずかに斜めに挿入してください。
- 上腕三頭筋の切開部から、上腕の皮膚の下を通る大きな血管の下(遠位)の遠位腕挿入部位までの経路をクリアし、上腕二頭筋電極の経路とは異なる経路を作成します。
- ECR挿入:ステップ3「筋肉への電極の挿入」に従います。
- ECRの最も近位の部分に挿入します。
- ECRとその拮抗薬との間の折り目から出て、この折り目で結び目を作ります。
- 上腕三頭筋の挿入から肘の下のPL挿入部位までの経路をクリアします。
- PL挿入:ステップ3「筋肉への電極の挿入」に従います。
- 動物を仰向けに置き、手のひらを上にして腕を頭にテープで固定します。
- 肘のちょうど遠位に挿入します。
- 手首の腱に十分に近位に出て、出口部位の結び目が手首の腱ではなく筋肉にくるようにします。
- 動物を横向きに再配置し、6-0シルク縫合糸を使用して上腕三頭筋の切開部を縫合します。
- 動物を仰向けに再配置し、6-0シルク縫合糸を使用して遠位腕の切開部を縫合します。
- ヘッドプレートの背面にデンタルセメントを使用してコネクタを固定します。
- 6-0シルク縫合糸を使用して首の切開を縫合します。
- 炎症を軽減するために、切開部位に局所抗生物質クリームを塗布します。
- エリザベス朝の首輪( 材料の表を参照)を動物に取り付けて、回復中に縫合糸を邪魔しないようにします。
3. 筋肉に電極を挿入する
- 曲げて針をわずかに曲げます(27 G、ステップ1)。
- ニードルドライバー( 材料の表を参照)で針を持ち、一対の鉗子のハンドルに押し付けて、5〜10度の曲げを追加します。
- 針の長さに沿って異なる位置に合計3つのベンドを追加します。
- 筋肉の出入り位置を視覚化します。
- 入口と出口の部位を覆い隠している脂肪や筋膜を、細い鉗子で切断または引っ張って取り除きます。出血を制限するために、血管の損傷を避けるようにしてください。
- 筋繊維と平行に走る3〜5mmの水中ワイヤーを目指します。これにより、露出した電極ワイヤーのストレッチが筋肉内に沈むようになります。
- ニードルドライバーを使用して、もう一方の手で鈍い湾曲した鉗子で逆圧をかけながら、筋肉の近位端に針を挿入します。針を筋肉に通して出口部位まで押し込みます。
- 針が筋肉から出たら、鈍い鉗子で先端をつかみ、針を引き抜きます。近位の結び目が挿入部位の上に座るまで引っ張り続けます。
- 遠位結び目を作ります。
- 鉗子を使用して、出口部位の遠位に緩い結び目を結びます。結び目を1cmのループに締めます。
- 鉗子でループを押し、出口部位の上に配置します。
- 遠位結び目を完全に締める前に、出口部位から約0.5mm遠位のどこまで閉じるべきかを視覚化します。この位置で細かく曲がった鉗子でループをそっとつかみ、ループを鉗子の上にしっかりと引っ張ります。
注:このステップでは、出口部位のすぐ上で遠位結び目を締めないでください、または次のステップで結び目が完全に締められると筋肉が圧迫されます。 - 結び目から細い鉗子を取り外し、細い曲げた鉗子で結び目を出口部位に向かって押し、針の端を指で引っ張って結び目を締めます。近位と遠位の両方の結び目がそれぞれ挿入部位と出口部位の外側に適切に配置されていることを確認して、挿入された電極を所定の位置に固定します。
- 出口の結び目をまっすぐで細い鉗子でつかみ、鉗子の周りの遠位ワイヤーをしっかりとカールさせて、結び目の周りのワイヤーを筋肉に向かって/皮膚から離します。
- 遠位結び目から0.5mm遠位のワイヤーを切り取り、結び目の周りに小さなこぶを巻き付けたままにします。
前のステップでは、こぶの切り口が動物の皮膚に突き刺さず、炎症を引き起こすことがないようにします。
4. 術後のケア
- 手術直後は、以下の手順で行ってください。
- ケージの仲間が縫合糸を邪魔しないように、動物を一人で飼います。
- 動物を低い寝具のある清潔なケージに入れます。エリザベス朝の首輪を着用している間、動物の可動性を妨げる可能性のあるネストレットとエンリッチメントマテリアルをすべて取り除きます。
- 首輪を着用したままアクセスできる水とウェットフードを動物に与えます。
- 手術後24時間および48時間後に次の手順を実行します。
- エリザベス朝の首輪を取り外して、動物が20分間自分で毛づくろいをできるようにします。
- ステップ2.2およびステップ2.3で述べたように、イソフルランで麻酔を誘発します。
- 注射可能な鎮痛薬と抗生物質の薬を投与します。
- 切開部位に縫合糸の欠落、開放創、感染や炎症の兆候がないか検査します。縫合糸を交換し、必要に応じてより多くの局所抗生物質を塗布します。
- エリザベス朝の首輪が外されるまで、48時間ごとにウェットフードを交換してください。
- 手術後6日で以下の手順を行ってください。
- 傷が完全に治癒することを確認してください。
- 傷口が閉じている場合は、縫合糸を抜いてください。傷口が開いている場合は、縫合糸を取り除くためにさらに2日待ちます。縫合糸を抜くときは、エリザベス朝の首輪を外します。
- マウスを新しい清潔なケージに戻し、完全な寝具と濃縮物を提供します。
注:動物は手術後7日で実験または水分不足に進むことができます。
結果
図2、 図3、 および図4 は、頭を固定せずにトレッドミルで歩く(図2)、頭を固定して回転するホイールを登る(図3)、頭を固定して水滴に手を伸ばす(図4)という異なる行動をとるマウスの前肢筋から記録された正規化された筋肉活動を示しています。 図 2 は、1.5 秒のトレッドミルでの移動と、2 つの肘屈筋の作動間の時間から推定されたおおよそのステップサイクルを示しています。 図3 は、移植後6週間で手首伸筋電極が故障した動物からの5秒間のEMGデータを示しています。 図 3A では、4 つの電極すべてが、ホイールの回転 (上昇を示す) に合わせてクリーンな EMG 信号を生成します。 図3B は、故障後の同じ電極からの信号を示しています:手首伸筋電極は、動物の動きによって変化しないノイズの多い信号を生成します。 図4 は、マウスが動かない状態から水滴に手を伸ばすように移行したタスク中の4つの前肢筋群からの1秒間のEMGを示しています。
図2、図3、および図4では、差動アンプを使用して電圧信号を増幅し、バンドパスフィルタリング(250〜20,000Hz)しました。 次に、生の電圧を1kHzにサブサンプリングし、データセット間で比較するためにzスコア付けしました。プロトコルで指定された 4 つの筋肉 (上腕二頭筋、上腕三頭筋、ECR、および PL) に電極が埋め込まれましたが、隣接する相乗的な筋肉が EMG 信号に影響を与えなかったとは限らないことに注意してください。したがって、各記録は、精度のためにそのシナジーグループ(肘屈筋など)に割り当てられます。単一の筋肉から単離された記録を検証するには、複数のシナジストで同時に記録し、筋肉記録間のクロストークをアッセイする必要がありますが、これは特にマウスの下腕では非常に難しい場合があります。
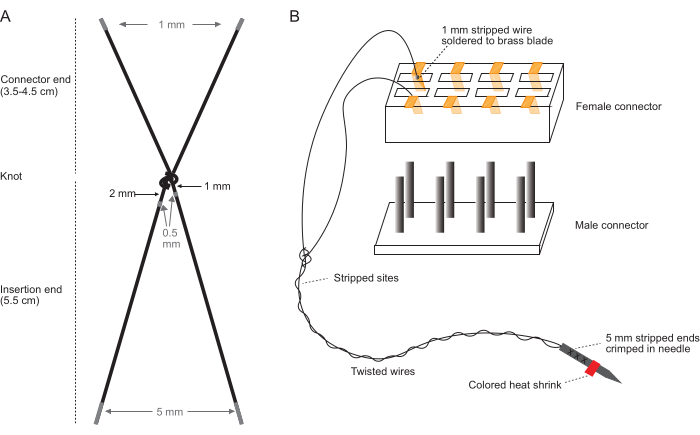
図1:電極セット製造の概略図(A)1つの電極ペアの図。灰色の領域は、ストリップする場所を示します。(B)コネクタに単一の完成した電極ペアが挿入されたコネクタアセンブリの図。(B)の図は縮尺を合わせたものではありません。この図の拡大版を表示するには、ここをクリックしてください。
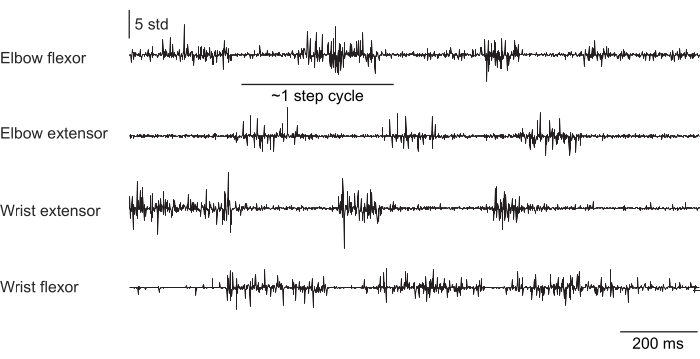
図2:トレッドミル上を歩く自由に動く(頭に固定されていない)マウスの4つの筋肉からの代表的なEMG記録。 合計時間は 1.5 秒です。ステップサイクルは、逐次肘伸筋の活性化間の時間から推定されました。 この図の拡大版を表示するには、ここをクリックしてください。
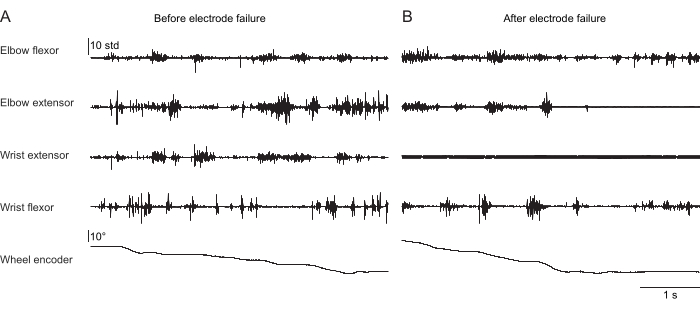
図3:自然な上昇行動を行う頭部固定マウスの4つの筋肉からの代表的なEMG記録。 5行目 は、ロータリーエンコーダーによって読み取られたクライミングホイールの位置を示しています。この値の変化は、ホイールが回転し、動物がアクティブに登っていることを示します。合計持続時間は5秒です。(A)クライミング中に移植後36日で記録します。(B)手首伸筋電極が故障した後、同じマウスに移植されてから72日後に記録します。 この図の拡大版を表示するには、ここをクリックしてください。
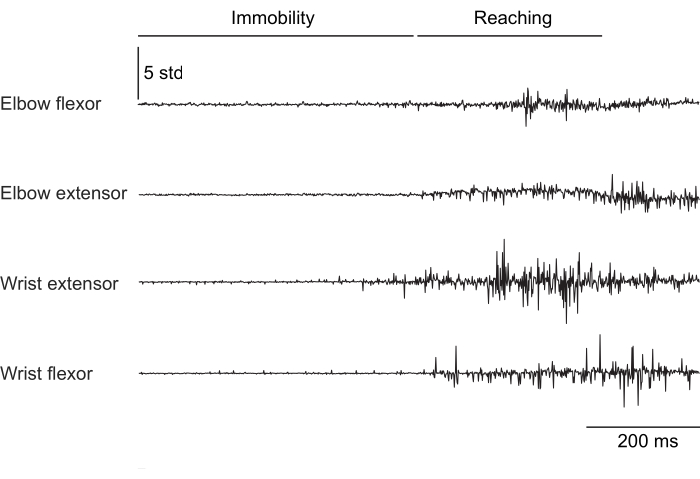
図4:頭部固定マウスの4つの筋肉が動かない状態から到達動作に移行するまでの代表的な筋電図記録。 合計時間は 1 秒です。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
このプロトコルにより、頭部固定マウスから数週間にわたってさまざまな行動をとる安定した筋活動の記録が可能になります。最近、この方法は、トレッドミルでの移動18,20、ジョイスティックを引くタスク18、および共収縮タスク21などの行動中の四肢の筋肉組織の神経制御を調べるために採用されている。ここで説明するプロトコルはマウスの肘と手首の筋肉に特異的ですが、電極ペアの長さおよび/または総数を変更することにより、異なる筋肉または異なる数の筋肉から記録するように簡単に変更できます。ここで述べる方法は、ヘッドレスト15,16,17のないマウスにおける前肢および後肢の筋肉活動を記録するために以前に使用されたものから適応された。
電極の作製は、習得するためにかなりの練習が必要です。学習中は、毎日1〜2時間の練習をお勧めします。電極の剥がしは、基礎となるワイヤを損傷することなく絶縁体を切断するために必要な正確なレベルの力のため、最も困難なステップです。この力の程度は刃の切れ味に依存するため、メスの刃を頻繁に交換することで、学習中の再現性を確保することができます。ステンレス鋼は容易にはんだ付けしないため、コネクタの真鍮ブレードにワイヤをはんだ付けすることも難しい場合があります。ステンレス適合フラックスをたっぷりと塗布することで、接続が促進されます。
移植手術中の主な課題は、埋め込まれたワイヤーや近位の結び目を乱さずに遠位結び目を結ぶことです。近位の結び目は、挿入部位の筋肉に滑り込むのを防ぐのに十分な大きさでなければなりません-したがって、電極セット製造のステップ2で結び目をきつく結びすぎないようにしてください。移植後に近位結び目が移動する場合は、カーボンファイバー製の先端の鉗子を使用して慎重に再配置します。電極全体が引っ張られないように、鉗子でワイヤーをしっかりと握ったまま、遠位結び目をゆっくりと締めます。このステップは、埋め込まれた電極の寿命を確保するために重要です:電極に過度の張力がかかると、動物が動くときに電極が壊れる可能性があります。一方、緩んだ電極は回復中に移動し、組織が治癒するにつれて関連する筋肉との接触を失う可能性があります。
動物は手術から驚くほどよく回復しますが、注意すべき潜在的な合併症があります。まず、マウスは機会があれば縫合糸と電極を噛みます。エリザベス朝の首輪はこれを防ぎますが、動物が自分で毛づくろいをするのも防ぎます。一部のマウスは、目の周りに粘液のような蓄積を発達させます。時折、雄のマウス、特に高齢のマウスは、動物に苦痛を与える可能性のある尿道閉塞を経験します。縫合糸を検査する前に、動物が毎日20分間自分で毛づくろいをすることを許可すると、動物はこれらの問題を防ぐのに十分な時間を与える必要があります。
この方法には、注意すべき重要な制限があります。まず、これらのカスタム電極は、一般に、単一のモーターユニットの活動を解決できません。さらに、電気信号は、近くの相乗筋の活動によるクロストークを排除することが難しいため、特定の筋肉(つまり、上腕二頭筋)からのみ発せられることを保証するものではありません。したがって、出版物では、研究者は通常、記録された筋肉を相乗作用グループ(つまり、肘屈筋)で参照します。各実験後に死後解剖を行い、各電極の位置を確認することをお勧めします。これは、回復中に組織内で移動する可能性があるためです。
単一の運動単位の活動に関心のある研究者は、エモリー大学のCenter for Advanced Motor Bioengineering Research(CAMBER)によって新しく開発されたEMG電極を試すことを検討する必要があります。これらの電極はまだ開発途上ですが、CAMBERは最新の電極設計を提供します。これらの電極の主な欠点は寿命です:このプロトコルに記載されている手作りの電極は、一般に数週間の記録を可能にしますが、CAMBER電極は短期間の実験に最適です。EMG記録法を選択した研究者は、CAMBERに直接連絡して、電極が特定の実験に適しているかどうかを判断できます。
開示事項
何一つ。
謝辞
著者らは、この方法の開発に貢献したClaire Warriner博士に感謝します。マーク・アグリオスとサジシュヌ・サヴィヤはフィギュアの準備を手伝いました。この研究は、Searle Scholar Award、Sloan Research Fellowship、Simons Collaboration on the Global Brain Pilot Award、Whitehall Research Grant Award、The Chicago Biomedical Consortium with the Searle Funds at The Chicago Community Trust、NIH grant DP2 NS120847 (A.M.)、NIH grant 2T32MH067564 (A.K.)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| #11 Scalpel Blades | World Precision Instruments | 504170 | For EMG electrode fabrication |
| #3 Scalpel Handle | Fine Science Tools | 10003-12 | For EMG electrode fabrication |
| 1 mL Sub-Q Syringe (100 pack) | Becton Dickinson | 309597 | For administering injectable drugs |
| 12-pin connector | Newark | 33AC2371 | 12-pin connector with brass fittings; for EMG electrode fabrication |
| 18 G Needles | Exel International | 26419 | For EMG electrode fabrication |
| 27 G Needles | Exel International | 26426 | For EMG electrode fabrication |
| 3 M Transpore Surgical Tape | 3M | 1527-0 | For taping animal's limbs out during surgery |
| 6-0 silk sutures | Henry Schein | 101-2636 | These sutures work well with delicate skin around the wrists |
| C&B Metabond Complete Kit | Pearson Dental | P16-0126 | Dental cement to affix connector to headplate |
| C57BL6/J Mice | Jackson Laboratories | #000664 | Wild type mice |
| Carbofib 5-CF Tweezers (2) | Aven tools | 18762 | Carbon fiber tipped forceps, used to manipulate delicate parts of electrode (stripped or inserted sections) |
| Carprodyl (Carprofen) 50 mg/mL Injection | Ceva Animal Health, LLC | G43010B | Injectable analgesic for pain management during and after surgery |
| Castroviejo Micro Needle Holder | Fine science tools | 12060-01 | For suturing |
| Castroviejo Needle Holder (large) | Fine science tools | 12565-14 | For inserting needle into muscle |
| Delicate Bone Scraper | Fine science tools | 10075-16 | To separate skin from underlying tissue |
| Dietgel 76A Dietary Supplement | Clear H2O | 72-07-5022 | For post-operative care |
| Dumont #5/45 Forceps | Fine science tools | 11251-35 | To remove fascia overlying muscle |
| Elizabethan collar for mouse | Kent Scientific Corporation | EC201V-10 | For post-operative care |
| Enrofloxacin 2.27% | Covetrus | #074743 | Injectable antibiotic for use during and after surgery |
| Epoxy gel | Devcon | 14265 | For EMG electrode fabrication |
| Hopkins Bulldog Clamp (4) | Stoelting | 10-000-481 | Tissue clamps for headplate implantation |
| Isoflurane Solution | Covetrus | 11695067771 | Inhalable anesthesia |
| Lidocaine Hydrochloride Injectable - 2% | Covetrus | #002468 | Topical analgesic for pain management during surgery |
| Medical Grade Oxygen | Airgas | OX USP200 | For administering isoflurane during surgery |
| MetriCide 1 Gallon | Metrex | 10-1400 | Glutaraldehyde solution for cold-sterilization of headplate and electrodes |
| MetriTest Strips 1.5% | Metrex | 10-303 | Test strips for monitoring glutaraldehyde solution (recommended) |
| Model 900LS Small Animal Stereotaxic Instrument | Kopf Instruments | 900LS | Stereotax with lazy susan feature that allows platform rotation during surgery |
| PFA-coated 0.0055" braided stainless steel wire | A-M systems | 793200 | For EMG electrode fabrication |
| Povidone-iodine prep pads | Dynarex | 1108 | For cleaning skin |
| Puralube Vet Ointment | Dechra | 37327 | Eye ointment for surgery |
| Sterile alcohol prep pads | Dynarex | 1113 | For cleaning skin |
| Straight fine #5 forceps | Fine science tools | 11295-10 | For curling wire after insertion |
| Straight fine scissors | Fine science tools | 14060-11 | For cutting wire |
| Student Vannas Spring Scissors | Fine science tools | 91500-09 | For making incisions, trimming fat and fascia, and suturing |
| Technik Tweezers 7B-SA (2) | Aven tools | 18074USA | Curved blunt forceps, for general use during surgery |
| Triple Antibiotic Ointment | Walgreens | 975863 | Topical antibiotic for surgery |
| V-1 Tabletop Laboratory Animal Anesthesia System | VetEquip | 901806 | Contains all necessary equipment for anesthesia induction and scavenging including vaporizer, induction chamber, moveable plastic nose cone, and tubing |
参考文献
- Dombeck, D. A., Khabbaz, A. N., Collman, F., Adelman, T. L., Tank, D. W. Imaging large scale neural activity with cellular resolution in awake mobile mice. Neuron. 56 (1), 43-57 (2007).
- Guo, Z. V., et al. Flow of cortical activity underlying a tactile decision in mice. Neuron. 81 (1), 179-194 (2014).
- Guo, J. Z., et al. Cortex commands the performance of skilled movement. eLife. 4, e10774 (2015).
- Morandell, K., Huber, D. The role of forelimb motor cortex areas in goal directed action in mice. Sci Rep. 7 (1), 15759 (2017).
- Galiñanes, G. L., Bonardi, C., Huber, D. Directional reaching for water as a cortex-dependent behavioral framework for mice. Cell Rep. 22 (10), 2767-2783 (2018).
- Evarts, E. V., Tanji, J. Reflex and intended responses in motor cortex pyramidal tract neurons of monkey. J Neurophysiol. 39 (5), 1069-1080 (1976).
- Hounsgaard, J., Hultborn, H., Jespersen, B., Kiehn, O. Bistability of alpha-motoneurones in the decerebrate cat and in the acute spinal cat after intravenous 5-hydroxytryptophan. J Physiol. 405, 345-367 (1988).
- Murphy, P. R., Hammond, G. R. The role of cutaneous afferents in the control of gamma-motoneurones during locomotion in the decerebrate cat. J Physiol. 434, 529-547 (1991).
- Manuel, M., Chardon, M., Tysseling, V., Heckman, C. J. Scaling of motor output, from mouse to humans. Physiol Bethesda Md. 34 (1), 5-13 (2019).
- Sauerbrei, B. A., et al. Cortical pattern generation during dexterous movement is input-driven. Nature. 577 (7790), 386-391 (2020).
- Barrett, J. M., Raineri Tapies, M. G., Shepherd, G. M. G. Manual dexterity of mice during food-handling involves the thumb and a set of fast basic movements. PLoS One. 15 (1), e0226774 (2020).
- Serradj, N., et al. Task-specific modulation of corticospinal neuron activity during motor learning in mice. Nat Commun. 14, 2708 (2023).
- Scholle, H. C., et al. Spatiotemporal surface EMG characteristics from rat triceps brachii muscle during treadmill locomotion indicate selective recruitment of functionally distinct muscle regions. Exp Brain Res. 138 (1), 26-36 (2001).
- Scholle, H. C., et al. Kinematic and electromyographic tools for characterizing movement disorders in mice. Mov Disord off J Mov Disord Soc. 25 (3), 265-274 (2010).
- Pearson, K. G., Acharya, H., Fouad, K. A new electrode configuration for recording electromyographic activity in behaving mice. J Neurosci Methods. 148 (1), 36-42 (2005).
- Akay, T., Acharya, H. J., Fouad, K., Pearson, K. G. Behavioral and electromyographic characterization of mice lacking EphA4 receptors. J Neurophysiol. 96 (2), 642-651 (2006).
- Akay, T., Tourtellotte, W. G., Arber, S., Jessell, T. M. Degradation of mouse locomotor pattern in the absence of proprioceptive sensory feedback. Proc Natl Acad Sci USA. 111 (47), 16877-16882 (2014).
- Miri, A., et al. Behaviorally selective engagement of short-latency effector pathways by motor cortex. Neuron. 95 (3), 683-696 (2017).
- Osborne, J., Dudman, J. RIVETS: A mechanical system for in vivo and in vitro electrophysiology and imaging. PloS One. 9 (2), e89007 (2014).
- Santuz, A., Laflamme, O. D., Akay, T. The brain integrates proprioceptive information to ensure robust locomotion. J Physiol. 600 (24), 5267-5294 (2022).
- Warriner, C. L., Fageiry, S., Saxena, S., Costa, R. M., Miri, A. Motor cortical influence relies on task-specific activity covariation. Cell Rep. 40, 111427 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved