Method Article
Aufzeichnung der Muskelaktivität der Vordergliedmaßen bei Mäusen mit fixiertem Kopf mit chronisch implantierten EMG-Elektroden
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die manuelle Herstellung und chirurgische Implantation von elektromyographischen (EMG) Elektroden in die Vordergliedmaßenmuskulatur von Mäusen, um die Muskelaktivität während kopffixierter Verhaltensexperimente aufzuzeichnen.
Zusammenfassung
Leistungsfähige genetische und molekulare Werkzeuge, die in der neurowissenschaftlichen Forschung zu Maussystemen zur Verfügung stehen, haben es Forschern ermöglicht, die Funktion des motorischen Systems mit beispielloser Präzision bei Mäusen mit fixiertem Kopf zu untersuchen, die eine Vielzahl von Aufgaben ausführen. Die geringe Größe der Maus erschwert die Messung der motorischen Leistung, da die traditionelle Methode der elektromyographischen (EMG) Aufzeichnung der Muskelaktivität für größere Tiere wie Katzen und Primaten konzipiert wurde. In Erwartung der kommerziell verfügbaren EMG-Elektroden für Mäuse besteht die derzeitige Goldstandardmethode zur Aufzeichnung der Muskelaktivität bei Mäusen darin, Elektrodensätze im eigenen Haus herzustellen. Dieser Artikel beschreibt eine Verfeinerung der etablierten Verfahren für die manuelle Herstellung eines Elektrodensets, die Implantation von Elektroden in der gleichen Chirurgie wie die Implantation der Kopfplatte, die Fixierung eines Verbindungsstücks auf der Kopfplatte und die postoperative Genesungsversorgung. Nach der Wiederherstellung können EMG-Aufzeichnungen mit Millisekundenauflösung über mehrere Wochen hinweg ohne merkliche Veränderungen der Signalqualität aufgenommen werden, wenn der Kopf fixiert ist. Diese Aufzeichnungen ermöglichen eine präzise Messung der Muskelaktivität der Vordergliedmaßen neben in vivo neuronaler Aufzeichnung und/oder Störung, um Mechanismen der motorischen Kontrolle bei Mäusen zu untersuchen.
Einleitung
In den letzten Jahrzehnten haben sich Mäuse zu einem attraktiven Modellorganismus für die Erforschung des motorischen Systems von Säugetieren entwickelt. Gängige experimentelle Ansätze beinhalten kopffixierte Mäuse, die motorische Aufgaben ausführen und gleichzeitigdie neuronale Aktivität überwachen und/oder stören 1,2,3,4,5. Studien zum motorischen System an größeren Spezies (wie Katzen und Primaten) haben sich traditionell auf die Elektromyographie (EMG) gestützt, um die motorische Leistung direkt während solcher Experimente zu messen 6,7,8. Die Aufzeichnung der Muskelaktivität bei Mäusen ist jedoch eine Herausforderung, da ihre Muskulatur zu klein für kommerziell erhältliche EMG-Elektroden ist, die in Experimenten mit großen Säugetieren verwendet werden9. Viele Forscher entscheiden sich dafür, die Kinematik der Gliedmaßen durch Video 4,10,11 und/oder Verhaltensleistung 2,4,12 zu verfolgen, um die motorische Leistung indirekt zu untersuchen, aber diesen Methoden fehlt die Auflösung, um den Einfluss der neuronalen Aktivität und deren Störung auf die Muskeln auf der Millisekunden-Zeitskala zu erfassen. Daher ist die Aufzeichnung von EMG für Forscher wünschenswert, die an der direkten neuronalen Steuerung von Muskeln interessiert sind.
Bei der EMG wird die Spannung zwischen zwei Punkten gemessen, die in der Regel durch einen kurzen Abstand getrennt sind, der ungefähr parallel zu den Fasern des aufgezeichneten Muskels verläuft. EMG-Elektroden gibt es in Oberflächen- (oder "Patch") und intramuskulären (oder "Nadel"-) Varianten. Oberflächenelektroden werden auf der Haut platziert oder über das Muskelgewebe gelegt und mit Klebstoff oder Nähten gesichert. Daher sind Oberflächenelektroden weniger invasiv als intramuskuläre Elektroden und aufgrund ihrer relativen Benutzerfreundlichkeit bei Menschen, Katzen und Primaten am beliebtesten. Oberflächenelektroden wurden auch erfolgreich bei Ratten und Mäusen eingesetzt 13,14; Sie müssen jedoch von Hand hergestellt und chirurgisch unter die Haut implantiert werden, da Nagetiere dazu neigen, während der Fellpflege zu versuchen, Fremdkörper zu entfernen. Intramuskuläre EMG-Elektroden hingegen werden chirurgisch in das Muskelgewebe implantiert. Da sie von Muskelgewebe umhüllt sind, bieten sie eine hohe räumliche Auflösung und bleiben auf unbestimmte Zeit in ihrer Position fixiert. Daher eignen sich implantierte intramuskuläre EMG-Elektroden ideal über Oberflächenelektroden für Langzeitexperimente mit Nagetieren. Um das intramuskuläre EMG bei Mäusen zuverlässig aufzuzeichnen, haben Forscher eine Methode entwickelt, mit der EMG-Elektroden von Hand hergestellt und in Muskeln implantiert werden können, die so klein sind wie die im Unterarm einer erwachsenen Maus. Diese Elektroden ermöglichen eine chronische Muskelaufzeichnung während des motorischen Verhaltens bei Nagetieren über mehrere Wochen.
Das hier beschriebene Protokoll ist das Ergebnis einer jahrzehntelangen Verfeinerung der etablierten Methoden 15,16,17,18, die ein Verfahren zur manuellen Herstellung, Implantation und Aufzeichnung von Draht-EMG-Elektroden hervorgebracht hat, die chronisch in Beuge-/Streckmuskelpaaren des Ellbogens und des Handgelenks bei sich verhaltenden Mäusen implantiert wurden. Der erste Abschnitt beschreibt die manuelle Herstellung eines Elektrodensatzes mit vier Elektrodenpaaren und einem 8-poligen Stecker für die Kopftischschnittstelle. Der nächste Abschnitt beschreibt die chirurgische Implantation der Elektroden intramuskulär in die Ober- und Unterarmmuskulatur in der gleichen Operation wie die Kopfplattenimplantation. Abschließend werden repräsentative Aufzeichnungen von Mäusen diskutiert, die eine Vielzahl von Verhaltensweisen ausführen. Insgesamt ist diese Methode eine kostengünstige und anpassbare Möglichkeit, Muskelaktivitätsmessungen in kopffeste Verhaltensexperimente einzubeziehen, die ideal für Labore mit etwas Erfahrung in der Elektrodenherstellung ist.
Protokoll
Alle Experimente und Verfahren wurden gemäß den NIH-Richtlinien durchgeführt und vom Institutional Animal Care and Use Committee der Northwestern University genehmigt. Andere Länder und/oder Institutionen können andere Vorschriften haben, die Änderungen an diesem Verfahren erfordern. Bei den in die vorliegende Studie eingeschlossenen Tieren handelte es sich um erwachsene männliche Tiere mit C57BL6/J (siehe Materialtabelle) im Alter von 12 bis 20 Wochen mit einem Mindestkörpergewicht von 20 g.
1. Herstellung des Elektrodensatzes
HINWEIS: Führen Sie diese Schritte auf einem sauberen Tischgerät mit einem Stereomikroskop mit einem Vergrößerungsbereich von 10x bis 40x und sauberen, bloßen Händen durch. In Abbildung 1 finden Sie Diagramme, in denen das Abisolieren von Elektrodendrähten (Abbildung 1A) und die Steckverbindermontage (Abbildung 1B) beschrieben sind.
- Drähte schneiden: Schneiden Sie für jedes Elektrodenpaar zwei Stücke PFA-beschichteten geflochtenen Edelstahldraht (7-adrig, 0,0055" Durchmesser) ab (siehe Materialtabelle). Für die Oberarmmuskulatur jeden Draht 9,5 cm lang abschneiden. Für die Unterarmmuskulatur jeden Draht 10,5 cm lang abschneiden.
- Binden Sie die beiden Drähte mit einem einzigen Knoten zusammen - dies wird bei der Implantation zu dem Knoten, der direkt außerhalb der Einstichstelle (proximaler Knoten) sitzt. Die gebundenen Drähte bestehen aus einem Elektrodenpaar.
- Positionieren Sie den Knoten mit einer 18-G-Nadel, die in ein Stück Wellpappe gesteckt wird, 6 cm vom Einstichende entfernt und ziehen Sie ihn um die Nadel fest, indem Sie die Elektrodenstränge gegen den Karton ziehen. Das Einsteckende schrumpft auf ca. 5,5 cm, die restlichen 0,5 cm werden im Knoten zusammengebunden.
- Entfernen Sie vorsichtig die Nadel und ziehen Sie den Knoten mit bloßen Händen zweimal fest, um ihn weiter zu festziehen.
HINWEIS: Der Knoten sollte nicht so fest wie möglich sein; Wenn Sie auf diese Weise festziehen, entsteht ein proximaler Knoten, der die richtige Größe hat, um die implantierten Elektroden im Gewebe zu verankern. - Achten Sie bei der Oberarmmuskulatur darauf, dass die Verbindungsenden 3,5 cm lang sind. Achten Sie bei der Unterarmmuskulatur darauf, dass die Verbindungsenden 4,5 cm lang sind.
- Entfernen Sie 0,5 mm Isolierung von jedem Draht: 1-1,5 mm vom Knoten an einem Draht und 2-2,5 mm vom Knoten an dem anderen Draht. Abbildung 1 zeigt, wo die einzelnen Drähte abisoliert werden müssen.
- Kleben Sie die Elektrode straff gegen ein Stück flache Pappe, wobei die beiden Enddrähte des Steckers zusammengesteckt und die Einführenddrähte auseinander gespreizt sind.
- Machen Sie mit einem Skalpell Kerben in die Isolierung und markieren Sie die Enden, an denen die Isolierung entfernt wird.
- Machen Sie an jeder Kerbe eine Reihe von ~6 Schnitten mit einer Skalpellklinge: ~2 oben, ~2 an der Seite und ~2 unter dem Draht.
HINWEIS: Es ist wichtig, den Draht selbst nicht zu stark zu durchschneiden. Andernfalls können die Strähnen reißen. Es ist Übung erforderlich, um den richtigen Druck zu erreichen, um die Isolierung vollständig zu durchtrennen und den Draht nur begrenzt zu beschädigen. - Drehen Sie das Elektrodenpaar um 180 Grad und wiederholen Sie die 6 Schnitte in jeder Kerbe.
- Platzieren Sie bei Bedarf zusätzliche Schnitte, um die 0,5 mm Isolierung vom darunter liegenden Draht zu trennen. Die Anzahl der Schnitte, die hier benötigt werden, hängt vom ausgeübten Druck und der Schärfe der Skalpellklinge ab.
- Winkeln Sie die Skalpellklinge so an, dass sie in Längsrichtung entlang der gelösten Isolierung schneidet, und entfernen Sie sie mit einer Pinzette vom Draht.
- Überprüfen Sie den freiliegenden Draht auf Bruch und/oder ausgefranste Isolierung, die beim Einführen in das Gewebe Schäden verursachen könnten.
- Ziehen Sie 1 mm vom Ende jedes Drahtes am Steckerende ab.
- Ziehen Sie das Ende jedes Drahtes am Einsteckende 5 mm ab.
- Verdrehen Sie die Einsteckenddrahtsegmente zusammen und crimpen Sie die 5 mm freiliegenden Enden in der Welle eines 0,5 Zoll zusammen. 27 G Nadel. Typische Injektionsnadeln können nach dem Entfernen des Luer-Lock-Endes verwendet werden.
- Wiederholen Sie die Schritte 1.1-1.6 für jedes Elektrodenpaar.
- Montieren Sie den Stecker.
- Schneiden Sie die Buchse des 12-poligen Steckers (siehe Materialtabelle) auf die Größe zu: # Elektrodenpaare x 2 Stiftschlitze.
- Entfernen Sie die Messingverschraubungen von jedem Steckeranschluss (diese sind bereits am 12-poligen Stecker befestigt) vorsichtig mit einer Zange. Speichern Sie diese Formstücke für den nächsten Schritt.
- Löten Sie jedes 1 mm freiliegende Ende jedes Drahtes an die Außenfläche einer der Klingen einer Messingarmatur.
VORSICHT: Beim Löten werden Dämpfe freigesetzt, die Haut-, Augen- und Atemwegsreizungen verursachen können. Tragen Sie Handschuhe (oder waschen Sie sich danach die Hände), verwenden Sie einen Augenschutz und verwenden Sie ein lokales Rauchabsauggerät, um die Exposition zu begrenzen.- Befestigen Sie den Messingbeschlag in einer zahnlosen Krokodilklemme, die mit der Außenseite einer seiner Klingen nach oben an einem helfenden Handwerkzeug befestigt ist.
- Positionieren Sie die Armatur unter dem Mikroskop, um eine hohe visuelle Kontrolle während des Lötens zu ermöglichen. Tupfen Sie mit einer entfalteten Büroklammer oder einem Stück Drahtschrott eine kleine Menge Edelstahl-kompatibles Flussmittel auf die Oberfläche der Klinge.
- Tragen Sie so viel Lötzinn auf die Klinge auf, dass die unteren ~1,5 mm der Messingklinge mit einer schmalen konischen Lötspitze bedeckt sind.
HINWEIS: Zu viel Lot beeinträchtigt hier die Steckverbindermontage, während zu wenig Lot eine unzureichende Verbindung hinterlassen kann. Halten Sie zusätzliche Messingbeschläge bereit, um bei Bedarf von vorne zu beginnen. - Beschichten Sie die Oberfläche des Lötmittels auf der Klinge großzügig mit Edelstahl-kompatiblem Flussmittel, aber vermeiden Sie es, dass Flussmittel in den Raum zwischen den beiden Klingen tropft.
- Halten Sie den 1 mm freiliegenden Elektrodendraht bündig gegen das Lot auf der Klinge und erhitzen Sie das Lot mit dem Bügeleisen, um die Verbindung zu verschmelzen.
- Überprüfen Sie die Verbindung: Der größte Teil des freiliegenden Drahtes sollte in das Lot eingetaucht sein, und der Draht sollte fest mit der Messingverschraubung verbunden sein. Stellen Sie sicher, dass kein Lötzinn zwischen die beiden Klingen der Messingverschraubung gelangt ist - dies könnte das spätere Einstecken eines Steckers erschweren. Stellen Sie abschließend sicher, dass die Verbindung bündig mit der Messingklinge abschließt, damit die Armatur im nächsten Schritt wieder in den Verbinder eingesetzt werden kann.
- Setzen Sie mit einer geraden Pinzette jede gelötete Messingverschraubung wieder in den Stecker ein und stellen Sie sicher, dass die Drähte jedes Elektrodenpaares nebeneinander liegen und sich nicht mit anderen Elektrodenpaaren verheddern. In Abbildung 1B sehen Sie die Ausrichtung eines einzelnen Elektrodenpaares im Steckverbinder.
HINWEIS: Die ideale Ausrichtung von links nach rechts ist: Bizeps (3,5 mm am Konnektorende), Trizeps (3,5 mm am Konnektorende), Extensor carpi radialis (ECR; 4,5 mm am Konnektorende) und Palmaris longus (PL; 4,5 mm am Konnektorende). Markieren Sie eine Seite mit einem Marker oder White-Out, um die Ausrichtung des Konnektors während der Implantation zu verfolgen. - Schneiden Sie einen 12-poligen Stecker auf die gleiche Größe (# Elektrodenpaare x 2) wie die Buchse ab und verbinden Sie ihn mit der Buchse. Werden Verschraubungen verschoben, können diese nach dem Aufsetzen des Steckers mit einer geraden Pinzette wieder eingesetzt werden.
- Entfernen Sie die Laschen, die von Messingbeschlägen ausgehen, mit einer Zange.
- Beschichten Sie die Stiftschlitze mit Epoxidharz und stellen Sie sicher, dass alle Metalle oder Drähte in der Nähe des Steckers vom Gewebe isoliert sind.
VORSICHT: Epoxidharz kann bei längerer Exposition Haut-, Augen- und Atemwegsreizungen verursachen. Tragen Sie Handschuhe, Augenschutz und verwenden Sie Epoxidharz nur in einem gut belüfteten Bereich oder unter einem örtlichen Rauchabsauggerät. - Lassen Sie den Verbinder mindestens 30 Minuten an der Luft trocknen.
- Testen Sie den Widerstand jedes Elektrodenpaares und markieren Sie die Nadeln mit kleinen farbigen Schrumpfsegmenten, um sie während der Operation leicht zu identifizieren.
HINWEIS: Der Widerstand sollte zwischen 18 und 50 Ohm liegen. Ein niedrigerer Widerstand kann auf einen Kurzschluss hinweisen. Ein höherer Widerstand kann auf eine zu starke Beschädigung der Drahtlitzen hinweisen. Ein hoher Widerstand entsteht jedoch häufig durch eine unvollkommene Verbindung zwischen dem Nadelschaft und dem Draht (hergestellt in Schritt 1.6), die durch zusätzliches Crimpen an dieser Verbindungsstelle behoben werden kann. - Stellen Sie vor der Implantation sicher, dass das Elektrodenset frei von Fasern und anderen Ablagerungen ist. Hierfür kann ein Sprühstaubwedel verwendet werden. Eine Inspektion unter dem Mikroskop kann hilfreich sein, um dies zu überprüfen.
2. Elektrodenimplantation
HINWEIS: In diesem Abschnitt wird ein einzelner chirurgischer Eingriff beschrieben, bei dem eine Kopfplatte und Elektroden, die im vorherigen Abschnitt hergestellt wurden, in den Trizeps, den Bizeps, den Streckknochen (ECR) und den Palmaris longus (PL) implantiert werden. Für die beiden letztgenannten Muskeln ist es sehr schwierig, die Elektrode ausschließlich in diese einzelnen Muskeln zu implantieren, ohne durch nahe gelegene synergistische Muskeln zu gehen. Siehe die folgende Diskussion über die Vorbehalte beim Versuch, Aufzeichnungen von einzelnen Muskeln zu isolieren. Kopfplatten werden in der Regel speziell für bestimmte Experimente entwickelt und hergestellt. In der vorliegenden Studie wurden 3D-gedruckte NIVETS-Kopfplattenaus Kunststoff 19 verwendet. Viele Open-Source-Kopfplattendesigns sind online über Janelia, das Allen Institute und unabhängige Forschungsgruppen verfügbar. Das hier beschriebene Kopfplattenverfahren wurde erfolgreich bei Kopfplatten aus Titan und Kunststoff angewendet. Der chirurgische Eingriff muss an einem stereotaktischen Instrument (siehe Materialtabelle) mit einem Stereomikroskop mit einer 10- bis 40-fachen Vergrößerung durchgeführt werden.
- Sterilisieren Sie die Elektroden und die Kopfplatte über Nacht oder 8 Stunden lang mit 1,5 % Glutaraldehyd kalt. Vor der Implantation kurz in sterilem Wasser abspülen und vollständig an der Luft trocknen lassen.
ACHTUNG: Glutaraldehyd ist schädlich, wenn es verschluckt wird, und kann Augen, Haut und Atemwege reizen. Griff mit Handschuhen in einem belüfteten Abzug. - Induzieren Sie eine Anästhesie mit 2-4% Isofluran in medizinischem Sauerstoff in einer Induktionskammer bis zum Verlust des Aufrichtreflexes (ca. 3 min) gemäß den institutionell anerkannten Protokollen.
- Bringen Sie das Tier in den beweglichen Nasenkonus, um weiterhin Anästhesie zu erhalten. Unter Narkose mit 2 % Isofluran in medizinischem Sauerstoff den Kopf, den Hals und die Gliedmaßen des Tieres vor der Operation rasieren. Führen Sie alle verbleibenden Schritte in diesem Abschnitt unter Narkose durch. Passen Sie die Dosierung von Isofluran nach Bedarf an, um eine Atemfrequenz von 1 Hz und das Fehlen eines Zehenquetschreflexes aufrechtzuerhalten.
- Tragen Sie Augenschmiermittel auf und tragen Sie es während der gesamten Operation alle 1 Stunde erneut auf.
- Verabreichen Sie zu Beginn der Operation injizierbare Analgetika (wie Carprofen, 5 mg/kg) und Antibiotika subkutan (wie Enrofloxacin, 10 mg/kg) (siehe Materialtabelle).
- Implantieren Sie die Kopfplatte mit den folgenden Schritten oder einer alternativen, von der Einrichtung zugelassenen Methode.
- Befestigen Sie den Kopf des Tieres in Ohrstangen auf dem stereotaktischen Instrument und führen Sie eine Anästhesie (2 % Isofluran) durch den Nasenkonus durch, der am stereotaktischen Instrument befestigt ist. Fügen Sie ein steriles Tuch hinzu, um die Asepsis zu erhalten.
- Reinigen Sie Kopf und Hals mit Povidon-Jod-Vorbereitungspads und sterilen Alkohol-Vorbereitungspads.
Tragen Sie bei Bedarf erneut Augenschmiermittel auf. - Lidocain (4 mg/kg) (siehe Materialtabelle) subkutan an der Inzisionsstelle injizieren.
- Stellen Sie eine ausreichende Narkoseeinleitung sicher, indem Sie eine Zehenklemme durchführen. Wenn der Aufrichtreflex nicht vorhanden ist, machen Sie einen Schnitt entlang der Mittellinie des Kopfes des Tieres vom kaudalen Rand der Augen bis zum kaudalen Rand der Ohren.
- Klemmen Sie die Haut mit Gewebeklammern heraus: zwei am rostralen Rand auf jeder Seite direkt hinter den Augen und zwei am kaudalen Rand direkt hinter den Ohren.
- Reinigen Sie die Schädeloberfläche, indem Sie vorsichtig mit einer Skalpellklinge abkratzen, um getrocknete Faszien zu entfernen.
- Tragen Sie eine dünne Schicht Zahnzement (siehe Materialtabelle) auf die Oberfläche des Schädels auf und lassen Sie ihn 5 Minuten trocknen.
- Positionieren Sie die Kopfplatte auf dem Schädel des Tieres. Wie und wo die Kopfplatte implantiert wird, hängt von der Kopfplatte und der Forschungsfrage ab.
- Verwenden Sie Zahnzement, um die Kopfplatte auf den Schädel zu kleben. Stellen Sie sicher, dass der Schädel vollständig bedeckt ist. Lassen Sie den Zahnzement 10 Minuten trocknen.
- Bringen Sie das Tier in einen beweglichen Nasenkonus aus Kunststoff, um für den Rest der Operation eine Anästhesie zu gewährleisten. Dies ermöglicht es, das Tier während der Operation regelmäßig neu zu positionieren, um auf verschiedene Muskeln zuzugreifen und gleichzeitig die Narkose aufrechtzuerhalten.
- Verlängern Sie den Schnitt am Nacken (der bei der Implantation der Kopfplatte gemacht wurde), so dass er 1 cm kaudal bis zu den Ohren reicht.
- Trennen Sie mit einem stumpfen Knochenschaber die Haut unter dem Halsschnitt vom darunter liegenden Gewebe, um einen Weg vom Halsschnitt zur Vordergliedmaße freizumachen, wo Elektroden implantiert werden.
- Befestigen Sie den EMG-Konnektor vorübergehend mit einem kleinen Stück Klebeband an der Kopfplatte, um ihn während der Elektrodenimplantation an Ort und Stelle zu halten.
- Reinigen Sie die Vordergliedmaßen des Tieres mit Povidon-Jod-Vorbereitungskissen und sterilen Alkohol-Vorbereitungspads.
- Machen Sie den Trizepsschnitt.
- Positionieren Sie das Tier mit dem Trizeps nach oben auf die Seite.
- Injizieren Sie Lidocain (4 mg/kg) an der geplanten Einschnittstelle. Dies lindert lokale Schmerzen und hält die Muskeln während der Implantation feucht.
HINWEIS: Die Muskeln sollten während der gesamten Operation feucht, aber nicht tropfnass bleiben. Tragen Sie sterile Kochsalzlösung nach Bedarf topisch auf, wenn Muskeln oder Haut trocken erscheinen. - Schneiden Sie 7 mm über den Trizeps parallel zum Knochen.
- Trennen Sie die Haut, die den Schnitt umgibt, mit dem stumpfen Knochenschaber vom darunter liegenden Gewebe. Arbeiten Sie den Schaber unter der Haut und zurück zum Halsschnitt, um einen Weg für die Elektroden freizumachen.
- Schneiden Sie alle Faszien ab, die den Muskel verdecken.
- Stellen Sie sicher, dass der Weg vom Hals zum Trizeps groß genug ist, indem Sie eine geschlossene Schere durch den Trizepsschnitt einführen und das Halsloch herausdrücken, das sich nach dem Verlassen des Lochs leicht öffnet.
- Bringen Sie die Trizepselektrode zum Trizepsschnitt: Führen Sie die Spitze des großen Nadeltreibers durch den Trizepsschnitt und aus dem Halsschnitt heraus. Klemmen Sie den Nadeltreiber der Länge nach um die Elektrodennadel und ziehen Sie ihn bis zum Trizepsschnitt durch.
- Einsetzen des Trizeps: Befolgen Sie Schritt 3 "Elektroden in die Muskeln einführen".
- Machen Sie den distalen Armschnitt.
- Positionieren Sie das Tier auf dem Rücken.
- Kleben Sie den Arm mit der Handfläche nach unten an der Seite des Tieres entlang.
- Injizieren Sie Lidocain (4 mg/kg) an der geplanten Einschnittstelle.
- Machen Sie einen 1 cm langen Schnitt über dem Bizeps und ECR von der Unterseite des Deltamuskels bis zur Mitte des Unterarms, parallel zum Knochen. Das distale Ende des Schnittes sollte ~2 mm über dem Ende der Unterarmmuskulatur liegen.
- Entfernen Sie die Faszien, um den Bizepsmuskel freizulegen.
- Machen Sie einen Weg vom distalen Armschnitt zurück zum Trizepsschnitt oberhalb (proximal) des großen Blutgefäßes, das unter der Haut des Oberarms verläuft, frei.
- Fädeln Sie die Bizepselektrode unter der Haut durch den Halsschnitt bis zum Trizepsschnitt ein, dann vom Trizepsschnitt zum distalen Armschnitt.
- Bizeps-Einführung: Befolgen Sie Schritt 3 "Elektroden in die Muskeln einführen".
- Kleben Sie den Arm des Tieres in der gleichen Position, aber mit der Handfläche nach unten, wieder fest.
- Führen Sie so nah wie möglich am proximalen Ende des freiliegenden Bizeps ein.
- Um mindestens 3 mm der Elektrode in das Muskelgewebe einzutauchen, stellen Sie sicher, dass Sie je nach Größe der Maus leicht diagonal zu den Muskelfasern einführen.
- Machen Sie einen Weg vom Trizepsschnitt zur distalen Armeinführungsstelle unterhalb (distal zu) dem großen Blutgefäß frei, das unter der Haut des Oberarms verläuft, und schaffen Sie einen Weg, der sich von dem der Bizepselektrode unterscheidet.
- ECR-Einführung: Befolgen Sie Schritt 3 "Elektroden in Muskeln einführen".
- In den proximalsten Teil des ECR einführen.
- Treten Sie in der Falte zwischen ECR und seinem Antagonisten aus und binden Sie den Knoten in dieser Falte.
- Machen Sie einen Weg vom Trizepsansatz zur PL-Einstichstelle unter dem Ellbogen frei.
- PL-Einführung: Befolgen Sie Schritt 3 "Elektroden in Muskeln einführen".
- Positionieren Sie das Tier auf dem Rücken und kleben Sie den Arm mit der Handfläche nach oben über den Kopf.
- Führen Sie es nur distal des Ellenbogens ein.
- Verlassen Sie die Sehnen ausreichend proximal zu den Sehnen des Handgelenks, so dass der Knoten an der Austrittsstelle auf dem Muskel und nicht auf den Sehnen des Handgelenks liegt.
- Positionieren Sie das Tier wieder auf die Seite und nähen Sie den Trizepsschnitt mit 6-0 Seidennähten.
- Positionieren Sie das Tier wieder auf dem Rücken und nähen Sie den distalen Armschnitt mit 6-0-Seidennähten.
- Befestigen Sie den Verbinder mit Zahnzement an der Rückseite der Kopfplatte.
- Vernähen Sie den Halsschnitt mit 6-0 Seidennähten.
- Tragen Sie topische antibiotische Creme auf die Inzisionsstellen auf, um Entzündungen zu reduzieren.
- Befestigen Sie ein elisabethanisches Halsband (siehe Materialtabelle) am Tier, um zu verhindern, dass es die Nähte während der Genesung stört.
3. Elektroden in die Muskeln einführen
- Die Nadel (27 G, Schritt 1) durch Biegen leicht krümmen.
- Halten Sie die Nadel mit dem Nadeltreiber fest (siehe Materialtabelle) und drücken Sie sie gegen den Griff einer Pinzette, um eine 5-10-Grad-Biegung hinzuzufügen.
- Fügen Sie insgesamt drei Biegungen an verschiedenen Positionen entlang der Länge der Nadel hinzu.
- Visualisieren Sie, wo Sie in den Muskel ein- und aussteigen müssen.
- Entfernen Sie Fett und Faszien, die die Ein- und Austrittsstelle verdecken, durch Schneiden oder Ziehen mit einer feinen Pinzette. Versuchen Sie, Gefäßschäden zu vermeiden, um Blutungen zu begrenzen.
- Zielen Sie auf 3-5 mm getauchten Draht, der parallel zu den Muskelfasern verläuft. Dadurch wird sichergestellt, dass die freiliegenden Abschnitte des Elektrodendrahtes in den Muskel eintauchen.
- Führen Sie die Nadel mit dem Nadeltreiber in das proximale Ende des Muskels ein, während Sie mit einer stumpfen gebogenen Pinzette in der anderen Hand einen Gegendruck ausüben. Schiebe die Nadel durch den Muskel zur Austrittsstelle.
- Sobald die Nadel aus dem Muskel austritt, greife die Spitze mit einer stumpfen Pinzette und ziehe die Nadel durch. Ziehe weiter, bis der proximale Knoten auf der Einstichstelle sitzt.
- Machen Sie den distalen Knoten.
- Binden Sie mit einer Pinzette einen losen Knoten distal an der Austrittsstelle. Den Knoten zu einer 1 cm Schlaufe festziehen.
- Schieben Sie die Schlaufe mit einer Pinzette und positionieren Sie sie über der Austrittsstelle.
- Visualisieren Sie, bis zu welcher Stelle der distale Knoten geschlossen werden sollte, bevor er vollständig festgezogen wird, etwa 0,5 mm distal zur Austrittsstelle. Fassen Sie die Schlaufe vorsichtig mit der fein gebogenen Pinzette an dieser Position und ziehen Sie die Schlaufe fest über Ihre Pinzette.
HINWEIS: Ziehen Sie den distalen Knoten in diesem Schritt nicht unmittelbar über der Austrittsstelle fest, da sonst der Muskel zusammengedrückt wird, wenn der Knoten im nächsten Schritt vollständig festgezogen wird. - Entfernen Sie die feine Pinzette aus dem Knoten und ziehen Sie den Knoten fest, indem Sie den Knoten mit der fein gebogenen Pinzette in Richtung Austrittsstelle schieben und mit den Fingern am Nadelende ziehen. Stellen Sie sicher, dass sowohl der proximale als auch der distale Knoten ordnungsgemäß außerhalb der Ein- bzw. Austrittsstelle positioniert sind, um die eingeführte Elektrode an Ort und Stelle zu verankern.
- Fassen Sie den Austrittsknoten mit einer geraden, feinen Pinzette und wickeln Sie den distalen Draht fest um die Pinzette, um den Draht um den Knoten herum und in Richtung Muskel / weg von der Haut zu biegen.
- Schneiden Sie den Draht 0,5 mm distal zum distalen Knoten ab und lassen Sie eine kleine Noppe um den Knoten herum.
Der vorherige Schritt stellt sicher, dass das abgeschnittene Ende des Noppens nicht in die Haut des Tieres eindringt, was zu Reizungen führen kann.
4. Nachsorge
- Führen Sie unmittelbar nach der Operation die folgenden Schritte durch.
- Bringen Sie das Tier einzeln unter, damit seine Käfiggenossen seine Nähte nicht stören.
- Setzen Sie das Tier in einen sauberen Käfig mit niedriger Einstreu. Entfernen Sie sämtliches Nestchen- und Anreicherungsmaterial, das die Beweglichkeit des Tieres beeinträchtigen könnte, während es das elisabethanische Halsband trägt.
- Geben Sie dem Tier Wasser und Nassfutter, an das es zugreifen kann, während es das Halsband trägt.
- Führen Sie die folgenden Schritte 24 h und 48 h nach der Operation durch.
- Entfernen Sie das elisabethanische Halsband, damit sich das Tier 20 Minuten lang selbst putzen kann.
- Induzieren Sie eine Anästhesie mit Isofluran, wie in Schritt 2.2 und Schritt 2.3 erwähnt.
- Verabreichen Sie injizierbare schmerzstillende und antibiotische Medikamente.
- Untersuchen Sie die Schnittstellen auf fehlende Nähte, offene Wunden und Anzeichen von Infektionen oder Reizungen. Ersetzen Sie die Nähte und wenden Sie bei Bedarf topischere Antibiotika an.
- Wechseln Sie das Nassfutter alle 48 Stunden, bis das elisabethanische Halsband entfernt ist.
- Führen Sie die folgenden Schritte 6 Tage nach der Operation durch.
- Überprüfen Sie die Wunden auf vollständige Heilung.
- Wenn Wunden verschlossen sind, entfernen Sie die Nähte. Wenn die Wunden offen sind, warten Sie noch zwei Tage, um die Nähte zu entfernen. Entfernen Sie den elisabethanischen Kragen, wenn die Nähte entfernt werden.
- Setzen Sie die Maus wieder in einen neuen, sauberen Käfig mit vollständiger Einstreu und Anreicherung ein.
HINWEIS: Die Tiere können 7 Tage nach der Operation zu Versuchen oder Wasserentzug übergehen.
Ergebnisse
Abbildung 2, Abbildung 3 und Abbildung 4 zeigen eine normalisierte Muskelaktivität, die von den Vordergliedmaßenmuskeln von Mäusen aufgezeichnet wurde, die unterschiedliche Verhaltensweisen ausführten: Laufbandlaufen ohne Kopffixierung (Abbildung 2), Klettern auf einem rotierenden Rad unter Kopffixierung (Abbildung 3) und Greifen nach Wassertropfen unter Kopffixierung (Abbildung 4). Abbildung 2 zeigt 1,5 s Fortbewegung auf dem Laufband mit einem ungefähren Schrittzyklus, der aus der Zeit zwischen zwei Ellbogenbeugeraktivierungen geschätzt wird. Abbildung 3 zeigt 5 s EMG-Daten von einem Tier, bei dem die Streckelektrode des Handgelenks 6 Wochen nach der Implantation versagte. In Abbildung 3A erzeugen alle vier Elektroden ein sauberes EMG-Signal, das sich an der Drehung des Rades orientiert (was das Klettern anzeigt). Abbildung 3B zeigt das Signal von denselben Elektroden nach dem Versagen: Die Streckelektrode des Handgelenks erzeugt ein verrauschtes Signal, das sich nicht mit der Bewegung des Tieres ändert. Abbildung 4 zeigt 1 s EMG von den vier Muskelgruppen der Vordergliedmaßen während einer Aufgabe, bei der die Maus von der Unbeweglichkeit zum Griff nach einem Wassertropfen überging.
In Abbildung 2, Abbildung 3 und Abbildung 4 wurden die Spannungssignale mit Hilfe eines Differenzverstärkers verstärkt und bandpassgefiltert (250-20.000 Hz).Die Rohspannung wurde dann auf 1 kHz subabgetastet und zum Vergleich zwischen den Datensätzen mit einem Z-Score bewertet. Beachten Sie nochmals, dass, obwohl Elektroden in die vier im Protokoll angegebenen Muskeln (Bizeps, Trizeps, ECR und PL) implantiert wurden, es nicht garantiert ist, dass benachbarte synergistische Muskeln das EMG-Signal nicht beeinflussen; Daher wird jede Aufnahme aus Gründen der Genauigkeit ihrer Synergiegruppe (Ellbogenbeuger usw.) zugeordnet. Die Verifizierung isolierter Aufzeichnungen von einzelnen Muskeln würde gleichzeitige Aufzeichnungen in mehreren Synergisten erfordern, um auf Crosstalk zwischen Muskelaufzeichnungen zu testen, was insbesondere im unteren Arm von Mäusen unerschwinglich schwierig sein kann.
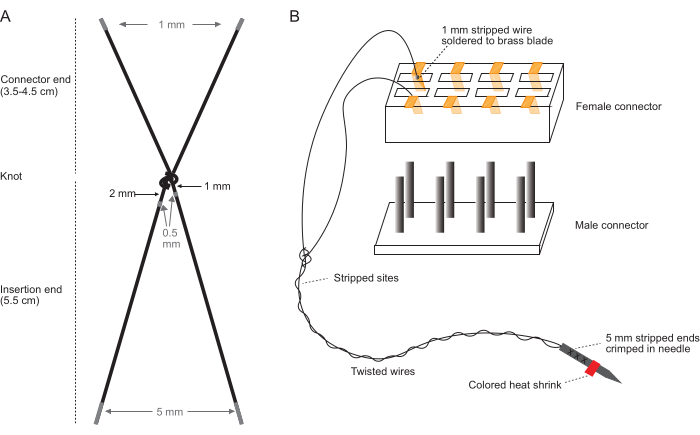
Abbildung 1: Schematische Darstellung der Herstellung des Elektrodensatzes. (A) Diagramm eines einzelnen Elektrodenpaares. Graue Bereiche zeigen an, wo abgezogen werden soll. (B) Diagramm der Steckverbinderbaugruppe mit einem einzelnen fertigen Elektrodenpaar, das in den Steckverbinder eingesetzt wird. Das Diagramm in (B) ist nicht maßstabsgetreu. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
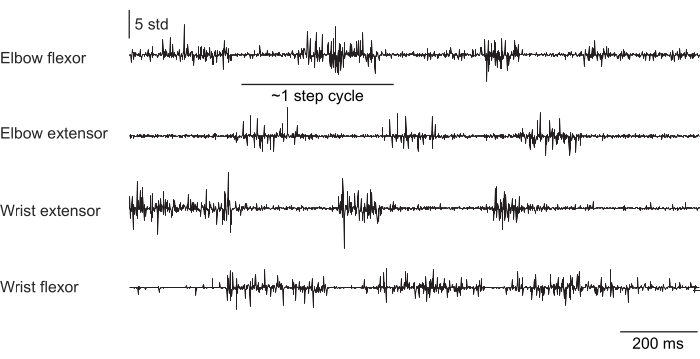
Abbildung 2: Repräsentative EMG-Aufnahme von vier Muskeln einer frei beweglichen (nicht kopffixierten) Maus, die auf einem Laufband läuft. Die Gesamtdauer beträgt 1,5 s. Der Stufenzyklus wurde aus der Zeit zwischen den sequentiellen Aktivierungen des Ellenbogenstreckers geschätzt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
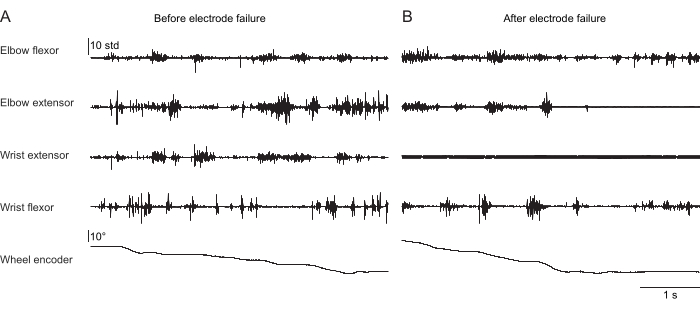
Abbildung 3: Repräsentative EMG-Aufzeichnung von vier Muskeln einer Maus mit fixiertem Kopf, die ein naturalistisches Kletterverhalten ausführt. Die 5. Reihe zeigt die Position des Steigrads an, die von einem Drehgeber abgelesen wird; Änderungen dieses Wertes deuten darauf hin, dass sich das Rad dreht und das Tier aktiv klettert. Die Gesamtdauer beträgt 5 s. (A) Aufzeichnung 36 Tage nach der Implantation während des Kletterns. (B) Aufzeichnung 72 Tage nach der Implantation in dieselbe Maus nach Versagen der Handgelenkstreckelektrode. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
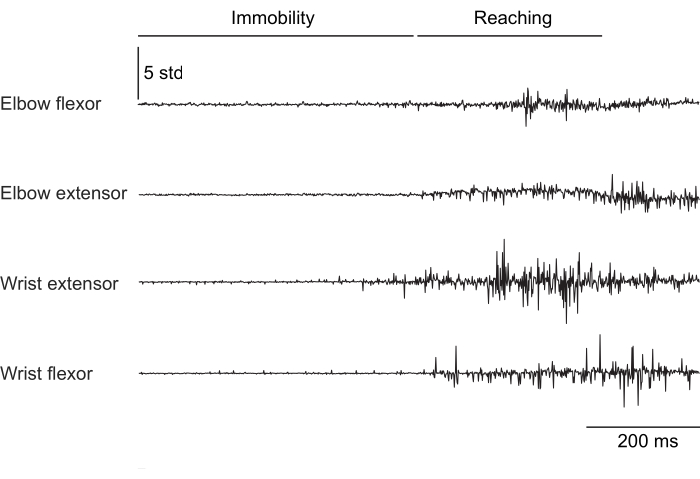
Abbildung 4: Repräsentative EMG-Aufzeichnung von vier Muskeln einer Maus mit fixiertem Kopf, die von der Unbeweglichkeit zur Ausführung einer Greifbewegung übergeht. Die Gesamtdauer beträgt 1 s. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Dieses Protokoll ermöglicht stabile Muskelaktivitätsaufzeichnungen von Mäusen mit festem Kopf, die über mehrere Wochen hinweg eine Vielzahl von Verhaltensweisen ausführen. In jüngster Zeit wurde diese Methode eingesetzt, um die neuronale Kontrolle der Gliedmaßenmuskulatur während Verhaltensweisen wie der Fortbewegung auf dem Laufband18,20, einer Joystick-Zugaufgabe18 und einer Co-Kontraktionsaufgabe21 zu untersuchen. Während das hier beschriebene Protokoll spezifisch für Ellenbogen- und Handgelenksmuskeln von Mäusen ist, kann es leicht modifiziert werden, um von verschiedenen Muskeln oder einer unterschiedlichen Anzahl von Muskeln aufzuzeichnen, indem die Länge und/oder die Gesamtzahl der Elektrodenpaare geändert wird. Die hier beschriebene Methode wurde von den zuvor verwendeten Methoden zur Aufzeichnung der Muskelaktivität der Vorder- und Hintergliedmaßen bei Mäusen ohne Kopfstütze angepasst 15,16,17.
Die Herstellung von Elektroden erfordert viel Übung, um sie zu beherrschen. Tägliches Üben von 1-2 Stunden während des Lernens wird empfohlen. Das Abisolieren der Elektroden ist aufgrund des präzisen Kraftaufwands, der erforderlich ist, um die Isolierung zu durchtrennen, ohne den darunter liegenden Draht zu beschädigen, der anspruchsvollste Schritt. Diese Kraft hängt von der Schärfe der Klinge ab, so dass ein häufiger Austausch der Skalpellklinge dazu beitragen kann, die Reproduzierbarkeit während des Lernens zu gewährleisten. Auch das Löten der Drähte an die Messingklingen des Steckverbinders kann schwierig sein, da sich Edelstahl nicht ohne weiteres lötet. Das Auftragen einer großzügigen Menge an edelstahlverträglichem Flussmittel hilft, die Verbindung zu fördern.
Die größte Herausforderung bei der Implantation besteht darin, den distalen Knoten zu binden, ohne den implantierten Draht oder den proximalen Knoten zu stören. Der proximale Knoten muss groß genug sein, um an der Einstichstelle nicht in den Muskel zu rutschen - vermeiden Sie daher, dass der Knoten in Schritt 2 der Herstellung des Elektrodensets zu fest gebunden wird. Wenn der proximale Knoten nach der Implantation wandert, verwenden Sie eine Pinzette mit Kohlefaserspitze, um ihn vorsichtig neu zu positionieren. Ziehen Sie den distalen Knoten langsam fest, während Sie den Draht mit einer Pinzette fest greifen, um zu vermeiden, dass die gesamte Elektrode durchgezogen wird. Dieser Schritt ist entscheidend, um die Langlebigkeit der implantierten Elektroden zu gewährleisten: Zu viel Spannung auf die Elektrode kann dazu führen, dass sie bricht, wenn sich das Tier bewegt, während sich eine lose Elektrode während der Genesung verschieben und den Kontakt zum zugehörigen Muskel verlieren kann, wenn das Gewebe heilt.
Die Tiere erholen sich bemerkenswert gut von der Operation, obwohl es mögliche Komplikationen zu beachten gibt. Zuerst kauen Mäuse an ihren Nähten und Elektroden, wenn sie die Gelegenheit dazu haben. Das elisabethanische Halsband verhindert dies, verhindert aber auch, dass sich das Tier selbst putzt. Einige Mäuse entwickeln eine schleimartige Ansammlung um ihre Augen. Gelegentlich kommt es bei männlichen Mäusen, insbesondere bei älteren, zu Harnröhrenblockaden, die für das Tier belastend sein können. Wenn Sie das Tier jeden Tag 20 Minuten lang putzen lassen, bevor es die Nähte inspiziert, sollte das Tier genügend Zeit haben, diese Probleme zu vermeiden.
Es gibt wichtige Einschränkungen dieser Methode zu beachten. Erstens können diese kundenspezifischen Elektroden im Allgemeinen die Aktivität einer einzelnen motorischen Einheit nicht auflösen. Darüber hinaus ist nicht garantiert, dass das elektrische Signal ausschließlich von einem bestimmten Muskel (d. h. dem Bizeps) ausgeht, da es schwierig ist, eine Übersprache von der Aktivität in nahe gelegenen synergistischen Muskeln auszuschließen. Daher beziehen sich Forscher in Veröffentlichungen häufig auf die erfassten Muskeln nach ihrer Synergiegruppe (d. h. Ellenbogenbeuger). Es wird empfohlen, nach jedem Experiment postmortale Dissektionen durchzuführen, um die Position jeder Elektrode zu überprüfen, da sie sich während der Genesung im Gewebe verschieben können.
Forscher, die sich für die Aktivität einzelner motorischer Einheiten interessieren, sollten in Erwägung ziehen, neu entwickelte EMG-Elektroden des Center for Advanced Motor Bioengineering Research (CAMBER) an der Emory University auszuprobieren. Diese Elektroden befinden sich noch in der Entwicklung, aber CAMBER wird das neueste Elektrodendesign liefern. Der Hauptnachteil dieser Elektroden ist die Langlebigkeit: Die in diesem Protokoll beschriebenen handgefertigten Elektroden ermöglichen in der Regel Aufzeichnungen über mehrere Wochen, während CAMBER-Elektroden am besten für kurzfristige Experimente geeignet sind. Forscher, die sich für eine EMG-Aufzeichnungsmethode entscheiden, können sich direkt an CAMBER wenden, um festzustellen, ob ihre Elektroden für ein bestimmtes Experiment geeignet sind.
Offenlegungen
Nichts.
Danksagungen
Die Autoren danken Dr. Claire Warriner für ihren Beitrag zur Entwicklung dieser Methode. Mark Agrios und Sajishnu Savya halfen bei der Erstellung der Zahlen. Diese Forschung wurde durch einen Searle Scholar Award, ein Sloan Research Fellowship, eine Simons Collaboration on the Global Brain Pilot Award, einen Whitehall Research Grant Award, das Chicago Biomedical Consortium mit Unterstützung der Searle Funds at The Chicago Community Trust, das NIH Grant DP2 NS120847 (A.M.) und das NIH Grant 2T32MH067564 (A.K.) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| #11 Scalpel Blades | World Precision Instruments | 504170 | For EMG electrode fabrication |
| #3 Scalpel Handle | Fine Science Tools | 10003-12 | For EMG electrode fabrication |
| 1 mL Sub-Q Syringe (100 pack) | Becton Dickinson | 309597 | For administering injectable drugs |
| 12-pin connector | Newark | 33AC2371 | 12-pin connector with brass fittings; for EMG electrode fabrication |
| 18 G Needles | Exel International | 26419 | For EMG electrode fabrication |
| 27 G Needles | Exel International | 26426 | For EMG electrode fabrication |
| 3 M Transpore Surgical Tape | 3M | 1527-0 | For taping animal's limbs out during surgery |
| 6-0 silk sutures | Henry Schein | 101-2636 | These sutures work well with delicate skin around the wrists |
| C&B Metabond Complete Kit | Pearson Dental | P16-0126 | Dental cement to affix connector to headplate |
| C57BL6/J Mice | Jackson Laboratories | #000664 | Wild type mice |
| Carbofib 5-CF Tweezers (2) | Aven tools | 18762 | Carbon fiber tipped forceps, used to manipulate delicate parts of electrode (stripped or inserted sections) |
| Carprodyl (Carprofen) 50 mg/mL Injection | Ceva Animal Health, LLC | G43010B | Injectable analgesic for pain management during and after surgery |
| Castroviejo Micro Needle Holder | Fine science tools | 12060-01 | For suturing |
| Castroviejo Needle Holder (large) | Fine science tools | 12565-14 | For inserting needle into muscle |
| Delicate Bone Scraper | Fine science tools | 10075-16 | To separate skin from underlying tissue |
| Dietgel 76A Dietary Supplement | Clear H2O | 72-07-5022 | For post-operative care |
| Dumont #5/45 Forceps | Fine science tools | 11251-35 | To remove fascia overlying muscle |
| Elizabethan collar for mouse | Kent Scientific Corporation | EC201V-10 | For post-operative care |
| Enrofloxacin 2.27% | Covetrus | #074743 | Injectable antibiotic for use during and after surgery |
| Epoxy gel | Devcon | 14265 | For EMG electrode fabrication |
| Hopkins Bulldog Clamp (4) | Stoelting | 10-000-481 | Tissue clamps for headplate implantation |
| Isoflurane Solution | Covetrus | 11695067771 | Inhalable anesthesia |
| Lidocaine Hydrochloride Injectable - 2% | Covetrus | #002468 | Topical analgesic for pain management during surgery |
| Medical Grade Oxygen | Airgas | OX USP200 | For administering isoflurane during surgery |
| MetriCide 1 Gallon | Metrex | 10-1400 | Glutaraldehyde solution for cold-sterilization of headplate and electrodes |
| MetriTest Strips 1.5% | Metrex | 10-303 | Test strips for monitoring glutaraldehyde solution (recommended) |
| Model 900LS Small Animal Stereotaxic Instrument | Kopf Instruments | 900LS | Stereotax with lazy susan feature that allows platform rotation during surgery |
| PFA-coated 0.0055" braided stainless steel wire | A-M systems | 793200 | For EMG electrode fabrication |
| Povidone-iodine prep pads | Dynarex | 1108 | For cleaning skin |
| Puralube Vet Ointment | Dechra | 37327 | Eye ointment for surgery |
| Sterile alcohol prep pads | Dynarex | 1113 | For cleaning skin |
| Straight fine #5 forceps | Fine science tools | 11295-10 | For curling wire after insertion |
| Straight fine scissors | Fine science tools | 14060-11 | For cutting wire |
| Student Vannas Spring Scissors | Fine science tools | 91500-09 | For making incisions, trimming fat and fascia, and suturing |
| Technik Tweezers 7B-SA (2) | Aven tools | 18074USA | Curved blunt forceps, for general use during surgery |
| Triple Antibiotic Ointment | Walgreens | 975863 | Topical antibiotic for surgery |
| V-1 Tabletop Laboratory Animal Anesthesia System | VetEquip | 901806 | Contains all necessary equipment for anesthesia induction and scavenging including vaporizer, induction chamber, moveable plastic nose cone, and tubing |
Referenzen
- Dombeck, D. A., Khabbaz, A. N., Collman, F., Adelman, T. L., Tank, D. W. Imaging large scale neural activity with cellular resolution in awake mobile mice. Neuron. 56 (1), 43-57 (2007).
- Guo, Z. V., et al. Flow of cortical activity underlying a tactile decision in mice. Neuron. 81 (1), 179-194 (2014).
- Guo, J. Z., et al. Cortex commands the performance of skilled movement. eLife. 4, e10774(2015).
- Morandell, K., Huber, D. The role of forelimb motor cortex areas in goal directed action in mice. Sci Rep. 7 (1), 15759(2017).
- Galiñanes, G. L., Bonardi, C., Huber, D. Directional reaching for water as a cortex-dependent behavioral framework for mice. Cell Rep. 22 (10), 2767-2783 (2018).
- Evarts, E. V., Tanji, J. Reflex and intended responses in motor cortex pyramidal tract neurons of monkey. J Neurophysiol. 39 (5), 1069-1080 (1976).
- Hounsgaard, J., Hultborn, H., Jespersen, B., Kiehn, O. Bistability of alpha-motoneurones in the decerebrate cat and in the acute spinal cat after intravenous 5-hydroxytryptophan. J Physiol. 405, 345-367 (1988).
- Murphy, P. R., Hammond, G. R. The role of cutaneous afferents in the control of gamma-motoneurones during locomotion in the decerebrate cat. J Physiol. 434, 529-547 (1991).
- Manuel, M., Chardon, M., Tysseling, V., Heckman, C. J. Scaling of motor output, from mouse to humans. Physiol Bethesda Md. 34 (1), 5-13 (2019).
- Sauerbrei, B. A., et al. Cortical pattern generation during dexterous movement is input-driven. Nature. 577 (7790), 386-391 (2020).
- Barrett, J. M., Raineri Tapies, M. G., Shepherd, G. M. G. Manual dexterity of mice during food-handling involves the thumb and a set of fast basic movements. PLoS One. 15 (1), e0226774(2020).
- Serradj, N., et al. Task-specific modulation of corticospinal neuron activity during motor learning in mice. Nat Commun. 14, 2708(2023).
- Scholle, H. C., et al. Spatiotemporal surface EMG characteristics from rat triceps brachii muscle during treadmill locomotion indicate selective recruitment of functionally distinct muscle regions. Exp Brain Res. 138 (1), 26-36 (2001).
- Scholle, H. C., et al. Kinematic and electromyographic tools for characterizing movement disorders in mice. Mov Disord off J Mov Disord Soc. 25 (3), 265-274 (2010).
- Pearson, K. G., Acharya, H., Fouad, K. A new electrode configuration for recording electromyographic activity in behaving mice. J Neurosci Methods. 148 (1), 36-42 (2005).
- Akay, T., Acharya, H. J., Fouad, K., Pearson, K. G. Behavioral and electromyographic characterization of mice lacking EphA4 receptors. J Neurophysiol. 96 (2), 642-651 (2006).
- Akay, T., Tourtellotte, W. G., Arber, S., Jessell, T. M. Degradation of mouse locomotor pattern in the absence of proprioceptive sensory feedback. Proc Natl Acad Sci USA. 111 (47), 16877-16882 (2014).
- Miri, A., et al. Behaviorally selective engagement of short-latency effector pathways by motor cortex. Neuron. 95 (3), 683-696 (2017).
- Osborne, J., Dudman, J. RIVETS: A mechanical system for in vivo and in vitro electrophysiology and imaging. PloS One. 9 (2), e89007(2014).
- Santuz, A., Laflamme, O. D., Akay, T. The brain integrates proprioceptive information to ensure robust locomotion. J Physiol. 600 (24), 5267-5294 (2022).
- Warriner, C. L., Fageiry, S., Saxena, S., Costa, R. M., Miri, A. Motor cortical influence relies on task-specific activity covariation. Cell Rep. 40, 111427(2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten