需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用于规划和执行人体经颅超声神经调控实验的管道
摘要
经颅超声刺激 (TUS) 是一种新兴的非侵入性神经调控技术,需要仔细规划声学和热模拟。该方法描述了图像处理和超声模拟管道,用于高效、用户友好、简化的人体 TUS 实验规划。
摘要
经颅超声刺激 (TUS) 是一种新兴的非侵入性神经调控技术,能够高精度地操纵皮层和皮层下结构。进行涉及人类的实验需要仔细规划声学和热仿真。此规划对于调整骨与超声束形状和轨迹的干扰以及确保 TUS 参数满足安全要求至关重要。获取 T1 和 T2 加权以及具有 1 mm 各向同性分辨率的零时间回波 (ZTE) 磁共振成像 (MRI) 扫描(或者计算机断层扫描 X 射线 (CT) 扫描)用于颅骨重建和模拟。使用神经导航平台进行目标和轨迹映射。SimNIBS 用于颅骨、皮肤和脑组织的初始分割。TUS 的模拟是通过 BabelBrain 工具进行的,该工具使用 ZTE 扫描生成头骨的合成 CT 图像,并将其转换为声学特性。我们使用具有电动转向功能的相控阵超声换能器。调整 Z 方向转向以确保达到目标深度。规划工具还支持其他传感器配置。运行热模拟以确保温度和机械指数要求符合 FDA 建议的人体 TUS 声学指南。在 TUS 交付过程中,机械臂使用无框架立体定向定位系统协助传感器移动到所需位置。
引言
常用的非侵入性神经刺激技术包括经颅直流电刺激 (tDCS) 和经颅磁刺激 (TMS)。然而,两者都具有有限的穿透深度和较低的精度 1,2。相比之下,经颅超声 (TUS) 是一种新兴的非侵入性技术,能够增强或抑制神经元活动 3,4,5 并以毫米级精度靶向皮质或皮质下结构 6,7。使用啮齿动物4、8、9、兔子10、绵羊5、11、猪6 和非人灵长类动物7、12、13、14 的动物模型显示了 TUS 的有效性和安全性。研究表明,针对不同的大脑区域可以引起大鼠的肢体运动8 、猪的体感诱发电位 (SSEP)6 、非人灵长类动物的视觉运动活动12、认知和动机决策13 的变化以及其他行为变化。在人类中,已观察到 TUS 在针对初级运动皮层 15,16 时改变运动诱发电位 (MEP) 和反应时间任务的表现,在针对体感皮层 17 和感觉丘脑18 时改变触觉辨别任务和 SSEP 的表现。组织学分析显示,猪6、绵羊 5,11、兔子 10 和非人灵长类动物14 没有与 TUS 相关的肉眼或微观结构变化,也没有发现与其他非侵入性神经刺激技术显着不同的副作用19。
TUS 使用频率在 200 kHz 和 700 kHz 之间的脉冲低强度聚焦超声来产生瞬态神经调节效果。原位典型的空间峰值脉搏平均强度 (Isppa) 为 10 W/cm2 或更低,报告的人类占空比(超声开启的时间百分比)在 0.5% 到 70% 之间 20,21,22,23,24。尽管已经提出 TUS 神经调控的机制主要涉及脂质膜的机械搅动,导致离子通道打开 25,26,27,但可能的热和空化效应不容忽视。它们通过机械 (MI) 和热 (TI) 指数进行评估。MI 描述了 TUS 将发生的预测的空化相关生物效应,而 TI 描述了超声应用后组织内的潜在温度升高28,29。此外,改变频率和输入强度也会导致 MI 和 TI 发生变化。频率越高,空间分辨率越好,发生机械生物效应的可能性越小;然而,它们在组织中具有更强的吸收能力,这增加了温度升高的可能性28。或者,相同强度的较低频率会增加 MI。同样,增加强度往往会增加机械和热生物效应的程度30。因此,在实验之前,必须对所有将要实施的 TUS 参数进行仔细的规划和仿真。
规划 TUS 实验需要确定目标和目标轨迹,以及热仿真和声学仿真的性能。仿真有助于优化机械效应并减轻 TUS 对组织的热影响。他们需要了解颅骨加热的预测、超声在焦点处的压力振幅、局灶矫正以及颅骨和皮肤内的其他加热。充分的模拟可确保焦点到达感兴趣的目标,并遵循国际经颅超声刺激安全和标准联盟 (ITRUSST)31 推荐的生物物理安全指南规定的超声使用安全参数,这些指南基于 FDA 和加拿大卫生部的建议。最近的研究还强调了动物和人类伴随 TUS 32,33,34 的听觉混杂效应,因此 TUS 刺激可以激活大脑中的听觉通路以引发反应 32,33,34。啮齿动物的听觉神经横断32 (transection of the auditory nerves)、去除耳蜗液32 (cochlear fluid) 或化学性耳聋33 (chemical deafness) 已被用来减少动物的这些影响。在人类中,通过耳机管理听觉音调已被用于有效掩盖来自 TUS 的听觉噪声,控制 TUS 诱导的听觉活动混淆34。这突出了在假刺激条件下控制听觉噪声的必要性,这必须纳入协议规划、设计和实施中。
在这里,我们提供了有关如何适当完成在人体中进行 TUS 神经调控实验所需的准备(第 1 步、第 2 步)、规划(第 3 步)、模拟(第 4 步)和 TUS 交付(第 5 步)的指南。
研究方案
所有涉及使用人类受试者的方法均按照涉及人类的研究的三委员会道德行为进行,并且该协议已获得卡尔加里大学联合健康研究伦理委员会 (CHREB) 的批准。所有受试者在参与前均提供了知情书面同意书。人类参与者必须是年龄在 18 至 40 岁之间、愿意并能够完成磁共振成像 (MRI) 扫描的健康右撇子成年人。排除标准包括癫痫发作家族史、情绪或心血管疾病、耳外伤、酒精或药物依赖、使用处方药、包括心脏起搏器在内的金属植入物、怀孕、心血管疾病、神经或精神疾病史、无法与研究者和研究人员沟通,以及无法律行为能力或法律行为能力有限。下面描述的方案遵循 ITRUSST 关于 TUS 研究标准化报告的建议35。材料 表中列出了本研究中使用的设备、软件和必要的 Web 链接的详细信息。
1. 高分辨率磁共振成像
- 使用 24 通道头/颈线圈对参与者进行成像。
注意:或者,该站点可用的最佳头/颈线圈足以获得解剖学 MRI。 - 以 1 mm 的分辨率收集 T1 和 T2 加权 MR 图像以及零时间回波 (ZTE) 序列。
注意:建议参与者在没有佩戴耳罩式耳机的情况下收集 MR 图像,因为它会影响图像重建并使后续的规划和实施步骤变得困难。相反,为了 MR 安全,建议参与者只戴耳塞。- 对于 T1 加权成像,使用具有以下参数的 3D 反转恢复制备的快速破坏梯度回波 (FSPGR) 序列:重复时间 (TR) = 8.4 毫秒,回波时间 (TE) = 3.2 毫秒,反转时间 (TI) = 650 毫秒,翻转角度为 10 度,视场尺寸为 256 毫米 x 256 毫米 x 188 毫米,矩阵尺寸为 256 x 256 x 188, GRAPPA (ARC) 因子在相位编码方向为 2,矢状-斜方向与 AC-PC 近似对齐。
注意:总扫描时间为 5 分 21 秒。 - 对于 T2 加权成像,使用具有以下参数的 3D 快速旋转回波 (FSE):TR = 3000 ms,TE = 60-90 ms,回波序列长度为 130,视场尺寸为 256 mm x 225 mm x 188 mm,矩阵尺寸为 256 x 256 x 188,矢状-斜方向近似对齐 AC-PC 轴。在相位编码和切片方向上使用了 2 的 GRAPPA (ARC) 因子。
注意:总扫描时间为 3 分 58 秒。 - 对于 ZTE 图像,请使用各向同性 3D ZTE 扫描,设置如下:TR = 698 ms,TE = 16 μs,翻转角 1 度,接收器带宽 62.5 kHz,平均值数 = 3.5,视场尺寸为 256 mm x 256 mm x 256 mm,矩阵尺寸为 256 x 256 x 256。
注意:总扫描时间为 5 分 23 秒。
注意:必须先完成 MR 映像,然后才能开始 TUS 规划。
- 对于 T1 加权成像,使用具有以下参数的 3D 反转恢复制备的快速破坏梯度回波 (FSPGR) 序列:重复时间 (TR) = 8.4 毫秒,回波时间 (TE) = 3.2 毫秒,反转时间 (TI) = 650 毫秒,翻转角度为 10 度,视场尺寸为 256 毫米 x 256 毫米 x 188 毫米,矩阵尺寸为 256 x 256 x 188, GRAPPA (ARC) 因子在相位编码方向为 2,矢状-斜方向与 AC-PC 近似对齐。
2. 预处理参与者图像
- 使用 dcm2niix 工具将 T1-w、T2-w 和 ZTE DICOM 扫描文件从 DICOM 转换为 Nifti 格式。在终端窗口中,执行: dcm2niix。
注意:dcm2niix 工具可在 GitHub 上找到(参见 材料表)。BabelBrain 工具会共同注册参与者的图像,以适应在不同日期收集的图像。如果 T1-w 图像不是各向同性的,则会将其重新采样为 1 mm 各向同性体素;但是,CT/ZTE 图像不是。相反,模拟的蒙版会根据 PPW 重新采样为最终分辨率。不需要额外的共同注册或对齐步骤。 - 使用 SimNIBS 的 charm 工具执行共配准和组织掩码提取。在终端窗口中,执行: charm ,其中 是用于标识的字符串。此时,可以暂停实验计划,并在其他时间继续。
注意:创建的文件将保存在 m2m 子目录中,该子目录将在后续规划阶段使用。使用 charm 工具预处理图像对于组织分割是必要的,因为这是在 BabelBrain 工具36 中使用所必需的。
3. 轨迹规划
- 打开 Brainsight,单击 New Empty Project,然后加载参与者的 T1-w Nifti 图像,该图像在步骤 2.1 中生成。
注意:如果使用 v2.5.3 之前的 Brainsight 版本,可以选择“新建空项目”或“新建 SimNIBS 项目”。如果使用 Brainsight v2.5.3 及更高版本,Brainsight 和 BabelBrain 之间有集成,强烈建议点击“新建 SimNIBS 项目”;但是,这两者都足以完成规划步骤。“新建空项目”需要加载 T1-w 映像,而“新建 SimNIBS 项目”需要加载直接加载 T1-w 映像的 .msh 文件。所有其他功能和步骤保持不变。 - 单击 Overlays,然后单击 Configure Overlays 以创建和查看叠加。点击 添加 选择要叠加的文件。
注意:如果无法在 T1-w 图像上可视化目标,则必须首先将其定位在共同注册的 T2-w 图像上(因此 T1-w 和 T2-w 坐标相同)。然后,将坐标传输到 T1-w 图像上,用于后续规划步骤。步骤 2.2 中的超级按钮工具在 m2m /T2_reg.nii.gz 文件路径中生成共同注册的 T2-w 图像。 - 关闭叠加部分,单击 目标 选项卡,然后单击 配置目标。单击 蓝色信息 按钮可更改叠加层的不透明度、颜色和阈值,以便对图像进行比较。
注意:可以执行此操作以可视化共同配准的 Nifti 图像,并应用于观察声学模拟将如何与目标叠加。 - 单击 Reconstructions 选项卡,然后单击 New Reconstruction... 下拉菜单。单击 Skin (皮肤),然后在新窗口中单击 Compute Skin (计算皮肤 )。完成后,单击窗口左上角的 关闭 按钮。
- 在 “Reconstructions” 选项卡中,单击 New Reconstruction... 下拉菜单,然后单击 Full Brain Curvilinear。
- 通过拖动绿色框的边缘来调整矢状面(图 1A)、冠状面(图 1B)和横向(图 1C)图像上的每个框,使线条紧紧围绕大脑(图 1)。
- 滚动浏览所有切片,以确保组织没有边缘重叠。单击 计算曲线 并将剥离深度调整为 4 毫米(图 1D)。
注意:全脑曲线提供了皮层的 3D 重建,可以剥离以观察不同的深度。它允许在大脑上准确一致地放置 TMS 线圈,以定位感兴趣的区域。
- 单击 Brainsight 上的 地标 选项卡,然后单击 配置地标。
- 将十字准线(光标)放在鼻尖上,并在“名称:”字段中标记地标“鼻子”(图 2A)。将十字准线放在鼻梁上方的眼睛之间,并标记地标“Nasion”(图 2A)。
- 将十字准线放在左耳上并标记地标“L Ear”(图 2B)。将十字准线放在右耳上并标记地标“R Ear”(图 2C)。
- 单击 Targets 选项卡,并使用十字准线(光标)定位感兴趣的目标。
- 将十字准线(光标)放在所需目标的位置上,并使用屏幕右侧的角度切换来设置轨迹角度。
- 选择所需的目标和轨迹后,单击 新建 下拉菜单,然后选择 轨迹.通过在 “Name:” 旁边的文本框中键入内容来命名目标。
- 通过单击 Export... 导出目标,并将其保存在相应的 Subject 文件夹中。保存文件后,可以暂停计划,稍后可以重新开始实验。
注意:该目标将在后续步骤中用于完成热模拟和声学模拟。
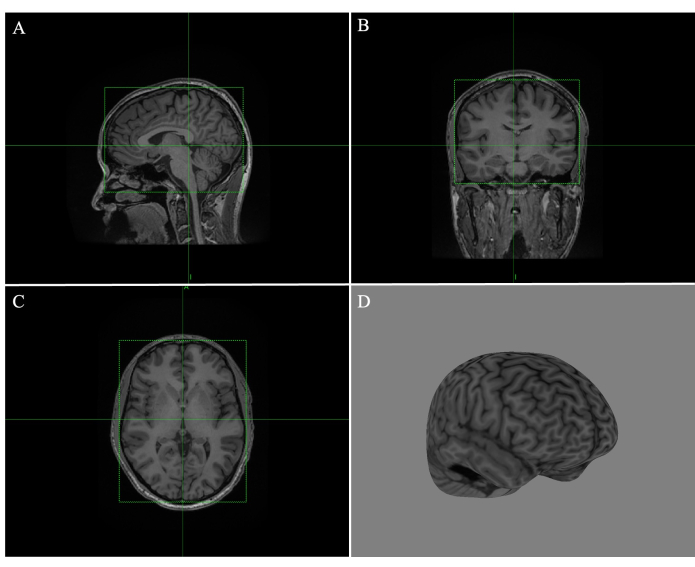
图 1:在 Brainsight 中创建全脑曲线。 (A) 调整到矢状 MR 图像边缘的框。(B) 调整到冠状 MR 图像边缘的框。(C) 调整到横向 MR 图像边缘的框。(D) 剥离深度为 4 mm 的全脑曲线重建。 请单击此处查看此图的较大版本。
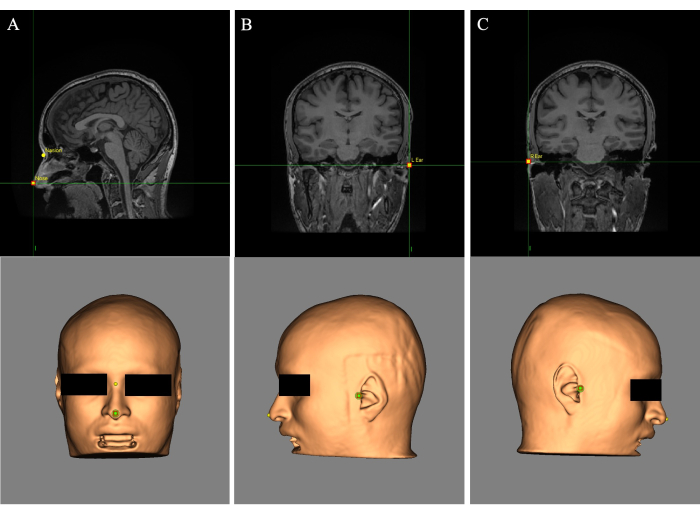
图 2:放置在皮肤重建和 MR 图像上的标志。 (A) 鼻子和鼻部标志放置。(B) 左耳标志放置。(C) 右耳标志放置。 请单击此处查看此图的较大版本。
4. 使用 BabelBrain 进行模拟
注意:有关使用 BabelBrain 进行仿真的详细信息,请参阅 BabelBrain 的手册:https://proteusmrighifu.github.io/BabelBrain/index.html。
- 打开 BabelBrain 并选择声学和热仿真所需的文件。
注:本提交内容使用相控阵探头;但是,其他传感器与此规划软件完全兼容。该程序可以完成 Single、CTX_500、H-317、H-246 和传感器的模拟。在以下方法中,H-317 将用作选定的传感器。- 通过单击 “选择轨迹... ”并选择合适的参与者文件,选择之前在步骤 3.7.3 中从 Brainsight 导出的 txt 文件。单击 选择 SimNIBS... ,选择在步骤 2 中创建的 SimNIBS 文件(m2m_folder名称)。单击 选择 T1W... ,然后选择在步骤 2.1 中生成的 T1-w 图像,该图像之前用于目标和轨迹映射。
- 在“使用 CT”标签旁边的下拉列表中,如果使用 CT 扫描,请选择真实 CT ,如果使用 ZTE 扫描,请选择 ZTE ,如果使用超级按钮工具生成的简化蒙版(如果只有 T1 和 T2-w 图像可用),请选择 NO 。使用 CT 或 ZTE 图像时,单击 Correg.? 下拉菜单,然后单击 CT to MR。单击 Select 并从相应的参与者文件中选择相应的图像。
- 单击“Select Thermal Profile ...”(选择热配置文件...),然后选择热配置文件,该文件根据开启持续时间、关闭持续时间和占空比来描述实验的超声处理参数。
注意:详细信息可以在 BabelBrain 的手册中查阅:https://proteusmrighifu.github.io/BabelBrain/index.html。https://github.com/ProteusMRIgHIFU/BabelBrain/tree/main/Profiles 上提供了配置文件示例。 - 单击“Transducer(传感器)”旁边的下拉菜单,然后选择用于实验的传感器。单击“计算后端”旁边的下拉菜单,然后选择运行模拟的计算机的计算后端。输入所有信息后,单击 CONTINUE (继续 ) 以完成其余的模拟。
- 子步骤 A:计算掩码。
- 选择换能器的超声频率和适当的每波长点 (PPW)。
注意:6 PPW 对于大多数情况来说就足够了。 - 保持标准化的 ZTE 范围和 Hounsfield 单位 (胡) 不变。
注意:如果使用真实的 CT,则只会显示 胡 阈值。如果未提供 ZTE 或 CT 扫描,则此条目将不存在。 - 单击 Calculate planning mask。检查图像,检查以确保准确识别皮肤、头骨和大脑的边界。
注意:如果存在任何差异,请调整标准化的 ZTE 范围和/或 胡 阈值。
- 选择换能器的超声频率和适当的每波长点 (PPW)。
- 子步骤 B:声学仿真。单击 步骤 2 - Ac Sim 选项卡打开。
注意:此选项卡的外观会有所不同,具体取决于所选的传感器。以下是 H-317 传感器的特定内容。- 通过键入适当的距离,调整从圆锥体到焦点的距离,以反映从圆锥体表面到目标的距离。
注意:这是由实验中使用的物理锥体决定的。 - 单击 Calculate Fields 按钮执行模拟。
- 调整 Z 转向 (mm) 值,使十字准线(指示目标)位于焦点的中心(图 3)。按向上或向下箭头或手动输入所需的值,然后单击 Calculate Fields。
注意:正值会将焦点引导到大脑更深处,而负值会导致焦点在表面移动。 - 如果焦点位于预期目标的侧面,请调整 X/Y 机械。保持 Z 机械不变。单击 Calculate Fields。
注意:在 4.3.1 中,Z 机械 Z 机械是作为与锥体距离的函数重新计算的。如果在完成计算后需要调整 Z 方向、X/Y 机械或超出目标的最大深度,则必须重新计算声学仿真文件。单击 Calculate Fields(计算字段 ),然后选择 Yes(是 )重新计算。选择 No (否 ) 以重新加载现有文件。
- 通过键入适当的距离,调整从圆锥体到焦点的距离,以反映从圆锥体表面到目标的距离。
- 子步骤 C:热仿真。单击 步骤 3 - 热模拟 选项卡,然后单击 计算热场。评估机械和热模拟(图 4),以确保它们符合 ITRUSST31 推荐的人类受试者声学指南(软组织机械指数 (MI) ≤1.9;热上升 ≤2 °C,热剂量 ≤0.25 CEM43,1.5 <颅热指数 (TIC) ≤ 2.0 的暴露时间限制为 80 分钟,2.0 < TIC ≤ 2.5 的 40 分钟, 2.5 < TIC ≤ 3.0 为 10 分钟,3.0 < TIC ≤ 4.0 为 160 秒,4.0 < TIC ≤ 5.0 为 40 秒,5.0 < TIC ≤ 6.0)为 10 秒。
注意:BabelBrain 求解生物传热方程以估计温度上升36。在极少数情况下,可能会出现异常的高温体素,在这种情况下,如果任何解剖特征可以解释异常温度升高,则应分析 MR 图像。- 通过单击 Isppa(W/cm2) 框旁边的向上或向下箭头或手动输入高于 0.1 的值来调整 Isppa,以观察参数如何随不同强度而变化。
注意:所有强度、温度变化和机械指数的摘要都可以导出为 CSV 文件以供参考。该软件计算出在水条件下(Isppa 在水中)所需的强度,需要施加该强度才能在 原位达到所需的强度。 - 单击界面下部区域的 MTB、MTS 和 MTC 按钮,查看大脑、皮肤和颅骨中温度最高的切片。热仿真步骤完成后,仿真即完成。
注意:文件将自动保存在与 T1-w 映像相同的位置。
注意:结尾为 <...FullElasticSolution_Sub_NORM.nii.gz> 可以在 Brainsight 中加载,以可视化 T1 空间中的声场叠加。将有用于纯水条件的文件(文件名中带有中缀 “Water”)和用于组织存在的条件的文件(文件名中没有中缀)。按照步骤 3.1 后面的注释中的步骤添加叠加。在热仿真步骤之后,仿真完成,实验可以暂停,直到 TUS 交付会话。
- 通过单击 Isppa(W/cm2) 框旁边的向上或向下箭头或手动输入高于 0.1 的值来调整 Isppa,以观察参数如何随不同强度而变化。
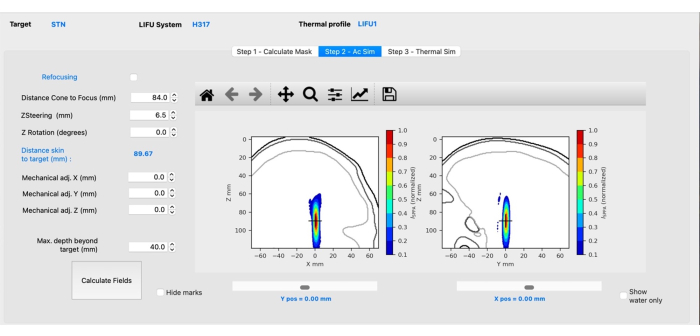
图 3:使用 BabelBrain 进行声学仿真。 请单击此处查看此图的较大版本。
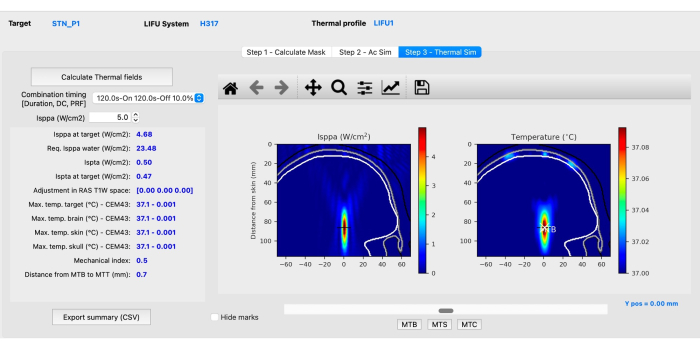
图 4:使用 BabelBrain 进行热仿真。请单击此处查看此图的较大版本。
5. TUS 交付会话
- 打开 Brainsight 并单击 Open Existing Project。选择在轨迹和目标映射期间创建和保存的 Brainsight 文件。
- 单击 Sessions 开始新的实验会话。单击 下拉列表 并选择 新建,然后选择 在线会话。单击 目标名称 ,然后单击 Add 和 Next 将目标添加到实验会话并继续进入实验窗口。
注意:如果使用与规划不同的计算机执行 TUS 交付,Brainsight 将需要选择适当的 T1-w 映像。在这种情况下,将打开一个新窗口,并提示您从参与者文件中选择关联的 T1-w 参与者图像 。 - 单击 Window 和 Tool Calibration,然后选择要使用的工具,然后单击 Re-Calibrate。
注意:对于实验期间使用的传感器和所有其他工具(例如 TMS 线圈),必须完成此步骤。- 将大型线圈跟踪器和校准块固定到传感器上。确保相机可以看到两个工具上的基准点。单击 Begin Calibration Countdown 重新校准。
注意:保存校准将确保它在当天的实验中保持不变。如果未执行此操作且计算机关闭,则设备将需要重新校准。
- 将大型线圈跟踪器和校准块固定到传感器上。确保相机可以看到两个工具上的基准点。单击 Begin Calibration Countdown 重新校准。
- 根据其设置程序设置换能器以进行实验。在设置传感器之前,请取下传感器上的跟踪器,以免损坏传感器。
注:所述设置适用于带有定制耦合锥的 H-317 传感器。- 根据需要组装锥体,将传感器膜放在锥体和端盖之间。使用螺钉、垫圈和螺母将耦合锥连接到传感器的法兰上,确保所有接头都拧紧,以免泄漏。
- 用去离子水填充传感器,并将泵的管子连接到传感器上,将标有“IN”的管子连接到“OUT”和“OUT”和“IN”。在按下泵上的“DRAIN”的同时堵住水孔以释放压力。
- 将换能器倒置以隔离薄膜上的气泡,然后向上旋转,让它们通过标有“OUT”的换能器管排出。重复此操作,直到去除所有可见的气泡。设置传感器,使其“OUT”管向前倾斜并位于最高点,并在泵运行 30 分钟的情况下离开。
- 将传感器倒置,验证是否已去除所有气泡。如果仍有气泡,请隔离胶片上的气泡,并像以前一样旋转传感器,以确保它们通过“OUT”管排出。重复上述步骤,直到去除所有气泡。
- 关闭泵,拆下软管,并将传感器锁定在空档。将跟踪器重新安装到传感器上,然后继续进行参与者设置。
- 使用眼镜、放置在耳朵和眉毛上方的头带(图 5)或轻型粘合剂跟踪器将受试者跟踪器连接到参与者的头部。确保基准点的方向对摄像机可见,并且在移近或到达最终位置时不会被传感器阻挡或撞击。
- 将摄像头放在参加者前面,以便它可以看到主题跟踪器和指针。
注意:如果它们不可见,则屏幕左下角的指示器将为红色。这也可以通过进入 Brainsight 上的“Polaris”选项卡来验证。
- 将摄像头放在参加者前面,以便它可以看到主题跟踪器和指针。
- 单击 Brainsight 中的 注册 选项卡。将指针放在步骤3.6中设置的所有四个地标上,用双手稳定它,然后点击 样本并转到下一个地标。
注意: 头带或眼镜必须紧紧地戴在参与者的头上,并且被摄体跟踪器不要移动。如果发生这种情况,请再次执行注册。如果在配准完成后必须旋转基准点以适应传感器的移动,请重新进行配准。 - 单击 Validation ( 验证) 选项卡以验证参与者注册。将指针轻轻放在头皮上的各个位置,并确保所有穴位都小于 3 毫米。
注意:为 TMS 创建的商业神经导航系统正在用于人体 TUS 实验。手持式换能器校准37 可以接受 3 毫米的平移误差,因为它与目标精度38,39 和其他神经导航系统40 一致。3 毫米值嵌入到 Brainsight 神经导航软件中。- 如果任何点大于 3 毫米,请单击 “添加 ”按钮以添加其他特征点,最多可添加三个点。如果需要三个以上的点才能实现 3 mm 以下的一致验证,请重新进行配准。
注意:为了提高注册成功率,建议参与者在未佩戴耳罩式耳机的情况下收集 MR 图像,因为它会影响图像重建并使注册变得困难。在点击 Sample & Go To Next Landmark之前,请注意将指针尽可能靠近地标的位置,并确保用双手稳定指针。验证可以保证头皮表面所有点的平均值都低于阈值。在头皮上的所有随机位置都低于 3 毫米阈值之前,不要继续。
- 如果任何点大于 3 毫米,请单击 “添加 ”按钮以添加其他特征点,最多可添加三个点。如果需要三个以上的点才能实现 3 mm 以下的一致验证,请重新进行配准。
- 将下巴托和稳定器放在后脑勺上,固定参与者的头部,以防止移动(图 5)。确保他们在实验期间舒适地坐在椅子上。
- 单击 Perform。使用机械臂沿所选轨迹将传感器定位在感兴趣的靶标上。
注意: 确保练习并熟悉机械臂的组件如何移动以到达目标。通过了解机械臂的移动性并熟悉它如何围绕头部方向移动,成功定位机械臂,因为这在很大程度上取决于目标的位置。- 使用 bullseye 窗口上的十字准线实现正确的定位和角度(图 6)。对齐两个圆(平移和旋转),使它们位于十字准线上,并参考精度读数进行验证。
- 将拍摄对象的头发沿自然部分分开,然后梳理超声凝胶以确保头发内没有气穴。如果大面积需要耦合,请将超声凝胶涂抹在换能器膜上。使用注射器用额外的超声凝胶填充任何剩余的气穴。
- 通过观察十字准线何时位于目标周围的盒子中间,将传感器降低到适当的高度(图 6)。这将指示何时达到适当的目标深度。
- 定制的 Python 脚本使用步骤 4 中的仿真结果对 128 放大器单元进行编程,并通过耳机 (https://github.com/ProteusMRIgHIFU/TUSApp) 生成声音。如果进行在线和/或双盲实验,请确保通过耳机34,41 播放屏蔽音频,或在突发持续时间 42,43,44 上增加和偏移刺激,以减少潜在的听觉混淆效应。
注意:在此步骤中,如果使用市售装置(如 CTX-500 传感器),请规定在水条件下模拟的强度以及其他参数(PRF、持续时间、占空比)。H-317 换能器使用专用脚本来运行换能器;因此,本提交文件中省略了该步骤。- 在 MATLAB 中生成掩码音频,以便在 TUS 交付开始时播放。假刺激期间的声音结合了 250 kHz 的连续正弦波、100 Hz 突发频率的方波(采样频率为 48 kHz)和随机噪声,以紧密复制换能器产生的声音。在 TUS 期间,只有随机噪声通过耳机播放,因为被摄体也会听到换能器发出的声音。
- 完成 TUS 输送后,在进行任何后续实验程序之前,从参与者的头部取下传感器、凝胶和跟踪器。
- 要清理 TUS 设备,请从传感器上取下跟踪器以避免损坏。通过取下顶部的塞子并将其倒置以排出水来拆卸传感器。拆下耦合锥体并将其拆卸,让部件风干。
- 将传感器放回空位,并确保所有机械臂组件以 90° 紧固,以便存放到下一次 TUS 实验会话。

图 5:用于神经导航的基准点。 眼镜(左)和头带(右),附有基准点,用于主体跟踪。受试者的头部用下巴托和脑后稳定器固定。 请单击此处查看此图的较大版本。
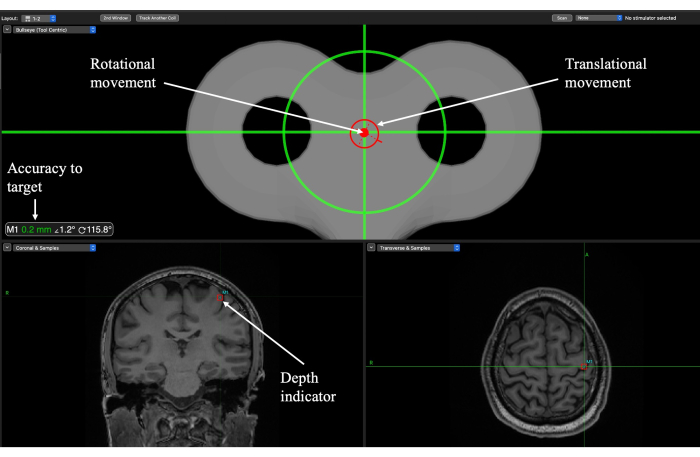
图 6:在初级运动皮层 (M1) 目标的 TUS 递送过程中用于目标定位的 Brainsight 神经导航屏幕。 旋转和平移指示器指导实验者将传感器放置在头皮上的哪个位置以及何时达到轨迹角度。Accuracy to target (目标精度) 表示平移和旋转方向与目标的距离,应该用于微调运动。深度指示器显示焦点的深度,应用于将探头降低到适当的高度。 请单击此处查看此图的较大版本。
结果
图 7 显示了我们其中一项研究42 的比较会话样本,其中两个不同的参与者采用特定的超声参数(基频为 250 kHz,超声处理持续时间为 120 s,脉冲重复频率 (PRF) 为 100 Hz,占空比为 10%,ISPPA 为 5 W/cm²)。在这项研究中,从神经系统健康的受试者那里获得了具有 1 mm 各向同性分辨率的 T1-、T2-w 和 ZTE MRI 扫描。TMS 针对初级运动皮层 (M1),以评估不同 ...
讨论
在这种方法中,执行特定于主题的模拟以预测和评估将 TUS 应用于大脑可能产生的热和机械效应。参与者之间的数据集必须保持独立并仔细记录,因为使用不正确的扫描或数据文件会导致模拟不准确。当收集大量参与者扫描并一起执行规划时,确保正确标记图像和文件夹并在排序和保存文件时谨慎进行非常重要。
为了准确地执行仿真,必须对头骨进行正确建模,以获得对声学...
披露声明
作者没有需要声明的利益冲突。
致谢
这项工作得到了加拿大自然科学与工程研究委员会发现资助、INNOVAIT 计划、卡明医学研究基金、加拿大创新基金会(项目 36703)、霍奇基斯脑研究所 CAPRI 资助和阿尔伯塔省帕金森协会资助的部分支持。GBP 感谢加拿大卫生研究所 (FDN-143290) 和阿尔伯塔省校园创新主席计划的支持。
材料
| Name | Company | Catalog Number | Comments |
| 128-channel amplifier unit | Image Guided Therapy | This unit drives the H-317 transducer | |
| 24-channel head coil | General Electric | ||
| 3D printer | Raise3D | Pro2 | Filament thickness of 1.75mm. |
| 3T MRI scanner | General Electric | Discovery 750 HD | MR Console version DV26.0_R05_2008 |
| BabelBrain | Samuel Pichardo (University of Calgary) | Version 0.3.0 | Accessible at https://github.com/ProteusMRIgHIFU/BabelBrain. Executes thermal and acoustic simulations. |
| Blender | Blender Foundation | Version 3.4.1 | Accessible at https://www.blender.org. Blender is called automatically by BabelBrain. |
| Brainsight | Rogue Research | Version 2.5.2 | Used for target identification, trajectory planning, and execution of TUS delivery sessions. |
| Chair and chin/head holder | Rogue Research | To be used during TUS delivery session to ensure stability of participant’s head for optimized targeting. | |
| Custom-made coupling cone | University of Calgary team | 3D printed cone in acrylonitrile butadiene styrene (ABS), only required for H-317 transducer. | |
| dcm2niix | Chris Rorden (University of South Carolina) | Version 1.0.20220720 | Accessible at https://github.com/rordenlab/dcm2niix/releases. Used for pre-processing subject MR images. |
| Fiducials and headband or glasses | Brainsight, Rogue Research | ST-1325 (subject tracker), LCT-583 (large coil tracker) | Headband or glasses can be interchangeably used. |
| Headphones | Beats | Fit Pro True Wireless Earbuds | Wireless Bluetooth earbuds with disposable tips. |
| MacBookPro | Apple | M2 Max, 16”, 64GB RAM | Computer for completing trajectory planning and simulations |
| SimNIBS | Axel Thielscher (Technical University of Denmark) | Version 4.0.0 | Accessible at https://simnibs.github.io/simnibs/build/html.index.html |
| Syringe(s) | 10 mL, 60 mL | Used to add additional ultrasound gel to fill air pockets. | |
| Transducer | Sonicconcepts | H-317 | Other supported transducers include CTX_500 (NeuroFUS, Sonicconcepts), Single element, H-246 (Sonicconcepts), and Bsonix (Brainsonix) |
| Transducer film | Sonicconcepts | Polyurethane membrane | Interface between transducer and the subject |
| Ultrasound gel | Wavelength | Clear Ultrasound Gel | Coupling medium. |
| Windows Laptop | Acer | Aspire A717-71G, Intel Core i7-7700HQ, 16 GB RAM | System used to control 128-channel amplifier and generate sound through the headphones |
参考文献
- Baek, H., Pahk, K. J., Kim, H. A review of low-intensity focused ultrasound for neuromodulation. Biomed Eng Lett. 7 (2), 135-142 (2017).
- Rezayat, E., Toostani, I. G. A review on brain stimulation using low intensity focused ultrasound. Basic Clin Neurosci. 7 (3), 187-194 (2016).
- Dell'Italia, J., Sanguinetti, J. L., Monti, M. M., Bystritsky, A., Reggente, N. Current state of potential mechanisms supporting low intensity focused ultrasound for neuromodulation. Front Hum Neurosci. 16, 872639 (2022).
- Kim, H., et al. Suppression of EEG visual-evoked potentials in rats through neuromodulatory focused ultrasound. Neuroreport. 26 (4), 211-215 (2015).
- Yoon, K., et al. Effects of sonication parameters on transcranial focused ultrasound brain stimulation in an ovine model. PLoS One. 14 (10), e0224311 (2019).
- Dallapiazza, R. F., et al. Non-invasive neuromodulation and thalamic mapping with low-intensity focused ultrasound. J Neurosurg. 128 (3), 875-884 (2018).
- Folloni, D., et al. Manipulation of subcortical and deep cortical activity in the primate brain using transcranial focused ultrasound stimulation. Neuron. 101 (6), 1109-1116 (2019).
- Gulick, D. W., Li, T., Kleim, J. A., Towe, B. C. Comparison of electrical and ultrasound neurostimulation in rat motor cortex. Ultrasound Med Biol. 43 (12), 2824-2833 (2017).
- King, R. L., Brown, J. R., Newsome, W. T., Pauly, K. B. Effective parameters for ultrasound-induced in vivo neurostimulation. Ultrasound Med Biol. 39 (2), 312-331 (2013).
- Yoo, S. S., et al. Focused ultrasound modulates region-specific brain activity. Neuroimage. 56 (3), 1267-1275 (2011).
- Kim, H. C., et al. Transcranial focused ultrasound modulates cortical and thalamic motor activity in awake sheep. Sci Rep. 11 (1), 19274 (2021).
- Deffieux, T., et al. Low-intensity focused ultrasound modulates monkey visuomotor behavior. Curr Biol. 23 (23), 2430-2433 (2013).
- Munoz, F., et al. Long term study of motivational and cognitive effects of low-intensity focused ultrasound neuromodulation in the dorsal striatum of nonhuman primates. Brain Stimul. 15 (2), 360-372 (2022).
- Verhagen, L., et al. Offline impact of transcranial focused ultrasound on cortical activation in primates. ELife. 8, e40541 (2019).
- Fomenko, A., et al. Systematic examination of low-intensity ultrasound parameters on human motor cortex excitability and behavior. ELife. 9, e54497 (2020).
- Legon, W., Bansal, P., Tyshynsky, R., Ai, L., Mueller, J. K. Transcranial focused ultrasound neuromodulation of the human primary motor cortex. Sci Rep. 8 (1), 10007 (2018).
- Legon, W., et al. Transcranial focused ultrasound modulates the activity of primary somatosensory cortex in humans. Nat Neurosci. 17 (2), 322-329 (2014).
- Legon, W., Ai, L., Bansal, P., Mueller, J. K. Neuromodulation with single-element transcranial focused ultrasound in human thalamus. Hum Brain Mapp. 39 (5), 1995-2006 (2018).
- Legon, W., et al. A retrospective qualitative report of symptoms and safety from transcranial focused ultrasound for neuromodulation in humans. Sci Rep. 10, 5573 (2020).
- Forster, A., et al. Investigating the role of the right inferior frontal gyrus in control perception: A double-blind cross-over study using ultrasonic neuromodulation. Neuropsychologia. 187, 108589 (2023).
- Forster, A., et al. Transcranial focused ultrasound modulates the emergence of learned helplessness via midline theta modification. J Affect Disord. 329, 273-284 (2023).
- Ziebell, P., et al. Inhibition of midfrontal theta with transcranial ultrasound explains greater approach versus withdrawal behavior in humans. Brain Stimul. 16 (5), 1278-1288 (2023).
- Kim, H. C., Lee, W., Weisholtz, D. S., Yoo, S. S. Transcranial focused ultrasound stimulation of cortical and thalamic somatosensory areas in human. PLoS One. 18 (7), e0288654 (2023).
- Kim, Y. G., et al. Neuromodulation using transcranial focused ultrasound on the bilateral medial prefrontal cortex. J Clin Med. 11 (13), 3809 (2022).
- Chu, Y. C., Lim, J., Chien, A., Chen, C. C., Wang, J. L. Activation of mechanosensitive ion channels by ultrasound. Ultrasound Med Biol. 48 (10), 1981-1994 (2022).
- Kubanek, J., et al. Ultrasound modulates ion channel currents. Sci Rep. 6 (1), 24170 (2016).
- Prieto, M. L., Firouzi, K., Khuri-Yakub, B. T., Maduke, M. Activation of Piezo1 but not NaV1.2 channels by ultrasound at 43 MHz. Ultrasound Med Biol. 44 (6), 1217-1232 (2018).
- Quarato, C. M. I., et al. A review on biological effects of ultrasounds: Key messages for clinicians. Diagnostics. 13 (5), 855 (2023).
- Nowicki, A. Safety of ultrasonic examinations; thermal and mechanical indices. Med Ultrason. 22 (2), 203 (2020).
- Miller, D. L., et al. Overview of therapeutic ultrasound applications and safety considerations. J Ultrasound Med. 31 (4), 623-634 (2012).
- Aubry, J. F., et al. ITRUSST consensus on biophysical safety for transcranial ultrasonic stimulation. arXiv preprint arXiv. , 2311.05359 (2023).
- Guo, H., et al. Ultrasound produces extensive brain activation via a cochlear pathway. Neuron. 98 (5), 1020-1030 (2018).
- Sato, T., Shapiro, M. G., Tsao, D. Y. Ultrasonic neuromodulation causes widespread cortical activation via an indirect auditory mechanism. Neuron. 98 (5), 1031-1041 (2018).
- Braun, V., Blackmore, J., Cleveland, R. O., Butler, C. R. Transcranial ultrasound stimulation in humans is associated with an auditory confound that can be effectively masked. Brain Stimul. 13 (6), 1527-1534 (2020).
- Martin, E., et al. ITRUSST consensus on standardised reporting for transcranial ultrasound stimulation. Brain Stimul. , S1935861X24000718 (2024).
- Pichardo, S. BabelBrain: An open-source application for prospective modeling of transcranial focused ultrasound for neuromodulation applications. IEEE Trans Ultrason Ferroelectr Freq Control. 70 (7), 587-599 (2023).
- Khoshnevisan, A., Allahabadi, N. S. Neuronavigation: Principles, clinical applications and potential pitfalls. Iran J Psychiatry. 7 (2), 97-103 (2012).
- Xu, L., et al. Characterization of the targeting accuracy of a neuronavigation-guided transcranial fus system in vitro, in vivo, and in silico. IEEE Trans Biomed Eng. 70 (5), 1528-1538 (2023).
- Kuehn, B., et al. Sensor-based neuronavigation: Evaluation of a large continuous patient population. Clin Neurol Neurosurg. 110 (10), 1012-1019 (2008).
- Ambrosini, E., et al. StimTrack: An open-source software for manual transcranial magnetic stimulation coil positioning. J Neurosci Methods. 293, 97-104 (2018).
- Kop, B. R., et al. Auditory confounds can drive online effects of transcranial ultrasonic stimulation in humans. eLife. , (2024).
- Zadeh, A. K., et al. The effect of transcranial ultrasound pulse repetition frequency on sustained inhibition in the human primary motor cortex: A double-blind, sham-controlled study. Brain Stimul. 17 (2), 476-484 (2024).
- Mohammadjavadi, M., et al. Elimination of peripheral auditory pathway activation does not affect motor responses from ultrasound neuromodulation. Brain Stimul. 12 (4), 901-910 (2019).
- Johnstone, A., et al. A range of pulses commonly used for human transcranial ultrasound stimulation are clearly audible. Brain Stimul. 14 (5), 1353-1355 (2021).
- Zeng, K., et al. Induction of human motor cortex plasticity by theta burst transcranial ultrasound stimulation. Ann Neurol. 91 (2), 238-252 (2022).
- Lee, W., et al. Image-guided transcranial focused ultrasound stimulates human primary somatosensory cortex. Sci Rep. 5, 8743 (2015).
- Ridding, M. C., Rothwell, J. C. Is there a future for therapeutic use of transcranial magnetic stimulation. Nat Rev Neurosci. 8 (7), 559-567 (2007).
- Nicolo, P., Ptak, R., Guggisberg, A. G. Variability of behavioural responses to transcranial magnetic stimulation: Origins and predictors. Neuropsychologia. 74, 137-144 (2015).
- Horvath, J. C., Carter, O., Forte, J. D. No significant effect of transcranial direct current stimulation (tDCS) found on simple motor reaction time comparing 15 different simulation protocols. Neuropsychologia. 91, 544-552 (2016).
- Horvath, J. C., Vogrin, S. J., Carter, O., Cook, M. J., Forte, J. D. Effects of a common transcranial direct current stimulation (tDCS) protocol on motor evoked potentials found to be highly variable within individuals over 9 testing sessions. Exp Brain Res. 234 (9), 2629-2642 (2016).
- Angla, C., Larrat, B., Gennisson, J., Chatillon, S. Transcranial ultrasound simulations: A review. Med Phys. 50 (2), 1051-1072 (2023).
- Miller, G. W., Eames, M., Snell, J., Aubry, J. Ultrashort echo-time MRI versus CT for skull aberration correction in MR-guided transcranial focused ultrasound: In vitro comparison on human calvaria. Med Phys. 42 (5), 2223-2233 (2015).
- Miscouridou, M., Pineda-Pardo, J. A., Stagg, C. J., Treeby, B. E., Stanziola, A. Classical and learned MR to pseudo-CT mappings for accurate transcranial ultrasound simulation. IEEE Trans Ultrason Ferroelectr Freq Control. 69 (10), 2896-2905 (2022).
- Pichardo, S., et al. A viscoelastic model for the prediction of transcranial ultrasound propagation: application for the estimation of shear acoustic properties in the human skull. Phys Med Biol. 62 (17), 6938-6962 (2017).
- Pichardo, S. . ProteusMRIgHIFU/BABELVISCOFDTD: Software Library for FDTD of viscoelastic equation using a staggered grid arrangement with support for GPU and CPU backends. , (2024).
- Aubry, J. F., et al. Benchmark problems for transcranial ultrasound simulation: Intercomparison of compressional wave models. J Acoust Soc Am. 152 (2), 1003-1019 (2022).
- Pinton, G., et al. Attenuation, scattering, and absorption of ultrasound in the skull bone: Absorption of ultrasound in the skull bone. Med Phys. 39 (1), 299-307 (2011).
- Chaplin, V., et al. On the accuracy of optically tracked transducers for image-guided transcranial ultrasound. Int J Comput Assist Radiol Surg. 14 (8), 1317-1327 (2019).
- Wu, S. Y., et al. Efficient blood-brain barrier opening in primates with neuronavigation-guided ultrasound and real-time acoustic mapping. Sci Rep. 8 (1), 7978 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。