Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Pipeline para la planificación y ejecución de experimentos de neuromodulación por ultrasonido transcraneal en humanos
En este artículo
Resumen
La estimulación transcraneal por ultrasonido (TUS) es una técnica emergente de neuromodulación no invasiva que requiere una planificación cuidadosa de simulaciones acústicas y térmicas. La metodología describe un proceso de procesamiento de imágenes y simulación de ultrasonido para una planificación eficiente, fácil de usar y simplificada para la experimentación humana con TUS.
Resumen
La estimulación transcraneal por ultrasonido (TUS) es una técnica emergente de neuromodulación no invasiva capaz de manipular estructuras tanto corticales como subcorticales con alta precisión. La realización de experimentos con seres humanos requiere una planificación cuidadosa de las simulaciones acústicas y térmicas. Esta planificación es esencial para ajustar la interferencia ósea con la forma y la trayectoria del haz de ultrasonido y para garantizar que los parámetros del TUS cumplan con los requisitos de seguridad. Se adquieren imágenes de resonancia magnética (RM) ponderadas en T1 y T2, junto con ecos de tiempo cero (ZTE) con resolución isotrópica de 1 mm (alternativamente tomografías computarizadas de rayos X (TC)) para la reconstrucción y simulaciones del cráneo. El mapeo de objetivos y trayectorias se realiza utilizando una plataforma de neuronavegación. SimNIBS se utiliza para la segmentación inicial del cráneo, la piel y los tejidos cerebrales. La simulación de TUS se lleva a cabo con la herramienta BabelBrain, que utiliza el escaneo ZTE para producir imágenes sintéticas de TC del cráneo que se convertirán en propiedades acústicas. Utilizamos un transductor de ultrasonido Phased Array con capacidades de dirección eléctrica. La dirección en Z se ajusta para garantizar que se alcance la profundidad objetivo. Otras configuraciones de transductor también son compatibles con la herramienta de planificación. Se realizan simulaciones térmicas para garantizar que los requisitos de temperatura e índice mecánico estén dentro de las pautas acústicas para TUS en sujetos humanos, según lo recomendado por la FDA. Durante las sesiones de entrega de TUS, un brazo mecánico ayuda en el movimiento del transductor a la ubicación requerida mediante un sistema de localización estereotáctica sin marco.
Introducción
Las técnicas de neuroestimulación no invasivas comúnmente utilizadas incluyen la estimulación transcraneal de corriente directa (tDCS) y la estimulación magnética transcraneal (TMS). Sin embargo, ambos tienen una profundidad de penetración limitada y una baja precisión 1,2. Por el contrario, la ecografía transcraneal (TUS) es una técnica emergente no invasiva capaz de mejorar o suprimir la actividad neuronal 3,4,5 y dirigirse a las estructuras corticales o subcorticales con precisión milimétrica 6,7. Los modelos animales que utilizan roedores 4,8,9, conejos10, ovejas 5,11, cerdos6 y primates no humanos 7,12,13,14 han demostrado la eficacia y seguridad del TUS. Los estudios han demostrado que dirigirse a varias regiones del cerebro puede provocar movimientos de las extremidades8 en ratas, potenciales evocados somatosensoriales (SSEP) en cerdos6 y cambios en la actividad visomotora12, la toma de decisiones cognitivas y motivacionales en primates no humanos13, entre otros cambios en el comportamiento. En humanos, se ha observado que el TUS cambia los potenciales evocados motores (MEP) y el rendimiento en una tarea de tiempo de reacción cuando se dirige a la corteza motora primaria15,16 y altera el rendimiento en una tarea de discriminación táctil y SSEP cuando se dirige a la corteza somatosensorial17 y el tálamo sensorial18. Los análisis histológicos no han revelado cambios estructurales macroscópicos o microscópicos asociados con el TUS en cerdos6, ovejas 5,11, conejos10 y primates no humanos14, y no se han observado efectos secundarios que difieran significativamente de otras técnicas de neuroestimulación no invasivas19.
TUS utiliza ultrasonidos focalizados pulsados de baja intensidad a una frecuencia entre 200 kHz y 700 kHz para producir un efecto neuromodulador transitorio. La intensidad media del pulso de pico espacial (Isppa) típica in situ es de 10 W/cm2 o menos, con ciclos de trabajo informados (porcentaje de tiempo cuando el ultrasonido está activado) que oscila entre el 0,5% y el 70% en humanos 20,21,22,23,24. A pesar de que se ha propuesto que los mecanismos de la neuromodulación de la TUS involucran principalmente la agitación mecánica de las membranas lipídicas que conduce a la apertura de canales iónicos 25,26,27, los posibles efectos térmicos y de cavitación no pueden ser ignorados. Se evalúan a través de índices mecánicos (MI) y térmicos (TI). El IM describe los efectos biológicos relacionados con la cavitación previstos que ocurrirán con el TUS, mientras que el TI describe el aumento potencial de la temperatura dentro de los tejidos después de la aplicación de ultrasonido28,29. Además, cambiar la frecuencia y la intensidad de entrada también hace que cambien el MI y el TI. Las frecuencias más altas tienen una mejor resolución espacial y disminuyen la probabilidad de bioefectos mecánicos; sin embargo, tienen una absorción más fuerte en el tejido, lo que aumenta el potencial de aumento de la temperatura28. Alternativamente, las frecuencias más bajas a la misma intensidad aumentan el IM. Del mismo modo, el aumento de la intensidad tiende a aumentar la magnitud de los bioefectos mecánicos y térmicos30. Por lo tanto, es imperativo que se realice una planificación y simulación cuidadosas antes de las sesiones de experimentación para todos los parámetros de TUS que se implementarán.
La planificación de un experimento TUS requiere la identificación del objetivo y la trayectoria de interés y la realización de simulaciones térmicas y acústicas. Las simulaciones ayudan a optimizar los efectos mecánicos y a mitigar los efectos térmicos del TUS en los tejidos. Requieren comprender la predicción del calentamiento del cráneo, la amplitud de la presión del ultrasonido en el punto focal, la corrección focal y otros calentamientos dentro del cráneo y la piel. Una simulación adecuada garantiza que el punto focal alcance el objetivo de interés y se sigan los parámetros de seguridad para el uso de ultrasonidos establecidos por las directrices de seguridad biofísica recomendadas por el Consorcio Internacional de Normas y Seguridad de la Estimulación Ultrasónica Transcraneal (ITRUSST)31, que se basan en las recomendaciones de la FDA y Health Canada. Estudios recientes también han destacado un efecto de confusión auditiva acompañado de TUS 32,33,34 en animales y humanos, por lo que la estimulación de TUS puede activar las vías auditivas en el cerebro para provocar respuestas 32,33,34. La transección de los nervios auditivos32, la eliminación del líquido coclear32 o la sordera química33 en roedores se han empleado para disminuir estos efectos en los animales. En los seres humanos, la administración de un tono auditivo a través de auriculares se ha utilizado para enmascarar eficazmente el ruido auditivo del TUS, controlando la actividad auditiva inducida por el TUS34. Esto pone de manifiesto la necesidad de controlar el ruido auditivo en condiciones de estimulación simulada, que debe incorporarse a la planificación, el diseño y la implementación del protocolo.
Aquí, presentamos una guía sobre cómo completar adecuadamente la preparación (paso 1, paso 2), la planificación (paso 3), las simulaciones (paso 4) y la entrega de TUS (paso 5) necesarios para realizar el experimento de neuromodulación TUS en humanos.
Protocolo
Todos los métodos que involucran el uso de sujetos humanos se realizaron de acuerdo con la Conducta Ética para la Investigación con Seres Humanos, y el protocolo fue aprobado por la Junta Conjunta de Ética en Investigación en Salud (CHREB) de la Universidad de Calgary. Todos los sujetos dieron su consentimiento informado por escrito antes de participar. Se requirió que los participantes humanos fueran adultos diestros sanos de entre 18 y 40 años dispuestos y capaces de completar una resonancia magnética (IRM). Los criterios de exclusión incluyeron antecedentes familiares de convulsiones, trastornos del estado de ánimo o cardiovasculares, traumatismo auditivo, dependencia del alcohol o las drogas, uso de medicamentos recetados, implantes metálicos, incluido un marcapasos, embarazo, trastornos cardiovasculares, antecedentes de trastornos neurológicos o psiquiátricos, incapacidad para comunicarse con el investigador y el personal del estudio, e incapacidad legal o capacidad legal limitada. El protocolo que se describe a continuación sigue las recomendaciones de ITRUSST sobre la notificación estandarizada de los estudios TUS35. Los detalles del equipo, el software y los enlaces web necesarios utilizados en este estudio se enumeran en la Tabla de Materiales.
1. Resonancia magnética de alta resolución
- Imagine al participante usando una bobina de cabeza/cuello de 24 canales.
NOTA: Alternativamente, el mejor espiral de cabeza/cuello disponible en el sitio es suficiente para obtener una resonancia magnética anatómica. - Recopile imágenes de resonancia magnética ponderadas en T1 y T2, y secuencias de eco en tiempo cero (ZTE) con una resolución de 1 mm.
NOTA: Se recomienda que las imágenes de RMN se tomen sin que el participante use auriculares sobre la oreja, ya que puede afectar la reconstrucción de la imagen y dificultar los pasos posteriores de planificación e implementación. En su lugar, se recomienda que el participante solo use tapones para los oídos por seguridad en la RMN.- Para la obtención de imágenes ponderadas en T1, utilice una secuencia de eco de gradiente estropeado rápido (FSPGR) preparada para la recuperación de inversión 3D con los siguientes parámetros: tiempo de repetición (TR) = 8,4 ms, tiempo de eco (TE) = 3,2 ms, tiempo de inversión (TI) = 650 ms, ángulo de giro de 10 grados, un campo de visión de 256 mm x 256 mm x 188 mm, tamaño de matriz de 256 x 256 x 188, Factor GRAPPA (ARC) de 2 en la dirección de codificación de fase y orientación sagital-oblicua para aproximar la alineación con AC-PC.
NOTA: El tiempo total de escaneo es de 5 min y 21 s. - Para la obtención de imágenes ponderadas en T2, utilice un eco de espín rápido (FSE) 3D con los siguientes parámetros: TR = 3000 ms, TE = 60-90 ms, una longitud de tren de eco de 130, un campo de visión de 256 mm x 225 mm x 188 mm, un tamaño de matriz de 256 x 256 x 188 y una orientación sagital-oblicua que se aproxime a la alineación con el eje AC-PC. Se utilizó un factor GRAPPA (ARC) de dos en la codificación de fase y en la dirección del corte.
NOTA: El tiempo total de escaneo es de 3 min y 58 s. - Para las imágenes ZTE, utilice un escaneo ZTE 3D isotrópico con los siguientes ajustes: TR = 698 ms, TE = 16 μs, ángulo de giro de 1 grado, ancho de banda del receptor de 62,5 kHz, número de promedios = 3,5, un campo de visión de 256 mm x 256 mm x 256 mm, tamaño de la matriz de 256 x 256 x 256.
NOTA: El tiempo total de escaneo es de 5 min y 23 s.
NOTA: Las imágenes de resonancia magnética deben completarse antes de que pueda comenzar la planificación de TUS.
- Para la obtención de imágenes ponderadas en T1, utilice una secuencia de eco de gradiente estropeado rápido (FSPGR) preparada para la recuperación de inversión 3D con los siguientes parámetros: tiempo de repetición (TR) = 8,4 ms, tiempo de eco (TE) = 3,2 ms, tiempo de inversión (TI) = 650 ms, ángulo de giro de 10 grados, un campo de visión de 256 mm x 256 mm x 188 mm, tamaño de matriz de 256 x 256 x 188, Factor GRAPPA (ARC) de 2 en la dirección de codificación de fase y orientación sagital-oblicua para aproximar la alineación con AC-PC.
2. Preprocesamiento de las imágenes de los participantes
- Convierta archivos de escaneo DICOM T1-w, T2-w y ZTE de DICOM a formato Nifti con la herramienta dcm2niix. En una ventana de terminal, ejecute: dcm2niix .
NOTA: La herramienta dcm2niix está disponible en GitHub (consulte Tabla de materiales). La herramienta BabelBrain registra conjuntamente las imágenes del participante para dar cabida a las imágenes recogidas en días separados. Si las imágenes T1-w no son isotrópicas, se vuelven a muestrear a vóxeles isótropos de 1 mm; sin embargo, las imágenes de TC/ZTE no lo son. En su lugar, las máscaras para la simulación se vuelven a muestrear a la resolución final en términos de PPW. No se requieren pasos adicionales de co-registro o alineación. - Ejecute el corregistro y la extracción de mascarillas de tejido utilizando la herramienta de encanto de SimNIBS. En una ventana de terminal, ejecute: charm , donde es una cadena para la identificación. En este punto, la planificación del experimento se puede pausar y continuar en otro momento.
NOTA: Los archivos creados se guardarán en un subdirectorio m2m , que se utilizará en las siguientes etapas de planificación. El preprocesamiento de imágenes con la herramienta charm es necesario para la segmentación de tejidos, ya que es necesario para su uso en la herramienta BabelBrain36.
3. Planificación de la trayectoria
- Abra Brainsight, haga clic en Nuevo proyecto vacío y cargue la imagen T1-w Nifti del participante, producida en el paso 2.1.
NOTA: Si se utiliza una versión de Brainsight anterior a la v2.5.3, se puede elegir "Nuevo Proyecto Vacío" o "Nuevo Proyecto SimNIBS". Si se utiliza Brainsight v2.5.3 en adelante, hay integración entre Brainsight y BabelBrain y se recomienda encarecidamente hacer clic en "Nuevo proyecto SimNIBS"; Sin embargo, ambos siguen siendo suficientes para completar los pasos de planificación. "Nuevo proyecto vacío" requiere cargar la imagen T1-w, mientras que "Nuevo proyecto SimNIBS" requiere cargar un archivo .msh que carga directamente la imagen T1-w. Todas las demás funcionalidades y pasos siguen siendo los mismos. - Haga clic en Superposiciones y, a continuación, en Configurar superposiciones para crear y ver una superposición. Haga clic en Agregar para seleccionar el archivo que desea superponer.
NOTA: Si el objetivo no se puede visualizar en una imagen T1-w, primero debe localizarse en una imagen T2-w registrada conjuntamente (por lo que las coordenadas T1-w y T2-w son las mismas). A continuación, transfiera las coordenadas a una imagen T1-w para los siguientes pasos de planificación. La herramienta de acceso en el paso 2.2 produce una imagen T2-w co-registrada en la ruta del archivo m2m /T2_reg.nii.gz. - Cierre la sección de superposiciones, haga clic en la pestaña Destinos , seguido de Configurar destinos. Haga clic en el botón azul de información para cambiar la opacidad, el color y el umbral de la superposición para permitir una comparación de las imágenes.
NOTA: Esto se puede realizar para visualizar imágenes Nifti corregistradas y debe usarse para observar cómo las simulaciones acústicas se superpondrán con el objetivo. - Haga clic en la pestaña Reconstrucciones , luego en el menú desplegable Nueva Reconstrucción... . Haga clic en Skin, seguido de Compute Skin en la nueva ventana. Una vez completado, haga clic en el botón Cerrar en la esquina superior izquierda de la ventana.
- Dentro de la pestaña "Reconstrucciones", haga clic en el menú desplegable Nueva Reconstrucción... seguido de Curvilínea Cerebral Completa.
- Ajuste cada cuadro en las imágenes sagitales (Figura 1A), coronales (Figura 1B) y transversales (Figura 1C) arrastrando los bordes del cuadro verde, de modo que las líneas rodeen firmemente el cerebro (Figura 1).
- Desplácese por todas las rodajas para asegurarse de que no se superpongan los bordes del pañuelo. Haga clic en Calcular curvilíneo y ajuste la profundidad de la cáscara a 4 mm (Figura 1D).
NOTA: El curvilíneo cerebral completo proporciona una reconstrucción en 3D de la corteza, que se puede pelar para observar diferentes profundidades. Permite la colocación precisa y consistente de una bobina TMS sobre el cerebro para localizar la región de interés.
- Haga clic en la pestaña Puntos de referencia en Brainsight, seguido de Configurar puntos de referencia.
- Coloque el punto de mira (cursor) en la punta de la nariz y, en el campo "Nombre:", etiquete el punto de referencia "Nariz" (Figura 2A). Coloque el punto de mira entre los ojos por encima del puente de la nariz y etiquete el hito como "Nasion" (Figura 2A).
- Coloque el punto de mira en la oreja izquierda y etiquete el punto de referencia como "Oreja L" (Figura 2B). Coloque el punto de mira en la oreja derecha y etiquete el punto de referencia "Oreja R" (Figura 2C).
- Haga clic en la pestaña Objetivos y utilice el punto de mira (cursor) para localizar el objetivo de interés.
- Coloque el punto de mira (cursor) en la ubicación del objetivo deseado y use los conmutadores de ángulo en el lado derecho de la pantalla para establecer el ángulo de trayectoria.
- Una vez seleccionado el objetivo y la trayectoria deseados, haga clic en el menú desplegable Nuevo y elija Trayectoria. Asigne un nombre al objetivo escribiendo en el cuadro de texto junto a "Nombre:".
- Exporte el objetivo haciendo clic en Exportar... y guárdelo en la carpeta de asunto correspondiente. Una vez guardado el archivo, la planificación se puede pausar y el experimento se puede reiniciar más tarde.
NOTA: El objetivo se utilizará en los pasos posteriores para completar las simulaciones térmicas y acústicas.
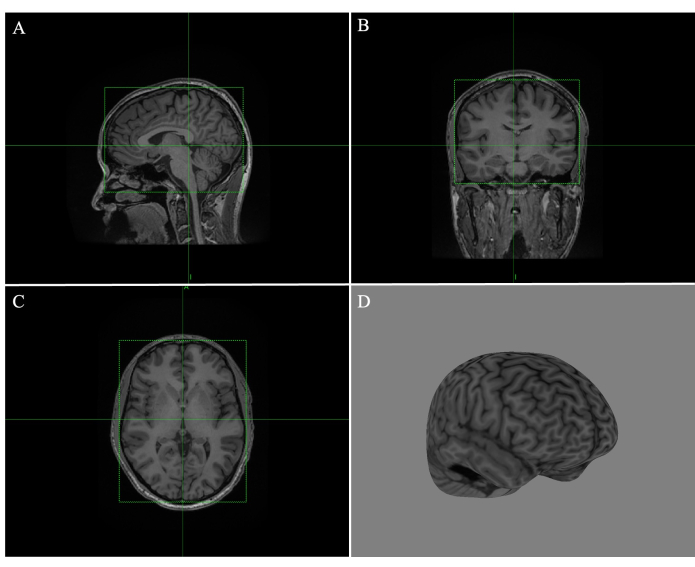
Figura 1: Creación de un curvilíneo cerebral completo en Brainsight. (A) Cuadro ajustado al borde de la imagen de resonancia magnética sagital. (B) Caja ajustada al borde de la imagen de RM coronal. (C) Caja ajustada al borde de la imagen de resonancia magnética transversal. (D) Reconstrucción curvilínea completa del cerebro con una profundidad de pelado de 4 mm. Haga clic aquí para ver una versión más grande de esta figura.
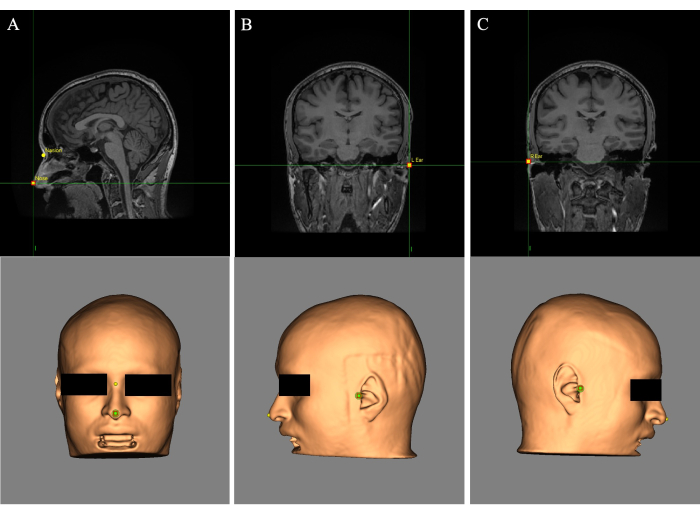
Figura 2: Puntos de referencia colocados en la reconstrucción de la piel y la imagen de resonancia magnética. (A) Ubicación de la nariz y los puntos de referencia. (B) Colocación de puntos de referencia en la oreja izquierda. (C) Colocación de puntos de referencia en la oreja derecha. Haga clic aquí para ver una versión más grande de esta figura.
4. Simulaciones con BabelBrain
NOTA: Los detalles para la simulación con BabelBrain se pueden consultar en el manual de BabelBrain: https://proteusmrighifu.github.io/BabelBrain/index.html.
- Abra BabelBrain y seleccione los archivos necesarios para las simulaciones acústicas y térmicas.
NOTA: Esta presentación utiliza un transductor de ultrasonido multielemento (Phased Array); Sin embargo, otros transductores son totalmente compatibles con este software de planificación. Este programa puede completar simulaciones para transductores individuales, CTX_500, H-317, H-246 y transductores. En el siguiente método, se utilizará el H-317 como transductor seleccionado.- Seleccione el archivo txt previamente exportado desde Brainsight durante el paso 3.7.3 haciendo clic en Seleccionar Trayectoria... y eligiendo el archivo de participante apropiado. Haga clic en Seleccionar SimNIBS... para elegir el archivo SimNIBS (nombre m2m_folder) creado en el paso 2. Haga clic en Seleccionar T1W... y elija la imagen T1-w producida en el paso 2.1 utilizada anteriormente para el mapeo de objetivos y trayectorias.
- En el menú desplegable junto a la etiqueta "¿Usar tomografía computarizada?", elija TC real si usa una tomografía computarizada, ZTE si usa una exploración ZTE o NO si usa una máscara simplificada generada por la herramienta de acceso si solo están disponibles imágenes T1 y T2-w. Cuando utilice una imagen CT o ZTE, haga clic en el menú desplegable Correg.? seguido de CT a MR. Haga clic en Seleccionar y elija la imagen correspondiente del archivo de participante correspondiente.
- Haga clic en "Seleccionar perfil térmico..." y elija el archivo de perfil térmico que describe los parámetros de sonicación del experimento en términos de duración activada, duración desactivada y ciclo de trabajo.
NOTA: Los detalles se pueden consultar en el manual de BabelBrain: https://proteusmrighifu.github.io/BabelBrain/index.html. Ejemplos de perfiles están disponibles en https://github.com/ProteusMRIgHIFU/BabelBrain/tree/main/Profiles. - Haga clic en el menú desplegable junto a "Transductor" y seleccione el transductor utilizado para la experimentación. Haga clic en el menú desplegable junto a "Backend de computación" y elija el backend de computación de la computadora que ejecuta las simulaciones. Una vez introducida toda la información, haga clic en CONTINUAR para completar el resto de las simulaciones.
- Subpaso A: Calcular mascarilla.
- Seleccione la frecuencia de ultrasonido del transductor y el punto por longitud de onda (PPW) adecuado.
NOTA: 6 PPW es suficiente para la mayoría de los escenarios. - Deje el rango ZTE normalizado y las unidades Hounsfield (HU) como están.
NOTA: Si se utiliza una TC real, solo aparecerá el umbral de HU. Si no se proporciona una exploración ZTE o TC, esta entrada estará ausente. - Haga clic en Calcular máscara de planificación. Inspeccione la imagen, verificando que los límites de la piel, el cráneo y el cerebro se reconocieron con precisión.
NOTA: Si hay discrepancias, ajuste el rango ZTE normalizado y/o el umbral de HU.
- Seleccione la frecuencia de ultrasonido del transductor y el punto por longitud de onda (PPW) adecuado.
- Subetapa B: Simulación acústica. Haga clic en la pestaña Paso 2 - Ac Sim para abrir.
NOTA: Esta pestaña tendrá un aspecto diferente en función del transductor seleccionado. Lo que sigue es específico del transductor H-317.- Ajuste la distancia desde el cono hasta el enfoque para reflejar la distancia desde la superficie del cono hasta el objetivo escribiendo la distancia adecuada.
NOTA: Esto está dictado por el cono físico que se utilizará en los experimentos. - Ejecute la simulación haciendo clic en el botón Calcular campos .
- Ajuste el valor de la dirección Z (mm) para que el punto de mira (que indica el objetivo) esté en el centro del punto focal (Figura 3). Presione las flechas hacia arriba o hacia abajo o ingrese manualmente el valor requerido, luego haga clic en Calcular campos.
NOTA: Los valores positivos dirigirán el punto focal más profundamente en el cerebro, mientras que los valores negativos harán que el punto focal se mueva superficialmente. - Ajuste la mecánica X/Y si el punto focal es lateral al objetivo previsto. Deje Z mecánico como está. Haga clic en Calcular campos.
NOTA: Z mecánico se recalcula en función de la distancia desde el cono en 4.3.1. Si es necesario ajustar la dirección Z, la mecánica X/Y o la profundidad máxima más allá del objetivo después de completar un cálculo, se deben volver a calcular los archivos de simulación acústica. Haga clic en Calcular campos y seleccione Sí para volver a calcular. Seleccione No para volver a cargar los archivos existentes.
- Ajuste la distancia desde el cono hasta el enfoque para reflejar la distancia desde la superficie del cono hasta el objetivo escribiendo la distancia adecuada.
- Subetapa C: Simulación térmica. Haga clic en la pestaña Paso 3 - Simulación térmica , luego haga clic en Calcular campos térmicos. Evaluar las simulaciones mecánicas y térmicas (Figura 4) para asegurarse de que cumplen con las directrices acústicas en seres humanos según lo recomendado por ITRUSST31 (índice mecánico (IM) en tejidos blandos ≤1,9; aumento térmico ≤2 °C, dosis térmica ≤0,25 CEM43, tiempo de exposición restringido a 80 min para 1,5 < índice térmico craneal (TIC) ≤ 2,0, 40 min para 2,0 < TIC ≤ 2,5, 10 s para 2,5 < TIC ≤ 3,0, 160 s para 3,0 < TIC ≤ 4,0, 40 s para 4,0 < TIC ≤ 5,0 y 10 s para 5,0 < TIC ≤ 6,0).
NOTA: BabelBrain resuelve la Ecuación de Transferencia de Biocalor para estimar el aumento de la temperatura36. En raras ocasiones, pueden ocurrir vóxeles anormales de alta temperatura, en cuyo caso se deben analizar las imágenes de resonancia magnética si alguna característica anatómica podría explicar el aumento inusual de la temperatura.- Ajuste laI sppa haciendo clic en las flechas hacia arriba o hacia abajo junto al cuadro Isppa (W/cm2) o introduciendo manualmente un valor superior a 0,1 para observar cómo cambian los parámetros con diferentes intensidades.
NOTA: Un resumen de todas las intensidades, cambios de temperatura e índices mecánicos se puede exportar como un archivo CSV como referencia. El software calcula la intensidad requerida en condiciones de agua (Isppa en agua) que debe aplicarse para lograr la intensidad deseada in situ. - Haga clic en los botones MTB, MTS y MTC en la región inferior de la interfaz para ver el corte con la temperatura más alta en el cerebro, la piel y el cráneo. Una vez finalizado el paso de simulación térmica, se completan las simulaciones.
NOTA: Los archivos se guardarán automáticamente en la misma ubicación que la imagen T1-w.
NOTA: Los archivos acústicos con un <... FullElasticSolution_Sub_NORM.nii.gz> se puede cargar en Brainsight para visualizar la superposición de campo acústico en el espacio T1. Habrá archivos para condiciones de solo agua (con el infijo "Agua" en el nombre del archivo) y archivos para condiciones de presencia de tejido (sin infijo en el nombre del archivo). Siga los pasos de la nota siguiente al paso 3.1 para agregar una superposición. Después del paso de simulación térmica, las simulaciones se completan y el experimento se puede pausar hasta la sesión de entrega de TUS.
- Ajuste laI sppa haciendo clic en las flechas hacia arriba o hacia abajo junto al cuadro Isppa (W/cm2) o introduciendo manualmente un valor superior a 0,1 para observar cómo cambian los parámetros con diferentes intensidades.
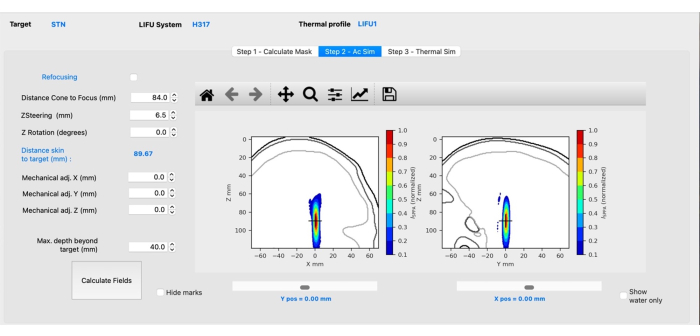
Figura 3: Simulación acústica con BabelBrain. Haga clic aquí para ver una versión más grande de esta figura.
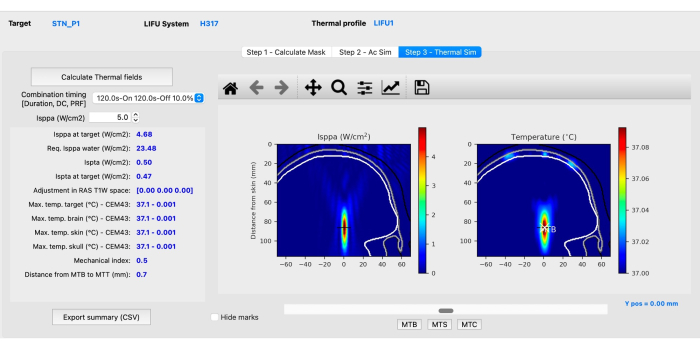
Figura 4: Simulación térmica con BabelBrain. Haga clic aquí para ver una versión más grande de esta figura.
5. Sesión de entrega de TUS
- Abra Brainsight y haga clic en Abrir proyecto existente. Seleccione el archivo Brainsight creado y guardado durante el mapeo de trayectorias y objetivos.
- Haga clic en Sesiones para comenzar una nueva sesión de experimentación. Haga clic en el menú desplegable y seleccione Nuevo, seguido de Sesión en línea. Haga clic en el nombre del objetivo seguido de Agregar y Siguiente para agregar el destino a la sesión de experimento y continuar con la ventana de experimentación.
NOTA: Si la entrega de TUS se realiza utilizando una computadora diferente a la que se utilizó para la planificación, Brainsight requerirá que se elija la imagen T1-w adecuada. En este caso, se abrirá una nueva ventana y se le pedirá que seleccione la imagen de participante T1-w asociada de su archivo de participante. - Haga clic en Ventana y Calibración de herramientas, y seleccione las herramientas que se utilizarán, seguido de Recalibrar.
NOTA: Este paso debe completarse para el transductor y todas las demás herramientas utilizadas durante la sesión experimental, como una bobina TMS.- Fije el rastreador de bobina grande y el bloque de calibración al transductor. Asegúrese de que la cámara pueda ver los fiduciales de ambas herramientas. Haga clic en Comenzar cuenta regresiva de calibración para volver a calibrar.
NOTA: Al guardar la calibración, se asegurará de que permanezca igual para ese día de experimentos. Si esto no se realiza y la computadora se apaga, el equipo requerirá una recalibración.
- Fije el rastreador de bobina grande y el bloque de calibración al transductor. Asegúrese de que la cámara pueda ver los fiduciales de ambas herramientas. Haga clic en Comenzar cuenta regresiva de calibración para volver a calibrar.
- Configure el transductor de acuerdo con sus procedimientos de configuración para la experimentación. Retire el rastreador del transductor antes de configurarlo para que no se dañe.
NOTA: La configuración descrita es para el transductor H-317 con un cono de acoplamiento personalizado.- Ensamble el cono según sea necesario, colocando la película del transductor entre el cono y la tapa del extremo. Fije el cono de acoplamiento a la brida del transductor con tornillos, arandelas y tuercas, asegurándose de que todos estén apretados para que no haya fugas.
- Llene el transductor con agua desionizada y conecte los tubos de la bomba al transductor, conectando el tubo etiquetado como "IN" a "OUT" y el "OUT" a "IN". Tape el orificio de agua mientras presiona "DRAIN" en la bomba para aliviar la presión.
- Voltee el transductor al revés para aislar las burbujas de aire en la película, luego gírelo hacia arriba, permitiéndoles salir a través del tubo del transductor etiquetado como "OUT". Repita esto hasta que se eliminen todas las burbujas de aire visibles. Configure el transductor de modo que su tubo "OUT" esté inclinado hacia adelante y en el punto más alto, y déjelo con la bomba funcionando durante 30 minutos.
- Voltee el transductor boca abajo para verificar que se hayan eliminado todas las burbujas de aire. Si quedan algunas, aísle las burbujas de aire en la película y gire el transductor como antes para asegurarse de que salgan a través del tubo de "SALIDA". Repita hasta que se hayan eliminado todas las burbujas.
- Apague la bomba, desconecte las mangueras y bloquee el transductor en punto muerto. Vuelva a conectar el rastreador al transductor y continúe con la configuración del participante.
- Fije el rastreador de sujetos a la cabeza del participante utilizando gafas, una diadema colocada sobre las orejas y las cejas (Figura 5) o el rastreador adhesivo ligero. Asegúrese de que los fiduciales estén orientados de manera que sean visibles para la cámara y no sean bloqueados o golpeados por el transductor cuando se mueva hacia o una vez que haya alcanzado su posición final.
- Coloque la cámara frente al participante para que pueda ver el rastreador de sujetos y el puntero.
NOTA: Si no están visibles, el indicador en la parte inferior izquierda de la pantalla será rojo. Esto también se puede verificar ingresando a la pestaña "Polaris" en Brainsight.
- Coloque la cámara frente al participante para que pueda ver el rastreador de sujetos y el puntero.
- Haga clic en la pestaña Registro en Brainsight. Coloque el puntero en los cuatro puntos de referencia establecidos durante el paso 3.6, estabilizándolo con ambas manos, luego haga clic en Muestra e ir al siguiente punto de referencia.
NOTA: Es importante que la diadema o las gafas permanezcan ajustadas a la cabeza del participante y que el rastreador de sujetos no se mueva. Si esto sucede, vuelva a realizar el registro. Si los fiduciales deben girarse para acomodar el movimiento del transductor después de que se haya completado el registro, vuelva a realizar el registro. - Haga clic en la pestaña Validación para validar el registro de participante. Coloque ligeramente el puntero en varias posiciones a lo largo del cuero cabelludo y asegúrese de que todos los puntos tengan menos de 3 mm.
NOTA: Los sistemas comerciales de neuronavegación creados para TMS se están utilizando para la experimentación con TUS en humanos. Un error de traslación de 3 mm es aceptable para la calibración de transductores portátiles37, ya que es consistente con la precisión del objetivo38,39 y otros sistemas de neuronavegación40. El valor de 3 mm está integrado en el software de neuronavegación de Brainsight.- Si alguno de los puntos tiene más de 3 mm, haga clic en el botón Añadir para añadir puntos de referencia adicionales hasta un máximo de tres puntos. Si se requieren más de tres puntos para lograr una validación consistente por debajo de 3 mm, vuelva a realizar el registro.
NOTA: Para mejorar el éxito del registro, se recomienda que las imágenes de resonancia magnética se recojan sin que el participante use auriculares sobre la oreja, ya que puede afectar la reconstrucción de la imagen y dificultar el registro. Tenga cuidado de que el puntero se coloque lo más cerca posible del punto de referencia antes de hacer clic en Muestra e ir al siguiente punto de referencia, y asegúrese de que el puntero esté estabilizado con ambas manos. La validación proporciona la seguridad de que el promedio de todos los puntos a lo largo de la superficie del cuero cabelludo está por debajo del umbral. No continúe hasta que todas las ubicaciones aleatorias del cuero cabelludo estén por debajo del umbral de 3 mm.
- Si alguno de los puntos tiene más de 3 mm, haga clic en el botón Añadir para añadir puntos de referencia adicionales hasta un máximo de tres puntos. Si se requieren más de tres puntos para lograr una validación consistente por debajo de 3 mm, vuelva a realizar el registro.
- Asegure la cabeza del participante con el mentonera y el estabilizador colocados en la parte posterior de la cabeza para evitar el movimiento (Figura 5). Asegúrese de que estén cómodamente sentados en la silla durante todo el experimento.
- Haga clic en Realizar. Utilice el brazo mecánico para colocar el transductor sobre el objetivo de interés a lo largo de la trayectoria seleccionada.
NOTA: Asegúrese de practicar y familiarizarse con la forma en que los componentes del brazo mecánico se mueven para alcanzar el objetivo. El éxito en el posicionamiento del brazo mecánico se logra a través de la comprensión de la movilidad del brazo y estar familiarizado con la orientación de la cabeza, ya que esto depende en gran medida de la ubicación del objetivo.- Utilice el punto de mira en la ventana de diana para lograr la posición y el ángulo correctos (Figura 6). Alinee ambos círculos (traslación y rotación) para que se coloquen en el punto de mira y consulte la lectura de precisión para su verificación.
- Separe el cabello del sujeto a lo largo de su parte natural y peine con el gel de ultrasonido para asegurarse de que no haya bolsas de aire dentro del cabello. Si un área grande requiere acoplamiento, aplique gel de ultrasonido a la película del transductor. Llene las bolsas de aire restantes con gel de ultrasonido adicional con una jeringa.
- Baje el transductor a la altura adecuada observando cuando el punto de mira esté en el centro de la caja que rodea el objetivo (Figura 6). Esto indicará cuándo se ha alcanzado la profundidad objetivo adecuada.
- Un script de Python personalizado utiliza los resultados de las simulaciones del paso 4 para programar la unidad de 128 amplificadores y generar sonido a través de auriculares (https://github.com/ProteusMRIgHIFU/TUSApp). Si realiza un experimento en línea y/o doble ciego, asegúrese de que el audio enmascarado se reproduzca a través de auriculares34,41 o aumente el estímulo y lo desplace durante la duración de la ráfaga 42,43,44 como métodos para reducir los posibles efectos de confusión auditiva.
NOTA: En este paso, si utiliza una unidad disponible comercialmente, como un transductor CTX-500, prescriba la intensidad que se simuló en condiciones de agua, junto con otros parámetros (PRF, duración, ciclo de trabajo). El transductor H-317 utiliza un script dedicado para ejecutar el transductor; Por lo tanto, ese paso se omite en la presente comunicación.- Genere el audio de enmascaramiento en MATLAB para que se reproduzca al inicio de la entrega de TUS. El sonido durante la estimulación simulada combina una onda sinicular continua a 250 kHz, una onda cuadrada a una frecuencia de ráfaga de 100 Hz muestreada a 48 kHz, con ruido aleatorio para replicar de cerca el sonido producido por el transductor. Durante el TUS, solo se reproduce ruido aleatorio a través de los auriculares, ya que el sonido emitido por el transductor también será escuchado por el sujeto.
- Una vez finalizada la administración de TUS, retire el transductor, el gel y el rastreador de la cabeza del participante antes de cualquier procedimiento experimental posterior.
- Para limpiar el equipo TUS, retire el rastreador del transductor para evitar daños. Desmonte el transductor quitando el tapón de la parte superior y volteándolo boca abajo para drenar el agua. Retire el cono de acoplamiento y desmóntelo para permitir que las piezas se sequen al aire.
- Vuelva a poner el transductor en punto muerto y asegúrese de que todos los componentes del brazo estén bien bloqueados a 90° para su almacenamiento hasta la próxima sesión experimental de TUS.

Figura 5: Fiduciales a utilizar para la neuronavegación. Gafas (izquierda) y diadema (derecha) con fiduciales adjuntos para el seguimiento del sujeto. La cabeza del sujeto está asegurada con un mentonera y un estabilizador detrás de la cabeza. Haga clic aquí para ver una versión más grande de esta figura.
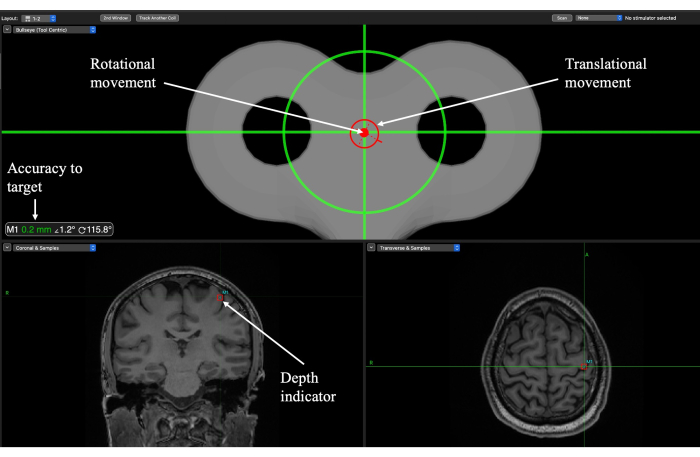
Figura 6: Pantalla de neuronavegación de Brainsight para la localización de objetivos durante la sesión de entrega de TUS para un objetivo de corteza motora primaria (M1). Los indicadores de rotación y traslación guían al experimentador sobre dónde colocar el transductor sobre el cuero cabelludo y cuándo se ha alcanzado el ángulo de trayectoria. La precisión del objetivo indica qué tan cerca está la orientación de traslación y rotación del objetivo y se debe usar para ajustar el movimiento. El indicador de profundidad muestra la profundidad del punto focal y debe utilizarse para bajar el transductor a la altura adecuada. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
La Figura 7 ilustra ejemplos comparativos de sesiones de uno de nuestros estudios42, con dos participantes distintos que emplean parámetros de ultrasonido específicos (frecuencia fundamental de 250 kHz, duración de la sonicación de 120 s, una frecuencia de repetición de impulsos (PRF) de 100 Hz, un ciclo de trabajo del 10% y unaSPPA I de 5 W/cm²). En esta investigación, se obtuvieron resonancias magnéticas T1-, T2-w y ZTE con una resolución isotró...
Discusión
En este método, se realizan simulaciones específicas de cada sujeto para predecir y evaluar los posibles efectos térmicos y mecánicos resultantes de la aplicación de TUS en el cerebro. Los conjuntos de datos entre los participantes deben permanecer separados y cuidadosamente documentados, ya que el uso de un escaneo o archivo de datos incorrecto dará lugar a simulaciones inexactas. Cuando se recopilan numerosos escaneos de participantes y la planificación se realiza en conjunto, es importante garantizar el etiquet...
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Este trabajo fue apoyado en parte por una beca Discovery del Consejo de Investigación de Ciencias Naturales e Ingeniería de Canadá, el programa INNOVAIT, el Fondo de Investigación Médica Cumming, la Fundación Canadiense para la Innovación (Proyecto 36703), la beca CAPRI del Instituto del Cerebro Hotchkiss y la financiación de la Asociación de Parkinson de Alberta. GBP agradece el apoyo de los Institutos Canadienses para la Investigación en Salud (FDN-143290) y el Programa de Cátedras Innovates del Campus Alberta.
Materiales
| Name | Company | Catalog Number | Comments |
| 128-channel amplifier unit | Image Guided Therapy | This unit drives the H-317 transducer | |
| 24-channel head coil | General Electric | ||
| 3D printer | Raise3D | Pro2 | Filament thickness of 1.75mm. |
| 3T MRI scanner | General Electric | Discovery 750 HD | MR Console version DV26.0_R05_2008 |
| BabelBrain | Samuel Pichardo (University of Calgary) | Version 0.3.0 | Accessible at https://github.com/ProteusMRIgHIFU/BabelBrain. Executes thermal and acoustic simulations. |
| Blender | Blender Foundation | Version 3.4.1 | Accessible at https://www.blender.org. Blender is called automatically by BabelBrain. |
| Brainsight | Rogue Research | Version 2.5.2 | Used for target identification, trajectory planning, and execution of TUS delivery sessions. |
| Chair and chin/head holder | Rogue Research | To be used during TUS delivery session to ensure stability of participant’s head for optimized targeting. | |
| Custom-made coupling cone | University of Calgary team | 3D printed cone in acrylonitrile butadiene styrene (ABS), only required for H-317 transducer. | |
| dcm2niix | Chris Rorden (University of South Carolina) | Version 1.0.20220720 | Accessible at https://github.com/rordenlab/dcm2niix/releases. Used for pre-processing subject MR images. |
| Fiducials and headband or glasses | Brainsight, Rogue Research | ST-1325 (subject tracker), LCT-583 (large coil tracker) | Headband or glasses can be interchangeably used. |
| Headphones | Beats | Fit Pro True Wireless Earbuds | Wireless Bluetooth earbuds with disposable tips. |
| MacBookPro | Apple | M2 Max, 16”, 64GB RAM | Computer for completing trajectory planning and simulations |
| SimNIBS | Axel Thielscher (Technical University of Denmark) | Version 4.0.0 | Accessible at https://simnibs.github.io/simnibs/build/html.index.html |
| Syringe(s) | 10 mL, 60 mL | Used to add additional ultrasound gel to fill air pockets. | |
| Transducer | Sonicconcepts | H-317 | Other supported transducers include CTX_500 (NeuroFUS, Sonicconcepts), Single element, H-246 (Sonicconcepts), and Bsonix (Brainsonix) |
| Transducer film | Sonicconcepts | Polyurethane membrane | Interface between transducer and the subject |
| Ultrasound gel | Wavelength | Clear Ultrasound Gel | Coupling medium. |
| Windows Laptop | Acer | Aspire A717-71G, Intel Core i7-7700HQ, 16 GB RAM | System used to control 128-channel amplifier and generate sound through the headphones |
Referencias
- Baek, H., Pahk, K. J., Kim, H. A review of low-intensity focused ultrasound for neuromodulation. Biomed Eng Lett. 7 (2), 135-142 (2017).
- Rezayat, E., Toostani, I. G. A review on brain stimulation using low intensity focused ultrasound. Basic Clin Neurosci. 7 (3), 187-194 (2016).
- Dell'Italia, J., Sanguinetti, J. L., Monti, M. M., Bystritsky, A., Reggente, N. Current state of potential mechanisms supporting low intensity focused ultrasound for neuromodulation. Front Hum Neurosci. 16, 872639 (2022).
- Kim, H., et al. Suppression of EEG visual-evoked potentials in rats through neuromodulatory focused ultrasound. Neuroreport. 26 (4), 211-215 (2015).
- Yoon, K., et al. Effects of sonication parameters on transcranial focused ultrasound brain stimulation in an ovine model. PLoS One. 14 (10), e0224311 (2019).
- Dallapiazza, R. F., et al. Non-invasive neuromodulation and thalamic mapping with low-intensity focused ultrasound. J Neurosurg. 128 (3), 875-884 (2018).
- Folloni, D., et al. Manipulation of subcortical and deep cortical activity in the primate brain using transcranial focused ultrasound stimulation. Neuron. 101 (6), 1109-1116 (2019).
- Gulick, D. W., Li, T., Kleim, J. A., Towe, B. C. Comparison of electrical and ultrasound neurostimulation in rat motor cortex. Ultrasound Med Biol. 43 (12), 2824-2833 (2017).
- King, R. L., Brown, J. R., Newsome, W. T., Pauly, K. B. Effective parameters for ultrasound-induced in vivo neurostimulation. Ultrasound Med Biol. 39 (2), 312-331 (2013).
- Yoo, S. S., et al. Focused ultrasound modulates region-specific brain activity. Neuroimage. 56 (3), 1267-1275 (2011).
- Kim, H. C., et al. Transcranial focused ultrasound modulates cortical and thalamic motor activity in awake sheep. Sci Rep. 11 (1), 19274 (2021).
- Deffieux, T., et al. Low-intensity focused ultrasound modulates monkey visuomotor behavior. Curr Biol. 23 (23), 2430-2433 (2013).
- Munoz, F., et al. Long term study of motivational and cognitive effects of low-intensity focused ultrasound neuromodulation in the dorsal striatum of nonhuman primates. Brain Stimul. 15 (2), 360-372 (2022).
- Verhagen, L., et al. Offline impact of transcranial focused ultrasound on cortical activation in primates. ELife. 8, e40541 (2019).
- Fomenko, A., et al. Systematic examination of low-intensity ultrasound parameters on human motor cortex excitability and behavior. ELife. 9, e54497 (2020).
- Legon, W., Bansal, P., Tyshynsky, R., Ai, L., Mueller, J. K. Transcranial focused ultrasound neuromodulation of the human primary motor cortex. Sci Rep. 8 (1), 10007 (2018).
- Legon, W., et al. Transcranial focused ultrasound modulates the activity of primary somatosensory cortex in humans. Nat Neurosci. 17 (2), 322-329 (2014).
- Legon, W., Ai, L., Bansal, P., Mueller, J. K. Neuromodulation with single-element transcranial focused ultrasound in human thalamus. Hum Brain Mapp. 39 (5), 1995-2006 (2018).
- Legon, W., et al. A retrospective qualitative report of symptoms and safety from transcranial focused ultrasound for neuromodulation in humans. Sci Rep. 10, 5573 (2020).
- Forster, A., et al. Investigating the role of the right inferior frontal gyrus in control perception: A double-blind cross-over study using ultrasonic neuromodulation. Neuropsychologia. 187, 108589 (2023).
- Forster, A., et al. Transcranial focused ultrasound modulates the emergence of learned helplessness via midline theta modification. J Affect Disord. 329, 273-284 (2023).
- Ziebell, P., et al. Inhibition of midfrontal theta with transcranial ultrasound explains greater approach versus withdrawal behavior in humans. Brain Stimul. 16 (5), 1278-1288 (2023).
- Kim, H. C., Lee, W., Weisholtz, D. S., Yoo, S. S. Transcranial focused ultrasound stimulation of cortical and thalamic somatosensory areas in human. PLoS One. 18 (7), e0288654 (2023).
- Kim, Y. G., et al. Neuromodulation using transcranial focused ultrasound on the bilateral medial prefrontal cortex. J Clin Med. 11 (13), 3809 (2022).
- Chu, Y. C., Lim, J., Chien, A., Chen, C. C., Wang, J. L. Activation of mechanosensitive ion channels by ultrasound. Ultrasound Med Biol. 48 (10), 1981-1994 (2022).
- Kubanek, J., et al. Ultrasound modulates ion channel currents. Sci Rep. 6 (1), 24170 (2016).
- Prieto, M. L., Firouzi, K., Khuri-Yakub, B. T., Maduke, M. Activation of Piezo1 but not NaV1.2 channels by ultrasound at 43 MHz. Ultrasound Med Biol. 44 (6), 1217-1232 (2018).
- Quarato, C. M. I., et al. A review on biological effects of ultrasounds: Key messages for clinicians. Diagnostics. 13 (5), 855 (2023).
- Nowicki, A. Safety of ultrasonic examinations; thermal and mechanical indices. Med Ultrason. 22 (2), 203 (2020).
- Miller, D. L., et al. Overview of therapeutic ultrasound applications and safety considerations. J Ultrasound Med. 31 (4), 623-634 (2012).
- Aubry, J. F., et al. ITRUSST consensus on biophysical safety for transcranial ultrasonic stimulation. arXiv preprint arXiv. , 2311.05359 (2023).
- Guo, H., et al. Ultrasound produces extensive brain activation via a cochlear pathway. Neuron. 98 (5), 1020-1030 (2018).
- Sato, T., Shapiro, M. G., Tsao, D. Y. Ultrasonic neuromodulation causes widespread cortical activation via an indirect auditory mechanism. Neuron. 98 (5), 1031-1041 (2018).
- Braun, V., Blackmore, J., Cleveland, R. O., Butler, C. R. Transcranial ultrasound stimulation in humans is associated with an auditory confound that can be effectively masked. Brain Stimul. 13 (6), 1527-1534 (2020).
- Martin, E., et al. ITRUSST consensus on standardised reporting for transcranial ultrasound stimulation. Brain Stimul. , S1935861X24000718 (2024).
- Pichardo, S. BabelBrain: An open-source application for prospective modeling of transcranial focused ultrasound for neuromodulation applications. IEEE Trans Ultrason Ferroelectr Freq Control. 70 (7), 587-599 (2023).
- Khoshnevisan, A., Allahabadi, N. S. Neuronavigation: Principles, clinical applications and potential pitfalls. Iran J Psychiatry. 7 (2), 97-103 (2012).
- Xu, L., et al. Characterization of the targeting accuracy of a neuronavigation-guided transcranial fus system in vitro, in vivo, and in silico. IEEE Trans Biomed Eng. 70 (5), 1528-1538 (2023).
- Kuehn, B., et al. Sensor-based neuronavigation: Evaluation of a large continuous patient population. Clin Neurol Neurosurg. 110 (10), 1012-1019 (2008).
- Ambrosini, E., et al. StimTrack: An open-source software for manual transcranial magnetic stimulation coil positioning. J Neurosci Methods. 293, 97-104 (2018).
- Kop, B. R., et al. Auditory confounds can drive online effects of transcranial ultrasonic stimulation in humans. eLife. , (2024).
- Zadeh, A. K., et al. The effect of transcranial ultrasound pulse repetition frequency on sustained inhibition in the human primary motor cortex: A double-blind, sham-controlled study. Brain Stimul. 17 (2), 476-484 (2024).
- Mohammadjavadi, M., et al. Elimination of peripheral auditory pathway activation does not affect motor responses from ultrasound neuromodulation. Brain Stimul. 12 (4), 901-910 (2019).
- Johnstone, A., et al. A range of pulses commonly used for human transcranial ultrasound stimulation are clearly audible. Brain Stimul. 14 (5), 1353-1355 (2021).
- Zeng, K., et al. Induction of human motor cortex plasticity by theta burst transcranial ultrasound stimulation. Ann Neurol. 91 (2), 238-252 (2022).
- Lee, W., et al. Image-guided transcranial focused ultrasound stimulates human primary somatosensory cortex. Sci Rep. 5, 8743 (2015).
- Ridding, M. C., Rothwell, J. C. Is there a future for therapeutic use of transcranial magnetic stimulation. Nat Rev Neurosci. 8 (7), 559-567 (2007).
- Nicolo, P., Ptak, R., Guggisberg, A. G. Variability of behavioural responses to transcranial magnetic stimulation: Origins and predictors. Neuropsychologia. 74, 137-144 (2015).
- Horvath, J. C., Carter, O., Forte, J. D. No significant effect of transcranial direct current stimulation (tDCS) found on simple motor reaction time comparing 15 different simulation protocols. Neuropsychologia. 91, 544-552 (2016).
- Horvath, J. C., Vogrin, S. J., Carter, O., Cook, M. J., Forte, J. D. Effects of a common transcranial direct current stimulation (tDCS) protocol on motor evoked potentials found to be highly variable within individuals over 9 testing sessions. Exp Brain Res. 234 (9), 2629-2642 (2016).
- Angla, C., Larrat, B., Gennisson, J., Chatillon, S. Transcranial ultrasound simulations: A review. Med Phys. 50 (2), 1051-1072 (2023).
- Miller, G. W., Eames, M., Snell, J., Aubry, J. Ultrashort echo-time MRI versus CT for skull aberration correction in MR-guided transcranial focused ultrasound: In vitro comparison on human calvaria. Med Phys. 42 (5), 2223-2233 (2015).
- Miscouridou, M., Pineda-Pardo, J. A., Stagg, C. J., Treeby, B. E., Stanziola, A. Classical and learned MR to pseudo-CT mappings for accurate transcranial ultrasound simulation. IEEE Trans Ultrason Ferroelectr Freq Control. 69 (10), 2896-2905 (2022).
- Pichardo, S., et al. A viscoelastic model for the prediction of transcranial ultrasound propagation: application for the estimation of shear acoustic properties in the human skull. Phys Med Biol. 62 (17), 6938-6962 (2017).
- Pichardo, S. . ProteusMRIgHIFU/BABELVISCOFDTD: Software Library for FDTD of viscoelastic equation using a staggered grid arrangement with support for GPU and CPU backends. , (2024).
- Aubry, J. F., et al. Benchmark problems for transcranial ultrasound simulation: Intercomparison of compressional wave models. J Acoust Soc Am. 152 (2), 1003-1019 (2022).
- Pinton, G., et al. Attenuation, scattering, and absorption of ultrasound in the skull bone: Absorption of ultrasound in the skull bone. Med Phys. 39 (1), 299-307 (2011).
- Chaplin, V., et al. On the accuracy of optically tracked transducers for image-guided transcranial ultrasound. Int J Comput Assist Radiol Surg. 14 (8), 1317-1327 (2019).
- Wu, S. Y., et al. Efficient blood-brain barrier opening in primates with neuronavigation-guided ultrasound and real-time acoustic mapping. Sci Rep. 8 (1), 7978 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados