Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Pipeline pour la planification et l’exécution d’expériences de neuromodulation par ultrasons transcrâniens chez l’homme
Dans cet article
Résumé
La stimulation par ultrasons transcrâniens (TUS) est une technique émergente de neuromodulation non invasive qui nécessite une planification minutieuse des simulations acoustiques et thermiques. La méthodologie décrit un pipeline de traitement d’images et de simulation d’échographie pour une planification efficace, conviviale et rationalisée de l’expérimentation TUS humaine.
Résumé
La stimulation par ultrasons transcrâniens (TUS) est une technique émergente de neuromodulation non invasive capable de manipuler les structures corticales et sous-corticales avec une grande précision. La réalisation d’expériences impliquant des humains nécessite une planification minutieuse des simulations acoustiques et thermiques. Cette planification est essentielle pour s’adapter à l’interférence osseuse avec la forme et la trajectoire du faisceau d’ultrasons et pour s’assurer que les paramètres TUS répondent aux exigences de sécurité. Des examens pondérés en T1 et T2, ainsi que des examens d’imagerie par résonance magnétique (IRM) par écho en temps zéro (ZTE) avec une résolution isotrope de 1 mm, sont acquis (tomographie assistée par ordinateur, rayons X (TDM)) pour la reconstruction et les simulations du crâne. La cartographie des cibles et des trajectoires est réalisée à l’aide d’une plateforme de neuronavigation. SimNIBS est utilisé pour la segmentation initiale du crâne, de la peau et des tissus cérébraux. La simulation de TUS est réalisée à l’aide de l’outil BabelBrain, qui utilise le balayage ZTE pour produire des images CT synthétiques du crâne à convertir en propriétés acoustiques. Nous utilisons un transducteur à ultrasons à réseau phasé avec des capacités de direction électrique. La direction en Z est ajustée pour s’assurer que la profondeur cible est atteinte. D’autres configurations de sondes sont également prises en charge dans l’outil de planification. Des simulations thermiques sont effectuées pour s’assurer que les exigences en matière de température et d’indice mécanique sont conformes aux directives acoustiques pour le TUS chez les sujets humains, comme recommandé par la FDA. Pendant les sessions d’administration TUS, un bras mécanique aide à déplacer le transducteur à l’endroit requis à l’aide d’un système de localisation stéréotaxique sans cadre.
Introduction
Les techniques de neurostimulation non invasive couramment utilisées comprennent la stimulation transcrânienne à courant continu (tDCS) et la stimulation magnétique transcrânienne (TMS). Cependant, les deux ont une profondeur de pénétration limitée et une faible précision 1,2. En revanche, l’échographie transcrânienne (TUS) est une technique non invasive émergente capable d’améliorer ou de supprimer l’activité neuronale 3,4,5 et de cibler les structures corticales ou sous-corticales avec une précision millimétrique 6,7. Des modèles animaux utilisant des rongeurs 4,8,9, des lapins10, des moutons 5,11, des porcs6 et des primates non humains 7,12,13,14 ont montré l’efficacité et l’innocuité du TUS. Des études ont démontré que le ciblage de diverses régions du cerveau peut provoquer des mouvements des membres8 chez le rat, des potentiels évoqués somatosensoriels (SSEP) chez le porc6 et des changements dans l’activité visuomotrice12, la prise de décision cognitive et motivationnelle chez les primates non humains13, entre autres changements de comportement. Chez l’homme, on a observé que les TUS modifient les potentiels évoqués moteurs (MEP) et les performances lors d’une tâche de temps de réaction lorsqu’ils ciblent le cortex moteur primaire15,16 et altèrent les performances lors d’une tâche de discrimination tactile et les SSEP lorsqu’ils ciblent le cortex somatosensoriel17 et le thalamus sensoriel18. Les analyses histologiques n’ont révélé aucun changement structurel macroscopique ou microscopique associé à la TUS chez les porcs6, les moutons 5,11, les lapins10 et les primates non humains14, et aucun effet secondaire n’a été observé qui diffère significativement des autres techniques de neurostimulation non invasives19.
TUS utilise des ultrasons focalisés pulsés de faible intensité à une fréquence comprise entre 200 kHz et 700 kHz pour produire un effet neuromodulateur transitoire. L’intensité moyenne d’impulsion (I sppa) spatiale typique in situ est de 10 W/cm2 ou moins, avec des cycles d’utilisation rapportés (pourcentage de temps pendant lequel l’ultrason est allumé) allant de 0,5 % à 70 % chez l’homme 20,21,22,23,24. Bien que les mécanismes de la neuromodulation TUS aient été proposés comme impliquant principalement l’agitation mécanique des membranes lipidiques conduisant à l’ouverture des canaux ioniques 25,26,27, les effets thermiques et de cavitation possibles ne peuvent être ignorés. Ils sont évalués à l’aide d’indices mécaniques (MI) et thermiques (TI). L’IM décrit les effets biologiques prévus liés à la cavitation qui se produiront avec le TUS, tandis que le TI décrit l’augmentation potentielle de la température dans les tissus après l’application d’ultrasons28,29. De plus, la modification de la fréquence et de l’intensité d’entrée entraîne également une modification de l’IM et de l’TI. Les fréquences plus élevées ont une meilleure résolution spatiale et diminuent la probabilité d’effets biologiques mécaniques ; Cependant, ils ont une absorption plus forte dans les tissus, ce qui augmente le potentiel d’augmentation de la température28. Alternativement, des fréquences plus basses à la même intensité augmentent l’IM. De même, l’augmentation de l’intensité tend à augmenter l’ampleur des effets biologiques mécaniques etthermiques 30. Il est donc impératif qu’une planification et une simulation minutieuses soient effectuées avant les sessions d’expérimentation pour tous les paramètres TUS qui seront mis en œuvre.
La planification d’une expérience TUS nécessite l’identification de la cible et de la trajectoire d’intérêt et la réalisation de simulations thermiques et acoustiques. Les simulations aident à optimiser les effets mécaniques et à atténuer les effets thermiques du TUS sur les tissus. Ils nécessitent de comprendre la prédiction de l’échauffement du crâne, de l’amplitude de pression des ultrasons au point focal, de la correction focale et d’autres échauffements à l’intérieur du crâne et de la peau. Une simulation adéquate permet de s’assurer que le point focal atteindra la cible d’intérêt et que les paramètres de sécurité pour l’utilisation des ultrasons établis par les lignes directrices de sécurité sur la sécurité biophysique recommandées par l’International Transcranial Ultrasonic Stimulation Safety and Standards Consortium (ITRUSST)31, qui sont fondées sur les recommandations de la FDA et de Santé Canada, sont suivis. Des études récentes ont également mis en évidence un effet de confusion auditive accompagné de TUS 32,33,34 chez les animaux et les humains, où la stimulation TUS peut activer les voies auditives dans le cerveau pour susciter des réponses 32,33,34. La section des nerfs auditifs32, l’ablation du liquide cochléaire32 ou la surdité chimique33 chez les rongeurs ont été utilisées pour diminuer ces effets chez les animaux. Chez l’homme, l’administration d’un ton auditif à l’aide d’écouteurs a été utilisée pour masquer efficacement le bruit auditif du TUS, en contrôlant l’activité auditive induite par le TUS confondu34. Cela souligne la nécessité de contrôler le bruit auditif dans des conditions de stimulation simulées, qui doivent être intégrées dans la planification, la conception et la mise en œuvre du protocole.
Ici, nous présentons un guide sur la façon de réaliser de manière appropriée la préparation (étape 1, étape 2), la planification (étape 3), les simulations (étape 4) et l’administration de TUS (étape 5) nécessaires pour réaliser l’expérience de neuromodulation TUS chez l’homme.
Protocole
Toutes les méthodes faisant appel à des sujets humains ont été mises en œuvre conformément à la Recommandation éthique de la recherche avec des êtres humains des trois Conseils, et le protocole a été approuvé par le Comité conjoint d’éthique de la recherche en santé (CHREB) de l’Université de Calgary. Tous les sujets ont fourni un consentement écrit éclairé avant de participer. Les participants humains devaient être des adultes droitiers en bonne santé âgés de 18 à 40 ans, désireux et capables de passer une imagerie par résonance magnétique (IRM). Les critères d’exclusion comprenaient des antécédents familiaux de convulsions, de troubles de l’humeur ou cardiovasculaires, un traumatisme de l’oreille, une dépendance à l’alcool ou à la drogue, l’utilisation de médicaments sur ordonnance, d’implants métalliques, y compris un stimulateur cardiaque, une grossesse, des troubles cardiovasculaires, des antécédents de troubles neurologiques ou psychiatriques, une incapacité à communiquer avec l’investigateur et le personnel de l’étude, et une incapacité juridique ou une capacité juridique limitée. Le protocole décrit ci-dessous suit les recommandations de l’ITRUSST sur la notification standardisée des études TUS35. Les détails de l’équipement, des logiciels et des liens Web nécessaires utilisés dans cette étude sont énumérés dans la table des matériaux.
1. Imagerie par résonance magnétique à haute résolution
- Imagez le participant à l’aide d’une bobine tête/cou à 24 canaux.
REMARQUE : Alternativement, la meilleure bobine tête/cou disponible sur le site est suffisante pour obtenir une IRM anatomique. - Collectez des images IRM pondérées en T1 et T2 et des séquences d’écho à temps zéro (ZTE) à une résolution de 1 mm.
REMARQUE : Il est recommandé de recueillir des images IRM sans que le participant porte des écouteurs supra-auriculaires, car cela peut avoir un impact sur la reconstruction de l’image et rendre difficiles les étapes ultérieures de planification et de mise en œuvre. Au lieu de cela, il est recommandé au participant de ne porter que des bouchons d’oreille pour la sécurité de l’IRM.- Pour l’imagerie pondérée T1, utilisez une séquence d’écho à gradient rapide gâté (FSPGR) préparée pour la récupération d’inversion 3D avec les paramètres suivants : temps de répétition (TR) = 8,4 ms, temps d’écho (TE) = 3,2 ms, temps d’inversion (TI) = 650 ms, angle de retournement de 10 degrés, champ de vision mesurant 256 mm x 256 mm x 188 mm, taille de matrice de 256 x 256 x 188, Facteur GRAPPA (ARC) de 2 dans la direction d’encodage de phase, et orientation sagittale-oblique pour se rapprocher de l’alignement avec AC-PC.
REMARQUE : La durée totale de numérisation est de 5 min et 21 s. - Pour l’imagerie pondérée T2, utilisez un écho à spin rapide 3D (FSE) avec les paramètres suivants : TR = 3000 ms, TE = 60-90 ms, une longueur de train d’écho de 130, un champ de vision mesurant 256 mm x 225 mm x 188 mm, une taille de matrice de 256 x 256 x 188 et une orientation sagittale-oblique se rapprochant de l’alignement avec l’axe AC-PC. Un facteur GRAPPA (ARC) de deux a été utilisé dans la direction de l’encodage de phase et de la coupe.
REMARQUE : La durée totale de numérisation est de 3 min et 58 s. - Pour les images ZTE, utilisez un balayage ZTE 3D isotrope avec les paramètres suivants : TR = 698 ms, TE = 16 μs, angle de retournement de 1 degré, bande passante du récepteur de 62,5 kHz, nombre de moyennes = 3,5, un champ de vision mesurant 256 mm x 256 mm x 256 mm, taille de matrice de 256 x 256 x 256.
REMARQUE : La durée totale de numérisation est de 5 min et 23 s.
REMARQUE : Les images RM doivent être terminées avant que la planification TUS puisse commencer.
- Pour l’imagerie pondérée T1, utilisez une séquence d’écho à gradient rapide gâté (FSPGR) préparée pour la récupération d’inversion 3D avec les paramètres suivants : temps de répétition (TR) = 8,4 ms, temps d’écho (TE) = 3,2 ms, temps d’inversion (TI) = 650 ms, angle de retournement de 10 degrés, champ de vision mesurant 256 mm x 256 mm x 188 mm, taille de matrice de 256 x 256 x 188, Facteur GRAPPA (ARC) de 2 dans la direction d’encodage de phase, et orientation sagittale-oblique pour se rapprocher de l’alignement avec AC-PC.
2. Prétraitement des images des participants
- Convertissez les fichiers de numérisation DICOM T1-w, T2-w et ZTE du format DICOM DICOM au format Nifti à l’aide de l’outil dcm2niix. Dans une fenêtre de terminal, exécutez : dcm2niix .
REMARQUE : L’outil dcm2niix est disponible sur GitHub (voir la table des matériaux). L’outil BabelBrain co-enregistre les images du participant pour s’adapter aux images collectées à des jours différents. Si les images T1-w ne sont pas isotropes, elles sont rééchantillonnées en voxels isotropes de 1 mm ; cependant, les images CT/ZTE ne le sont pas. Au lieu de cela, les masques de simulation sont rééchantillonnés à la résolution finale en termes de PPW. Aucune étape supplémentaire de co-inscription ou d’alignement n’est requise. - Exécutez le co-enregistrement et l’extraction du masque tissulaire à l’aide de l’outil de charme de SimNIBS. Dans une fenêtre de terminal, exécutez : charm , où est une chaîne de caractères pour l’identification. À ce stade, la planification de l’expérience peut être interrompue et poursuivie à un autre moment.
REMARQUE : Les fichiers créés seront enregistrés dans un sous-répertoire m2m qui sera utilisé dans les étapes de planification ultérieures. Le prétraitement des images à l’aide de l’outil Charm est nécessaire à des fins de segmentation des tissus, comme cela est nécessaire pour une utilisation dans l’outil BabelBrain36.
3. Planification de trajectoire
- Ouvrez Brainsight, cliquez sur Nouveau projet vide et chargez l’image T1-w Nifti du participant, produite à l’étape 2.1.
REMARQUE : Si vous utilisez une version de Brainsight antérieure à la v2.5.3, vous pouvez choisir « Nouveau projet vide » ou « Nouveau projet SimNIBS ». Si vous utilisez Brainsight v2.5.3 et les versions ultérieures, il y a une intégration entre Brainsight et BabelBrain et il est fortement recommandé de cliquer sur « Nouveau projet SimNIBS » ; Cependant, les deux sont encore suffisants pour compléter les étapes de planification. « Nouveau projet vide » nécessite le chargement de l’image T1-w, tandis que « Nouveau projet SimNIBS » nécessite le chargement d’un fichier .msh qui charge directement l’image T1-w. Toutes les autres fonctionnalités et étapes restent les mêmes. - Cliquez sur Superpositions, puis sur Configurer les superpositions pour créer et afficher une superposition. Cliquez sur Ajouter pour sélectionner le fichier à superposer.
REMARQUE : Si la cible ne peut pas être visualisée sur une image T1-w, elle doit d’abord être localisée sur une image T2-w co-enregistrée (les coordonnées T1-w et T2-w sont donc identiques). Ensuite, transférez les coordonnées sur une image T1-w pour les étapes de planification suivantes. L’outil de sélection de l’étape 2.2 produit une image T2-w co-enregistrée dans le chemin d’accès au fichier m2m /T2_reg.nii.gz. - Fermez la section des superpositions, cliquez sur l’onglet Cibles , puis sur Configurer les cibles. Cliquez sur le bouton d’information bleu pour modifier l’opacité, la couleur et le seuil de la superposition afin de permettre une comparaison des images.
REMARQUE : Cette opération peut être effectuée pour visualiser des images Nifti co-enregistrées et doit être utilisée pour observer comment les simulations acoustiques se superposeront à la cible. - Cliquez sur l’onglet Reconstructions , puis sur le menu déroulant Nouvelle Reconstruction. Cliquez sur Habillage, puis sur Habillage de calcul dans la nouvelle fenêtre. Une fois terminé, cliquez sur le bouton de fermeture dans le coin supérieur gauche de la fenêtre.
- Dans l’onglet « Reconstructions », cliquez sur le menu déroulant Nouvelle Reconstruction... suivi de Full Brain Curvilinear.
- Ajustez chaque case sur les images sagittales (Figure 1A), coronales (Figure 1B) et transversales (Figure 1C) en faisant glisser les bords de la boîte verte, de sorte que les lignes entourent étroitement le cerveau (Figure 1).
- Faites défiler toutes les tranches pour vous assurer qu’aucun bord du tissu ne se chevauche. Cliquez sur Calculer curviligne et ajustez la profondeur de pelage à 4 mm (Figure 1D).
REMARQUE : Le curviligne complet du cerveau fournit une reconstruction 3D du cortex, qui peut être pelé pour observer différentes profondeurs. Il permet de placer avec précision et cohérence une bobine TMS sur le cerveau afin de localiser la région d’intérêt.
- Cliquez sur l’onglet Points de repère sur Brainsight, puis sur Configurer les points de repère.
- Placez le réticule (curseur) sur l’extrémité du nez et, dans le champ « Nom : », étiquetez le point de repère « Nez » (Figure 2A). Placez le réticule entre les yeux au-dessus de l’arête du nez et étiquetez le point de repère « Nasion » (figure 2A).
- Placez le réticule sur l’oreille gauche et étiquetez le point de repère « Oreille en L » (Figure 2B). Placez le réticule sur l’oreille droite et étiquetez le point de repère « R Ear » (Figure 2C).
- Cliquez sur l’onglet Cibles et utilisez le réticule (curseur) pour localiser la cible qui vous intéresse.
- Placez le réticule (curseur) à l’emplacement de la cible souhaitée et utilisez les bascules d’angle sur le côté droit de l’écran pour définir l’angle de trajectoire.
- Une fois la cible et la trajectoire souhaitées sélectionnées, cliquez sur le menu déroulant Nouveau , puis choisissez Trajectoire. Nommez la cible en tapant dans la zone de texte à côté de « Nom : ».
- Exportez la cible en cliquant sur Exporter... et enregistrez-la dans le dossier d’objet approprié. Une fois le fichier enregistré, la planification peut être interrompue et l’expérience peut redémarrer plus tard.
REMARQUE : La cible sera utilisée dans les étapes suivantes pour réaliser des simulations thermiques et acoustiques.
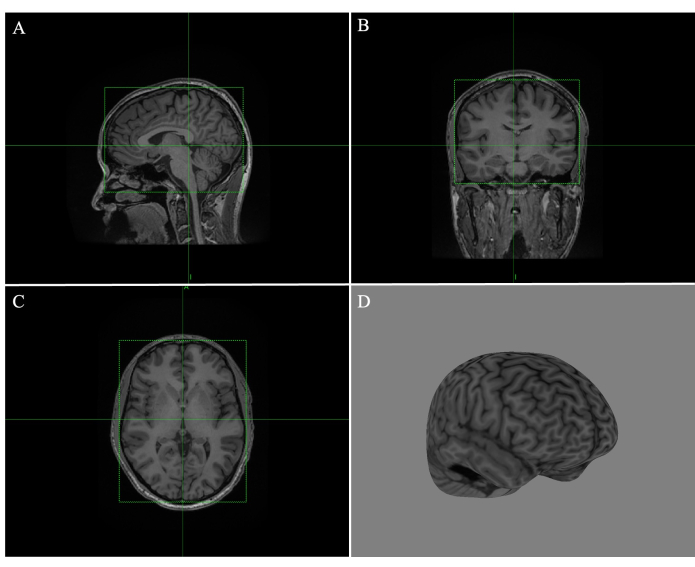
Figure 1 : Création d’un cerveau curviligne complet dans Brainsight. (A) Boîte ajustée au bord de l’image IRM sagittale. (B) Boîte ajustée au bord de l’image IRM coronale. (C) Boîte ajustée au bord de l’image IRM transversale. (D) Reconstruction curviligne complète du cerveau avec une profondeur de pelage de 4 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
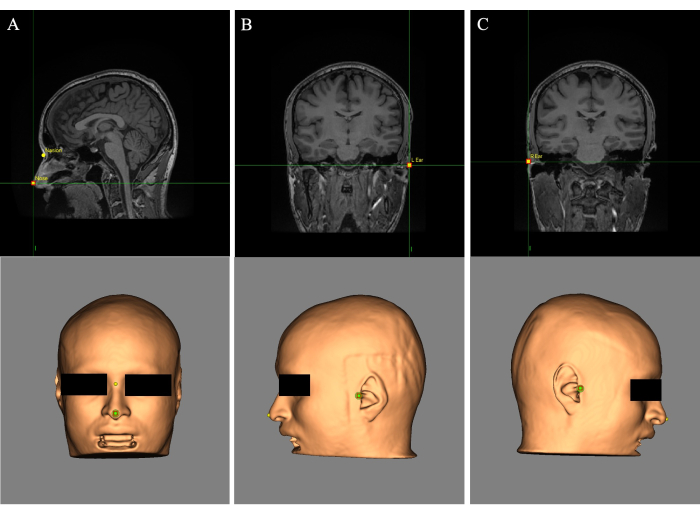
Figure 2 : Repères placés sur la reconstruction cutanée et l’image IRM. (A) Placement des points de repère du nez et de la nasion. (B) Placement du point de repère de l’oreille gauche. (C) Placement du point de repère de l’oreille droite. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Simulations avec BabelBrain
REMARQUE : Les détails de la simulation avec BabelBrain peuvent être consultés dans le manuel de BabelBrain : https://proteusmrighifu.github.io/BabelBrain/index.html.
- Ouvrez BabelBrain et sélectionnez les fichiers requis pour les simulations acoustiques et thermiques.
REMARQUE : Cette soumission utilise une sonde multiéléments ; Cependant, d’autres sondes sont entièrement compatibles avec ce logiciel de planification. Ce programme peut effectuer des simulations pour Single, CTX_500, H-317, H-246 et transducteurs. Dans la méthode suivante, le H-317 sera utilisé comme sonde sélectionnée.- Sélectionnez le fichier txt précédemment exporté depuis Brainsight à l’étape 3.7.3 en cliquant sur Sélectionner la trajectoire... et en choisissant le fichier de participant approprié. Cliquez sur Sélectionner SimNIBS... pour choisir le fichier SimNIBS (nom m2m_folder) créé à l’étape 2. Cliquez sur Sélectionner T1W... et choisissez l’image T1-w produite à l’étape 2.1 utilisée précédemment pour la cartographie de la cible et de la trajectoire.
- Dans le menu déroulant à côté de l’étiquette « Utiliser CT ? », choisissez CT réel si vous utilisez un scanner CT, ZTE si vous utilisez un scanner ZTE, ou NO si vous utilisez un masque simplifié généré par l’outil de charme si seules les images T1 et T2-w sont disponibles. Lorsque vous utilisez une image CT ou ZTE, cliquez sur le menu déroulant Correg.® , puis sur CT à MR. Cliquez sur Sélectionner et choisissez l’image correspondante dans le fichier de participant approprié.
- Cliquez sur « Sélectionner le profil thermique... » et choisissez le fichier de profil thermique qui décrit les paramètres de sonication de l’expérience en termes de durée d’activation, de durée d’arrêt et de cycle d’utilisation.
REMARQUE : Les détails peuvent être consultés dans le manuel de BabelBrain : https://proteusmrighifu.github.io/BabelBrain/index.html. Des exemples de profils sont disponibles sur https://github.com/ProteusMRIgHIFU/BabelBrain/tree/main/Profiles. - Cliquez sur le menu déroulant à côté de « Sonde » et sélectionnez la sonde utilisée pour l’expérimentation. Cliquez sur le menu déroulant à côté de « Informatique en arrière-plan » et choisissez le moteur de calcul de l’ordinateur exécutant les simulations. Une fois toutes les informations saisies, cliquez sur CONTINUER pour terminer le reste des simulations.
- Sous-étape A : Calculer le masque.
- Sélectionnez la fréquence ultrasonore du transducteur et le point par longueur d’onde (PPW) approprié.
REMARQUE : 6 PPW est suffisant pour la plupart des scénarios. - Laissez la plage ZTE normalisée et les unités Hounsfield (HU) telles quelles.
REMARQUE : Si vous utilisez un vrai TC, seul le seuil HU apparaîtra. Si aucun scintigraphe ZTE ou CT n’est fourni, cette entrée sera absente. - Cliquez sur Calculer le masque de planification. Inspectez l’image, en vérifiant que les limites de la peau, du crâne et du cerveau ont été reconnues avec précision.
REMARQUE : En cas d’anomalie, ajustez la plage ZTE normalisée et/ou le seuil HU.
- Sélectionnez la fréquence ultrasonore du transducteur et le point par longueur d’onde (PPW) approprié.
- Sous-étape B : Simulation acoustique. Cliquez sur l’onglet Étape 2 - Ac Sim pour l’ouvrir.
REMARQUE : Cet onglet aura un aspect différent en fonction de la sonde sélectionnée. Ce qui suit est spécifique à la sonde H-317.- Ajustez la distance entre le cône et la mise au point pour refléter la distance entre la surface du cône et la cible en saisissant la distance appropriée.
REMARQUE : Ceci est dicté par le cône physique à utiliser dans les expériences. - Exécutez la simulation en cliquant sur le bouton Calculer les champs .
- Ajustez la valeur de direction Z (mm) de sorte que le réticule (indiquant la cible) soit au centre du point focal (Figure 3). Appuyez sur les flèches vers le haut ou vers le bas ou saisissez manuellement la valeur requise, puis cliquez sur Calculer les champs.
REMARQUE : Les valeurs positives dirigeront le point focal plus profondément dans le cerveau, tandis que les valeurs négatives feront bouger le point focal superficiellement. - Ajustez la mécanique X/Y si le point focal est latéral à la cible prévue. Laissez Z mécanique tel quel. Cliquez sur Calculer les champs.
REMARQUE : Z mécanique est recalculé en fonction de la distance du cône en 4.3.1. S’il est nécessaire d’ajuster la direction Z, la mécanique X/Y ou la profondeur maximale au-delà de la cible après avoir effectué un calcul, les fichiers de simulation acoustique doivent être recalculés. Cliquez sur Calculer les champs et sélectionnez Oui pour recalculer. Sélectionnez Non pour recharger les fichiers existants.
- Ajustez la distance entre le cône et la mise au point pour refléter la distance entre la surface du cône et la cible en saisissant la distance appropriée.
- Sous-étape C : Simulation thermique. Cliquez sur l’onglet Étape 3 - Simulation thermique , puis cliquez sur Calculer les champs thermiques. Évaluer les simulations mécaniques et thermiques (Figure 4) pour s’assurer qu’elles respectent les directives acoustiques chez les sujets humains recommandées par l’ITRUSST31 (Indice mécanique (IM) dans les tissus mous ≤1,9 ; élévation thermique ≤2 °C, dose thermique ≤0,25 CEM43, temps d’exposition limité à 80 min pour 1,5 < indice thermique crânien (TIC) ≤ 2,0, 40 min pour 2,0 < TIC ≤ 2,5, 10 min pour les TIC ≤ 3.0 < 2.5, 160 s pour les TIC ≤ 4.0 <, 40 s pour les TIC ≤ 5.0 < et 10 s pour les < TIC ≤ 6.0).
REMARQUE : BabelBrain résout l’équation de transfert de biochaleur pour estimer l’élévation de la température36. Dans de rares cas, des voxels anormaux à haute température peuvent se produire, auquel cas les images IRM doivent être analysées si des caractéristiques anatomiques pourraient expliquer l’augmentation inhabituelle de la température.- Ajustez le Isppa en cliquant sur les flèches vers le haut ou vers le bas à côté de la case Isppa (L/cm2) ou en saisissant manuellement une valeur supérieure à 0,1 pour observer comment les paramètres changent avec différentes intensités.
REMARQUE : Un résumé de toutes les intensités, changements de température et indices mécaniques peut être exporté sous forme de fichier CSV à titre de référence. Le logiciel calcule l’intensité requise dans les conditions de l’eau (Isppa dans l’eau) qui doit être appliquée pour atteindre l’intensité souhaitée in situ. - Cliquez sur les boutons MTB, MTS et MTC dans la partie inférieure de l’interface pour afficher la tranche avec la température la plus élevée dans le cerveau, la peau et le crâne. Une fois l’étape de simulation thermique terminée, les simulations sont terminées.
REMARQUE : Les fichiers seront automatiquement enregistrés au même emplacement que l’image T1-w.
REMARQUE : Fichiers acoustiques avec une fin <... FullElasticSolution_Sub_NORM.nii.gz> peuvent être chargés dans Brainsight pour visualiser la superposition du champ acoustique dans l’espace T1. Il y aura des fichiers pour les conditions d’eau uniquement (avec l’infixe « Eau » dans le nom de fichier) et des fichiers pour les conditions présentes dans les tissus (pas d’infixe dans le nom de fichier). Suivez les étapes de la note suivant l’étape 3.1 pour ajouter une superposition. Après l’étape de simulation thermique, les simulations sont terminées et l’expérience peut être interrompue jusqu’à la session de livraison TUS.
- Ajustez le Isppa en cliquant sur les flèches vers le haut ou vers le bas à côté de la case Isppa (L/cm2) ou en saisissant manuellement une valeur supérieure à 0,1 pour observer comment les paramètres changent avec différentes intensités.
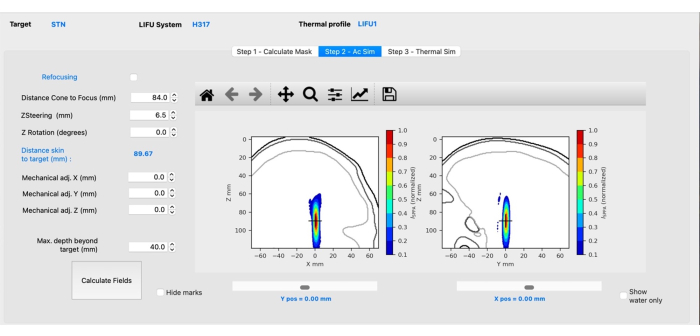
Figure 3 : Simulation acoustique à l’aide de BabelBrain. Veuillez cliquer ici pour voir une version agrandie de cette figure.
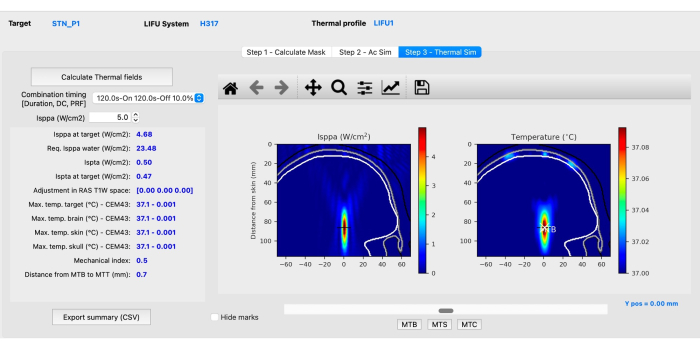
Figure 4 : Simulation thermique à l’aide de BabelBrain. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Séance de livraison TUS
- Ouvrez Brainsight et cliquez sur Ouvrir un projet existant. Sélectionnez le fichier Brainsight créé et enregistré lors de la cartographie de la trajectoire et de la cible.
- Cliquez sur Sessions pour commencer une nouvelle session d’expérimentation. Cliquez sur le menu déroulant et sélectionnez Nouveau, puis Session en ligne. Cliquez sur le nom de la cible, puis sur Ajouter, puis sur Suivant pour ajouter la cible à la session d’expérience et passer à la fenêtre d’expérimentation.
REMARQUE : Si la livraison TUS est effectuée à l’aide d’un ordinateur différent de celui utilisé pour la planification, Brainsight aura besoin de choisir l’image T1-w appropriée. Dans ce cas, une nouvelle fenêtre s’ouvrira et vous invitera à sélectionner l’image du participant T1-w associée à partir de sa fiche participant. - Cliquez sur Fenêtre et Étalonnage de l’outil, puis sélectionnez les outils à utiliser, puis sur Recalibrer.
REMARQUE : Cette étape doit être effectuée pour le transducteur et tous les autres outils utilisés pendant la session expérimentale, tels qu’une bobine TMS.- Fixez le traqueur de grande bobine et le bloc d’étalonnage au transducteur. Assurez-vous que la caméra peut voir les repères sur les deux outils. Cliquez sur Commencer le compte à rebours de l’étalonnage pour recalibrer.
REMARQUE : La sauvegarde de l’étalonnage garantira qu’il reste le même pour ce jour d’expériences. Si cela n’est pas fait et que l’ordinateur s’éteint, l’équipement devra être recalibré.
- Fixez le traqueur de grande bobine et le bloc d’étalonnage au transducteur. Assurez-vous que la caméra peut voir les repères sur les deux outils. Cliquez sur Commencer le compte à rebours de l’étalonnage pour recalibrer.
- Configurez le transducteur conformément à ses procédures de configuration pour l’expérimentation. Retirez le tracker sur le transducteur avant de l’installer afin qu’il ne soit pas endommagé.
REMARQUE : La configuration décrite est pour le transducteur H-317 avec un cône de couplage personnalisé.- Assemblez le cône selon vos besoins, en plaçant le film du transducteur entre le cône et le capuchon d’extrémité. Fixez le cône d’accouplement à la bride du transducteur à l’aide de vis, de rondelles et d’écrous, en vous assurant que tous sont bien serrés afin qu’il n’y ait pas de fuites.
- Remplissez le transducteur avec de l’eau désionisée et fixez les tubes de la pompe au transducteur, en connectant le tube étiqueté « IN » à « OUT » et le « OUT » à « IN ». Bouchez le trou d’eau tout en appuyant sur « DRAIN » sur la pompe pour relâcher la pression.
- Retournez le transducteur pour isoler les bulles d’air sur le film, puis tournez-le vers le haut, leur permettant de sortir par le tube du transducteur étiqueté « OUT ». Répétez cette opération jusqu’à ce que toutes les bulles d’air visibles soient éliminées. Installez le transducteur de manière à ce que son tube « OUT » soit incliné vers l’avant et au point le plus élevé, et laissez-le avec la pompe en marche pendant 30 min.
- Retournez le transducteur pour vérifier que toutes les bulles d’air ont été éliminées. S’il en reste, isolez les bulles d’air sur le film et tournez le transducteur comme avant pour vous assurer qu’elles sortent par le tube « OUT ». Répétez l’opération jusqu’à ce que toutes les bulles aient été éliminées.
- Éteignez la pompe, détachez les tuyaux et verrouillez le transducteur au point mort. Rattachez le tracker à la sonde et procédez à la configuration du participant.
- Fixez le traceur de sujet à la tête du participant à l’aide de lunettes, d’un bandeau placé au-dessus des oreilles et des sourcils (Figure 5) ou du traceur adhésif léger. Assurez-vous que les repères sont orientés de manière à ce qu’ils soient visibles par la caméra et qu’ils ne soient pas bloqués ou touchés par le transducteur lorsqu’il se rapproche ou une fois qu’il a atteint sa position finale.
- Placez l’appareil photo devant le participant de manière à ce qu’il puisse voir le suivi du sujet et le pointeur.
REMARQUE : S’ils ne sont pas visibles, l’indicateur en bas à gauche de l’écran sera rouge. Cela peut également être vérifié en entrant dans l’onglet « Polaris » sur Brainsight.
- Placez l’appareil photo devant le participant de manière à ce qu’il puisse voir le suivi du sujet et le pointeur.
- Cliquez sur l’onglet Inscription dans Brainsight. Placez le pointeur sur les quatre points de repère définis à l’étape 3.6, en le stabilisant avec les deux mains, puis cliquez sur Sample & Go To Next Landmark.
REMARQUE : Il est important que le bandeau ou les lunettes restent serrés sur la tête du participant et que le suivi du sujet ne bouge pas. Si cela se produit, effectuez à nouveau l’enregistrement. Si les repères doivent être tournés pour s’adapter au mouvement de la sonde une fois l’enregistrement terminé, refaites l’enregistrement. - Cliquez sur l’onglet Validation pour valider l’inscription du participant. Placez légèrement le pointeur sur différentes positions le long du cuir chevelu et assurez-vous que tous les points sont inférieurs à 3 mm.
REMARQUE : Les systèmes commerciaux de neuronavigation créés pour la TMS sont utilisés pour l’expérimentation TUS chez l’homme. Une erreur de translation de 3 mm est acceptable pour l’étalonnage d’une sonde portative37, car elle est compatible avec la précision de la cible38,39 et d’autres systèmes de neuronavigation40. La valeur de 3 mm est intégrée dans le logiciel de neuronavigation Brainsight.- Si la taille d’un point est supérieure à 3 mm, cliquez sur le bouton Ajouter pour ajouter des points de repère supplémentaires jusqu’à un maximum de trois points. Si plus de trois points sont nécessaires pour obtenir une validation cohérente inférieure à 3 mm, refaites l’enregistrement.
REMARQUE : Pour améliorer le succès de l’inscription, il est recommandé que les images IRM soient collectées sans que le participant porte d’écouteurs supra-auriculaires, car cela peut avoir un impact sur la reconstruction de l’image et rendre l’inscription difficile. Veillez à ce que le pointeur soit placé aussi près que possible du point de repère avant de cliquer sur Échantillonner et aller au point de repère suivant, et assurez-vous que le pointeur est stabilisé à l’aide des deux mains. La validation rassure sur le fait que la moyenne de tous les points le long de la surface du cuir chevelu est inférieure au seuil. Ne continuez pas tant que tous les emplacements aléatoires sur le cuir chevelu ne sont pas inférieurs au seuil de 3 mm.
- Si la taille d’un point est supérieure à 3 mm, cliquez sur le bouton Ajouter pour ajouter des points de repère supplémentaires jusqu’à un maximum de trois points. Si plus de trois points sont nécessaires pour obtenir une validation cohérente inférieure à 3 mm, refaites l’enregistrement.
- Fixez la tête du participant à l’aide de la mentonnière et du stabilisateur placés à l’arrière de la tête pour l’empêcher de bouger (figure 5). Assurez-vous qu’ils sont confortablement assis sur la chaise pendant toute la durée de l’expérience.
- Cliquez sur Performer. Utilisez le bras mécanique pour positionner la sonde sur la cible d’intérêt le long de la trajectoire sélectionnée.
REMARQUE : Assurez-vous de vous entraîner et de vous familiariser avec la façon dont les composants du bras mécanique se déplacent pour atteindre la cible. Le succès du positionnement du bras mécanique passe par la compréhension de la mobilité du bras et la familiarité avec la façon dont il se déplace dans l’orientation de la tête, car cela dépend fortement de l’emplacement de la cible.- Utilisez le réticule sur la fenêtre de l’œil de bœuf pour obtenir le positionnement et l’angle corrects (Figure 6). Alignez les deux cercles (translationnel et rotationnel) de sorte qu’ils soient positionnés sur le réticule et reportez-vous à la lecture de précision pour vérification.
- Séparez les cheveux du sujet le long de leur partie naturelle et peignez le gel à ultrasons pour vous assurer qu’il n’y a pas de poches d’air dans les cheveux. Si une grande surface nécessite un couplage, appliquez du gel à ultrasons sur le film du transducteur. Remplissez les poches d’air restantes avec du gel à ultrasons supplémentaire à l’aide d’une seringue.
- Abaissez le transducteur à la hauteur appropriée en observant quand le réticule se trouve au milieu de la boîte entourant la cible (figure 6). Cela indiquera quand la profondeur cible appropriée a été atteinte.
- Un script Python personnalisé utilise les résultats des simulations de l’étape 4 pour programmer l’unité de 128 amplificateurs et générer du son au casque (https://github.com/ProteusMRIgHIFU/TUSApp). Si vous effectuez une expérience en ligne et/ou en double aveugle, assurez-vous que le masquage audio est diffusé par le casque34,41 ou augmentez le stimulus et décalez-le sur la durée de la rafale 42,43,44 comme méthodes pour réduire les effets de confusion auditifs potentiels.
REMARQUE : À cette étape, si vous utilisez une unité disponible dans le commerce, telle qu’une sonde CTX-500, prescrivez l’intensité qui a été simulée dans des conditions d’eau, ainsi que d’autres paramètres (PRF, durée, cycle de service). La sonde H-317 utilise un script dédié pour faire fonctionner la sonde ; Par conséquent, cette étape est omise dans le présent mémoire.- Générez l’audio de masquage dans MATLAB pour le lire au début de la diffusion TUS. Le son pendant la stimulation fictive combine une onde sinusoïdale continue à 250 kHz, une onde carrée à une fréquence de rafale de 100 Hz échantillonnée à 48 kHz, avec un bruit aléatoire pour reproduire fidèlement le son produit par le transducteur. Pendant TUS, seul un bruit aléatoire est émis par le casque, car le son émis par le transducteur sera également entendu par le sujet.
- Une fois l’administration du TUS terminée, retirez le transducteur, le gel et le tracker de la tête du participant avant toute procédure expérimentale ultérieure.
- Pour nettoyer l’équipement TUS, retirez le tracker de la sonde pour éviter de l’endommager. Démontez le transducteur en retirant le bouchon sur le dessus et en le retournant pour vider l’eau. Retirez le cône d’accouplement et démontez-le pour permettre aux pièces de sécher à l’air.
- Remettez la sonde au point mort et assurez-vous que tous les composants du bras sont bien verrouillés à 90° pour le stockage jusqu’à la prochaine session expérimentale TUS.

Figure 5 : Points de repère à utiliser pour la neuronavigation. Lunettes (à gauche) et bandeau (à droite) avec repères fixés pour le suivi du sujet. La tête du sujet est sécurisée par une mentonnière et un stabilisateur derrière sa tête. Veuillez cliquer ici pour voir une version agrandie de cette figure.
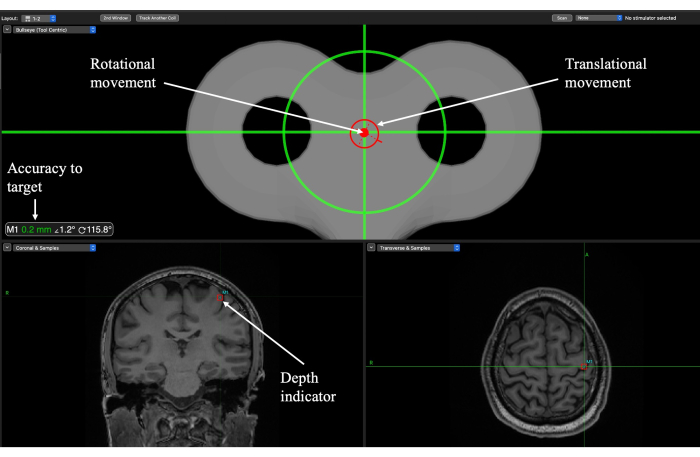
Figure 6 : Écran de neuronavigation Brainsight pour la localisation de la cible pendant la séance d’administration TUS pour une cible primaire du cortex moteur (M1). Des indicateurs de rotation et de translation guident l’expérimentateur sur l’endroit où positionner le capteur sur le cuir chevelu et lorsque l’angle de trajectoire a été atteint. La précision par rapport à la cible indique la proximité de l’orientation de translation et de rotation par rapport à la cible et doit être utilisée pour affiner le mouvement. L’indicateur de profondeur indique la profondeur du point focal et doit être utilisé pour abaisser le transducteur à la hauteur appropriée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
La figure 7 illustre des échantillons comparatifs de sessions de l’une de nos études42, mettant en scène deux participants distincts utilisant des paramètres ultrasonores spécifiques (fréquence fondamentale de 250 kHz, durée de sonication de 120 s, fréquence de répétition d’impulsions (PRF) de 100 Hz, rapport cyclique de 10 % et ISPPA de 5 W/cm²). Dans cette recherche, des IRM T1-, T2-w et ZTE avec une résolution isotrope de 1 mm ont été o...
Discussion
Dans cette méthode, des simulations spécifiques au sujet sont effectuées pour prédire et évaluer les effets thermiques et mécaniques possibles résultant de l’application de TUS au cerveau. Les ensembles de données entre les participants doivent rester séparés et soigneusement documentés, car l’utilisation d’un scan ou d’un fichier de données incorrect entraînera des simulations inexactes. Lorsque de nombreux numérisages de participants sont collectés et que la planification est effectuée ensemble,...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Ces travaux ont été financés en partie par une subvention à la découverte du Conseil de recherches en sciences naturelles et en génie du Canada, le programme INNOVAIT, le Fonds de recherche médicale Cumming, la Fondation canadienne pour l’innovation (projet 36703), la subvention CAPRI de l’Institut du cerveau Hotchkiss et le financement de l’Association Parkinson de l’Alberta. GBP remercie les Instituts de recherche en santé du Canada (FDN-143290) et le programme de chaires Campus Alberta Innovates.
matériels
| Name | Company | Catalog Number | Comments |
| 128-channel amplifier unit | Image Guided Therapy | This unit drives the H-317 transducer | |
| 24-channel head coil | General Electric | ||
| 3D printer | Raise3D | Pro2 | Filament thickness of 1.75mm. |
| 3T MRI scanner | General Electric | Discovery 750 HD | MR Console version DV26.0_R05_2008 |
| BabelBrain | Samuel Pichardo (University of Calgary) | Version 0.3.0 | Accessible at https://github.com/ProteusMRIgHIFU/BabelBrain. Executes thermal and acoustic simulations. |
| Blender | Blender Foundation | Version 3.4.1 | Accessible at https://www.blender.org. Blender is called automatically by BabelBrain. |
| Brainsight | Rogue Research | Version 2.5.2 | Used for target identification, trajectory planning, and execution of TUS delivery sessions. |
| Chair and chin/head holder | Rogue Research | To be used during TUS delivery session to ensure stability of participant’s head for optimized targeting. | |
| Custom-made coupling cone | University of Calgary team | 3D printed cone in acrylonitrile butadiene styrene (ABS), only required for H-317 transducer. | |
| dcm2niix | Chris Rorden (University of South Carolina) | Version 1.0.20220720 | Accessible at https://github.com/rordenlab/dcm2niix/releases. Used for pre-processing subject MR images. |
| Fiducials and headband or glasses | Brainsight, Rogue Research | ST-1325 (subject tracker), LCT-583 (large coil tracker) | Headband or glasses can be interchangeably used. |
| Headphones | Beats | Fit Pro True Wireless Earbuds | Wireless Bluetooth earbuds with disposable tips. |
| MacBookPro | Apple | M2 Max, 16”, 64GB RAM | Computer for completing trajectory planning and simulations |
| SimNIBS | Axel Thielscher (Technical University of Denmark) | Version 4.0.0 | Accessible at https://simnibs.github.io/simnibs/build/html.index.html |
| Syringe(s) | 10 mL, 60 mL | Used to add additional ultrasound gel to fill air pockets. | |
| Transducer | Sonicconcepts | H-317 | Other supported transducers include CTX_500 (NeuroFUS, Sonicconcepts), Single element, H-246 (Sonicconcepts), and Bsonix (Brainsonix) |
| Transducer film | Sonicconcepts | Polyurethane membrane | Interface between transducer and the subject |
| Ultrasound gel | Wavelength | Clear Ultrasound Gel | Coupling medium. |
| Windows Laptop | Acer | Aspire A717-71G, Intel Core i7-7700HQ, 16 GB RAM | System used to control 128-channel amplifier and generate sound through the headphones |
Références
- Baek, H., Pahk, K. J., Kim, H. A review of low-intensity focused ultrasound for neuromodulation. Biomed Eng Lett. 7 (2), 135-142 (2017).
- Rezayat, E., Toostani, I. G. A review on brain stimulation using low intensity focused ultrasound. Basic Clin Neurosci. 7 (3), 187-194 (2016).
- Dell'Italia, J., Sanguinetti, J. L., Monti, M. M., Bystritsky, A., Reggente, N. Current state of potential mechanisms supporting low intensity focused ultrasound for neuromodulation. Front Hum Neurosci. 16, 872639 (2022).
- Kim, H., et al. Suppression of EEG visual-evoked potentials in rats through neuromodulatory focused ultrasound. Neuroreport. 26 (4), 211-215 (2015).
- Yoon, K., et al. Effects of sonication parameters on transcranial focused ultrasound brain stimulation in an ovine model. PLoS One. 14 (10), e0224311 (2019).
- Dallapiazza, R. F., et al. Non-invasive neuromodulation and thalamic mapping with low-intensity focused ultrasound. J Neurosurg. 128 (3), 875-884 (2018).
- Folloni, D., et al. Manipulation of subcortical and deep cortical activity in the primate brain using transcranial focused ultrasound stimulation. Neuron. 101 (6), 1109-1116 (2019).
- Gulick, D. W., Li, T., Kleim, J. A., Towe, B. C. Comparison of electrical and ultrasound neurostimulation in rat motor cortex. Ultrasound Med Biol. 43 (12), 2824-2833 (2017).
- King, R. L., Brown, J. R., Newsome, W. T., Pauly, K. B. Effective parameters for ultrasound-induced in vivo neurostimulation. Ultrasound Med Biol. 39 (2), 312-331 (2013).
- Yoo, S. S., et al. Focused ultrasound modulates region-specific brain activity. Neuroimage. 56 (3), 1267-1275 (2011).
- Kim, H. C., et al. Transcranial focused ultrasound modulates cortical and thalamic motor activity in awake sheep. Sci Rep. 11 (1), 19274 (2021).
- Deffieux, T., et al. Low-intensity focused ultrasound modulates monkey visuomotor behavior. Curr Biol. 23 (23), 2430-2433 (2013).
- Munoz, F., et al. Long term study of motivational and cognitive effects of low-intensity focused ultrasound neuromodulation in the dorsal striatum of nonhuman primates. Brain Stimul. 15 (2), 360-372 (2022).
- Verhagen, L., et al. Offline impact of transcranial focused ultrasound on cortical activation in primates. ELife. 8, e40541 (2019).
- Fomenko, A., et al. Systematic examination of low-intensity ultrasound parameters on human motor cortex excitability and behavior. ELife. 9, e54497 (2020).
- Legon, W., Bansal, P., Tyshynsky, R., Ai, L., Mueller, J. K. Transcranial focused ultrasound neuromodulation of the human primary motor cortex. Sci Rep. 8 (1), 10007 (2018).
- Legon, W., et al. Transcranial focused ultrasound modulates the activity of primary somatosensory cortex in humans. Nat Neurosci. 17 (2), 322-329 (2014).
- Legon, W., Ai, L., Bansal, P., Mueller, J. K. Neuromodulation with single-element transcranial focused ultrasound in human thalamus. Hum Brain Mapp. 39 (5), 1995-2006 (2018).
- Legon, W., et al. A retrospective qualitative report of symptoms and safety from transcranial focused ultrasound for neuromodulation in humans. Sci Rep. 10, 5573 (2020).
- Forster, A., et al. Investigating the role of the right inferior frontal gyrus in control perception: A double-blind cross-over study using ultrasonic neuromodulation. Neuropsychologia. 187, 108589 (2023).
- Forster, A., et al. Transcranial focused ultrasound modulates the emergence of learned helplessness via midline theta modification. J Affect Disord. 329, 273-284 (2023).
- Ziebell, P., et al. Inhibition of midfrontal theta with transcranial ultrasound explains greater approach versus withdrawal behavior in humans. Brain Stimul. 16 (5), 1278-1288 (2023).
- Kim, H. C., Lee, W., Weisholtz, D. S., Yoo, S. S. Transcranial focused ultrasound stimulation of cortical and thalamic somatosensory areas in human. PLoS One. 18 (7), e0288654 (2023).
- Kim, Y. G., et al. Neuromodulation using transcranial focused ultrasound on the bilateral medial prefrontal cortex. J Clin Med. 11 (13), 3809 (2022).
- Chu, Y. C., Lim, J., Chien, A., Chen, C. C., Wang, J. L. Activation of mechanosensitive ion channels by ultrasound. Ultrasound Med Biol. 48 (10), 1981-1994 (2022).
- Kubanek, J., et al. Ultrasound modulates ion channel currents. Sci Rep. 6 (1), 24170 (2016).
- Prieto, M. L., Firouzi, K., Khuri-Yakub, B. T., Maduke, M. Activation of Piezo1 but not NaV1.2 channels by ultrasound at 43 MHz. Ultrasound Med Biol. 44 (6), 1217-1232 (2018).
- Quarato, C. M. I., et al. A review on biological effects of ultrasounds: Key messages for clinicians. Diagnostics. 13 (5), 855 (2023).
- Nowicki, A. Safety of ultrasonic examinations; thermal and mechanical indices. Med Ultrason. 22 (2), 203 (2020).
- Miller, D. L., et al. Overview of therapeutic ultrasound applications and safety considerations. J Ultrasound Med. 31 (4), 623-634 (2012).
- Aubry, J. F., et al. ITRUSST consensus on biophysical safety for transcranial ultrasonic stimulation. arXiv preprint arXiv. , 2311.05359 (2023).
- Guo, H., et al. Ultrasound produces extensive brain activation via a cochlear pathway. Neuron. 98 (5), 1020-1030 (2018).
- Sato, T., Shapiro, M. G., Tsao, D. Y. Ultrasonic neuromodulation causes widespread cortical activation via an indirect auditory mechanism. Neuron. 98 (5), 1031-1041 (2018).
- Braun, V., Blackmore, J., Cleveland, R. O., Butler, C. R. Transcranial ultrasound stimulation in humans is associated with an auditory confound that can be effectively masked. Brain Stimul. 13 (6), 1527-1534 (2020).
- Martin, E., et al. ITRUSST consensus on standardised reporting for transcranial ultrasound stimulation. Brain Stimul. , S1935861X24000718 (2024).
- Pichardo, S. BabelBrain: An open-source application for prospective modeling of transcranial focused ultrasound for neuromodulation applications. IEEE Trans Ultrason Ferroelectr Freq Control. 70 (7), 587-599 (2023).
- Khoshnevisan, A., Allahabadi, N. S. Neuronavigation: Principles, clinical applications and potential pitfalls. Iran J Psychiatry. 7 (2), 97-103 (2012).
- Xu, L., et al. Characterization of the targeting accuracy of a neuronavigation-guided transcranial fus system in vitro, in vivo, and in silico. IEEE Trans Biomed Eng. 70 (5), 1528-1538 (2023).
- Kuehn, B., et al. Sensor-based neuronavigation: Evaluation of a large continuous patient population. Clin Neurol Neurosurg. 110 (10), 1012-1019 (2008).
- Ambrosini, E., et al. StimTrack: An open-source software for manual transcranial magnetic stimulation coil positioning. J Neurosci Methods. 293, 97-104 (2018).
- Kop, B. R., et al. Auditory confounds can drive online effects of transcranial ultrasonic stimulation in humans. eLife. , (2024).
- Zadeh, A. K., et al. The effect of transcranial ultrasound pulse repetition frequency on sustained inhibition in the human primary motor cortex: A double-blind, sham-controlled study. Brain Stimul. 17 (2), 476-484 (2024).
- Mohammadjavadi, M., et al. Elimination of peripheral auditory pathway activation does not affect motor responses from ultrasound neuromodulation. Brain Stimul. 12 (4), 901-910 (2019).
- Johnstone, A., et al. A range of pulses commonly used for human transcranial ultrasound stimulation are clearly audible. Brain Stimul. 14 (5), 1353-1355 (2021).
- Zeng, K., et al. Induction of human motor cortex plasticity by theta burst transcranial ultrasound stimulation. Ann Neurol. 91 (2), 238-252 (2022).
- Lee, W., et al. Image-guided transcranial focused ultrasound stimulates human primary somatosensory cortex. Sci Rep. 5, 8743 (2015).
- Ridding, M. C., Rothwell, J. C. Is there a future for therapeutic use of transcranial magnetic stimulation. Nat Rev Neurosci. 8 (7), 559-567 (2007).
- Nicolo, P., Ptak, R., Guggisberg, A. G. Variability of behavioural responses to transcranial magnetic stimulation: Origins and predictors. Neuropsychologia. 74, 137-144 (2015).
- Horvath, J. C., Carter, O., Forte, J. D. No significant effect of transcranial direct current stimulation (tDCS) found on simple motor reaction time comparing 15 different simulation protocols. Neuropsychologia. 91, 544-552 (2016).
- Horvath, J. C., Vogrin, S. J., Carter, O., Cook, M. J., Forte, J. D. Effects of a common transcranial direct current stimulation (tDCS) protocol on motor evoked potentials found to be highly variable within individuals over 9 testing sessions. Exp Brain Res. 234 (9), 2629-2642 (2016).
- Angla, C., Larrat, B., Gennisson, J., Chatillon, S. Transcranial ultrasound simulations: A review. Med Phys. 50 (2), 1051-1072 (2023).
- Miller, G. W., Eames, M., Snell, J., Aubry, J. Ultrashort echo-time MRI versus CT for skull aberration correction in MR-guided transcranial focused ultrasound: In vitro comparison on human calvaria. Med Phys. 42 (5), 2223-2233 (2015).
- Miscouridou, M., Pineda-Pardo, J. A., Stagg, C. J., Treeby, B. E., Stanziola, A. Classical and learned MR to pseudo-CT mappings for accurate transcranial ultrasound simulation. IEEE Trans Ultrason Ferroelectr Freq Control. 69 (10), 2896-2905 (2022).
- Pichardo, S., et al. A viscoelastic model for the prediction of transcranial ultrasound propagation: application for the estimation of shear acoustic properties in the human skull. Phys Med Biol. 62 (17), 6938-6962 (2017).
- Pichardo, S. . ProteusMRIgHIFU/BABELVISCOFDTD: Software Library for FDTD of viscoelastic equation using a staggered grid arrangement with support for GPU and CPU backends. , (2024).
- Aubry, J. F., et al. Benchmark problems for transcranial ultrasound simulation: Intercomparison of compressional wave models. J Acoust Soc Am. 152 (2), 1003-1019 (2022).
- Pinton, G., et al. Attenuation, scattering, and absorption of ultrasound in the skull bone: Absorption of ultrasound in the skull bone. Med Phys. 39 (1), 299-307 (2011).
- Chaplin, V., et al. On the accuracy of optically tracked transducers for image-guided transcranial ultrasound. Int J Comput Assist Radiol Surg. 14 (8), 1317-1327 (2019).
- Wu, S. Y., et al. Efficient blood-brain barrier opening in primates with neuronavigation-guided ultrasound and real-time acoustic mapping. Sci Rep. 8 (1), 7978 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon