É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Pipeline para Planejamento e Execução de Experimentos de Neuromodulação por Ultrassom Transcraniano em Humanos
Neste Artigo
Resumo
A estimulação ultrassônica transcraniana (UST) é uma técnica emergente de neuromodulação não invasiva que requer um planejamento cuidadoso de simulações acústicas e térmicas. A metodologia descreve um pipeline de processamento de imagem e simulação de ultrassom para um planejamento eficiente, fácil de usar e simplificado para experimentação de TUS humano.
Resumo
A estimulação ultrassônica transcraniana (UST) é uma técnica emergente de neuromodulação não invasiva capaz de manipular estruturas corticais e subcorticais com alta precisão. A realização de experimentos envolvendo humanos requer um planejamento cuidadoso de simulações acústicas e térmicas. Esse planejamento é essencial para ajustar a interferência óssea na forma e trajetória do feixe de ultrassom e para garantir que os parâmetros do UST atendam aos requisitos de segurança. As imagens de ressonância magnética (RM) ponderadas em T1 e T2, juntamente com a ressonância magnética (MRI) com eco em tempo zero (ZTE) com resolução isotrópica de 1 mm, são adquiridas (alternativamente tomografia computadorizada (TC)) para reconstrução e simulações do crânio. O mapeamento de alvos e trajetórias é realizado usando uma plataforma de neuronavegação. O SimNIBS é usado para a segmentação inicial do crânio, pele e tecidos cerebrais. A simulação do UST é realizada com a ferramenta BabelBrain, que usa a varredura ZTE para produzir imagens sintéticas de TC do crânio para serem convertidas em propriedades acústicas. Usamos um transdutor de ultrassom Phased Array com recursos de direção elétrica. A direção Z é ajustada para garantir que a profundidade desejada seja alcançada. Outras configurações de transdutor também são suportadas na ferramenta de planejamento. As simulações térmicas são executadas para garantir que os requisitos de temperatura e índice mecânico estejam dentro das diretrizes acústicas para UST em seres humanos, conforme recomendado pelo FDA. Durante as sessões de entrega do TUS, um braço mecânico auxilia no movimento do transdutor para o local necessário usando um sistema de localização estereotáxica sem moldura.
Introdução
As técnicas de neuroestimulação não invasivas comumente usadas incluem estimulação transcraniana por corrente contínua (ETCC) e estimulação magnética transcraniana (EMT). No entanto, ambos têm profundidade de penetração limitada e baixa precisão 1,2. Por outro lado, o ultrassom transcraniano (UST) é uma técnica não invasiva emergente capaz de aumentar ou suprimir a atividade neuronal 3,4,5 e direcionar estruturas corticais ou subcorticais com precisão milimétrica 6,7. Modelos animais usando roedores 4,8,9, coelhos10, ovelhas5,11, suínos6 e primatas não humanos 7,12,13,14 mostraram a eficácia e segurança do UST. Estudos demonstraram que o direcionamento de várias regiões do cérebro pode provocar movimentos dos membros8 em ratos, potenciais evocados somatossensoriais (SSEPs) em suínos6 e mudanças na atividade visuomotora12, tomada de decisão cognitiva e motivacional em primatas não humanos13 entre outras mudanças no comportamento. Em humanos, observou-se que o UST altera os potenciais evocados motores (MEPs) e o desempenho em uma tarefa de tempo de reação ao atingir o córtex motor primário15,16 e o desempenho alterado em uma tarefa de discriminação tátil e SSEPs ao atingir o córtex somatossensorial17 e o tálamo sensorial18. As análises histológicas não revelaram alterações estruturais macroscópicas ou microscópicas associadas ao UST em suínos6, ovelhas 5,11, coelhos10 e primatas não humanos14, e não foram observados efeitos colaterais que diferissem significativamente de outras técnicas de neuroestimulação não invasivas19.
O TUS usa ultrassom focalizado pulsado de baixa intensidade a uma frequência entre 200 kHz e 700 kHz para produzir um efeito neuromodulador transitório. A intensidade média típica do pulso de pico espacial (Isppa) in situ é de 10 W / cm2 ou menos, com ciclos de trabalho relatados (porcentagem de tempo em que o ultrassom está ligado) variando de 0,5% a 70% em humanos 20,21,22,23,24. Embora os mecanismos da neuromodulação do UST tenham sido propostos como envolvendo principalmente a agitação mecânica das membranas lipídicas levando à abertura dos canais iônicos25 , 26 , 27 , possíveis efeitos térmicos e de cavitação não podem ser ignorados. Eles são avaliados por meio de índices mecânicos (MI) e térmicos (TI). O IM descreve os bioefeitos previstos relacionados à cavitação que ocorrerão com o UST, enquanto o TI descreve o aumento potencial da temperatura dentro dos tecidos após a aplicação de ultrassom28,29. Além disso, alterar a frequência e a intensidade de entrada também faz com que o MI e o TI mudem. Frequências mais altas têm melhor resolução espacial e diminuem a probabilidade de bioefeitos mecânicos; no entanto, eles têm maior absorção no tecido, o que aumenta o potencial de aumento de temperatura28. Alternativamente, frequências mais baixas na mesma intensidade aumentam o IM. Da mesma forma, o aumento da intensidade tende a aumentar a magnitude dos bioefeitos mecânicos e térmicos30. É, portanto, imperativo que um planejamento e simulação cuidadosos sejam realizados antes das sessões de experimentação para todos os parâmetros do TUS que serão implementados.
O planejamento de um experimento de TUS requer a identificação do alvo e da trajetória de interesse e a realização de simulações térmicas e acústicas. As simulações auxiliam na otimização dos efeitos mecânicos e na mitigação dos efeitos térmicos do UST nos tecidos. Eles exigem a compreensão da previsão do aquecimento do crânio, amplitude de pressão do ultrassom no ponto focal, correção focal e outros aquecimentos dentro do crânio e da pele. A simulação adequada garante que o ponto focal atinja o alvo de interesse e os parâmetros de segurança para uso de ultrassom estabelecidos pelas diretrizes de segurança biofísica, conforme recomendado pelo International Transcranial Ultrasonic Stimulation Safety and Standards Consortium (ITRUSST)31, que são baseados nas recomendações da FDA e da Health Canada, são seguidos. Estudos recentes também destacaram um efeito de confusão auditiva acompanhado por UST 32,33,34 em animais e humanos, pelo qual a estimulação do UST pode ativar vias auditivas no cérebro para provocar respostas 32,33,34. A transecção dos nervos auditivos32, a remoção do líquido coclear32 ou a surdez química33 em roedores têm sido empregadas para diminuir esses efeitos em animais. Em humanos, a administração de um tom auditivo por meio de fones de ouvido tem sido usada para mascarar efetivamente o ruído auditivo do UST, controlando o confundimento da atividade auditiva induzida pelo UST34. Isso destaca a necessidade de controlar o ruído auditivo em condições de estimulação simulada, que deve ser incorporada ao planejamento, design e implementação do protocolo.
Aqui, apresentamos um guia sobre como concluir adequadamente a preparação (etapa 1, etapa 2), planejamento (etapa 3), simulações (etapa 4) e entrega de TUS (etapa 5) necessários para realizar o experimento de neuromodulação de TUS em humanos.
Protocolo
Todos os métodos que envolvem o uso de seres humanos foram realizados em conformidade com a Conduta Ética do Tri-Conselho para Pesquisa Envolvendo Seres Humanos, e o protocolo foi aprovado pelo Conselho Conjunto de Ética em Pesquisa em Saúde (CHREB) da Universidade de Calgary. Todos os indivíduos forneceram consentimento informado por escrito antes da participação. Os participantes humanos deveriam ser adultos destros saudáveis entre 18 e 40 anos, dispostos e capazes de concluir uma ressonância magnética (MRI). Os critérios de exclusão incluíram histórico familiar de convulsões, humor ou distúrbios cardiovasculares, trauma de ouvido, dependência de álcool ou drogas, uso de medicamentos prescritos, implantes metálicos, incluindo marca-passo, gravidez, distúrbios cardiovasculares, histórico de distúrbios neurológicos ou psiquiátricos, incapacidade de se comunicar com o investigador e a equipe do estudo e incapacidade legal ou capacidade legal limitada. O protocolo descrito a seguir segue as recomendações do ITRUSST sobre o relato padronizado de estudos de UST35. Os detalhes do equipamento, software e links necessários usados neste estudo estão listados na Tabela de Materiais.
1. Ressonância magnética de alta resolução
- Visualize o participante usando uma bobina de cabeça/pescoço de 24 canais.
NOTA: Alternativamente, a melhor bobina de cabeça/pescoço disponível no local é suficiente para obter uma ressonância magnética anatômica. - Colete imagens de RM ponderadas em T1 e T2 e sequências de eco em tempo zero (ZTE) com resolução de 1 mm.
NOTA: Recomenda-se que as imagens de RM sejam coletadas sem que o participante use fones de ouvido, pois isso pode afetar a reconstrução da imagem e dificultar as etapas subsequentes de planejamento e implementação. Em vez disso, recomenda-se que o participante use apenas tampões de ouvido para segurança de RM.- Para imagens ponderadas em T1, use uma sequência de eco gradiente estragado rápido (FSPGR) preparada para recuperação de inversão 3D com os seguintes parâmetros: tempo de repetição (TR) = 8,4 ms, tempo de eco (TE) = 3,2 ms, tempo de inversão (TI) = 650 ms, ângulo de inversão de 10 graus, um campo de visão medindo 256 mm x 256 mm x 188 mm, tamanho da matriz de 256 x 256 x 188, Fator GRAPPA (ARC) de 2 na direção da codificação de fase e orientação sagital-oblíqua para alinhamento aproximado com AC-PC.
NOTA: O tempo total de varredura é de 5 min e 21 s. - Para imagens ponderadas em T2, use um eco de rotação rápida 3D (FSE) com os seguintes parâmetros: TR = 3000 ms, TE = 60-90 ms, um comprimento de trem de eco de 130, o campo de visão medindo 256 mm x 225 mm x 188 mm, tamanho da matriz de 256 x 256 x 188 e uma orientação sagital-oblíqua aproximando o alinhamento com o eixo AC-PC. Um fator de grappa (ARC) de dois foi utilizado na codificação de fase e na direção do corte.
NOTA: O tempo total de varredura é de 3 minutos e 58 seg. - Para imagens ZTE, use uma varredura 3D ZTE isotrópica com as seguintes configurações: TR = 698 ms, TE = 16 μs, ângulo de inversão de 1 grau, largura de banda do receptor de 62,5 kHz, número de médias = 3,5, um campo de view medindo 256 mm x 256 mm x 256 mm, tamanho da matriz de 256 x 256 x 256.
NOTA: O tempo total de varredura é de 5 min e 23 s.
NOTA: As imagens de RM devem ser concluídas antes que o planejamento do TUS possa começar.
- Para imagens ponderadas em T1, use uma sequência de eco gradiente estragado rápido (FSPGR) preparada para recuperação de inversão 3D com os seguintes parâmetros: tempo de repetição (TR) = 8,4 ms, tempo de eco (TE) = 3,2 ms, tempo de inversão (TI) = 650 ms, ângulo de inversão de 10 graus, um campo de visão medindo 256 mm x 256 mm x 188 mm, tamanho da matriz de 256 x 256 x 188, Fator GRAPPA (ARC) de 2 na direção da codificação de fase e orientação sagital-oblíqua para alinhamento aproximado com AC-PC.
2. Pré-processamento das imagens dos participantes
- Converta arquivos de varredura DICOM T1-w, T2-w e ZTE do formato DICOM para Nifti usando a ferramenta dcm2niix. Em uma janela de terminal, execute: dcm2niix .
NOTA: A ferramenta dcm2niix está disponível no GitHub (consulte Tabela de materiais). A ferramenta BabelBrain registra as imagens do participante para acomodar as imagens coletadas em dias separados. Se as imagens T1-w não forem isotrópicas, elas são reamostradas para voxels isotrópicos de 1 mm; no entanto, as imagens CT/ZTE não são. Em vez disso, as máscaras para a simulação são reamostradas para a resolução final em termos de PPW. Nenhuma etapa adicional de co-registro ou alinhamento é necessária. - Execute o co-registro e a extração da máscara de tecido usando a ferramenta charm do SimNIBS. Em uma janela de terminal, execute: charm , onde é uma string para identificação. Neste ponto, o planejamento do experimento pode ser pausado e continuado em outro momento.
NOTA: Os arquivos criados serão salvos em um subdiretório m2m , que será usado nas etapas de planejamento subsequentes. O pré-processamento de imagens com a ferramenta charm é necessário para fins de segmentação de tecidos, pois isso é necessário para uso na ferramenta BabelBrain36.
3. Planejamento de trajetória
- Abra o Brainsight, clique em Novo Projeto Vazio e carregue a imagem T1-w Nifti do participante, produzida na etapa 2.1.
NOTA: Se estiver usando uma versão do Brainsight anterior à v2.5.3, "Novo Projeto Vazio" ou "Novo Projeto SimNIBS" pode ser escolhido. Se estiver usando o Brainsight v2.5.3 em diante, há integração entre o Brainsight e o BabelBrain e é altamente recomendável clicar em "Novo Projeto SimNIBS"; no entanto, ambos ainda são suficientes para concluir as etapas de planejamento. "Novo Projeto Vazio" requer o carregamento da imagem T1-w, enquanto o "Novo Projeto SimNIBS" requer o carregamento de um arquivo .msh que carrega diretamente a imagem T1-w. Todas as outras funcionalidades e etapas permanecem as mesmas. - Clique em Sobreposições e, em seguida, em Configurar sobreposições para criar e visualizar uma sobreposição. Clique em Adicionar para selecionar o arquivo a ser sobreposto.
NOTA: Se o alvo não puder ser visualizado em uma imagem T1-w, ele deverá primeiro ser localizado em uma imagem T2-w co-registrada (portanto, as coordenadas T1-w e T2-w são as mesmas). Em seguida, transfira as coordenadas para uma imagem T1-w para as etapas de planejamento subsequentes. A ferramenta de charme na etapa 2.2 produz uma imagem T2-w co-registrada no caminho do arquivo m2m /T2_reg.nii.gz. - Feche a seção de sobreposições, clique na guia Destinos , seguida de Configurar destinos. Clique no botão azul de informações para alterar a opacidade, a cor e o limite da sobreposição para permitir uma comparação das imagens.
NOTA: Isso pode ser realizado para visualizar imagens Nifti co-registradas e deve ser usado para observar como as simulações acústicas se sobreporão ao alvo. - Clique na guia Reconstruções e, em seguida, no menu suspenso Nova Reconstrução.... Clique em Skin, seguido de Compute Skin na nova janela. Depois de concluído, clique no botão fechar no canto superior esquerdo da janela.
- Na guia "Reconstruções", clique no menu suspenso Nova Reconstrução... seguido de Full Brain Curvilíne.
- Ajuste cada caixa nas imagens sagital (Figura 1A), coronal (Figura 1B) e transversal (Figura 1C) arrastando as bordas da caixa verde, de modo que as linhas fiquem firmemente ao redor do cérebro (Figura 1).
- Percorra todas as fatias para garantir que nenhuma borda do tecido esteja sobreposta. Clique em Compute Curvilíneo e ajuste a profundidade de descascamento para 4 mm (Figura 1D).
NOTA: O cérebro curvilíneo completo fornece uma reconstrução 3D do córtex, que pode ser descascada para observar diferentes profundidades. Ele permite a colocação precisa e consistente de uma bobina TMS sobre o cérebro para localizar a região de interesse.
- Clique na guia Pontos de referência no Brainsight, seguido de Configurar pontos de referência.
- Coloque a mira (cursor) na ponta do nariz e, no campo "Nome:", rotule o ponto de referência "Nariz" (Figura 2A). Coloque a mira entre os olhos acima da ponte do nariz e rotule o ponto de referência como "Nasion" (Figura 2A).
- Coloque a mira na orelha esquerda e rotule o ponto de referência como "Orelha em L" (Figura 2B). Coloque a mira na orelha direita e rotule o ponto de referência como "R Ear" (Figura 2C).
- Clique na guia Alvos e use a mira (cursor) para localizar o alvo de interesse.
- Coloque a mira (cursor) no local do alvo desejado e use os botões de ângulo no lado direito da tela para definir o ângulo da trajetória.
- Depois que o alvo e a trajetória desejados forem selecionados, clique no menu suspenso Novo e escolha Trajetória. Nomeie o destino digitando na caixa de texto ao lado de "Nome:".
- Exporte o destino clicando em Exportar... e salve-o na pasta de assunto apropriada. Depois que o arquivo é salvo, o planejamento pode ser pausado e o experimento pode ser reiniciado mais tarde.
NOTA: O alvo será usado nas etapas subsequentes para concluir as simulações térmicas e acústicas.
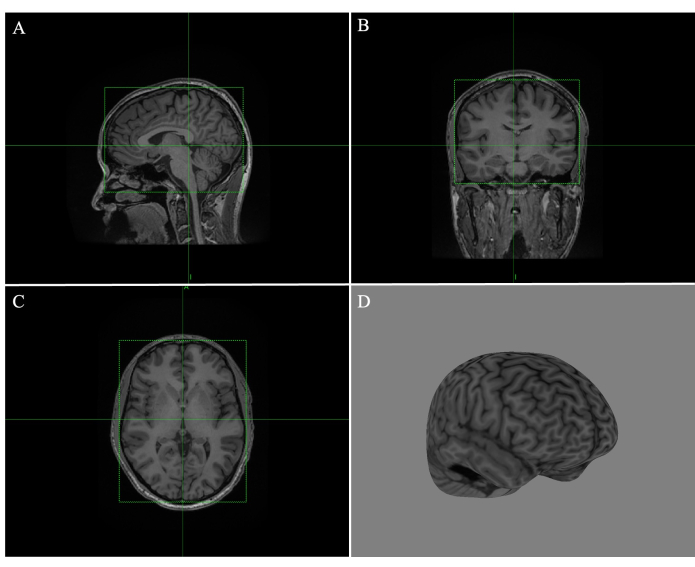
Figura 1: Criando uma curvilínea cerebral completa no Brainsight. (A) Caixa ajustada à borda da imagem de RM sagital. (B) Caixa ajustada à borda da imagem coronal de RM. (C) Caixa ajustada à borda da imagem transversal de RM. (D) Reconstrução curvilínea cerebral completa com profundidade de casca de 4 mm. Clique aqui para ver uma versão maior desta figura.
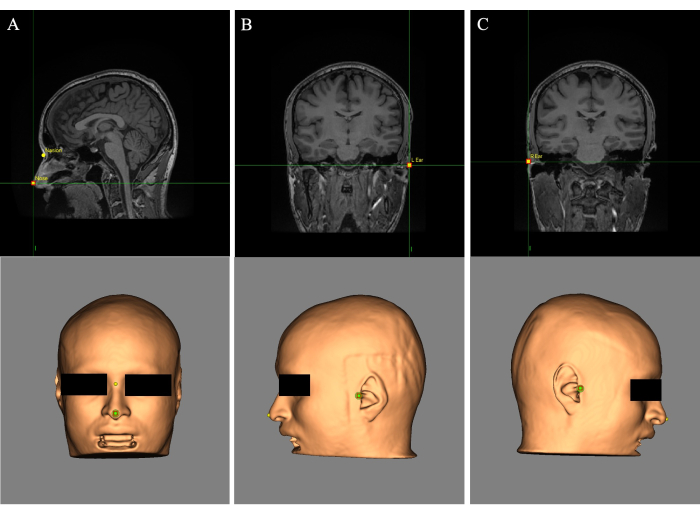
Figura 2: Pontos de referência colocados na reconstrução da pele e imagem de RM. (A) Colocação de pontos de referência do nariz e do násio. (B) Colocação do ponto de referência da orelha esquerda. (C) Colocação do ponto de referência da orelha direita. Clique aqui para ver uma versão maior desta figura.
4. Simulações com BabelBrain
NOTA: Detalhes para simulação com o BabelBrain podem ser consultados no manual do BabelBrain: https://proteusmrighifu.github.io/BabelBrain/index.html.
- Abra o BabelBrain e selecione os arquivos necessários para simulações acústicas e térmicas.
NOTA: Este envio usa um transdutor Phased Array; no entanto, outros transdutores são totalmente compatíveis com este software de planejamento. Este programa pode completar simulações para Single, CTX_500, H-317, H-246 e transdutores. No método a seguir, o H-317 será usado como o transdutor selecionado.- Selecione o arquivo txt exportado anteriormente do Brainsight durante a etapa 3.7.3 clicando em Selecionar Trajetória... e escolhendo o arquivo de participante apropriado. Clique em Selecionar SimNIBS... para escolher o arquivo SimNIBS (nome m2m_folder) criado na Etapa 2. Clique em Selecionar T1W... e escolha a imagem T1-w produzida na etapa 2.1 usada anteriormente para mapeamento de alvo e trajetória.
- No menu suspenso ao lado do rótulo "Usar TC?", escolha TC real se estiver usando uma tomografia computadorizada, ZTE se estiver usando uma varredura ZTE ou NÃO se estiver usando uma máscara simplificada gerada pela ferramenta de charme se apenas imagens T1 e T2-w estiverem disponíveis. Ao usar uma imagem de TC ou ZTE, clique no menu suspenso Correg.? seguido de CT para MR. Clique em Selecionar e escolha a imagem correspondente no arquivo de participante apropriado.
- Clique em "Selecionar perfil térmico ..." e escolha o arquivo de perfil térmico que descreve os parâmetros de sonicação do experimento em termos de duração ligada, duração desligada e ciclo de trabalho.
NOTA: Os detalhes podem ser consultados no manual do BabelBrain: https://proteusmrighifu.github.io/BabelBrain/index.html. Exemplos de perfis estão disponíveis em https://github.com/ProteusMRIgHIFU/BabelBrain/tree/main/Profiles. - Clique no menu suspenso ao lado de "Transdutor" e selecione o transdutor usado para experimentação. Clique no menu suspenso ao lado de "Back-end de computação" e escolha o back-end de computação do computador que executa as simulações. Depois que todas as informações forem inseridas, clique em CONTINUAR para concluir o restante das simulações.
- Subetapa A: Calcular máscara.
- Selecione a frequência de ultrassom do transdutor e o ponto apropriado por comprimento de onda (PPW).
NOTA: 6 PPW são suficientes para a maioria dos cenários. - Deixe o intervalo ZTE normalizado e as unidades Hounsfield (HU) como estão.
NOTA: Se estiver usando um TC real, apenas o limite de HU aparecerá. Se nenhuma varredura ZTE ou TC for fornecida, esta entrada estará ausente. - Clique em Calcular máscara de planejamento. Inspecione a imagem, verificando se os limites da pele, crânio e cérebro foram reconhecidos com precisão.
NOTA: Se houver discrepâncias, ajuste a faixa ZTE normalizada e/ou o limite de HU.
- Selecione a frequência de ultrassom do transdutor e o ponto apropriado por comprimento de onda (PPW).
- Subetapa B: Simulação Acústica. Clique na guia Etapa 2 - Ac Sim para abrir.
NOTA: Esta guia terá uma aparência diferente dependendo do transdutor selecionado. O que se segue é específico para o transdutor H-317.- Ajuste a distância do cone ao foco para refletir a distância da superfície do cone ao alvo digitando a distância apropriada.
NOTA: Isso é ditado pelo cone físico a ser usado em experimentos. - Execute a simulação clicando no botão Calcular campos .
- Ajuste o valor da direção Z (mm) para que a mira (indicando o alvo) fique no centro do ponto focal (Figura 3). Pressione as setas para cima ou para baixo ou insira manualmente o valor necessário e clique em Calcular campos.
NOTA: Valores positivos direcionarão o ponto focal mais profundamente para dentro do cérebro, enquanto valores negativos farão com que o ponto focal se mova superficialmente. - Ajuste X/Y mecânico se o ponto focal estiver lateral ao alvo pretendido. Deixe Z mecânico como está. Clique em Calcular campos.
NOTA: Z mecânico é recalculado em função da distância do cone em 4.3.1. Se necessário ajustar a direção Z, a mecânica X/Y ou a profundidade máxima além do alvo após a conclusão de um cálculo, os arquivos de simulação acústica devem ser recalculados. Clique em Calcular campos e selecione Sim para recalcular. Selecione Não para recarregar os arquivos existentes.
- Ajuste a distância do cone ao foco para refletir a distância da superfície do cone ao alvo digitando a distância apropriada.
- Subetapa C: Simulação Térmica. Clique na guia Etapa 3 - Thermal Sim e, em seguida, clique em Calcular campos térmicos. Avaliar as simulações mecânicas e térmicas (figura 4) para garantir que cumprem as diretrizes acústicas em seres humanos, conforme recomendado pelo ITRUSST31 (índice mecânico (IM) em tecidos moles ≤1,9; aumento térmico ≤2 °C, dose térmica ≤0,25 CEM43, tempo de exposição restrito a 80 min para 1,5 < índice térmico craniano (TIC) ≤ 2,0, 40 min para 2,0 < TIC ≤ 2,5, 10 min para 2,5 < TIC ≤ 3,0, 160 s para 3,0 < TIC ≤ 4,0, 40 s para 4,0 < TIC ≤ 5,0 e 10 s para 5,0 < TIC ≤ 6,0).
NOTA: BabelBrain resolve a Equação de Transferência de Biocalor para estimar o aumento da temperatura36. Em raras ocasiões, podem ocorrer voxels anormais de alta temperatura, caso em que as imagens de RM devem ser analisadas se alguma característica anatômica puder explicar o aumento incomum da temperatura.- Ajuste oI sppa clicando nas setas para cima ou para baixo ao lado da caixa Isppa(W/cm2) ou inserindo manualmente um valor acima de 0,1 para observar como os parâmetros mudam com diferentes intensidades.
NOTA: Um resumo de todas as intensidades, mudanças de temperatura e índices mecânicos pode ser exportado como um arquivo CSV para referência. O software calcula a intensidade necessária em condições de água (Isppa na água) que precisa ser aplicada para atingir a intensidade desejada in situ. - Clique nos botões MTB, MTS e MTC na região inferior da interface para visualizar a fatia com a temperatura mais alta no cérebro, pele e crânio. Após a conclusão da etapa de simulação térmica, as simulações são concluídas.
NOTA: Os arquivos serão salvos automaticamente no mesmo local que a imagem T1-w.
NOTA: Arquivos acústicos com um < final... FullElasticSolution_Sub_NORM.nii.gz> podem ser carregados no Brainsight para visualizar a sobreposição do campo acústico no espaço T1. Haverá arquivos para condições somente de água (com o infixo "Água" no nome do arquivo) e arquivos para condições presentes no tecido (sem infixo no nome do arquivo). Siga as etapas na nota após a etapa 3.1 para adicionar uma sobreposição. Após a etapa de simulação térmica, as simulações são concluídas e o experimento pode ser pausado até a sessão de entrega do TUS.
- Ajuste oI sppa clicando nas setas para cima ou para baixo ao lado da caixa Isppa(W/cm2) ou inserindo manualmente um valor acima de 0,1 para observar como os parâmetros mudam com diferentes intensidades.
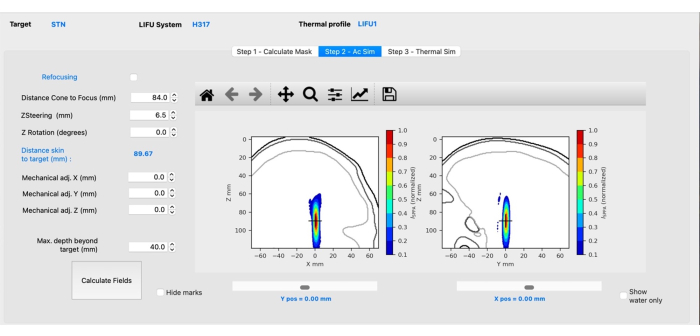
Figura 3: Simulação acústica usando BabelBrain. Clique aqui para ver uma versão maior desta figura.
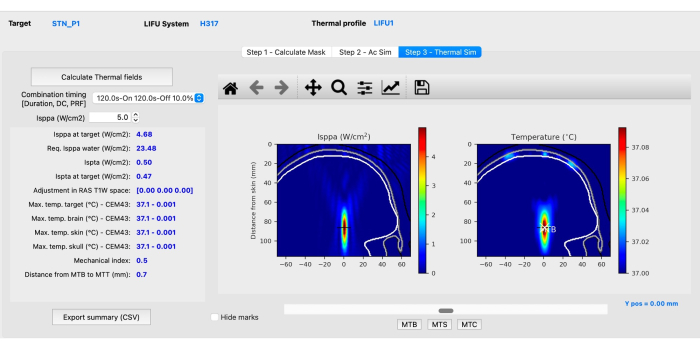
Figura 4: Simulação térmica usando o BabelBrain. Clique aqui para ver uma versão maior desta figura.
5. Sessão de entrega do TUS
- Abra o Brainsight e clique em Abrir Projeto Existente. Selecione o arquivo Brainsight criado e salvo durante o mapeamento de trajetória e alvo.
- Clique em Sessões para iniciar uma nova sessão de experimentação. Clique no menu suspenso e selecione Novo, seguido de Sessão Online. Clique no nome do destino seguido de Adicionar e Avançar para adicionar o destino à sessão de experimento e continuar na janela de experimentação.
NOTA: Se a entrega do TUS for realizada usando um computador diferente do que foi usado para o planejamento, o Brainsight exigirá que a imagem T1-w apropriada seja escolhida. Nesse caso, uma nova janela será aberta e solicitará que você selecione a imagem do participante T1-w associada do arquivo do participante. - Clique em Janela e Calibração da ferramenta e selecione as ferramentas a serem usadas, seguido de Recalibrar.
NOTA: Esta etapa deve ser concluída para o transdutor e todas as outras ferramentas usadas durante a sessão experimental, como uma bobina TMS.- Prenda o rastreador de bobina grande e o bloco de calibração ao transdutor. Certifique-se de que a câmera possa ver os fiduciais em ambas as ferramentas. Clique em Iniciar contagem regressiva de calibração para recalibrar.
NOTA: Salvar a calibração garantirá que ela permaneça a mesma para aquele dia de experimentos. Se isso não for realizado e o computador desligar, o equipamento precisará ser recalibrado.
- Prenda o rastreador de bobina grande e o bloco de calibração ao transdutor. Certifique-se de que a câmera possa ver os fiduciais em ambas as ferramentas. Clique em Iniciar contagem regressiva de calibração para recalibrar.
- Configure o transdutor de acordo com seus procedimentos de configuração para experimentação. Remova o rastreador no transdutor antes de configurá-lo para que não seja danificado.
NOTA: A configuração descrita é para o transdutor H-317 com um cone de acoplamento personalizado.- Monte o cone conforme necessário, colocando o filme do transdutor entre o cone e a tampa da extremidade. Prenda o cone de acoplamento ao flange do transdutor usando parafusos, arruelas e porcas, garantindo que todos estejam apertados para que não haja vazamentos.
- Encha o transdutor com água desionizada e conecte os tubos da bomba ao transdutor, conectando o tubo rotulado como "IN" a "OUT" e "OUT" a "IN". Tampe o orifício de água enquanto pressiona "DRAIN" na bomba para aliviar a pressão.
- Vire o transdutor de cabeça para baixo para isolar as bolhas de ar no filme e, em seguida, gire para cima, permitindo que elas saiam pelo tubo do transdutor identificado como "OUT". Repita isso até que todas as bolhas de ar visíveis sejam removidas. Configure o transdutor de forma que seu tubo "OUT" fique inclinado para frente e no ponto mais alto e deixe com a bomba funcionando por 30 min.
- Vire o transdutor de cabeça para baixo para verificar se todas as bolhas de ar foram removidas. Se alguns permanecerem, isole as bolhas de ar no filme e gire o transdutor como antes para garantir que elas saiam pelo tubo "OUT". Repita até que todas as bolhas tenham sido removidas.
- Desligue a bomba, desconecte as mangueiras e trave o transdutor em ponto morto. Reconecte o rastreador ao transdutor e prossiga com a configuração do participante.
- Prenda o rastreador de assunto na cabeça do participante usando óculos, uma faixa de cabeça colocada acima das orelhas e sobrancelhas (Figura 5) ou o rastreador adesivo leve. Certifique-se de que os fiduciais estejam orientados de forma que fiquem visíveis para a câmera e não sejam bloqueados ou atingidos pelo transdutor ao se mover em direção ou quando atingir sua posição final.
- Coloque a câmera na frente do participante para que ele possa ver o rastreador de assunto e o ponteiro.
NOTA: Se eles não estiverem visíveis, o indicador no canto inferior esquerdo da tela ficará vermelho. Isso também pode ser verificado entrando na guia "Polaris" no Brainsight.
- Coloque a câmera na frente do participante para que ele possa ver o rastreador de assunto e o ponteiro.
- Clique na guia Registro no Brainsight. Coloque o ponteiro em todos os quatro pontos de referência definidos durante a etapa 3.6, estabilizando-o com as duas mãos, depois clique em Sample & Go To Next Landmark.
NOTA: É importante que a faixa de cabeça ou os óculos permaneçam apertados na cabeça do participante e que o rastreador de assuntos não se mova. Se isso acontecer, execute o registro novamente. Se os fiduciais precisarem ser girados para acomodar o movimento do transdutor após a conclusão do registro, refaça o registro. - Clique na guia Validação para validar o registro do participante. Coloque levemente o ponteiro em várias posições ao longo do couro cabeludo e certifique-se de que todos os pontos tenham menos de 3 mm.
NOTA: Os sistemas comerciais de neuronavegação criados para TMS estão sendo utilizados para experimentação de TUS em humanos. Um erro de translação de 3 mm é aceitável para calibração de transdutores portáteis37, pois é consistente com a precisão do alvo38,39 e outros sistemas de neuronavegação40. O valor de 3 mm está embutido no software de neuronavegação Brainsight.- Se algum ponto for maior que 3 mm, clique no botão Adicionar para adicionar pontos de referência adicionais para um máximo de três pontos. Se forem necessários mais de três pontos para obter uma validação consistente abaixo de 3 mm, refaça o registro.
NOTA: Para melhorar o sucesso do registro, recomenda-se que as imagens de RM sejam coletadas sem que o participante use fones de ouvido, pois isso pode afetar a reconstrução da imagem e dificultar o registro. Tenha cuidado para que o ponteiro seja colocado o mais próximo possível do ponto de referência antes de clicar em Sample & Go To Next Landmark, e certifique-se de que o ponteiro esteja estabilizado usando as duas mãos. A validação fornece garantia de que a média de todos os pontos ao longo da superfície do couro cabeludo está abaixo do limiar. Não prossiga até que todos os locais aleatórios no couro cabeludo estejam abaixo do limite de 3 mm.
- Se algum ponto for maior que 3 mm, clique no botão Adicionar para adicionar pontos de referência adicionais para um máximo de três pontos. Se forem necessários mais de três pontos para obter uma validação consistente abaixo de 3 mm, refaça o registro.
- Prenda a cabeça do participante com o apoio de queixo e o estabilizador colocados na parte de trás da cabeça para evitar movimentos (Figura 5). Certifique-se de que eles estejam sentados confortavelmente na cadeira durante o experimento.
- Clique em Executar. Use o braço mecânico para posicionar o transdutor sobre o alvo de interesse ao longo da trajetória selecionada.
NOTA: Certifique-se de praticar e estar familiarizado com a forma como os componentes do braço mecânico se movem para atingir o alvo. O sucesso no posicionamento do braço mecânico vem da compreensão da mobilidade do braço e da familiarização com a forma como ele se move na orientação da cabeça, pois isso depende muito da localização do alvo.- Use a mira na janela do alvo para obter o posicionamento e o ângulo corretos (Figura 6). Alinhe os dois círculos (translacional e rotacional) para que fiquem posicionados na mira e consulte a leitura de precisão para verificação.
- Divida o cabelo do sujeito ao longo de sua parte natural e penteie o gel de ultrassom para garantir que não haja bolsas de ar dentro do cabelo. Se uma grande área exigir acoplamento, aplique gel de ultrassom no filme do transdutor. Encha as bolsas de ar restantes com gel de ultrassom adicional usando uma seringa.
- Abaixe o transdutor até a altura apropriada observando quando a mira está no meio da caixa ao redor do alvo (Figura 6). Isso indicará quando a profundidade alvo apropriada foi atingida.
- Um script Python personalizado usa os resultados das simulações na etapa 4 para programar a unidade de 128 amplificadores e gerar som por meio de fones de ouvido (https://github.com/ProteusMRIgHIFU/TUSApp). Se estiver realizando um experimento online e/ou duplo-cego, certifique-se de que o áudio de mascaramento seja reproduzido por meio de fones de ouvido34,41 ou aumente o estímulo e compense ao longo da duração da explosão 42,43,44 como métodos para reduzir possíveis efeitos de confusão auditiva.
NOTA: Nesta etapa, se estiver usando uma unidade disponível comercialmente, como um transdutor CTX-500, prescreva a intensidade que foi simulada em condições de água, juntamente com outros parâmetros (PRF, duração, ciclo de trabalho). O transdutor H-317 usa um script dedicado para executar o transdutor; Por conseguinte, esta etapa é omitida da presente alegação.- Gere o áudio de mascaramento no MATLAB para reproduzir no início da entrega do TUS. O som durante a estimulação simulada combina uma onda senoidal contínua a 250 kHz, uma onda quadrada a uma frequência de rajada de 100 Hz amostrada a 48 kHz, com ruído aleatório para replicar de perto o som produzido pelo transdutor. Durante o TUS, apenas ruídos aleatórios são reproduzidos pelos fones de ouvido, pois o som emitido pelo transdutor também será ouvido pelo sujeito.
- Após a conclusão da entrega do UST, remova o transdutor, o gel e o rastreador da cabeça do participante antes de qualquer procedimento experimental subsequente.
- Para limpar o equipamento TUS, remova o rastreador do transdutor para evitar danos. Desmonte o transdutor removendo o plugue na parte superior e virando-o de cabeça para baixo para drenar a água. Remova o cone de acoplamento e desmonte-o para permitir que as peças sequem ao ar.
- Retorne o transdutor para neutro e certifique-se de que todos os componentes do braço estejam travados firmemente a 90° para armazenamento até a próxima sessão experimental de TUS.

Figura 5: Fiduciais a serem usados para neuronavegação. Óculos (esquerda) e faixa de cabeça (direita) com fiduciais anexados para rastreamento de assunto. A cabeça do sujeito é presa com um apoio de queixo e estabilizador atrás da cabeça. Clique aqui para ver uma versão maior desta figura.
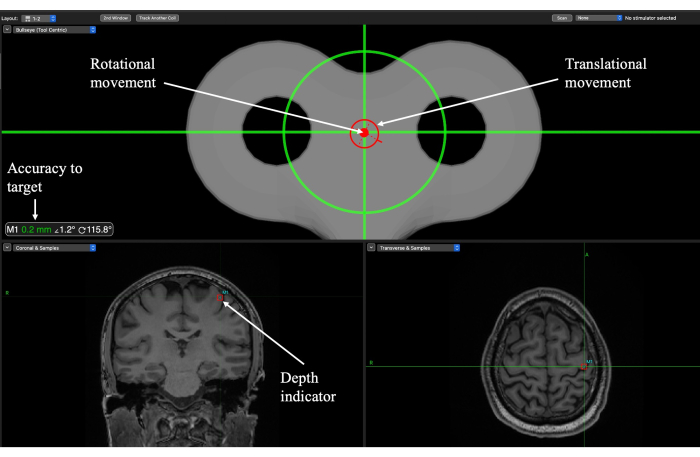
Figura 6: Tela de neuronavegação Brainsight para localização do alvo durante a sessão de entrega do TUS para um alvo do córtex motor primário (M1). Indicadores rotacionais e translacionais orientam o experimentador sobre onde posicionar o transdutor sobre o couro cabeludo e quando o ângulo da trajetória foi alcançado. A precisão do alvo indica o quão perto a orientação translacional e rotacional está do alvo e deve ser usada para ajustar o movimento. O indicador de profundidade mostra a profundidade do ponto focal e deve ser usado para abaixar o transdutor até a altura apropriada. Clique aqui para ver uma versão maior desta figura.
Resultados
A Figura 7 ilustra amostras comparativas de sessões de um de nossos estudos42, apresentando dois participantes distintos empregando parâmetros específicos de ultrassom (frequência fundamental de 250 kHz, duração da sonicação de 120 s, frequência de repetição de pulso (PRF) de 100 Hz, ciclo de trabalho de 10% eSPPA I de 5 W/cm²). Nesta pesquisa, exames de ressonância magnética T1-, T2-w e ZTE com resolução isotrópica de 1 mm foram obtidos de...
Discussão
Neste método, simulações específicas do assunto são realizadas para prever e avaliar possíveis efeitos térmicos e mecânicos resultantes da aplicação de UST no cérebro. Os conjuntos de dados entre os participantes devem permanecer separados e cuidadosamente documentados, pois o uso de uma varredura ou arquivo de dados incorreto levará a simulações imprecisas. Quando várias digitalizações de participantes são coletadas e o planejamento é realizado em conjunto, é importante garantir a rotulagem adequada ...
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
Este trabalho foi apoiado em parte por um Conselho de Pesquisa em Ciências Naturais e Engenharia do Canadá Discovery Grant, o programa INNOVAIT, o Cumming Medical Research Fund, a Fundação Canadense para Inovação (Projeto 36703), o Hotchkiss Brain Institute CAPRI Grant e o Parkinson Association of Alberta Funding. A GBP reconhece o apoio dos Institutos Canadenses de Pesquisa em Saúde (FDN-143290) e do Programa de Cátedra Inova do Campus Alberta.
Materiais
| Name | Company | Catalog Number | Comments |
| 128-channel amplifier unit | Image Guided Therapy | This unit drives the H-317 transducer | |
| 24-channel head coil | General Electric | ||
| 3D printer | Raise3D | Pro2 | Filament thickness of 1.75mm. |
| 3T MRI scanner | General Electric | Discovery 750 HD | MR Console version DV26.0_R05_2008 |
| BabelBrain | Samuel Pichardo (University of Calgary) | Version 0.3.0 | Accessible at https://github.com/ProteusMRIgHIFU/BabelBrain. Executes thermal and acoustic simulations. |
| Blender | Blender Foundation | Version 3.4.1 | Accessible at https://www.blender.org. Blender is called automatically by BabelBrain. |
| Brainsight | Rogue Research | Version 2.5.2 | Used for target identification, trajectory planning, and execution of TUS delivery sessions. |
| Chair and chin/head holder | Rogue Research | To be used during TUS delivery session to ensure stability of participant’s head for optimized targeting. | |
| Custom-made coupling cone | University of Calgary team | 3D printed cone in acrylonitrile butadiene styrene (ABS), only required for H-317 transducer. | |
| dcm2niix | Chris Rorden (University of South Carolina) | Version 1.0.20220720 | Accessible at https://github.com/rordenlab/dcm2niix/releases. Used for pre-processing subject MR images. |
| Fiducials and headband or glasses | Brainsight, Rogue Research | ST-1325 (subject tracker), LCT-583 (large coil tracker) | Headband or glasses can be interchangeably used. |
| Headphones | Beats | Fit Pro True Wireless Earbuds | Wireless Bluetooth earbuds with disposable tips. |
| MacBookPro | Apple | M2 Max, 16”, 64GB RAM | Computer for completing trajectory planning and simulations |
| SimNIBS | Axel Thielscher (Technical University of Denmark) | Version 4.0.0 | Accessible at https://simnibs.github.io/simnibs/build/html.index.html |
| Syringe(s) | 10 mL, 60 mL | Used to add additional ultrasound gel to fill air pockets. | |
| Transducer | Sonicconcepts | H-317 | Other supported transducers include CTX_500 (NeuroFUS, Sonicconcepts), Single element, H-246 (Sonicconcepts), and Bsonix (Brainsonix) |
| Transducer film | Sonicconcepts | Polyurethane membrane | Interface between transducer and the subject |
| Ultrasound gel | Wavelength | Clear Ultrasound Gel | Coupling medium. |
| Windows Laptop | Acer | Aspire A717-71G, Intel Core i7-7700HQ, 16 GB RAM | System used to control 128-channel amplifier and generate sound through the headphones |
Referências
- Baek, H., Pahk, K. J., Kim, H. A review of low-intensity focused ultrasound for neuromodulation. Biomed Eng Lett. 7 (2), 135-142 (2017).
- Rezayat, E., Toostani, I. G. A review on brain stimulation using low intensity focused ultrasound. Basic Clin Neurosci. 7 (3), 187-194 (2016).
- Dell'Italia, J., Sanguinetti, J. L., Monti, M. M., Bystritsky, A., Reggente, N. Current state of potential mechanisms supporting low intensity focused ultrasound for neuromodulation. Front Hum Neurosci. 16, 872639 (2022).
- Kim, H., et al. Suppression of EEG visual-evoked potentials in rats through neuromodulatory focused ultrasound. Neuroreport. 26 (4), 211-215 (2015).
- Yoon, K., et al. Effects of sonication parameters on transcranial focused ultrasound brain stimulation in an ovine model. PLoS One. 14 (10), e0224311 (2019).
- Dallapiazza, R. F., et al. Non-invasive neuromodulation and thalamic mapping with low-intensity focused ultrasound. J Neurosurg. 128 (3), 875-884 (2018).
- Folloni, D., et al. Manipulation of subcortical and deep cortical activity in the primate brain using transcranial focused ultrasound stimulation. Neuron. 101 (6), 1109-1116 (2019).
- Gulick, D. W., Li, T., Kleim, J. A., Towe, B. C. Comparison of electrical and ultrasound neurostimulation in rat motor cortex. Ultrasound Med Biol. 43 (12), 2824-2833 (2017).
- King, R. L., Brown, J. R., Newsome, W. T., Pauly, K. B. Effective parameters for ultrasound-induced in vivo neurostimulation. Ultrasound Med Biol. 39 (2), 312-331 (2013).
- Yoo, S. S., et al. Focused ultrasound modulates region-specific brain activity. Neuroimage. 56 (3), 1267-1275 (2011).
- Kim, H. C., et al. Transcranial focused ultrasound modulates cortical and thalamic motor activity in awake sheep. Sci Rep. 11 (1), 19274 (2021).
- Deffieux, T., et al. Low-intensity focused ultrasound modulates monkey visuomotor behavior. Curr Biol. 23 (23), 2430-2433 (2013).
- Munoz, F., et al. Long term study of motivational and cognitive effects of low-intensity focused ultrasound neuromodulation in the dorsal striatum of nonhuman primates. Brain Stimul. 15 (2), 360-372 (2022).
- Verhagen, L., et al. Offline impact of transcranial focused ultrasound on cortical activation in primates. ELife. 8, e40541 (2019).
- Fomenko, A., et al. Systematic examination of low-intensity ultrasound parameters on human motor cortex excitability and behavior. ELife. 9, e54497 (2020).
- Legon, W., Bansal, P., Tyshynsky, R., Ai, L., Mueller, J. K. Transcranial focused ultrasound neuromodulation of the human primary motor cortex. Sci Rep. 8 (1), 10007 (2018).
- Legon, W., et al. Transcranial focused ultrasound modulates the activity of primary somatosensory cortex in humans. Nat Neurosci. 17 (2), 322-329 (2014).
- Legon, W., Ai, L., Bansal, P., Mueller, J. K. Neuromodulation with single-element transcranial focused ultrasound in human thalamus. Hum Brain Mapp. 39 (5), 1995-2006 (2018).
- Legon, W., et al. A retrospective qualitative report of symptoms and safety from transcranial focused ultrasound for neuromodulation in humans. Sci Rep. 10, 5573 (2020).
- Forster, A., et al. Investigating the role of the right inferior frontal gyrus in control perception: A double-blind cross-over study using ultrasonic neuromodulation. Neuropsychologia. 187, 108589 (2023).
- Forster, A., et al. Transcranial focused ultrasound modulates the emergence of learned helplessness via midline theta modification. J Affect Disord. 329, 273-284 (2023).
- Ziebell, P., et al. Inhibition of midfrontal theta with transcranial ultrasound explains greater approach versus withdrawal behavior in humans. Brain Stimul. 16 (5), 1278-1288 (2023).
- Kim, H. C., Lee, W., Weisholtz, D. S., Yoo, S. S. Transcranial focused ultrasound stimulation of cortical and thalamic somatosensory areas in human. PLoS One. 18 (7), e0288654 (2023).
- Kim, Y. G., et al. Neuromodulation using transcranial focused ultrasound on the bilateral medial prefrontal cortex. J Clin Med. 11 (13), 3809 (2022).
- Chu, Y. C., Lim, J., Chien, A., Chen, C. C., Wang, J. L. Activation of mechanosensitive ion channels by ultrasound. Ultrasound Med Biol. 48 (10), 1981-1994 (2022).
- Kubanek, J., et al. Ultrasound modulates ion channel currents. Sci Rep. 6 (1), 24170 (2016).
- Prieto, M. L., Firouzi, K., Khuri-Yakub, B. T., Maduke, M. Activation of Piezo1 but not NaV1.2 channels by ultrasound at 43 MHz. Ultrasound Med Biol. 44 (6), 1217-1232 (2018).
- Quarato, C. M. I., et al. A review on biological effects of ultrasounds: Key messages for clinicians. Diagnostics. 13 (5), 855 (2023).
- Nowicki, A. Safety of ultrasonic examinations; thermal and mechanical indices. Med Ultrason. 22 (2), 203 (2020).
- Miller, D. L., et al. Overview of therapeutic ultrasound applications and safety considerations. J Ultrasound Med. 31 (4), 623-634 (2012).
- Aubry, J. F., et al. ITRUSST consensus on biophysical safety for transcranial ultrasonic stimulation. arXiv preprint arXiv. , 2311.05359 (2023).
- Guo, H., et al. Ultrasound produces extensive brain activation via a cochlear pathway. Neuron. 98 (5), 1020-1030 (2018).
- Sato, T., Shapiro, M. G., Tsao, D. Y. Ultrasonic neuromodulation causes widespread cortical activation via an indirect auditory mechanism. Neuron. 98 (5), 1031-1041 (2018).
- Braun, V., Blackmore, J., Cleveland, R. O., Butler, C. R. Transcranial ultrasound stimulation in humans is associated with an auditory confound that can be effectively masked. Brain Stimul. 13 (6), 1527-1534 (2020).
- Martin, E., et al. ITRUSST consensus on standardised reporting for transcranial ultrasound stimulation. Brain Stimul. , S1935861X24000718 (2024).
- Pichardo, S. BabelBrain: An open-source application for prospective modeling of transcranial focused ultrasound for neuromodulation applications. IEEE Trans Ultrason Ferroelectr Freq Control. 70 (7), 587-599 (2023).
- Khoshnevisan, A., Allahabadi, N. S. Neuronavigation: Principles, clinical applications and potential pitfalls. Iran J Psychiatry. 7 (2), 97-103 (2012).
- Xu, L., et al. Characterization of the targeting accuracy of a neuronavigation-guided transcranial fus system in vitro, in vivo, and in silico. IEEE Trans Biomed Eng. 70 (5), 1528-1538 (2023).
- Kuehn, B., et al. Sensor-based neuronavigation: Evaluation of a large continuous patient population. Clin Neurol Neurosurg. 110 (10), 1012-1019 (2008).
- Ambrosini, E., et al. StimTrack: An open-source software for manual transcranial magnetic stimulation coil positioning. J Neurosci Methods. 293, 97-104 (2018).
- Kop, B. R., et al. Auditory confounds can drive online effects of transcranial ultrasonic stimulation in humans. eLife. , (2024).
- Zadeh, A. K., et al. The effect of transcranial ultrasound pulse repetition frequency on sustained inhibition in the human primary motor cortex: A double-blind, sham-controlled study. Brain Stimul. 17 (2), 476-484 (2024).
- Mohammadjavadi, M., et al. Elimination of peripheral auditory pathway activation does not affect motor responses from ultrasound neuromodulation. Brain Stimul. 12 (4), 901-910 (2019).
- Johnstone, A., et al. A range of pulses commonly used for human transcranial ultrasound stimulation are clearly audible. Brain Stimul. 14 (5), 1353-1355 (2021).
- Zeng, K., et al. Induction of human motor cortex plasticity by theta burst transcranial ultrasound stimulation. Ann Neurol. 91 (2), 238-252 (2022).
- Lee, W., et al. Image-guided transcranial focused ultrasound stimulates human primary somatosensory cortex. Sci Rep. 5, 8743 (2015).
- Ridding, M. C., Rothwell, J. C. Is there a future for therapeutic use of transcranial magnetic stimulation. Nat Rev Neurosci. 8 (7), 559-567 (2007).
- Nicolo, P., Ptak, R., Guggisberg, A. G. Variability of behavioural responses to transcranial magnetic stimulation: Origins and predictors. Neuropsychologia. 74, 137-144 (2015).
- Horvath, J. C., Carter, O., Forte, J. D. No significant effect of transcranial direct current stimulation (tDCS) found on simple motor reaction time comparing 15 different simulation protocols. Neuropsychologia. 91, 544-552 (2016).
- Horvath, J. C., Vogrin, S. J., Carter, O., Cook, M. J., Forte, J. D. Effects of a common transcranial direct current stimulation (tDCS) protocol on motor evoked potentials found to be highly variable within individuals over 9 testing sessions. Exp Brain Res. 234 (9), 2629-2642 (2016).
- Angla, C., Larrat, B., Gennisson, J., Chatillon, S. Transcranial ultrasound simulations: A review. Med Phys. 50 (2), 1051-1072 (2023).
- Miller, G. W., Eames, M., Snell, J., Aubry, J. Ultrashort echo-time MRI versus CT for skull aberration correction in MR-guided transcranial focused ultrasound: In vitro comparison on human calvaria. Med Phys. 42 (5), 2223-2233 (2015).
- Miscouridou, M., Pineda-Pardo, J. A., Stagg, C. J., Treeby, B. E., Stanziola, A. Classical and learned MR to pseudo-CT mappings for accurate transcranial ultrasound simulation. IEEE Trans Ultrason Ferroelectr Freq Control. 69 (10), 2896-2905 (2022).
- Pichardo, S., et al. A viscoelastic model for the prediction of transcranial ultrasound propagation: application for the estimation of shear acoustic properties in the human skull. Phys Med Biol. 62 (17), 6938-6962 (2017).
- Pichardo, S. . ProteusMRIgHIFU/BABELVISCOFDTD: Software Library for FDTD of viscoelastic equation using a staggered grid arrangement with support for GPU and CPU backends. , (2024).
- Aubry, J. F., et al. Benchmark problems for transcranial ultrasound simulation: Intercomparison of compressional wave models. J Acoust Soc Am. 152 (2), 1003-1019 (2022).
- Pinton, G., et al. Attenuation, scattering, and absorption of ultrasound in the skull bone: Absorption of ultrasound in the skull bone. Med Phys. 39 (1), 299-307 (2011).
- Chaplin, V., et al. On the accuracy of optically tracked transducers for image-guided transcranial ultrasound. Int J Comput Assist Radiol Surg. 14 (8), 1317-1327 (2019).
- Wu, S. Y., et al. Efficient blood-brain barrier opening in primates with neuronavigation-guided ultrasound and real-time acoustic mapping. Sci Rep. 8 (1), 7978 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados