このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
経頭蓋超音波ニューロモデュレーション実験のヒトにおける計画と実行のためのパイプライン
要約
経頭蓋超音波刺激法(TUS)は、音響シミュレーションと熱シミュレーションの慎重な計画を必要とする新しい非侵襲的神経調節技術です。この方法論は、ヒトTUS実験のための効率的でユーザーフレンドリーで合理化された計画のための画像処理および超音波シミュレーションパイプラインを説明しています。
要約
経頭蓋超音波刺激法(TUS)は、皮質構造と皮質下構造の両方を高精度で操作できる新しい非侵襲的神経調節技術です。人間が関与する実験を行うには、音響シミュレーションと熱シミュレーションを慎重に計画する必要があります。この計画は、超音波ビームの形状と軌道に対する骨の干渉を調整し、TUSパラメータが安全要件を満たしていることを確認するために不可欠です。T1 および T2 強調は、1 mm 等方性分解能のゼロタイムエコー (ZTE) 磁気共鳴画像法 (MRI) スキャンとともに取得されます (または、コンピューター断層撮影 X 線 (CT) スキャン) 頭蓋骨の再建とシミュレーションのために。ターゲットと軌道のマッピングは、ニューロナビゲーションプラットフォームを使用して実行されます。SimNIBSは、頭蓋骨、皮膚、および脳組織の初期セグメンテーションに使用されます。TUSのシミュレーションはBabelBrainツールで引き継がれ、ZTEスキャンを使用して頭蓋骨の合成CT画像を生成し、音響特性に変換します。電動ステアリング機能を備えたフェーズドアレイ超音波トランスデューサを使用しています。Zステアリングは、目標の深さに達するように調整されます。その他のトランスデューサ構成も計画ツールでサポートされています。熱シミュレーションは、温度と機械的指数の要件が、FDAが推奨するヒト被験者のTUSの音響ガイドライン内にあることを確認するために実行されます。TUSの送達セッション中、機械式アームは、フレームレス定位ローカリゼーションシステムを使用して、トランスデューサーを必要な位置まで移動させます。
概要
一般的に使用される非侵襲的神経刺激技術には、経頭蓋直流刺激(tDCS)と経頭蓋磁気刺激(TMS)が含まれます。ただし、どちらも貫通深さが限られており、精度は1,2が低いです。対照的に、経頭蓋超音波(TUS)は、ニューロン活動を増強または抑制し、ミリメートル精度で皮質または皮質下構造を標的とすることができる新しい非侵襲的技術です3,4,5。げっ歯類4,8,9、ウサギ10、ヒツジ5,11、ブタ6、および非ヒト霊長類7,12,13,14を用いた動物モデルにより、TUSの有効性と安全性が示されている。研究によると、ラットではさまざまな脳領域を標的とすると、ラットでは四肢の動き8、ブタでは体性感覚誘発電位(SSEP)6、ヒト以外の霊長類では視覚運動活動12、認知的および動機付けの意思決定13の変化が引き起こされることが実証されています。ヒトでは、TUSは、一次運動野15,16を標的とすると反応時間課題の運動誘発電位(MEPs)とパフォーマンスを変化させ、体性感覚皮質17と感覚視床18を標的とすると、触覚識別タスクとSSEPSのパフォーマンスを変化させることが観察されている。組織学的解析では、ブタ6、ヒツジ5,11、ウサギ10、および非ヒト霊長類14において、TUSに関連する肉眼的または微視的な構造変化は明らかにされておらず、他の非侵襲的神経刺激技術19と有意に異なる副作用は見られなかった。
TUSは、200 kHz〜700 kHzの周波数でパルス低強度集束超音波を使用して、一時的な神経調節効果を生み出します。典型的な空間ピークパルス平均強度(Isppa)は、その場で10 W / cm2以下であり、報告されているデューティサイクル(超音波がオンの時間の割合)は、ヒトで0.5%から70%の範囲です20,21,22,23,24。TUSニューロモデュレーションのメカニズムは、主にイオンチャネル25,26,27の開口につながる脂質膜の機械的攪拌を含むと提案されているが、可能な熱およびキャビテーションの影響を無視することはできない。これらは、機械的(MI)および熱(TI)インデックスによって評価されます。MIは、TUSで発生する予測されるキャビテーション関連の生体影響を説明し、一方、TIは、超音波適用後の組織内の潜在的な温度上昇を記述します28,29。さらに、周波数と入力強度を変更すると、MIとTIも変化します。周波数が高いほど、空間分解能が高くなり、機械的な生体効果の可能性が低くなります。しかし、それらは組織内でより強く吸収され、それが温度上昇の可能性を高める28。あるいは、同じ強度で周波数が低いほど、MIが増加します。同様に、強度を増大させると、機械的および熱的生体効果30の大きさが増加する傾向がある。したがって、実装されるすべてのTUSパラメータについて、実験セッションの前に慎重な計画とシミュレーションを実行することが不可欠です。
TUSの実験を計画するには、対象のターゲットと軌道の特定、および熱シミュレーションと音響シミュレーションの性能が必要です。シミュレーションは、機械的影響を最適化し、TUSの組織に対する熱影響を軽減するのに役立ちます。彼らは、頭蓋骨の加熱、焦点での超音波の圧力振幅、焦点補正、および頭蓋骨と皮膚内の他の加熱の予測を理解する必要があります。適切なシミュレーションにより、焦点が関心の対象に到達することが保証され、FDAおよびカナダ保健省の推奨事項に基づく国際経頭蓋超音波刺激安全性基準コンソーシアム(ITRUSST)31によって推奨されている生物物理学的安全性に関する安全ガイドラインによって設定された超音波使用の安全性パラメータが守られます。最近の研究では、動物やヒトにおけるTUS 32,33,34を伴う聴覚交絡効果も強調されており、TUS刺激は脳内の聴覚経路を活性化して反応を誘発することができる32,33,34。動物におけるこれらの影響を減少させるために、齧歯類における聴覚神経32の切断、蝸牛液32の除去、または化学的難聴33が用いられてきた。ヒトでは、ヘッドフォンを介して聴覚トーンを投与することで、TUSからの聴覚ノイズを効果的にマスクし、TUSによって引き起こされる聴覚活動の交絡を制御しています34。このことは、偽刺激条件での聴覚ノイズを制御する必要性を浮き彫りにしており、これをプロトコルの計画、設計、および実装に組み込む必要があります。
ここでは、ヒトでTUS神経調節実験を行うために必要な準備(ステップ1、ステップ2)、計画(ステップ3)、シミュレーション(ステップ4)、TUS送達(ステップ5)を適切に完了するためのガイドを提供します。
プロトコル
ヒトを対象とするすべての方法は、Tri-Council Ethical Conduct for Research Involving Humansに準拠して実施され、プロトコルはカルガリー大学のConjoint Health Research Ethics Board(CHREB)によって承認されました。すべての被験者は、参加前に書面によるインフォームドコンセントを提供しました。人間の参加者は、18歳から40歳までの健康な右利きの成人であり、磁気共鳴画像法(MRI)スキャンを完了する意思と能力がある必要がありました。除外基準には、発作、気分障害、または心血管障害の家族歴、耳の外傷、アルコールまたは薬物依存、処方薬の使用、ペースメーカーを含む金属インプラント、妊娠、心血管障害、神経障害または精神障害の病歴、研究者および研究スタッフとのコミュニケーション不能、および法的無能力または限られた法的能力が含まれていました。以下に説明するプロトコルは、TUS研究の標準化された報告に関するITRUSSTの推奨事項に従っています35。この調査で使用した機器、ソフトウェア、および必要な Web リンクの詳細は、 資料の表に記載されています。
1. 高分解能磁気共鳴画像法
- 24チャンネルのヘッド/ネックコイルを使用して参加者をイメージします。
注:あるいは、その部位で利用可能な最高の頭頸部コイルは、解剖学的MRIを取得するのに十分です。 - T1 および T2 強調 MR 画像、および 1 mm の解像度でゼロタイムエコー (ZTE) シーケンスを収集します。
注: MR 画像は、画像の再構築に影響を与え、その後の計画と実装手順を困難にする可能性があるため、参加者がオーバーイヤー ヘッドフォンを着用せずに収集することをお勧めします。代わりに、参加者はMRの安全のために耳栓のみを着用することをお勧めします。- T1 強調イメージングでは、3D 反転回復準備済み高速スポイルドグラジエントエコー (FSPGR) シーケンスを使用し、繰り返し時間 (TR) = 8.4 ms、エコー時間 (TE) = 3.2 ms、反転時間 (TI) = 650 ms、フリップ角度 10 度、視野角 256 mm x 256 mm x 188 mm、マトリックスサイズ 256 x 256 x 188、 位相符号化方向のGRAPPA(ARC)係数は2で、AC-PCとの近似アライメントのための矢状斜め方向。
注:合計スキャン時間は5分21秒です。 - T2強調イメージングでは、TR = 3000 ms、TE = 60-90 ms、エコー列長130、視野角256 mm x 225 mm x 188 mm、マトリックスサイズ256 x 256 x 188、AC-PC軸とのアライメントを近似する矢状斜め配向の3D高速スピンエコー(FSE)を使用します。GRAPPA(ARC)係数2は、位相符号化とスライス方向に利用されました。
注:合計スキャン時間は3分58秒です。 - ZTE画像の場合、TR = 698 ms、TE = 16 μs、フリップ角度1度、レシーバー帯域幅62.5 kHz、平均数= 3.5、視野角256 mm x 256 mm、マトリックスサイズ256 x 256 x 256 x256の設定で等方性3D ZTEスキャンを使用します。
注:合計スキャン時間は5分23秒です。
注:TUSの計画を開始する前に、MR画像を完成させる必要があります。
- T1 強調イメージングでは、3D 反転回復準備済み高速スポイルドグラジエントエコー (FSPGR) シーケンスを使用し、繰り返し時間 (TR) = 8.4 ms、エコー時間 (TE) = 3.2 ms、反転時間 (TI) = 650 ms、フリップ角度 10 度、視野角 256 mm x 256 mm x 188 mm、マトリックスサイズ 256 x 256 x 188、 位相符号化方向のGRAPPA(ARC)係数は2で、AC-PCとの近似アライメントのための矢状斜め方向。
2. 参加者画像の前処理
- dcm2niixツールを使用して、T1-w、T2-w、およびZTE DICOMスキャンファイルをDICOMからNifti形式に変換します。ターミナルウィンドウで、 dcm2niix を実行します。
注: dcm2niix ツールは GitHub で入手できます ( 資料の表を参照)。BabelBrain ツールは、参加者の画像を共同登録して、別々の日に収集された画像に対応します。T1-w 画像が等方性でない場合、1 mm の等方性ボクセルにリサンプリングされます。ただし、CT/ZTE画像はそうではありません。代わりに、シミュレーションのマスクは、PPW での最終解像度にリサンプリングされます。追加の共同登録や調整手順は必要ありません。 - 共レジストレーションと組織マスク抽出をSimNIBSのチャームツールで実行します。ターミナルウィンドウで、 charm を実行します。ここで、 は識別用の文字列です。この時点で、実験計画を一時停止し、別の時間に続行できます。
注:作成されたファイルはm2mサブディレクトリに保存され、後続の計画段階で使用されます。チャームツールによる画像の前処理は、組織セグメンテーションの目的で必要であり、これはBabelBrainツール36で使用するために必要である。
3. 軌道計画
- Brainsightを開き、[ New Empty Project]をクリックして、ステップ2.1で作成した参加者のT1-w Nifti画像をロードします。
注:v2.5.3より前のBrainsightバージョンを使用している場合は、「新しい空のプロジェクト」または「新しいSimNIBSプロジェクト」のいずれかを選択できます。Brainsight v2.5.3以降を使用している場合、BrainsightとBabelBrainの間には統合があり、「新しいSimNIBSプロジェクト」をクリックすることを強くお勧めします。ただし、計画手順を完了するには、どちらも十分です。「New Empty Project」では T1-w イメージをロードする必要がありますが、「New SimNIBS Project」では T1-w イメージを直接ロードする .msh ファイルをロードする必要があります。他のすべての機能と手順は同じままです。 - [Overlays] をクリックし、[Configure Overlays] をクリックして、オーバーレイを作成および表示します。[追加]をクリックして、オーバーレイするファイルを選択します。
注: ターゲットを T1-w 画像で視覚化できない場合は、まず、共登録された T2-w 画像にターゲットをローカライズする必要があります (したがって、T1-w 座標と T2-w 座標は同じになります)。次に、座標を T1-w 画像に転送して、後続の計画手順に使用します。手順 2.2 のチャーム ツールは、m2m /T2_reg.nii.gz ファイル パスに共登録された T2-w イメージを生成します。 - オーバーレイセクションを閉じ、[ ターゲット ]タブをクリックしてから、[ ターゲットの設定]をクリックします。 青い情報 ボタンをクリックして、オーバーレイの不透明度、色、しきい値を変更し、画像の比較を可能にします。
注:これは、共に登録されたNifti画像を視覚化するために実行でき、音響シミュレーションがターゲットとどのように重なるかを観察するために使用する必要があります。 - 「 Reconstructions 」タブをクリックし、「 New Reconstruction... 」ドロップダウンメニューをクリックします。 [スキン] をクリックし、新しいウィンドウで [ スキンの計算 ] をクリックします。完了したら、ウィンドウの左上隅にある 閉じる ボタンをクリックします。
- 「Reconstructions」タブで、「 New Reconstruction... 」ドロップダウンメニューをクリックし、「 Full Brain Curvilinear」をクリックします。
- 矢状(図1A)、冠状(図1B)、横方向(図1C)の各ボックスを、緑色のボックスの端をドラッグして調整し、線が脳(図1)をしっかりと囲むようにします。
- すべてのスライスをスクロールして、組織の端が重なっていないことを確認します。 Compute Curvilinear をクリックし、剥離深さを4 mmに調整します(図1D)。
注:完全な脳の曲線は、皮質の3D再構成を提供し、皮質を剥がしてさまざまな深さを観察することができます。これにより、TMSコイルを脳上に正確かつ一貫して配置し、関心領域をローカライズすることができます。
- Brainsightの[ ランドマーク ]タブをクリックし、次に[ ランドマークの設定]をクリックします。
- 十字線(カーソル)を鼻の先端に置き、[Name:]フィールドにランドマーク「Nose」のラベルを付けます(図2A)。鼻梁の上の目の間に十字線を配置し、ランドマークに「Nasion」のラベルを付けます(図2A)。
- 十字線を左耳に置き、ランドマークに「L耳」のラベルを付けます(図2B)。十字線を右耳に置き、ランドマークに「R Ear」というラベルを付けます(図2C)。
- [ターゲット] タブをクリックし、十字線 (カーソル) を使用して目的のターゲットをローカライズします。
- 目的のターゲットの位置に十字線(カーソル)を置き、画面の右側にある角度トグルを使用して軌道角度を設定します。
- 目的のターゲットと軌道を選択したら、[ 新規 ] ドロップダウン メニューをクリックし、[ 軌道] を選択します。「Name:」の横のテキストボックスに入力して、ターゲットに名前を付けます。
- 「エクスポート...」をクリックしてターゲットをエクスポートし、適切な件名フォルダに保存します。ファイルを保存すると、計画を一時停止し、後で実験を再開できます。
注:ターゲットは、熱シミュレーションと音響シミュレーションを完了するための後続の手順で使用されます。
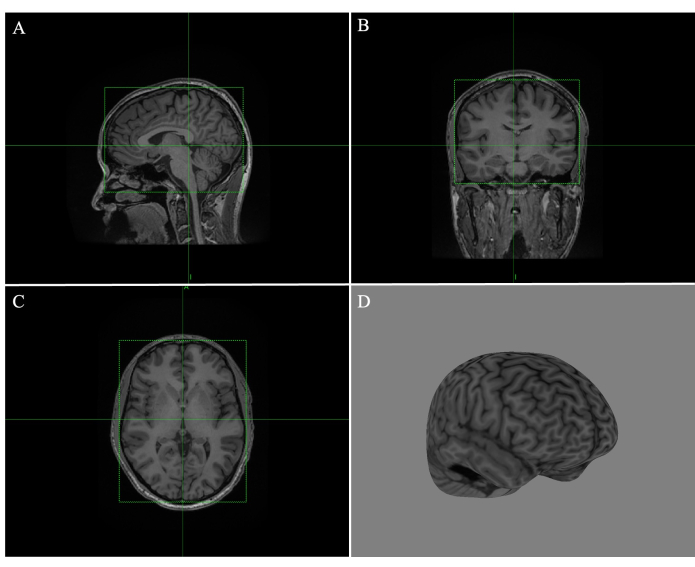
図1:Brainsightで全脳曲線を作成 (A)矢状MR画像の端に合わせて調整されたボックス。(B)冠状MR画像のエッジに合わせて調整されたボックス。(C)横方向MR画像のエッジに調整されたボックス。(D) 剥離深さ4mmの全脳曲線再構成 この 図の拡大版を見るには、ここをクリックしてください。
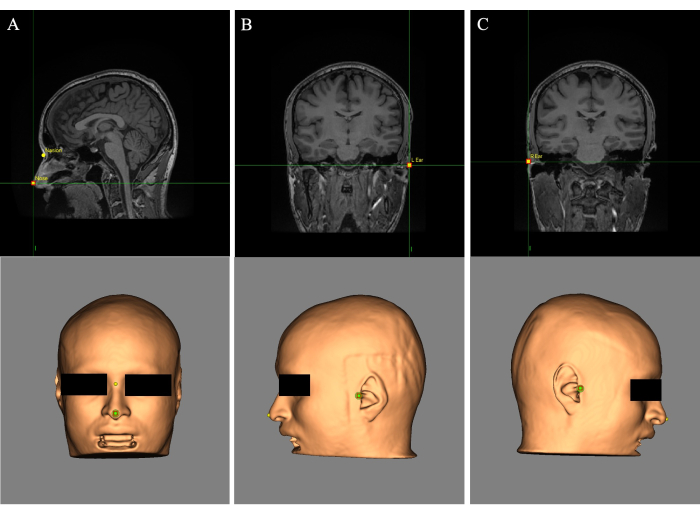
図2:皮膚再建とMR画像に配置されたランドマーク。 (A)ノーズとナシオンのランドマークの配置。(B)左耳のランドマークの配置。(C)右耳のランドマークの配置。 この図の拡大版を表示するには、ここをクリックしてください。
4. BabelBrainによるシミュレーション
注:BabelBrainを使用したシミュレーションの詳細については、BabelBrainのマニュアル https://proteusmrighifu.github.io/BabelBrain/index.html を参照してください。
- BabelBrain を開き、音響シミュレーションと熱シミュレーションに必要なファイルを選択します。
注:この提出物はフェーズドアレイ探触子を使用しています。ただし、他のトランスデューサは、この計画ソフトウェアと完全に互換性があります。このプログラムは、シングル、CTX_500、H-317、H-246、およびトランスデューサのシミュレーションを完了することができます。次の方法では、H-317を選択したトランスデューサーとして使用します。- ステップ3.7.3でBrainsightからエクスポートしたtxtファイルを選択するには、[ Select Trajectory... ]をクリックし、適切な参加者ファイルを選択します。 Select SimNIBS... をクリックして、ステップ2で作成したSimNIBSファイル(m2m_folder名)を選択します。 [Select T1W... ] をクリックし、ステップ 2.1 でターゲットと軌道のマッピングに使用した T1-w イメージを選択します。
- 「CTを使用しますか?」ラベルの横にあるドロップダウン内で、CTスキャンを使用する場合は 実際のCT を選択し、ZTEスキャンを使用する場合は ZTE を選択し、T1-およびT2-w画像のみが使用可能な場合はチャームツールによって生成された簡略化マスクを使用する場合は NO を選択します。CTまたはZTE画像を使用する場合は、[ Correg.? ]ドロップダウンメニューをクリックしてから [CTからMR]をクリックします。 [選択 ]をクリックし、適切な参加者ファイルから対応する画像を選択します。
- 「Select Thermal Profile ...」をクリックし、実験の超音波処理パラメータをオン、オフ、およびデューティサイクルの点で記述する熱プロファイルファイルを選択します。
注:詳細については、BabelBrainのマニュアルを参照してください:https://proteusmrighifu.github.io/BabelBrain/index.html。プロファイルの例は、https://github.com/ProteusMRIgHIFU/BabelBrain/tree/main/Profiles で入手できます。 - 「トランスデューサ」の横にあるドロップダウンメニューをクリックし、実験に使用するトランスデューサを選択します。「Computing backend」の横にあるドロップダウンメニューをクリックし、シミュレーションを実行しているコンピューターの計算バックエンドを選択します。すべての情報を入力したら、[ 続行 ]をクリックして残りのシミュレーションを完了します。
- サブステップ A: マスクを計算します。
- 探触子の超音波周波数と、波長あたりの適切なポイント(PPW)を選択します。
注: ほとんどのシナリオでは、6 PPW で十分です。 - 正規化された ZTE 範囲とハウンズフィールド単位 (HU) はそのままにしておきます。
注:実際のCTを使用している場合は、HUしきい値のみが表示されます。ZTEまたはCTスキャンが提供されていない場合、このエントリはありません。 - 「計画マスクの計算」をクリックします。画像を検査し、皮膚、頭蓋骨、脳の境界が正確に認識されたことを確認します。
注: 不一致がある場合は、正規化された ZTE 範囲や HU しきい値を調整します。
- 探触子の超音波周波数と、波長あたりの適切なポイント(PPW)を選択します。
- サブステップ B: 音響シミュレーション。 [ステップ 2 - AC Sim ] タブをクリックして開きます。
注意: このタブは、選択したトランスデューサーによって見え方が異なります。以下は、H-317トランスデューサーに固有のものです。- 適切な距離を入力して、円錐から焦点までの距離を調整し、円錐の表面からターゲットまでの距離を反映します。
注:これは、実験で使用する物理コーンによって決まります。 - [ フィールドの計算 ] ボタンをクリックしてシミュレーションを実行します。
- Zステアリング(mm)の値を調整して、十字線(ターゲットを示す)が焦点の中心にくるようにします(図3)。 上矢印または下矢印 を押すか、必要な値を手動で入力してから、[ フィールドの計算]をクリックします。
注:正の値は焦点を脳のより深くに向けますが、負の値は焦点を表面的に動かします。 - 焦点が目的のターゲットに対して横方向にある場合は、X / Yメカニカルを調整します。Zメカニカルはそのままにしておきます。 [フィールドの計算]をクリックします。
注:Zメカニカルは、4.3.1の円錐からの距離の関数として再計算されます。計算の完了後に、Zステアリング、X/Yメカニカル、またはターゲットを超える最大深度を調整する必要がある場合は、音響シミュレーションファイルを再計算する必要があります。 「フィールドの計算 」をクリックし、「 はい 」を選択して再計算します。[ いいえ ] を選択して、既存のファイルを再読み込みします。
- 適切な距離を入力して、円錐から焦点までの距離を調整し、円錐の表面からターゲットまでの距離を反映します。
- サブステップC:熱シミュレーション。「Step 3 - Thermal Sim」タブをクリックし、「Calculate Thermal Fields」をクリックします。ITRUSST31 (軟部組織の機械的指数 (MI) ≤1.9; 熱上昇 ≤2 °C、熱線量 ≤0.25 CEM43、曝露時間を 1.5 < 頭蓋熱指数 (TIC) ≤ 2.0 で 80 分に制限、2.0 < TIC ≤2.5 で 40 分に制限された人体の音響ガイドラインを満たすために、機械的および熱シミュレーション (図 4) を評価します。 2.5 < TIC ≤ 3.0 の場合は 10 分、3.0 < TIC ≤ 4.0 の場合は 160 秒、4.0 < TIC ≤ 5.0 の場合は 40 秒、5.0 < TIC ≤ 6.0) の場合は 10 秒です。
注:BabelBrainは、生体熱伝達方程式を解いて温度36の上昇を推定します。まれに、異常な高温ボクセルが発生することがありますが、その場合は、解剖学的特徴が異常な温度上昇を説明できる場合は、MR画像を分析する必要があります。- Isppa(W / cm2)ボックスの横にある上矢印または下矢印をクリックするか、0.1を超える値を手動で入力して、パラメータがさまざまな強度でどのように変化するかを観察して、Isppaを調整します。
注意: すべての強度、温度変化、および機械的インデックスの概要は、参照用にCSVファイルとしてエクスポートできます。このソフトウェアは、その場で目的の強度を達成するために適用する必要がある水条件での必要な強度を計算します(水中のIsppa)。 - インターフェースの下部にある [MTB]、[MTS] 、および [MTC ] ボタンをクリックすると、脳、皮膚、頭蓋骨の温度が最も高いスライスが表示されます。熱シミュレーションのステップが終了すると、シミュレーションは完了です。
注:ファイルはT1-wイメージと同じ場所に自動的に保存されます。
注:エンディング<のある音響ファイル...FullElasticSolution_Sub_NORM.nii.gz>をBrainsightにロードして、T1空間の音場オーバーレイを視覚化できます。水のみの条件のファイル(ファイル名に「水」の接尾辞が含まれる)と組織が存在する条件のファイル(ファイル名に接尾辞がない)があります。手順 3.1 に続く注の手順に従って、オーバーレイを追加します。熱シミュレーションのステップの後、シミュレーションは完了し、TUSの配信セッションまで実験を一時停止できます。
- Isppa(W / cm2)ボックスの横にある上矢印または下矢印をクリックするか、0.1を超える値を手動で入力して、パラメータがさまざまな強度でどのように変化するかを観察して、Isppaを調整します。
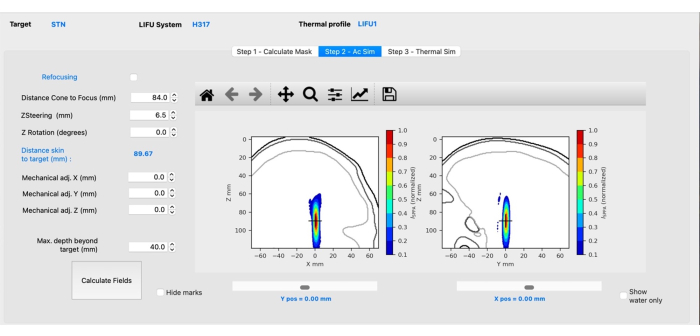
図3:BabelBrainを使用した音響シミュレーション。 この図の拡大版を表示するには、ここをクリックしてください。
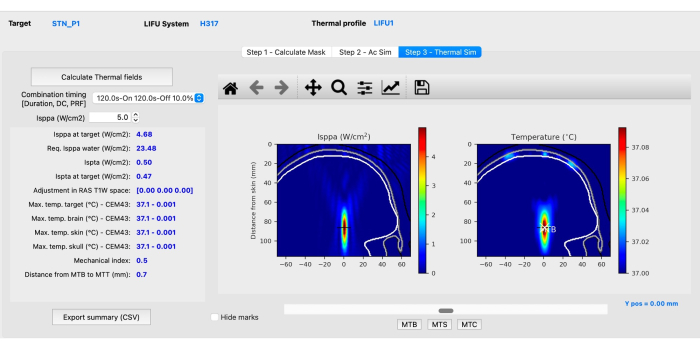
図4:BabelBrainを使用した熱シミュレーション。この図の拡大版を表示するには、ここをクリックしてください。
5. TUSデリバリーセッション
- Brainsightを開き、[ 既存のプロジェクトを開く]をクリックします。軌道とターゲットのマッピング中に作成および保存したBrainsightファイルを選択します。
- 「セッション」をクリックして、新しい実験セッションを開始します。ドロップダウンをクリックして [新規] を選択し、次に [オンライン セッション] を選択します。ターゲット名をクリックし、次に [追加] をクリックし、次にクリックしてターゲットを実験セッションに追加し、実験ウィンドウに進みます。
注:TUS配信が計画に使用されたものとは異なるコンピューターを使用して実行される場合、Brainsightでは適切なT1-wイメージを選択する必要があります。この場合、新しいウィンドウが開き、参加者ファイルから関連する T1-w参加者イメージ を選択するように求められます。 - [ウィンドウ]と[ツールキャリブレーション]をクリックし、使用するツールを選択してから、[再キャリブレーション]を選択します。
注意: この手順は、探触子と、実験セッション中に使用される他のすべてのツール(TMSコイルなど)で完了する必要があります。- 大型コイルトラッカーとキャリブレーションブロックをトランスデューサに固定します。カメラが両方のツールの指標を確認できることを確認します。 「Begin Calibration Countdown 」をクリックして、再キャリブレーションします。
注:キャリブレーションを保存すると、その実験日でも同じままであることが保証されます。これを行わず、コンピューターの電源がオフになった場合、機器は再キャリブレーションが必要になります。
- 大型コイルトラッカーとキャリブレーションブロックをトランスデューサに固定します。カメラが両方のツールの指標を確認できることを確認します。 「Begin Calibration Countdown 」をクリックして、再キャリブレーションします。
- 実験のためのセットアップ手順に従ってトランスデューサをセットアップします。トランスデューサーが損傷しないように、セットアップする前にトランスデューサーのトラッカーを取り外してください。
注:説明されているセットアップは、カスタマイズされたカップリングコーンを備えたH-317トランスデューサ用です。- 必要に応じてコーンを組み立て、トランスデューサーフィルムをコーンとエンドキャップの間に置きます。カップリングコーンをトランスデューサのフランジにネジ、ワッシャー、ナットで取り付け、漏れがないようにすべてがしっかりと締まっていることを確認します。
- トランスデューサーに脱イオン水を入れ、ポンプからのチューブをトランスデューサーに取り付け、「IN」から「OUT」に、「OUT」から「IN」にラベル付けされたチューブを接続します。ポンプの「DRAIN」を押しながら水穴を塞ぐと、圧力が解放されます。
- トランスデューサーを逆さまにしてフィルム上の気泡を分離し、上向きに回転させて、「OUT」とラベル付けされたトランスデューサーチューブから出られるようにします。目に見えるすべての気泡が除去されるまで、これを繰り返します。トランスデューサーの「OUT」チューブが前方に角度を付けて最高点になるようにセットアップし、ポンプを30分間作動させたままにします。
- トランスデューサーを逆さまにして、すべての気泡が除去されたことを確認します。気泡が残っている場合は、フィルム上の気泡を分離し、以前と同じようにトランスデューサーを回転させて、「OUT」チューブから出るようにします。すべての気泡が取り除かれるまで繰り返します。
- ポンプをオフにし、ホースを取り外して、トランスデューサーをニュートラルにロックします。トラッカーをトランスデューサーに再度取り付け、参加者のセットアップを続行します。
- 眼鏡、耳と眉毛の上に配置されたヘッドバンド(図5)、または軽量の粘着トラッカーを使用して、被験者トラッカーを参加者の頭に取り付けます。フィデューシャルがカメラから見えるように向きを変え、トランスデューサーが最終位置に向かって移動したり、最終位置に到達したときにトランスデューサーにブロックされたり衝突したりしないようにします。
- カメラを参加者の正面に置き、被写体トラッカーとポインターが見えるようにします。
注:表示されていない場合、画面の左下にあるインジケーターは赤になります。これは、Brainsightの「Polaris」タブに入ることでも確認できます。
- カメラを参加者の正面に置き、被写体トラッカーとポインターが見えるようにします。
- Brainsightの[ 登録 ]タブをクリックします。ステップ3.6で設定した4つのランドマークすべてにポインタを置き、両手で固定してから、 サンプルと次のランドマークに移動をクリックします。
注:ヘッドバンドまたはメガネが参加者の頭にしっかりと固定されていること、および被写体トラッカーが動かないことが重要です。その場合は、再度登録を行ってください。レジストレーションの完了後に、トランスデューサーの動きに合わせてフィデューシャルを回転させる必要がある場合は、レジストレーションをやり直します。 - 「検証」タブをクリックして、参加者登録を検証します。ポインターを頭皮に沿ったさまざまな位置に軽く置き、すべてのポイントが3mm未満であることを確認します。
注:TMS用に作成された商用ニューロナビゲーションシステムは、ヒトでのTUS実験に利用されています。3mmの並進誤差は、ハンドヘルドトランスデューサキャリブレーション37では許容され、目標精度38,39および他のニューロナビゲーションシステム40と一致している。3mmの値は、Brainsightニューロナビゲーションソフトウェアに組み込まれています。- 3 mmを超えるポイントがある場合は、[ 追加 ]ボタンをクリックして、最大3つのポイントのランドマークポイントを追加します。3 mm 未満で一貫した検証を実現するために 3 ポイントを超える必要がある場合は、レジストレーションをやり直します。
注: 登録の成功率を向上させるために、MR 画像は、画像の再構築に影響を与え、登録を困難にする可能性があるため、参加者がオーバーイヤー ヘッドフォンを着用せずに収集することをお勧めします。 「Sample & Go To Next Landmark」をクリックする前に、ポインタがランドマークにできるだけ近づくように注意し、両手でポインタが安定していることを確認してください。この検証により、頭皮表面に沿ったすべてのポイントの平均がしきい値を下回っていることが再確認されます。頭皮のすべてのランダムな位置が3mmのしきい値を下回るまで続行しないでください。
- 3 mmを超えるポイントがある場合は、[ 追加 ]ボタンをクリックして、最大3つのポイントのランドマークポイントを追加します。3 mm 未満で一貫した検証を実現するために 3 ポイントを超える必要がある場合は、レジストレーションをやり直します。
- チンレストとスタビライザーを後頭部に置いて参加者の頭を固定し、動きを防ぎます(図5)。実験期間中、彼らが椅子に快適に座っていることを確認してください。
- 「Perform」をクリックします。メカニカルアームを使用して、選択した軌道に沿って探触子を対象のターゲット上に配置します。
注意: メカニカルアームのコンポーネントがターゲットに到達するためにどのように動くかを練習し、よく理解してください。メカニカルアームの位置決めを成功させるには、アームの可動性を理解し、ターゲットの位置に大きく依存するため、アームが頭の向きについてどのように動くかに精通する必要があります。- ブルズアイウィンドウの十字線を使用して、正しい位置と角度を実現します(図6)。両方の円(並進円と回転円)を十字線上に配置されるように位置合わせし、検証のために精度の読み取り値を参照します。
- 被験者の髪を自然な部分に沿って分け、超音波ジェルで梳いて、髪の中にエアポケットがないことを確認します。広い領域でカップリングが必要な場合は、超音波ゲルをトランスデューサーフィルムに塗布します。シリンジを使用して、残りのエアポケットに追加の超音波ジェルを入れます。
- 探触子を適切な高さまで下げるには、照準が対象物を囲むボックスの中央にあることを確認します(図6)。これにより、適切なターゲット深度に達したことが示されます。
- カスタムメイドのPythonスクリプトは、ステップ4のシミュレーションの結果を使用して、128アンプユニットをプログラムし、ヘッドフォン(https://github.com/ProteusMRIgHIFU/TUSApp)を介してサウンドを生成します。オンラインおよび/または二重盲検実験を行う場合、マスキングオーディオがヘッドフォン34、41 を通じて再生されるか、または刺激をオンにランプし、バースト持続時間42、43、44 にわたってオフセットすることを、潜在的な聴覚交絡効果を減らす方法として確認する。
注意: このステップで、CTX-500トランスデューサーなどの市販のユニットを使用する場合は、他のパラメーター(PRF、持続時間、デューティサイクル)とともに、水条件でシミュレートされた強度を規定します。H-317 トランスデューサーは、専用のスクリプトを使用してトランスデューサーを実行します。したがって、この提出物ではそのステップは省略されています。- TUS 配信の開始時に再生するマスキング オーディオを MATLAB で生成します。偽刺激中の音は、250 kHzの連続的な正弦波、48 kHzでサンプリングされたバースト周波数100 Hzの方形波、およびランダムノイズを組み合わせて、トランスデューサから生成される音を忠実に再現します。TUS中は、トランスデューサーから発せられた音も被験者に聞こえるため、ヘッドホンからはランダムなノイズのみが再生されます。
- TUSの送達が完了したら、その後の実験手順の前に、トランスデューサー、ゲル、およびトラッカーを参加者の頭から取り外します。
- TUS機器を清掃するには、損傷を防ぐためにトラッカーをトランスデューサーから取り外します。上部のプラグを取り外し、逆さまにして水を排出することにより、トランスデューサーを分解します。カップリングコーンを取り外して分解し、ピースを風乾させます。
- トランスデューサーをニュートラルに戻し、すべてのアームコンポーネントが90°にしっかりとロックされていることを確認して、次のTUS実験セッションまで保管します。

図5:ニューロナビゲーションに使用される基準。 眼鏡(左)とヘッドバンド(右)には、被写体追跡用の基準が取り付けられています。被験者の頭部は、頭部の後ろにチンレストとスタビライザーで固定されています。 この図の拡大版を表示するには、ここをクリックしてください。
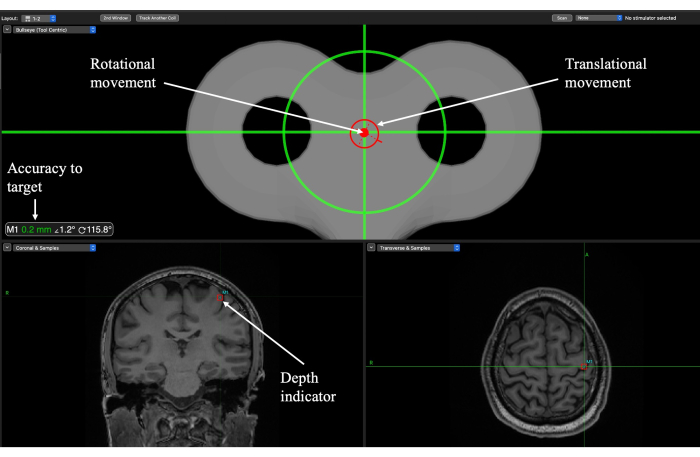
図6:一次運動皮質(M1)ターゲットのTUSデリバリーセッション中のターゲットローカリゼーションのためのBrainsightニューロナビゲーション画面。 回転インジケータと並進インジケータは、トランスデューサを頭皮のどこに配置するか、および軌道角度がいつ達成されたかについて実験者を導きます。ターゲットの精度は、並進方向と回転方向がターゲットにどれだけ近いかを示し、動きを微調整するために使用する必要があります。深度インジケータは焦点の深さを示すため、探触子を適切な高さまで下げるために使用する必要があります。 この図の拡大版を表示するには、ここをクリックしてください。
結果
図7は、特定の超音波パラメータ(基本周波数250kHz、超音波処理持続時間120秒、パルス繰り返し周波数(PRF)100Hz、デューティサイクル10%、ISPPA5W/cm²)を使用する2つの異なる参加者を特徴とする、我々の研究42の1つからの比較セッションサンプルを示しています。本研究では、神経学的に健康な被験者から、1mmの等方性分解能のT1-、T2-w、およびZTEのMR...
ディスカッション
この手法では、被験者固有のシミュレーションを行い、TUSの脳への適用から生じる可能性のある熱的および機械的影響を予測および評価します。参加者間のデータセットは、誤ったスキャンやデータファイルを使用すると不正確なシミュレーションにつながるため、別々に慎重に文書化する必要があります。多数の参加者スキャンが収集され、計画が一緒に実行される場合は、画像とフォル?...
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
この研究は、カナダ自然科学工学研究評議会ディスカバリー助成金、INNOVAITプログラム、カミング医学研究基金、カナダイノベーション財団(プロジェクト36703)、ホッチキス脳研究所CAPRI助成金、およびアルバータ州パーキンソン協会の資金提供によって部分的に支援されました。GBPは、カナダ保健研究所(FDN-143290)およびキャンパスアルバータイノベーションチェアプログラムからの支援を認めています。
資料
| Name | Company | Catalog Number | Comments |
| 128-channel amplifier unit | Image Guided Therapy | This unit drives the H-317 transducer | |
| 24-channel head coil | General Electric | ||
| 3D printer | Raise3D | Pro2 | Filament thickness of 1.75mm. |
| 3T MRI scanner | General Electric | Discovery 750 HD | MR Console version DV26.0_R05_2008 |
| BabelBrain | Samuel Pichardo (University of Calgary) | Version 0.3.0 | Accessible at https://github.com/ProteusMRIgHIFU/BabelBrain. Executes thermal and acoustic simulations. |
| Blender | Blender Foundation | Version 3.4.1 | Accessible at https://www.blender.org. Blender is called automatically by BabelBrain. |
| Brainsight | Rogue Research | Version 2.5.2 | Used for target identification, trajectory planning, and execution of TUS delivery sessions. |
| Chair and chin/head holder | Rogue Research | To be used during TUS delivery session to ensure stability of participant’s head for optimized targeting. | |
| Custom-made coupling cone | University of Calgary team | 3D printed cone in acrylonitrile butadiene styrene (ABS), only required for H-317 transducer. | |
| dcm2niix | Chris Rorden (University of South Carolina) | Version 1.0.20220720 | Accessible at https://github.com/rordenlab/dcm2niix/releases. Used for pre-processing subject MR images. |
| Fiducials and headband or glasses | Brainsight, Rogue Research | ST-1325 (subject tracker), LCT-583 (large coil tracker) | Headband or glasses can be interchangeably used. |
| Headphones | Beats | Fit Pro True Wireless Earbuds | Wireless Bluetooth earbuds with disposable tips. |
| MacBookPro | Apple | M2 Max, 16”, 64GB RAM | Computer for completing trajectory planning and simulations |
| SimNIBS | Axel Thielscher (Technical University of Denmark) | Version 4.0.0 | Accessible at https://simnibs.github.io/simnibs/build/html.index.html |
| Syringe(s) | 10 mL, 60 mL | Used to add additional ultrasound gel to fill air pockets. | |
| Transducer | Sonicconcepts | H-317 | Other supported transducers include CTX_500 (NeuroFUS, Sonicconcepts), Single element, H-246 (Sonicconcepts), and Bsonix (Brainsonix) |
| Transducer film | Sonicconcepts | Polyurethane membrane | Interface between transducer and the subject |
| Ultrasound gel | Wavelength | Clear Ultrasound Gel | Coupling medium. |
| Windows Laptop | Acer | Aspire A717-71G, Intel Core i7-7700HQ, 16 GB RAM | System used to control 128-channel amplifier and generate sound through the headphones |
参考文献
- Baek, H., Pahk, K. J., Kim, H. A review of low-intensity focused ultrasound for neuromodulation. Biomed Eng Lett. 7 (2), 135-142 (2017).
- Rezayat, E., Toostani, I. G. A review on brain stimulation using low intensity focused ultrasound. Basic Clin Neurosci. 7 (3), 187-194 (2016).
- Dell'Italia, J., Sanguinetti, J. L., Monti, M. M., Bystritsky, A., Reggente, N. Current state of potential mechanisms supporting low intensity focused ultrasound for neuromodulation. Front Hum Neurosci. 16, 872639 (2022).
- Kim, H., et al. Suppression of EEG visual-evoked potentials in rats through neuromodulatory focused ultrasound. Neuroreport. 26 (4), 211-215 (2015).
- Yoon, K., et al. Effects of sonication parameters on transcranial focused ultrasound brain stimulation in an ovine model. PLoS One. 14 (10), e0224311 (2019).
- Dallapiazza, R. F., et al. Non-invasive neuromodulation and thalamic mapping with low-intensity focused ultrasound. J Neurosurg. 128 (3), 875-884 (2018).
- Folloni, D., et al. Manipulation of subcortical and deep cortical activity in the primate brain using transcranial focused ultrasound stimulation. Neuron. 101 (6), 1109-1116 (2019).
- Gulick, D. W., Li, T., Kleim, J. A., Towe, B. C. Comparison of electrical and ultrasound neurostimulation in rat motor cortex. Ultrasound Med Biol. 43 (12), 2824-2833 (2017).
- King, R. L., Brown, J. R., Newsome, W. T., Pauly, K. B. Effective parameters for ultrasound-induced in vivo neurostimulation. Ultrasound Med Biol. 39 (2), 312-331 (2013).
- Yoo, S. S., et al. Focused ultrasound modulates region-specific brain activity. Neuroimage. 56 (3), 1267-1275 (2011).
- Kim, H. C., et al. Transcranial focused ultrasound modulates cortical and thalamic motor activity in awake sheep. Sci Rep. 11 (1), 19274 (2021).
- Deffieux, T., et al. Low-intensity focused ultrasound modulates monkey visuomotor behavior. Curr Biol. 23 (23), 2430-2433 (2013).
- Munoz, F., et al. Long term study of motivational and cognitive effects of low-intensity focused ultrasound neuromodulation in the dorsal striatum of nonhuman primates. Brain Stimul. 15 (2), 360-372 (2022).
- Verhagen, L., et al. Offline impact of transcranial focused ultrasound on cortical activation in primates. ELife. 8, e40541 (2019).
- Fomenko, A., et al. Systematic examination of low-intensity ultrasound parameters on human motor cortex excitability and behavior. ELife. 9, e54497 (2020).
- Legon, W., Bansal, P., Tyshynsky, R., Ai, L., Mueller, J. K. Transcranial focused ultrasound neuromodulation of the human primary motor cortex. Sci Rep. 8 (1), 10007 (2018).
- Legon, W., et al. Transcranial focused ultrasound modulates the activity of primary somatosensory cortex in humans. Nat Neurosci. 17 (2), 322-329 (2014).
- Legon, W., Ai, L., Bansal, P., Mueller, J. K. Neuromodulation with single-element transcranial focused ultrasound in human thalamus. Hum Brain Mapp. 39 (5), 1995-2006 (2018).
- Legon, W., et al. A retrospective qualitative report of symptoms and safety from transcranial focused ultrasound for neuromodulation in humans. Sci Rep. 10, 5573 (2020).
- Forster, A., et al. Investigating the role of the right inferior frontal gyrus in control perception: A double-blind cross-over study using ultrasonic neuromodulation. Neuropsychologia. 187, 108589 (2023).
- Forster, A., et al. Transcranial focused ultrasound modulates the emergence of learned helplessness via midline theta modification. J Affect Disord. 329, 273-284 (2023).
- Ziebell, P., et al. Inhibition of midfrontal theta with transcranial ultrasound explains greater approach versus withdrawal behavior in humans. Brain Stimul. 16 (5), 1278-1288 (2023).
- Kim, H. C., Lee, W., Weisholtz, D. S., Yoo, S. S. Transcranial focused ultrasound stimulation of cortical and thalamic somatosensory areas in human. PLoS One. 18 (7), e0288654 (2023).
- Kim, Y. G., et al. Neuromodulation using transcranial focused ultrasound on the bilateral medial prefrontal cortex. J Clin Med. 11 (13), 3809 (2022).
- Chu, Y. C., Lim, J., Chien, A., Chen, C. C., Wang, J. L. Activation of mechanosensitive ion channels by ultrasound. Ultrasound Med Biol. 48 (10), 1981-1994 (2022).
- Kubanek, J., et al. Ultrasound modulates ion channel currents. Sci Rep. 6 (1), 24170 (2016).
- Prieto, M. L., Firouzi, K., Khuri-Yakub, B. T., Maduke, M. Activation of Piezo1 but not NaV1.2 channels by ultrasound at 43 MHz. Ultrasound Med Biol. 44 (6), 1217-1232 (2018).
- Quarato, C. M. I., et al. A review on biological effects of ultrasounds: Key messages for clinicians. Diagnostics. 13 (5), 855 (2023).
- Nowicki, A. Safety of ultrasonic examinations; thermal and mechanical indices. Med Ultrason. 22 (2), 203 (2020).
- Miller, D. L., et al. Overview of therapeutic ultrasound applications and safety considerations. J Ultrasound Med. 31 (4), 623-634 (2012).
- Aubry, J. F., et al. ITRUSST consensus on biophysical safety for transcranial ultrasonic stimulation. arXiv preprint arXiv. , 2311.05359 (2023).
- Guo, H., et al. Ultrasound produces extensive brain activation via a cochlear pathway. Neuron. 98 (5), 1020-1030 (2018).
- Sato, T., Shapiro, M. G., Tsao, D. Y. Ultrasonic neuromodulation causes widespread cortical activation via an indirect auditory mechanism. Neuron. 98 (5), 1031-1041 (2018).
- Braun, V., Blackmore, J., Cleveland, R. O., Butler, C. R. Transcranial ultrasound stimulation in humans is associated with an auditory confound that can be effectively masked. Brain Stimul. 13 (6), 1527-1534 (2020).
- Martin, E., et al. ITRUSST consensus on standardised reporting for transcranial ultrasound stimulation. Brain Stimul. , S1935861X24000718 (2024).
- Pichardo, S. BabelBrain: An open-source application for prospective modeling of transcranial focused ultrasound for neuromodulation applications. IEEE Trans Ultrason Ferroelectr Freq Control. 70 (7), 587-599 (2023).
- Khoshnevisan, A., Allahabadi, N. S. Neuronavigation: Principles, clinical applications and potential pitfalls. Iran J Psychiatry. 7 (2), 97-103 (2012).
- Xu, L., et al. Characterization of the targeting accuracy of a neuronavigation-guided transcranial fus system in vitro, in vivo, and in silico. IEEE Trans Biomed Eng. 70 (5), 1528-1538 (2023).
- Kuehn, B., et al. Sensor-based neuronavigation: Evaluation of a large continuous patient population. Clin Neurol Neurosurg. 110 (10), 1012-1019 (2008).
- Ambrosini, E., et al. StimTrack: An open-source software for manual transcranial magnetic stimulation coil positioning. J Neurosci Methods. 293, 97-104 (2018).
- Kop, B. R., et al. Auditory confounds can drive online effects of transcranial ultrasonic stimulation in humans. eLife. , (2024).
- Zadeh, A. K., et al. The effect of transcranial ultrasound pulse repetition frequency on sustained inhibition in the human primary motor cortex: A double-blind, sham-controlled study. Brain Stimul. 17 (2), 476-484 (2024).
- Mohammadjavadi, M., et al. Elimination of peripheral auditory pathway activation does not affect motor responses from ultrasound neuromodulation. Brain Stimul. 12 (4), 901-910 (2019).
- Johnstone, A., et al. A range of pulses commonly used for human transcranial ultrasound stimulation are clearly audible. Brain Stimul. 14 (5), 1353-1355 (2021).
- Zeng, K., et al. Induction of human motor cortex plasticity by theta burst transcranial ultrasound stimulation. Ann Neurol. 91 (2), 238-252 (2022).
- Lee, W., et al. Image-guided transcranial focused ultrasound stimulates human primary somatosensory cortex. Sci Rep. 5, 8743 (2015).
- Ridding, M. C., Rothwell, J. C. Is there a future for therapeutic use of transcranial magnetic stimulation. Nat Rev Neurosci. 8 (7), 559-567 (2007).
- Nicolo, P., Ptak, R., Guggisberg, A. G. Variability of behavioural responses to transcranial magnetic stimulation: Origins and predictors. Neuropsychologia. 74, 137-144 (2015).
- Horvath, J. C., Carter, O., Forte, J. D. No significant effect of transcranial direct current stimulation (tDCS) found on simple motor reaction time comparing 15 different simulation protocols. Neuropsychologia. 91, 544-552 (2016).
- Horvath, J. C., Vogrin, S. J., Carter, O., Cook, M. J., Forte, J. D. Effects of a common transcranial direct current stimulation (tDCS) protocol on motor evoked potentials found to be highly variable within individuals over 9 testing sessions. Exp Brain Res. 234 (9), 2629-2642 (2016).
- Angla, C., Larrat, B., Gennisson, J., Chatillon, S. Transcranial ultrasound simulations: A review. Med Phys. 50 (2), 1051-1072 (2023).
- Miller, G. W., Eames, M., Snell, J., Aubry, J. Ultrashort echo-time MRI versus CT for skull aberration correction in MR-guided transcranial focused ultrasound: In vitro comparison on human calvaria. Med Phys. 42 (5), 2223-2233 (2015).
- Miscouridou, M., Pineda-Pardo, J. A., Stagg, C. J., Treeby, B. E., Stanziola, A. Classical and learned MR to pseudo-CT mappings for accurate transcranial ultrasound simulation. IEEE Trans Ultrason Ferroelectr Freq Control. 69 (10), 2896-2905 (2022).
- Pichardo, S., et al. A viscoelastic model for the prediction of transcranial ultrasound propagation: application for the estimation of shear acoustic properties in the human skull. Phys Med Biol. 62 (17), 6938-6962 (2017).
- Pichardo, S. . ProteusMRIgHIFU/BABELVISCOFDTD: Software Library for FDTD of viscoelastic equation using a staggered grid arrangement with support for GPU and CPU backends. , (2024).
- Aubry, J. F., et al. Benchmark problems for transcranial ultrasound simulation: Intercomparison of compressional wave models. J Acoust Soc Am. 152 (2), 1003-1019 (2022).
- Pinton, G., et al. Attenuation, scattering, and absorption of ultrasound in the skull bone: Absorption of ultrasound in the skull bone. Med Phys. 39 (1), 299-307 (2011).
- Chaplin, V., et al. On the accuracy of optically tracked transducers for image-guided transcranial ultrasound. Int J Comput Assist Radiol Surg. 14 (8), 1317-1327 (2019).
- Wu, S. Y., et al. Efficient blood-brain barrier opening in primates with neuronavigation-guided ultrasound and real-time acoustic mapping. Sci Rep. 8 (1), 7978 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved