JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
인간에 대한 경두개 초음파 신경조절 실험의 계획 및 실행을 위한 파이프라인
요약
경두개 초음파 자극(TUS)은 음향 및 열 시뮬레이션에 대한 신중한 계획이 필요한 새로운 비침습적 신경 조절 기술입니다. 이 방법론은 인간 TUS 실험을 위한 효율적이고 사용자 친화적이며 간소화된 계획을 위한 이미지 처리 및 초음파 시뮬레이션 파이프라인을 설명합니다.
초록
경두개 초음파 자극(TUS)은 대뇌 피질 및 피질 하부 구조를 매우 정밀하게 조작할 수 있는 새로운 비침습적 신경 조절 기술입니다. 인간과 관련된 실험을 수행하려면 음향 및 열 시뮬레이션을 신중하게 계획해야 합니다. 이 계획은 초음파 빔의 모양과 궤적에 대한 뼈 간섭을 조정하고 TUS 매개변수가 안전 요구 사항을 충족하는지 확인하는 데 필수적입니다. 두개골 재건 및 시뮬레이션을 위해 1mm 등방성 해상도의 제로 타임 에코(ZTE) 자기 공명 영상(MRI) 스캔과 함께 T1 및 T2 가중치를 획득합니다(또는 컴퓨터 단층 촬영 X선(CT) 스캔). 표적 및 궤적 매핑은 신경 항행 플랫폼을 사용하여 수행됩니다. SimNIBS는 두개골, 피부 및 뇌 조직의 초기 분할에 사용됩니다. TUS의 시뮬레이션은 ZTE 스캔을 사용하여 두개골의 합성 CT 이미지를 생성하여 음향 특성으로 변환하는 BabelBrain 도구로 이어집니다. 우리는 전기 조향 기능이 있는 위상 배열 초음파 변환기를 사용합니다. 목표 수심에 도달하도록 Z-스티어링이 조정됩니다. 다른 변환기 구성도 계획 도구에서 지원됩니다. 열 시뮬레이션은 온도 및 기계적 지수 요구 사항이 FDA에서 권장하는 인간 피험자의 TUS에 대한 음향 지침 내에 있는지 확인하기 위해 실행됩니다. TUS 전달 세션 동안 기계 팔은 프레임리스 정위 위치 파악 시스템을 사용하여 트랜스듀서를 필요한 위치로 이동하는 데 도움을 줍니다.
서문
일반적으로 사용되는 비침습적 신경자극 기술에는 경두개 직류 자극(tDCS) 및 경두개 자기 자극(TMS)이 포함됩니다. 그러나 둘 다 침투 깊이가 제한적이고 정밀도가 낮습니다 1,2. 대조적으로, 경두개 초음파(TUS)는 신경 활동을 강화하거나 억제할 수 있는 새로운 비침습적 기술입니다 3,4,5 밀리미터 정밀도로 피질 또는 피질하 구조를 표적으로 삼을 수 있습니다 6,7. 설치류 4,8,9, 토끼10, 양 5,11, 돼지6 및 비인간 영장류 7,12,13,14를 사용한 동물 모델은 TUS의 효능과 안전성을 보여주었습니다. 연구에 따르면 다양한 뇌 영역을 표적으로 삼으면 쥐의 경우 사지 움직임8, 돼지의 경우 체성 감각 유발 전위(SSEP), 비인간 영장류의 시운동 활동12, 인지 및 동기 부여 의사 결정의 변화13를 유발할 수 있습니다. 인간의 경우, TUS는 1차 운동 피질(15,16)을 표적으로 할 때 반응 시간 과제에 대한 운동 유발 전위(MEPs)와 성능을 변화시키고, 체성 감각 피질(17)과 감각 시상(18)을 표적으로 할 때 촉각 구별 과제 및 SSEP에 대한 성능을 변화시키는 것으로 관찰되었습니다. 조직학적 분석에서 돼지 6, 양 5,11, 토끼10 및 비인간 영장류14에서 TUS와 관련된 총체적 또는 미세한 구조적 변화가 나타나지 않았으며, 다른 비침습적 신경자극 기법19과 유의하게 다른 부작용은 나타나지 않았다.
TUS는 200kHz에서 700kHz 사이의 주파수에서 펄스 저강도 집속 초음파를 사용하여 일시적인 신경 조절 효과를 생성합니다. 일반적인 제자리 공간 피크 펄스 평균 강도(Isppa)는 10W/cm2 이하이며, 보고된 듀티 사이클(초음파가 켜져 있는 시간의 백분율)은 인간 20,21,22,23,24에서 0.5%에서 70% 사이입니다. TUS 신경 조절의 메커니즘은 주로 이온 채널25,26,27의 개방으로 이어지는 지질막의 기계적 교반을 포함하는 것으로 제안되었지만, 가능한 열 및 캐비테이션 효과는 무시할 수 없습니다. 기계적(MI) 및 열(TI) 지수를 통해 평가됩니다. MI는 TUS에서 발생할 것으로 예측된 캐비테이션 관련 생체 효과를 설명하는 반면, TI는 초음파 적용 후 조직 내의 잠재적인 온도 상승을 설명합니다28,29. 또한 주파수와 입력 강도를 변경하면 MI와 TI도 변경됩니다. 주파수가 높을수록 공간 해상도가 향상되고 기계적 생체 효과의 가능성이 줄어듭니다. 그러나, 그들은 조직에서 더 강한 흡수력을 가지고 있으며, 이는 온도 상승의 가능성을 증가시킨다28. 또는 동일한 강도에서 더 낮은 주파수는 MI를 증가시킵니다. 유사하게, 강도를 증가시키는 것은 기계적, 열적 생체 효과(30)의 크기를 증가시키는 경향이 있다. 따라서 구현될 모든 TUS 매개변수에 대한 실험 세션 전에 신중한 계획과 시뮬레이션을 수행하는 것이 중요합니다.
TUS 실험을 계획하려면 관심 대상과 궤적을 식별하고 열 및 음향 시뮬레이션을 수행해야 합니다. 시뮬레이션은 기계적 효과를 최적화하고 TUS가 조직에 미치는 열적 효과를 완화하는 데 도움이 됩니다. 이를 위해서는 두개골 가열, 초점에서 초음파의 압력 진폭, 초점 보정 및 두개골과 피부 내의 기타 가열에 대한 예측을 이해해야 합니다. 적절한 시뮬레이션을 통해 초점이 관심 대상에 도달하고 FDA 및 캐나다 보건부(Health Canada)의 권장 사항을 기반으로 하는 ITRUSST(International Transcranial Ultrasonic Stimulation Safety and Standards Consortium)31에서 권장하는 생물물리학적 안전성에 대한 안전 지침에 명시된 초음파 사용에 대한 안전 매개변수를 따릅니다. 최근 연구는 또한 동물과 인간에서 TUS 32,33,34를 동반하는 청각 교란 효과를 강조했으며, TUS 자극은 뇌의 청각 경로를 활성화하여 반응을 유도 할 수 있습니다 32,33,34. 청각 신경(transsectionary nerves)32, 달팽이관액(cochlear fluid)32의 제거, 또는 설치류에서의 화학적 난청(chemical deafness)33이 동물에서의 이러한 영향을 감소시키기 위해 사용되어 왔다. 인간의 경우, 헤드폰을 통해 청각적 톤을 관리하는 것이 TUS로부터의 청각적 소음을 효과적으로 가리기 위해 사용되어, TUS에 의해 유발된 청각 활동을 제어한다34. 이는 가짜 자극 조건에서 청각 소음을 제어해야 할 필요성을 강조하며, 이는 프로토콜 계획, 설계 및 구현에 통합되어야 합니다.
여기에서는 인간을 대상으로 TUS 신경조절 실험을 수행하기 위해 필요한 준비(1단계, 2단계), 계획(3단계), 시뮬레이션(4단계) 및 TUS 전달(5단계)을 적절하게 완료하는 방법에 대한 가이드를 제공합니다.
프로토콜
인간 피험자의 사용과 관련된 모든 방법은 인간과 관련된 연구에 대한 Tri-Council Ethical Conduct에 따라 수행되었으며, 프로토콜은 캘거리 대학의 Conjoint Health Research Ethics Board (CHREB)의 승인을 받았습니다. 모든 피험자는 참여 전에 정보에 입각한 서면 동의를 제공했습니다. 인간 참가자는 18세에서 40세 사이의 건강하고 오른손잡이 성인이어야 하며 자기 공명 영상(MRI) 스캔을 완료할 의지와 능력이 있어야 했습니다. 제외 기준에는 발작, 기분 또는 심혈관 장애의 가족력, 귀 외상, 알코올 또는 약물 의존성, 처방약 사용, 심박 조율기를 포함한 금속 임플란트, 임신, 심혈관 장애, 신경 또는 정신 장애의 병력, 연구자 및 연구 직원과의 의사 소통 불능, 법적 무능력 또는 제한된 법적 능력이 포함되었습니다. 아래에 설명된 프로토콜은 TUS 연구35의 표준화된 보고에 대한 ITRUSST의 권장 사항을 따릅니다. 이 연구에 사용된 장비, 소프트웨어 및 필요한 웹 링크에 대한 자세한 내용은 자료 표에 나열되어 있습니다.
1. 고해상도 자기 공명 영상
- 24채널 헤드/넥 코일을 사용하여 참가자를 이미지화합니다.
알림: 또는 현장에서 사용할 수 있는 최고의 머리/목 코일만으로도 해부학적 MRI를 얻을 수 있습니다. - T1 및 T2 가중 MR 이미지와 ZTE(Zero-time echo) 시퀀스를 1mm 해상도로 수집합니다.
참고: MR 이미지는 이미지 재구성에 영향을 미치고 후속 계획 및 구현 단계를 어렵게 만들 수 있으므로 참가자가 오버이어 헤드폰을 착용하지 않고 수집하는 것이 좋습니다. 대신 참가자는 MR 안전을 위해 귀마개만 착용하는 것이 좋습니다.- T1 가중 이미징의 경우 반복 시간(TR) = 8.4ms, 에코 시간(TE) = 3.2ms, 반전 시간(TI) = 650ms, 플립 각도 10도, 시야 256mm x 256mm x 188mm, 매트릭스 크기 256 x 256 x 188, 위상 인코딩 방향에서 GRAPPA(ARC) 계수 2, AC-PC와의 근사치 정렬을 위한 사지-경사 방향.
참고: 총 스캔 시간은 5분 21초입니다. - T2 가중 이미징의 경우 TR = 3000ms, TE = 60-90ms, 에코 트레인 길이 130, 시야 256mm x 225mm x 188mm, 매트릭스 크기 256 x 256 x 188, AC-PC 축과 정렬에 가까운 사선 방향과 함께 3D FSE(Fast-Spin Echo)를 사용합니다. 2의 GRAPPA (ARC) 계수는 위상 인코딩 및 슬라이스 방향에 사용되었습니다.
참고: 총 스캔 시간은 3분 58초입니다. - ZTE 이미지의 경우 TR = 698ms, TE = 16μs, 플립 각도 1도, 수신기 대역폭 62.5kHz, 평균 수 = 3.5, 시야 256mm x 256mm x 256mm, 매트릭스 크기 256 x 256 x 256 설정으로 등방성 3D ZTE 스캔을 사용합니다.
참고: 총 스캔 시간은 5분 23초입니다.
참고: TUS 계획을 시작하기 전에 MR 이미지를 완료해야 합니다.
- T1 가중 이미징의 경우 반복 시간(TR) = 8.4ms, 에코 시간(TE) = 3.2ms, 반전 시간(TI) = 650ms, 플립 각도 10도, 시야 256mm x 256mm x 188mm, 매트릭스 크기 256 x 256 x 188, 위상 인코딩 방향에서 GRAPPA(ARC) 계수 2, AC-PC와의 근사치 정렬을 위한 사지-경사 방향.
2. 참가자 이미지 전처리
- dcm2niix 도구를 사용하여 T1-w, T2-w 및 ZTE DICOM 스캔 파일을 DICOM에서 Nifti 형식으로 변환합니다. 터미널 창에서 dcm2niix 를 실행합니다.
참고: dcm2niix 도구는 GitHub에서 사용할 수 있습니다( 자료 표 참조). BabelBrain 도구는 별도의 날짜에 수집된 이미지를 수용하기 위해 참가자의 이미지를 공동 등록합니다. T1-w 이미지가 등방성이 아닌 경우 1mm 등방성 복셀로 다시 샘플링됩니다. 그러나 CT/ZTE 이미지는 그렇지 않습니다. 대신, 시뮬레이션을 위한 마스크는 PPW 측면에서 최종 해상도로 다시 샘플링됩니다. 추가적인 공동 등록 또는 조정 단계가 필요하지 않습니다. - SimNIBS의 참 도구를 사용하여 공동 정합 및 조직 마스크 추출을 실행합니다. 터미널 창에서 charm 을 실행합니다. 여기서 는 식별을 위한 문자열입니다. 이 시점에서 실험 계획을 일시 중지하고 다른 시간에 계속할 수 있습니다.
참고: 생성된 파일은 m2m 하위 디렉토리에 저장되며 이는 후속 계획 단계에서 사용됩니다. 참(charm) 도구를 사용한 이미지를 전처리하는 것은 조직 분할 목적에 필요하며, 이는 BabelBrain 도구(36)에서 사용하기 위해 필요하다.
3. 궤적 계획
- Brainsight를 열고, New Empty Project를 클릭하고, 2.1단계에서 생성된 참가자의 T1-w Nifti 이미지를 로드합니다.
참고: Brainsight v2.5.3 이전 버전을 사용하는 경우 "새 빈 프로젝트" 또는 "새 SimNIBS 프로젝트"를 선택할 수 있습니다. Brainsight v2.5.3 이상을 사용하는 경우 Brainsight와 BabelBrain 간에 통합이 있으며 "새 SimNIBS 프로젝트"를 클릭하는 것이 좋습니다. 그러나 둘 다 계획 단계를 완료하기에 충분합니다. "새 빈 프로젝트"를 사용하려면 T1-w 이미지를 로드해야 하고, "새 SimNIBS 프로젝트"를 사용하려면 T1-w 이미지를 직접 로드하는 .msh 파일을 로드해야 합니다. 다른 모든 기능과 단계는 동일하게 유지됩니다. - Overlays(오버레이)를 클릭한 다음 Configure Overlays(오버레이 구성)를 클릭하여 오버레이를 만들고 봅니다. 추가를 클릭하여 오버레이할 파일을 선택합니다.
참고: T1-w 이미지에서 대상을 시각화할 수 없는 경우 먼저 공동 등록된 T2-w 이미지에서 지역화해야 합니다(따라서 T1-w 및 T2-w 좌표가 동일함). 그런 다음 후속 계획 단계를 위해 좌표를 T1-w 이미지로 전송합니다. 2.2단계의 참 도구는 m2m/T2_reg.nii.gz 파일 경로에 공동 등록된 T2-w 이미지를 생성합니다. - overlays 섹션을 닫고, Targets 탭을 클릭한 다음 Configure Targets를 클릭합니다. 파란색 정보 버튼을 클릭하여 오버레이의 불투명도, 색상 및 임계값을 변경하여 이미지를 비교할 수 있습니다.
참고: 이 작업은 공동 등록된 Nifti 이미지를 시각화하기 위해 수행할 수 있으며 음향 시뮬레이션이 대상과 어떻게 오버레이되는지 관찰하는 데 사용해야 합니다. - Reconstructions 탭을 클릭한 다음 New Reconstruction... 드롭다운 메뉴를 클릭합니다. Skin(스킨)을 클릭한 다음 새 창에서 Compute Skin(스킨 계산)을 클릭합니다. 완료되면 창의 왼쪽 상단 모서리에 있는 닫기 버튼을 클릭합니다.
- "Reconstructions" 탭에서 New Reconstruction... 드롭다운 메뉴를 클릭한 다음 Full Brain Curvilinear를 클릭합니다.
- 녹색 상자의 가장자리를 드래그하여 시상(그림 1A), 관상(그림 1B) 및 횡(그림 1C) 이미지의 각 상자를 조정하여 선이 뇌를 단단히 둘러싸도록 합니다(그림 1).
- 모든 슬라이스를 스크롤하여 조직의 가장자리가 겹치지 않도록 합니다. Compute Curvilinear 를 클릭하고 박리 깊이를 4mm로 조정합니다(그림 1D).
참고: 전체 뇌 곡선형은 피질의 3D 재구성을 제공하며, 이를 벗겨내어 다양한 깊이를 관찰할 수 있습니다. 이를 통해 뇌 위에 TMS 코일을 정확하고 일관되게 배치하여 관심 영역의 위치를 파악할 수 있습니다.
- Brainsight에서 Landmarks 탭을 클릭한 다음 Configure Landmarks를 클릭합니다.
- 십자선(커서)을 코 끝에 놓고 "이름:" 필드에 랜드마크 "코"라는 레이블을 지정합니다(그림 2A). 콧등 위의 눈 사이의 십자선을 놓고 랜드마크에 "Nasion"이라는 레이블을 붙입니다(그림 2A).
- 왼쪽 귀에 십자선을 놓고 랜드마크에 "L Ear"라는 레이블을 지정합니다(그림 2B). 오른쪽 귀에 십자선을 놓고 랜드마크에 "R Ear"라는 레이블을 지정합니다(그림 2C).
- Targets 탭을 클릭하고 십자선(커서)을 사용하여 관심 대상을 현지화합니다.
- 원하는 대상의 위치에 십자선(커서)을 놓고 화면 오른쪽에 있는 각도 토글을 사용하여 궤적 각도를 설정합니다.
- 원하는 대상과 궤적을 선택했으면 새로 만들기 드롭다운 메뉴를 클릭하고 궤적을 선택합니다. "Name:" 옆의 텍스트 상자에 입력하여 대상의 이름을 지정합니다.
- Export(내보내기)를 클릭하여 대상을 내보내고 적절한 subject 폴더에 저장합니다. 파일이 저장되면 계획을 일시 중지할 수 있으며 나중에 실험을 다시 시작할 수 있습니다.
참고: 대상은 열 및 음향 시뮬레이션을 완료하기 위한 후속 단계에서 사용됩니다.
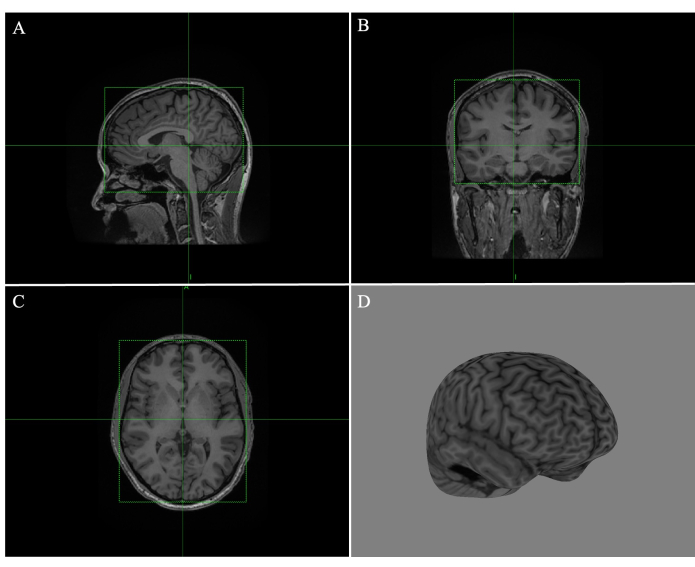
그림 1: Brainsight에서 전체 뇌 곡선 만들기. (A) 시상 MR 이미지의 가장자리에 맞게 조정된 상자. (B) 상자가 코로나 MR 이미지의 가장자리에 맞게 조정되었습니다. (C) 가로 MR 이미지의 가장자리로 조정된 상자. (D) 4mm의 박리 깊이를 가진 전체 뇌 곡선 재구성. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
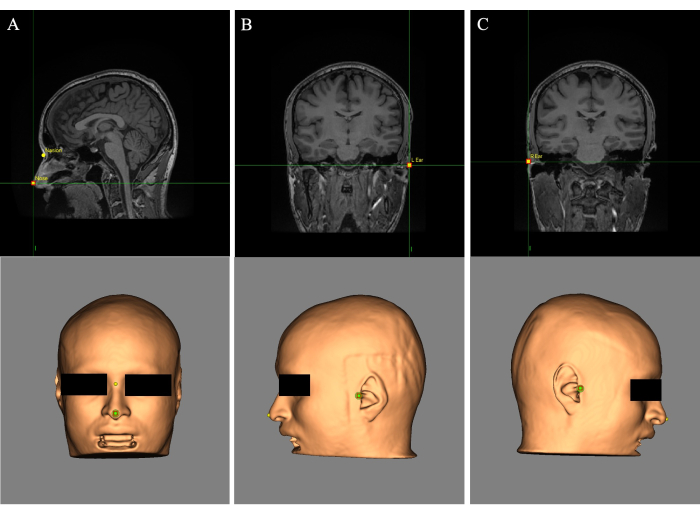
그림 2: 피부 재건 및 MR 이미지에 배치된 랜드마크. (A) 코와 콧방울 랜드마크 배치. (B) 왼쪽 귀 랜드마크 배치. (C) 오른쪽 귀 랜드마크 배치. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. BabelBrain을 사용한 시뮬레이션
참고: BabelBrain을 사용한 시뮬레이션에 대한 자세한 내용은 BabelBrain의 설명서(https://proteusmrighifu.github.io/BabelBrain/index.html)에서 확인할 수 있습니다.
- BabelBrain을 열고 음향 및 열 시뮬레이션에 필요한 파일을 선택합니다.
참고: 이 제출물은 위상 배열 변환기를 사용합니다. 그러나 다른 변환기는 이 계획 소프트웨어와 완벽하게 호환됩니다. 이 프로그램은 단일, CTX_500, H-317, H-246 및 변환기에 대한 시뮬레이션을 완료할 수 있습니다. 다음 방법에서는 H-317이 선택한 변환기로 사용됩니다.- 3.7.3단계에서 Trajectory ... 를 클릭하고 적절한 참가자 파일을 선택하여 Brainsight에서 이전에 내보낸 txt 파일을 선택합니다. SimNIBS 선택... 을 클릭하여 2단계에서 만든 SimNIBS 파일(m2m_folder 이름)을 선택합니다. T1W 선택... 을 클릭하고 이전에 타겟 및 궤적 매핑에 사용된 2.1단계에서 생성된 T1-w 이미지를 선택합니다.
- "CT를 사용하시겠습니까?" 레이블 옆의 드롭다운에서 CT 스캔을 사용하는 경우 실제 CT 를 선택하고, ZTE 스캔을 사용하는 경우 ZTE 를 선택하거나, T1 및 T2-w 이미지만 사용할 수 있는 경우 참 도구에서 생성된 단순화된 마스크를 사용하는 경우 NO 를 선택합니다. CT 또는 ZTE 이미지를 사용하는 경우 Correg.? 드롭다운 메뉴를 클릭한 다음 CT에서 MR로 클릭합니다. 선택을 클릭하고 해당 참가자 파일에서 해당 이미지를 선택합니다.
- "열 프로필 선택 ..."을 클릭하고 지속 시간 켜짐, 꺼짐 지속 시간 및 듀티 사이클 측면에서 실험의 초음파 처리 매개 변수를 설명하는 열 프로필 파일을 선택하십시오.
참고: 자세한 내용은 BabelBrain의 설명서(https://proteusmrighifu.github.io/BabelBrain/index.html)에서 확인할 수 있습니다. 프로필의 예는 https://github.com/ProteusMRIgHIFU/BabelBrain/tree/main/Profiles 에서 확인할 수 있습니다. - "Transducer" 옆의 드롭다운 메뉴를 클릭하고 실험에 사용되는 변환기를 선택합니다. "Computing backend(컴퓨팅 백엔드)" 옆의 드롭다운 메뉴를 클릭하고 시뮬레이션을 실행하는 컴퓨터의 컴퓨팅 백엔드를 선택합니다. 모든 정보를 입력했으면 CONTINUE(계속 )를 클릭하여 나머지 시뮬레이션을 완료합니다.
- 하위 단계 A: 마스크를 계산합니다.
- 변환기의 초음파 주파수와 파장당 적절한 지점(PPW)을 선택합니다.
참고: 대부분의 시나리오에서는 6PPW로 충분합니다. - 정규화된 ZTE 범위와 Hounsfield 단위(HU)는 그대로 둡니다.
알림: 실제 CT를 사용하는 경우 HU 임계값만 나타납니다. ZTE 또는 CT 스캔이 제공되지 않으면 이 항목이 없습니다. - Calculate planning mask(계획 마스크 계산)를 클릭합니다. 이미지를 검사하여 피부, 두개골 및 뇌의 경계가 정확하게 인식되었는지 확인합니다.
알림: 불일치가 있는 경우 정규화된 ZTE 범위 및/또는 HU 임계값을 조정하십시오.
- 변환기의 초음파 주파수와 파장당 적절한 지점(PPW)을 선택합니다.
- 하위 단계 B: 음향 시뮬레이션. Step 2 - Ac Sim 탭을 클릭하여 엽니다.
알림: 이 탭은 선택한 변환기에 따라 다르게 보입니다. 다음은 H-317 변환기에만 해당됩니다.- 적절한 거리를 입력하여 원뿔 표면에서 대상까지의 거리를 반영하도록 초점을 맞출 원뿔로부터의 거리를 조정합니다.
참고: 이것은 실험에 사용되는 물리적 원뿔에 의해 결정됩니다. - Calculate Fields 버튼을 클릭하여 시뮬레이션을 실행합니다.
- Z 스티어링(mm) 값을 조정하여 십자선(대상을 나타냄)이 초점의 중앙에 오도록 합니다(그림 3). 위쪽 또는 아래쪽 화살표를 누르거나 필요한 값을 수동으로 입력한 다음 필드 계산을 클릭합니다.
알림: 양수 값은 초점을 뇌 깊숙이 향하게 하는 반면 음수 값은 초점이 표면적으로 움직이게 합니다. - 초점이 의도한 대상의 측면인 경우 X/Y 기계적으로 조정합니다. Z를 기계적으로 두는 것은 그대로 둡니다. Calculate Fields(필드 계산)를 클릭합니다.
참고: Z mechanical은 4.3.1에서 원뿔로부터의 거리의 함수로 다시 계산됩니다. 계산을 완료한 후 Z 스티어링, X/Y 기계식 또는 최대 깊이를 목표 이상으로 조정해야 하는 경우 음향 시뮬레이션 파일을 다시 계산해야 합니다. Calculate Fields(필드 계산 )를 클릭하고 Yes(예 )를 선택하여 다시 계산합니다. 기존 파일을 다시 로드하려면 아니요 를 선택합니다.
- 적절한 거리를 입력하여 원뿔 표면에서 대상까지의 거리를 반영하도록 초점을 맞출 원뿔로부터의 거리를 조정합니다.
- 하위 단계 C: 열 시뮬레이션. Step 3 - Thermal Sim 탭을 클릭한 다음 Calculate Thermal Fields를 클릭합니다. 기계 및 열 시뮬레이션(그림 4)을 평가하여 ITRUSST31 (연조직 ≤1.9의 기계적 지수(MI), 열 상승 ≤2°C, 열 선량 ≤0.25 CEM43, 노출 시간이 1.5 < 두개골 열 지수(TIC) ≤ 2.0의 경우 80분, 2.0 < TIC ≤ 2.5의 경우 40분, 2.5 < TIC ≤ 3.0의 경우 10분, 3.0 < TIC ≤ 4.0의 경우 160초, 4.0 < TIC ≤ 5.0의 경우 40초, 5.0< TIC ≤ 6.0)의 경우 10초).
참고: BabelBrain은 생체 열 전달 방정식을 풀어 온도36의 상승을 추정합니다. 드문 경우지만 비정상적인 고온 복셀이 발생할 수 있으며, 이 경우 비정상적인 온도 상승을 설명할 수 있는 해부학적 특징이 있는지 MR 이미지를 분석해야 합니다.- Isppa(W/cm2) 상자 옆의 위쪽 또는 아래쪽 화살표를 클릭하거나 0.1 이상의 값을 수동으로 입력하여 매개변수가 다양한 강도에 따라 어떻게 변하는지 관찰하여 Isppa를 조정합니다.
알림: 모든 강도, 온도 변화 및 기계적 지수에 대한 요약은 참조를 위해 CSV 파일로 내보낼 수 있습니다. 이 소프트웨어는 원하는 in situ를 달성하기 위해 적용해야 하는 물 조건(물 속의 Isppa)에서 필요한 강도를 계산합니다. - 인터페이스의 아래쪽 영역에 있는 MTB, MTS 및 MTC 버튼을 클릭하여 view 뇌, 피부 및 두개골에서 온도가 가장 높은 슬라이스. 열 시뮬레이션 단계가 완료되면 시뮬레이션이 완료됩니다.
참고: 파일은 T1-w 이미지와 동일한 위치에 자동으로 저장됩니다.
참고: 어쿠스틱 file끝 <이 있는 파일... FullElasticSolution_Sub_NORM.nii.gz> Brainsight에 로드하여 T1 공간에서 음장 오버레이를 시각화할 수 있습니다. 물 전용 조건(파일 이름에 "Water" 인픽스 포함)에 대한 파일과 조직이 있는 조건(파일 이름에 인픽스 없음)에 대한 파일이 있습니다. 3.1단계 다음 참고의 단계에 따라 오버레이를 추가합니다. 열 시뮬레이션 단계가 끝나면 시뮬레이션이 완료되고 TUS 전달 세션까지 실험을 일시 중지할 수 있습니다.
- Isppa(W/cm2) 상자 옆의 위쪽 또는 아래쪽 화살표를 클릭하거나 0.1 이상의 값을 수동으로 입력하여 매개변수가 다양한 강도에 따라 어떻게 변하는지 관찰하여 Isppa를 조정합니다.
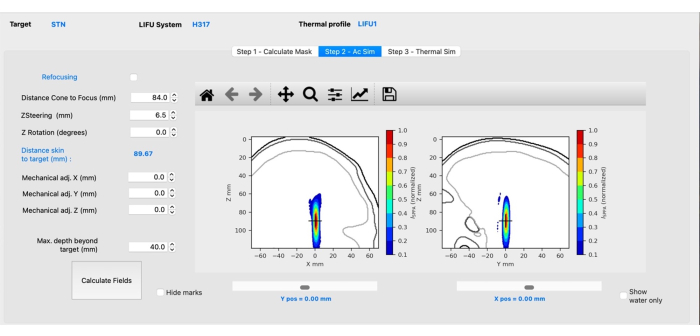
그림 3: BabelBrain을 사용한 음향 시뮬레이션. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
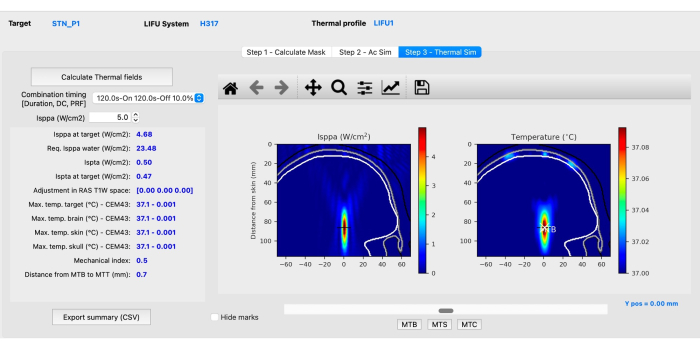
그림 4: BabelBrain을 사용한 열 시뮬레이션. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. TUS 전달 세션
- Brainsight를 열고 기존 프로젝트 열기를 클릭합니다. 궤적 및 대상 매핑 중에 생성 및 저장된 Brainsight 파일을 선택합니다.
- Sessions( 세션 )를 클릭하여 새 실험 세션을 시작합니다. 드롭다운 을 클릭하고 New(새로 만들기)를 선택한 다음 Online Session(온라인 세션)을 선택합니다. 대상 이름을 클릭한 다음 Add(추가)를 클릭하고 Next(다음 )를 클릭하여 대상을 실험 세션에 추가하고 실험 창으로 계속 진행합니다.
참고: TUS 전달이 계획에 사용된 것과 다른 컴퓨터를 사용하여 수행되는 경우 Brainsight는 적절한 T1-w 이미지를 선택해야 합니다. 이 경우 새 창이 열리고 참가자 파일에서 연결된 T1-w 참가자 이미지를 선택하라는 메시지가 표시됩니다. - Window( 창)와 Tool Calibration(도구 보정)을 클릭하고 사용할 도구를 선택한 다음 Re-Calibrate(재보정)를 선택합니다.
알림: 이 단계는 변환기 및 TMS 코일과 같은 실험 세션 중에 사용되는 기타 모든 도구에 대해 완료해야 합니다.- 대형 코일 트래커와 교정 블록을 변환기에 고정합니다. 카메라가 두 도구의 기준점을 볼 수 있는지 확인하십시오. Begin Calibration Countdown(캘리브레이션 카운트다운 시작 )을 클릭하여 다시 캘리브레이션합니다.
알림: 보정을 저장하면 실험 당일 동안 동일하게 유지됩니다. 이 작업을 수행하지 않고 컴퓨터가 꺼지면 장비를 다시 보정해야 합니다.
- 대형 코일 트래커와 교정 블록을 변환기에 고정합니다. 카메라가 두 도구의 기준점을 볼 수 있는지 확인하십시오. Begin Calibration Countdown(캘리브레이션 카운트다운 시작 )을 클릭하여 다시 캘리브레이션합니다.
- 실험을 위한 설정 절차에 따라 변환기를 설정합니다. 변환기가 손상되지 않도록 설정하기 전에 변환기의 트래커를 제거하십시오.
알림: 설명된 설정은 맞춤형 커플링 콘이 있는 H-317 변환기에 대한 것입니다.- 필요에 따라 원뿔을 조립하고 원뿔과 엔드 캡 사이에 변환기 필름을 놓습니다. 나사, 와셔 및 너트를 사용하여 커플링 콘을 변환기의 플랜지에 부착하고 누출이 없도록 모두 단단히 조입니다.
- 변환기에 탈이온수를 채우고 펌프의 튜브를 변환기에 연결하여 "IN"을 "OUT"으로, "OUT"을 "IN"으로 레이블이 지정된 튜브를 "IN"으로 연결합니다. 펌프의 "DRAIN"을 누른 상태에서 물 구멍을 막아 압력을 높이십시오.
- 변환기를 거꾸로 뒤집어 필름의 기포를 격리한 다음 위쪽으로 회전하여 "OUT"이라고 표시된 변환기 튜브를 통해 빠져나갈 수 있도록 합니다. 눈에 보이는 모든 기포가 제거될 때까지 이 작업을 반복합니다. "OUT" 튜브가 앞쪽과 가장 높은 지점에 오도록 변환기를 설정하고 펌프를 30분 동안 작동시킨 상태로 둡니다.
- 변환기를 거꾸로 뒤집어 모든 기포가 제거되었는지 확인합니다. 일부가 남아 있으면 필름의 기포를 분리하고 이전과 같이 변환기를 돌려 "OUT" 튜브를 통해 빠져나가도록 합니다. 모든 거품이 제거될 때까지 반복합니다.
- 펌프를 끄고 호스를 분리한 다음 변환기를 중립에서 잠급니다. 트래커를 변환기에 다시 부착하고 참가자 설정을 진행합니다.
- 안경, 귀와 눈썹 위에 놓인 머리띠(그림 5) 또는 경량 접착 추적기를 사용하여 참가자의 머리에 피사체 추적기를 부착합니다. 기준점이 카메라에서 볼 수 있도록 방향을 지정하고 변환기가 최종 위치로 이동하거나 최종 위치에 도달한 후 변환기에 의해 막히거나 부딪히지 않도록 합니다.
- 참가자가 피사체 추적기와 포인터를 볼 수 있도록 카메라를 참가자 앞에 놓습니다.
알림: 보이지 않으면 화면 왼쪽 하단의 표시기가 빨간색으로 표시됩니다. 이것은 Brainsight의 "Polaris" 탭에 들어가 확인할 수도 있습니다.
- 참가자가 피사체 추적기와 포인터를 볼 수 있도록 카메라를 참가자 앞에 놓습니다.
- Brainsight에서 등록 탭을 클릭합니다. 3.6단계에서 설정한 4개의 랜드마크 모두에 포인터를 놓고 양손으로 고정한 다음 Sample & Go To Next Landmark를 클릭합니다.
알림: 머리띠나 안경이 참가자의 머리에 단단히 고정되어 있고 피사체 추적기가 움직이지 않는 것이 중요합니다. 이 경우 등록을 다시 수행하십시오. 등록이 완료된 후 변환기 이동을 수용하기 위해 기준점을 회전해야 하는 경우 등록을 다시 수행하십시오. - Validation(검증) 탭을 클릭하여 참가자 등록을 확인합니다. 두피를 따라 다양한 위치에 포인터를 가볍게 놓고 모든 점이 3mm 미만이 되도록 합니다.
참고: TMS를 위해 만들어진 상용 신경 항법 시스템은 인간을 대상으로 한 TUS 실험에 활용되고 있습니다. 3mm의 병진 오차는 핸드헬드 트랜스듀서 교정(37)에 대해 허용될 수 있는데, 이는 목표 정확도(38,39) 및 다른 신경 항법 시스템(40)과 일치하기 때문이다. 3mm 값은 Brainsight 신경 항법 소프트웨어에 내장되어 있습니다.- 포인트가 3mm보다 큰 경우 추가 버튼을 클릭하여 최대 3개의 포인트까지 랜드마크 포인트를 추가합니다. 3mm 미만의 일관된 검증을 달성하기 위해 3개 이상의 포인트가 필요한 경우 정합을 다시 수행합니다.
참고: 등록 성공률을 높이려면 이미지 재구성에 영향을 미치고 등록을 어렵게 만들 수 있으므로 참가자가 오버이어 헤드폰을 착용하지 않고 MR 이미지를 수집하는 것이 좋습니다. Sample & Go To Next Landmark를 클릭하기 전에 포인터가 랜드마크에 최대한 가깝게 놓이도록 주의하고, 양손을 사용하여 포인터가 안정되어 있는지 확인하십시오. 검증은 두피 표면을 따라 있는 모든 지점의 평균이 임계값 미만임을 확신할 수 있습니다. 두피의 모든 무작위 위치가 3mm 임계값 미만이 될 때까지 진행하지 마십시오.
- 포인트가 3mm보다 큰 경우 추가 버튼을 클릭하여 최대 3개의 포인트까지 랜드마크 포인트를 추가합니다. 3mm 미만의 일관된 검증을 달성하기 위해 3개 이상의 포인트가 필요한 경우 정합을 다시 수행합니다.
- 움직임을 방지하기 위해 턱 받침대와 안정제를 머리 뒤쪽에 배치하여 참가자의 머리를 고정합니다(그림 5). 실험이 진행되는 동안 의자에 편안하게 앉을 수 있도록 합니다.
- Perform( 수행)을 클릭합니다. 기계 암을 사용하여 선택한 궤적을 따라 관심 대상 위에 변환기를 배치합니다.
알림: 기계 팔의 구성 요소가 목표에 도달하기 위해 어떻게 움직이는지 연습하고 숙지해야 합니다. 기계 팔의 위치 지정에 성공하려면 팔의 이동성을 이해하고 대상의 위치에 따라 크게 달라지기 때문에 머리 방향에 대해 어떻게 움직이는지 익숙해져야 합니다.- 과녁 모양의 창에 있는 십자선을 사용하여 올바른 위치와 각도를 얻을 수 있습니다(그림 6). 두 원(평행 이동 및 회전)을 정렬하여 십자선에 배치하고 확인을 위해 정확도 판독값을 참조합니다.
- 피험자의 머리카락을 자연스러운 부분을 따라 자르고 초음파 젤을 빗어 머리카락 안에 공기 주머니가 없는지 확인합니다. 넓은 영역에 커플링이 필요한 경우 변환기 필름에 초음파 젤을 적용합니다. 주사기를 사용하여 남아 있는 공기 주머니에 추가 초음파 젤을 채웁니다.
- 십자선이 대상을 둘러싼 상자 중앙에 있을 때를 관찰하여 변환기를 적절한 높이로 낮춥니다(그림 6). 이것은 적절한 목표 수심에 도달했을 때를 나타냅니다.
- 맞춤형 Python 스크립트는 4단계의 시뮬레이션 결과를 사용하여 128 증폭기 장치를 프로그래밍하고 헤드폰(https://github.com/ProteusMRIgHIFU/TUSApp)을 통해 사운드를 생성합니다. 온라인 및/또는 이중맹검 실험을 수행하는 경우, 잠재적인 청각적 교란 효과를 줄이기 위한 방법으로 마스킹 오디오가 헤드폰(34,41)을 통해 재생되거나, 버스트 지속시간(42,43,44)에 걸쳐 자극을 켜고 오프셋시키도록 보장한다.
참고: 이 단계에서 CTX-500 변환기와 같이 시중에서 판매되는 장치를 사용하는 경우 다른 매개변수(PRF, 지속 시간, 듀티 사이클)와 함께 물 조건에서 시뮬레이션된 강도를 규정합니다. H-317 변환기는 전용 스크립트를 사용하여 변환기를 실행합니다. 따라서 이 제출에서는 해당 단계가 생략됩니다.- MATLAB에서 마스킹 오디오를 생성하여 TUS 전달 시작 시 재생할 수 있습니다. 가짜 자극 중 소리는 250kHz의 연속 사인파, 48kHz에서 샘플링된 100Hz의 버스트 주파수에서 구형파를 변환기에서 생성된 소리를 밀접하게 복제하는 무작위 소음과 결합합니다. TUS 중에는 변환기에서 방출되는 소리도 피험자도 들을 수 있기 때문에 헤드폰을 통해 무작위 소음만 재생됩니다.
- TUS 전달이 완료된 후 후속 실험 절차 전에 참가자의 머리에서 변환기, 젤 및 추적기를 제거합니다.
- TUS 장비를 청소하려면 손상을 방지하기 위해 변환기에서 트래커를 제거하십시오. 상단의 플러그를 제거하고 거꾸로 뒤집어 물을 배출하여 변환기를 분해합니다. 커플링 콘을 제거하고 분해하여 부품이 공기 중에서 건조되도록 합니다.
- 변환기를 중립으로 되돌리고 다음 TUS 실험 세션까지 보관하기 위해 모든 암 구성 요소가 90°로 단단히 잠겨 있는지 확인합니다.

그림 5: 신경 항법에 사용되는 기준점. 안경(왼쪽)과 머리띠(오른쪽)와 피사체 추적을 위해 부착된 기준점이 있는 머리띠. 피험자의 머리는 턱 받침대와 머리 뒤에 안정 장치로 고정되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
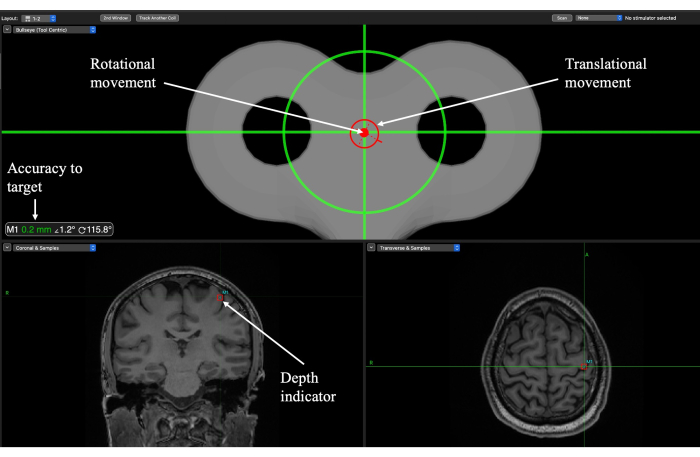
그림 6: 일차 운동 피질(M1) 표적에 대한 TUS 전달 세션 중 표적 국소화를 위한 Brainsight 신경 탐색 화면. 회전 및 병진 표시기는 실험자가 두피 위에 변환기를 배치할 위치와 궤적 각도가 달성되었을 때 안내합니다. 목표에 대한 정확도는 평행 이동 및 회전 방향이 대상에 얼마나 가까운지를 나타내며 움직임을 미세 조정하는 데 사용해야 합니다. 깊이 표시기는 초점의 깊이를 표시하며 변환기를 적절한 높이로 낮추는 데 사용해야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
그림 7은 특정 초음파 매개변수(기본 주파수 250kHz, 초음파 처리 지속 시간 120초, 펄스 반복 주파수(PRF) 100Hz, 듀티 사이클 10% 및 5W/cm²의 ISPPA)를 사용하는 두 명의 별개의 참가자를 특징으로 하는 연구중 하나의 비교 세션 샘플을 보여줍니다. 이 연구에서는 신경학적으로 건강한 피험자로부터 1mm 등방성 해상도의 T1-, T2-w 및 ZTE MRI 스캔을 얻었습니다. T...
토론
이 방법에서는 TUS를 뇌에 적용하여 발생할 수 있는 열적, 기계적 효과를 예측하고 평가하기 위해 대상별 시뮬레이션을 수행합니다. 참가자 간의 데이터 세트는 부정확한 시뮬레이션으로 이어질 수 있으므로 별도로 신중하게 문서화해야 합니다. 수많은 참가자 스캔이 수집되고 계획이 함께 수행되는 경우 이미지 및 폴더의 적절한 레이블을 확인하고 파일을 정렬 및 저장할 때 주의하여 진행하는 ?...
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
이 연구는 캐나다 자연 과학 및 공학 연구 위원회 디스커버리 그랜트, INNOVAIT 프로그램, 커밍 의학 연구 기금, 캐나다 혁신 재단(프로젝트 36703), 호치키스 뇌 연구소 CAPRI 보조금 및 앨버타 파킨슨 협회 기금의 일부 지원을 받았습니다. GBP는 Canadian Institutes for Health Research(FDN-143290) 및 Campus Alberta Innovates Chair Program의 지원을 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| 128-channel amplifier unit | Image Guided Therapy | This unit drives the H-317 transducer | |
| 24-channel head coil | General Electric | ||
| 3D printer | Raise3D | Pro2 | Filament thickness of 1.75mm. |
| 3T MRI scanner | General Electric | Discovery 750 HD | MR Console version DV26.0_R05_2008 |
| BabelBrain | Samuel Pichardo (University of Calgary) | Version 0.3.0 | Accessible at https://github.com/ProteusMRIgHIFU/BabelBrain. Executes thermal and acoustic simulations. |
| Blender | Blender Foundation | Version 3.4.1 | Accessible at https://www.blender.org. Blender is called automatically by BabelBrain. |
| Brainsight | Rogue Research | Version 2.5.2 | Used for target identification, trajectory planning, and execution of TUS delivery sessions. |
| Chair and chin/head holder | Rogue Research | To be used during TUS delivery session to ensure stability of participant’s head for optimized targeting. | |
| Custom-made coupling cone | University of Calgary team | 3D printed cone in acrylonitrile butadiene styrene (ABS), only required for H-317 transducer. | |
| dcm2niix | Chris Rorden (University of South Carolina) | Version 1.0.20220720 | Accessible at https://github.com/rordenlab/dcm2niix/releases. Used for pre-processing subject MR images. |
| Fiducials and headband or glasses | Brainsight, Rogue Research | ST-1325 (subject tracker), LCT-583 (large coil tracker) | Headband or glasses can be interchangeably used. |
| Headphones | Beats | Fit Pro True Wireless Earbuds | Wireless Bluetooth earbuds with disposable tips. |
| MacBookPro | Apple | M2 Max, 16”, 64GB RAM | Computer for completing trajectory planning and simulations |
| SimNIBS | Axel Thielscher (Technical University of Denmark) | Version 4.0.0 | Accessible at https://simnibs.github.io/simnibs/build/html.index.html |
| Syringe(s) | 10 mL, 60 mL | Used to add additional ultrasound gel to fill air pockets. | |
| Transducer | Sonicconcepts | H-317 | Other supported transducers include CTX_500 (NeuroFUS, Sonicconcepts), Single element, H-246 (Sonicconcepts), and Bsonix (Brainsonix) |
| Transducer film | Sonicconcepts | Polyurethane membrane | Interface between transducer and the subject |
| Ultrasound gel | Wavelength | Clear Ultrasound Gel | Coupling medium. |
| Windows Laptop | Acer | Aspire A717-71G, Intel Core i7-7700HQ, 16 GB RAM | System used to control 128-channel amplifier and generate sound through the headphones |
참고문헌
- Baek, H., Pahk, K. J., Kim, H. A review of low-intensity focused ultrasound for neuromodulation. Biomed Eng Lett. 7 (2), 135-142 (2017).
- Rezayat, E., Toostani, I. G. A review on brain stimulation using low intensity focused ultrasound. Basic Clin Neurosci. 7 (3), 187-194 (2016).
- Dell'Italia, J., Sanguinetti, J. L., Monti, M. M., Bystritsky, A., Reggente, N. Current state of potential mechanisms supporting low intensity focused ultrasound for neuromodulation. Front Hum Neurosci. 16, 872639 (2022).
- Kim, H., et al. Suppression of EEG visual-evoked potentials in rats through neuromodulatory focused ultrasound. Neuroreport. 26 (4), 211-215 (2015).
- Yoon, K., et al. Effects of sonication parameters on transcranial focused ultrasound brain stimulation in an ovine model. PLoS One. 14 (10), e0224311 (2019).
- Dallapiazza, R. F., et al. Non-invasive neuromodulation and thalamic mapping with low-intensity focused ultrasound. J Neurosurg. 128 (3), 875-884 (2018).
- Folloni, D., et al. Manipulation of subcortical and deep cortical activity in the primate brain using transcranial focused ultrasound stimulation. Neuron. 101 (6), 1109-1116 (2019).
- Gulick, D. W., Li, T., Kleim, J. A., Towe, B. C. Comparison of electrical and ultrasound neurostimulation in rat motor cortex. Ultrasound Med Biol. 43 (12), 2824-2833 (2017).
- King, R. L., Brown, J. R., Newsome, W. T., Pauly, K. B. Effective parameters for ultrasound-induced in vivo neurostimulation. Ultrasound Med Biol. 39 (2), 312-331 (2013).
- Yoo, S. S., et al. Focused ultrasound modulates region-specific brain activity. Neuroimage. 56 (3), 1267-1275 (2011).
- Kim, H. C., et al. Transcranial focused ultrasound modulates cortical and thalamic motor activity in awake sheep. Sci Rep. 11 (1), 19274 (2021).
- Deffieux, T., et al. Low-intensity focused ultrasound modulates monkey visuomotor behavior. Curr Biol. 23 (23), 2430-2433 (2013).
- Munoz, F., et al. Long term study of motivational and cognitive effects of low-intensity focused ultrasound neuromodulation in the dorsal striatum of nonhuman primates. Brain Stimul. 15 (2), 360-372 (2022).
- Verhagen, L., et al. Offline impact of transcranial focused ultrasound on cortical activation in primates. ELife. 8, e40541 (2019).
- Fomenko, A., et al. Systematic examination of low-intensity ultrasound parameters on human motor cortex excitability and behavior. ELife. 9, e54497 (2020).
- Legon, W., Bansal, P., Tyshynsky, R., Ai, L., Mueller, J. K. Transcranial focused ultrasound neuromodulation of the human primary motor cortex. Sci Rep. 8 (1), 10007 (2018).
- Legon, W., et al. Transcranial focused ultrasound modulates the activity of primary somatosensory cortex in humans. Nat Neurosci. 17 (2), 322-329 (2014).
- Legon, W., Ai, L., Bansal, P., Mueller, J. K. Neuromodulation with single-element transcranial focused ultrasound in human thalamus. Hum Brain Mapp. 39 (5), 1995-2006 (2018).
- Legon, W., et al. A retrospective qualitative report of symptoms and safety from transcranial focused ultrasound for neuromodulation in humans. Sci Rep. 10, 5573 (2020).
- Forster, A., et al. Investigating the role of the right inferior frontal gyrus in control perception: A double-blind cross-over study using ultrasonic neuromodulation. Neuropsychologia. 187, 108589 (2023).
- Forster, A., et al. Transcranial focused ultrasound modulates the emergence of learned helplessness via midline theta modification. J Affect Disord. 329, 273-284 (2023).
- Ziebell, P., et al. Inhibition of midfrontal theta with transcranial ultrasound explains greater approach versus withdrawal behavior in humans. Brain Stimul. 16 (5), 1278-1288 (2023).
- Kim, H. C., Lee, W., Weisholtz, D. S., Yoo, S. S. Transcranial focused ultrasound stimulation of cortical and thalamic somatosensory areas in human. PLoS One. 18 (7), e0288654 (2023).
- Kim, Y. G., et al. Neuromodulation using transcranial focused ultrasound on the bilateral medial prefrontal cortex. J Clin Med. 11 (13), 3809 (2022).
- Chu, Y. C., Lim, J., Chien, A., Chen, C. C., Wang, J. L. Activation of mechanosensitive ion channels by ultrasound. Ultrasound Med Biol. 48 (10), 1981-1994 (2022).
- Kubanek, J., et al. Ultrasound modulates ion channel currents. Sci Rep. 6 (1), 24170 (2016).
- Prieto, M. L., Firouzi, K., Khuri-Yakub, B. T., Maduke, M. Activation of Piezo1 but not NaV1.2 channels by ultrasound at 43 MHz. Ultrasound Med Biol. 44 (6), 1217-1232 (2018).
- Quarato, C. M. I., et al. A review on biological effects of ultrasounds: Key messages for clinicians. Diagnostics. 13 (5), 855 (2023).
- Nowicki, A. Safety of ultrasonic examinations; thermal and mechanical indices. Med Ultrason. 22 (2), 203 (2020).
- Miller, D. L., et al. Overview of therapeutic ultrasound applications and safety considerations. J Ultrasound Med. 31 (4), 623-634 (2012).
- Aubry, J. F., et al. ITRUSST consensus on biophysical safety for transcranial ultrasonic stimulation. arXiv preprint arXiv. , 2311.05359 (2023).
- Guo, H., et al. Ultrasound produces extensive brain activation via a cochlear pathway. Neuron. 98 (5), 1020-1030 (2018).
- Sato, T., Shapiro, M. G., Tsao, D. Y. Ultrasonic neuromodulation causes widespread cortical activation via an indirect auditory mechanism. Neuron. 98 (5), 1031-1041 (2018).
- Braun, V., Blackmore, J., Cleveland, R. O., Butler, C. R. Transcranial ultrasound stimulation in humans is associated with an auditory confound that can be effectively masked. Brain Stimul. 13 (6), 1527-1534 (2020).
- Martin, E., et al. ITRUSST consensus on standardised reporting for transcranial ultrasound stimulation. Brain Stimul. , S1935861X24000718 (2024).
- Pichardo, S. BabelBrain: An open-source application for prospective modeling of transcranial focused ultrasound for neuromodulation applications. IEEE Trans Ultrason Ferroelectr Freq Control. 70 (7), 587-599 (2023).
- Khoshnevisan, A., Allahabadi, N. S. Neuronavigation: Principles, clinical applications and potential pitfalls. Iran J Psychiatry. 7 (2), 97-103 (2012).
- Xu, L., et al. Characterization of the targeting accuracy of a neuronavigation-guided transcranial fus system in vitro, in vivo, and in silico. IEEE Trans Biomed Eng. 70 (5), 1528-1538 (2023).
- Kuehn, B., et al. Sensor-based neuronavigation: Evaluation of a large continuous patient population. Clin Neurol Neurosurg. 110 (10), 1012-1019 (2008).
- Ambrosini, E., et al. StimTrack: An open-source software for manual transcranial magnetic stimulation coil positioning. J Neurosci Methods. 293, 97-104 (2018).
- Kop, B. R., et al. Auditory confounds can drive online effects of transcranial ultrasonic stimulation in humans. eLife. , (2024).
- Zadeh, A. K., et al. The effect of transcranial ultrasound pulse repetition frequency on sustained inhibition in the human primary motor cortex: A double-blind, sham-controlled study. Brain Stimul. 17 (2), 476-484 (2024).
- Mohammadjavadi, M., et al. Elimination of peripheral auditory pathway activation does not affect motor responses from ultrasound neuromodulation. Brain Stimul. 12 (4), 901-910 (2019).
- Johnstone, A., et al. A range of pulses commonly used for human transcranial ultrasound stimulation are clearly audible. Brain Stimul. 14 (5), 1353-1355 (2021).
- Zeng, K., et al. Induction of human motor cortex plasticity by theta burst transcranial ultrasound stimulation. Ann Neurol. 91 (2), 238-252 (2022).
- Lee, W., et al. Image-guided transcranial focused ultrasound stimulates human primary somatosensory cortex. Sci Rep. 5, 8743 (2015).
- Ridding, M. C., Rothwell, J. C. Is there a future for therapeutic use of transcranial magnetic stimulation. Nat Rev Neurosci. 8 (7), 559-567 (2007).
- Nicolo, P., Ptak, R., Guggisberg, A. G. Variability of behavioural responses to transcranial magnetic stimulation: Origins and predictors. Neuropsychologia. 74, 137-144 (2015).
- Horvath, J. C., Carter, O., Forte, J. D. No significant effect of transcranial direct current stimulation (tDCS) found on simple motor reaction time comparing 15 different simulation protocols. Neuropsychologia. 91, 544-552 (2016).
- Horvath, J. C., Vogrin, S. J., Carter, O., Cook, M. J., Forte, J. D. Effects of a common transcranial direct current stimulation (tDCS) protocol on motor evoked potentials found to be highly variable within individuals over 9 testing sessions. Exp Brain Res. 234 (9), 2629-2642 (2016).
- Angla, C., Larrat, B., Gennisson, J., Chatillon, S. Transcranial ultrasound simulations: A review. Med Phys. 50 (2), 1051-1072 (2023).
- Miller, G. W., Eames, M., Snell, J., Aubry, J. Ultrashort echo-time MRI versus CT for skull aberration correction in MR-guided transcranial focused ultrasound: In vitro comparison on human calvaria. Med Phys. 42 (5), 2223-2233 (2015).
- Miscouridou, M., Pineda-Pardo, J. A., Stagg, C. J., Treeby, B. E., Stanziola, A. Classical and learned MR to pseudo-CT mappings for accurate transcranial ultrasound simulation. IEEE Trans Ultrason Ferroelectr Freq Control. 69 (10), 2896-2905 (2022).
- Pichardo, S., et al. A viscoelastic model for the prediction of transcranial ultrasound propagation: application for the estimation of shear acoustic properties in the human skull. Phys Med Biol. 62 (17), 6938-6962 (2017).
- Pichardo, S. . ProteusMRIgHIFU/BABELVISCOFDTD: Software Library for FDTD of viscoelastic equation using a staggered grid arrangement with support for GPU and CPU backends. , (2024).
- Aubry, J. F., et al. Benchmark problems for transcranial ultrasound simulation: Intercomparison of compressional wave models. J Acoust Soc Am. 152 (2), 1003-1019 (2022).
- Pinton, G., et al. Attenuation, scattering, and absorption of ultrasound in the skull bone: Absorption of ultrasound in the skull bone. Med Phys. 39 (1), 299-307 (2011).
- Chaplin, V., et al. On the accuracy of optically tracked transducers for image-guided transcranial ultrasound. Int J Comput Assist Radiol Surg. 14 (8), 1317-1327 (2019).
- Wu, S. Y., et al. Efficient blood-brain barrier opening in primates with neuronavigation-guided ultrasound and real-time acoustic mapping. Sci Rep. 8 (1), 7978 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유