Method Article
使用基于任务的功能磁共振成像探索强迫症认知再评估的神经相关性
摘要
我们介绍了一种协议,用于使用功能磁共振成像来探索认知情绪调节任务的神经相关性,即认知重新评估。该方案用于强迫症患者和健康对照,但也可用于其他临床样本。
摘要
强迫症 (OCD) 患者在面对负面情绪时表现出边缘和眶额叶区域的大脑活动增强,这可能与情绪调节技能受损有关。当面临情绪困扰的情况时,调节情绪的能力是一种必要的应对机制,并且深思熟虑的情绪调节策略(例如认知重新评估)已在普通人群中进行了广泛研究。尽管如此,人们对 OCD 患者潜在的故意情绪调节缺陷和相关神经相关性知之甚少。在这里,我们描述了一种协议,用于研究 OCD 患者与匹配的对照样本相比,使用功能磁共振成像 (fMRI) 进行故意情绪调节(认知重新评估)的神经相关性。该协议遵循当前神经影像学研究的黄金标准,包括任务激活和连接分析(以及行为数据),以允许更完整的调查。因此,我们预计它将有助于扩大对强迫症中情绪(失调)调节的神经相关性的认识,它也可以应用于探索其他精神疾病中的情绪调节缺陷。
引言
功能磁共振成像 (fMRI) 是了解精神疾病的有力工具,因为它允许研究人员以相对较高的空间分辨率观察大脑功能,从而深入了解这些疾病背后的神经机制1。通过检测血流的变化,fMRI 可以查明在特定任务期间或响应特定刺激时更活跃的大脑区域,突出与抑郁症、焦虑症、精神分裂症和双相情感障碍等疾病相关的大脑功能异常。此外,fMRI 可以揭示功能连接模式,显示大脑的不同部分如何相互通信,这对于理解精神疾病中被破坏的复杂网络至关重要2。这种非侵入性技术不仅有助于识别精神症状的神经相关性,还有助于探索可能是症状特征和治疗效果背后的心理过程3。
情绪调节就是这样一个过程,它涉及通过各种调节过程启动新的情绪反应或改变正在进行的情绪反应。情绪调节策略有几种类型,包括注意力部署(分散注意力)、认知重新评估(重新解释刺激的含义和个人联系)和抑制情绪体验或表达 4,5。关于重新评估,以前的 fMRI 研究发现它与背侧前扣带皮层 (ACC)、背内侧和外侧额叶皮层以及颞叶和顶叶区域的激活有关 6,7。这些额叶和扣带回脑区域是额顶叶认知控制网络的一部分,它在努力调节中发挥作用。在重新评估的背景下,这个网络有助于在认知上将刺激的消极情感意义重新构建为更中性的术语8。反过来,这个网络控制自下而上的腹侧和边缘区域,例如杏仁核,参与自动评估情绪刺激9。先前使用动态因果模型分析的研究已经使用 fMRI 检查了在情绪调节任务期间这些背侧和腹侧区域之间的关系。他们发现,虽然额下回 (IFG) 与背外侧前额叶皮层 (PFC) 密切相关,但腹内侧 PFC 代表了前额叶区域直接影响杏仁核的主要途径10,11。
强迫症 (OCD) 是一种精神疾病,影响 1-3% 的人口,其特征是令人痛苦和反复出现的想法、冲动或图像(强迫症),然后是重复的精神或身体行为(强迫症)12。当暴露于与疾病相关的刺激时,强迫症患者会经历负面情绪,如恐惧、焦虑、厌恶或内疚13,14,同时腹侧额叶和边缘大脑区域的活动增加,如眶额叶皮层 (OFC)、喙部 ACC 和杏仁核15。此外,先前的研究表明,强迫症患者在情绪调节方面存在困难,尤其是在采用认知重新评估策略时16。因此,据推测,强迫症中发现的增强情绪反应与这些情绪调节障碍有关 17,18,19。事实上,认知行为疗法(OCD20 的一线治疗)包括培训患者情绪调节策略,以帮助他们在认知上重新评估消极的、触发症状的情况是否具有威胁性。
在神经生物学上,腹侧和背侧网络之间功能失调的相互作用被认为与各种精神疾病的情绪处理和调节改变有关 21,22,23。在 OCD 中,功能和结构神经影像学研究都揭示了与这些网络相关的大脑区域损伤 24,25,26,一些功能缺陷在症状改善后恢复正常27,28。该证据支持这样一种观点,即在 OCD 中发现的情绪调节困难可能与背侧脑区的控制功能受损和/或腹侧系统的过度激活有关。因此,通过认知重新评估训练恢复这些网络之间的平衡可能会改善患者的症状29。尽管有这些证据,但很少有以前的文献通过使用 fMRI 来探索强迫症中认知情绪调节的神经相关性。因此,所有对该主题感兴趣的研究团队都可以使用的标准化协议的定义将允许该研究领域的知识以一致和稳健的方式取得进展。
研究方案
目前的研究是根据赫尔辛基宣言进行的,并得到了布拉加医院和米尼奥大学(葡萄牙布拉加)机构伦理委员会的批准。这项工作涉及的所有程序均符合相关机构和国家人体实验委员会的道德标准,以及 2008 年修订的 1975 年赫尔辛基宣言。
1. 参与者
注意:成年(≥18 岁)强迫症患者是在定期会诊期间从布拉加医院(葡萄牙布拉加)精神病学科招募的。
- 在定期会诊期间招募患有强迫症的成年患者(≥18 岁),由经验丰富的精神科医生根据标准标准对他们进行诊断(见 材料表)。进行迷你国际神经精神病学访谈30 以评估其他潜在的精神病理学状况。
- 对于 OCD 患者,设定排除标准以包括当前存在其他精神病诊断(轴 I 或轴 II 障碍)或当前或过去的主要神经系统或医疗状况。
注意:精神药理学药物的使用不是排除标准;大多数患者 (80.64%) 在招募时正在服药,治疗在整个研究过程中保持一致。 - 通过机构的邮件列表和社交网络以及研究人员的社区联系方式进行便利抽样,从相同的社会人口学背景中招募健康对照 (HC)。
- 如果他们当前或过去有任何神经、精神或重大疾病,或者如果他们现在或过去接受过精神药物治疗,则排除 HC。
- 考虑进行 MRI 的禁忌症(金属植入物或幽闭恐惧症)作为所有参与者的一般排除标准。
- 在患者精神病学咨询期间或通过电话采访确认 HC 的纳入/排除标准。如果参与者符合纳入标准并同意参与,请安排参与研究的日期。
- 研究当天,在开始研究程序之前,向参与者出示并解释书面知情同意书,并在继续之前获得他们的书面知情同意书。
2. 实验方案
注意:进行心理评估,然后进行 MRI 采集,整个实验方案总共持续不超过 1.5 小时(图 1)。
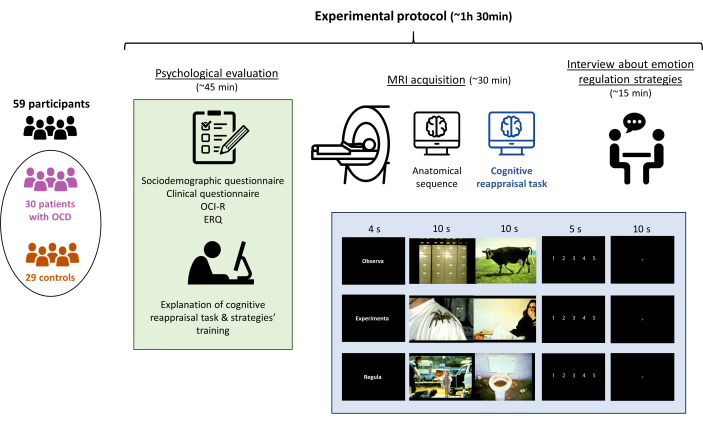
图 1:研究的实验方案。 参与者 (30 名强迫症患者和 29 名匹配的对照组) 接受了心理评估,然后是认知重新评估任务的解释、MRI 采集(包括任务的执行),最后是访谈以确认任务被充分执行。整个实验步骤持续了大约 90 分钟。 请点击这里查看此图的较大版本。
- 心理测评 (~45 min)
- 按以下顺序完成以下心理测量量表,在相应人群中验证,以及社会人口学和临床问卷:
- 社会人口学问卷:收集有关性别/性别、出生年份、受教育年限、居住地区、公民身份、家庭状况、工作状况和手部优势的信息。有关本研究中使用的问卷,请参阅 补充文件 1 ,并附有英文翻译。
- 临床问卷:收集有关物质使用(烟草、酒精或其他药物)、习惯性药物使用、当前身体或精神疾病诊断以及精神疾病史的信息。有关本研究中使用的问卷,请参阅 补充文件 2 ,并附有英文翻译。
- 响应强迫症清单 (OCI-R)。有关本研究中使用的问卷,请参阅 补充文件 3 ,并附有英文翻译。
注意:这是一个包含 18 个项目的清单,适用于 OCD 和 HC 患者,测量六组症状:洗涤、检查、订购、囤积、强迫症和中和31,32。洗涤分量表的评分是通过将第 5、11 和 17 项的分数相加获得的;用于检查第 2、8 和 14 项;用于订购第 3、9 和 15 项;用于囤积物品 1、7 和 13;用于痴迷于第 6、12 和 18 项;以及用于中和第 4、10 和 16 项。也可以通过将所有分量表的分数相加来获得总分。 - 应用情绪调节问卷 (ERQ),它评估两种情绪调节策略的习惯性使用:重新评估和抑制33,34。通过将项目 1、3、5、7、8 和 10 的分数相加来计算再评估子量表上的分数,并通过将项目 2、4、6 和 9 的分数相加来计算抑制子量表上的分数。有关本研究中使用的问卷,请参阅补充文件 4,并附有英文翻译。
- 为了衡量强迫症和强迫症状的严重程度,确保强迫症患者在招募时在精神病学咨询期间完成了耶鲁-布朗强迫症量表 (Y-BOCS)35,36。否则,请在心理测量评估期间收集此信息。有关本研究中使用的问卷,请参阅补充文件 5,并附有英文翻译。
- 完成量表后,解释要在扫描仪上进行的认知重新评估任务,并培训参与者要使用的情绪调节策略(参见第 2.3 节)。
注意:重要的是要在 MRI 采集之前尝试始终应用这些量表,以确保认知重新评估任务不会影响量表的反应。
- 按以下顺序完成以下心理测量量表,在相应人群中验证,以及社会人口学和临床问卷:
- 成像数据采集 (~30 min)
- 在配备 32 通道头线圈的 3T 扫描仪上采集成像数据(参见 材料表)。在开始 MRI 采集之前,指导参与者仰卧在扫描床上,并为头部添加额外的缓冲,以确保参与者在扫描过程中感到舒适,这将最大限度地减少运动。为参与者提供护耳装置、右手响应框(参见第 2.3 节)和左手紧急停止按钮,以防他们迫切需要停止扫描仪。
- 让所有参与者在扫描仪内执行认知重新评估任务(见下文)。在此任务中,获取对血氧相关水平 (BOLD) 对比度波动敏感的多波段回波平面成像 (EPI) 序列 (CMRREPI 2D),参数如下(7.8 分钟):重复时间 (TR) = 1,000 毫秒,回波时间 (TE) = 27 毫秒,翻转角 (FA) = 62°,2 毫米3 等距体素大小,64 个轴向切片在 200 x 200 毫米2 的矩阵上。
- 在扫描会话中包括矢状面的解剖梯度回波磁化制备的快速采集以进行配准(MPRAGE,TR = 2,420 ms,TE = 4.12 ms,FA = 9°,视野 (FOV) = 176 x 256 x 256 mm3,1 mm3 等距体素大小)。
注意:在开始数据收集之前,请确保参与者可以在屏幕投影中清楚地看到刺激物演示,并且响应按钮正在适当地收集响应。确保参与者以正确的方向看到刺激,而不是翻转或反转。
- fMRI 认知重估任务
- 在扫描之前,对参与者进行距离和重新解释策略的培训。例如,在展示带有令人不安的场景的图片时(本研究中使用的图片见 补充文件 6 ),指导他们通过以下列方式之一认知重构场景来重新评估自己的情绪:(i) 情况并不像最初看起来那么糟糕(即,以更积极的方式解释情况)(重新解释);(ii) 情况会随着时间的推移而变得更好(重新解释);(iii) 所描绘的场景不是真实的(例如,如果现场有人,认为他们是演员)(保持距离);(iv) 场景中出现的人是陌生人,因此不会影响自己(保持距离)。特别指导参与者在任务期间不要使用非认知策略(例如移开视线)。
- 在获取 fMRI 序列时使用认知重新评估任务37 。该任务由一系列块组成,包括中性或负性图片刺激,参与者被要求:
- Observe (被动观察中性刺激)。
- 保持 (积极关注负面刺激引起的情绪,随着时间的推移保持它们)。
- 调节 (使用先前训练的认知重新评估策略重新评估由负面刺激引起的情绪)。
- 使用来自国际情感图片系统 (IAPS38) 的以下 24 个刺激(照片):
- 在“观察”条件下展示八张中性图片(例如家居物品)(代码 1670、5395、5455、5660、5900、6150、7000、7496,请参阅 补充文件 7)。
- 在维护(代码 2661、3230、3300、6360、6831、9041、9560、9570,见 补充文件 8)和监管(代码 2141、3030、6838、7380、9300、9530、9561、9582,见 补充文件 9)条件中使用 16 张非常令人不快、令人兴奋的图片(例如,肢解)。
- 将任务构建为由 12 个块组成,每个条件 (Observe、Maintain 或 Regullate) 四个块。在整个任务中伪随机化指令,以避免诱发持续的情绪状态。
注意:对于本实验,条件顺序为调节、维护、观察、维护、调节、观察、维护、观察、调节、观察、维护、调节。 - 以屏幕中间显示 4 秒的指令 (Observe, Maintain or Regulate) 开始每个块。提示后,向参与者展示两种等效价的不同刺激,每个刺激 10 秒。在提出每个模块的第二个刺激后,让参与者以 1-5 的数字等级(其中 1 代表感觉“中性”,5 代表“极度消极”)对所经历的负面情绪的强度进行自我评分。为了最大限度地减少残留效应,请在每个块后在屏幕中间显示一个固定十字 10 秒。
注意:刺激是根据其情绪唤醒和效价的正常分数来选择的。应仔细考虑在维持和调节条件下平衡负片的情感内容,以避免由于这些属性的差异而产生混淆效应。 - 使用参考软件39 (参见 材料表)和与 MRI 兼容的斜镜系统来显示任务的指令和视觉刺激。
- 使用与 MRI 兼容的反应板( 材料 表)记录扫描仪内的情绪评分。
- MRI 会议结束后,对参与者进行访谈,以确保他们遵循指示并充分执行任务。询问他们使用的情绪调节策略类型(重新解释、疏远或其他),以及他们在任务期间是否改变了策略,或者是否有最适合他们的特定策略,并且在整个任务中保持不变。有关本研究中使用的问卷,请参阅 补充文件 10 ,并附有英文翻译。
- 使用 MRI 后访谈中的信息,根据所使用的情绪调节策略(距离、重新解释或两者兼而有之)将样本分为不同的亚组,并进一步分别探索每个亚组的后续分析。
3. 数据分析
- 行为分析
- 使用参考软件(参见 材料表)进行统计分析。
- 考虑 P 值< 0.05 具有统计显著性。
- 使用 Shapiro-Wilk 正态性检验检查连续变量的正态性,并根据结果使用独立样本 t 检验或 Mann-Whitney U 检验比较这些变量的组。
- 使用卡方检验来比较组之间的性别/性别分布。
- 使用卡方检验来比较各组之间的情绪调节策略分布。
- 使用 2 x 3 重复测量方差分析可分析两组之间每个条件(观察、维持和调节)扫描器内评级的潜在差异。然后,使用 事后 检验来检查每两个条件之间的差异,包括多重比较的 Holm 校正。对完整样本以及每个情绪调节子组执行此作。
- 通过从均值 Maintain 评级中减去均值 Regulating 评级(成功 = 保持 - 调节),计算参与者在减少扫描仪内负面情绪体验方面的成功率,并通过从平均值 Maintain 评级中减去平均值 Observe 评级来计算参与者在情绪处理过程中的情绪反应性(反应性 = 保持 - 观察)。然后,根据数据的正态性,使用独立样本 t 检验或 Mann-Whitney 检验比较计算变量上的组。对完整样本以及每个情绪调节子组执行此作。
注意:补充 文件 11 中提供了几个显示如何在 JASP 上执行这些分析的打印屏幕。
- 神经影像学数据的预处理
注意:使用参考软件40,41 对图像进行预处理(参见材料表)。该软件为功能和结构数据执行标准化的稳健预处理管道,并根据可用的数据和元数据调整其管道并用作输入,而无需用户定义任何参数或步骤。有关管道的更多详细信息,请参阅文档中的补充文件 11 和工作流部分。- 使用平均帧位移 (FD) > 0.5 mm 的排除标准来考虑扫描仪内的移动,查看预处理软件生成的质量检查报告中包含的平均 FD 值。
注意:本研究没有参与者超过此阈值;因此,没有参与者必须因此而被排除在外。 - 此外,目视检查输出报告以评估共同注册的准确性,并确定预处理管道期间的任何其他潜在问题。
- 使用参考软件42 中的 fslmaths 函数(参见材料表)以 8 mm 的半峰全宽 (FWHM) 内核对结果的时间序列进行空间平滑(有关本研究中使用的特定命令,请参阅补充文件 11)。
- 使用平均帧位移 (FD) > 0.5 mm 的排除标准来考虑扫描仪内的移动,查看预处理软件生成的质量检查报告中包含的平均 FD 值。
- fMRI 任务激活分析
注意:使用参考软件执行任务激活分析(参见 材料表)。- 作为初步步骤,调整预处理产生的 fMRI 时间序列数据的矩阵尺寸,以允许使用来自引用软件43 的 3dresample 函数的软件兼容(参见材料表),将“MNI152_T1_2mm_brain.nii.gz”模板作为主图像(参见补充文件 11 有关本研究中使用的特定命令)。
- 对于第一级(单主体)分析,在 SPM12 中定义以下兴趣对比:Maintain > Observe,它允许检测与经历的负面情绪相关的激活,以及 Regulating > Sustain,以识别与认知重新评估策略的实施相关的激活。
- 图像在屏幕上 20 秒的模型条件,不包括说明、评级和交叉注视期。使用规范血流动力学响应函数卷积每个体素的 BOLD 响应,并使用 128 秒高通滤波器。
- 使用平均脑脊液和白质信号作为协变量,以及在 fMRIprep 预处理期间计算的变量来校正运动。运动变量包括前六个 aCompCor 分量,以及 FD 和 DVARS(体素上均方根 VARiance 的导数)。
- 对于二级(组)分析,使用双样本 t 检验来查找相关对比中各组之间的差异。对完整样本以及每个情绪调节子组执行此作。使用聚类阈值校正在全脑水平分析数据:体素 p < 0.001 未校正,聚类 p < 0.05 家族误差 (FWE) 校正。
注意:执行此分析的过程的多个打印屏幕可在 补充文件 11 中找到。
- 心理生理相互作用分析
- 为了探索不同任务条件刺激的大脑区域之间的连接,请在参考软件中执行心理生理相互作用 (PPI) 分析。
- 要执行此分析,请根据至少两种不同的方法选择一个或多个种子区域:数据驱动的方法,选择在任务激活分析中发现的组间显着差异的区域;或理论驱动的方法,根据以前的文献选择种子。在这项研究中,根据以前关于 OCD 患者情绪处理改变的文献选择 PPI 种子。
- 例如,使用 Picó-Pérez 等人 15 荟萃分析中的以下区域,与 HC 相比,OCD 患者在情绪处理过程中被确定为过度激活:从右前岛叶延伸到杏仁核和壳核的簇,左角回,由左杏仁核和腹侧壳核组成的簇,左中央前回, 内侧前额叶皮层和左丘脑(有关更多信息,请参见 表 1 )。
- 探索兴趣对比(“心理”因素)对所选六颗种子与大脑所有其他区域(“生理”因素)之间时间过程相关性强度的影响。
- 通过全脑线性回归分析估计每个对比和每个种子的功能连接图。使用设置为 128 秒的高通滤波器来消除小于约 0.008 Hz 的低频漂移。通过估计种子时间序列与来自大脑其余部分的每个体素信号之间的回归系数,为每个主题生成对比度图像(一级分析)。
- 要评估组差异(二级分析),请将上一步生成的图像包括在每个对比的双样本 t 检验分析中。对完整样本以及每个情绪调节子组执行此作。使用与 fMRI 任务激活分析中相同的显著性阈值。此外,对这些结果的 p 值应用 Bonferroni 校正,以考虑通过探索的种子数量进行多重比较校正 (p < 0.05 / 6 = p < 0.0083)。
注意:执行此分析的过程的多个打印屏幕可在 补充文件 11 中找到。
表 1:心理生理相互作用分析中使用的种子。 缩写:Ke,体素中的集群范围;MNI,蒙特利尔神经学研究所。 请点击此处下载此表格。
结果
表 2 包括参与者的临床和社会人口学信息摘要。该研究包括 67 名成人个体 (34 名 OCD 患者和 31 名 HC)。然而,由于 MRI 伪影或任务表现不佳,有 6 名参与者 (4 名患者和 2 名对照) 被排除在外 (在最后接受采访时,两名参与者报告没有应用调节策略,他们没有注意)。最终样本包括 30 名 OCD 患者 (17 名女性;平均年龄 = 28.97,SD = 11.14 岁) 和 29 名 HC (15 名女性;平均年龄 = 29.35,SD = 12.14 岁)。两组在年龄、受教育年限、性别/性别分布以及任务期间使用的情绪调节策略方面进行了匹配。 表 2 还列出了 OCD 患者组的临床信息,包括症状严重程度、发病年龄和用药状态。
关于完整样本任务期间的评级,使用 Huynh-Feldt 检验,因为我们的 2 x 3 重复测量方差分析违反了球度的假设。条件的主要影响具有统计学意义 (F(1.783, 98.067) = 112.728, p < .001),事后测试显示 Maintain 条件与 Observe 条件显著不同(指向两组成功的负面情绪诱导;t = −14.423,pholm < .001),调节条件与维持条件不同(表明两组情绪调节也成功;t = 3.597, pholm < .001)(图 2)。然而,组的主效应没有统计学意义 (F(1, 55) = 0.155, p = .695),组和条件之间也没有显着的交互作用 (F (1.783, 98.067) = 1.877, p = .163)。然而,成功变量在组间存在显著差异 (t(55) = 2.15,p = .036),对照组显示出比 OCD 患者更好的调节。
在对距离子组进行探索时,也违反了球形度的假设,因此再次使用 Huynh-Feldt 检验作为我们的 2 x 3 重复测量方差分析。条件的主要影响具有统计学意义 (F(1.398, 27.961) = 35.704, p < 0.001), 事后 测试显示 Maintain 条件与 Observe 条件显著不同(表明负面情绪诱导成功;t = −7.666,pholm < 0.001),但 Regulate 条件与 Maintain 不再显著差异(指向未能成功调节情绪;t = 0.755,pholm < 0.455)(图 2)。组的主效应也不显著 (F(1, 20) = 0.887, p = 0.358),组与条件之间的交互作用也是如此 (F (1.398, 27.961) = 0.103, p = 0.832)。因此,成功变量在组间也没有显著差异 (t(20) = -0.132,p = 0.896)。
关于重新解释子组,由于没有违反球度的假设,因此执行了没有球形度校正的 2 x 3 重复测量方差分析。条件的主要影响也很显著 (F(1.8, 23.404) = 28.355, p < 0.001),事后测试显示 Maintain 条件与 Observe 条件显著不同(指向成功的负面情绪诱导;t = −7.48,pholm < 0.001),调节条件与维持条件不同(表明情绪调节成功;t = 2.983,pholm < 0.006)(图 2).然而,组的主效应无统计学意义 (F(1, 13) = 2.623, p = 0.129),组和条件之间也没有显着的交互作用 (F (1.8, 23.404) = 2.312, p = 0.126)。然而,组间成功变量存在显著差异 (t(13) = 2.664,p = 0.019),对照组显示出比 OCD 患者更好的调节。
最后,对于 Both 策略子组,由于没有违反球度的假设,还执行了没有球度校正的 2 x 3 重复测量方差分析。条件的主要影响具有统计学意义 (F(1.592, 22.294) = 27.772, p < 0.001), 事后 检验显示 Maintain 条件与 Observe 条件显著不同(表明负面情绪诱导成功;t = −7.114,pholm < 0.001),但 Regulate 条件与 Maintain 不再显著差异(指向未能成功调节情绪;t = 1.634,pholm < 0.114)(图 2)。组的主效应无统计学意义 (F(1, 14) = 0.245, p = 0.629),组与条件之间也没有显著交互作用 (F (1.592, 22.294) = 0.143, p = 0.867)。同样,成功变量在组间没有显著差异 (t(13) = 0.597,p = 0.56)。
总体而言,当考虑完整样本时,负面情绪诱导是成功的,并且两组的情绪调节都是有效的,尽管在考虑成功变量时,对照组似乎显示出比 OCD 患者更好的情绪调节。关于特定的情绪调节策略亚组,消极情绪诱导对他们所有亚组都是成功的,而情绪调节似乎对 Distancing 和 Both 策略亚组失败,仅在 Reinterpretation 亚组中成功。此外,只有这个亚组在成功变量中显示出显着的组差异,与 OCD 患者相比,对照组表现出更好的情绪调节(与完整样本一致)。这为在这项任务中采用重新解释策略的好处提供了证据,既可以确保总体上成功的情绪调节,也可以检测对照组和患者组之间的显着差异。不过,考虑到每个亚组的样本量减少以及在进行亚组分析时相关的统计功效损失,应谨慎对待这些发现。
关于心理测量量表,ERQ 没有显着的组间差异,但 OCI-R 分量表中 OCD 患者的得分显着高于 HC,OCI-R 囤积除外(表 2)。
最后,关于 fMRI 任务激活结果,在选定的多重比较校正阈值下,Maintain > Observe 或 Regulating > Maintain 在全脑水平上没有显着的组间差异。然而,当根据所使用的情绪调节策略探索亚组时,Reinterpretation 和 Both 策略亚组出现了显着的组间差异。具体来说,对于 Reinterpretation 亚组,对照在 Maintain > Observe 对比中表现出比 OCD 患者更高的楔前叶激活。另一方面,对于 Both 策略亚组,OCD 患者在右后岛叶和双侧中央前回的激活增加,也用于 Maintain > Observe 对比(见 表 3 和 图3)。距离亚组或 Regulate > Maintain 对比没有统计学意义的结果。
此外,关于 PPI 分析,它显示对于完整样本,与 OC>D 患者相比,对照中左角回种子和左腹外侧 PFC (vlPFC) 之间的连接显着更高,而 Regulate > Maintain (OCD 患者的连接性增加)。在探索不同的策略亚组时,发现左侧杏仁核种子与右侧颞下回 (ITG) 和左侧枕中回 (MOG) 之间的连接性增加,用于距离亚组和保持>观察对比。此外,对于两种策略亚组和调节>维持对比,同一种子与右侧背外侧 PFC (dlPFC)、右侧尾状核尾部和左侧内侧 PFC 的连接性也在患者中增加。最后,对于重新解释亚组,与对比 Regulated > Maintain 的 OCD 患者相比,对照组内侧 PFC 种子和右侧中央前回之间的连接显着更高(表 3 和 图 4)。
总之,全脑任务激活分析显示整个样本的组间差异不显著,但亚组分析突出了与所采用的情绪调节策略相关的具体差异。例如,在 Maintain > Observe 对比中,Reinterpretation 策略显示 OCD 患者的楔前叶激活减少,而 Both 策略亚组显示 OCD 患者后岛叶和中央前回等区域的激活增加。这些发现指出了强迫症中潜在的策略特异性神经改变,有趣的是,这些改变不是在调节情绪时(调节>保持对比)而是在体验情绪时(保持>观察对比)时很明显。这表明采用不同的情绪调节方法对情绪处理的一般影响。功能连接分析 (PPI) 提供了进一步的见解,揭示了 OCD 患者连接模式的改变。值得注意的是,在 OCD 患者中,左侧角回-vlPFC 网络在 Maintain > Observe 对比中显示连接性降低,而 Regulate > Maintain 对比则表现出相反的模式。亚组分析确定了与杏仁核和内侧 PFC 种子相关的连接性的额外中断,控制在关键调节网络中表现出更强的连接性,尤其是在参与重新解释策略时。
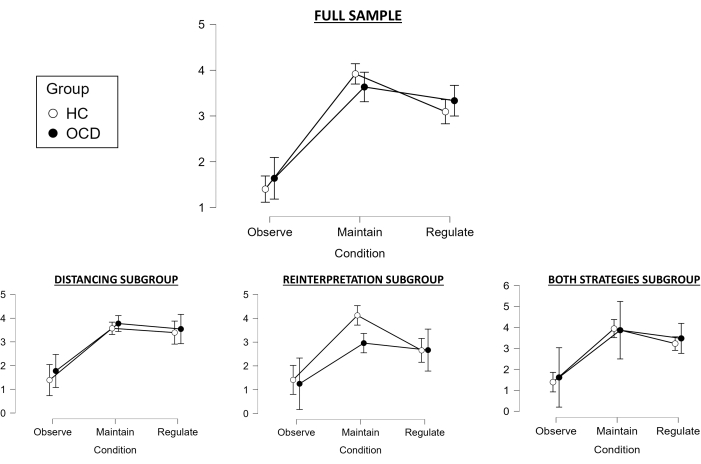
图 2:行为结果。 每组和每种情况(1 表示“中性”,5 表示“极度消极”)、完整样本(上图)以及不同子组(取决于所使用的情绪调节策略)(下图)的平均(95% 置信区间)扫描仪内情绪评分。缩写: HC = 健康对照;OCD = 强迫症。 请单击此处查看此图的较大版本。
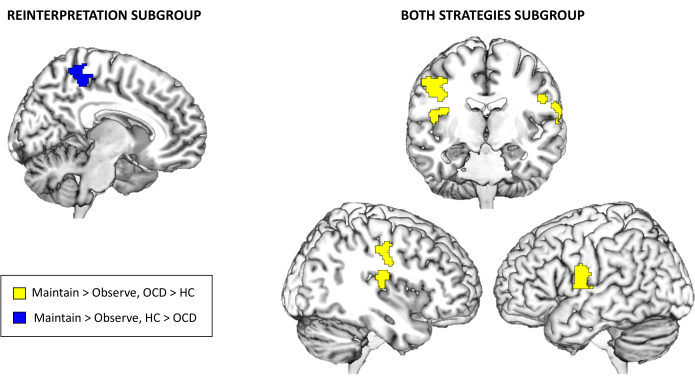
图 3:fMRI 任务激活结果。 Reinterpretation 和 Maintain > Observe 对比的 Both 策略子组全脑激活的组间差异。研究结果在全脑水平上具有重要意义 p < .05 FWE 簇校正 请单击此处查看此图的较大版本。
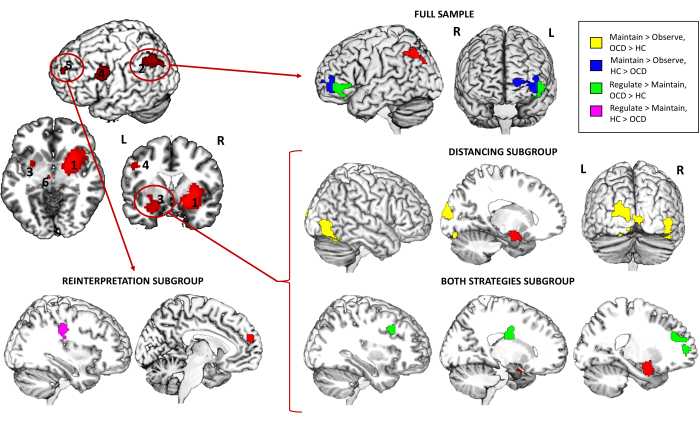
图 4:fMRI 任务心理生理相互作用结果。 完整样本的全脑连接的组间差异以及左角回 (2) 、左杏仁核 (3) 和内侧 PFC (5) 种子的不同策略亚组。种子以红色表示,而具有差分连接的区域以黄色 (OCD > HC) 或蓝色 (HC > OCD) 表示,用于 Maintain > Observe 对比,绿色 (OCD > HC) 或紫色 (HC > OCD) 表示调节>保持对比度。结果在全脑水平 p < .05 FWE 簇校正时具有显着意义。参见表 3,了解按探索的种子数量进行额外 Bonferroni 校正后幸存下来的发现。缩写: HC = 健康对照;OCD = 强迫症。 请单击此处查看此图的较大版本。
表 2:参与者的社会人口学和临床特征。 OCI-R 分量表的总 N = 58,扫描仪内情绪评分 N = 57,任务期间使用的策略 N = 54。缩写: AP = 抗精神病药;Dist = 距离;ERQ = 情绪调节问卷;HC = 健康对照;OCD = 强迫症;OCI-R = 强迫症量表修订版;Reint = 重新解释;SD = 标准差;SSRI = 选择性 5-羟色胺再摄取抑制剂;Y-BOCS = 耶鲁-布朗强迫症量表。 请点击此处下载此表格。
表 3:fMRI 任务结果。 完整样本以及不同策略亚组的任务激活和心理生理相互作用分析的组间差异。结果在全脑水平 p < .05 FWE 簇校正时具有显着意义。*PPI 发现在通过探索的种子数量进行额外 Bonferroni 校正后仍然重要 (p < .05 / 6 = p < .0083)。缩写:dlPFC,背外侧前额叶皮层;HC,健康对照;ITG,颞下回;Ke,体素中的聚类范围;MNI,蒙特利尔神经学研究所;MOG,枕中回;强迫症,强迫症;PFC,前额叶皮层;PPI,心理生理相互作用分析;vlPFC,腹外侧前额叶皮层。 请点击此处下载此表格。
补充文件 1:使用的社会人口学问卷(葡萄牙语),并附有英文翻译。请点击此处下载此文件。
补充文件 2:使用的临床问卷(葡萄牙语),附有英文翻译。请点击此处下载此文件。
补充文件 3:使用的 OCI-R 的葡萄牙语版本,并附有英文翻译。请点击此处下载此文件。
补充文件 4:使用的 ERQ 的葡萄牙语版本,并附有英文翻译。请点击此处下载此文件。
补充文件 5:使用的 Y-BOCS 的葡萄牙语版本,并附有英文翻译。请点击此处下载此文件。
补充文件 6:用于解释认知重新评估任务的演示文稿,并在扫描前培训参与者保持距离和重新解释策略,并附有英文翻译。请点击此处下载此文件。
补充文件 7:用于认知重评估任务的观察条件的 IAPS 中性图片。请点击此处下载此文件。
补充文件 8:用于认知重估任务的 Maintain 条件的 IAPS 底片图片。请点击此处下载此文件。
补充文件 9:用于认知再评估任务的 Regulated 条件的 IAPS 负片图片。请点击此处下载此文件。
补充文件 10:MRI 会议后使用的问卷,以检查参与者是否充分执行了任务并记录他们使用了哪些策略,并附有英文翻译。请点击此处下载此文件。
补充文件 11:本研究中包含的不同数据分析的详细软件步骤。请点击此处下载此文件。
讨论
该协议允许研究人员使用 fMRI 认知重新评估任务,探索与对照组相比,强迫症患者情绪调节的神经相关性。这种设计显示出通过深思熟虑的策略增强我们对大脑调节情绪机制的理解的潜力,可用于强迫症患者以及其他精神病人群。此外,我们使用最新的神经影像学金标准(例如,多波段序列、fMRIPrep 预处理和适当的多重比较校正方法)精心设计了协议。特别注意确保两个参与者组在社会人口学变量上匹配,并将数据质量差的参与者排除在分析之外。
尽管采取了所有这些预防措施,但我们在一些分析中仍有负面结果(即没有组间差异)。在行为层面,在对完整样本使用 2 x 3 重复测量方差分析分析扫描仪内评分时,组效应不显著。这一发现与之前对精神病学人群的荟萃分析和系统评价一致23,44,表明社会期望效应、扫描内行为评估或情绪体验自我意识受损的潜在影响。然而,Success 变量中出现了显着的组别差异,表明 OCD 患者表现出较差的情绪调节。因此,尽管两组在不同条件下的评级模式总体上相似,但当仅关注 Maintain 和 Regulated 条件时,仍然可以观察到变化。
此外,当对不同的情绪调节亚组重复此分析时,Reinterpretation 亚组是唯一显示出与完整样本相同的结果模式的亚组,而 Distancing 和 Both 策略亚组没有显示基于扫描仪内评级的成功情绪调节,也没有显示成功变量的组间统计学显着差异。这表明在这项任务中使用重新解释策略的有益影响,既可以确保总体上成功的情绪调节,也可以检测对照组和患者组之间的显着差异。无论如何,一般研究结果表明,强迫症患者认知重估缺陷的证据有限,这在面对症状特异性刺激(例如具有特定症状内容的图像45)时可能更加明显,与相对保留的重估能力形成鲜明对比暴露于一般负面内容的刺激时。
在分析完整样本时,调节情绪成功的适度差异与大脑激活的显着差异并不对应。然而,当特别关注 Reinterpretation 亚组时,与对照组相比,OCD 患者在体验情绪时表现出楔前叶的激活减少。楔前叶作为默认模式网络 (DMN) 的一部分,是一个关键参与自我指涉处理46 的区域,这可能反映出使用重新解释策略适应任务需求的控制者的能力更好,在维持条件下适当地参与情绪处理(而强迫症患者没有这样做)。关于 PPI 分析,它揭示了左额顶叶网络区域之间完整样本的连接性差异,特别是左角回和左 vlPFC 区域之间的连接差异,这些区域对选择性注意力、认知控制和工作记忆至关重要47,48。虽然整个样本没有与任务相关的 fMRI 激活差异以及额顶叶网络的显着连接性改变最初可能看起来是矛盾的,但我们认为这强调了采用不同神经影像学分析的相关性。这些方法产生了不同的见解,表明可能需要某些神经影像学模式和分析方法来检测特定的改变。此外,情绪调节亚组分析发现了进一步的差异,确定了与杏仁核和内侧 PFC 种子相关的连接性的额外中断,控制在关键调节网络中表现出更强的连接性,尤其是在参与重新解释策略时。
综上所述,这些发现表明 OCD 中的情绪调节缺陷不是全局性的,而是依赖于环境和策略的。虽然一些支持情绪调节的神经网络仍然有效,但其他神经网络表现出明显的变化,特别是在响应特定策略时。这些结果强调了在评估 OCD 时考虑情绪调节策略的个体差异以及这些过程背后的神经机制的重要性。未来的研究应探索症状特异性刺激的影响,并检查针对这些被破坏的网络的潜在治疗干预措施。
进一步的考虑与任务的设计局限性有关,因为它本身就对评估参与者在体验和调节情绪方面的参与度和表现提出了挑战。为了试图减轻这一限制,我们进行了 MRI 后访谈,询问参与者他们在任务期间使用了哪些情绪调节策略,并排除了那些没有充分执行任务的参与者。在这一行中,未来使用类似设计的研究可以通过结合客观的心理生理学测量(如心率变异性)来提高稳健性,这可以提供更可靠的情绪调节性能评估。此外,我们试图理清使用重新解释或疏远策略(或两者兼而有之)的不同行为和神经影响,但未来更好地支持这些分析的研究将阐明我们初步发现的稳健性和可复制性。
披露声明
在过去的 3 年里,PM 收到了来自 Angelini、AstraZeneca、Bial Foundation、Biogen、DGS-Portugal、FCT、FLAD、Janssen-Cilag、Gulbenkian Foundation、Lundbeck、Springer Healthcare、Tecnimede 和 2CA-Braga 的赠款、CME 相关酬金或咨询费。
致谢
这项工作由葡萄牙国家基金通过科学技术基金会 (FCT) 资助 - 项目 UIDB/50026/2020 (DOI 10.54499/UIDB/50026/2020)、UIDP/50026/2020 (DOI 10.54499/UIDP/50026/2020) 和 LA/P/0050/2020 (DOI 10.54499/LA/P/0050/2020),以及项目 NORTE-01-0145-FEDER-000039,由北葡萄牙区域业务计划 (NORTE 2020) 根据葡萄牙 2020 伙伴关系协议通过欧洲区域发展基金 (ERDF) 支持。MPP 得到了 MCIN/AEI/10.13039/501100011033 和“欧盟下一代EU/PRTR”资助的赠款 RYC2021-031228-I 的支持。
材料
| Name | Company | Catalog Number | Comments |
| AFNI | National Institute of Mental Health | RRID:SCR_005927 | https://afni.nimh.nih.gov/ |
| Diagnostic and Statistical Manual of Mental Disorders | American Psychiatric Association | 5th edition | |
| fMRIPrep | NiPreps Community | RRID:SCR_016216 | Based on Nipype (RRID:SCR_002502). Pipeline details: https://fmriprep.org/en/stable/workflows.html |
| FSL | FMRIB Software Library, Analysis Group, FMRIB, Oxford | ||
| JASP | JASP Team, University of Amsterdam, the Netherlands | ||
| Magnetic resonance imaging (MRI) scanner | Siemens | Verio 3T | |
| MRI-compatible response pad | Lumina–Cedrus Corporation | ||
| PsychoPy3 | University of Nottingham | ||
| SPM12 | Wellcome Trust Center for Neuroimaging | https://www.fil.ion.ucl. ac.uk/spm/ |
参考文献
- Buckholtz, J. W., Meyer-Lindenberg, A. Psychopathology and the human connectome: toward a transdiagnostic model of risk for mental illness. Neuron. 74 (6), 990-1004 (2012).
- Menon, V. Large-scale brain networks and psychopathology: a unifying triple network model. Trends Cogn Sci. 15 (10), 483-506 (2011).
- Picó-Pérez, M., et al. Neural predictors of cognitive-behavior outcome in anxiety-related disorders: a meta-analysis of task-based fMRI studies. Psychol Med. 53 (8), 3387-3395 (2023).
- Gross, J. J. Antecedent- and response-focused emotion regulation: Divergent consequences for experience, expression, and physiology. J Pers Soc Psychol. 74 (1), 224-237 (1998).
- Ochsner, K., Silvers, J., Buhle, J. Functional imaging studies of emotion regulation: A synthetic review and evolving model of the cognitive control of emotion. Ann N Y Acad Sci. 1252, 1-35 (2012).
- Buhle, J. T., et al. Cognitive reappraisal of emotion: A meta-analysis of human neuroimaging studies. Cereb Cortex. 24 (11), 2981-2990 (2013).
- Frank, D. W., et al. Emotion regulation: Quantitative meta-analysis of functional activation and deactivation. Neurosci Biobehav Rev. 45, 202-211 (2014).
- Dosenbach, N. U. F., et al. Distinct brain networks for adaptive and stable task control in humans. Proc Natl Acad Sci USA. 104 (26), 11073-11078 (2007).
- Ochsner, K. N., Gross, J. J. The neural bases of emotion and emotion regulation: A valuation perspective. Gross, J. J. (ed) Handbook. , The Guilford Press. 23-42 (2014).
- Morawetz, C., Bode, S., Baudewig, J., Kirilina, E., Heekeren, H. R. Changes in effective connectivity between dorsal and ventral prefrontal regions moderate emotion regulation. Cereb Cortex. 26 (5), 1923-1937 (2016).
- Steward, T., et al. Dynamic neural interactions supporting the cognitive reappraisal of emotion. Cereb Cortex. 31 (2), 961-973 (2021).
- American Psychiatric Association. Diagnostic and statistical manual of mental disorders. , (2013).
- Schienle, A., Schäfer, A., Stark, R., Walter, B., Vaitl, D. Neural responses of OCD patients towards disorder-relevant, generally disgust-inducing and fear-inducing pictures. Int J Psychophysiol. 57 (1), 69-77 (2005).
- vanden Heuvel, O. A., et al. Amygdala activity in obsessive-compulsive disorder with contamination fear: a study with oxygen-15 water positron emission tomography. Psychiatry Res Neuroimaging. 132 (3), 225-237 (2004).
- Picó-Pérez, M., et al. Modality-specific overlaps in brain structure and function in obsessive-compulsive disorder: Multimodal meta-analysis of case-control MRI studies. Neurosci Biobehav Rev. 112, 83-94 (2020).
- Goldberg, X., et al. Inter-individual variability in emotion regulation: Pathways to obsessive-compulsive symptoms. J Obsessive Compuls Relat Disord. 11, 105-112 (2016).
- Mataix-Cols, D., vanden Heuvel, O. A. Common and distinct neural correlates of obsessive-compulsive and related disorders. Psychiatr Clin North Am. 2 (2), 391-410 (2006).
- Milad, M. R., Rauch, S. L. Obsessive-compulsive disorder: beyond segregated cortico-striatal pathways. Trends Cogn Sci. 16 (1), 43-51 (2012).
- Paul, S., Simon, D., Endrass, T., Kathmann, N. Altered emotion regulation in obsessive-compulsive disorder as evidenced by the late positive potential. Psychol Med. 46 (1), 137-147 (2016).
- Franklin, M. E., Foa, E. B. Treatment of obsessive compulsive disorder. Annual review of clinical psychology. , 229-243 (2011).
- Hu, T., et al. Relation between emotion regulation and mental health: a meta-analysis review. Psychol Rep. 114 (2), 341-362 (2014).
- Phillips, M. L., Drevets, W. C., Rauch, S. L., Lane, R. Neurobiology of emotion perception II: implications for major psychiatric disorders. Biol Psychiatry. 54 (5), 515-528 (2003).
- Picó-Pérez, M., Radua, J., Steward, T., Menchón, J. M., Soriano-Mas, C. Emotion regulation in mood and anxiety disorders: A meta-analysis of fMRI cognitive reappraisal studies. Prog Neuro-Psychopharmacology Biol Psychiatry. 79, 96-104 (2017).
- de Wit, S. J., et al. Multicenter voxel-based morphometry mega-analysis of structural brain acans in obsessive-compulsive disorder. Am J Psychiatry. 171 (3), 340-349 (2014).
- Ferreira, S., et al. Frontoparietal hyperconnectivity during cognitive regulation in obsessive-compulsive disorder followed by reward valuation inflexibility. J Psychiatr Res. 137, 657-666 (2020).
- Menzies, L., et al. Integrating evidence from neuroimaging and neuropsychological studies of obsessive-compulsive disorder: The orbitofronto-striatal model revisited. Neurosci Biobehav Rev. 32 (3), 525-549 (2008).
- Huyser, C., Veltman, D. J., Wolters, L. H., De Haan, E., Boer, F. Functional magnetic resonance imaging during planning before and after cognitive-behavioral therapy in pediatric obsessive-compulsive disorder. J Am Acad Child Adolesc Psychiatry. 49 (12), 1238-1248 (2010).
- Vriend, C., et al. Switch the itch: A naturalistic follow-up study on the neural correlates of cognitive flexibility in obsessive-compulsive disorder. Psychiatry Res Neuroimaging. 213 (1), 31-38 (2013).
- Fink, J., Pflugradt, E., Stierle, C., Exner, C. Changing disgust through imagery rescripting and cognitive reappraisal in contamination-based obsessive-compulsive disorder. J Anxiety Disord. 54, 36-48 (2018).
- Sheehan, D. V., et al. The Mini-International Neuropsychiatric Interview (M.I.N.I.): The development and validation of a structured diagnostic psychiatric interview for DSM-IV and ICD-10. J Clin Psychiatry. 59, (1998).
- Foa, E. B., et al. The obsessive-compulsive inventory: Development and validation of a short version. Psychol Assess. 14 (4), 485-496 (2002).
- Varela Cunha,, G,, et al. The Obsessive-Compulsive Inventory-Revised (OCI-R): Translation and validation of the European Portuguese version. Acta Med Port. 36 (3), 174-182 (2023).
- Gross, J. J., John, O. P. Individual differences in two emotion regulation processes: implications for affect, relationships, and well-being. J Pers Soc Psychol. 85 (2), 348-362 (2003).
- Vaz, F. M., Martins, C., Martins, E. C. Diferenciação emocional e regulação emocional em adultos portugueses. PSICOLOGIA. 22 (2), 123-135 (2008).
- Goodman, W. K., et al. The Yale-Brown Obsessive Compulsive Scale. Arch Gen Psychiatry. 46 (11), 1006(1989).
- Castro-Rodrigues, P., et al. Criterion validity of the Yale-Brown Obsessive-Compulsive Scale second edition for diagnosis of obsessive-compulsive disorder in adults. Front Psychiatry. 9. 431, (2018).
- Phan, K. L., et al. Neural substrates for voluntary suppression of negative affect: A functional magnetic resonance imaging study. Biol Psychiatry. 57 (3), 210-219 (2005).
- Lang, P., Bradley, M., Cuthbert, B. International Affective Picture System (IAPS): Digitized photographs, instruction manual and affective ratings. Technical Report A-6. , University of Florida. Gainesville, FL. (2005).
- Peirce, J. W. PsychoPy-Psychophysics software in Python. J Neurosci Methods. 162 (1-2), 8-13 (2007).
- Esteban, O., et al. fMRIPrep: a robust preprocessing pipeline for functional MRI. Nat Methods. 16 (1), 111-116 (2019).
- Esteban, O., et al. Analysis of task-based functional MRI data preprocessed with fMRIPrep. Nat Protoc. 15 (7), 2186-2202 (2020).
- Jenkinson, M., Beckmann, C. F., Behrens, T. E. J., Woolrich, M. W., Smith, S. M. FSL. NeuroImage. 62 (2), 782-790 (2012).
- Cox, R. W. AFNI: software for analysis and visualization of functional magnetic resonance neuroimages. Comput Biomed Res. 29 (29), 162-173 (1996).
- Zilverstand, A., Parvaz, M. A., Goldstein, R. Z. Neuroimaging cognitive reappraisal in clinical populations to define neural targets for enhancing emotion regulation. A systematic review. Neuroimage. 151, 105-116 (2017).
- Thorsen, A. L., et al. Emotion regulation in obsessive-compulsive disorder, unaffected siblings, and unrelated healthy control participants. Biol Psychiatry Cogn Neurosci Neuroimaging. 4 (4), 352-360 (2019).
- Utevsky, A. V., Smith, D. V., Huettel, S. A. Precuneus is a functional core of the default-mode network. J Neurosci. 34 (3), 932(2014).
- Aron, A. R., Robbins, T. W., Poldrack, R. A. Inhibition and the right inferior frontal cortex: one decade on. Trends Cogn Sci. 18 (4), 177-185 (2014).
- Pessoa, L., Kastner, S., Ungerleider, L. G. Neuroimaging studies of attention: from modulation of sensory processing to top-down control. J Neurosci. 23 (10), 3990-3998 (2003).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。